引用本文: 曾琦, 張月華, 楊小玲, 陳嬌陽, 張靜, 楊瑩, 姜玉武, 吳希如. KCNQ2 基因相關癲癇的臨床表型譜研究. 癲癇雜志, 2019, 5(4): 244-256. doi: 10.7507/2096-0247.20190042 復制
KCNQ2 基因是電壓門控鉀離子通道基因,與 KCNQ3 共同編碼形成 M 型鉀離子通道,主要表達于大腦組織。1998 年 Singh 等[1]首次報道 KCNQ2 基因是良性家族性新生兒癲癇(Benign familial neonatal epilepsy,BFNE)的致病基因。Grinton 等[2]發現 81.8%(27/33)的 BFNE 家系為 KCNQ2 基因變異所致,證實 KCNQ2 基因是 BFNE 的主要致病基因,也有少數報道稱 KCNQ2 基因變異可以導致良性家族性新生兒-嬰兒癲癇(Benign familial neonatal-infantile epilepsy,BFNIE)或良性家族性嬰兒癲癇(Benign familial infantile epilepsy,BFIE)[3]。2003 年 Dedek 等[4]報道 KCNQ2 基因變異導致的 BFNE 家系中少數受累者可表現為早發癲癇性腦病(Early infantile epileptic encephalopathy,EIEE)。隨后發現部分 EIEE 的散發病例也可由 KCNQ2 基因新生變異導致,證實 KCNQ2 基因亦是其致病基因[5]。近年來,隨著二代測序技術的發展,有關 KCNQ2 基因變異導致癲癇的報道逐漸增多。目前,我國尚缺乏對 KCNQ2 基因變異表型譜的研究。本研究對北京大學第一醫院兒科收集的 KCNQ2 基因變異的癲癇患兒表型特點及基因變異特點進行總結分析,旨在對相關疾病的臨床診治提供參考。
1 資料與方法
1.1 研究對象
收集 2012 年 1 月—2018 年 1 月北京大學第一醫院兒科神經專科診治的 KCNQ2 基因變異陽性的癲癇患兒 40 例,每例患兒由監護人簽署知情同意書,收集患兒及其家系成員的臨床資料和外周血 DNA。對每例入選的患兒及其家系成員建立詳細的臨床資料登記表(內容包括姓名、性別、出生日期、民族、發病年齡、發作表現、圍產期情況、既往史、智力運動發育情況、家族史、用藥史及輔助檢查結果),通過門診復診及隨訪患兒的治療及反應。本研究已通過北京大學第一醫院倫理委員會的批準[編號:2012(453)]。
1.2 方法
采用 Miller 改良鹽析法提取外周血白細胞基因組 DNA。采用靶向捕獲二代測序癲癇基因檢測包篩查患兒的基因變異,對發現 KCNQ2 基因變異的患兒,采用一代測序的方法驗證患兒及其家系成員相關變異位點。抗癲癇藥物(AEDs)的療效分為 4 種:發作控制(至少 3 個月無發作)、發作減少(發作次數減少≥25%)、無效(發作次數減少<25%)和加重。用藥后發作控制或發作次數減少為有效,藥物嘗試到最大有效劑量發作無明顯減少為無效。
1.3 統計學方法
癲癇患兒臨床特征中各表型發病率為計數資料,用例(%)表示。
2 結果
2.1 KCNQ2 基因變異結果
本研究共收集 40 例 KCNQ2 基因變異患兒,其中男 22 例,女 18 例。共檢測到 36 種不同的 KCNQ2 基因雜合變異(Genbank 序列號為 NM_172107.2),其中錯義變異 25 種(25/36,69.4%),堿基缺失或插入所致移碼變異 2 種,無義變異 4 種,片段缺失 5 種(例 6、例 20 和例 21 患兒的 KCNQ2 基因片段缺失還累及與 KCNQ2 基因相鄰的 CHRNA4)。例 22、例 26、例 29 和例 36 患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,例 14 和例 39 攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L。16 種為已報道的致病變異,其余 20 種均為尚未見報道的新變異。20 種新變異在 100 名健康對照組中均未發現。
40 例患兒中,12 例為遺傳性變異,其余 28 例為新生變異(28/40,70.0%)。12 例攜帶 KCNQ2 基因遺傳性變異的患兒中,11 例有癲癇或熱性驚厥家族史,1 例無癲癇或熱性驚厥家族史(例 11)。本研究 40 例患兒 KCNQ2 基因變異結果見表 1。
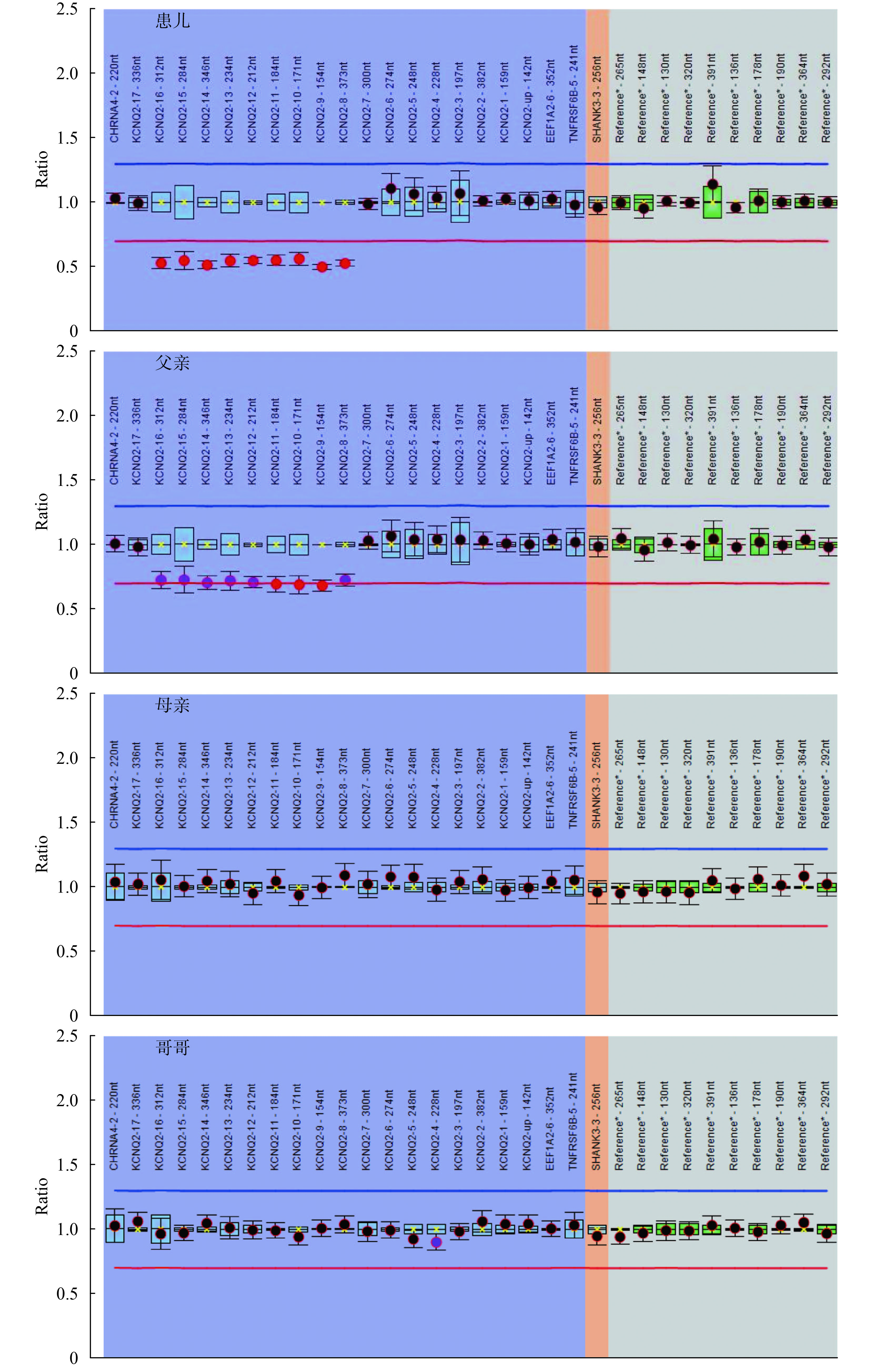
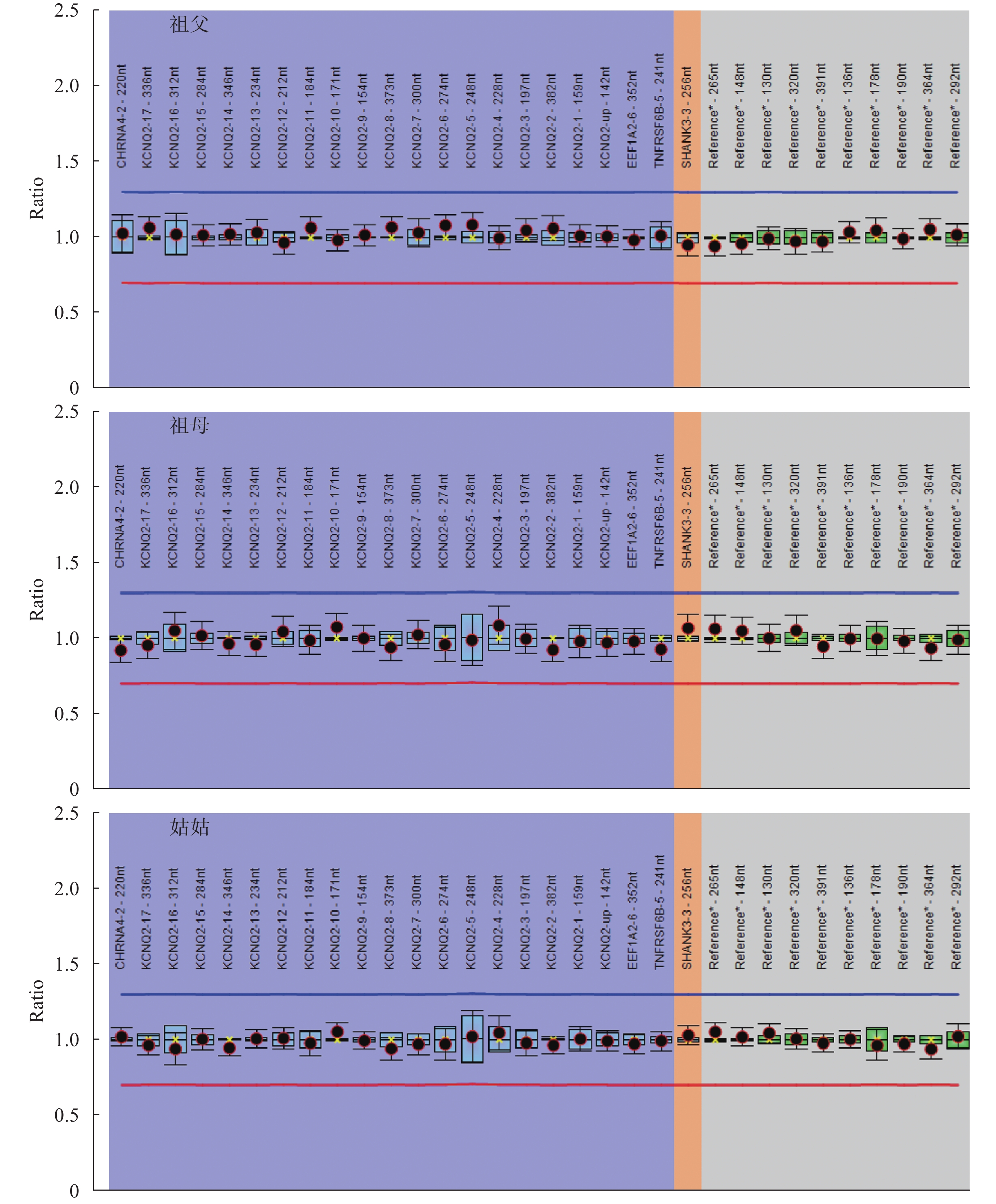
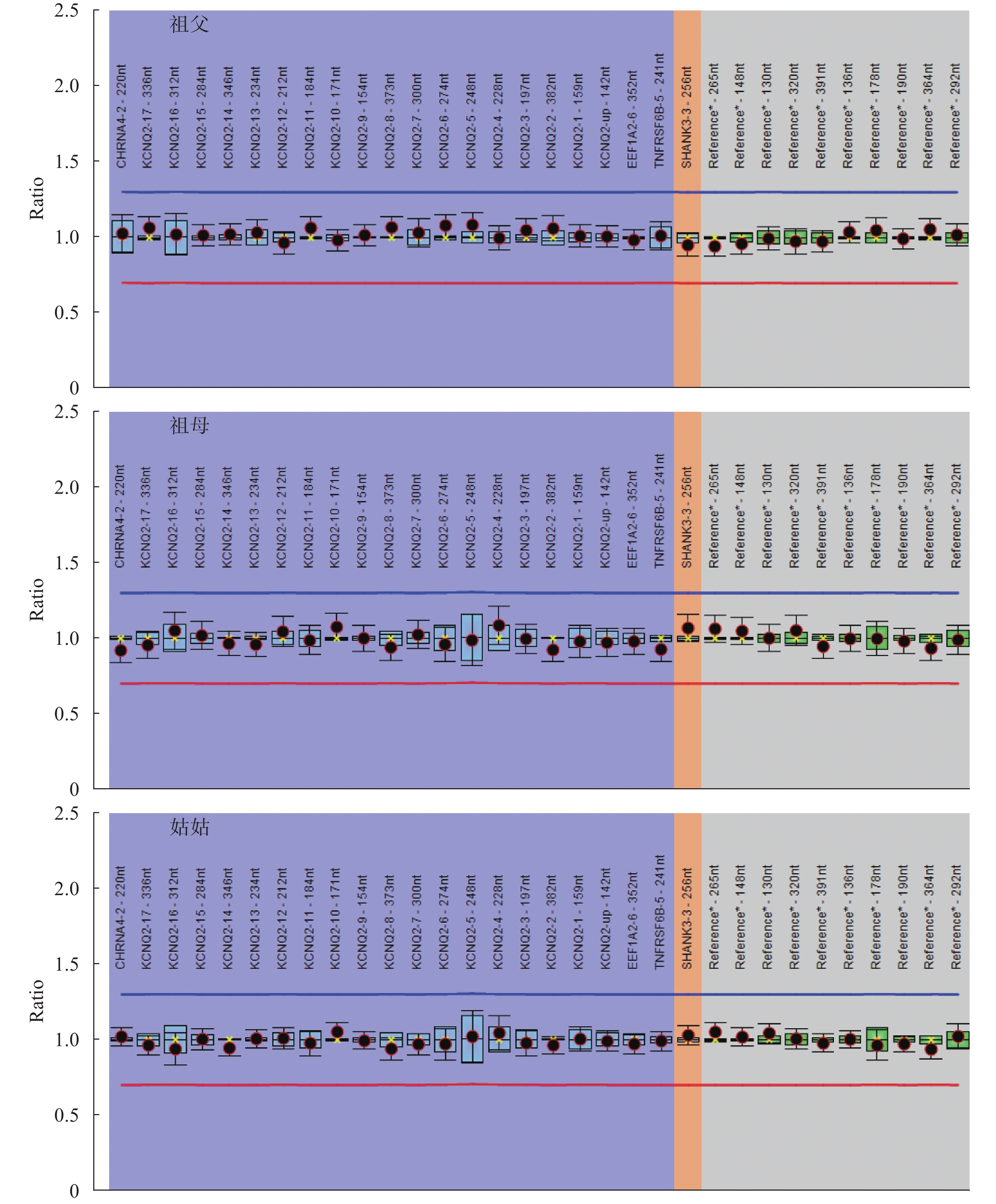
例 30 的父親有熱性驚厥史,母親無熱性驚厥或癲癇病史,該患兒發現 KCNQ2 基因無義變異 c.1892T>A/p.L631X,遺傳自無癥狀的母親,考慮患兒母親為外顯不全。例 11 發現 KCNQ2 基因外顯子 8-16 雜合缺失,進一步用多重連接依賴的探針擴增(Multiplex ligation-dependent probe amplification,MLPA)方法驗證患兒及其家系成員,患兒父親 KCNQ2 基因外顯子 8-16 也存在缺失,但缺失比例低于患兒(患兒 KCNQ2 基因外顯子 8-16 MLPA Ratio 為 0.49~0.55,而患兒父親該值為 0.68~0.74,可疑為嵌合突變。患兒的母親、哥哥、姑姑、祖父和祖母未攜帶相同變異。例 11 患兒及其家系成員的 MLPA 結果見圖 1。在 28 例攜帶 KCNQ2 基因新生變異的患兒中,25 例無癲癇或熱性驚厥家族史,3 例患兒有熱性驚厥家族史(例 10 的父親、例 25 的母親、例 34 的哥哥)。
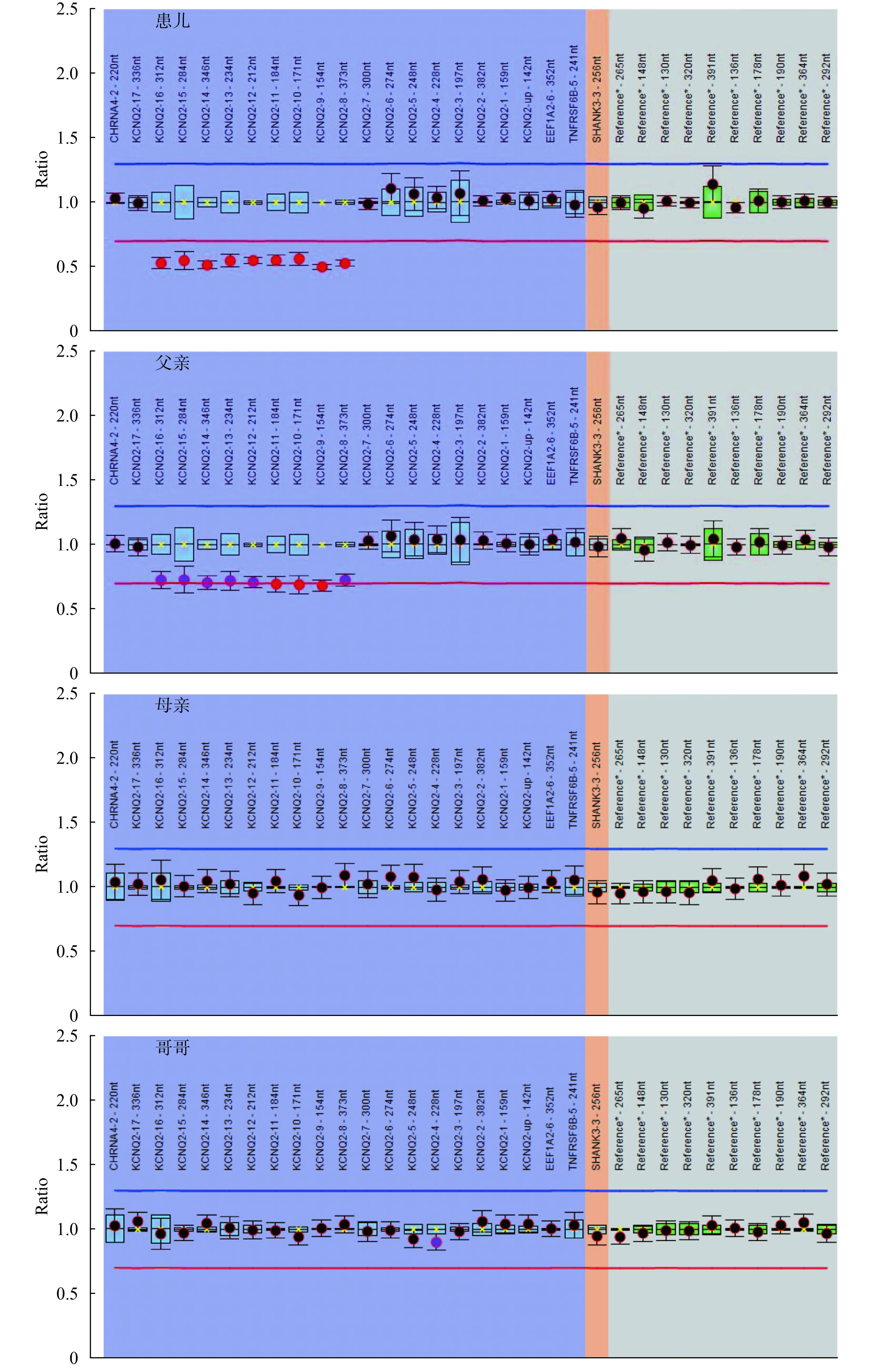 圖1
例 11 患兒及其家系成員的多重連接依賴的探針擴增分析結果
圖1
例 11 患兒及其家系成員的多重連接依賴的探針擴增分析結果
患兒為 KCNQ2 基因外顯子 8-16 雜合缺失,患兒父親外顯子 8-16 雜合缺失(可疑為嵌合突變),患兒母親、哥哥、祖父、祖母和姑姑為陰性
Figure1. MLPA analysis result of patient 11 and his family membersPatient 11 had heterozygous deletion of KCNQ2 exon 8-16, the father had heterozygous deletion of KCNQ2 (were suspected of mosaic), the mother, brother, grandfather, grandmother, and aunt of patient 11 were wildtype
2.2 KCNQ2 基因變異癲癇患兒的臨床特點
2.2.1 癲癇發作表現
40 例 KCNQ2 基因變異患兒的癲癇起病年齡在出生后 1 d~9 個月,中位起病年齡為出生后 3 d。40 例患兒中,新生兒期起病 32 例(32/40,80.0%),其中 28 例在出生后 1 周內起病(28/40,70.0%),1 周~1 個月起病 4 例(4/40,10.0%);1~3 個月起病 4 例(4/40,10.0%);≥4 個月起病 4 例(4/40,10.0%)。40 例表現為多種發作類型,其中局灶性發作 38 例(38/40,95.0%),痙攣發作 10 例(10/40,25.0%),肌陣攣發作 4 例(4/40,10.0%),強直-痙攣發作 3 例(3/40,7.5%),全面強直-陣攣發作和強直發作各 1 例。34 例發作持續時間<5 min(34/40,85.0%);6 例發作持續時間>5 min,發作持續的最長時間為 10 min~1.5 h,其中 4 例(4/40,10.0%)病程中曾有癲癇持續狀態史(發作持續時間>30 min);該 4 例患兒分別為例 5、例 9、例 24 和例 26,其中 3 例癲癇持續狀態為發熱誘發。40 例發作均有叢集性(即 24 h 內發作>2 次)的特點。6 例發作有熱敏感特點(6/40,15.0%)。見表 1。
2.2.2 智力運動發育情況
在 40 例患兒中,25 例(25/40,62.5%)有不同程度的智力運動發育落后,余 15 例智力運動發育正常(15/40,37.5%)。在 25 例智力運動發育落后患兒中,18 例始終不會抬頭,不認人,幾乎無語言發育(18/25,72.0%)。12 例 KCNQ2 基因遺傳性變異的患兒中,11 例智力運動發育正常(11/12,91.7%),另 1 例智力運動發育落后(1/12,8.3%)。28 例攜帶 KCNQ2 基因新生變異的患兒中,4 例(4/28,14.3%)發育正常,余 24 例(24/28,85.7%)伴發育落后。3 例智力運動發育落后的患兒有孤獨癥樣表現(3/25,12.0%)。
2.2.3 腦電圖表現
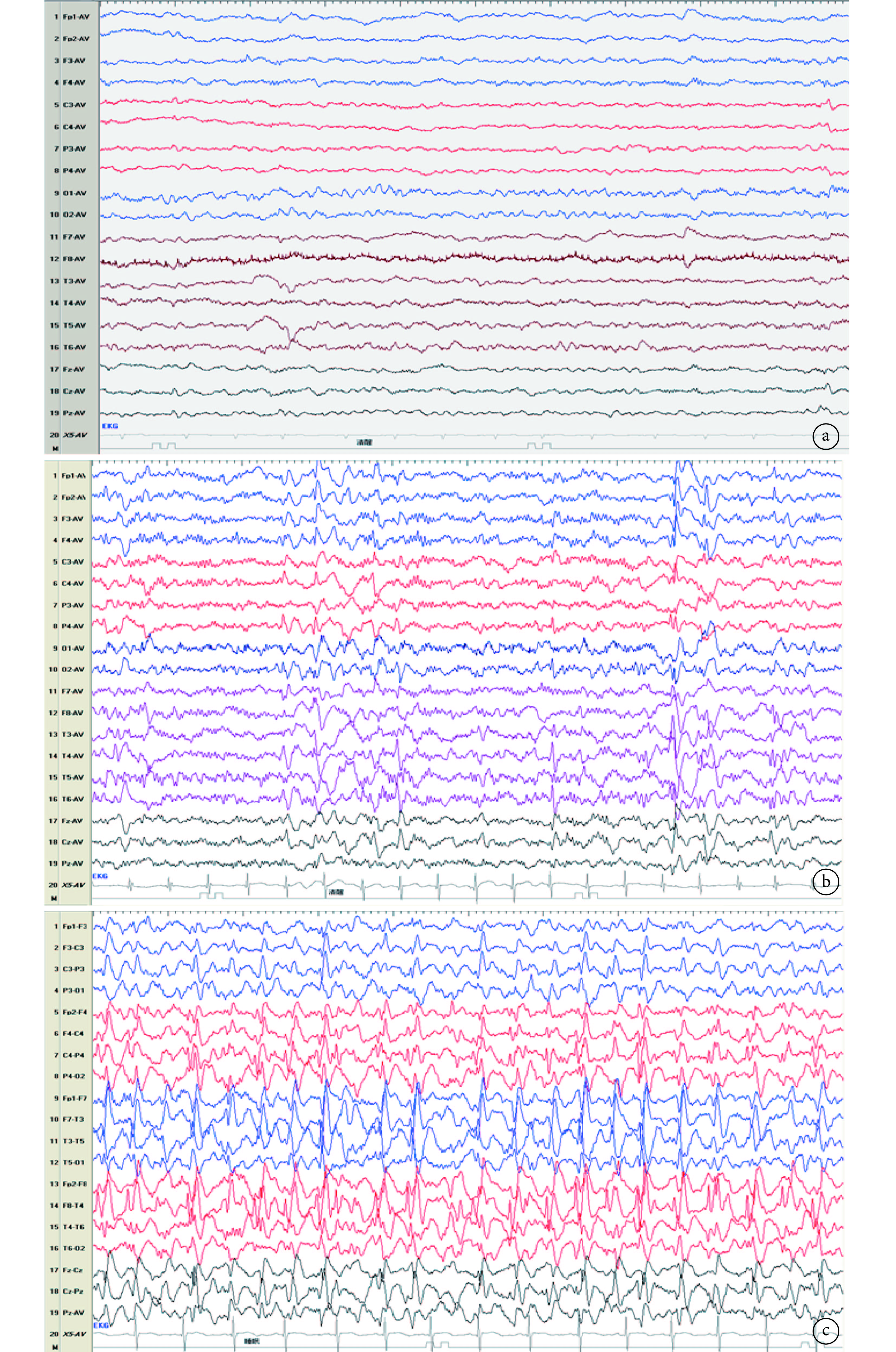
40 例患兒均進行過至少 1 次視頻腦電圖(VEEG)檢查,其中腦電圖(EEG)異常 33 例,余 7 例患兒 VEEG 正常。在 33 例 EEG 異常患兒中,背景活動減慢 15 例;發作間期 EEG 顯示局灶性或多灶性放電 31 例,放電可位于一側或雙側的額極、額區、中央區、中線區、頂區、顳區、枕區等部位;高峰失律 10 例;爆發?抑制 8 例;廣泛性癇樣放電 3 例(放電表現可為尖波、棘波、棘慢波、多棘慢波、快波)。25 例監測到臨床發作,其中局灶性發作 19 例,痙攣發作 7 例,肌陣攣發作 3 例,強直發作 1 例,強直痙攣發作 1 例。3 例患兒(例 5、例 14 和例 15)EEG 出現了睡眠中癲癇性電持續狀態(Electrical status epilepticus during sleep,ESES),放電部位可波及額區、中央區、中線區、頂區、顳區和枕區,睡眠期接近持續發放,非快速動眼期(Non-rapid eye-movement,NREM)放電指數為 85%~95%。圖 2 為例 5 患兒 3 歲齡 EEG,顯示雙側中后顳區為主的棘波、棘慢波發放,睡眠期接近持續發放,NREM 期放電指數>85%。余 7 例 KCNQ2 基因變異患兒 VEEG 正常。
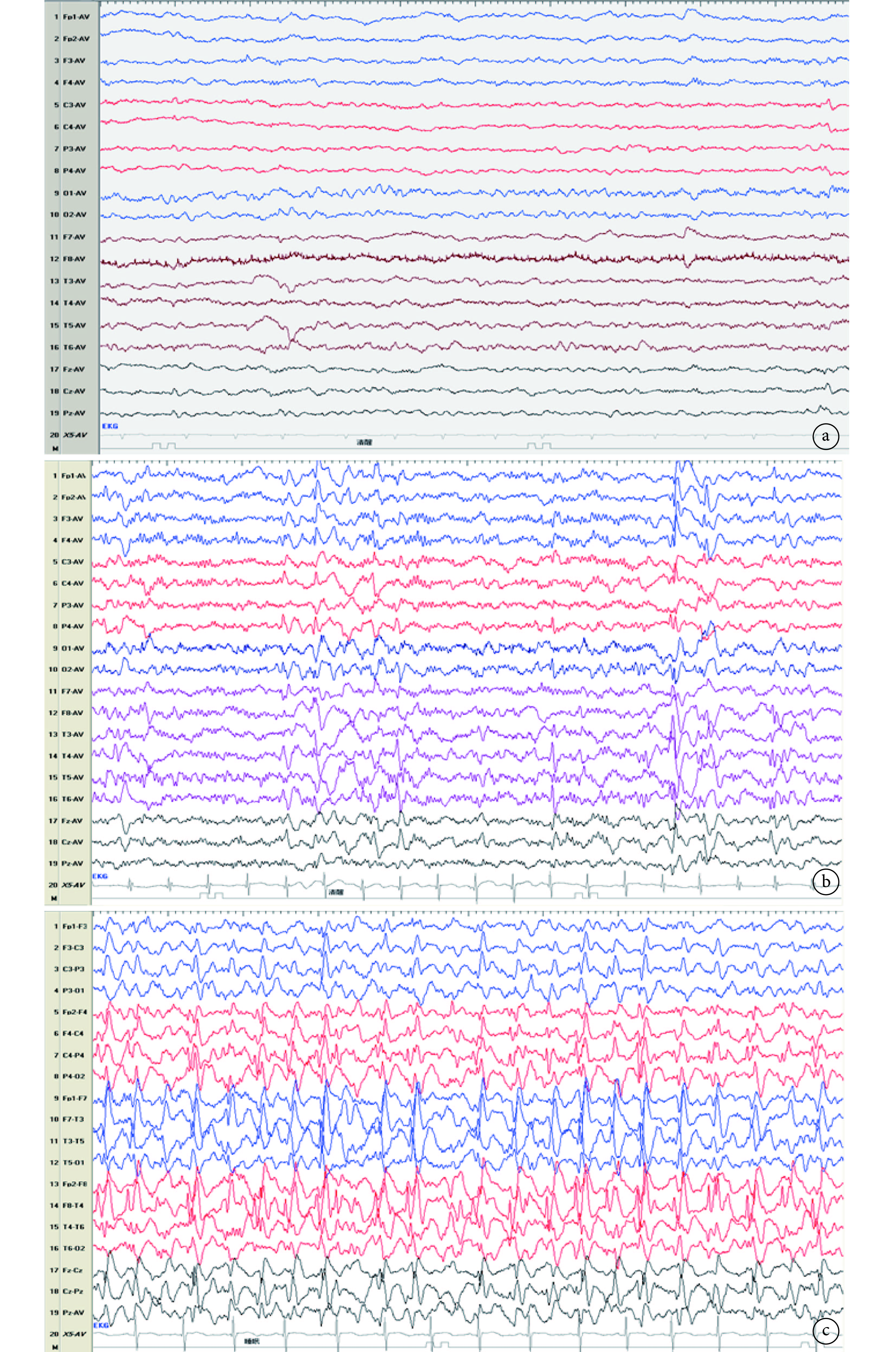 圖2
例 5 患兒 3 歲齡腦電圖
圖2
例 5 患兒 3 歲齡腦電圖
a. 腦電圖背景活動正常;b. 清醒期雙側中后顳區棘波、棘慢波發放;c. 睡眠期雙側中后顳區為主的棘波、棘慢波接近持續發放,有泛化趨勢,NREM 期放電指數>85%
Figure2. EEG of patient 5 (at 3 years of age)a. The background activity was normal; b. Spikes or spike and wave discharges in the bilateral middle and posterior temporal areas during the waking period; c. In the sleep stage, the spikes or spike and wave discharges mainly in the bilateral middle and posterior temporal regions were nearly continuous,showing a generalization trend, and the discharge index in NREM was > 85%
2.2.4 顱腦影像學成像檢查
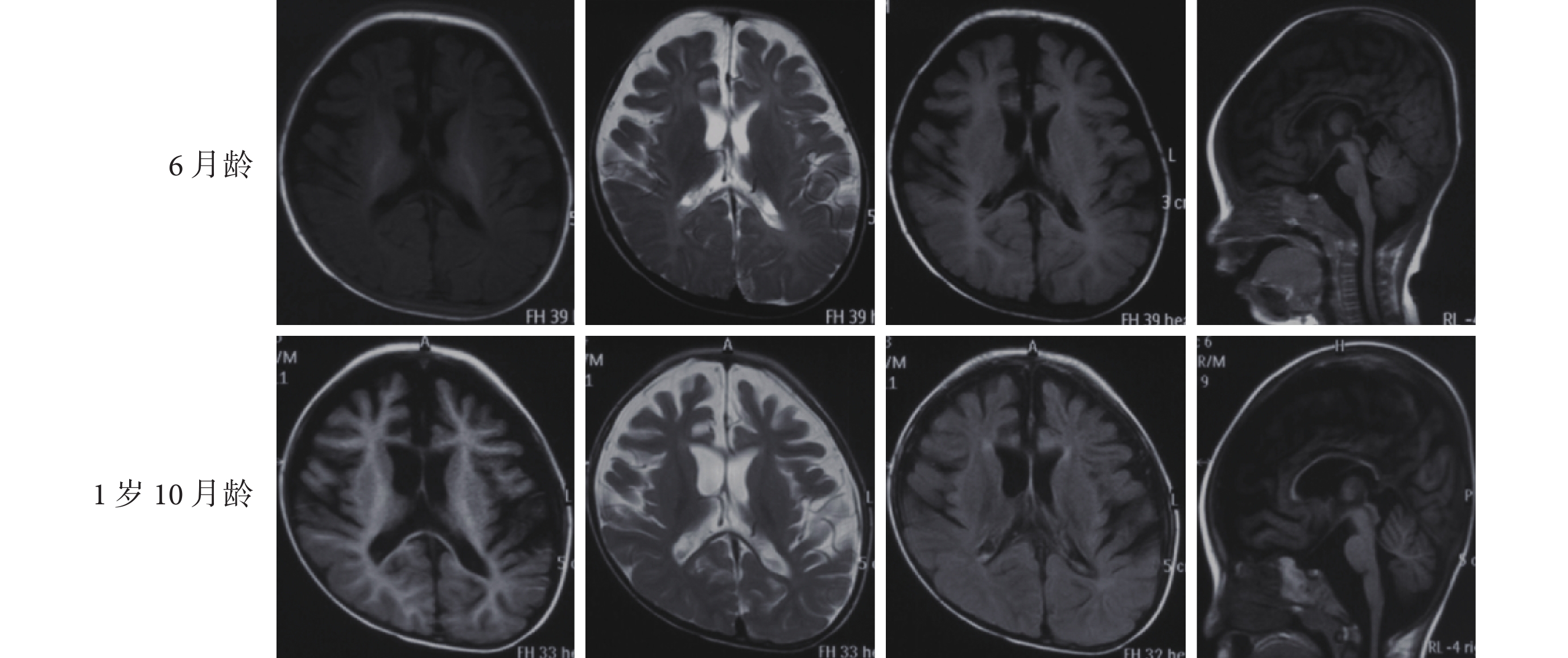
40 例患兒均行至少 1 次顱腦核磁共振成像(MRI)檢查,14 例攜帶 KCNQ2 基因新生變異且伴發育落后的患兒有不同程度異常(14/40,35.0%,末次檢查時間為出生后 2 個月~1 歲 10 個月),其中腦溝增深見于 4 例患兒(4/40,10.0%),雙側側腦室增大見于 3 例患兒(3/40,7.5%),雙側額顳區蛛網膜下腔增寬見于 11 例患兒(11/40,27.5%),雙側額顳區皮層發育不良見于 2 例患兒(2/40,5.0%),胼胝體發育不良見于 10 例患兒(10/40,25.0%)。14 例 MRI 異常患兒均為 KCNQ2 基因新生變異,且均伴智力運動發育落后。例 15 患兒 6 月齡和 1 歲 10 月齡的頭顱 MRI 均提示雙側額顳區蛛網膜下腔增寬,額顳區皮層發育不良,胼胝體發育不良,腦溝增深(圖 3)。余 26 例 MRI 正常。
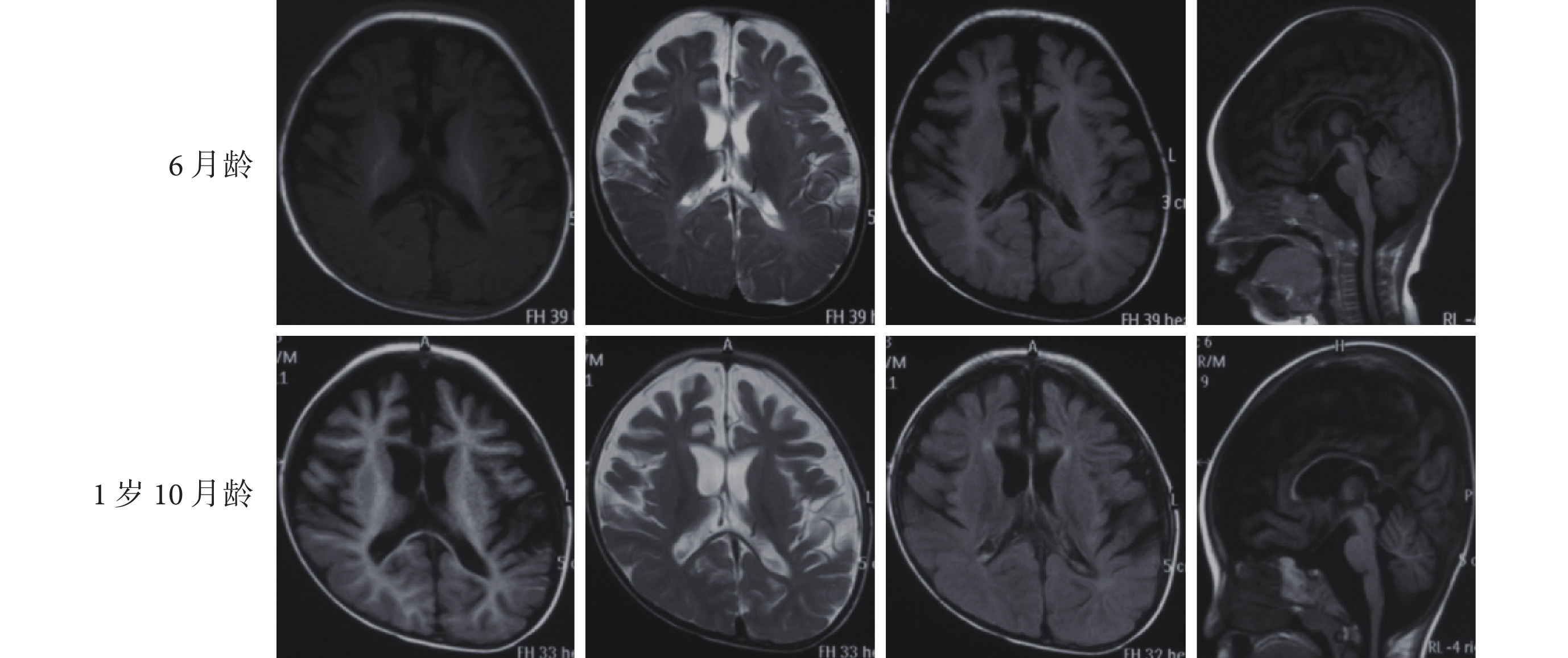 圖3
例 15 患兒的顱腦核磁共振結果
圖3
例 15 患兒的顱腦核磁共振結果
a. 6 月齡;b. 1 歲 10 月齡 MRI 均提示雙側額顳區蛛網膜下腔增寬,雙側額顳區皮層及胼胝體發育不良,腦溝增深
Figure3. Brain MRI results of patient 15a. at 6 months of age; b. at 1 year and 10 months of age. Both brain MRI showed enlargement of subarachnoid spaces in the frontal and temporal region, cortial dysplasia in the bilateral frontal and temporal region, agenesis of corpus callosum,and sulus deepening
2.2.5 癲癇綜合征診斷
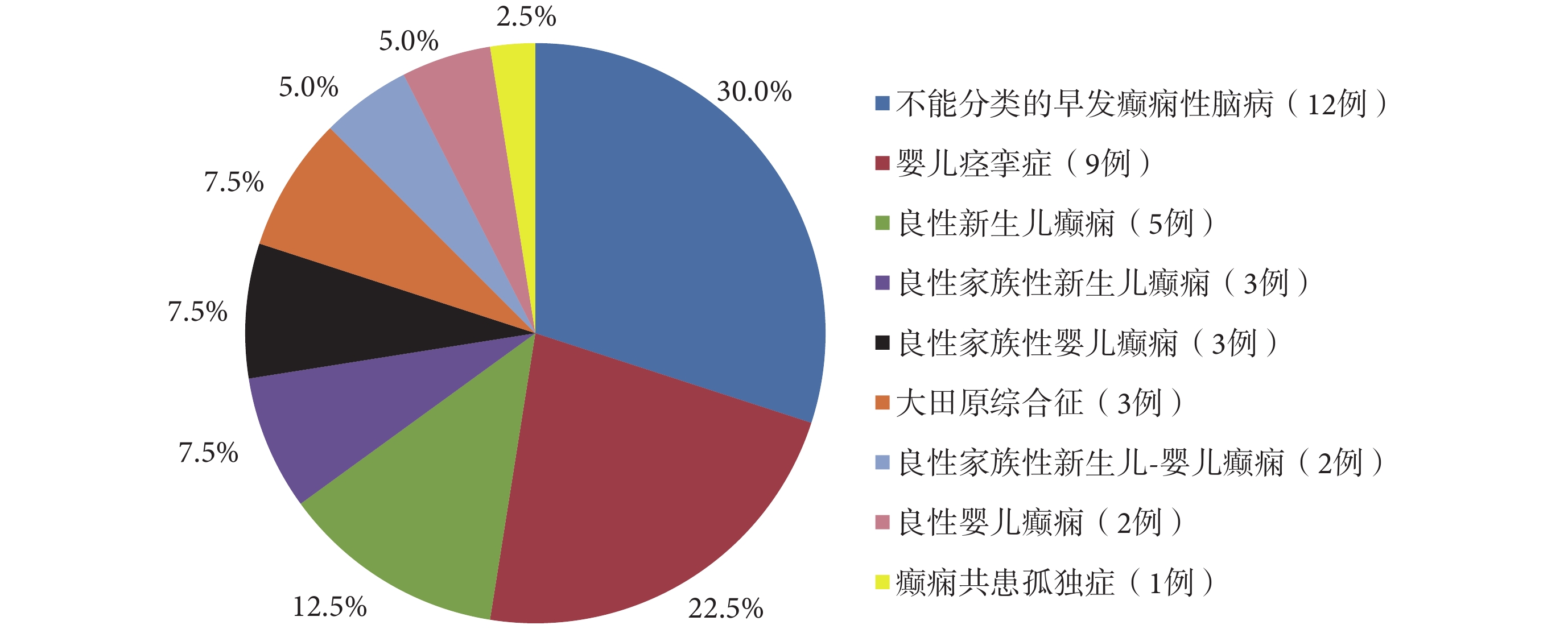
40 例 KCNQ2 基因變異陽性患兒可診斷為多種不同的癲癇綜合征,其中 BFNE 3 例;BFNIE 2 例;BFIE 3 例;良性新生兒癲癇(Benign neonatal epilepsy,BNE)5 例;良性嬰兒癲癇(Benign infantile epilepsy,BIE)2 例;大田原綜合征(Ohtahara syndrome,OS)3 例;嬰兒痙攣癥(West syndrome,WS)9 例;不能分類的 EIEE 12 例,其中例 5 為 1 個 BFNIE 家系的先證者,該家系其余 7 例受累者在生后第 2 d~6 個月出現癲癇,1 歲前緩解,智力運動發育正常,僅例 5 存在智力運動發育落后,病程中 EEG 曾出現 ESES 現象;癲癇共患孤獨癥 1 例。40 例患兒中,不同表型所占的比例見圖 4。
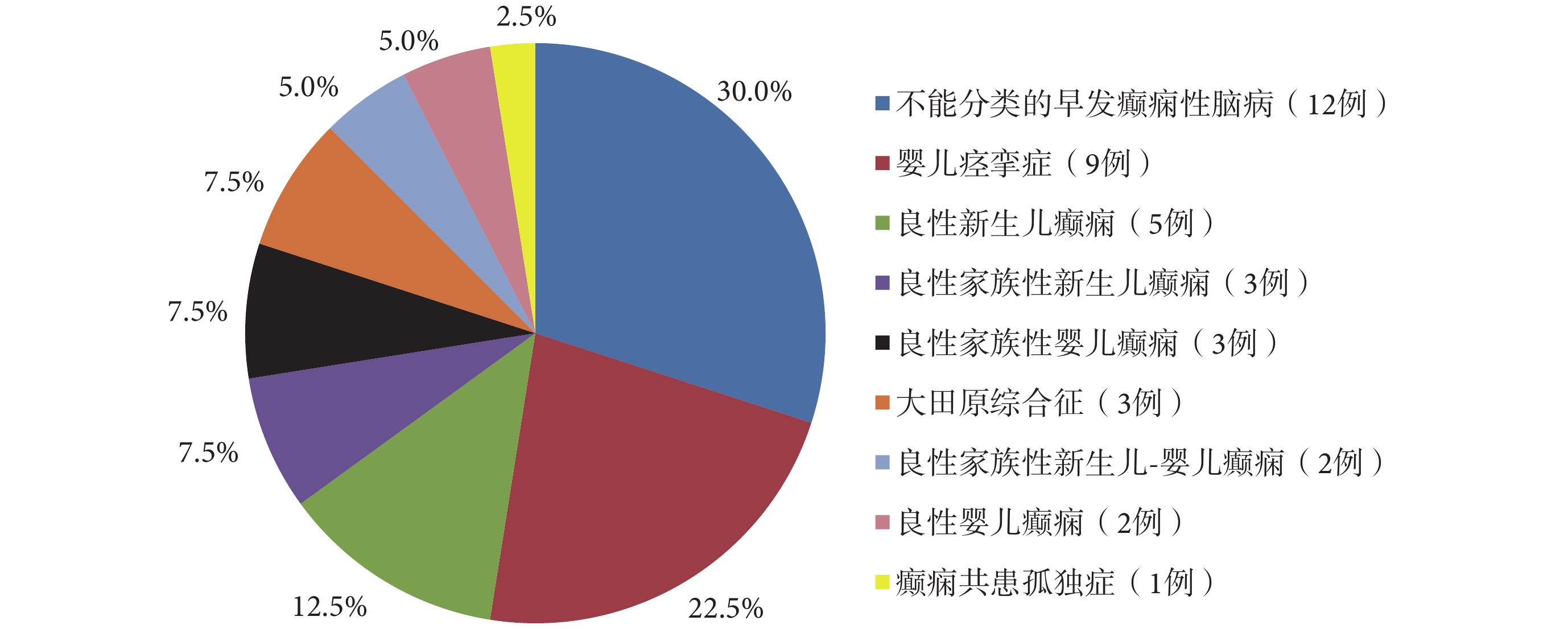 圖4
40 例 KCNQ2 基因變異癲癇患兒不同表型所占的比例
Figure4.
Distribution of patients with KCNQ2 variants according to phenotype
圖4
40 例 KCNQ2 基因變異癲癇患兒不同表型所占的比例
Figure4.
Distribution of patients with KCNQ2 variants according to phenotype
2.2.6 治療和隨訪
40 例患兒的末次隨訪年齡為 3 月齡~8 歲 10 月齡,其中 32 例發作已緩解(32/40,80.0%),其中 31 例(31/40,77.5%)在生后 1 月齡~3 歲 6 月齡發作緩解,另 1 例在 8 歲 1 月齡緩解。在 32 例發作已緩解患兒中,18 例發作緩解時使用單藥治療,其中奧卡西平 8 例,丙戊酸鈉 6 例,左乙拉西坦 3 例,促腎上腺皮質激素(ACTH) 1 例;11 例發作緩解時聯合使用 2 種 AEDs 治療,2 例發作緩解時聯合使用 3 種 AEDs 治療,1 例患兒(例 5)曾嘗試多種 AEDs 未能緩解,在 8 歲 1 月齡時自行緩解。8 例發作尚未緩解的患兒中 AEDs 使用情況為:2 例 1 種,1 例 2 種,其余 5 例均 3~9 種。
本研究將 AEDs 的療效分為 4 種:發作控制(至少 3 個月無發作)、發作減少(發作次數減少>25%)、無效(發作次數減少<25%)和加重。用藥后發作控制或減少為有效,藥物嘗試到最大有效量發作無明顯減少為無效。40 例 KCNQ2 基因變異癲癇患兒使用最多的 AEDs 為丙戊酸鈉、左乙拉西坦、托吡酯和苯巴比妥,使用最多的鈉離子通道阻滯劑為奧卡西平、苯巴比妥和卡馬西平。20 例曾口服丙戊酸鈉,其中 14 例有效(14/20,70.0%),6 例無效(6/20,30.0%);24 例曾口服左乙拉西坦,其中 11 例有效(11/24,45.8%),13 例無效(13/24,54.2%);18 例曾口服托吡酯,其中 10 例有效(10/18,55.5%),7 例無效(7/18,38.9%),1 例加重(1/18,5.6%);22 例曾口服奧卡西平,其中 20 例有效(20/22,90.9%),1 例無效(1/22,4.5%),1 例加重(1/22,4.5%);3 例曾口服卡馬西平,其中 1 例無效(1/3,33.3%),2 例加重(2/3,66.7%);13 例曾口服苯巴比妥,其中 9 例有效(9/13,69.2%),4 例無效(4/13,30.8%)。
40 例 KCNQ2 基因變異癲癇患兒中,2 例出現 AEDs 相關的不良反應,其中 1 例口服奧卡西平后出現了藥物過敏性皮疹,停用奧卡西平后皮疹消失;1 例口服丙戊酸鈉后出現了震顫,停藥后上述癥狀消失。
2.3 KCNQ2 基因型與表型相關性分析
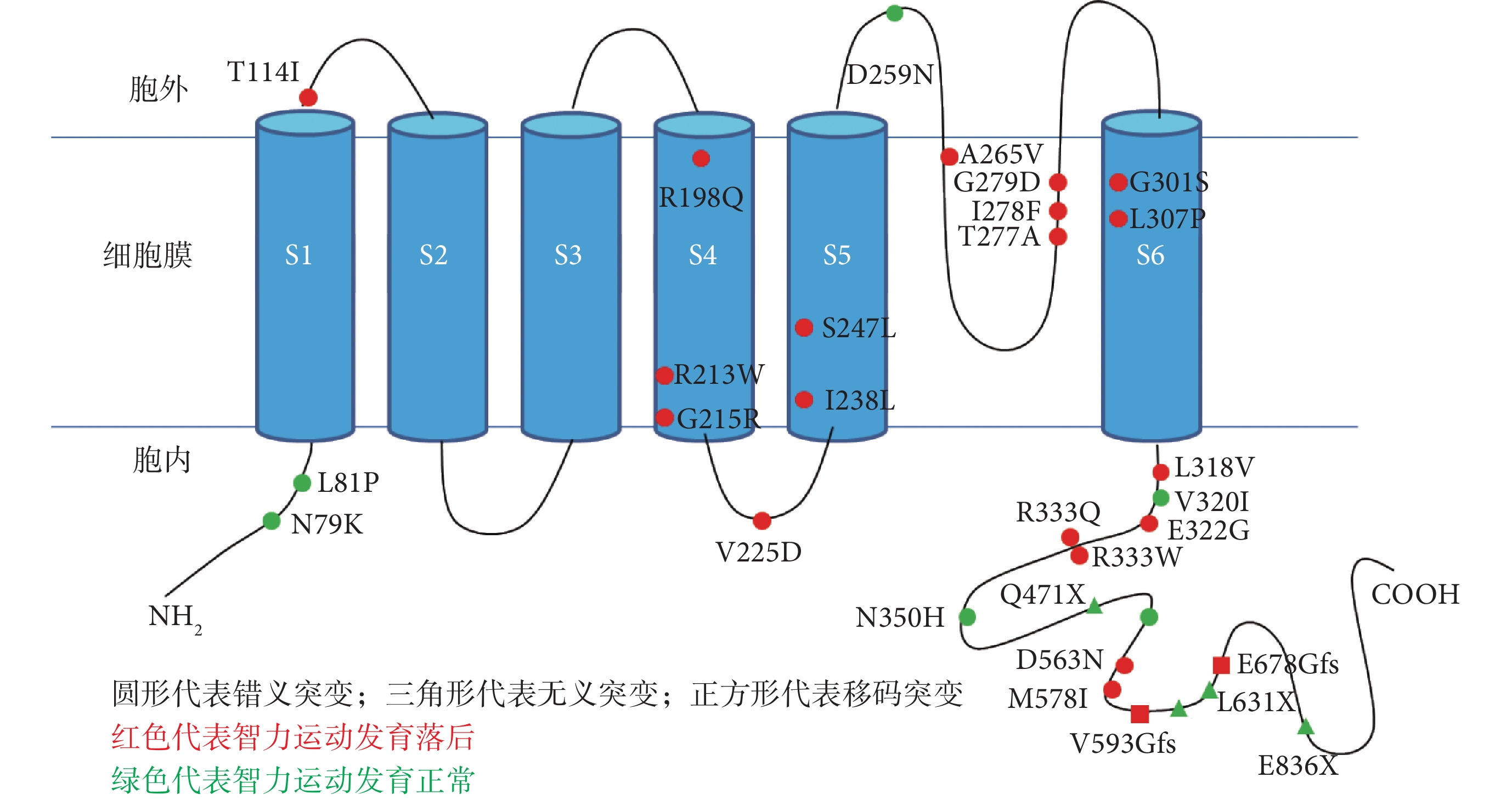
在本研究發現的 36 種 KCNQ2 基因變異中,有 31 種為點變異,余 5 種為基因片段缺失。在 31 種點變異中,21 種點變異患兒的智力運動發育落后,余 10 種點變異患兒的智力運動發育正常(圖 5)。智力運動發育正常患兒攜帶的 KCNQ2 基因點變異主要位于蛋白質 C 端和 N 端,且均不在跨膜區,而伴智力運動發育落后的 KCNQ2 基因點變異主要位于跨膜區和蛋白質 C 端。
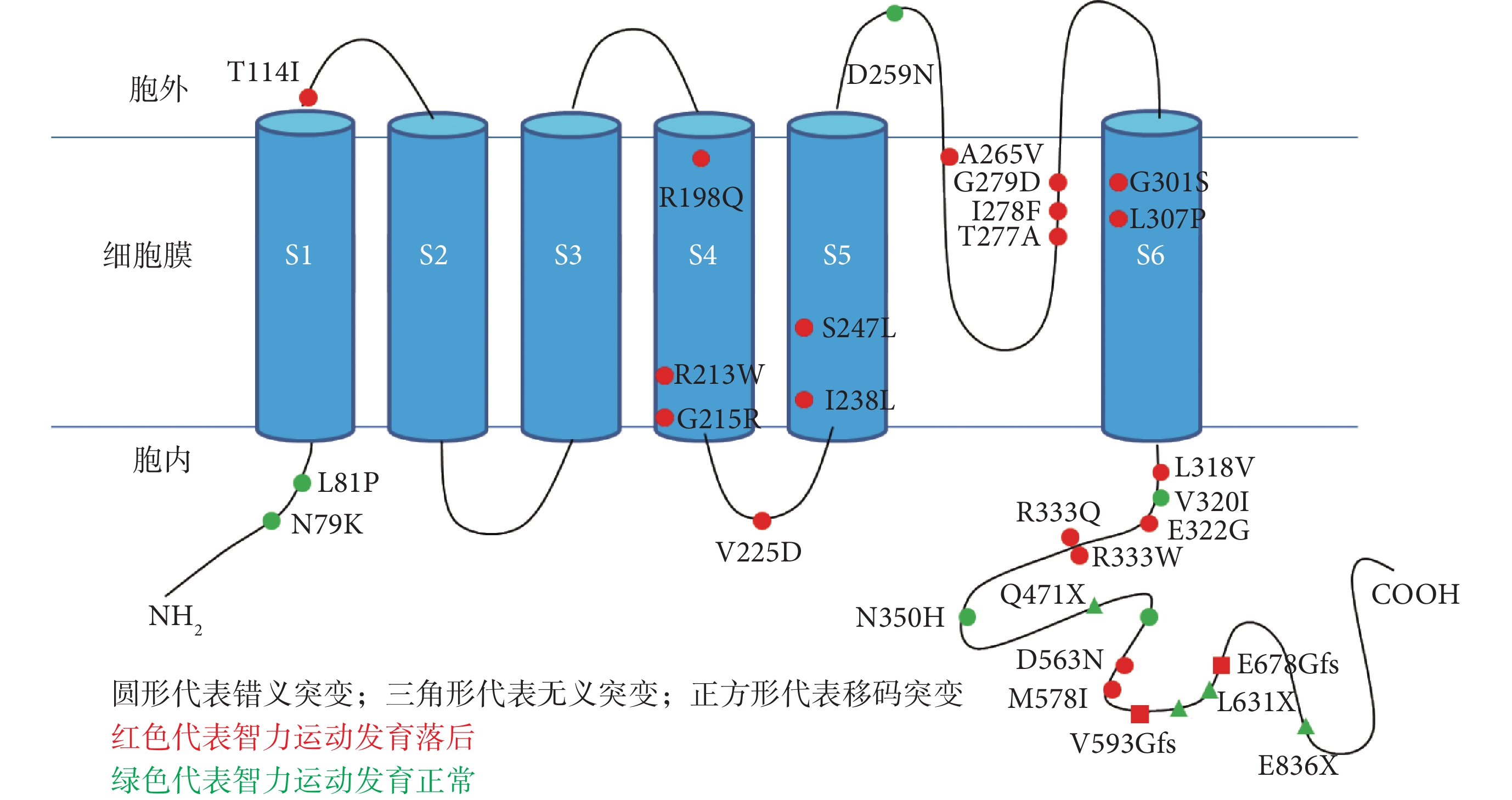 圖5
本研究 31 種 KCNQ2 基因點變異與智力運動發育的相關性分析
Figure5.
Correlation analysis of 31 KCNQ2 point variations and mental motor development
圖5
本研究 31 種 KCNQ2 基因點變異與智力運動發育的相關性分析
Figure5.
Correlation analysis of 31 KCNQ2 point variations and mental motor development
在本研究 40 例 KCNQ2 基因變異患兒中,29 例攜帶 KCNQ2 基因錯義變異,其中 6 例智力運動發育正常,23 例伴智力運動發育落后(23/29,79.3%);2 例攜帶移碼變異的患兒;4 例攜帶 KCNQ2 基因無義變異的患兒和 5 例攜帶 KCNQ2 基因片段缺失的患兒智力運動發育均正常。本研究有 4 例患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,均診斷為 WS,末次隨訪年齡在 10 月齡~1 歲月齡,均嘗試 3~5 種 AEDs 發作未控制,且智力運動發育重度落后。例 14 和例 39 攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L。2 例患兒分別在出生后 7 月齡和 5 月齡發作控制,診斷為 EIEE;其中例 14 在 1 歲 10 月齡 EEG 發現 ESES 現象,例 39 末次隨訪時 EEG 尚未發現 ESES 現象。
3 討論
3.1 KCNQ2 基因變異特點
目前國際上已報道了超過 130 種 KCNQ2 基因變異,包括錯義變異、框內堿基缺失或插入變異、堿基缺失或插入導致的移碼變異、無義變異、剪切位點變異以及 KCNQ2 基因部分外顯子甚至整個基因的缺失或重復,其中錯義變異最常見[2, 3, 6]。本研究發現了 36 種 KCNQ2 基因變異,包括錯義變異、堿基缺失或插入導致的移碼變異、無義變異和片段缺失 4 種不同的變異類型,未發現有 KCNQ2 基因框內堿基缺失或插入變異和剪切位點變異。本研究發現的 36 種 KCNQ2 基因變異中,69.4%(25/36)為錯義變異,說明錯義變異是 KCNQ2 基因最常見的變異類型,與文獻報道一致[2, 3, 6]。
文獻報道,KCNQ2 基因無熱點變異,僅少數 KCNQ2 基因變異患者可攜帶相同變異[2, 7]。本研究有 4 例嬰兒痙攣癥患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,該變異已有文獻報道與嬰兒痙攣癥相關[7]。另有 2 例 EIEE 患兒攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L(例 14 和例 39),該變異尚未見文獻報道。而本研究中其他患兒攜帶的變異均不相同,說明我國癲癇患兒 KCNQ2 基因變異也無熱點。近年來,文獻報道的 KCNQ2 基因導致的 EIEE 越來越多,其中大多為新生變異[6, 8]。本研究發現 70.0%(28/40)的患兒攜帶 KCNQ2 基因新生變異,其余為遺傳性變異,說明 KCNQ2 基因新生變異較遺傳性變異更常見。
3.2 KCNQ2 基因變異患兒的癲癇表型譜
KCNQ2 基因變異導致的癲癇起病早,大多在出生后 1 周內起病,少數可在新生兒期和嬰兒期起病,最晚起病年齡為 6 月齡[9]。本研究 KCNQ2 基因患兒的癲癇起病年齡在出生后 1 d~9 個月,80.0% 在新生兒期起病,其中 70.0%(28/40)在出生后 1 周內起病,≥4 個月起病者僅 4 例(4/40,10.0%)。
文獻報道,KCNQ2 基因變異的癲癇患兒可有多種發作類型,包括局灶性發作、強直陣攣發作、強直發作、痙攣發作、強直痙攣發作、肌陣攣發作等[10]。本研究發現 KCNQ2 基因患兒的癲癇發作類型有局灶性發作、痙攣發作、強直痙攣發作、全面強直陣攣發作、強直發作、肌陣攣發作,其中局灶性發作見于 95.0% 的患兒,是最常見的發作類型,而其他發作形式僅見于少數患兒。本研究所有患兒的發作均具有叢集性,說明叢集性發作是 KCNQ2 基因相關癲癇的表型特點之一。Sands 等[11]報道,3 例攜帶 KCNQ2 基因變異的 BFNE 患兒出現了癲癇持續狀態,均為局灶性發作,具體發作持續時間未見詳細描述。本研究有 4 例患兒發生過癲癇持續狀態,其中 3 例為發熱誘發,說明 KCNQ2 基因導致的癲癇少數可出現持續狀態,且發作有熱敏感的 KCNQ2 基因變異患兒易出現癲癇持續狀態。4 例出現癲癇持續狀態的患兒表型分別為 BFNE、BNE、EIEE 和 WS,說明攜帶 KCNQ2 基因變異的良性癲癇和癲癇性腦病患兒均可發生癲癇持續狀態。
本研究有 3 例 EIEE 患兒 EEG 出現了 ESES 現象,放電部位可波及額區、中央區、中線區、頂區、顳區和枕區,NREM 期放電指數均在 85% 以上,說明 KCNQ2 基因可能是 ESES 相關癲癇的致病基因。2003 年,Singh 等[12]報道在一個攜帶 KCNQ2 基因變異 Q323X 的 BFNE 家系有 2 例受累者分別在 2 歲和 4 歲時出現了兒童良性癲癇伴中央顳區棘波(BECTS),但未描述具體表現,也未提及該 2 例受累者隨訪過程中的 EEG 是否有 ESES 現象。目前尚未見有關 KCNQ2 基因變異導致 ESES 現象的報道,說明 ESES 現象在 KCNQ2 基因變異癲癇患者較少見。
文獻報道,KCNQ2 基因變異導致的癲癇性腦病患兒的早期顱腦影像學檢查可發現異常信號,主要在基底節和丘腦區,但大多在 3 歲前可恢復正常,而其他較常見的腦結構異常通常很難恢復,包括額葉發育不良伴額顳區蛛網膜下腔增寬、胼胝體發育不良和后部腦白質減少等[10, 13]。在本研究 24 例攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒中,有 14 例癲癇性腦病患兒的顱腦 MRI 提示異常,異常表現包括胼胝體發育不良、額顳區蛛網膜下腔增寬、額顳區皮層發育不良、腦溝增深、腦室增大,其中約半數攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒存在胼胝體發育不良和額顳區蛛網膜下腔增寬,說明額顳葉和胼胝體發育不良是 KCNQ2 基因變異相關癲癇性腦病常見的腦發育異常。本研究約半數攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒存在額顳葉和胼胝體發育不良。
BFNE 患兒的 KCNQ2 基因都遺傳自父或母一方,而導致癲癇性腦病的 KCNQ2 基因變異大多為新生變異[14, 15]。本研究攜帶 KCNQ2 基因遺傳性變異的患兒中,91.7% 智力運動發育正常,僅 1 例存在落后,而 85.7% 攜帶 KCNQ2 基因新生變異的患兒存在發育落后,說明 KCNQ2 基因新生變異常導致較嚴重的表型。本研究有 25 例患兒存在不同程度的智力運動發育落后,其中 18 例始終不會抬頭,不認人,幾乎無語言發育,智力運動發育嚴重落后。此外,有 11 例患兒發作緩解后智力運動發育無明顯進步,說明 KCNQ2 基因變異患兒的智力運動發育落后不僅與癲癇活動本身有關,還與 KCNQ2 基因變異對神經系統發育的影響有關,為發育性癲癇性腦病。文獻報道,癲癇是 KCNQ2 基因變異患兒最常見的表型,相關癲癇表型譜較廣,包括預后較好的 BFNE、BFNIE、BFIE 及 BNE 或 BIE,以及預后不良的 OS、WS 和其他不能分類的 EIEE[3, 14, 16, 17]。KCNQ2 基因變異還可以導致其他相對少見的表型,如孤獨癥、肌纖維顫搐、運動障礙等,大多伴癲癇發作[18-22]。本研究發現的 KCNQ2 基因變異相關癲癇表型有 BFNE、BFNIE、BFIE、BNE、BIE、OS、WS、不能分類的 EIEE 以及癲癇共患孤獨癥,與文獻報道的表型大致相同。
在同一個 BFNE 家系內攜帶相同 KCNQ2 基因的受累者表型輕重程度可有差異[4, 23, 24]。本研究例 5 來自一個 BFNIE 家系,表型為 EIEE,而其他家系成員的表型均為新生兒或嬰兒期起病的良性癲癇,說明家系內部不同受累者的表型可存在明顯差異,這種表型異質性可能與其他基因對患兒表型的修飾相關。既往文獻報道,在 KCNQ2 基因變異導致的 BFNE 家系存在外顯率不全,攜帶 KCNQ2 基因雜合致病變異者的外顯率約為 77%~85%[2, 25]。本研究例 30 患兒表型為 BIE,該患兒母親攜帶與患兒相同的無義變異 c.1892T>A/p.L631X,無抽搐史,考慮為外顯不全。
少數 EIEE 患兒的 KCNQ2 基因變異可遺傳自表型正常的嵌合體父或母一方,這些變異可以在血、皮膚和毛囊 DNA 中檢測出,變異比例在 5%~30% 之間,攜帶嵌合變異者的神經發育正常,少數可有新生兒期癲癇史[6, 26]。既往文獻尚未報道 KCNQ2 基因片段缺失相關的嵌合變異,本研究首次發現 1 例可疑 KCNQ2 基因片段缺失嵌合體變異。本研究例 11 患兒為 KCNQ2 基因外顯子 8-16 雜合缺失,MLPA 檢測發現其無癥狀的父親可疑為 KCNQ2 基因外顯子 8-16 雜合缺失嵌合體。
文獻報道,大多數 KCNQ2 基因變異導致的 EIEE 患兒在癲癇發病初期可對多種 AEDs 無效,但大多能在出生后 9 個月~4 歲發作緩解[6]。本研究 80.0% 患兒發作已緩解,其中 77.5%(35/40)在出生后 1 月齡~3 歲 6 月齡發作緩解,與文獻報道的緩解年齡大致接近。本研究大部分患兒發作控制時口服 1~2 種 AEDs,說明 KCNQ2 基因變異導致的癲癇相對容易控制。本研究有 8 例發作未控制的患兒的末次隨訪年齡尚小(8 月齡~1 歲 2 月齡),需進一步隨訪患兒的發作緩解年齡。
文獻報道,鈉離子通道阻滯劑卡馬西平、奧卡西平、苯妥英納和拉莫三嗪等對 KCNQ2 基因變異相關癲癇有效率高,但在少數患兒可導致發作加重[10, 15, 27, 28]。本研究中鈉離子通道阻滯劑奧卡西平的患兒最多,有效率高達 90%,與文獻報道一致。因此,建議攜帶 KCNQ2 基因變異的患兒應該首選鈉離子通道阻滯劑,尤其是奧卡西平。文獻報道,個別有痙攣發作的 KCNQ2 基因變異患兒使用卡馬西平治療有效[10]。本研究部分有痙攣發作的患兒使用奧卡西平后發作減少,說明有痙攣發作的 KCNQ2 基因患兒也可嘗試用奧卡西平進行治療。本研究 5% 的患兒在使用奧卡西平后出現發作加重,因此如果選用奧卡西平治療應注意密切隨診治。本研究中有患兒曾使用丙戊酸鈉、左乙拉西坦、托吡酯和苯巴比妥,其中丙戊酸鈉有效率 70%,是一種藥物中有效率最高者,且無患兒用藥后出現不良反應。文獻報道,鉀離子通道開放劑(如瑞替加濱和依佐加濱)能減少 KCNQ2 基因變異癲癇患者的發作,并能改善智力運動發育[13]。本研究 40 例患兒均未曾使用鉀離子通道開放劑。
3.3 KCNQ2 基因變異的基因型與表型的相關性
本研究發現,在攜帶 KCNQ2 基因點變異的患兒中,智力運動發育正常患兒攜帶的變異均位于跨膜區外,而位于跨膜區 S4、S5、S6 和 P 環區的變異導致的表型均伴智力運動發育落后,說明位于 S4、S5、S6 和 P 環區的變異常導致預后不良表型。文獻報道,KCNQ2 基因無義變異、移碼變異和剪切位點變異大多導致單倍體劑量不足,因此,攜帶這些類型變異的患兒的表型大多為預后較好的表型如 BFNE,而幾乎所有導致 EIEE 的變異都為錯義變異[29, 30]。本研究中有 29 例患兒攜帶 KCNQ2 基因錯義變異,其中 79.3%(23/29)智力運動發育落后,說明 KCNQ2 基因錯義變異常導致發育落后表型,與文獻報道一致。本研究有 4 例攜帶 KCNQ2 基因無義變異的患兒的末次隨訪年齡仍較小,但與同齡兒相比,智力運動發育大致正常,與文獻報道一致。本研究中有 2 例(例 17、例 18)患兒攜帶 KCNQ2 基因移碼變異,末次隨訪年齡均為 3 歲,均伴智力運動發育落后,與文獻報道不同。2 例患兒分別攜帶的 KCNQ2 基因變異 c.1778_1779 delTG/p.V593GfsX271 和 c.2032 dupG/p.E678GfsX187,這兩個變異均位于蛋白質 C 端,雖然均導致了移碼,但是翻譯合成的氨基酸鏈長度與正常的蛋白非常接近,推測這兩個移碼變異并非導致單倍體劑量不足,而是對鉀離子通道產生了更嚴重的影響。
4 結語
KCNQ2 基因變異以錯義變異為主,新生變異更常見。KCNQ2 基因變異導致的癲癇多在新生兒期起病,以局灶性發作為主,大多發作具有叢集性的特點;少數患兒 EEG 可出現 ESES 現象。KCNQ2 基因變異導致的癲癇表型譜廣。KCNQ2 基因片段缺失和無義變異常導致良性預后的癲癇表型。KCNQ2 基因遺傳性變異常導致良性家族性癲癇,而新生變異大多導致癲癇性腦病,其中約半數有額顳葉和胼胝體發育不良。鈉離子通道阻滯劑是治療 KCNQ2 基因變異相關癲癇的有效藥物。
KCNQ2 基因是電壓門控鉀離子通道基因,與 KCNQ3 共同編碼形成 M 型鉀離子通道,主要表達于大腦組織。1998 年 Singh 等[1]首次報道 KCNQ2 基因是良性家族性新生兒癲癇(Benign familial neonatal epilepsy,BFNE)的致病基因。Grinton 等[2]發現 81.8%(27/33)的 BFNE 家系為 KCNQ2 基因變異所致,證實 KCNQ2 基因是 BFNE 的主要致病基因,也有少數報道稱 KCNQ2 基因變異可以導致良性家族性新生兒-嬰兒癲癇(Benign familial neonatal-infantile epilepsy,BFNIE)或良性家族性嬰兒癲癇(Benign familial infantile epilepsy,BFIE)[3]。2003 年 Dedek 等[4]報道 KCNQ2 基因變異導致的 BFNE 家系中少數受累者可表現為早發癲癇性腦病(Early infantile epileptic encephalopathy,EIEE)。隨后發現部分 EIEE 的散發病例也可由 KCNQ2 基因新生變異導致,證實 KCNQ2 基因亦是其致病基因[5]。近年來,隨著二代測序技術的發展,有關 KCNQ2 基因變異導致癲癇的報道逐漸增多。目前,我國尚缺乏對 KCNQ2 基因變異表型譜的研究。本研究對北京大學第一醫院兒科收集的 KCNQ2 基因變異的癲癇患兒表型特點及基因變異特點進行總結分析,旨在對相關疾病的臨床診治提供參考。
1 資料與方法
1.1 研究對象
收集 2012 年 1 月—2018 年 1 月北京大學第一醫院兒科神經專科診治的 KCNQ2 基因變異陽性的癲癇患兒 40 例,每例患兒由監護人簽署知情同意書,收集患兒及其家系成員的臨床資料和外周血 DNA。對每例入選的患兒及其家系成員建立詳細的臨床資料登記表(內容包括姓名、性別、出生日期、民族、發病年齡、發作表現、圍產期情況、既往史、智力運動發育情況、家族史、用藥史及輔助檢查結果),通過門診復診及隨訪患兒的治療及反應。本研究已通過北京大學第一醫院倫理委員會的批準[編號:2012(453)]。
1.2 方法
采用 Miller 改良鹽析法提取外周血白細胞基因組 DNA。采用靶向捕獲二代測序癲癇基因檢測包篩查患兒的基因變異,對發現 KCNQ2 基因變異的患兒,采用一代測序的方法驗證患兒及其家系成員相關變異位點。抗癲癇藥物(AEDs)的療效分為 4 種:發作控制(至少 3 個月無發作)、發作減少(發作次數減少≥25%)、無效(發作次數減少<25%)和加重。用藥后發作控制或發作次數減少為有效,藥物嘗試到最大有效劑量發作無明顯減少為無效。
1.3 統計學方法
癲癇患兒臨床特征中各表型發病率為計數資料,用例(%)表示。
2 結果
2.1 KCNQ2 基因變異結果
本研究共收集 40 例 KCNQ2 基因變異患兒,其中男 22 例,女 18 例。共檢測到 36 種不同的 KCNQ2 基因雜合變異(Genbank 序列號為 NM_172107.2),其中錯義變異 25 種(25/36,69.4%),堿基缺失或插入所致移碼變異 2 種,無義變異 4 種,片段缺失 5 種(例 6、例 20 和例 21 患兒的 KCNQ2 基因片段缺失還累及與 KCNQ2 基因相鄰的 CHRNA4)。例 22、例 26、例 29 和例 36 患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,例 14 和例 39 攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L。16 種為已報道的致病變異,其余 20 種均為尚未見報道的新變異。20 種新變異在 100 名健康對照組中均未發現。
40 例患兒中,12 例為遺傳性變異,其余 28 例為新生變異(28/40,70.0%)。12 例攜帶 KCNQ2 基因遺傳性變異的患兒中,11 例有癲癇或熱性驚厥家族史,1 例無癲癇或熱性驚厥家族史(例 11)。本研究 40 例患兒 KCNQ2 基因變異結果見表 1。
例 30 的父親有熱性驚厥史,母親無熱性驚厥或癲癇病史,該患兒發現 KCNQ2 基因無義變異 c.1892T>A/p.L631X,遺傳自無癥狀的母親,考慮患兒母親為外顯不全。例 11 發現 KCNQ2 基因外顯子 8-16 雜合缺失,進一步用多重連接依賴的探針擴增(Multiplex ligation-dependent probe amplification,MLPA)方法驗證患兒及其家系成員,患兒父親 KCNQ2 基因外顯子 8-16 也存在缺失,但缺失比例低于患兒(患兒 KCNQ2 基因外顯子 8-16 MLPA Ratio 為 0.49~0.55,而患兒父親該值為 0.68~0.74,可疑為嵌合突變。患兒的母親、哥哥、姑姑、祖父和祖母未攜帶相同變異。例 11 患兒及其家系成員的 MLPA 結果見圖 1。在 28 例攜帶 KCNQ2 基因新生變異的患兒中,25 例無癲癇或熱性驚厥家族史,3 例患兒有熱性驚厥家族史(例 10 的父親、例 25 的母親、例 34 的哥哥)。
 圖1
例 11 患兒及其家系成員的多重連接依賴的探針擴增分析結果
圖1
例 11 患兒及其家系成員的多重連接依賴的探針擴增分析結果
患兒為 KCNQ2 基因外顯子 8-16 雜合缺失,患兒父親外顯子 8-16 雜合缺失(可疑為嵌合突變),患兒母親、哥哥、祖父、祖母和姑姑為陰性
Figure1. MLPA analysis result of patient 11 and his family membersPatient 11 had heterozygous deletion of KCNQ2 exon 8-16, the father had heterozygous deletion of KCNQ2 (were suspected of mosaic), the mother, brother, grandfather, grandmother, and aunt of patient 11 were wildtype

2.2 KCNQ2 基因變異癲癇患兒的臨床特點
2.2.1 癲癇發作表現
40 例 KCNQ2 基因變異患兒的癲癇起病年齡在出生后 1 d~9 個月,中位起病年齡為出生后 3 d。40 例患兒中,新生兒期起病 32 例(32/40,80.0%),其中 28 例在出生后 1 周內起病(28/40,70.0%),1 周~1 個月起病 4 例(4/40,10.0%);1~3 個月起病 4 例(4/40,10.0%);≥4 個月起病 4 例(4/40,10.0%)。40 例表現為多種發作類型,其中局灶性發作 38 例(38/40,95.0%),痙攣發作 10 例(10/40,25.0%),肌陣攣發作 4 例(4/40,10.0%),強直-痙攣發作 3 例(3/40,7.5%),全面強直-陣攣發作和強直發作各 1 例。34 例發作持續時間<5 min(34/40,85.0%);6 例發作持續時間>5 min,發作持續的最長時間為 10 min~1.5 h,其中 4 例(4/40,10.0%)病程中曾有癲癇持續狀態史(發作持續時間>30 min);該 4 例患兒分別為例 5、例 9、例 24 和例 26,其中 3 例癲癇持續狀態為發熱誘發。40 例發作均有叢集性(即 24 h 內發作>2 次)的特點。6 例發作有熱敏感特點(6/40,15.0%)。見表 1。
2.2.2 智力運動發育情況
在 40 例患兒中,25 例(25/40,62.5%)有不同程度的智力運動發育落后,余 15 例智力運動發育正常(15/40,37.5%)。在 25 例智力運動發育落后患兒中,18 例始終不會抬頭,不認人,幾乎無語言發育(18/25,72.0%)。12 例 KCNQ2 基因遺傳性變異的患兒中,11 例智力運動發育正常(11/12,91.7%),另 1 例智力運動發育落后(1/12,8.3%)。28 例攜帶 KCNQ2 基因新生變異的患兒中,4 例(4/28,14.3%)發育正常,余 24 例(24/28,85.7%)伴發育落后。3 例智力運動發育落后的患兒有孤獨癥樣表現(3/25,12.0%)。
2.2.3 腦電圖表現
40 例患兒均進行過至少 1 次視頻腦電圖(VEEG)檢查,其中腦電圖(EEG)異常 33 例,余 7 例患兒 VEEG 正常。在 33 例 EEG 異常患兒中,背景活動減慢 15 例;發作間期 EEG 顯示局灶性或多灶性放電 31 例,放電可位于一側或雙側的額極、額區、中央區、中線區、頂區、顳區、枕區等部位;高峰失律 10 例;爆發?抑制 8 例;廣泛性癇樣放電 3 例(放電表現可為尖波、棘波、棘慢波、多棘慢波、快波)。25 例監測到臨床發作,其中局灶性發作 19 例,痙攣發作 7 例,肌陣攣發作 3 例,強直發作 1 例,強直痙攣發作 1 例。3 例患兒(例 5、例 14 和例 15)EEG 出現了睡眠中癲癇性電持續狀態(Electrical status epilepticus during sleep,ESES),放電部位可波及額區、中央區、中線區、頂區、顳區和枕區,睡眠期接近持續發放,非快速動眼期(Non-rapid eye-movement,NREM)放電指數為 85%~95%。圖 2 為例 5 患兒 3 歲齡 EEG,顯示雙側中后顳區為主的棘波、棘慢波發放,睡眠期接近持續發放,NREM 期放電指數>85%。余 7 例 KCNQ2 基因變異患兒 VEEG 正常。
 圖2
例 5 患兒 3 歲齡腦電圖
圖2
例 5 患兒 3 歲齡腦電圖
a. 腦電圖背景活動正常;b. 清醒期雙側中后顳區棘波、棘慢波發放;c. 睡眠期雙側中后顳區為主的棘波、棘慢波接近持續發放,有泛化趨勢,NREM 期放電指數>85%
Figure2. EEG of patient 5 (at 3 years of age)a. The background activity was normal; b. Spikes or spike and wave discharges in the bilateral middle and posterior temporal areas during the waking period; c. In the sleep stage, the spikes or spike and wave discharges mainly in the bilateral middle and posterior temporal regions were nearly continuous,showing a generalization trend, and the discharge index in NREM was > 85%
2.2.4 顱腦影像學成像檢查
40 例患兒均行至少 1 次顱腦核磁共振成像(MRI)檢查,14 例攜帶 KCNQ2 基因新生變異且伴發育落后的患兒有不同程度異常(14/40,35.0%,末次檢查時間為出生后 2 個月~1 歲 10 個月),其中腦溝增深見于 4 例患兒(4/40,10.0%),雙側側腦室增大見于 3 例患兒(3/40,7.5%),雙側額顳區蛛網膜下腔增寬見于 11 例患兒(11/40,27.5%),雙側額顳區皮層發育不良見于 2 例患兒(2/40,5.0%),胼胝體發育不良見于 10 例患兒(10/40,25.0%)。14 例 MRI 異常患兒均為 KCNQ2 基因新生變異,且均伴智力運動發育落后。例 15 患兒 6 月齡和 1 歲 10 月齡的頭顱 MRI 均提示雙側額顳區蛛網膜下腔增寬,額顳區皮層發育不良,胼胝體發育不良,腦溝增深(圖 3)。余 26 例 MRI 正常。
 圖3
例 15 患兒的顱腦核磁共振結果
圖3
例 15 患兒的顱腦核磁共振結果
a. 6 月齡;b. 1 歲 10 月齡 MRI 均提示雙側額顳區蛛網膜下腔增寬,雙側額顳區皮層及胼胝體發育不良,腦溝增深
Figure3. Brain MRI results of patient 15a. at 6 months of age; b. at 1 year and 10 months of age. Both brain MRI showed enlargement of subarachnoid spaces in the frontal and temporal region, cortial dysplasia in the bilateral frontal and temporal region, agenesis of corpus callosum,and sulus deepening
2.2.5 癲癇綜合征診斷
40 例 KCNQ2 基因變異陽性患兒可診斷為多種不同的癲癇綜合征,其中 BFNE 3 例;BFNIE 2 例;BFIE 3 例;良性新生兒癲癇(Benign neonatal epilepsy,BNE)5 例;良性嬰兒癲癇(Benign infantile epilepsy,BIE)2 例;大田原綜合征(Ohtahara syndrome,OS)3 例;嬰兒痙攣癥(West syndrome,WS)9 例;不能分類的 EIEE 12 例,其中例 5 為 1 個 BFNIE 家系的先證者,該家系其余 7 例受累者在生后第 2 d~6 個月出現癲癇,1 歲前緩解,智力運動發育正常,僅例 5 存在智力運動發育落后,病程中 EEG 曾出現 ESES 現象;癲癇共患孤獨癥 1 例。40 例患兒中,不同表型所占的比例見圖 4。
 圖4
40 例 KCNQ2 基因變異癲癇患兒不同表型所占的比例
Figure4.
Distribution of patients with KCNQ2 variants according to phenotype
圖4
40 例 KCNQ2 基因變異癲癇患兒不同表型所占的比例
Figure4.
Distribution of patients with KCNQ2 variants according to phenotype
2.2.6 治療和隨訪
40 例患兒的末次隨訪年齡為 3 月齡~8 歲 10 月齡,其中 32 例發作已緩解(32/40,80.0%),其中 31 例(31/40,77.5%)在生后 1 月齡~3 歲 6 月齡發作緩解,另 1 例在 8 歲 1 月齡緩解。在 32 例發作已緩解患兒中,18 例發作緩解時使用單藥治療,其中奧卡西平 8 例,丙戊酸鈉 6 例,左乙拉西坦 3 例,促腎上腺皮質激素(ACTH) 1 例;11 例發作緩解時聯合使用 2 種 AEDs 治療,2 例發作緩解時聯合使用 3 種 AEDs 治療,1 例患兒(例 5)曾嘗試多種 AEDs 未能緩解,在 8 歲 1 月齡時自行緩解。8 例發作尚未緩解的患兒中 AEDs 使用情況為:2 例 1 種,1 例 2 種,其余 5 例均 3~9 種。
本研究將 AEDs 的療效分為 4 種:發作控制(至少 3 個月無發作)、發作減少(發作次數減少>25%)、無效(發作次數減少<25%)和加重。用藥后發作控制或減少為有效,藥物嘗試到最大有效量發作無明顯減少為無效。40 例 KCNQ2 基因變異癲癇患兒使用最多的 AEDs 為丙戊酸鈉、左乙拉西坦、托吡酯和苯巴比妥,使用最多的鈉離子通道阻滯劑為奧卡西平、苯巴比妥和卡馬西平。20 例曾口服丙戊酸鈉,其中 14 例有效(14/20,70.0%),6 例無效(6/20,30.0%);24 例曾口服左乙拉西坦,其中 11 例有效(11/24,45.8%),13 例無效(13/24,54.2%);18 例曾口服托吡酯,其中 10 例有效(10/18,55.5%),7 例無效(7/18,38.9%),1 例加重(1/18,5.6%);22 例曾口服奧卡西平,其中 20 例有效(20/22,90.9%),1 例無效(1/22,4.5%),1 例加重(1/22,4.5%);3 例曾口服卡馬西平,其中 1 例無效(1/3,33.3%),2 例加重(2/3,66.7%);13 例曾口服苯巴比妥,其中 9 例有效(9/13,69.2%),4 例無效(4/13,30.8%)。
40 例 KCNQ2 基因變異癲癇患兒中,2 例出現 AEDs 相關的不良反應,其中 1 例口服奧卡西平后出現了藥物過敏性皮疹,停用奧卡西平后皮疹消失;1 例口服丙戊酸鈉后出現了震顫,停藥后上述癥狀消失。
2.3 KCNQ2 基因型與表型相關性分析
在本研究發現的 36 種 KCNQ2 基因變異中,有 31 種為點變異,余 5 種為基因片段缺失。在 31 種點變異中,21 種點變異患兒的智力運動發育落后,余 10 種點變異患兒的智力運動發育正常(圖 5)。智力運動發育正常患兒攜帶的 KCNQ2 基因點變異主要位于蛋白質 C 端和 N 端,且均不在跨膜區,而伴智力運動發育落后的 KCNQ2 基因點變異主要位于跨膜區和蛋白質 C 端。
 圖5
本研究 31 種 KCNQ2 基因點變異與智力運動發育的相關性分析
Figure5.
Correlation analysis of 31 KCNQ2 point variations and mental motor development
圖5
本研究 31 種 KCNQ2 基因點變異與智力運動發育的相關性分析
Figure5.
Correlation analysis of 31 KCNQ2 point variations and mental motor development
在本研究 40 例 KCNQ2 基因變異患兒中,29 例攜帶 KCNQ2 基因錯義變異,其中 6 例智力運動發育正常,23 例伴智力運動發育落后(23/29,79.3%);2 例攜帶移碼變異的患兒;4 例攜帶 KCNQ2 基因無義變異的患兒和 5 例攜帶 KCNQ2 基因片段缺失的患兒智力運動發育均正常。本研究有 4 例患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,均診斷為 WS,末次隨訪年齡在 10 月齡~1 歲月齡,均嘗試 3~5 種 AEDs 發作未控制,且智力運動發育重度落后。例 14 和例 39 攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L。2 例患兒分別在出生后 7 月齡和 5 月齡發作控制,診斷為 EIEE;其中例 14 在 1 歲 10 月齡 EEG 發現 ESES 現象,例 39 末次隨訪時 EEG 尚未發現 ESES 現象。
3 討論
3.1 KCNQ2 基因變異特點
目前國際上已報道了超過 130 種 KCNQ2 基因變異,包括錯義變異、框內堿基缺失或插入變異、堿基缺失或插入導致的移碼變異、無義變異、剪切位點變異以及 KCNQ2 基因部分外顯子甚至整個基因的缺失或重復,其中錯義變異最常見[2, 3, 6]。本研究發現了 36 種 KCNQ2 基因變異,包括錯義變異、堿基缺失或插入導致的移碼變異、無義變異和片段缺失 4 種不同的變異類型,未發現有 KCNQ2 基因框內堿基缺失或插入變異和剪切位點變異。本研究發現的 36 種 KCNQ2 基因變異中,69.4%(25/36)為錯義變異,說明錯義變異是 KCNQ2 基因最常見的變異類型,與文獻報道一致[2, 3, 6]。
文獻報道,KCNQ2 基因無熱點變異,僅少數 KCNQ2 基因變異患者可攜帶相同變異[2, 7]。本研究有 4 例嬰兒痙攣癥患兒攜帶相同 KCNQ2 基因變異 c.593G>A/p.R198Q,該變異已有文獻報道與嬰兒痙攣癥相關[7]。另有 2 例 EIEE 患兒攜帶相同 KCNQ2 基因變異 c.740C>T/p.S247L(例 14 和例 39),該變異尚未見文獻報道。而本研究中其他患兒攜帶的變異均不相同,說明我國癲癇患兒 KCNQ2 基因變異也無熱點。近年來,文獻報道的 KCNQ2 基因導致的 EIEE 越來越多,其中大多為新生變異[6, 8]。本研究發現 70.0%(28/40)的患兒攜帶 KCNQ2 基因新生變異,其余為遺傳性變異,說明 KCNQ2 基因新生變異較遺傳性變異更常見。
3.2 KCNQ2 基因變異患兒的癲癇表型譜
KCNQ2 基因變異導致的癲癇起病早,大多在出生后 1 周內起病,少數可在新生兒期和嬰兒期起病,最晚起病年齡為 6 月齡[9]。本研究 KCNQ2 基因患兒的癲癇起病年齡在出生后 1 d~9 個月,80.0% 在新生兒期起病,其中 70.0%(28/40)在出生后 1 周內起病,≥4 個月起病者僅 4 例(4/40,10.0%)。
文獻報道,KCNQ2 基因變異的癲癇患兒可有多種發作類型,包括局灶性發作、強直陣攣發作、強直發作、痙攣發作、強直痙攣發作、肌陣攣發作等[10]。本研究發現 KCNQ2 基因患兒的癲癇發作類型有局灶性發作、痙攣發作、強直痙攣發作、全面強直陣攣發作、強直發作、肌陣攣發作,其中局灶性發作見于 95.0% 的患兒,是最常見的發作類型,而其他發作形式僅見于少數患兒。本研究所有患兒的發作均具有叢集性,說明叢集性發作是 KCNQ2 基因相關癲癇的表型特點之一。Sands 等[11]報道,3 例攜帶 KCNQ2 基因變異的 BFNE 患兒出現了癲癇持續狀態,均為局灶性發作,具體發作持續時間未見詳細描述。本研究有 4 例患兒發生過癲癇持續狀態,其中 3 例為發熱誘發,說明 KCNQ2 基因導致的癲癇少數可出現持續狀態,且發作有熱敏感的 KCNQ2 基因變異患兒易出現癲癇持續狀態。4 例出現癲癇持續狀態的患兒表型分別為 BFNE、BNE、EIEE 和 WS,說明攜帶 KCNQ2 基因變異的良性癲癇和癲癇性腦病患兒均可發生癲癇持續狀態。
本研究有 3 例 EIEE 患兒 EEG 出現了 ESES 現象,放電部位可波及額區、中央區、中線區、頂區、顳區和枕區,NREM 期放電指數均在 85% 以上,說明 KCNQ2 基因可能是 ESES 相關癲癇的致病基因。2003 年,Singh 等[12]報道在一個攜帶 KCNQ2 基因變異 Q323X 的 BFNE 家系有 2 例受累者分別在 2 歲和 4 歲時出現了兒童良性癲癇伴中央顳區棘波(BECTS),但未描述具體表現,也未提及該 2 例受累者隨訪過程中的 EEG 是否有 ESES 現象。目前尚未見有關 KCNQ2 基因變異導致 ESES 現象的報道,說明 ESES 現象在 KCNQ2 基因變異癲癇患者較少見。
文獻報道,KCNQ2 基因變異導致的癲癇性腦病患兒的早期顱腦影像學檢查可發現異常信號,主要在基底節和丘腦區,但大多在 3 歲前可恢復正常,而其他較常見的腦結構異常通常很難恢復,包括額葉發育不良伴額顳區蛛網膜下腔增寬、胼胝體發育不良和后部腦白質減少等[10, 13]。在本研究 24 例攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒中,有 14 例癲癇性腦病患兒的顱腦 MRI 提示異常,異常表現包括胼胝體發育不良、額顳區蛛網膜下腔增寬、額顳區皮層發育不良、腦溝增深、腦室增大,其中約半數攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒存在胼胝體發育不良和額顳區蛛網膜下腔增寬,說明額顳葉和胼胝體發育不良是 KCNQ2 基因變異相關癲癇性腦病常見的腦發育異常。本研究約半數攜帶 KCNQ2 基因新生變異且伴智力運動發育落后的患兒存在額顳葉和胼胝體發育不良。
BFNE 患兒的 KCNQ2 基因都遺傳自父或母一方,而導致癲癇性腦病的 KCNQ2 基因變異大多為新生變異[14, 15]。本研究攜帶 KCNQ2 基因遺傳性變異的患兒中,91.7% 智力運動發育正常,僅 1 例存在落后,而 85.7% 攜帶 KCNQ2 基因新生變異的患兒存在發育落后,說明 KCNQ2 基因新生變異常導致較嚴重的表型。本研究有 25 例患兒存在不同程度的智力運動發育落后,其中 18 例始終不會抬頭,不認人,幾乎無語言發育,智力運動發育嚴重落后。此外,有 11 例患兒發作緩解后智力運動發育無明顯進步,說明 KCNQ2 基因變異患兒的智力運動發育落后不僅與癲癇活動本身有關,還與 KCNQ2 基因變異對神經系統發育的影響有關,為發育性癲癇性腦病。文獻報道,癲癇是 KCNQ2 基因變異患兒最常見的表型,相關癲癇表型譜較廣,包括預后較好的 BFNE、BFNIE、BFIE 及 BNE 或 BIE,以及預后不良的 OS、WS 和其他不能分類的 EIEE[3, 14, 16, 17]。KCNQ2 基因變異還可以導致其他相對少見的表型,如孤獨癥、肌纖維顫搐、運動障礙等,大多伴癲癇發作[18-22]。本研究發現的 KCNQ2 基因變異相關癲癇表型有 BFNE、BFNIE、BFIE、BNE、BIE、OS、WS、不能分類的 EIEE 以及癲癇共患孤獨癥,與文獻報道的表型大致相同。
在同一個 BFNE 家系內攜帶相同 KCNQ2 基因的受累者表型輕重程度可有差異[4, 23, 24]。本研究例 5 來自一個 BFNIE 家系,表型為 EIEE,而其他家系成員的表型均為新生兒或嬰兒期起病的良性癲癇,說明家系內部不同受累者的表型可存在明顯差異,這種表型異質性可能與其他基因對患兒表型的修飾相關。既往文獻報道,在 KCNQ2 基因變異導致的 BFNE 家系存在外顯率不全,攜帶 KCNQ2 基因雜合致病變異者的外顯率約為 77%~85%[2, 25]。本研究例 30 患兒表型為 BIE,該患兒母親攜帶與患兒相同的無義變異 c.1892T>A/p.L631X,無抽搐史,考慮為外顯不全。
少數 EIEE 患兒的 KCNQ2 基因變異可遺傳自表型正常的嵌合體父或母一方,這些變異可以在血、皮膚和毛囊 DNA 中檢測出,變異比例在 5%~30% 之間,攜帶嵌合變異者的神經發育正常,少數可有新生兒期癲癇史[6, 26]。既往文獻尚未報道 KCNQ2 基因片段缺失相關的嵌合變異,本研究首次發現 1 例可疑 KCNQ2 基因片段缺失嵌合體變異。本研究例 11 患兒為 KCNQ2 基因外顯子 8-16 雜合缺失,MLPA 檢測發現其無癥狀的父親可疑為 KCNQ2 基因外顯子 8-16 雜合缺失嵌合體。
文獻報道,大多數 KCNQ2 基因變異導致的 EIEE 患兒在癲癇發病初期可對多種 AEDs 無效,但大多能在出生后 9 個月~4 歲發作緩解[6]。本研究 80.0% 患兒發作已緩解,其中 77.5%(35/40)在出生后 1 月齡~3 歲 6 月齡發作緩解,與文獻報道的緩解年齡大致接近。本研究大部分患兒發作控制時口服 1~2 種 AEDs,說明 KCNQ2 基因變異導致的癲癇相對容易控制。本研究有 8 例發作未控制的患兒的末次隨訪年齡尚小(8 月齡~1 歲 2 月齡),需進一步隨訪患兒的發作緩解年齡。
文獻報道,鈉離子通道阻滯劑卡馬西平、奧卡西平、苯妥英納和拉莫三嗪等對 KCNQ2 基因變異相關癲癇有效率高,但在少數患兒可導致發作加重[10, 15, 27, 28]。本研究中鈉離子通道阻滯劑奧卡西平的患兒最多,有效率高達 90%,與文獻報道一致。因此,建議攜帶 KCNQ2 基因變異的患兒應該首選鈉離子通道阻滯劑,尤其是奧卡西平。文獻報道,個別有痙攣發作的 KCNQ2 基因變異患兒使用卡馬西平治療有效[10]。本研究部分有痙攣發作的患兒使用奧卡西平后發作減少,說明有痙攣發作的 KCNQ2 基因患兒也可嘗試用奧卡西平進行治療。本研究 5% 的患兒在使用奧卡西平后出現發作加重,因此如果選用奧卡西平治療應注意密切隨診治。本研究中有患兒曾使用丙戊酸鈉、左乙拉西坦、托吡酯和苯巴比妥,其中丙戊酸鈉有效率 70%,是一種藥物中有效率最高者,且無患兒用藥后出現不良反應。文獻報道,鉀離子通道開放劑(如瑞替加濱和依佐加濱)能減少 KCNQ2 基因變異癲癇患者的發作,并能改善智力運動發育[13]。本研究 40 例患兒均未曾使用鉀離子通道開放劑。
3.3 KCNQ2 基因變異的基因型與表型的相關性
本研究發現,在攜帶 KCNQ2 基因點變異的患兒中,智力運動發育正常患兒攜帶的變異均位于跨膜區外,而位于跨膜區 S4、S5、S6 和 P 環區的變異導致的表型均伴智力運動發育落后,說明位于 S4、S5、S6 和 P 環區的變異常導致預后不良表型。文獻報道,KCNQ2 基因無義變異、移碼變異和剪切位點變異大多導致單倍體劑量不足,因此,攜帶這些類型變異的患兒的表型大多為預后較好的表型如 BFNE,而幾乎所有導致 EIEE 的變異都為錯義變異[29, 30]。本研究中有 29 例患兒攜帶 KCNQ2 基因錯義變異,其中 79.3%(23/29)智力運動發育落后,說明 KCNQ2 基因錯義變異常導致發育落后表型,與文獻報道一致。本研究有 4 例攜帶 KCNQ2 基因無義變異的患兒的末次隨訪年齡仍較小,但與同齡兒相比,智力運動發育大致正常,與文獻報道一致。本研究中有 2 例(例 17、例 18)患兒攜帶 KCNQ2 基因移碼變異,末次隨訪年齡均為 3 歲,均伴智力運動發育落后,與文獻報道不同。2 例患兒分別攜帶的 KCNQ2 基因變異 c.1778_1779 delTG/p.V593GfsX271 和 c.2032 dupG/p.E678GfsX187,這兩個變異均位于蛋白質 C 端,雖然均導致了移碼,但是翻譯合成的氨基酸鏈長度與正常的蛋白非常接近,推測這兩個移碼變異并非導致單倍體劑量不足,而是對鉀離子通道產生了更嚴重的影響。
4 結語
KCNQ2 基因變異以錯義變異為主,新生變異更常見。KCNQ2 基因變異導致的癲癇多在新生兒期起病,以局灶性發作為主,大多發作具有叢集性的特點;少數患兒 EEG 可出現 ESES 現象。KCNQ2 基因變異導致的癲癇表型譜廣。KCNQ2 基因片段缺失和無義變異常導致良性預后的癲癇表型。KCNQ2 基因遺傳性變異常導致良性家族性癲癇,而新生變異大多導致癲癇性腦病,其中約半數有額顳葉和胼胝體發育不良。鈉離子通道阻滯劑是治療 KCNQ2 基因變異相關癲癇的有效藥物。