引用本文: 張銀超, 劉源, 沈偉, 田志強, 朱雁飛, 吳登峰, 時立平, 陶國青. 腹腔鏡疝修補術后患者復發疝氣的預測模型構建與驗證:一項8年的回顧性研究. 中國循證醫學雜志, 2023, 23(7): 760-770. doi: 10.7507/1672-2531.202303137 復制
腹股溝疝是腹壁外科中常見的一類疾病,可嚴重影響患者生活質量[1]。傳統的疝修補術是治療腹股溝疝的主要治療手段,但恢復時間較長、復發率高。腹腔鏡手術具有手術創傷小、恢復快、感染率低等優點,目前已成為腹股溝疝的主要手術方式。但部分患者仍可能出現復發,這不僅增加了患者的住院時間,還加重額外的醫療負擔[2]。更重要的是,這些患者還需要承受二次手術的風險。因此,準確預測腹腔鏡疝修補術后的疝復發情況,識別高危患者,從而盡可能降低術后復發,顯得尤為重要。
一般情況下,外科醫生通常根據其臨床經驗對疝復發風險進行評估,但常無法準確預測術后復發和識別相關影響因素。部分研究者嘗試使用參數回歸方法來預測疾病。例如Song等[3]的研究納入了795例患者,結果表明性別與術后感染是疝氣發生與復發的高危因素。郭燕等[4]的研究表示年齡、內環口的大小及縫線的類型與疝氣復發關系密切。但回歸模型在處理復雜臨床特征變量之間的關系時有一定局限性。而且如果研究納入的變量較少,則回歸模型的預測結果可能有較大差異。近年來,人工智能在醫療領域發展迅速,機器學習作為其重要的分支,具有更穩定的模型建立、更準確的預測結果等優勢,已被廣泛應用于臨床預測等方面[5-6]。本次研究通過分析腹股溝疝患者術前和術后的臨床特征,借助機器學習算法建立腹腔鏡疝修補術后疝復發的預測模型,在不使用常規影像學檢查的情況下識別復發疝的高危因素,幫助臨床醫生為患者制定準確的個體化診療方案提供參考。
1 對象與方法
1.1 研究對象
本研究使用的患者數據來自于南京醫科大學附屬無錫人民醫院的臨床數據庫。病例納入標準:① 18~80歲的腹股溝疝患者;② 患者行腹腔鏡輔助腹股溝疝修補術;③ 手術團隊由具有獨立開展腹股溝疝修補術資質的高年資醫生組成。病例排除標準:① 嵌頓疝、絞窄疝等危及生命的急腹癥;② 巨大腹股溝疝;③ 腹腔鏡手術中轉開放手術;④ 因腹腔嚴重粘連無法開展腹腔鏡手術;⑤ 合并有嚴重的心血管疾病或呼吸系統疾病;⑥ 患者基本信息缺失、臨床數據缺失或失訪的患者。研究中所有患者術后隨訪至少5年。此研究經無錫市人民醫院倫理委員會審批(審批號:KY22085)。
患者臨床數據包括29項術前變量(手術日24 h內)、術中變量以及術后變量(手術后48 h內)。術前變量包括患者的人口統計學特征(性別、年齡、吸煙史、酗酒史及BMI)、基本臨床特征(ASA評分、NRS2002評分及手術史)、基本病史(貧血、腸梗阻、糖尿病、高血壓、慢性阻塞性肺疾病、高脂血癥以及冠心病)、實驗室檢查指標(白蛋白)。術中變量包括手術類型、補片大小、補片固定情況、手術時間、術中出血量、術中輸血情況、術中SpO2情況、術中體溫情況、患者術中是否發生心動過速、手術是否為急診手術。術后變量包括實驗室檢查指標(PCT、CRP以及SAA)。本次研究的結局變量為術后疝氣復發風險。
1.2 復發疝的相關定義與診斷
復發疝定義為患者在手術修補后,疝囊再次突出[7]。復發疝的診斷標準為:① 患者術后出現腹股溝或腹部突起或疼痛等癥狀;② 患者咳嗽時出現突出部位增大以及患者癥狀加重;③ 經腹部超聲、CT等影像學檢查后確診為復發疝。
1.3 機器學習算法預測模型的建立與評價
應用SPSS軟件和R軟件進行臨床預測模型的構建與評價。① 數據預處理。選取2010年1月至2015年12月的腹股溝疝患者作為模型建立集,選取2016年1月至2018年1月的腹股溝疝患者作為模型獨立驗證集。將模型建立集隨機分為訓練集(70%)與測試集(30%)。② 對模型建立集進行單因素、多因素分析。兩組差異比較,對分類變量采用卡方檢驗;對符合正態分布的連續性變量采用t檢驗;對不符合正態分布的連續性變量采用秩和檢驗。檢驗水準設為α=0.05。對單因素分析中有統計學意義的變量進行Logistic回歸分析,得到術后疝復發的獨立影響因素。使用梯度提升機(extreme gradient boosting,XGBoost)、隨機森林(random forest,RF)、支持向量機(support vector machine,SVM)以及K最臨近(k-nearest neighbor algorithm,KNN)4種機器學習模型對所有變量的重要性進行評分并依據影響因素權重進行排序。篩選出在4種模型排序中均排名前十位且在單因素、多因素分析中有統計學意義的變量。③ 建立預測模型并評價不同預測模型性能。將篩選的特征變量納入SVM、RF、XGBoost及KNN四種機器學習算法預測模型中。我們根據算法的原理,使用迭代的方法對模型的參數進行不斷改變并觀察模型結果,找出最優結果所對應的模型參數。由于k折交叉驗證易于實現,并且相比于其他方法其具有更低偏差的評估能力,因此它通常用于比較和選擇不同的模型算法。我們通過網格搜索調整超參數,并用重采樣方法(k=10)對模型建立集進行了k-折交叉驗證。k-折交叉驗證的實施如下:將原始數據集分成10組并選擇1個組作為測試數據集,并且選擇其余組作為訓練數據集。訓練數據集用于擬合模型并調整模型參數,測試數據集用于評估系統的性能。重復以上步驟,直到每個組都被測試。保留AUC、準確率、敏感度以及特異度等模型評估指標并對預測中的k輪適應度求平均,以獲得模型預測性能的最準確估計。通過區分度、校準度、臨床實用性3個方面來評價并選擇最佳預測模型:繪制ROC曲線,獲取AUC值,判定模型的預測效能;繪制校正曲線,評估模型預測結果與實際結果之間是否具有較好的一致性;繪制決策曲線分析(decision curve analysis, DCA),評估患者行干預性治療后的獲益情況。④ 采用模型獨立建立集對最佳模型進行驗證,繪制ROC曲線圖來判定模型的通用性與預測效能。⑤ 模型解釋。通過SHAP分析得到樣本中每個特征對預測的貢獻值,即Shapley值。根據Shapley值構建SHAP摘要圖以及單樣本SHAP解釋力圖。SHAP摘要圖對風險因素進行重要性排序,單樣本SHAP解釋力圖對單個樣本的預測結果進行分析解釋。
2 結果
2.1 患者的基本特征
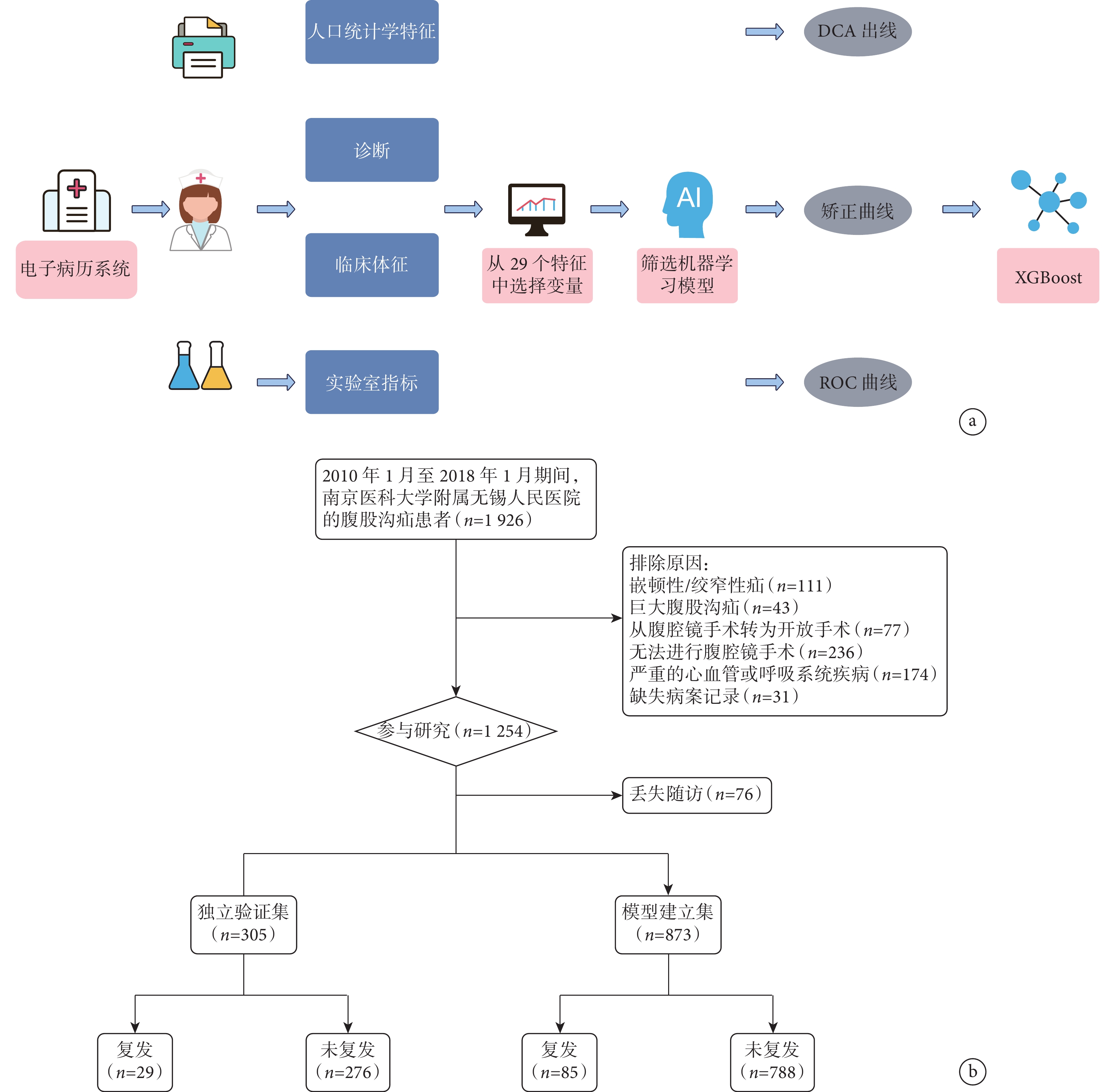
共納入1 178例腹股溝疝患者,其中114例(9.68%)出現術后復發。患者的基本特征見表1。研究設計和患者納入流程圖見圖1。
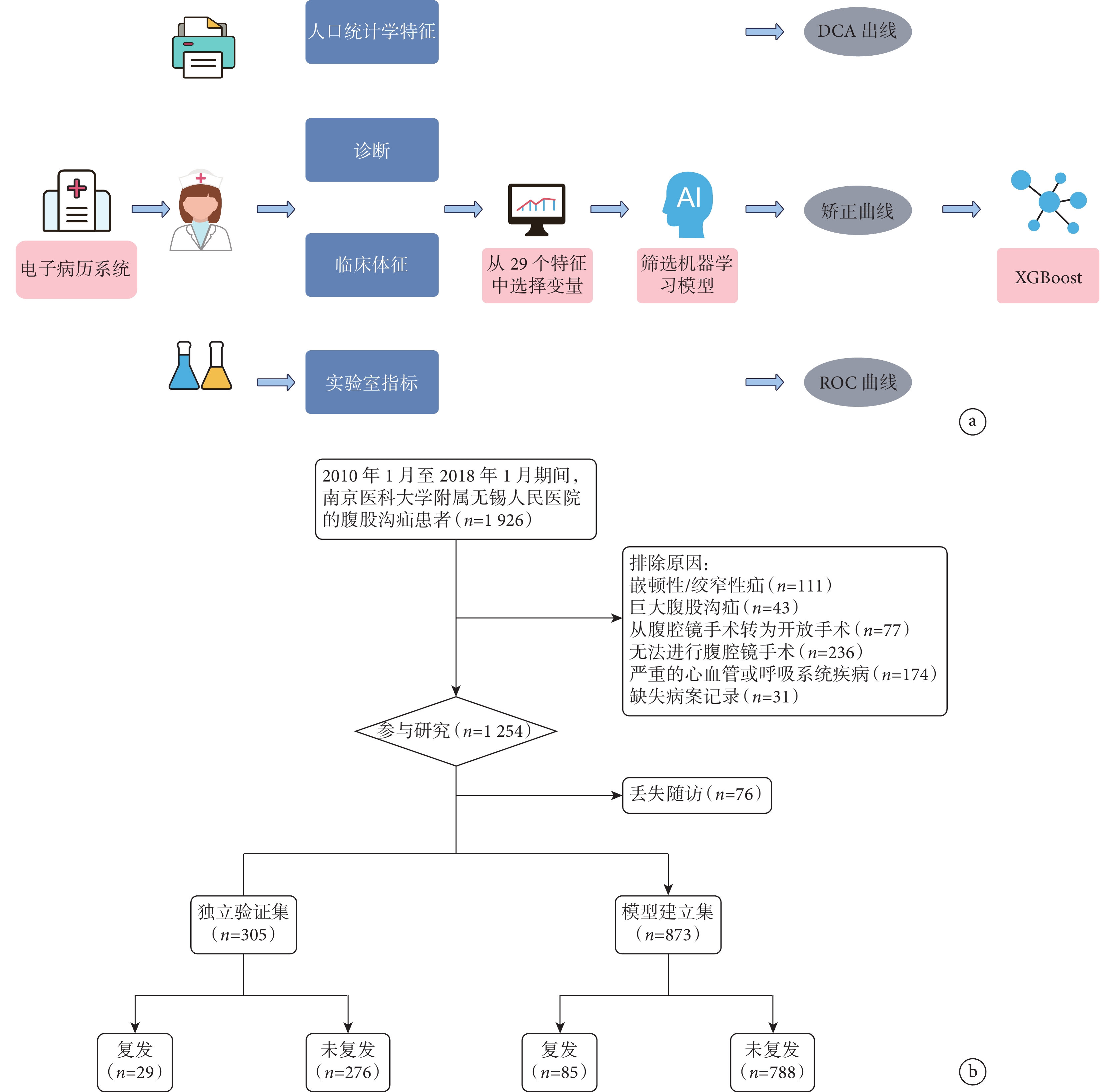 圖1
研究流程圖
圖1
研究流程圖
a:研究設計流程圖;b:患者篩選流程圖。
2.2 術后疝復發的危險因素篩選
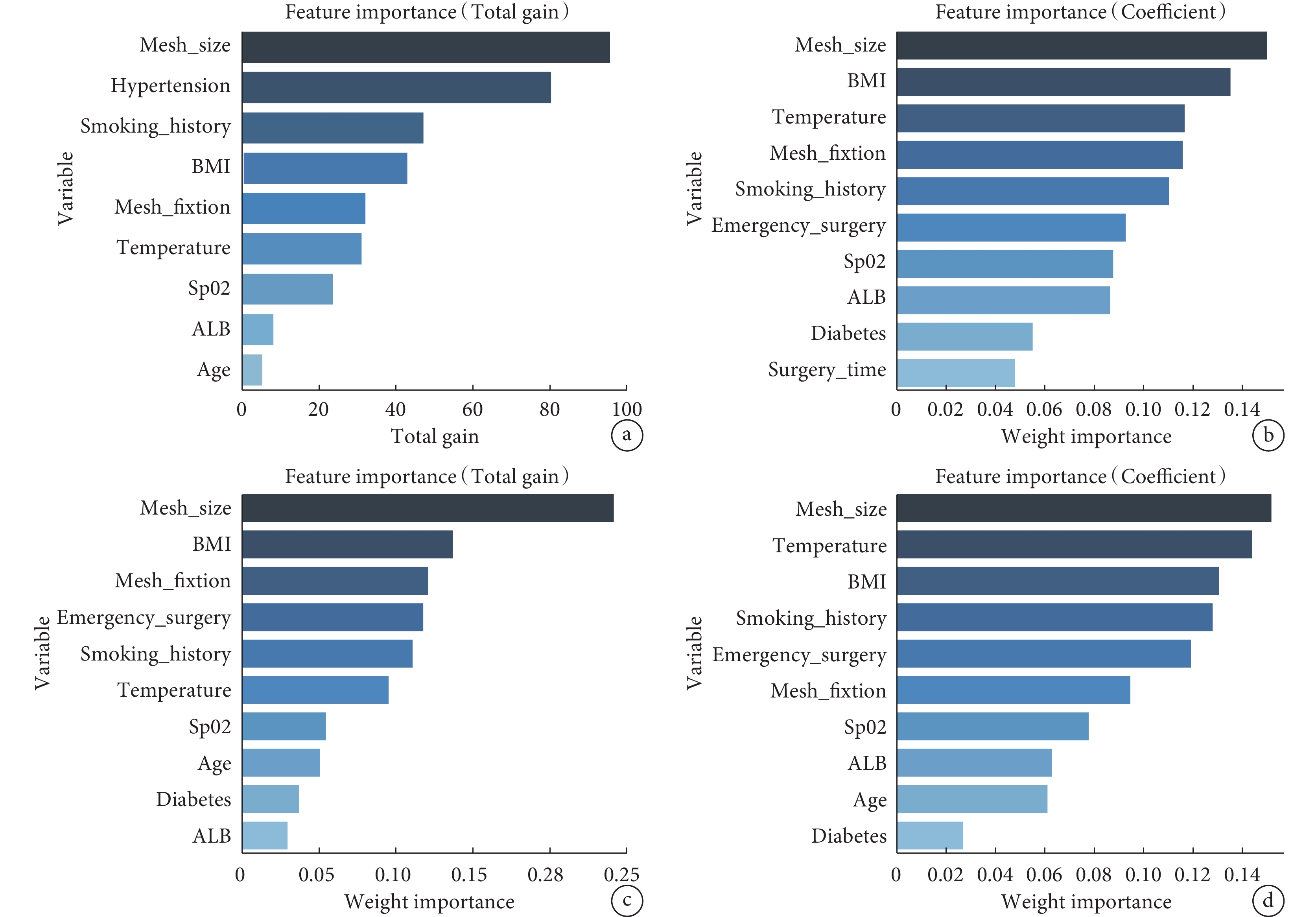
單因素分析、多因素分析結果表明,BMI、吸煙史、低蛋白血癥、腸梗阻病史、糖尿病史、高血壓病史、補片尺寸、補片不固定、急診手術、術中輸血、術中體溫低以及術中SpO2低是疝復發的獨立影響因素(P<0.05)(表2)。XGBoost、RF、SVM及KNN算法篩選出影響術后疝復發的危險因素包括補片尺寸、補片不固定、糖尿病史、低蛋白血癥、BMI、吸煙史、術中SpO2以及術中體溫低(圖2)。綜合分析后,納入本次預測模型的危險因素包括補片尺寸、補片的固定情況、糖尿病、低蛋白血癥、BMI、吸煙史、術中SpO2以及術中體溫低。
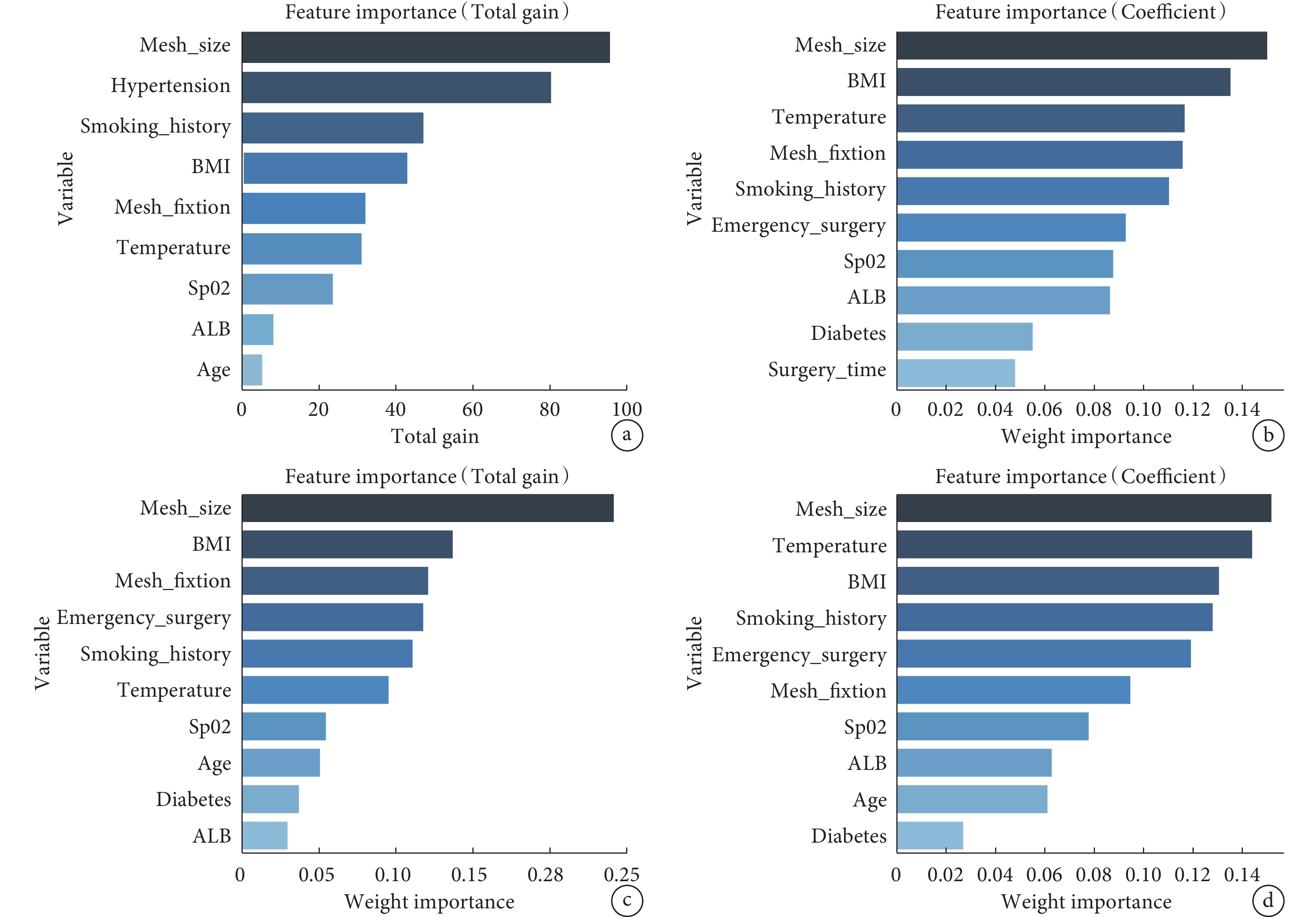 圖2
4個機器學習模型的影響因素排名圖
圖2
4個機器學習模型的影響因素排名圖
a:XGBoost模型的變量重要性排序圖;b:RF模型的變量重要性排名圖;c:SVM模型的變量重要性排序圖;d:KNN模型的變量重要性排序圖。
2.3 模型建立與評價
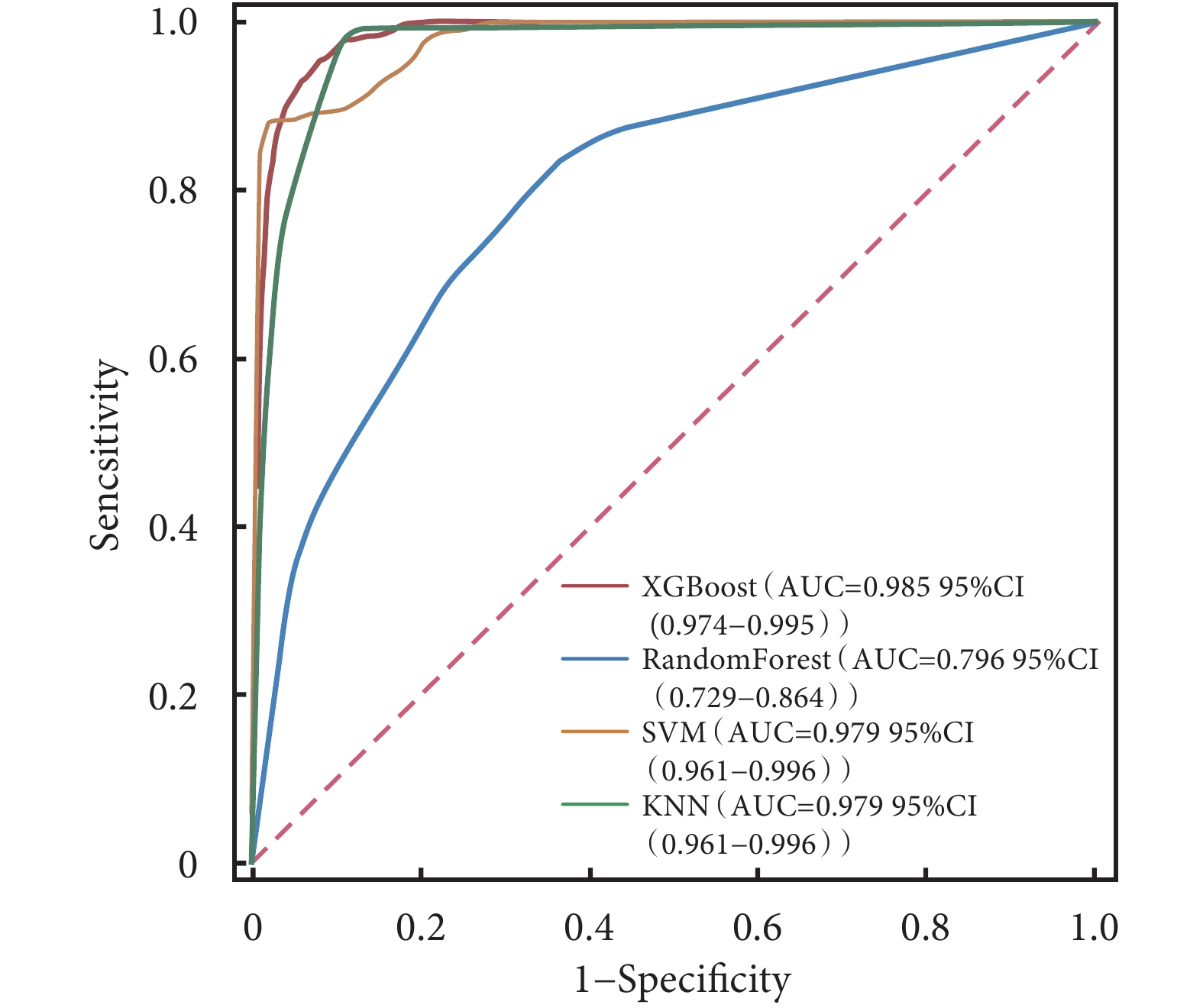
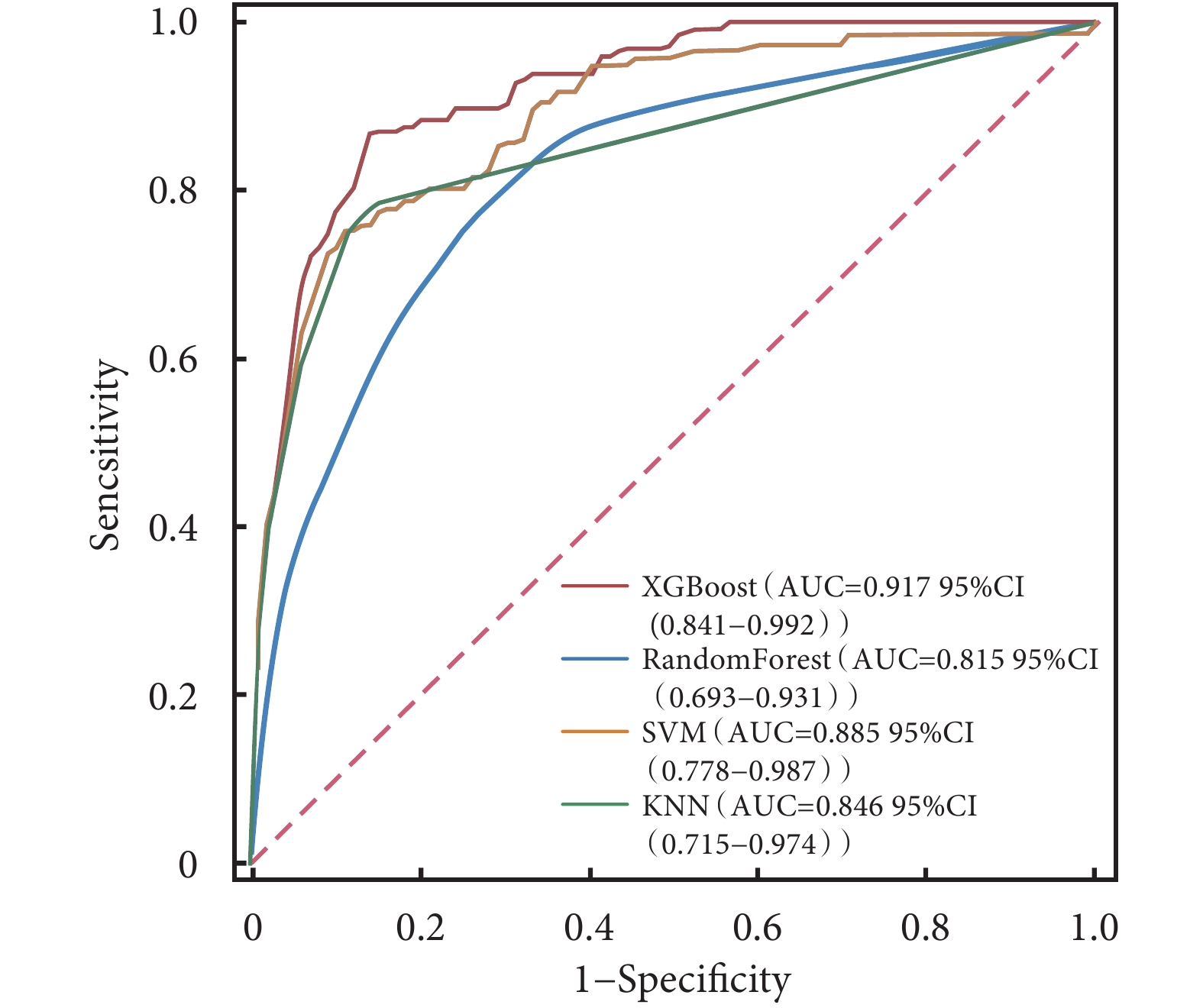
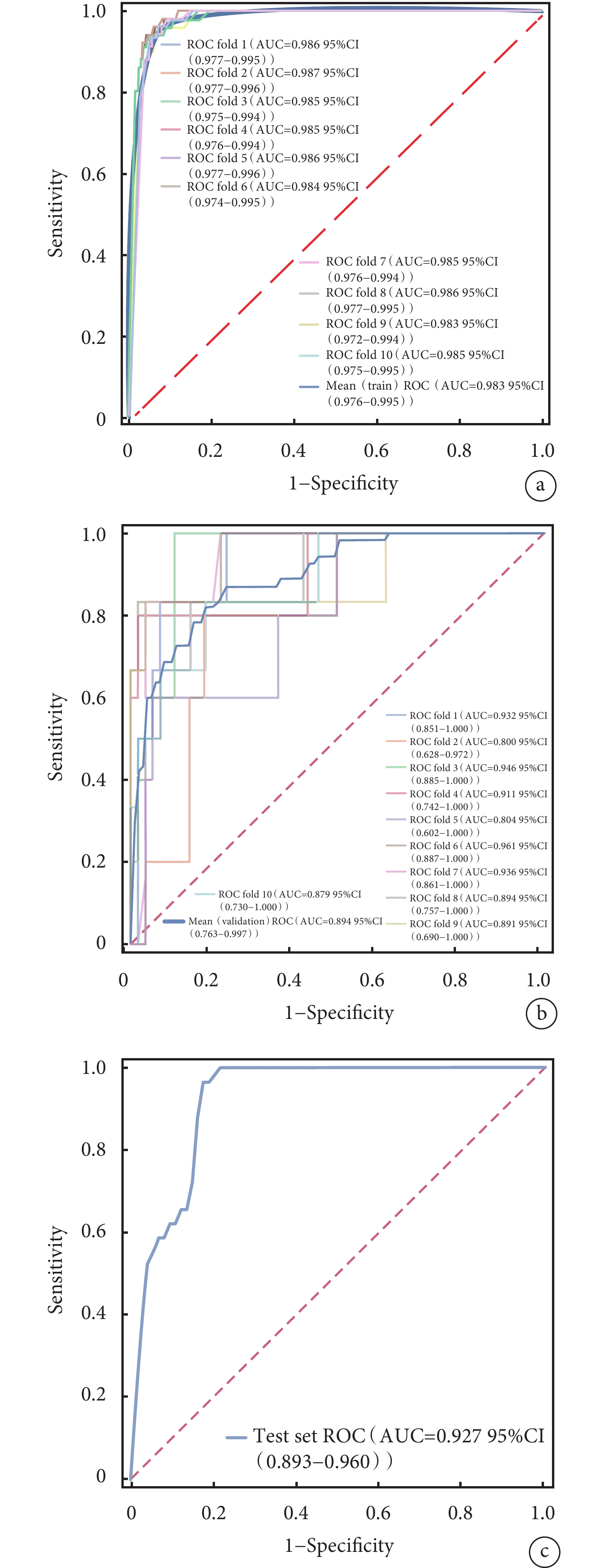
ROC曲線結果顯示,XGBoost在訓練集中的AUC值高達0.985;在驗證集中的AUC值為0.917,在4種模型中表現最好(表3)。4種模型的校正曲線與理想曲線相近,模型的預測結果與實際結果之間具有較高的一致性。DCA曲線顯示4種模型都實現了相對于全部治療或無治療計劃的凈臨床獲益(圖3~圖6)。采用k-折交叉驗證法比較4種模型的泛化能力。將30.01%的樣本(n=262)作為測試集,剩余樣本作為訓練集進行10折交叉驗證:① XGBoost驗證集的AUC=0.895±0.053,測試集的AUC=0.927,準確度=0.897(圖7);② RF驗證集的AUC=0.775±0.104,測試集的AUC=0.868,準確度=0.912;③ SVM驗證集的AUC=0.882±0.057,測試集的AUC=0.873,準確度=0.878;④ KNN驗證集的AUC=0.869±0.095,測試集的AUC=0.866,準確度=0.908。綜合比較后,認為XGBoost算法構建的模型為最佳預測模型。
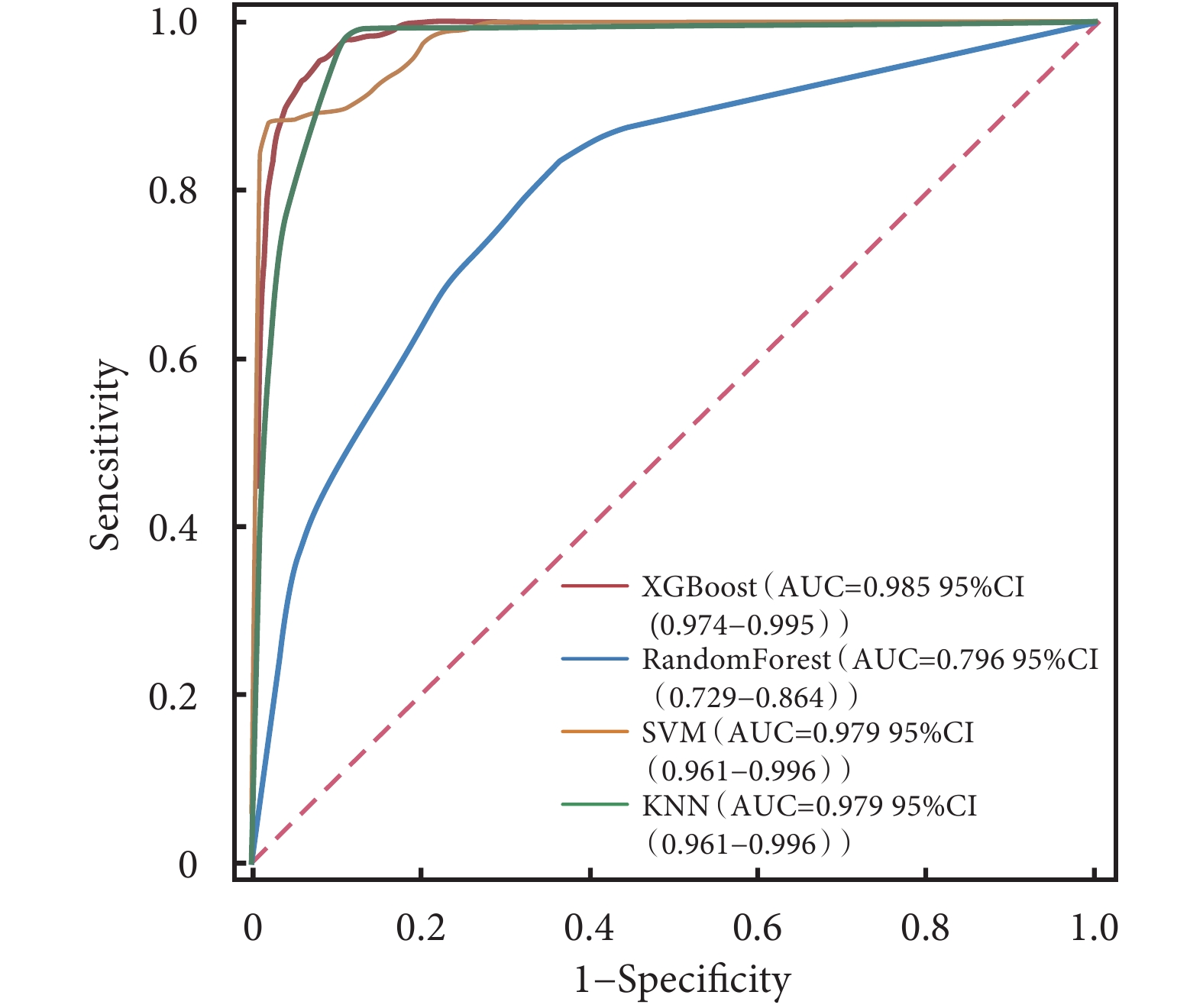 圖3
4種模型訓練集的ROC曲線
圖3
4種模型訓練集的ROC曲線
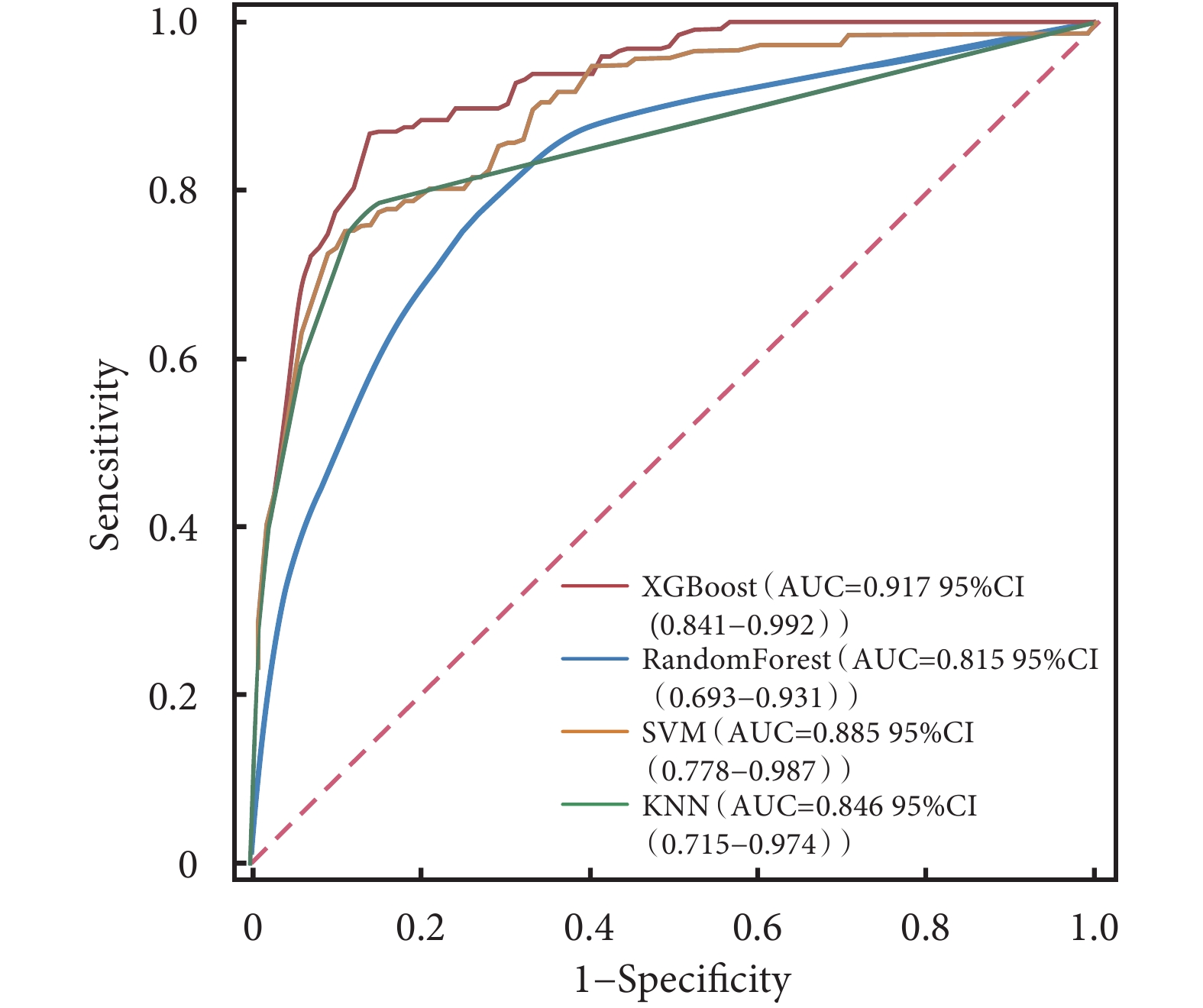 圖4
4種模型驗證集的ROC曲線
圖4
4種模型驗證集的ROC曲線
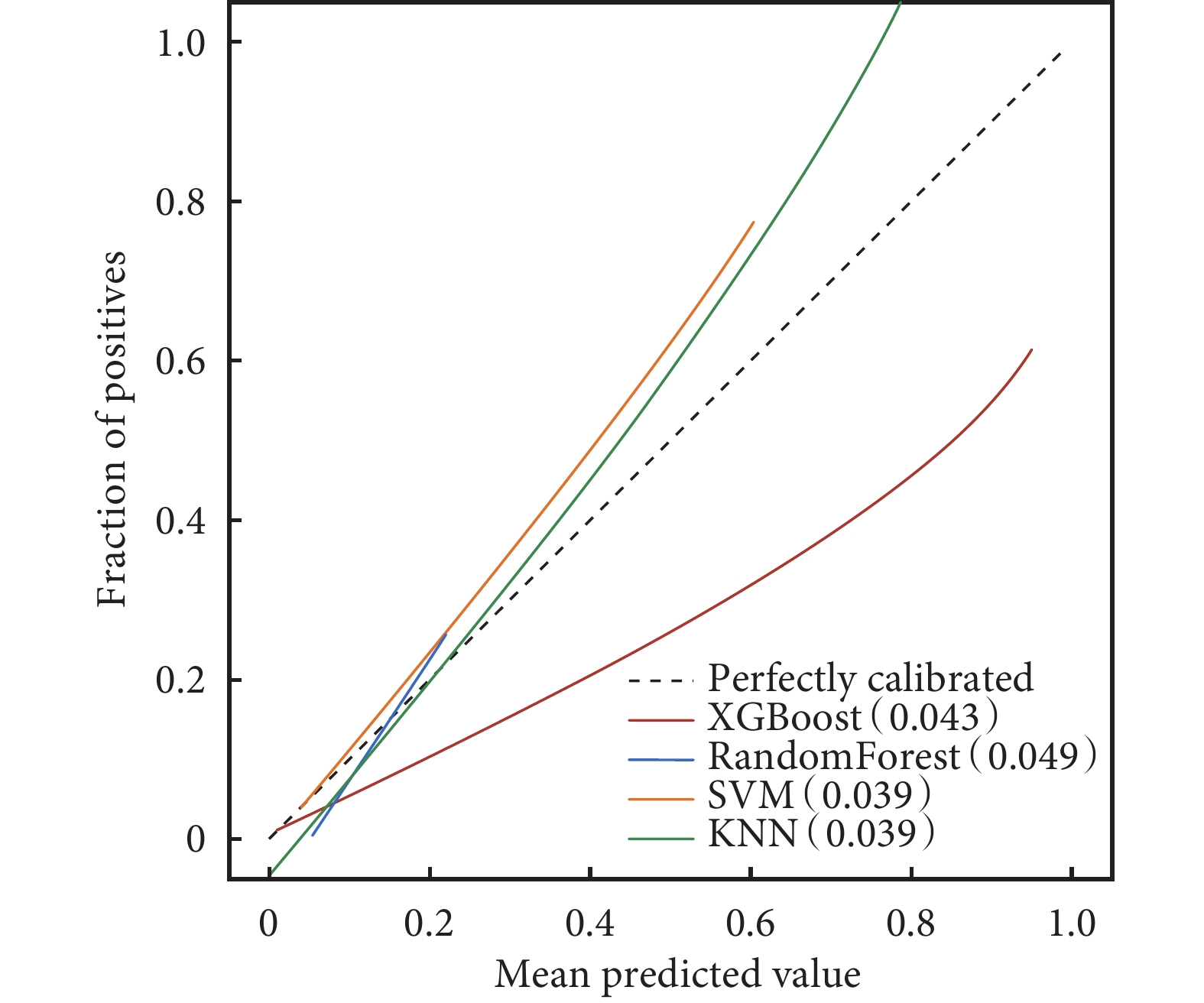 圖5
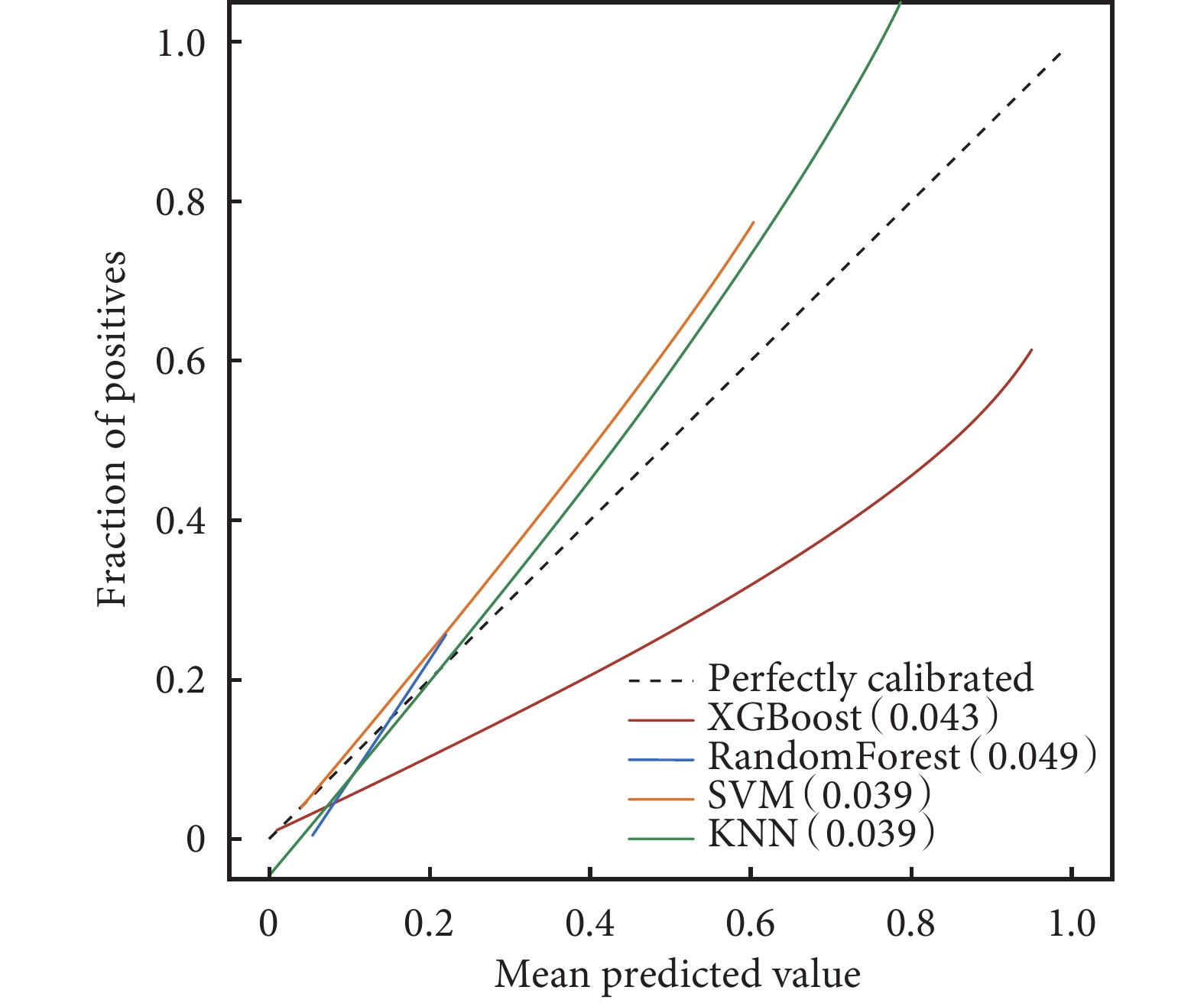
4種模型的校準圖
圖5
4種模型的校準圖
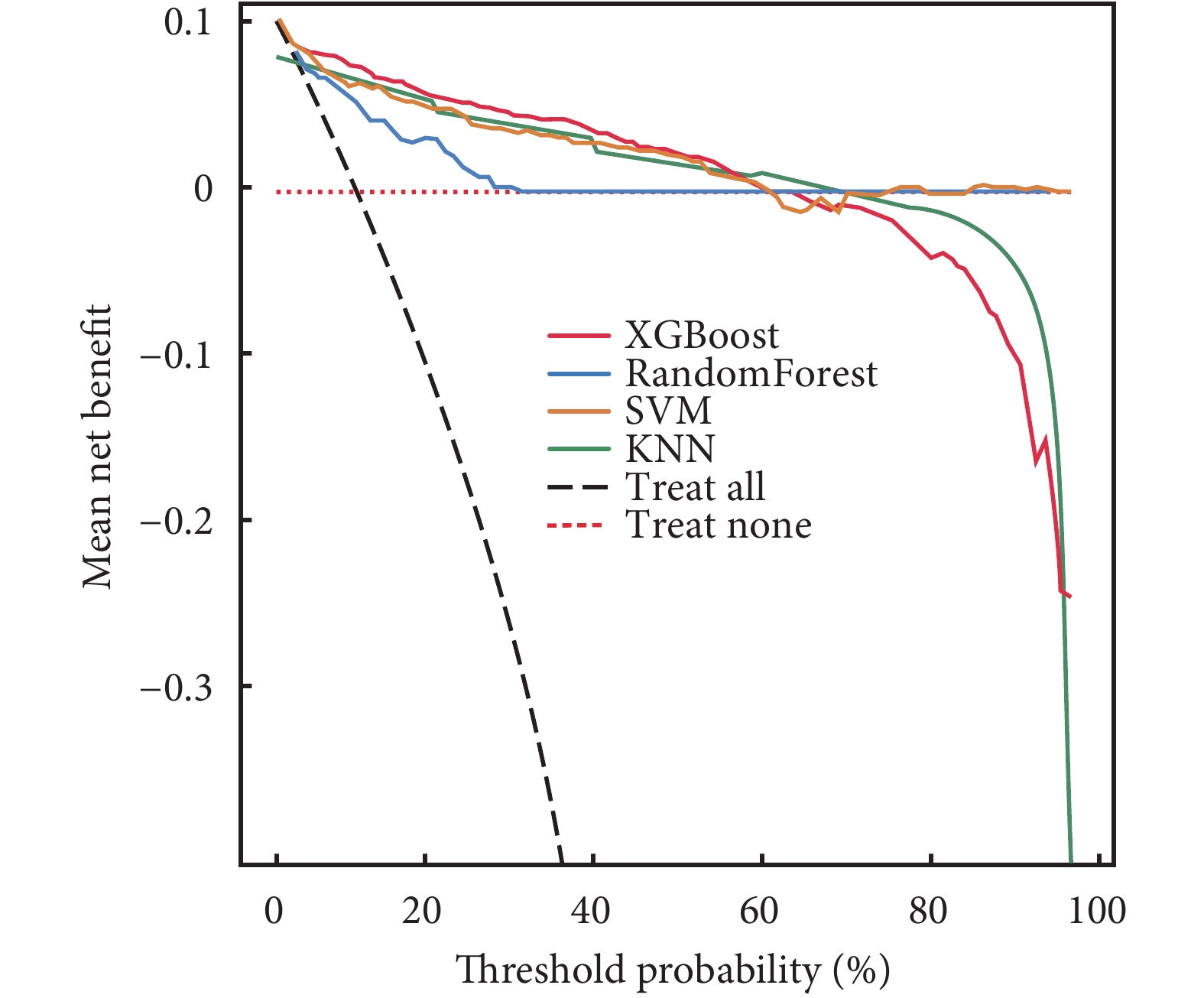 圖6
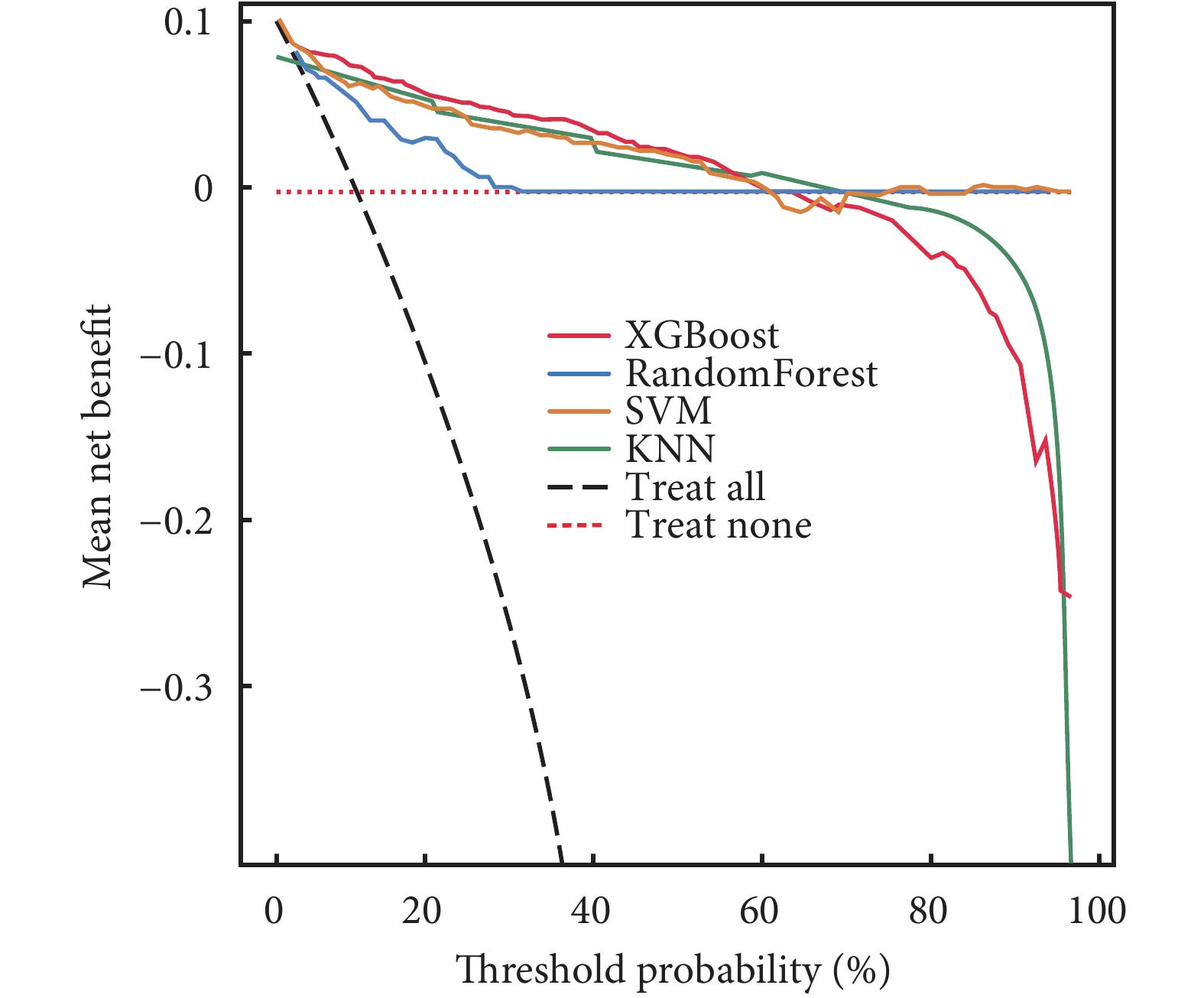
4種模型的DCA曲線
圖6
4種模型的DCA曲線
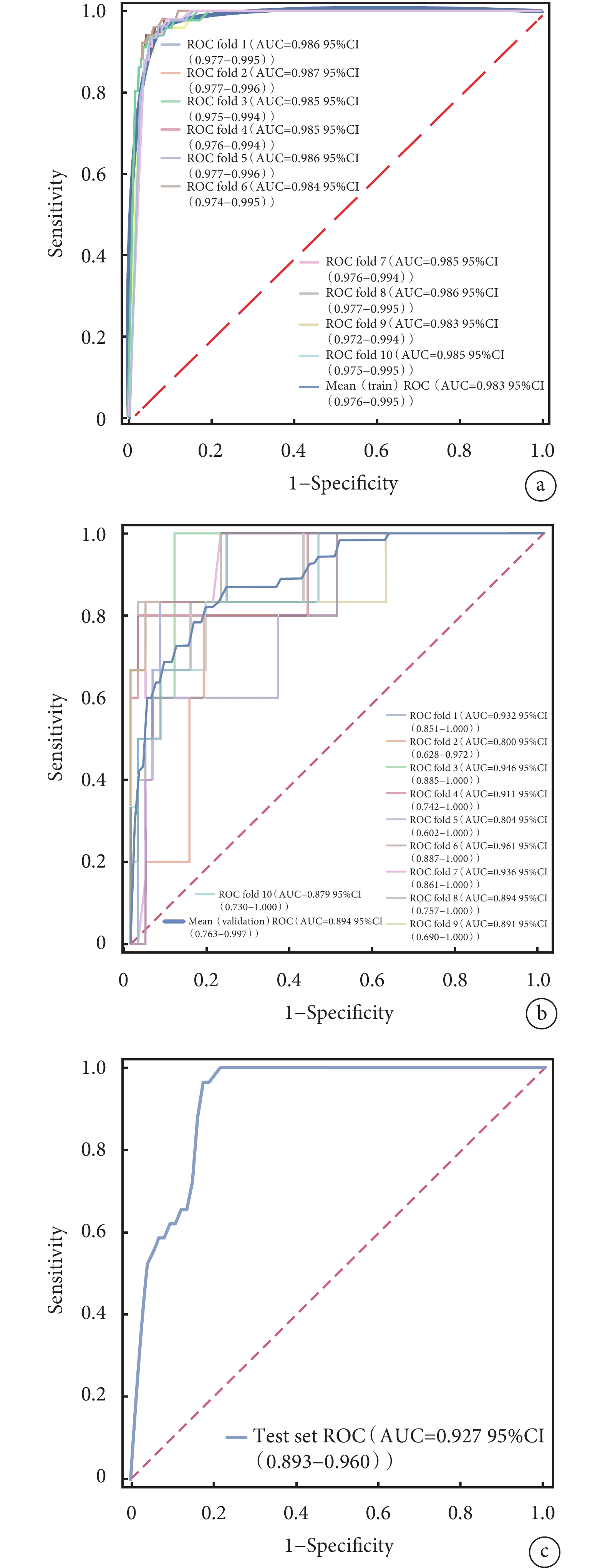 圖7
XGBoos模型的k-折交叉驗證結果
圖7
XGBoos模型的k-折交叉驗證結果
a:XGBoost模型訓練集的ROC曲線;b:XGBoost模型驗證集的ROC曲線;c:XGBoost模型測試集的ROC曲線。
2.4 獨立驗證集模型評估
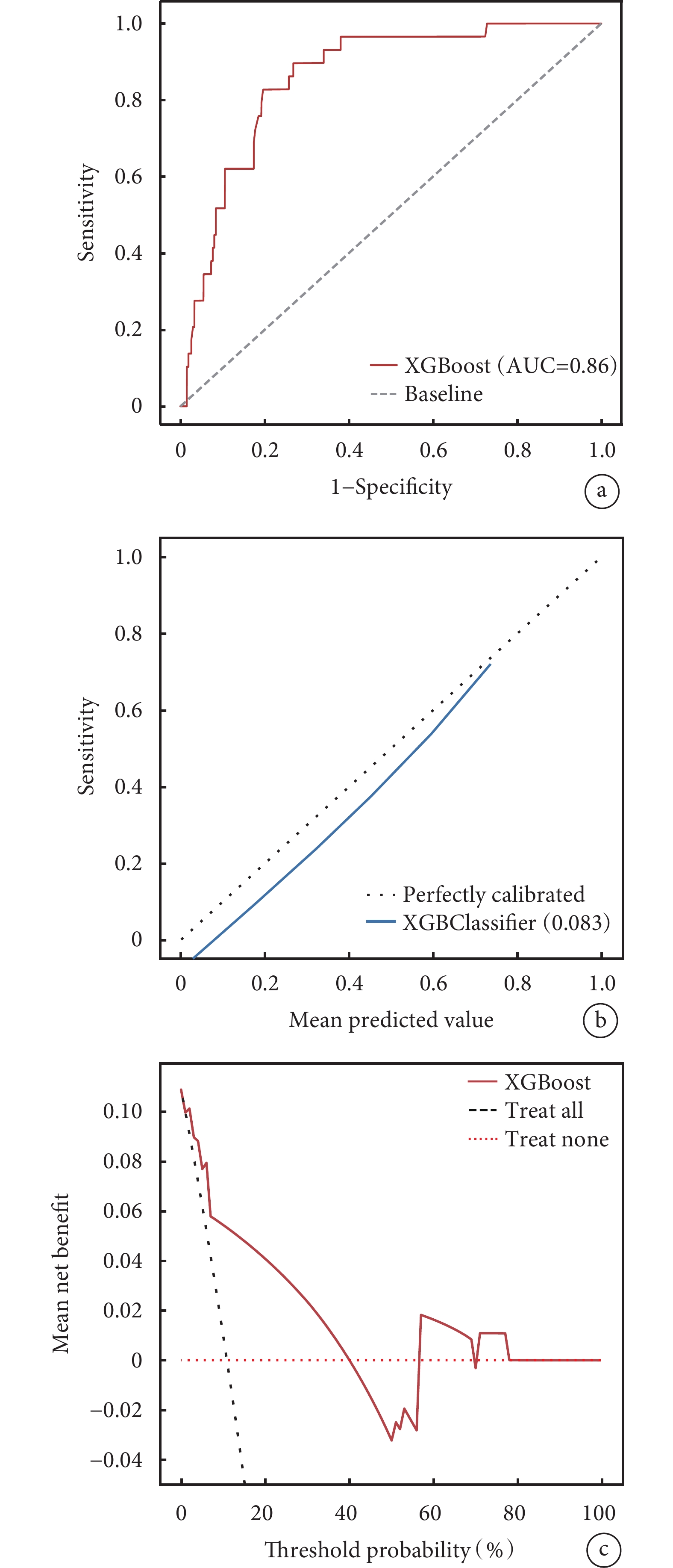
ROC曲線結果顯示,獨立驗證集AUC值為0.860,說明該預測模型對判斷疾病準確度很高。模型校正曲線與理想曲線相近,DCA曲線顯示模型實現了凈臨床獲益(圖8)。
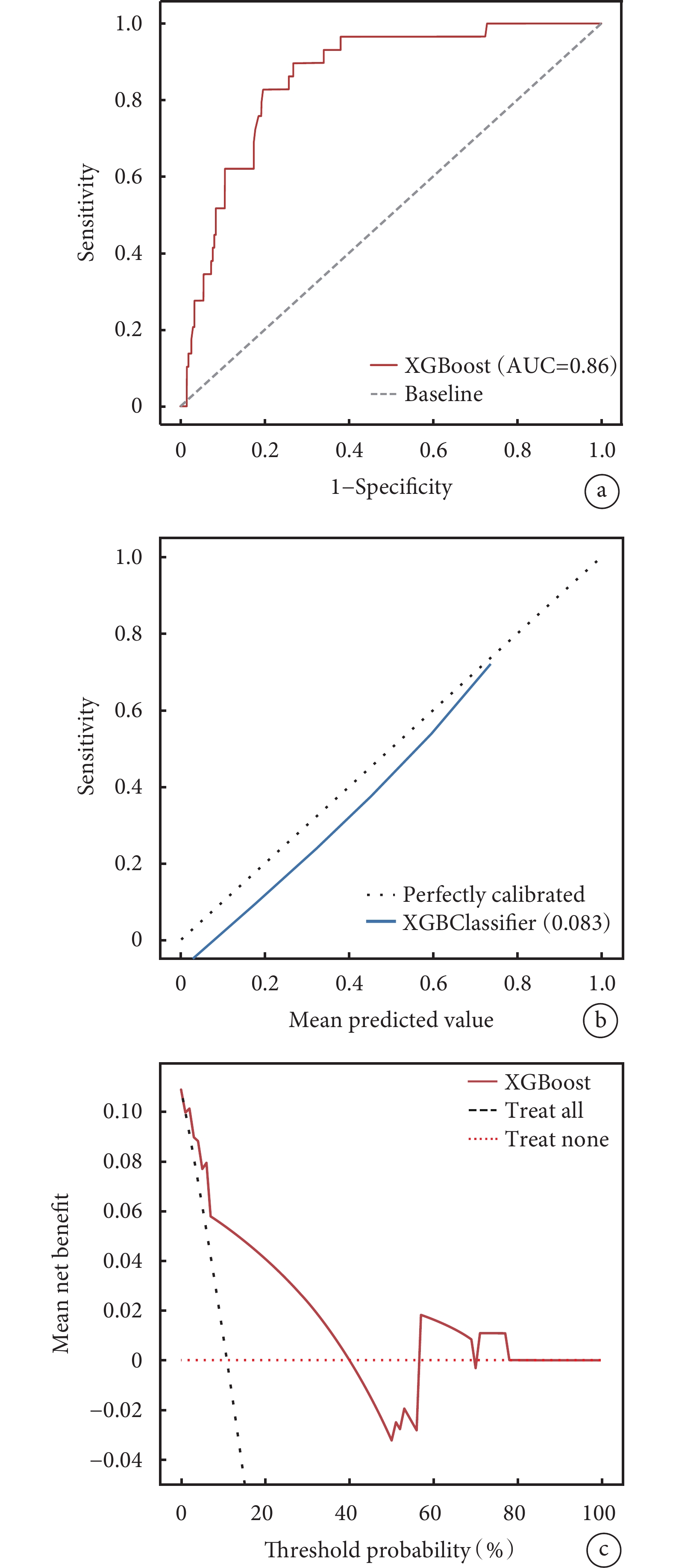 圖8
XGBoost模型獨立驗證集評價
圖8
XGBoost模型獨立驗證集評價
a:XGBoost模型獨立驗證集的ROC曲線;b:XGBoost模型獨立驗證集的校正曲線;c:XGBoost模型獨立驗證集的DCA曲線。
2.5 模型解釋
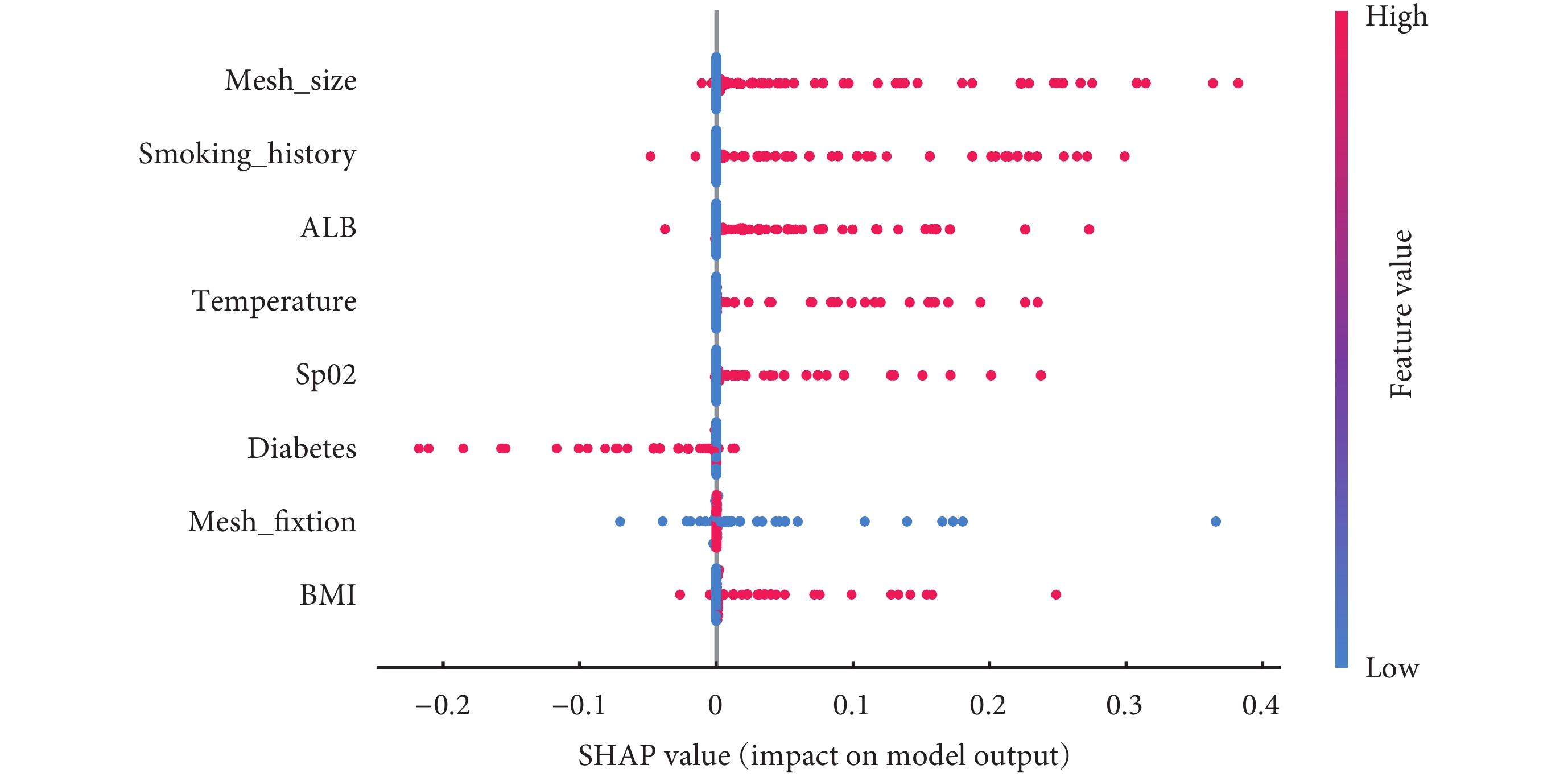
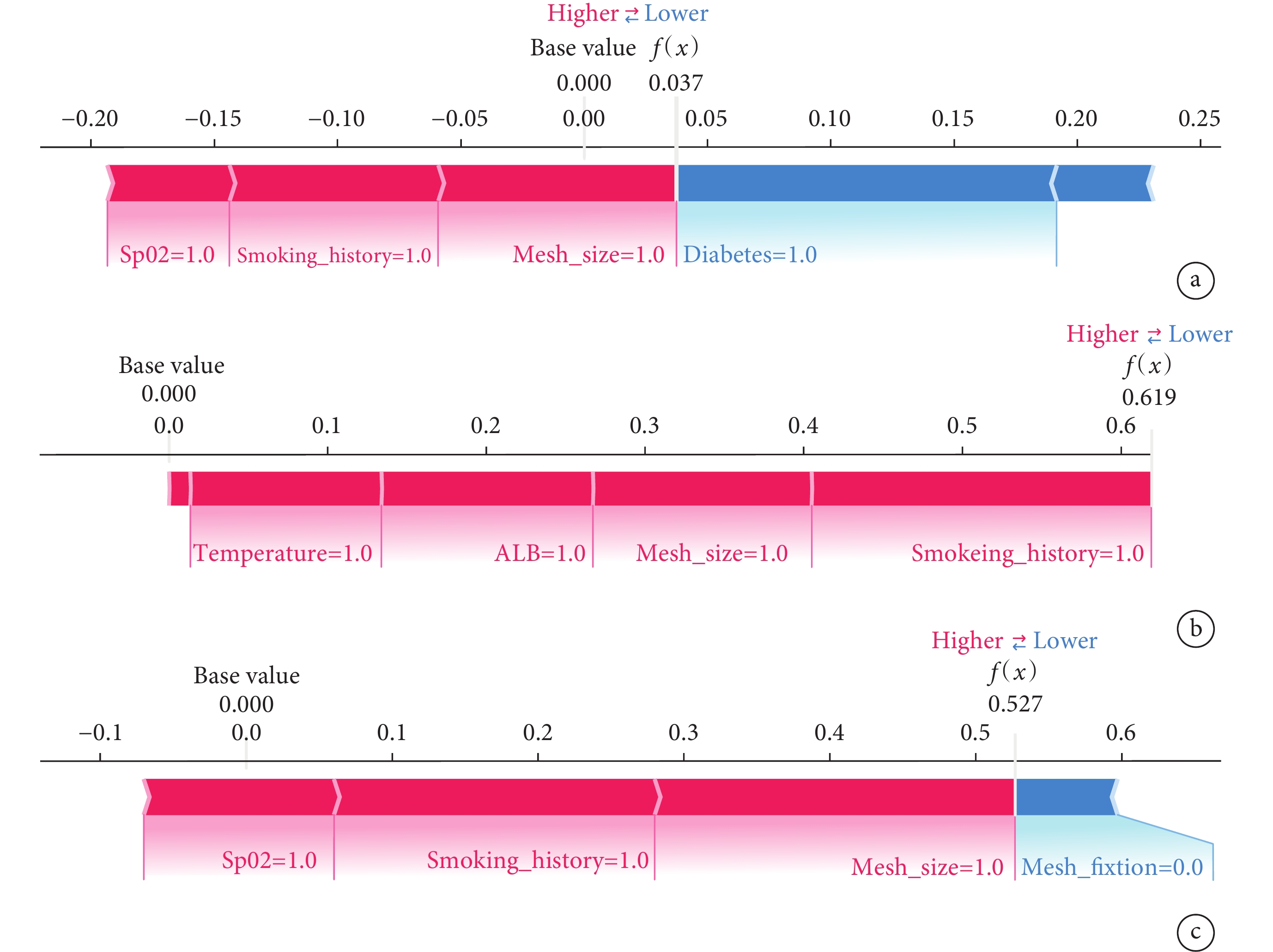
SHAP摘要圖結果顯示,腹股溝疝修補術后復發的危險因素排序為補片<10 cm、吸煙史、低蛋白血癥、術中體溫<36℃、術中SpO2<90%、糖尿病史、補片不固定、BMI≥25 kg/m2(圖9)。SHAP力圖顯示了研究模型對3個疝復發患者的預測分析。模型預測患者一的復發概率為0.037,且增加其復發概率的特征是術中SpO2<90%、吸煙史以及補片<10 cm;模型預測患者二的復發概率為0.619,且增加其復發概率的特征是術中體溫<36℃、低蛋白血癥、補片<10 cm以及吸煙史;模型預測患者三的復發概率為0.527,且增加其復發概率的特征是術中SpO2<90%、吸煙史以及補片<10 cm,降低其復發概率的特征是補片固定(圖10)。
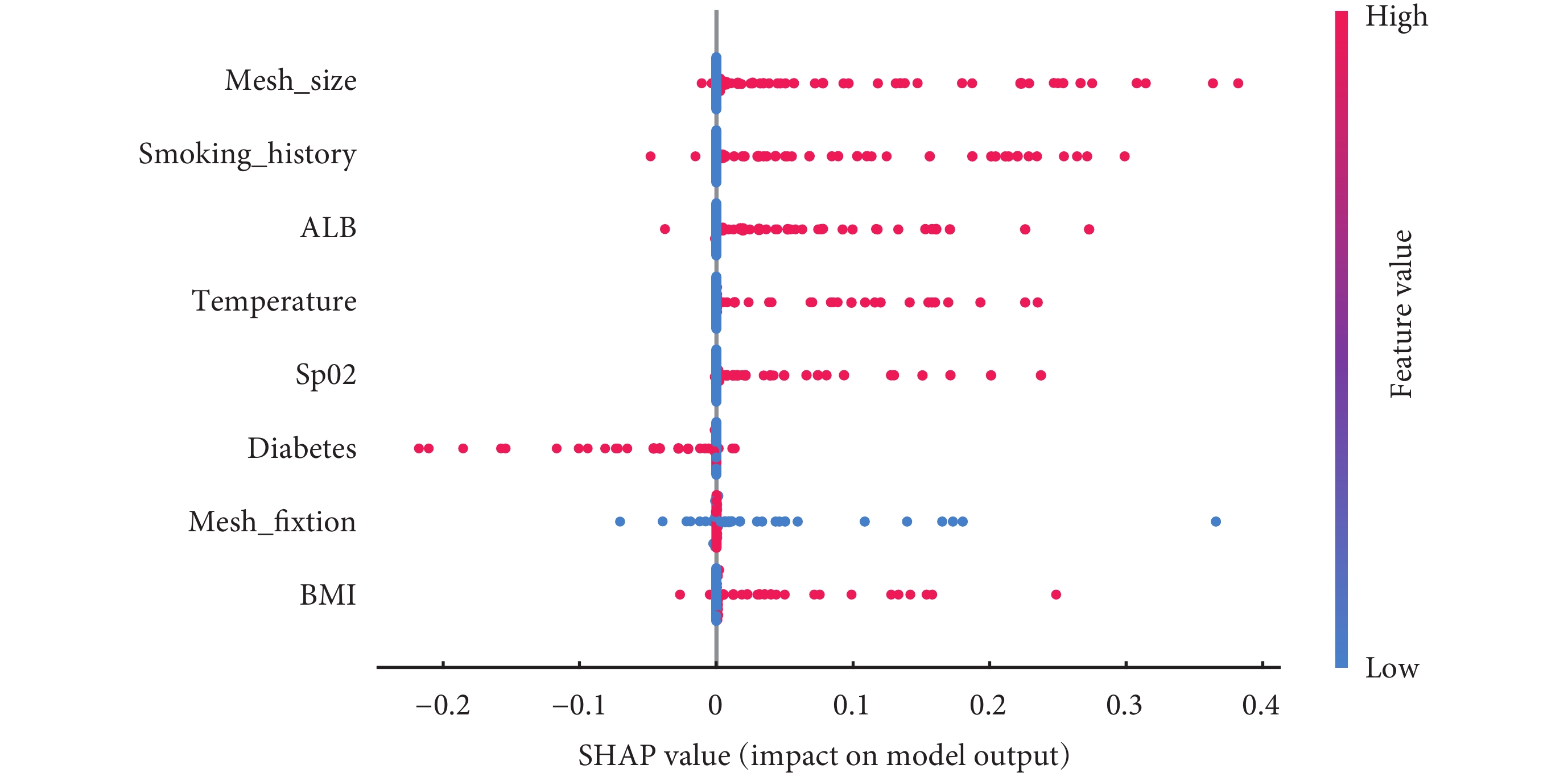 圖9
SHAP摘要圖
圖9
SHAP摘要圖
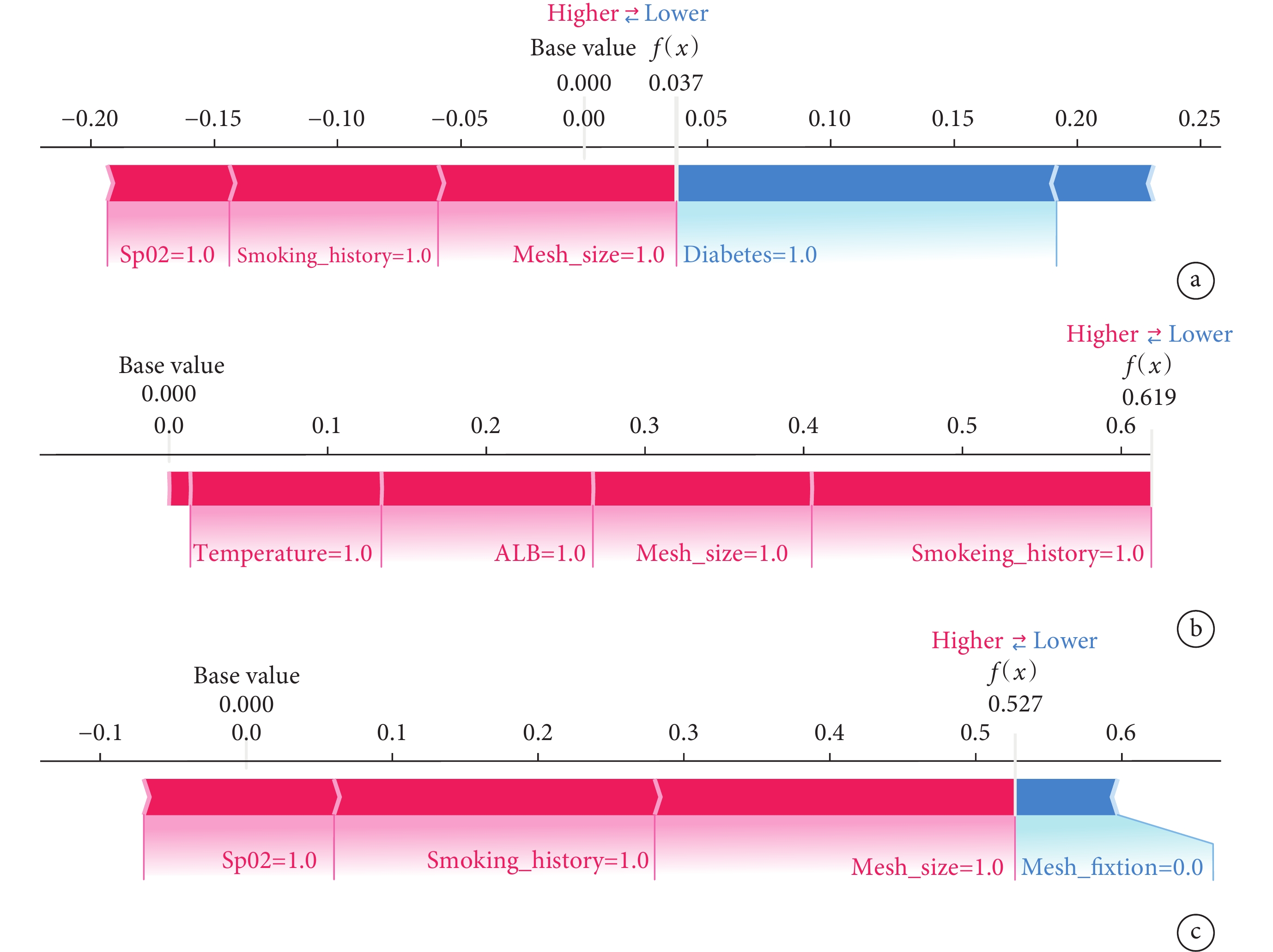 圖10
SHAP力圖
圖10
SHAP力圖
藍色變量:代表其降低了疾病的復發概率,SHAP值減少;紅色變量:代表其增加了疾病的復發概率,SHAP值增加;a:患者Ⅰ的預測分析;b:患者Ⅱ的預測分析;c:患者Ⅲ的預測分析。
3 討論
在本次研究中,我們使用四種機器學習算法來構建風險預測模型。雖然這些算法各有其特點,并在不同的場景下均有很好的應用前景,但通過構建和評價模型后發現,XGBoost算法表現出了最高的精確度、最佳的穩定性以及較好的泛化能力。相對于RF算法,XGBoost算法可以很方便地通過模型中特征的重要性排名來評估每個特征對模型的貢獻,以便于更加直觀地輸出模型結果。除此之外,XGBoost算法還具有更多的參數調整選項,可以更靈活地控制模型的表現[8]。SVM、KNN算法具有較高的模型復雜度,這在處理大規模的數據集時,導致算法的表現可能不夠優秀[9]。相比之下,XGBoost算法具有較低的模型復雜度,更適合用于多維度的研究,而且該算法還減少了計算量以及訓練時間。所以綜合比較下,本研究選擇使用XGBoost算法構建模型來預測患者腹腔鏡疝修補術后疝的復發。
部分研究[10-11]已經驗證了機器學習算法應用在臨床診斷以及預后方面的準確性和適用性。而且相對于傳統診斷方法,機器學習技術還可以準確地預測疾病進展中的不良結局。本研究建立的預測模型可以讓低危患者減少非必要的檢查,從而減輕患者經濟負擔。最重要的是,該模型可以幫助臨床決策者準確地識別復發疝的高危患者,及時采取有針對性的干預性治療,改善患者預后。此外,本次研究通過SHAP分析對模型進行了可視化分析,結果顯示疝復發與補片較小、術中不固定補片、糖尿病、低蛋白血癥、肥胖、吸煙、術中SpO2以及體溫低密切相關。
與正常患者相比,肥胖患者具有腹內壓更高、手術切口愈合能力更差且更易引發疝復發的特征。另一方面,這一類患者的腹壁肥厚,表面張力較大,這對手術器械的操作造成了限制。此外,患者內臟肥大進一步壓縮了手術操作空間。同樣,過多的脂肪組織也使得縫合腹壁筋膜層更加困難。這些因素對手術技巧提出了更高的要求。在術后,患者還容易因脂肪液化影響縫合區的密閉性,使得術后疝復發的風險更高。
在手術治療領域,無論是大型心臟外科手術還是小型腹壁外科手術,糖尿病患者的術后并發癥風險始終居高不下[12]。本研究也證實了糖尿病患者術后更易出現復發疝。我們認為,機體長期處于高血糖狀態對患者免疫系統的正常功能有一定影響。而且高血糖的細胞內環境會對中性粒細胞生理變化產生影響,弱化細胞的趨化移動和吞噬功能。術后細菌更易進入手術創面,從而導致并發癥如腹腔感染,增加了術后疝復發的風險,且此種影響可持續至術后兩至三個月。因此,臨床醫生需在圍手術期嚴格控制患者血糖水平,并對出現傷口感染的患者及時應用抗生素,以避免其他高危并發癥的發生。另一方面,患者內部環境的高血糖水平,會誘導產生炎癥因子,對機體膠原蛋白合成和纖維細胞增殖產生影響。同時,糖尿病患者還伴隨有組織微血管的變化,從一定程度上削弱了傷口血供[13-14]。這些因素都抑制了手術后傷口的愈合。在患者執行諸如咳嗽和下蹲等會增加腹腔壓力的動作后,未愈合的手術創面可能直接導致腹股溝疝的復發。
相比其他手術方式,腹股溝疝修補手術的特殊之處在于手術過程中需要植入補片這類外源性物質。而補片選擇不當,也會成為術后復發的危險因素。補片的大小以及是否固定是外科醫生長期以來一直關注的焦點[2]。Pankaj等[15]認為術中可以使用縫針或者釘子固定補片來防止補片因折疊、卷曲而導致疝復發的問題。本研究對1 178例腹股溝疝患者的回顧性分析也證實了這一結論。盡管固定補片可能會導致手術后腹股溝區血清腫,但固定穩固的補片能夠減少血清腫對疝復發的影響。同時,有研究還發現,補片尺寸過小也是疝復發的重要危險因素。更大的補片可以覆蓋更廣泛的疝損區域,并可能覆蓋腹股溝區域中可能存在的其他疝的位置。此外,本研究還通過三個樣本病例,闡釋了模型如何預測個體疝復發的情況。例如,在樣本Ⅱ的疾病預測分析中,患者營養狀況不佳是一個重要的預后風險因素。血漿白蛋白的分子量很小,但數量遠高于其他血漿蛋白,對于維持血液與組織液間的滲透壓具有重要的作用。由于低蛋白血癥患者血漿滲透壓下降,容易導致組織水腫,同時也會影響患者結締組織的合成能力。這些因素都不利于術后創傷的愈合。另一方面,此類患者體內合成的抗體較少,炎癥因子較多,更易引發炎癥反應和術后感染,從而增加了疝復發的風險[16-17]。因此,本研究結果提示臨床醫生應當及時復查患者的各項營養指標,加強對低蛋白血癥患者的營養支持,在患者能夠進食時,適當補充高蛋白飲食。
本研究在考慮了先前研究中包含的危險因素的基礎上,進一步納入了一些被臨床醫生忽視的疝復發危險因素。本研究發現吸煙也對疝復發產生了影響。我們認為煙草可能造成手術創面中的膠原蛋白沉積,降低周圍組織的氧含量和血供;同時尼古丁也會直接抑制細胞的修復功能。此外,吸煙者的術后感染率顯著高于非吸煙者,這些都是吸煙導致疝復發的重要機制。本研究還發現,術中SpO2低和體溫低的患者更容易復發疝,這可能與術中低體溫患者機體基礎條件較差,手術創面血液灌注差,術后愈合能力較弱有關。目前大多數外科醫生已經開始重視患者的術中體溫,并及時采取保暖措施。另一方面,術中SpO2與患者免疫力之間存在密切關聯。這主要歸因于中性粒細胞和巨噬細胞在充足的氧氣條件下才能夠實施正常的氧化殺傷功能。此外,SpO2過低的患者在術后易感染,進而大大增加了疝復發的風險。
本研究從區分度、校準度、臨床實用性三個方面全面地評價了預測模型性能,但研究還存在部分局限性。本研究雖然考慮了多方面的危險因素,但并未重點關注實驗室檢查指標等理化因素。而且雖然機器學習算法的準確度較高,但其模型更復雜,可解釋性較差。模型的整個計算及決策過程均在黑匣子里運行,不像邏輯回歸模型那樣直觀和清晰[18]。另一方面,本次研究作為一項單中心的回顧性研究,具有選擇性偏倚、分布偏倚以及回顧性偏倚等缺點。因此,未來的研究可能需要更多的多中心的前瞻性數據,以進一步提高研究結果的可靠性。
綜上所述,本次研究基于XGBoost機器學習算法建立模型來預測腹股溝疝復發的風險。該模型具有良好的預測精度和臨床實用價值,便于外科醫生及時診斷患者。本模型指出疝復發仍是患者在腹腔鏡疝修補術后面臨的主要問題之一,而且與補片較小、術中不固定補片、糖尿病、低蛋白血癥、肥胖、吸煙史、術中SpO2以及體溫低等因素密切相關。
腹股溝疝是腹壁外科中常見的一類疾病,可嚴重影響患者生活質量[1]。傳統的疝修補術是治療腹股溝疝的主要治療手段,但恢復時間較長、復發率高。腹腔鏡手術具有手術創傷小、恢復快、感染率低等優點,目前已成為腹股溝疝的主要手術方式。但部分患者仍可能出現復發,這不僅增加了患者的住院時間,還加重額外的醫療負擔[2]。更重要的是,這些患者還需要承受二次手術的風險。因此,準確預測腹腔鏡疝修補術后的疝復發情況,識別高危患者,從而盡可能降低術后復發,顯得尤為重要。
一般情況下,外科醫生通常根據其臨床經驗對疝復發風險進行評估,但常無法準確預測術后復發和識別相關影響因素。部分研究者嘗試使用參數回歸方法來預測疾病。例如Song等[3]的研究納入了795例患者,結果表明性別與術后感染是疝氣發生與復發的高危因素。郭燕等[4]的研究表示年齡、內環口的大小及縫線的類型與疝氣復發關系密切。但回歸模型在處理復雜臨床特征變量之間的關系時有一定局限性。而且如果研究納入的變量較少,則回歸模型的預測結果可能有較大差異。近年來,人工智能在醫療領域發展迅速,機器學習作為其重要的分支,具有更穩定的模型建立、更準確的預測結果等優勢,已被廣泛應用于臨床預測等方面[5-6]。本次研究通過分析腹股溝疝患者術前和術后的臨床特征,借助機器學習算法建立腹腔鏡疝修補術后疝復發的預測模型,在不使用常規影像學檢查的情況下識別復發疝的高危因素,幫助臨床醫生為患者制定準確的個體化診療方案提供參考。
1 對象與方法
1.1 研究對象
本研究使用的患者數據來自于南京醫科大學附屬無錫人民醫院的臨床數據庫。病例納入標準:① 18~80歲的腹股溝疝患者;② 患者行腹腔鏡輔助腹股溝疝修補術;③ 手術團隊由具有獨立開展腹股溝疝修補術資質的高年資醫生組成。病例排除標準:① 嵌頓疝、絞窄疝等危及生命的急腹癥;② 巨大腹股溝疝;③ 腹腔鏡手術中轉開放手術;④ 因腹腔嚴重粘連無法開展腹腔鏡手術;⑤ 合并有嚴重的心血管疾病或呼吸系統疾病;⑥ 患者基本信息缺失、臨床數據缺失或失訪的患者。研究中所有患者術后隨訪至少5年。此研究經無錫市人民醫院倫理委員會審批(審批號:KY22085)。
患者臨床數據包括29項術前變量(手術日24 h內)、術中變量以及術后變量(手術后48 h內)。術前變量包括患者的人口統計學特征(性別、年齡、吸煙史、酗酒史及BMI)、基本臨床特征(ASA評分、NRS2002評分及手術史)、基本病史(貧血、腸梗阻、糖尿病、高血壓、慢性阻塞性肺疾病、高脂血癥以及冠心病)、實驗室檢查指標(白蛋白)。術中變量包括手術類型、補片大小、補片固定情況、手術時間、術中出血量、術中輸血情況、術中SpO2情況、術中體溫情況、患者術中是否發生心動過速、手術是否為急診手術。術后變量包括實驗室檢查指標(PCT、CRP以及SAA)。本次研究的結局變量為術后疝氣復發風險。
1.2 復發疝的相關定義與診斷
復發疝定義為患者在手術修補后,疝囊再次突出[7]。復發疝的診斷標準為:① 患者術后出現腹股溝或腹部突起或疼痛等癥狀;② 患者咳嗽時出現突出部位增大以及患者癥狀加重;③ 經腹部超聲、CT等影像學檢查后確診為復發疝。
1.3 機器學習算法預測模型的建立與評價
應用SPSS軟件和R軟件進行臨床預測模型的構建與評價。① 數據預處理。選取2010年1月至2015年12月的腹股溝疝患者作為模型建立集,選取2016年1月至2018年1月的腹股溝疝患者作為模型獨立驗證集。將模型建立集隨機分為訓練集(70%)與測試集(30%)。② 對模型建立集進行單因素、多因素分析。兩組差異比較,對分類變量采用卡方檢驗;對符合正態分布的連續性變量采用t檢驗;對不符合正態分布的連續性變量采用秩和檢驗。檢驗水準設為α=0.05。對單因素分析中有統計學意義的變量進行Logistic回歸分析,得到術后疝復發的獨立影響因素。使用梯度提升機(extreme gradient boosting,XGBoost)、隨機森林(random forest,RF)、支持向量機(support vector machine,SVM)以及K最臨近(k-nearest neighbor algorithm,KNN)4種機器學習模型對所有變量的重要性進行評分并依據影響因素權重進行排序。篩選出在4種模型排序中均排名前十位且在單因素、多因素分析中有統計學意義的變量。③ 建立預測模型并評價不同預測模型性能。將篩選的特征變量納入SVM、RF、XGBoost及KNN四種機器學習算法預測模型中。我們根據算法的原理,使用迭代的方法對模型的參數進行不斷改變并觀察模型結果,找出最優結果所對應的模型參數。由于k折交叉驗證易于實現,并且相比于其他方法其具有更低偏差的評估能力,因此它通常用于比較和選擇不同的模型算法。我們通過網格搜索調整超參數,并用重采樣方法(k=10)對模型建立集進行了k-折交叉驗證。k-折交叉驗證的實施如下:將原始數據集分成10組并選擇1個組作為測試數據集,并且選擇其余組作為訓練數據集。訓練數據集用于擬合模型并調整模型參數,測試數據集用于評估系統的性能。重復以上步驟,直到每個組都被測試。保留AUC、準確率、敏感度以及特異度等模型評估指標并對預測中的k輪適應度求平均,以獲得模型預測性能的最準確估計。通過區分度、校準度、臨床實用性3個方面來評價并選擇最佳預測模型:繪制ROC曲線,獲取AUC值,判定模型的預測效能;繪制校正曲線,評估模型預測結果與實際結果之間是否具有較好的一致性;繪制決策曲線分析(decision curve analysis, DCA),評估患者行干預性治療后的獲益情況。④ 采用模型獨立建立集對最佳模型進行驗證,繪制ROC曲線圖來判定模型的通用性與預測效能。⑤ 模型解釋。通過SHAP分析得到樣本中每個特征對預測的貢獻值,即Shapley值。根據Shapley值構建SHAP摘要圖以及單樣本SHAP解釋力圖。SHAP摘要圖對風險因素進行重要性排序,單樣本SHAP解釋力圖對單個樣本的預測結果進行分析解釋。
2 結果
2.1 患者的基本特征
共納入1 178例腹股溝疝患者,其中114例(9.68%)出現術后復發。患者的基本特征見表1。研究設計和患者納入流程圖見圖1。
 圖1
研究流程圖
圖1
研究流程圖
a:研究設計流程圖;b:患者篩選流程圖。
2.2 術后疝復發的危險因素篩選
單因素分析、多因素分析結果表明,BMI、吸煙史、低蛋白血癥、腸梗阻病史、糖尿病史、高血壓病史、補片尺寸、補片不固定、急診手術、術中輸血、術中體溫低以及術中SpO2低是疝復發的獨立影響因素(P<0.05)(表2)。XGBoost、RF、SVM及KNN算法篩選出影響術后疝復發的危險因素包括補片尺寸、補片不固定、糖尿病史、低蛋白血癥、BMI、吸煙史、術中SpO2以及術中體溫低(圖2)。綜合分析后,納入本次預測模型的危險因素包括補片尺寸、補片的固定情況、糖尿病、低蛋白血癥、BMI、吸煙史、術中SpO2以及術中體溫低。
 圖2
4個機器學習模型的影響因素排名圖
圖2
4個機器學習模型的影響因素排名圖
a:XGBoost模型的變量重要性排序圖;b:RF模型的變量重要性排名圖;c:SVM模型的變量重要性排序圖;d:KNN模型的變量重要性排序圖。
2.3 模型建立與評價
ROC曲線結果顯示,XGBoost在訓練集中的AUC值高達0.985;在驗證集中的AUC值為0.917,在4種模型中表現最好(表3)。4種模型的校正曲線與理想曲線相近,模型的預測結果與實際結果之間具有較高的一致性。DCA曲線顯示4種模型都實現了相對于全部治療或無治療計劃的凈臨床獲益(圖3~圖6)。采用k-折交叉驗證法比較4種模型的泛化能力。將30.01%的樣本(n=262)作為測試集,剩余樣本作為訓練集進行10折交叉驗證:① XGBoost驗證集的AUC=0.895±0.053,測試集的AUC=0.927,準確度=0.897(圖7);② RF驗證集的AUC=0.775±0.104,測試集的AUC=0.868,準確度=0.912;③ SVM驗證集的AUC=0.882±0.057,測試集的AUC=0.873,準確度=0.878;④ KNN驗證集的AUC=0.869±0.095,測試集的AUC=0.866,準確度=0.908。綜合比較后,認為XGBoost算法構建的模型為最佳預測模型。
 圖3
4種模型訓練集的ROC曲線
圖3
4種模型訓練集的ROC曲線
 圖4
4種模型驗證集的ROC曲線
圖4
4種模型驗證集的ROC曲線
 圖5
4種模型的校準圖
圖5
4種模型的校準圖
 圖6
4種模型的DCA曲線
圖6
4種模型的DCA曲線
 圖7
XGBoos模型的k-折交叉驗證結果
圖7
XGBoos模型的k-折交叉驗證結果
a:XGBoost模型訓練集的ROC曲線;b:XGBoost模型驗證集的ROC曲線;c:XGBoost模型測試集的ROC曲線。
2.4 獨立驗證集模型評估
ROC曲線結果顯示,獨立驗證集AUC值為0.860,說明該預測模型對判斷疾病準確度很高。模型校正曲線與理想曲線相近,DCA曲線顯示模型實現了凈臨床獲益(圖8)。
 圖8
XGBoost模型獨立驗證集評價
圖8
XGBoost模型獨立驗證集評價
a:XGBoost模型獨立驗證集的ROC曲線;b:XGBoost模型獨立驗證集的校正曲線;c:XGBoost模型獨立驗證集的DCA曲線。
2.5 模型解釋
SHAP摘要圖結果顯示,腹股溝疝修補術后復發的危險因素排序為補片<10 cm、吸煙史、低蛋白血癥、術中體溫<36℃、術中SpO2<90%、糖尿病史、補片不固定、BMI≥25 kg/m2(圖9)。SHAP力圖顯示了研究模型對3個疝復發患者的預測分析。模型預測患者一的復發概率為0.037,且增加其復發概率的特征是術中SpO2<90%、吸煙史以及補片<10 cm;模型預測患者二的復發概率為0.619,且增加其復發概率的特征是術中體溫<36℃、低蛋白血癥、補片<10 cm以及吸煙史;模型預測患者三的復發概率為0.527,且增加其復發概率的特征是術中SpO2<90%、吸煙史以及補片<10 cm,降低其復發概率的特征是補片固定(圖10)。
 圖9
SHAP摘要圖
圖9
SHAP摘要圖
 圖10
SHAP力圖
圖10
SHAP力圖
藍色變量:代表其降低了疾病的復發概率,SHAP值減少;紅色變量:代表其增加了疾病的復發概率,SHAP值增加;a:患者Ⅰ的預測分析;b:患者Ⅱ的預測分析;c:患者Ⅲ的預測分析。
3 討論
在本次研究中,我們使用四種機器學習算法來構建風險預測模型。雖然這些算法各有其特點,并在不同的場景下均有很好的應用前景,但通過構建和評價模型后發現,XGBoost算法表現出了最高的精確度、最佳的穩定性以及較好的泛化能力。相對于RF算法,XGBoost算法可以很方便地通過模型中特征的重要性排名來評估每個特征對模型的貢獻,以便于更加直觀地輸出模型結果。除此之外,XGBoost算法還具有更多的參數調整選項,可以更靈活地控制模型的表現[8]。SVM、KNN算法具有較高的模型復雜度,這在處理大規模的數據集時,導致算法的表現可能不夠優秀[9]。相比之下,XGBoost算法具有較低的模型復雜度,更適合用于多維度的研究,而且該算法還減少了計算量以及訓練時間。所以綜合比較下,本研究選擇使用XGBoost算法構建模型來預測患者腹腔鏡疝修補術后疝的復發。
部分研究[10-11]已經驗證了機器學習算法應用在臨床診斷以及預后方面的準確性和適用性。而且相對于傳統診斷方法,機器學習技術還可以準確地預測疾病進展中的不良結局。本研究建立的預測模型可以讓低危患者減少非必要的檢查,從而減輕患者經濟負擔。最重要的是,該模型可以幫助臨床決策者準確地識別復發疝的高危患者,及時采取有針對性的干預性治療,改善患者預后。此外,本次研究通過SHAP分析對模型進行了可視化分析,結果顯示疝復發與補片較小、術中不固定補片、糖尿病、低蛋白血癥、肥胖、吸煙、術中SpO2以及體溫低密切相關。
與正常患者相比,肥胖患者具有腹內壓更高、手術切口愈合能力更差且更易引發疝復發的特征。另一方面,這一類患者的腹壁肥厚,表面張力較大,這對手術器械的操作造成了限制。此外,患者內臟肥大進一步壓縮了手術操作空間。同樣,過多的脂肪組織也使得縫合腹壁筋膜層更加困難。這些因素對手術技巧提出了更高的要求。在術后,患者還容易因脂肪液化影響縫合區的密閉性,使得術后疝復發的風險更高。
在手術治療領域,無論是大型心臟外科手術還是小型腹壁外科手術,糖尿病患者的術后并發癥風險始終居高不下[12]。本研究也證實了糖尿病患者術后更易出現復發疝。我們認為,機體長期處于高血糖狀態對患者免疫系統的正常功能有一定影響。而且高血糖的細胞內環境會對中性粒細胞生理變化產生影響,弱化細胞的趨化移動和吞噬功能。術后細菌更易進入手術創面,從而導致并發癥如腹腔感染,增加了術后疝復發的風險,且此種影響可持續至術后兩至三個月。因此,臨床醫生需在圍手術期嚴格控制患者血糖水平,并對出現傷口感染的患者及時應用抗生素,以避免其他高危并發癥的發生。另一方面,患者內部環境的高血糖水平,會誘導產生炎癥因子,對機體膠原蛋白合成和纖維細胞增殖產生影響。同時,糖尿病患者還伴隨有組織微血管的變化,從一定程度上削弱了傷口血供[13-14]。這些因素都抑制了手術后傷口的愈合。在患者執行諸如咳嗽和下蹲等會增加腹腔壓力的動作后,未愈合的手術創面可能直接導致腹股溝疝的復發。
相比其他手術方式,腹股溝疝修補手術的特殊之處在于手術過程中需要植入補片這類外源性物質。而補片選擇不當,也會成為術后復發的危險因素。補片的大小以及是否固定是外科醫生長期以來一直關注的焦點[2]。Pankaj等[15]認為術中可以使用縫針或者釘子固定補片來防止補片因折疊、卷曲而導致疝復發的問題。本研究對1 178例腹股溝疝患者的回顧性分析也證實了這一結論。盡管固定補片可能會導致手術后腹股溝區血清腫,但固定穩固的補片能夠減少血清腫對疝復發的影響。同時,有研究還發現,補片尺寸過小也是疝復發的重要危險因素。更大的補片可以覆蓋更廣泛的疝損區域,并可能覆蓋腹股溝區域中可能存在的其他疝的位置。此外,本研究還通過三個樣本病例,闡釋了模型如何預測個體疝復發的情況。例如,在樣本Ⅱ的疾病預測分析中,患者營養狀況不佳是一個重要的預后風險因素。血漿白蛋白的分子量很小,但數量遠高于其他血漿蛋白,對于維持血液與組織液間的滲透壓具有重要的作用。由于低蛋白血癥患者血漿滲透壓下降,容易導致組織水腫,同時也會影響患者結締組織的合成能力。這些因素都不利于術后創傷的愈合。另一方面,此類患者體內合成的抗體較少,炎癥因子較多,更易引發炎癥反應和術后感染,從而增加了疝復發的風險[16-17]。因此,本研究結果提示臨床醫生應當及時復查患者的各項營養指標,加強對低蛋白血癥患者的營養支持,在患者能夠進食時,適當補充高蛋白飲食。
本研究在考慮了先前研究中包含的危險因素的基礎上,進一步納入了一些被臨床醫生忽視的疝復發危險因素。本研究發現吸煙也對疝復發產生了影響。我們認為煙草可能造成手術創面中的膠原蛋白沉積,降低周圍組織的氧含量和血供;同時尼古丁也會直接抑制細胞的修復功能。此外,吸煙者的術后感染率顯著高于非吸煙者,這些都是吸煙導致疝復發的重要機制。本研究還發現,術中SpO2低和體溫低的患者更容易復發疝,這可能與術中低體溫患者機體基礎條件較差,手術創面血液灌注差,術后愈合能力較弱有關。目前大多數外科醫生已經開始重視患者的術中體溫,并及時采取保暖措施。另一方面,術中SpO2與患者免疫力之間存在密切關聯。這主要歸因于中性粒細胞和巨噬細胞在充足的氧氣條件下才能夠實施正常的氧化殺傷功能。此外,SpO2過低的患者在術后易感染,進而大大增加了疝復發的風險。
本研究從區分度、校準度、臨床實用性三個方面全面地評價了預測模型性能,但研究還存在部分局限性。本研究雖然考慮了多方面的危險因素,但并未重點關注實驗室檢查指標等理化因素。而且雖然機器學習算法的準確度較高,但其模型更復雜,可解釋性較差。模型的整個計算及決策過程均在黑匣子里運行,不像邏輯回歸模型那樣直觀和清晰[18]。另一方面,本次研究作為一項單中心的回顧性研究,具有選擇性偏倚、分布偏倚以及回顧性偏倚等缺點。因此,未來的研究可能需要更多的多中心的前瞻性數據,以進一步提高研究結果的可靠性。
綜上所述,本次研究基于XGBoost機器學習算法建立模型來預測腹股溝疝復發的風險。該模型具有良好的預測精度和臨床實用價值,便于外科醫生及時診斷患者。本模型指出疝復發仍是患者在腹腔鏡疝修補術后面臨的主要問題之一,而且與補片較小、術中不固定補片、糖尿病、低蛋白血癥、肥胖、吸煙史、術中SpO2以及體溫低等因素密切相關。