引用本文: 王紫霞, 汪其賢, 曾紅兵, 施靜. 抗C1q抗體對中國人群狼瘡腎炎診斷價值的Meta分析. 中國循證醫學雜志, 2015, 15(8): 914-921. doi: 10.7507/1672-2531.20150154 復制
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種累及全身的多系統自身免疫性疾病,狼瘡性腎炎(lupus nephritis,LN)是SLE伴發的腎臟損害,是SLE常見且嚴重的并發癥之一。對于SLE患者,腎臟受累及進行性腎功能損害仍是其主要的死亡原因之一 [1]。有研究報道,LN是由免疫、遺傳、感染、射線、內分泌、藥物、環境等多因素共同作用的結果,這種作用激活了T細胞,而活化的T細胞進一步激活B細胞,導致過多的自身抗體產生,最終自身抗體的產生及免疫復合物在腎臟的沉積導致LN發病 [2]。
抗C1q抗體是補體經典激活途徑中的啟動蛋白分子C1q的相應抗體,1984年在SLE患者的血清中首次檢出 [3]。自此,抗C1q抗體被報道出現在多種自身免疫性疾病和一些感染性疾病中,甚至出現在健康個體中 [4-7]。
在過去十幾年中,大量研究發現外周血清中的抗C1q抗體與LN疾病的活動性及嚴重程度相關[8-11]。一些研究發現抗C1q抗體在診斷LN中比傳統的血清標志物,如anti-dsDNA、C3和C4,有更高的敏感度和特異度 [12, 13]。然而,也有一些研究認為血清抗C1q抗體的水平與LN的發病機制無明顯相關性 [14]。因此,抗C1q抗體是否參與LN疾病的發展和是否為診斷LN的重要指標仍頗具爭議。
Yin等 [15]及Eggleton等 [16]已對抗C1q抗體在LN診斷中的價值進行了Meta分析,但目前缺乏抗C1q自身抗體對中國人群LN診斷價值的系統評價。故我們采用搜集血清中抗C1q抗體在中國人群中診斷LN的診斷性試驗進行系統評價和Meta分析,以期為中國人群LN的診斷提供參考依據。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型
國內外已發表的抗C1q抗體診斷LN診斷價值的診斷性試驗。文種限中、英文。
1.1.2 研究對象
疑似LN的SLE患者。SLE的診斷符合1997年美國風濕病學會(ACR)分類標準 [17]或1982年修訂的SLE診斷標準 [18]。患者為中國人群,其年齡、性別、民族及教育程度不限。
1.1.3 診斷方法
LN診斷的金標準為臨床上有LN活動表現或經腎活檢確診,待評價診斷方法為ELISA法檢測血清抗C1q抗體水平。
1.1.4 結局指標
敏感度(Sen)、特異度(Spe)、陽性似然比(+LR)、陰性似然比(-LR)、診斷比值比(DOR)、綜合受試者工作特征曲線(SROC)下面積(AUC)及Q*指數。
1.1.5 排除標準
① 不能獲得完整的診斷四格表數據或無原始數據的文獻;② 重復發表的文獻;③ 納入病例數少于10例。
1.2 檢索策略
計算機檢索PubMed、EMbase、CNKI、The Cochrane Library、VIP和WanFang Data數據庫,檢索時限均為建庫至2015年3月1日,搜集血清抗C1q抗體檢測用于中國人群LN診斷的診斷性試驗。此外,追溯納入研究的參考文獻,以補充獲取相關文獻。英文檢索詞包括systemic lupus erythematosus/ SLE、lupus nephritis/ LN、C1q、anti-C1q、meta-analysis;中文檢索詞包括抗C1q抗體、系統性紅斑狼瘡、狼瘡腎炎。
1.3 文獻篩選及資料提取
由2位評價員獨立按納入與排除標準篩選文獻和提取資料,并交叉核對,如遇分歧,則交由第三位研究者協助判斷,缺乏的資料盡量與原作者聯系予以補充。文獻篩選首先閱讀文題和摘要,在排除明顯不符合納入標準的文獻后,進一步閱讀全文進行復篩,以決定是否納入。資料提取的主要內容包括:① 納入研究的基本信息,包括研究題目、第一作者、發表時間、研究地區、樣本量等;② 研究對象的基本特征,包括患者性別、年齡、病程等;③ 待評價試驗的檢測方法、試劑來源、金標準、臨界值、診斷四格表數據等。
1.4 納入研究的方法學質量評價
由2名評價員按照Whiting等[19]制定的QUADAS工具,從偏倚(條目3~7、10~12、14)、變異(條目1~2)、報告質量(條目8~9、13)三方面對納入研究的方法學質量進行評價。如遇分歧,則討論解決或交由第三位研究者裁決。
1.5 統計分析
采用 Meta-Disc 1.4軟件進行Meta分析,Meta分析的檢驗水準設為α=0.05。首先采用Spearman相關分析檢驗有無閾值效應引起的異質性,若P>0.05,提示無閾值效應;若P<0.05,提示存在閾值效應所致異質性。若無閾值效應,則進一步分析有無其他原因所致異質性,并采用固定或隨機效應模型進行Meta分析,計算合并的Sen、Spe、+LR、-LR和DOR,繪制SROC曲線,并計算曲線下面積(AUC)和Q*指數;若存在閾值效應,則僅計算合并的DOR,通過繪制SROC曲線并計算AUC來判斷其診斷價值。采用Deville等 [20]的方法進行敏感性分析。采用Stata 11.0軟件,使用Egger’s檢驗和Egger’s檢驗進行發表偏倚分析 [21]。
2 結果
2.1 文獻檢索結果
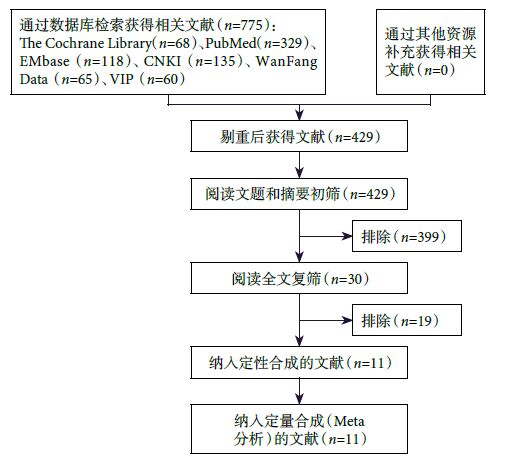
初檢出相關文獻775篇,經逐層篩選后,最終納入11個研究 [22-32],共1 084例SLE患者。文獻篩選流程及結果見圖 1。
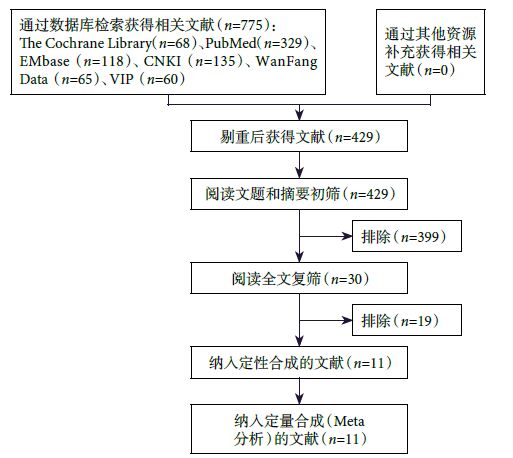 圖1
文獻篩選流程及結果
圖1
文獻篩選流程及結果
2.2 納入研究的基本特征與方法學質量評價
2.3 Meta分析結果
2.3.1 異質性檢驗
ROC平面圖分析結果顯示,不呈“肩臂狀”分布,進一步計算Sen和(1-Spe)對數的Spearman相關系數為0.445,P=0.170,提示不存在閾值效應。因各研究結果間存在非閾值效應所致異質性,故采用隨機效應模型進行Meta分析。
2.3.2 合并分析結果
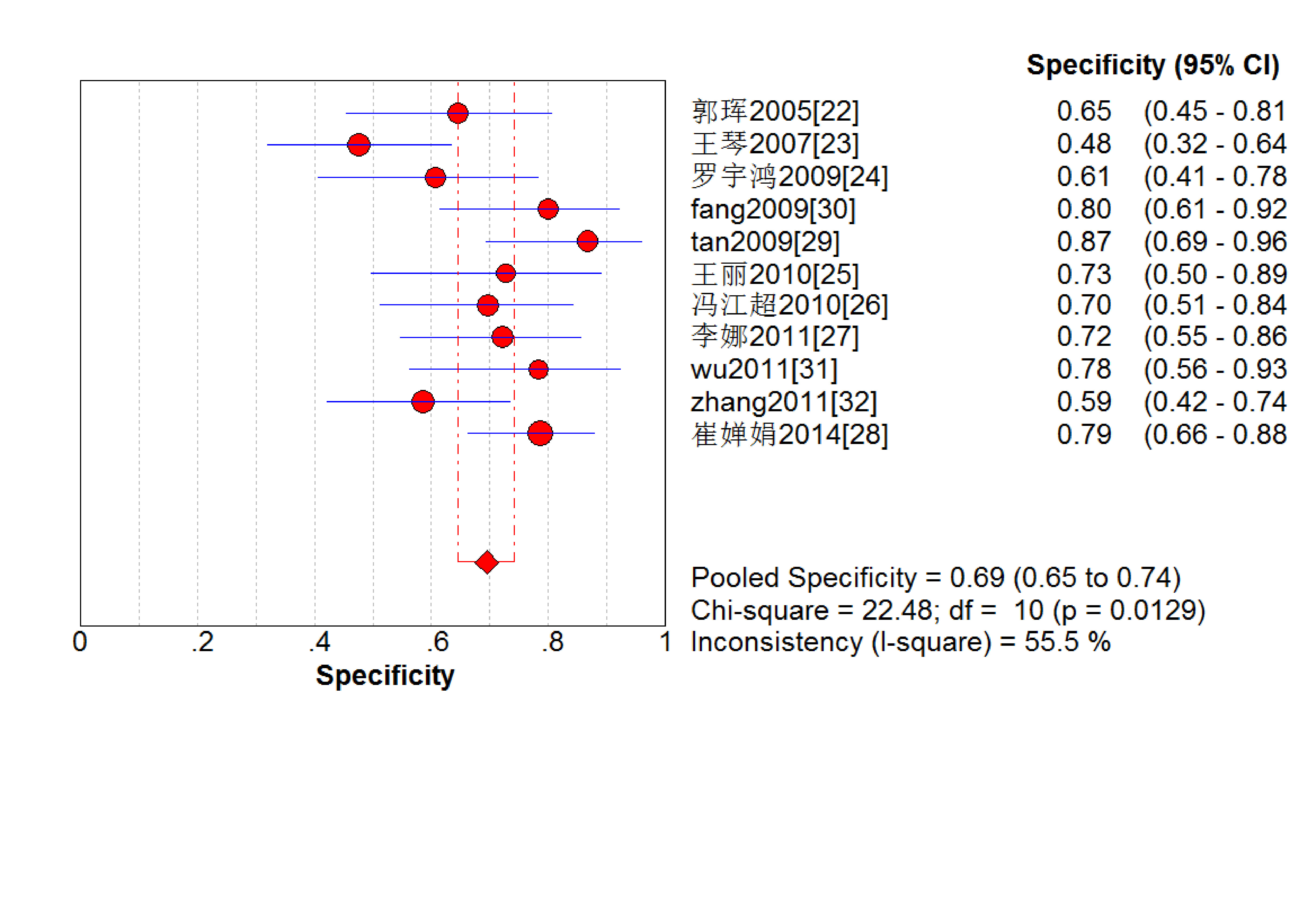
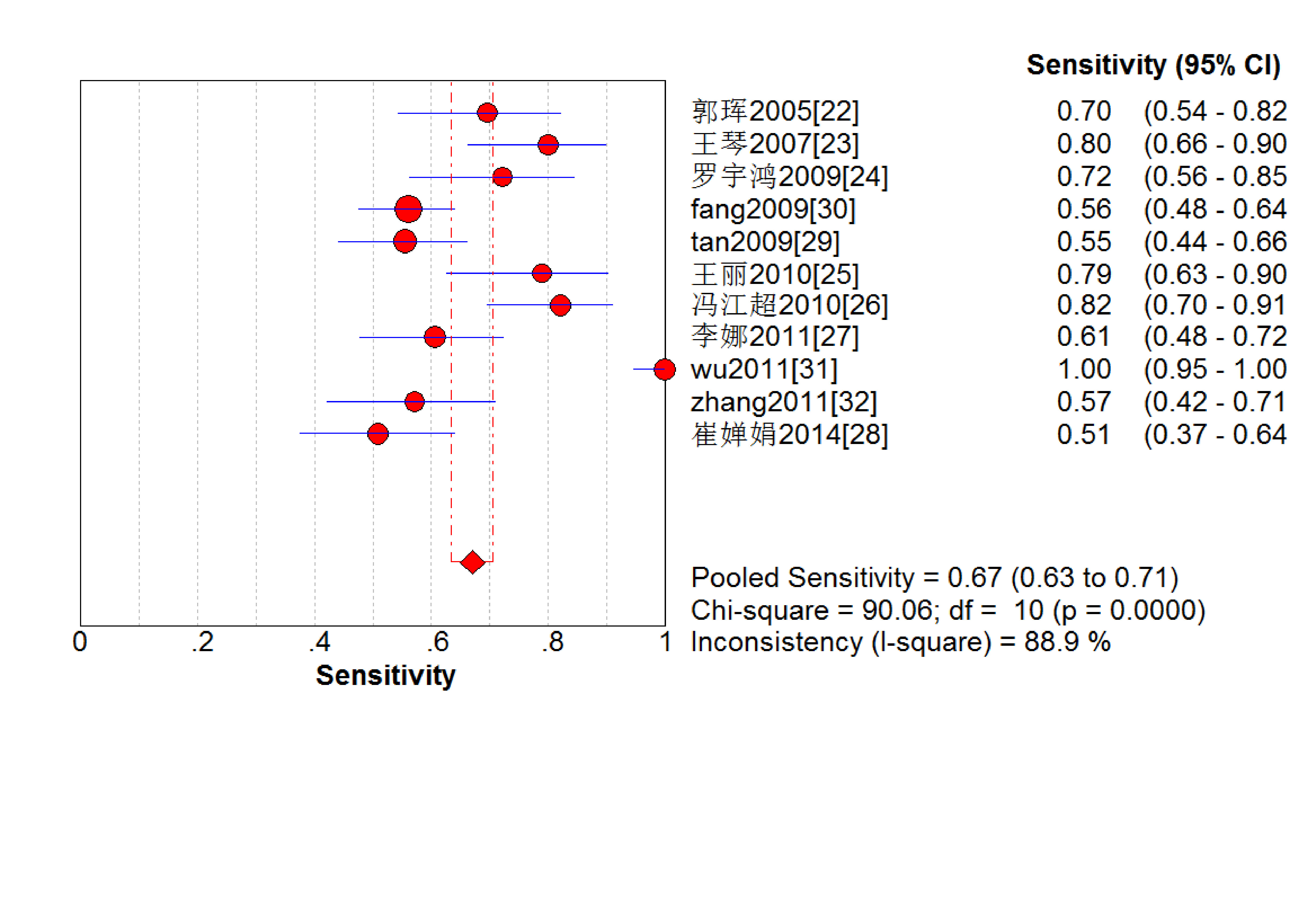
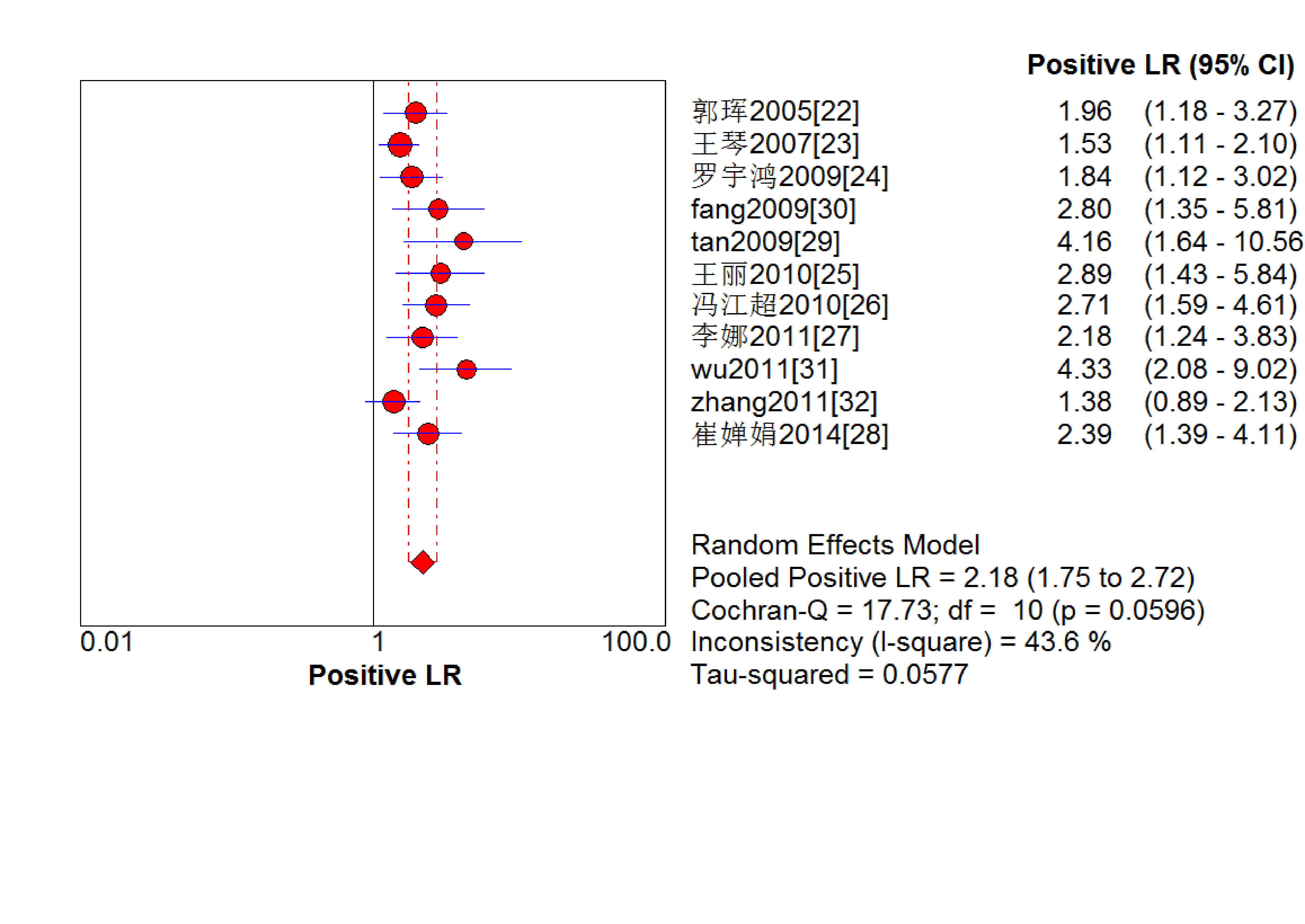
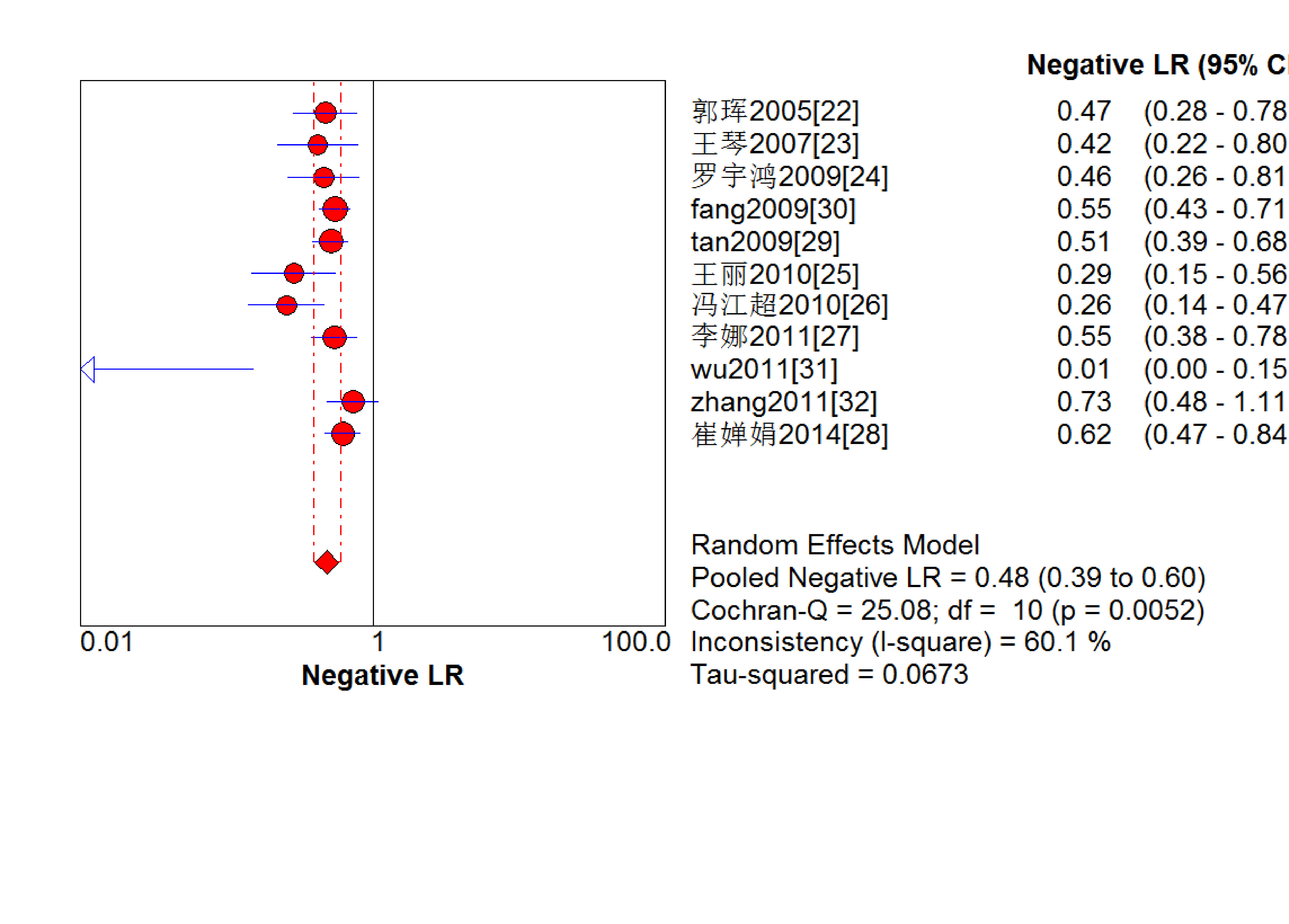
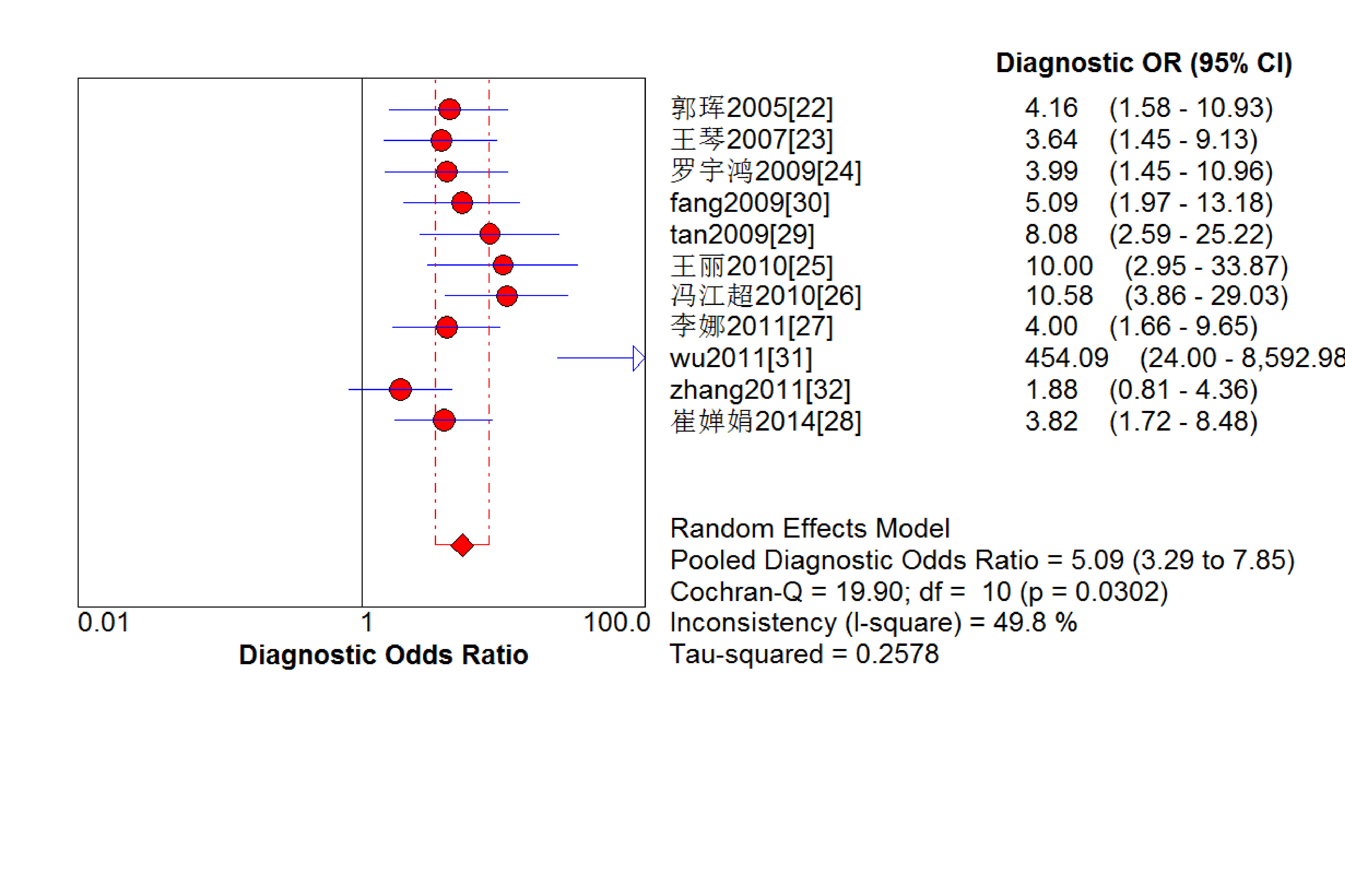
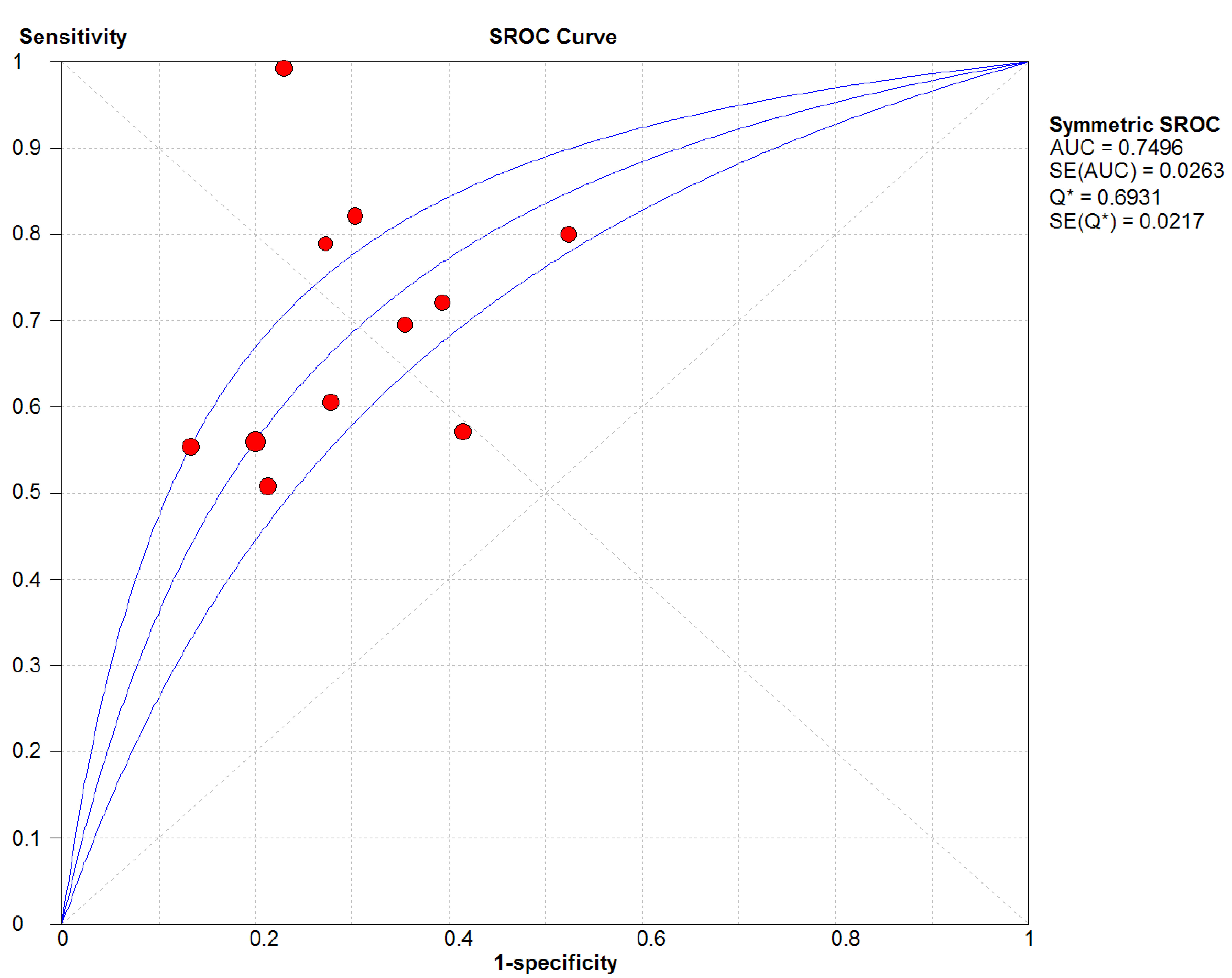
結果見圖 2~7。抗C1q抗體診斷LN的合并Sen、Spe、DOR、+LR和-LR分別為0.67[95%CI (0.63,0.71)]、0.69[95%CI (0.65,0.74)]、5.09[95%CI(3.29,7.85)]、2.18[95%CI(1.75,2.72)]和0.48[95%CI(0.39,0.60)],SROC AUC=0.749 6,Q*=0.693 1。抗C1q抗體診斷LN的平均漏診率為33.0%,平均誤診率為31.0%。
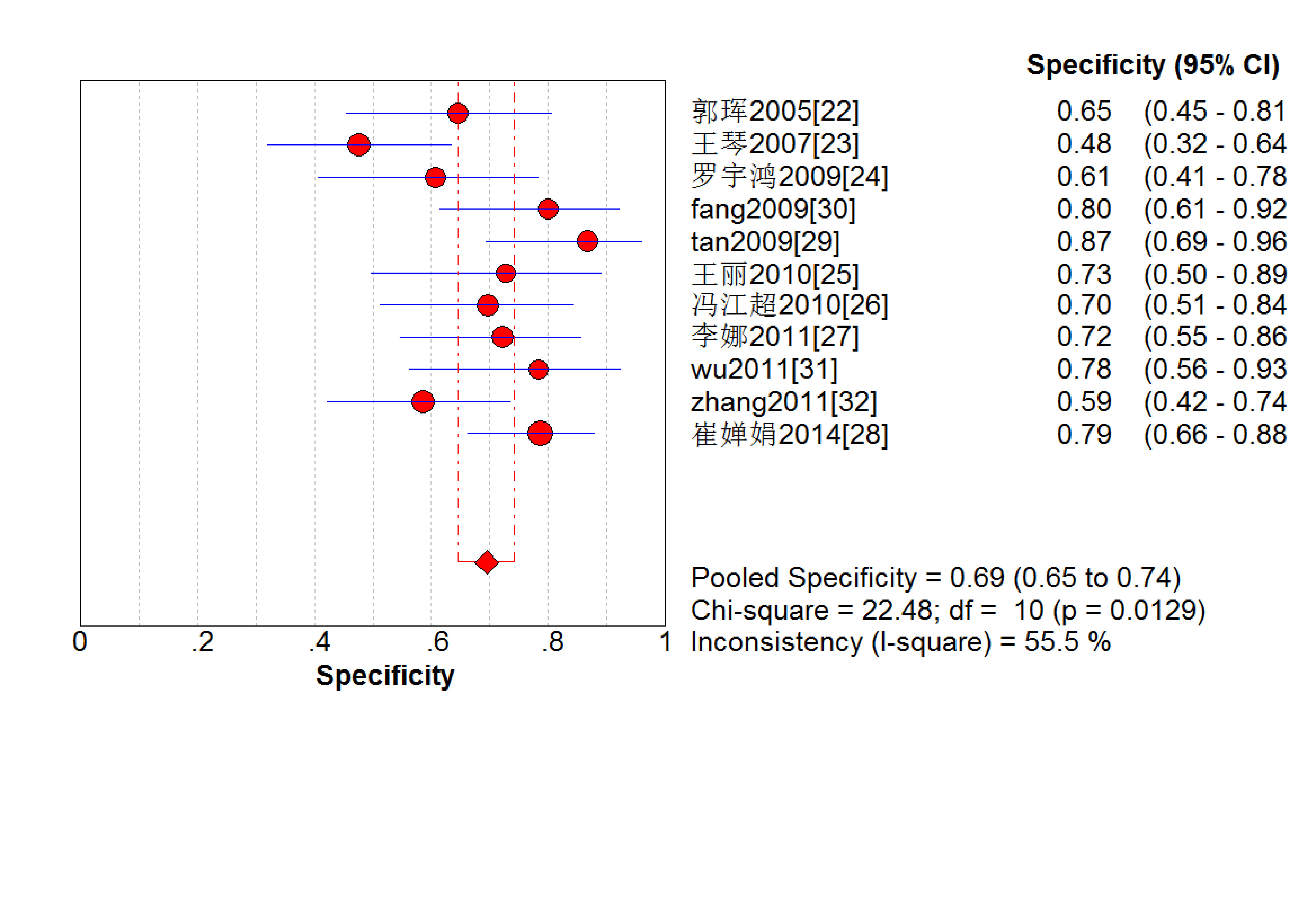 圖2
血清抗C1q抗體診斷LN特異度的Meta分析
圖2
血清抗C1q抗體診斷LN特異度的Meta分析
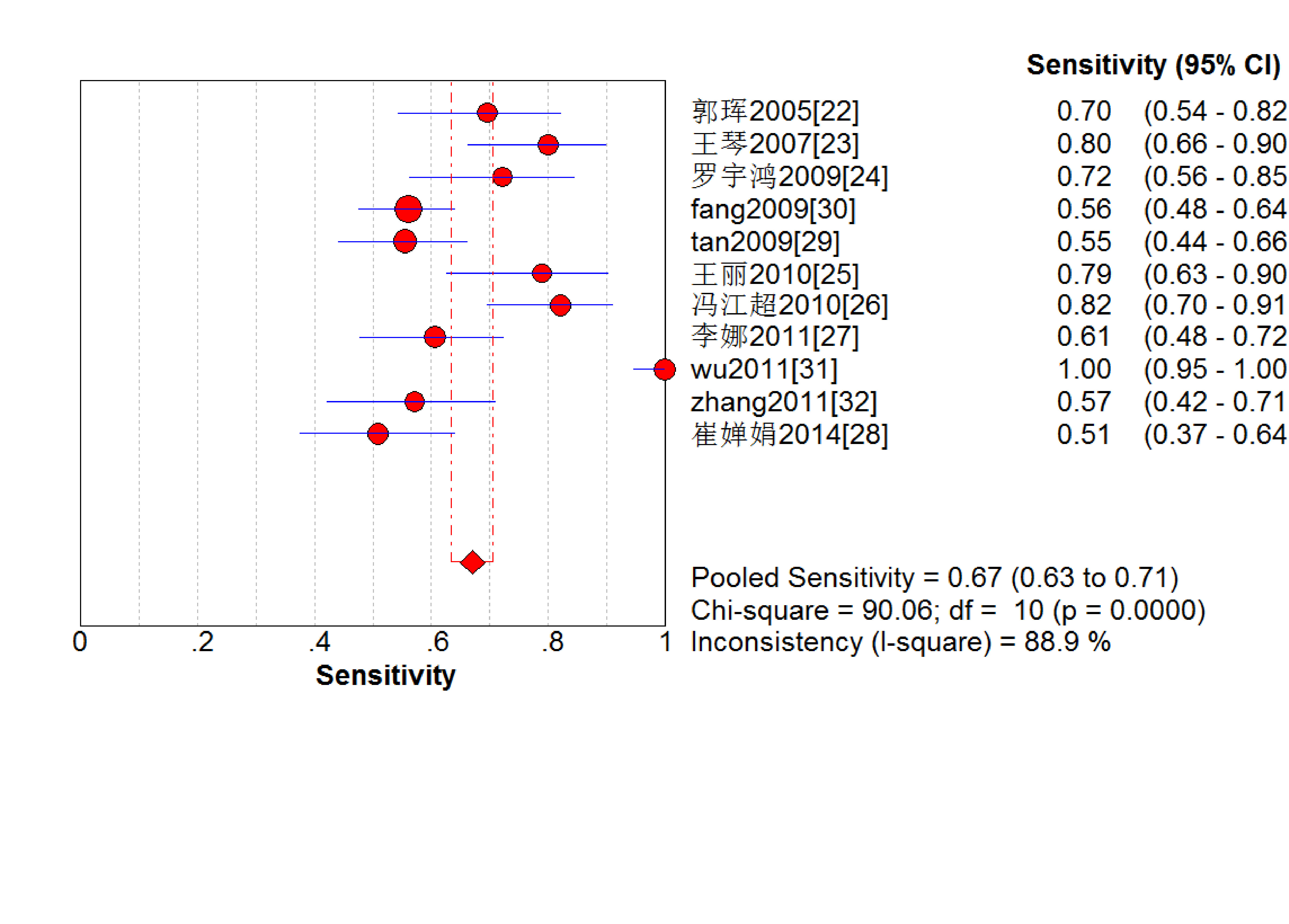 圖3
血清抗C1q抗體診斷LN敏感度的Meta分析
圖3
血清抗C1q抗體診斷LN敏感度的Meta分析
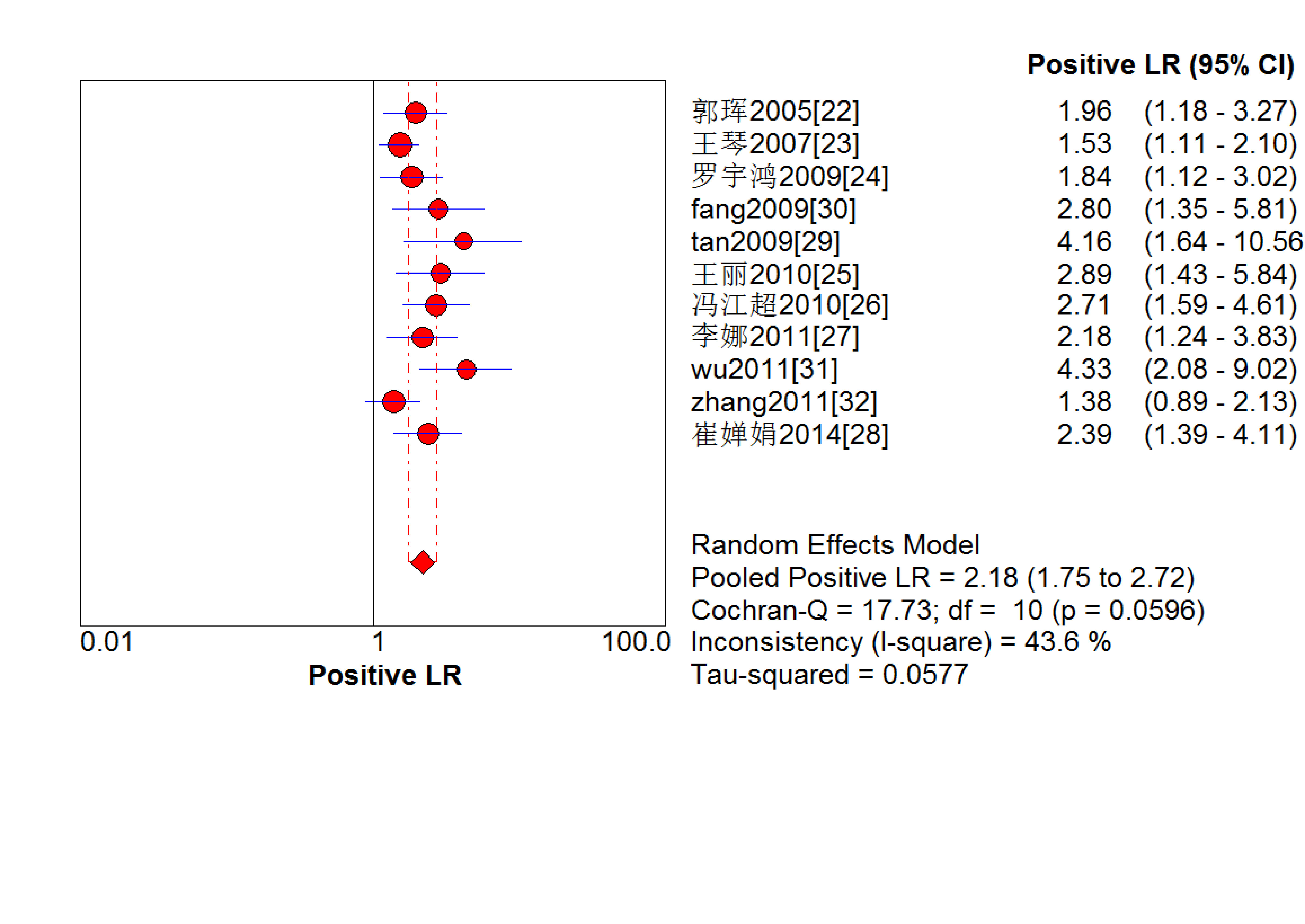 圖4
血清抗C1q抗體診斷LN陽性似然比的Meta分析
圖4
血清抗C1q抗體診斷LN陽性似然比的Meta分析
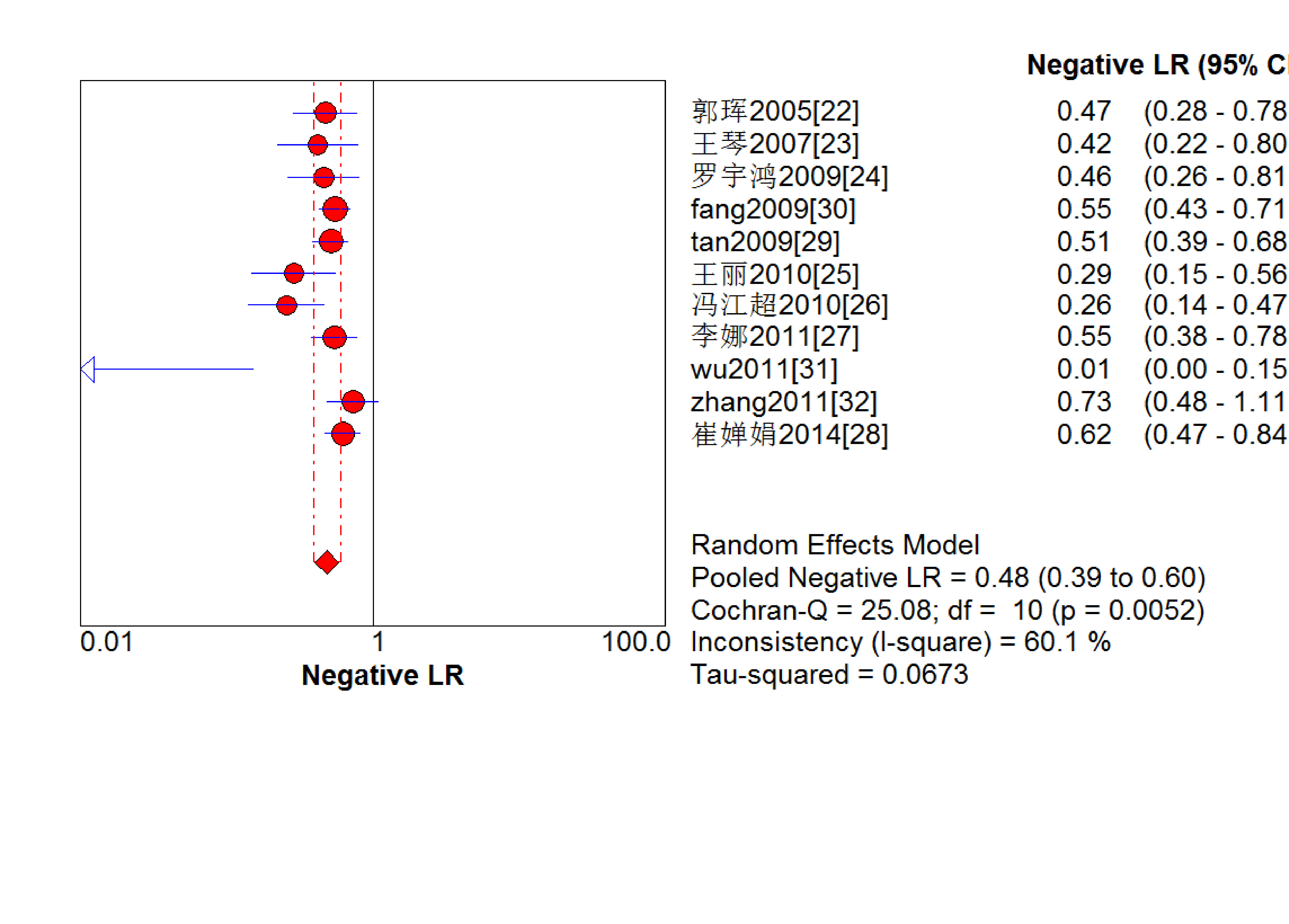 圖5
血清抗C1q抗體診斷LN陰性似然比的Meta分析
圖5
血清抗C1q抗體診斷LN陰性似然比的Meta分析
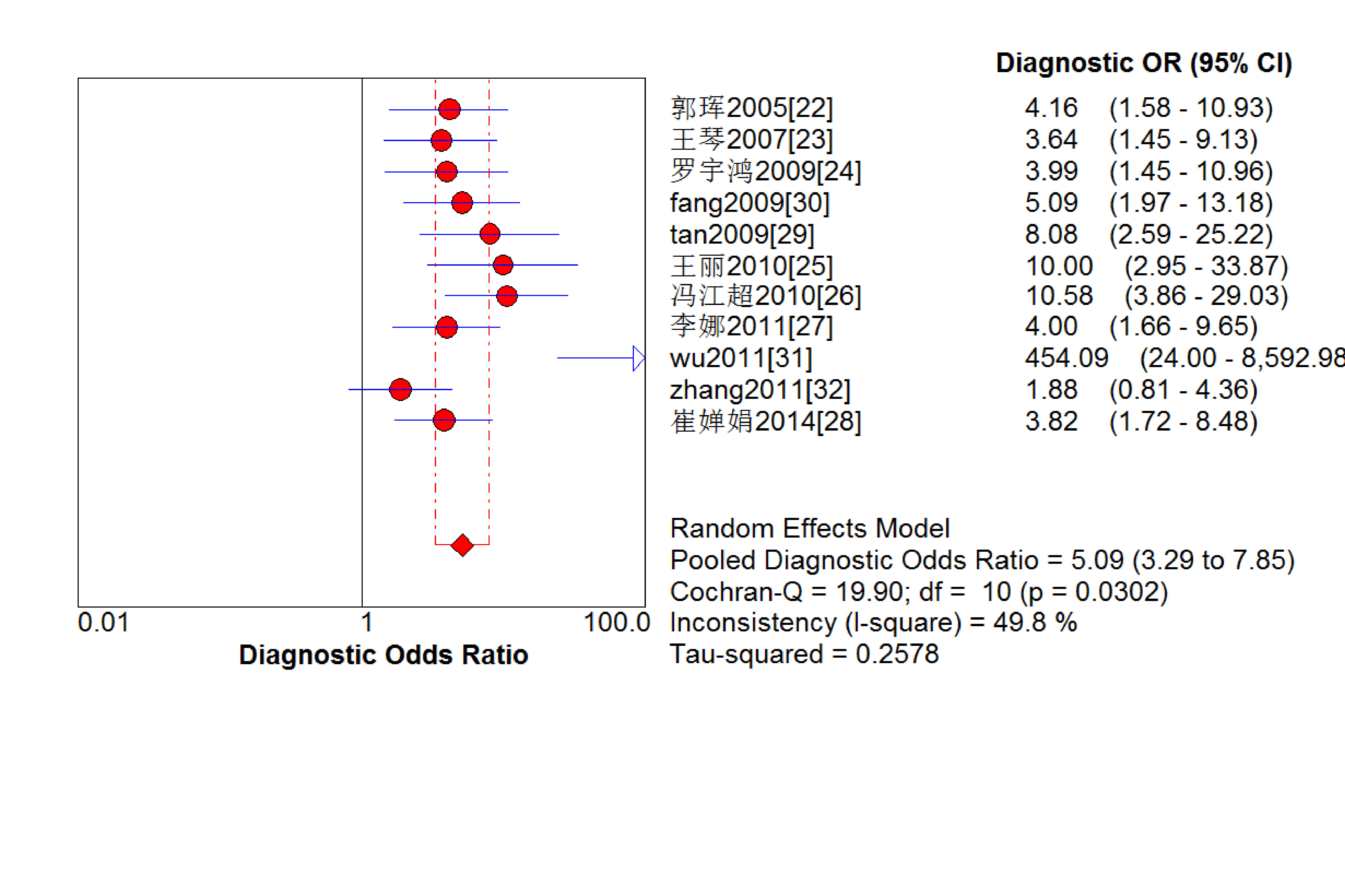 圖6
血清抗C1q抗體診斷LN診斷比值比的Meta分析
圖6
血清抗C1q抗體診斷LN診斷比值比的Meta分析
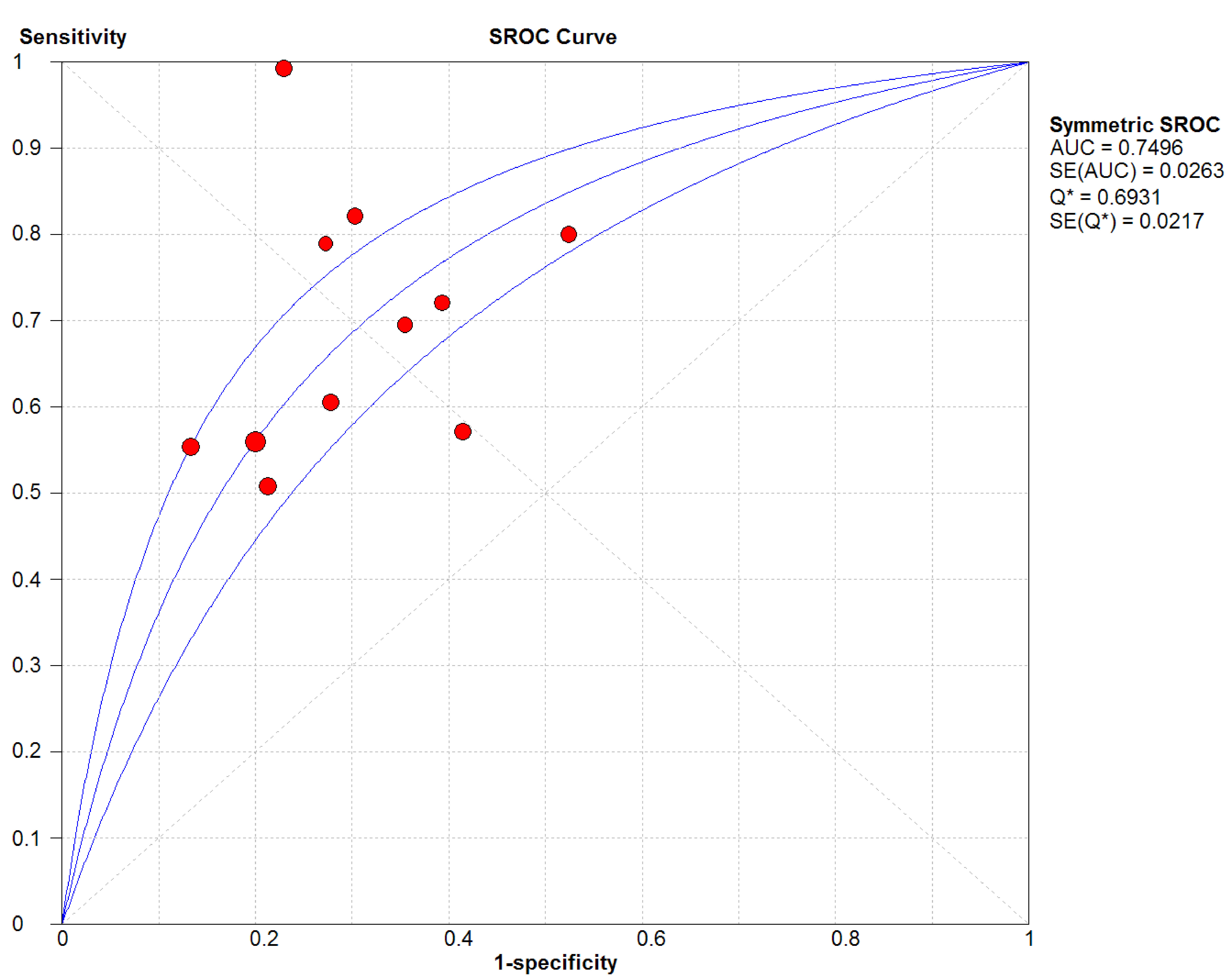 圖7
血清抗C1q抗體診斷LN的SROC曲線
圖7
血清抗C1q抗體診斷LN的SROC曲線
2.3.3 亞組分析和敏感性分析結果
由于各研究間存在異質性,我們對可能引起異質性的3個變量進行了亞組分析。① QUADAS分值:分為QUADAS≥ 10和QUADAS<10兩個亞組,相對診斷比值比(RDOR)為:1.01[95%CI(0.70,1.45),P=0.969 1]。② 樣本量:分為n≥ 90和n<90兩個亞組,RDOR=1.01 [95%CI(0.97,1.04),P=0.568 8]。③ 年齡:分為兒童組、成年組、未報告組3組,RDOR=1.42[95%CI(0.07,28.82),P=0.786 9]。亞組分析結果顯示,方法學質量高低、樣本量大小及年齡對抗C1q自身抗體診斷LN的準確性無明顯影響。
逐一剔除可能導致異質性的研究(如李娜等 [27]、Tan等 [29]、Wu等 [31])進行敏感性分析,結果顯示,合并的Sen、Spe、DOR等均無明顯變化,提示本研究結果的穩定性較好。
2.3.4 發表偏倚
Egger’s檢驗結果顯示t=5.34[95%CI(2.87,7.10)],P=0.000,有統計學意義,提示存在發表偏倚的潛在可能;Begg’s檢驗結果顯示Z=2.80,Pr=0.005,有統計學意義,也提示存在發表偏倚的潛在可能。
3 討論
補體分子C1q是補體經典激活途徑中的啟動蛋白,作為第一組成單位,具有調節各種免疫細胞反應的能力 [3]。當血清中出現抗C1q抗體時,C1q分子的抗原決定簇膠原樣區(collagen-like region,CLR)與抗C1q抗體結合,導致免疫復合物和細胞凋亡產物的清除發生障礙,從而刺激機體免疫系統產生更多的抗體,出現疾病的活動 [33, 34]。在LN患者中,大量的補體被激活,明顯增加了C1q的產生,繼而形成了抗C1q抗體 [35],抗C1q抗體進一步與自身抗原結合形成大量免疫復合物廣泛沉積于腎小球系膜區和毛細血管外,也可同時沉積于腎小管基底膜和小動脈壁而導致腎小球和腎小管間質損害 [36]。對LN患者而言,侵入性腎臟穿刺活組織病理學檢查是確診LN的金標準,但由于各種人為或非人為因素,仍有相當一部分患者無法行腎活檢,使得LN的診斷和治療存在不確定性。因此,尋找更精確的診斷指標在臨床上顯得至關重要。采用ELISA法檢測抗C1q抗體操作簡便、快捷,對檢測人員要求不高,易定量及自動化大規模檢測,對于因各種原因如凝血功能異常等無法做腎活檢的LN患者,檢測血清中抗C1q抗體的濃度成為評估LN的一個切實可行的選擇。
本研究結果顯示,匯總Sen、Spe、+LR、-LR和DOR存在高度異質性。但ROC平面圖和Spearman相關分析均提示不存在閾值效應。我們進一步分析了非閾值效應所致異質性的相關因素,發現樣本量、研究質量和年齡均不是非閾值效應所致異質性的原因。此外,有研究顯示抗C1q抗體水平與年齡無相關性 [37]。我們推測,產生異質性的原因可能包括:研究設計不同,ELISA法檢測抗C1q抗體濃度的技術掌握程度不同,選擇的檢測儀器、實驗室和實驗者不同,血標本的處理及規范不一致,且設定的陽性值不同,另外,SLE治療中激素及免疫抑制劑的使用使得抗C1q抗體的檢出率降低 [38]也是可能原因之一。
本研究的局限性:① 由于存在并發癥等潛在風險,并非所有患者均能行腎活檢診斷及評判LN的活動性,因此,作者采用SLE疾病活動性評分(systemic lupus erythematosus disease active index,SLEDAI)代替腎活檢定義LN及其活動性。這在一定程度可能導致金標準判讀偏倚,從而影響Meta分析結果的可靠性。② 已有文獻報告抗C1q抗體在增殖性LN中比非增殖性LN水平高 [8, 10, 37-39],Fang等 [30]的研究結果也表明,抗C1q抗體水平在彌漫增殖型腎病(Ⅳ型)患者較非彌漫增殖型腎病患者(Ⅱ+Ⅲ型、Ⅴ型)高。崔嬋娟等 [25]的研究再次證明,抗C1q抗體能客觀反應SLE的疾病活動性,有效指導LN病理分型,尤其是Ⅳ型LN。此外,Yin等 [15]的Meta分析證實,活動性LN比非活動性LN有更高水平的抗C1q抗體,Moroni等 [38]的研究也證實,抗C1q抗體與LN的活動性相關。但本Meta分析中,由于無法提取出以上資料,無法做增殖性LN與非增殖性LN,活動性LN與非活動性LN血清中抗C1q抗體水平的Meta分析,需今后的原始研究報告相關數據后進行評價。③ 由于納入研究數量有限,質量參差不齊,高質量研究不多,會在一定程度上影響Meta分析結果的可靠性。
本Meta分析與Yin等 [15]的Meta分析及Eggleton等 [16]的Meta分析結果相似,表明國家和種族差異并未影響相關的結果。
目前抗C1q抗體是否與LN的疾病活動性相關仍未達成共識 [12, 38, 40],本研究中,郭輝等 [22]、馮江超等 [26]、李娜等 [27]及羅宇鴻等 [24]的研究結果證實了抗C1q抗體、抗核小體抗體及IL-18的濃度與LN患者的SLEDAI評分呈正相關。王琴等 [23]、崔嬋娟等 [28]的研究結果表明,血清中抗C1q抗體與抗dsDNA抗體聯合檢測可提高LN及其活動性診斷的特異性,這與Yang等 [41]和Moroni等 [38]的研究結果一致。
綜上所述,抗C1q抗體陽性表明患LN的可能性為67.0%,誤診率為31.0%。疑似病例陰性者漏診率高達33.0%,因此,對于臨床疑診LN而檢測抗C1q抗體為陰性者,需要進一步檢查確認。本研究結果推薦抗C1q抗體用于LN的輔助診斷,僅適合與其他臨床指標如抗dsDNA抗體、抗核小體抗體及抗ANA抗體等聯合確診。今后的研究應采用統一的檢測方法及陽性標準,將活動性與非活動性LN、增殖性與非增殖性LN患者的資料分別列出,以為臨床決策提供更具參考價值的證據。
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種累及全身的多系統自身免疫性疾病,狼瘡性腎炎(lupus nephritis,LN)是SLE伴發的腎臟損害,是SLE常見且嚴重的并發癥之一。對于SLE患者,腎臟受累及進行性腎功能損害仍是其主要的死亡原因之一 [1]。有研究報道,LN是由免疫、遺傳、感染、射線、內分泌、藥物、環境等多因素共同作用的結果,這種作用激活了T細胞,而活化的T細胞進一步激活B細胞,導致過多的自身抗體產生,最終自身抗體的產生及免疫復合物在腎臟的沉積導致LN發病 [2]。
抗C1q抗體是補體經典激活途徑中的啟動蛋白分子C1q的相應抗體,1984年在SLE患者的血清中首次檢出 [3]。自此,抗C1q抗體被報道出現在多種自身免疫性疾病和一些感染性疾病中,甚至出現在健康個體中 [4-7]。
在過去十幾年中,大量研究發現外周血清中的抗C1q抗體與LN疾病的活動性及嚴重程度相關[8-11]。一些研究發現抗C1q抗體在診斷LN中比傳統的血清標志物,如anti-dsDNA、C3和C4,有更高的敏感度和特異度 [12, 13]。然而,也有一些研究認為血清抗C1q抗體的水平與LN的發病機制無明顯相關性 [14]。因此,抗C1q抗體是否參與LN疾病的發展和是否為診斷LN的重要指標仍頗具爭議。
Yin等 [15]及Eggleton等 [16]已對抗C1q抗體在LN診斷中的價值進行了Meta分析,但目前缺乏抗C1q自身抗體對中國人群LN診斷價值的系統評價。故我們采用搜集血清中抗C1q抗體在中國人群中診斷LN的診斷性試驗進行系統評價和Meta分析,以期為中國人群LN的診斷提供參考依據。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型
國內外已發表的抗C1q抗體診斷LN診斷價值的診斷性試驗。文種限中、英文。
1.1.2 研究對象
疑似LN的SLE患者。SLE的診斷符合1997年美國風濕病學會(ACR)分類標準 [17]或1982年修訂的SLE診斷標準 [18]。患者為中國人群,其年齡、性別、民族及教育程度不限。
1.1.3 診斷方法
LN診斷的金標準為臨床上有LN活動表現或經腎活檢確診,待評價診斷方法為ELISA法檢測血清抗C1q抗體水平。
1.1.4 結局指標
敏感度(Sen)、特異度(Spe)、陽性似然比(+LR)、陰性似然比(-LR)、診斷比值比(DOR)、綜合受試者工作特征曲線(SROC)下面積(AUC)及Q*指數。
1.1.5 排除標準
① 不能獲得完整的診斷四格表數據或無原始數據的文獻;② 重復發表的文獻;③ 納入病例數少于10例。
1.2 檢索策略
計算機檢索PubMed、EMbase、CNKI、The Cochrane Library、VIP和WanFang Data數據庫,檢索時限均為建庫至2015年3月1日,搜集血清抗C1q抗體檢測用于中國人群LN診斷的診斷性試驗。此外,追溯納入研究的參考文獻,以補充獲取相關文獻。英文檢索詞包括systemic lupus erythematosus/ SLE、lupus nephritis/ LN、C1q、anti-C1q、meta-analysis;中文檢索詞包括抗C1q抗體、系統性紅斑狼瘡、狼瘡腎炎。
1.3 文獻篩選及資料提取
由2位評價員獨立按納入與排除標準篩選文獻和提取資料,并交叉核對,如遇分歧,則交由第三位研究者協助判斷,缺乏的資料盡量與原作者聯系予以補充。文獻篩選首先閱讀文題和摘要,在排除明顯不符合納入標準的文獻后,進一步閱讀全文進行復篩,以決定是否納入。資料提取的主要內容包括:① 納入研究的基本信息,包括研究題目、第一作者、發表時間、研究地區、樣本量等;② 研究對象的基本特征,包括患者性別、年齡、病程等;③ 待評價試驗的檢測方法、試劑來源、金標準、臨界值、診斷四格表數據等。
1.4 納入研究的方法學質量評價
由2名評價員按照Whiting等[19]制定的QUADAS工具,從偏倚(條目3~7、10~12、14)、變異(條目1~2)、報告質量(條目8~9、13)三方面對納入研究的方法學質量進行評價。如遇分歧,則討論解決或交由第三位研究者裁決。
1.5 統計分析
采用 Meta-Disc 1.4軟件進行Meta分析,Meta分析的檢驗水準設為α=0.05。首先采用Spearman相關分析檢驗有無閾值效應引起的異質性,若P>0.05,提示無閾值效應;若P<0.05,提示存在閾值效應所致異質性。若無閾值效應,則進一步分析有無其他原因所致異質性,并采用固定或隨機效應模型進行Meta分析,計算合并的Sen、Spe、+LR、-LR和DOR,繪制SROC曲線,并計算曲線下面積(AUC)和Q*指數;若存在閾值效應,則僅計算合并的DOR,通過繪制SROC曲線并計算AUC來判斷其診斷價值。采用Deville等 [20]的方法進行敏感性分析。采用Stata 11.0軟件,使用Egger’s檢驗和Egger’s檢驗進行發表偏倚分析 [21]。
2 結果
2.1 文獻檢索結果
初檢出相關文獻775篇,經逐層篩選后,最終納入11個研究 [22-32],共1 084例SLE患者。文獻篩選流程及結果見圖 1。
 圖1
文獻篩選流程及結果
圖1
文獻篩選流程及結果
2.2 納入研究的基本特征與方法學質量評價
2.3 Meta分析結果
2.3.1 異質性檢驗
ROC平面圖分析結果顯示,不呈“肩臂狀”分布,進一步計算Sen和(1-Spe)對數的Spearman相關系數為0.445,P=0.170,提示不存在閾值效應。因各研究結果間存在非閾值效應所致異質性,故采用隨機效應模型進行Meta分析。
2.3.2 合并分析結果
結果見圖 2~7。抗C1q抗體診斷LN的合并Sen、Spe、DOR、+LR和-LR分別為0.67[95%CI (0.63,0.71)]、0.69[95%CI (0.65,0.74)]、5.09[95%CI(3.29,7.85)]、2.18[95%CI(1.75,2.72)]和0.48[95%CI(0.39,0.60)],SROC AUC=0.749 6,Q*=0.693 1。抗C1q抗體診斷LN的平均漏診率為33.0%,平均誤診率為31.0%。
 圖2
血清抗C1q抗體診斷LN特異度的Meta分析
圖2
血清抗C1q抗體診斷LN特異度的Meta分析
 圖3
血清抗C1q抗體診斷LN敏感度的Meta分析
圖3
血清抗C1q抗體診斷LN敏感度的Meta分析
 圖4
血清抗C1q抗體診斷LN陽性似然比的Meta分析
圖4
血清抗C1q抗體診斷LN陽性似然比的Meta分析
 圖5
血清抗C1q抗體診斷LN陰性似然比的Meta分析
圖5
血清抗C1q抗體診斷LN陰性似然比的Meta分析
 圖6
血清抗C1q抗體診斷LN診斷比值比的Meta分析
圖6
血清抗C1q抗體診斷LN診斷比值比的Meta分析
 圖7
血清抗C1q抗體診斷LN的SROC曲線
圖7
血清抗C1q抗體診斷LN的SROC曲線
2.3.3 亞組分析和敏感性分析結果
由于各研究間存在異質性,我們對可能引起異質性的3個變量進行了亞組分析。① QUADAS分值:分為QUADAS≥ 10和QUADAS<10兩個亞組,相對診斷比值比(RDOR)為:1.01[95%CI(0.70,1.45),P=0.969 1]。② 樣本量:分為n≥ 90和n<90兩個亞組,RDOR=1.01 [95%CI(0.97,1.04),P=0.568 8]。③ 年齡:分為兒童組、成年組、未報告組3組,RDOR=1.42[95%CI(0.07,28.82),P=0.786 9]。亞組分析結果顯示,方法學質量高低、樣本量大小及年齡對抗C1q自身抗體診斷LN的準確性無明顯影響。
逐一剔除可能導致異質性的研究(如李娜等 [27]、Tan等 [29]、Wu等 [31])進行敏感性分析,結果顯示,合并的Sen、Spe、DOR等均無明顯變化,提示本研究結果的穩定性較好。
2.3.4 發表偏倚
Egger’s檢驗結果顯示t=5.34[95%CI(2.87,7.10)],P=0.000,有統計學意義,提示存在發表偏倚的潛在可能;Begg’s檢驗結果顯示Z=2.80,Pr=0.005,有統計學意義,也提示存在發表偏倚的潛在可能。
3 討論
補體分子C1q是補體經典激活途徑中的啟動蛋白,作為第一組成單位,具有調節各種免疫細胞反應的能力 [3]。當血清中出現抗C1q抗體時,C1q分子的抗原決定簇膠原樣區(collagen-like region,CLR)與抗C1q抗體結合,導致免疫復合物和細胞凋亡產物的清除發生障礙,從而刺激機體免疫系統產生更多的抗體,出現疾病的活動 [33, 34]。在LN患者中,大量的補體被激活,明顯增加了C1q的產生,繼而形成了抗C1q抗體 [35],抗C1q抗體進一步與自身抗原結合形成大量免疫復合物廣泛沉積于腎小球系膜區和毛細血管外,也可同時沉積于腎小管基底膜和小動脈壁而導致腎小球和腎小管間質損害 [36]。對LN患者而言,侵入性腎臟穿刺活組織病理學檢查是確診LN的金標準,但由于各種人為或非人為因素,仍有相當一部分患者無法行腎活檢,使得LN的診斷和治療存在不確定性。因此,尋找更精確的診斷指標在臨床上顯得至關重要。采用ELISA法檢測抗C1q抗體操作簡便、快捷,對檢測人員要求不高,易定量及自動化大規模檢測,對于因各種原因如凝血功能異常等無法做腎活檢的LN患者,檢測血清中抗C1q抗體的濃度成為評估LN的一個切實可行的選擇。
本研究結果顯示,匯總Sen、Spe、+LR、-LR和DOR存在高度異質性。但ROC平面圖和Spearman相關分析均提示不存在閾值效應。我們進一步分析了非閾值效應所致異質性的相關因素,發現樣本量、研究質量和年齡均不是非閾值效應所致異質性的原因。此外,有研究顯示抗C1q抗體水平與年齡無相關性 [37]。我們推測,產生異質性的原因可能包括:研究設計不同,ELISA法檢測抗C1q抗體濃度的技術掌握程度不同,選擇的檢測儀器、實驗室和實驗者不同,血標本的處理及規范不一致,且設定的陽性值不同,另外,SLE治療中激素及免疫抑制劑的使用使得抗C1q抗體的檢出率降低 [38]也是可能原因之一。
本研究的局限性:① 由于存在并發癥等潛在風險,并非所有患者均能行腎活檢診斷及評判LN的活動性,因此,作者采用SLE疾病活動性評分(systemic lupus erythematosus disease active index,SLEDAI)代替腎活檢定義LN及其活動性。這在一定程度可能導致金標準判讀偏倚,從而影響Meta分析結果的可靠性。② 已有文獻報告抗C1q抗體在增殖性LN中比非增殖性LN水平高 [8, 10, 37-39],Fang等 [30]的研究結果也表明,抗C1q抗體水平在彌漫增殖型腎病(Ⅳ型)患者較非彌漫增殖型腎病患者(Ⅱ+Ⅲ型、Ⅴ型)高。崔嬋娟等 [25]的研究再次證明,抗C1q抗體能客觀反應SLE的疾病活動性,有效指導LN病理分型,尤其是Ⅳ型LN。此外,Yin等 [15]的Meta分析證實,活動性LN比非活動性LN有更高水平的抗C1q抗體,Moroni等 [38]的研究也證實,抗C1q抗體與LN的活動性相關。但本Meta分析中,由于無法提取出以上資料,無法做增殖性LN與非增殖性LN,活動性LN與非活動性LN血清中抗C1q抗體水平的Meta分析,需今后的原始研究報告相關數據后進行評價。③ 由于納入研究數量有限,質量參差不齊,高質量研究不多,會在一定程度上影響Meta分析結果的可靠性。
本Meta分析與Yin等 [15]的Meta分析及Eggleton等 [16]的Meta分析結果相似,表明國家和種族差異并未影響相關的結果。
目前抗C1q抗體是否與LN的疾病活動性相關仍未達成共識 [12, 38, 40],本研究中,郭輝等 [22]、馮江超等 [26]、李娜等 [27]及羅宇鴻等 [24]的研究結果證實了抗C1q抗體、抗核小體抗體及IL-18的濃度與LN患者的SLEDAI評分呈正相關。王琴等 [23]、崔嬋娟等 [28]的研究結果表明,血清中抗C1q抗體與抗dsDNA抗體聯合檢測可提高LN及其活動性診斷的特異性,這與Yang等 [41]和Moroni等 [38]的研究結果一致。
綜上所述,抗C1q抗體陽性表明患LN的可能性為67.0%,誤診率為31.0%。疑似病例陰性者漏診率高達33.0%,因此,對于臨床疑診LN而檢測抗C1q抗體為陰性者,需要進一步檢查確認。本研究結果推薦抗C1q抗體用于LN的輔助診斷,僅適合與其他臨床指標如抗dsDNA抗體、抗核小體抗體及抗ANA抗體等聯合確診。今后的研究應采用統一的檢測方法及陽性標準,將活動性與非活動性LN、增殖性與非增殖性LN患者的資料分別列出,以為臨床決策提供更具參考價值的證據。