引用本文: 鄧海霞, 李平, 陳俊文. 無哮喘的變應性支氣管肺曲霉病一例. 中國呼吸與危重監護雜志, 2023, 22(8): 583-586. doi: 10.7507/1671-6205.202109017 復制
變應性支氣管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)是人體對寄生于氣道內的曲霉發生超敏反應的一種肺部疾病,近年來僅在支氣管哮喘(1%~3.5%)、囊性纖維化(2%~9%)中提及ABPA的發病率[1],無肺部基礎疾病的ABPA患者罕見[2]。ABPA缺乏特異性的臨床表現,易造成漏診、誤診,確診時往往已經造成了支氣管及肺部組織的破壞。本文報道了1例無哮喘或囊性纖維化等肺部疾病的ABPA患者的診治過程,以期提高臨床醫生對ABPA的認識。
1 臨床資料
患者男,37歲,裝修木工。因“咳嗽、咳痰1個月”于2019-12-16入我院。1個月前,患者無明顯誘因出現咳嗽、咳黃褐色痰栓,無發熱、鼻塞、流涕、盜汗、咯血等其他癥狀,就診于襄陽市中醫院,給予抗炎、抗過敏等藥物治療后癥狀未見好轉。發病以來,大小便正常,體重無明顯改變。有過敏性鼻炎病史3年,無食物及藥物過敏史。
查體:體溫36.8℃,呼吸20次/min,脈搏93次/min、血壓 109/78 mm Hg(1 mm Hg=0.133 kPa)。雙肺呼吸音粗,右肺可聞及少量濕性啰音,心率93次/min,心律齊,各瓣膜區未聞及病理性雜音,腹平軟,肝脾肋下未觸及,雙下肢不腫。
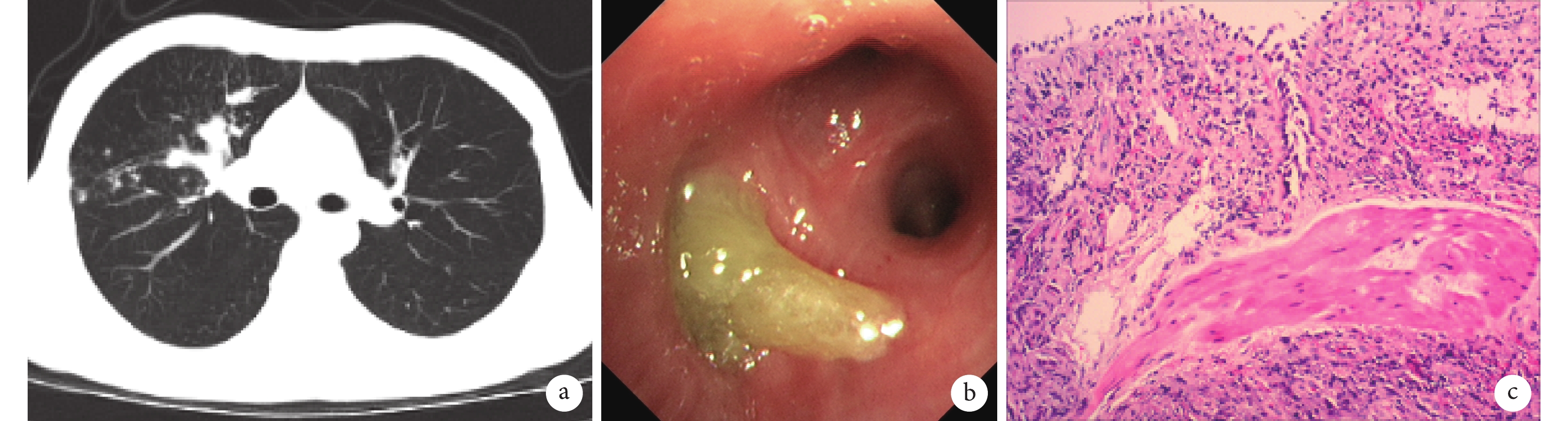
輔助檢查:2019-11-20在湖北省襄陽市中醫院行胸CT示右肺中上葉感染性病變。2019-12-11復查胸部CT示右肺中上葉感染性病變較前進展。2019-12-16我院實驗室檢查血常規:白細胞計數5.94×109/L[參考范圍(3.5~9.5)×109/L],嗜酸性粒細胞絕對數0.81×109/L[參考范圍(0.02~0.52)×109/L];降鈣素原(procalcitonin,PCT)<0.05 ng/mL(參考范圍:<0.1 ng/mL);紅細胞沉降率65 mm/1 h[參考范圍:(0~15)mm/1 h];肺癌全套:未見異常;血清G試驗<50 pg/mL(參考值:100 pg/mL);血清GM試驗:煙曲霉菌硫氧還原抗體IgG(+),念珠菌烯醇化酶抗體IgG(–);總IgE>1000 IU/mL[參考范圍(4~210)IU/mL];肺炎支原體抗體(–);肺炎衣原體抗體(–);結核基因X-PERT檢測示:MTB-DNA(–)、RIF(–)、rpoB-A(–)、rpoB-B(–)、rpoB-C(–)、rpoB-D(–)、rpoB-E(–)。心電圖:竇性心律,正常心電圖;胸部CT示右肺中上葉黏液嵌塞癥及相應支氣管輕度擴張(圖1a);肺功能測定正常;支氣管舒張試驗(–)。2019-12-20支氣管鏡檢查:右上葉前段支氣管開口痰栓堵塞(圖1b);支氣管肺泡灌洗液GM試驗:煙曲霉菌硫氧還原抗體IgG(+)、念珠菌烯醇化酶抗體IgG(–);支氣管鏡活檢:(右肺)氣道黏膜組織慢性炎癥,間質散在嗜酸性粒細胞浸潤(圖1c)。診斷考慮:ABPA,過敏性鼻炎。
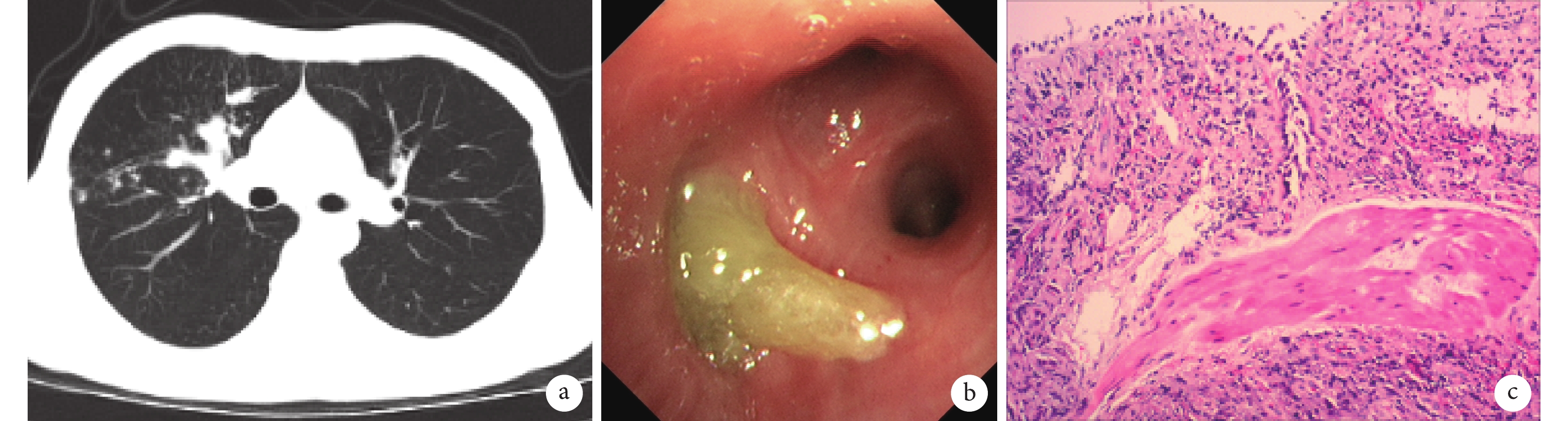 圖1
ABPA 患者治療前的相關檢查
圖1
ABPA 患者治療前的相關檢查
a. 胸部CT示右肺中上葉黏液嵌塞癥及相應支氣管輕度擴張;b. 電子支氣管鏡檢查示右上葉前段支氣管開口痰栓堵塞;c. 右肺組織活檢病理示:氣道黏膜組織慢性炎癥,間質散在嗜酸性粒細胞浸潤(蘇木精–伊紅染色×200)。
治療:(1)患者病程長且出現氣道結構改變,首先需要遠離工作環境。(2)建議使用激素聯合抗真菌藥物治療。患者考慮到激素的相關不良反應而拒絕激素治療,僅單用抗真菌治療(伏立康唑片,首日負荷劑量,維持劑量200 mg/次,2次/d)。口服伏立康唑片3 d后咳嗽、咳痰明顯減少,囑其出院后定期復查。
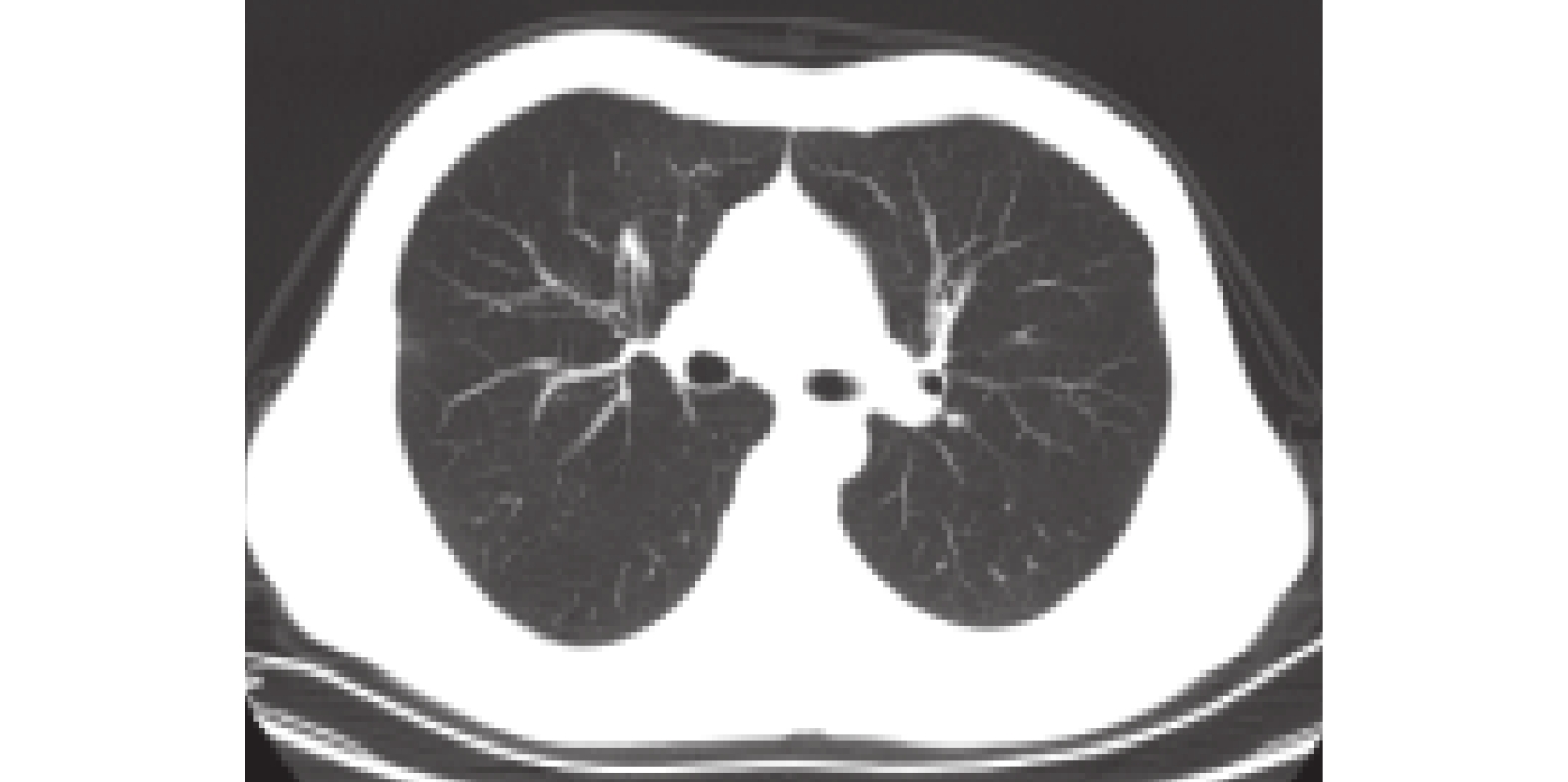
隨訪及后續治療:患者每月來我院復查,訴每月大部分時間表現正常,僅有3~5 d咳嗽,咳少量黃褐色顆粒樣痰,每月復查肝腎功能電解質均正常,胸部CT示病灶較前吸收減小。2020-08-18支氣管鏡檢查示右上葉前段支氣管開口痰栓堵塞,囑繼續規律服用伏立康唑片。2020-08-22患者咳嗽、咳黃褐色痰栓癥狀再發加重,建議患者加用激素治療,患者仍拒絕。2020-08-26前往復旦大學附屬中山醫院查血常規:白細胞計數5.19×109/L,中性粒細胞計數3.1×109/L,中性粒細胞百分比60.2%,嗜酸性粒細胞百分比8.9%;總IgE 4611 IU/mL,高敏C反應蛋白62.5 mg/L,紅細胞沉降率35 mm/1 h,PCT 0.07 ng/L,痰涂片找真菌(–);胸部CT示右肺上葉前段可見團塊狀高密度影,相應支氣管腔輕度擴張;2020-8-27支氣管鏡肺活檢:見支氣管壁及肺泡組織,支氣管黏膜固有膜內較多淋巴細胞浸潤,另見成片炎性滲出物,考慮炎癥性病變;灌洗液及肺組織涂片:細菌(–),真菌(–),抗酸桿菌(–);灌洗液高通量測序檢測:黃曲霉(嚴格序列數2條);肺組織培養:草綠色鏈球菌少量生長。最終診斷為ABPA。采取甲潑尼龍0.5 mg·kg–1·d–1,每隔2周減量4 mg聯合伏立康唑片0.2 g每日2次。2020-09-29第一次隨訪患者基本無咳嗽、咳痰,復查總IgE 807 IU/mL,嗜酸性粒細胞絕對數0/L,胸部CT示團塊狀高密度影較前明顯吸收變小,遂停用伏立康唑片。2020-11-03第二次隨訪患者咳嗽、咳痰癥狀完全緩解,復查總IgE 308 IU/mL,嗜酸性粒細胞絕對數0.1×109/L,胸部CT示未見團塊影。2020-11-16第三次隨訪復查總IgE 282.05 IU/mL,嗜酸性粒細胞絕對數0.07×109/L,胸部CT無殘留病灶,遺留中心性柱狀支氣管擴張影(圖2)。于2020-12-26停用激素,服用激素達4個月。2021-2-24又出現咳嗽、咳少量黃色痰栓,查總IgE 631 IU/mL,胸部CT未見新發病灶,考慮ABPA復發,繼續服用甲潑尼龍12 mg,每月減4 mg直至停止。隨訪至2021年9月未再出現咳嗽、咳痰癥狀。
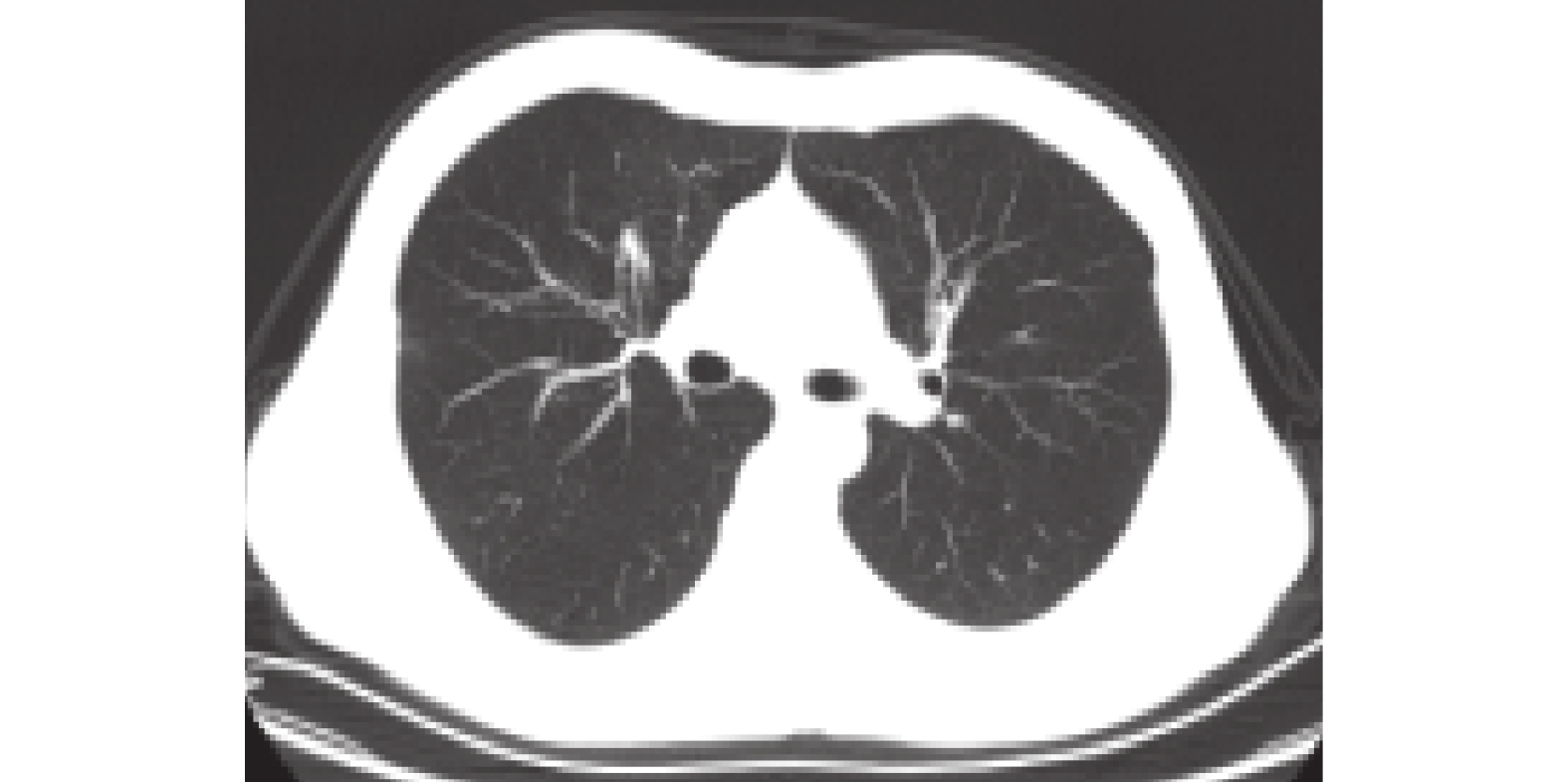 圖2
甲潑尼龍治療后胸部CT檢查像
圖2
甲潑尼龍治療后胸部CT檢查像
甲潑尼龍3個月后復查胸部CT示右肺中上葉病灶基本吸收消失,局部支氣管擴張程度較前減輕。
2 討論
ABPA是曲霉(最常見的是煙曲霉)引起的一種氣道超敏反應,多繼發于有哮喘等肺部基礎疾病的患者中,而無肺部基礎疾病的ABPA是極為少見的。2013年日本ABPA的全國性調查顯示358例的ABPA患者中19%無哮喘病史[3]。2017年印度學者回顧性分析530例ABPA患者[4],其中7%的患者無哮喘病史。因此,當出現相關免疫學指標升高及影像學改變時,即使無哮喘病史,也要考慮到ABPA可能。ABPA的臨床表現主為咳嗽、咳痰、喘息、胸悶等癥狀,咳黃褐色痰栓是其特異性的臨床表現,但不是所有患者均有[5],因此該疾病易漏診、誤診,延誤治療時機。
ABPA的發病機制尚未完全闡明,目前認為是基因與環境因素綜合作用的結果。對于正常人,吸入肺內的真菌孢子會被特異性抗體IgG和IgA清除;對于遺傳易感性患者,長期暴露于曲霉孢子的環境中將會引起ABPA。吸入肺的曲霉抗原激活CD4+ T淋巴細胞,增強白細胞介素(interleukin,IL)-4、IL-5、IL-13的基因表達,引起B淋巴細胞產生IgE,嗜酸性粒細胞聚集,肥大細胞脫顆粒,激發一系列炎癥反應,導致支氣管及肺組織的損傷,最終表現為支氣管擴張及肺纖維化[6-7],且支氣管擴張更易出現在無哮喘的ABPA中[4]。本例患者時有接觸霉變木材,有吸入曲霉的條件。規范治療后,后期隨訪未訴復發。因此,遠離曲霉的環境是減少ABPA復發的先決條件[8]。
中華醫學會呼吸病學分會哮喘學組制定的2017版《變應性支氣管肺曲霉病診治專家共識》[9]中的診斷標準:(1)相關疾病(至少符合1條):① 哮喘;② 其他,如支氣管擴張癥、慢阻肺、肺囊性纖維化等。(2)必需條件(2條均需符合):① 血清煙曲霉特異性IgE水平升高(>0.35 kUA/L)或煙曲霉皮試速發反應陽性;② 血清總IgE水平升高(>1000 U/mL)。(3)其他條件(至少符合2條):① 外周血嗜酸性粒細胞數>0.5×109/L(激素使用前的數值可作為診斷條件);② 影像學為一過性病變,包括實變、結節、牙膏征或指套征、游走性陰影等,持久性病變包括支氣管擴張、胸膜肺纖維化等;③ 血清煙曲霉特異性IgG或沉淀素陽性。無哮喘的ABPA診斷更為困難,經常被誤診為其他肺部疾病,如肺炎、肺結核、肺癌等。本例患者雖不滿足診斷ABPA所需的易感條件,但國際人類和動物真菌學協會指出,對無哮喘或囊性纖維化的患者,仍可以診斷ABPA[10];診斷ABPA最敏感的指標是煙曲霉特異性IgE抗體,也是篩查哮喘患者ABPA的首選方法。血清總IgE水平對ABPA的診斷和隨訪是一個重要的指標[11]。總IgE正常時,基本可排除ABPA。目前總IgE診斷界值還沒有統一標準,廣泛接受的是總IgE>1000 IU/mL,因此漏診幾率很大。由于我院對ABPA的檢測配置不完善,尚未開展皮膚曲霉試驗及曲霉特異性IgE檢查。但本例患者長期接觸霉變木材,咳黃褐色痰栓,實驗室檢查總IgE>1000 IU/mL,嗜酸性粒細胞絕對數0.81×109/L,煙曲霉菌硫氧還原抗體IgG(+),胸部CT示中心性支氣管擴張伴有黏液栓,病灶呈游走性。這基本符合ABPA的其他診斷標準。
無論哪種類型的ABPA,治療首選全身性糖皮質激素,但尚未有研究指導糖皮質激素的劑量及用藥療程。目前被采納的兩種方案:(1)潑尼松0.5 mg·kg–1·d–1,2周后改為隔日給藥,6~8周后每2周減量5~10 mg,直至停藥。(2)潑尼松0.75 mg·kg–1·d–1×6周,0.5 mg·kg–1·d–1×6周,之后每6周減量5 mg,總療程6~12個月。聯合抗真菌藥物,如伊曲康唑、伏立康唑或泊沙康唑等[4],可降低ABPA的急性加重頻率及減少糖皮質激素劑量[12]。研究表明血清型ABPA急性期患者口服糖皮質激素,緩解期吸入性糖皮質激素(inhaled corticosteroid,ICS)維持治療,5年內未見支氣管擴張形成[13];若直接使用ICS治療[14],6個月后癥狀未改善且總IgE水平增高99.3%,因此ICS不能作為急性期的一線治療。Agarwal等[15]對50例ABPA患者隨機分組進行強的松龍或伏立康唑片治療,6周和3個月后,兩組患者的療效、總IgE下降、肺功能和生活質量評分及首次發作時間均相似,且隨訪2年內發生急性加重的人數也基本相等。雖然這都是單中心小樣本研究,但研究均提出抗真菌藥物可能是治療急性期ABPA的替代藥物。從本例患者中可觀察到服用伏立康唑片期間臨床癥狀反復發作,總IgE水平未見下降,肺部浸潤影呈游走性出現。因此,對于單用抗真菌藥物治療ABPA的療效還需要多中心的研究進一步證實。對于少數不能耐受糖皮質激素的患者可使用抗IgE抗體靶向治療,例如奧馬珠單抗、貝那利珠單抗等,也取得較大益處,尤其在合并哮喘的患者中更明顯[16]。
ABPA是一種少見的疾病,目前對于難以控制的哮喘或囊性纖維化患者,經抗感染、止咳平喘等治療后癥狀未見緩解,最終診斷出ABPA難度不大;但對于無哮喘病史的患者,極易誤診為其他肺部疾病,確診過程多有延誤。希望通過我們的病例提高臨床醫生對無肺部基礎疾病的ABPA認識,在氣道結構改變之前明確診斷、規范治療、改善預后。
利益沖突:本研究不涉及任何利益沖突。
變應性支氣管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)是人體對寄生于氣道內的曲霉發生超敏反應的一種肺部疾病,近年來僅在支氣管哮喘(1%~3.5%)、囊性纖維化(2%~9%)中提及ABPA的發病率[1],無肺部基礎疾病的ABPA患者罕見[2]。ABPA缺乏特異性的臨床表現,易造成漏診、誤診,確診時往往已經造成了支氣管及肺部組織的破壞。本文報道了1例無哮喘或囊性纖維化等肺部疾病的ABPA患者的診治過程,以期提高臨床醫生對ABPA的認識。
1 臨床資料
患者男,37歲,裝修木工。因“咳嗽、咳痰1個月”于2019-12-16入我院。1個月前,患者無明顯誘因出現咳嗽、咳黃褐色痰栓,無發熱、鼻塞、流涕、盜汗、咯血等其他癥狀,就診于襄陽市中醫院,給予抗炎、抗過敏等藥物治療后癥狀未見好轉。發病以來,大小便正常,體重無明顯改變。有過敏性鼻炎病史3年,無食物及藥物過敏史。
查體:體溫36.8℃,呼吸20次/min,脈搏93次/min、血壓 109/78 mm Hg(1 mm Hg=0.133 kPa)。雙肺呼吸音粗,右肺可聞及少量濕性啰音,心率93次/min,心律齊,各瓣膜區未聞及病理性雜音,腹平軟,肝脾肋下未觸及,雙下肢不腫。
輔助檢查:2019-11-20在湖北省襄陽市中醫院行胸CT示右肺中上葉感染性病變。2019-12-11復查胸部CT示右肺中上葉感染性病變較前進展。2019-12-16我院實驗室檢查血常規:白細胞計數5.94×109/L[參考范圍(3.5~9.5)×109/L],嗜酸性粒細胞絕對數0.81×109/L[參考范圍(0.02~0.52)×109/L];降鈣素原(procalcitonin,PCT)<0.05 ng/mL(參考范圍:<0.1 ng/mL);紅細胞沉降率65 mm/1 h[參考范圍:(0~15)mm/1 h];肺癌全套:未見異常;血清G試驗<50 pg/mL(參考值:100 pg/mL);血清GM試驗:煙曲霉菌硫氧還原抗體IgG(+),念珠菌烯醇化酶抗體IgG(–);總IgE>1000 IU/mL[參考范圍(4~210)IU/mL];肺炎支原體抗體(–);肺炎衣原體抗體(–);結核基因X-PERT檢測示:MTB-DNA(–)、RIF(–)、rpoB-A(–)、rpoB-B(–)、rpoB-C(–)、rpoB-D(–)、rpoB-E(–)。心電圖:竇性心律,正常心電圖;胸部CT示右肺中上葉黏液嵌塞癥及相應支氣管輕度擴張(圖1a);肺功能測定正常;支氣管舒張試驗(–)。2019-12-20支氣管鏡檢查:右上葉前段支氣管開口痰栓堵塞(圖1b);支氣管肺泡灌洗液GM試驗:煙曲霉菌硫氧還原抗體IgG(+)、念珠菌烯醇化酶抗體IgG(–);支氣管鏡活檢:(右肺)氣道黏膜組織慢性炎癥,間質散在嗜酸性粒細胞浸潤(圖1c)。診斷考慮:ABPA,過敏性鼻炎。
 圖1
ABPA 患者治療前的相關檢查
圖1
ABPA 患者治療前的相關檢查
a. 胸部CT示右肺中上葉黏液嵌塞癥及相應支氣管輕度擴張;b. 電子支氣管鏡檢查示右上葉前段支氣管開口痰栓堵塞;c. 右肺組織活檢病理示:氣道黏膜組織慢性炎癥,間質散在嗜酸性粒細胞浸潤(蘇木精–伊紅染色×200)。
治療:(1)患者病程長且出現氣道結構改變,首先需要遠離工作環境。(2)建議使用激素聯合抗真菌藥物治療。患者考慮到激素的相關不良反應而拒絕激素治療,僅單用抗真菌治療(伏立康唑片,首日負荷劑量,維持劑量200 mg/次,2次/d)。口服伏立康唑片3 d后咳嗽、咳痰明顯減少,囑其出院后定期復查。
隨訪及后續治療:患者每月來我院復查,訴每月大部分時間表現正常,僅有3~5 d咳嗽,咳少量黃褐色顆粒樣痰,每月復查肝腎功能電解質均正常,胸部CT示病灶較前吸收減小。2020-08-18支氣管鏡檢查示右上葉前段支氣管開口痰栓堵塞,囑繼續規律服用伏立康唑片。2020-08-22患者咳嗽、咳黃褐色痰栓癥狀再發加重,建議患者加用激素治療,患者仍拒絕。2020-08-26前往復旦大學附屬中山醫院查血常規:白細胞計數5.19×109/L,中性粒細胞計數3.1×109/L,中性粒細胞百分比60.2%,嗜酸性粒細胞百分比8.9%;總IgE 4611 IU/mL,高敏C反應蛋白62.5 mg/L,紅細胞沉降率35 mm/1 h,PCT 0.07 ng/L,痰涂片找真菌(–);胸部CT示右肺上葉前段可見團塊狀高密度影,相應支氣管腔輕度擴張;2020-8-27支氣管鏡肺活檢:見支氣管壁及肺泡組織,支氣管黏膜固有膜內較多淋巴細胞浸潤,另見成片炎性滲出物,考慮炎癥性病變;灌洗液及肺組織涂片:細菌(–),真菌(–),抗酸桿菌(–);灌洗液高通量測序檢測:黃曲霉(嚴格序列數2條);肺組織培養:草綠色鏈球菌少量生長。最終診斷為ABPA。采取甲潑尼龍0.5 mg·kg–1·d–1,每隔2周減量4 mg聯合伏立康唑片0.2 g每日2次。2020-09-29第一次隨訪患者基本無咳嗽、咳痰,復查總IgE 807 IU/mL,嗜酸性粒細胞絕對數0/L,胸部CT示團塊狀高密度影較前明顯吸收變小,遂停用伏立康唑片。2020-11-03第二次隨訪患者咳嗽、咳痰癥狀完全緩解,復查總IgE 308 IU/mL,嗜酸性粒細胞絕對數0.1×109/L,胸部CT示未見團塊影。2020-11-16第三次隨訪復查總IgE 282.05 IU/mL,嗜酸性粒細胞絕對數0.07×109/L,胸部CT無殘留病灶,遺留中心性柱狀支氣管擴張影(圖2)。于2020-12-26停用激素,服用激素達4個月。2021-2-24又出現咳嗽、咳少量黃色痰栓,查總IgE 631 IU/mL,胸部CT未見新發病灶,考慮ABPA復發,繼續服用甲潑尼龍12 mg,每月減4 mg直至停止。隨訪至2021年9月未再出現咳嗽、咳痰癥狀。
 圖2
甲潑尼龍治療后胸部CT檢查像
圖2
甲潑尼龍治療后胸部CT檢查像
甲潑尼龍3個月后復查胸部CT示右肺中上葉病灶基本吸收消失,局部支氣管擴張程度較前減輕。
2 討論
ABPA是曲霉(最常見的是煙曲霉)引起的一種氣道超敏反應,多繼發于有哮喘等肺部基礎疾病的患者中,而無肺部基礎疾病的ABPA是極為少見的。2013年日本ABPA的全國性調查顯示358例的ABPA患者中19%無哮喘病史[3]。2017年印度學者回顧性分析530例ABPA患者[4],其中7%的患者無哮喘病史。因此,當出現相關免疫學指標升高及影像學改變時,即使無哮喘病史,也要考慮到ABPA可能。ABPA的臨床表現主為咳嗽、咳痰、喘息、胸悶等癥狀,咳黃褐色痰栓是其特異性的臨床表現,但不是所有患者均有[5],因此該疾病易漏診、誤診,延誤治療時機。
ABPA的發病機制尚未完全闡明,目前認為是基因與環境因素綜合作用的結果。對于正常人,吸入肺內的真菌孢子會被特異性抗體IgG和IgA清除;對于遺傳易感性患者,長期暴露于曲霉孢子的環境中將會引起ABPA。吸入肺的曲霉抗原激活CD4+ T淋巴細胞,增強白細胞介素(interleukin,IL)-4、IL-5、IL-13的基因表達,引起B淋巴細胞產生IgE,嗜酸性粒細胞聚集,肥大細胞脫顆粒,激發一系列炎癥反應,導致支氣管及肺組織的損傷,最終表現為支氣管擴張及肺纖維化[6-7],且支氣管擴張更易出現在無哮喘的ABPA中[4]。本例患者時有接觸霉變木材,有吸入曲霉的條件。規范治療后,后期隨訪未訴復發。因此,遠離曲霉的環境是減少ABPA復發的先決條件[8]。
中華醫學會呼吸病學分會哮喘學組制定的2017版《變應性支氣管肺曲霉病診治專家共識》[9]中的診斷標準:(1)相關疾病(至少符合1條):① 哮喘;② 其他,如支氣管擴張癥、慢阻肺、肺囊性纖維化等。(2)必需條件(2條均需符合):① 血清煙曲霉特異性IgE水平升高(>0.35 kUA/L)或煙曲霉皮試速發反應陽性;② 血清總IgE水平升高(>1000 U/mL)。(3)其他條件(至少符合2條):① 外周血嗜酸性粒細胞數>0.5×109/L(激素使用前的數值可作為診斷條件);② 影像學為一過性病變,包括實變、結節、牙膏征或指套征、游走性陰影等,持久性病變包括支氣管擴張、胸膜肺纖維化等;③ 血清煙曲霉特異性IgG或沉淀素陽性。無哮喘的ABPA診斷更為困難,經常被誤診為其他肺部疾病,如肺炎、肺結核、肺癌等。本例患者雖不滿足診斷ABPA所需的易感條件,但國際人類和動物真菌學協會指出,對無哮喘或囊性纖維化的患者,仍可以診斷ABPA[10];診斷ABPA最敏感的指標是煙曲霉特異性IgE抗體,也是篩查哮喘患者ABPA的首選方法。血清總IgE水平對ABPA的診斷和隨訪是一個重要的指標[11]。總IgE正常時,基本可排除ABPA。目前總IgE診斷界值還沒有統一標準,廣泛接受的是總IgE>1000 IU/mL,因此漏診幾率很大。由于我院對ABPA的檢測配置不完善,尚未開展皮膚曲霉試驗及曲霉特異性IgE檢查。但本例患者長期接觸霉變木材,咳黃褐色痰栓,實驗室檢查總IgE>1000 IU/mL,嗜酸性粒細胞絕對數0.81×109/L,煙曲霉菌硫氧還原抗體IgG(+),胸部CT示中心性支氣管擴張伴有黏液栓,病灶呈游走性。這基本符合ABPA的其他診斷標準。
無論哪種類型的ABPA,治療首選全身性糖皮質激素,但尚未有研究指導糖皮質激素的劑量及用藥療程。目前被采納的兩種方案:(1)潑尼松0.5 mg·kg–1·d–1,2周后改為隔日給藥,6~8周后每2周減量5~10 mg,直至停藥。(2)潑尼松0.75 mg·kg–1·d–1×6周,0.5 mg·kg–1·d–1×6周,之后每6周減量5 mg,總療程6~12個月。聯合抗真菌藥物,如伊曲康唑、伏立康唑或泊沙康唑等[4],可降低ABPA的急性加重頻率及減少糖皮質激素劑量[12]。研究表明血清型ABPA急性期患者口服糖皮質激素,緩解期吸入性糖皮質激素(inhaled corticosteroid,ICS)維持治療,5年內未見支氣管擴張形成[13];若直接使用ICS治療[14],6個月后癥狀未改善且總IgE水平增高99.3%,因此ICS不能作為急性期的一線治療。Agarwal等[15]對50例ABPA患者隨機分組進行強的松龍或伏立康唑片治療,6周和3個月后,兩組患者的療效、總IgE下降、肺功能和生活質量評分及首次發作時間均相似,且隨訪2年內發生急性加重的人數也基本相等。雖然這都是單中心小樣本研究,但研究均提出抗真菌藥物可能是治療急性期ABPA的替代藥物。從本例患者中可觀察到服用伏立康唑片期間臨床癥狀反復發作,總IgE水平未見下降,肺部浸潤影呈游走性出現。因此,對于單用抗真菌藥物治療ABPA的療效還需要多中心的研究進一步證實。對于少數不能耐受糖皮質激素的患者可使用抗IgE抗體靶向治療,例如奧馬珠單抗、貝那利珠單抗等,也取得較大益處,尤其在合并哮喘的患者中更明顯[16]。
ABPA是一種少見的疾病,目前對于難以控制的哮喘或囊性纖維化患者,經抗感染、止咳平喘等治療后癥狀未見緩解,最終診斷出ABPA難度不大;但對于無哮喘病史的患者,極易誤診為其他肺部疾病,確診過程多有延誤。希望通過我們的病例提高臨床醫生對無肺部基礎疾病的ABPA認識,在氣道結構改變之前明確診斷、規范治療、改善預后。
利益沖突:本研究不涉及任何利益沖突。