引用本文: 馮小藝, 歐雪梅. 尖端賽多孢子菌致免疫正常者肺部感染一例并文獻復習. 中國呼吸與危重監護雜志, 2021, 20(4): 266-269. doi: 10.7507/1671-6205.202010011 復制
尖端賽多孢子菌(Scedosporium apiospermum)是自然環境中常見的一種條件致病性真菌,在土壤、污水、糞便及腐敗的植物中廣泛分布。感染多發生于免疫功能缺陷患者,如血液系統腫瘤、器官移植、骨髓移植、獲得性免疫缺陷綜合征(AIDS)以及使用大量激素和免疫抑制劑患者。在免疫功能正常者中相對罕見,常見于有外傷、污水淹溺史,或有基礎肺疾病患者。尖端賽多孢子菌可侵犯任何部位,引起肺部、中樞神經系統、眼部、關節、皮膚、消化系統、甲狀腺、腎臟等組織器官感染,并常引起致死性感染[1]。尖端賽多孢子菌肺炎的臨床及影像學表現常與肺曲霉病相似,較難鑒別[2],其微生物學診斷困難。近年來,尖端賽多孢子菌病在高危人群的發病率有所上升,但在免疫功能正常宿主中相對罕見。國內文獻近 20 年報道的免疫正常宿主發生尖端賽多孢子菌感染中,外傷后關節及眼部感染 5 例,肺部感染 4 例,腦膿腫 2 例。現將我院收治的 1 例尖端賽多孢子菌致免疫正常者肺部感染的臨床資料報告如下,并結合文獻復習尖端賽多孢子菌感染的臨床特點、診斷方法及治療手段,以提高臨床醫師對此病的認識,減少誤診、漏診。
1 臨床資料
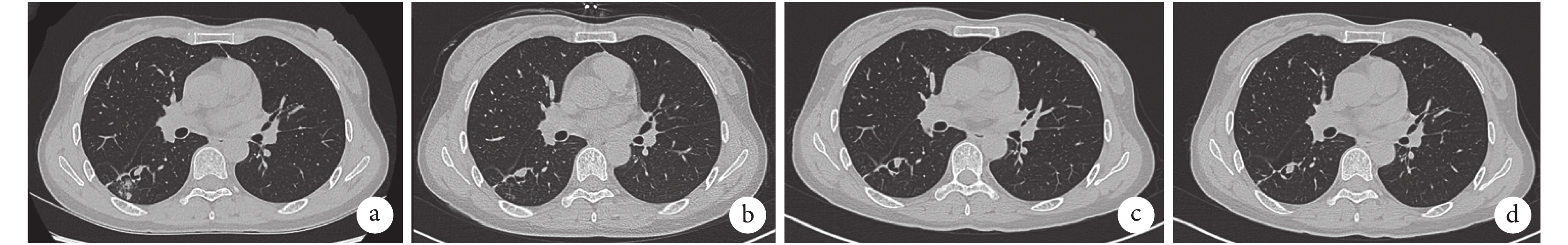
患者女性,47 歲,因“痰中帶血 1+ 個月”于 2020 年 7 月 21 日入院。入院前 1+ 個月,患者重體力勞作后出現痰中帶血,量少,色鮮紅。偶有咽癢、干咳、胸悶心悸不適,無明顯胸痛、喘息、發熱、腹痛、血尿等不適。患者于當地醫院行胸部 CT 檢查提示“右肺下葉背段空洞影,感染性病變可能,真菌?結核?”。痰涂片抗酸染色陰性。痰 TB-DNA 陽性。纖維支氣管鏡(簡稱纖支鏡)檢查示管腔未見明顯異常,支氣管肺泡灌洗液(BALF)中 TB-DNA 陰性。予抗感染治療后癥狀好轉。出院后患者逐漸出現咳嗽咳痰加重,為白色黏痰,呈拉絲狀,易咳出,伴有活動后氣緊不適,無咯血、胸痛、發熱及潮熱盜汗等癥狀,遂至我院門診就診。胸部 CT 檢查提示右肺下葉背段支氣管擴張伴肺部感染,支氣管內結節影(圖 1a);半乳甘露聚糖抗原(GM)試驗陰性、TB-IGRA 陰性、痰涂片未查見抗酸桿菌。為進一步明確診斷收入住院。患者既往體健,近期體重無明顯下降。否認外傷史,無溺水及污水接觸史。居住環境潮濕,家中飼養鴿子,居住地周圍有養雞場,但未近距離接觸。
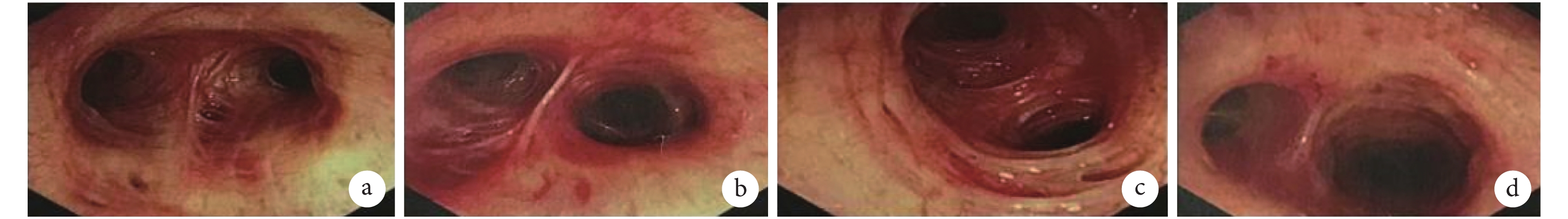
入院查體:體溫 36.5 ℃,脈搏 71 次/min,呼吸 20 次/min,血壓 103/77 mm Hg(1 mm Hg=0.133 kPa)。神清,慢性病容,全身淺表淋巴結未捫及腫大。頸靜脈無明顯充盈。雙肺呼吸音粗,聞及散在濕啰音。心界正常,心律齊,各瓣膜區未聞及雜音。腹軟無壓痛,肝脾肋下未捫及,雙下肢無水腫。實驗室檢查:血常規:血紅蛋白 124 g/L,血小板 213×109/L,白細胞 4.53×109/L,中性粒細胞 2.64×109/L,淋巴細胞 1.40×109/L,嗜酸性粒細胞 0.19×109/L。降鈣素原<0.02 ng/mL,血沉 27 mm/1 h,C 反應蛋白 1.09 mg/L。生化:丙氨酸氨基轉移酶 8 IU/L,門冬氨酸氨基轉移酶 14 IU/L,肌酐 59 μmol/L。心肌標志物:肌紅蛋白<21 ng/mL,肌鈣蛋白 T 3.7 ng/L,肌酸激酶同工酶 MB 質量 0.31 ng/mL。彌散性血管內凝血常規:凝血酶原時間 10.5 s,國際標準化比值 0.94,活化部分凝血活酶時間 29.5 s,D-二聚體 0.73 mg/L FEU。免疫全套:ANA 可疑,dsDNA、ENA 抗體譜均陰性;免疫球蛋白 M 3 610 mg/L,免疫球蛋白 E 968 IU/mL,補體 C3 0.745 g/L,補體 C4 0.137 g/L,余未見明顯異常。ANCA 陰性。痰細菌及真菌涂片未見異常。3 次痰抗酸染色陰性。真菌 G 實驗、GM 試驗、隱球菌抗原、TB-IGRA 均陰性。血清腫瘤標記:癌胚抗原、甲胎蛋白、糖類抗原 125、細胞角質蛋白 19 片段抗原 21-1、神經元特異性烯醇酶未見明顯異常。輸血前全套 HBsAb、HBeAb、HBcAb 陽性,余陰性。于我院行胸部高分辨率 CT 檢查:右肺下葉背段支氣管擴張并周圍少許感染,局部見空腔伴結節影,多系感染性病變:結核?真菌感染?(圖 1b)。纖支鏡檢查:各級管腔未見明顯異常,未見出血、狹窄及新生物(圖 2)。BALF:涂片查見極少革蘭陰性桿菌,分枝桿菌陰性;細菌真菌培養陰性;TB-DNA 陰性,TB-Xpert 陰性,GM 陰性;BALF 病原微生物高通量基因檢測結果:查見賽多孢子菌屬,相對豐度 72.3%,序列數 260,其中尖端賽多孢子菌序列數 164。診斷:肺尖端賽多孢子菌病,支氣管擴張。給予伏立康唑 200 mg q12h 靜脈滴注。患者咳嗽咯痰減輕,肺部濕啰音消失。出院后繼續口服伏立康唑治療。出院 1 個月后患者復查胸部 CT 見擴張支氣管腔中結節影較前稍縮小(圖 1c、圖 1d)。后因患者某些原因未再隨訪。
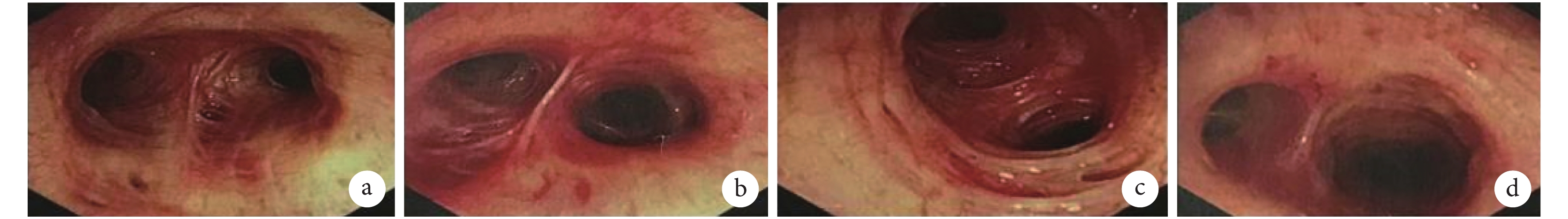 圖2
纖維支氣管鏡檢查像
圖2
纖維支氣管鏡檢查像
各級管腔未見明顯異常,未見出血、狹窄。
2 文獻復習
以“尖端賽多孢子菌”為關鍵詞檢索萬方數據庫和中國知網數據庫,以“Scedosporium apiospermum”為關鍵詞檢索 PubMed 數據庫,檢索時間 2000 年 1 月至 2020 年 9 月,共檢索到 1000 余病例,除國外 1 篇對上百例尖端賽多孢子菌病病例進行回顧性研究外[3],大部分為散發報道或僅有數十個病例的集中報道,其中尖端賽多孢子菌致肺部感染報道 400 余例,多發生于肺囊性纖維化患者及肺移植患者,發生于免疫正常宿主相對罕見,僅 40 余例。
尖端賽多孢子菌感染多發生免疫功能缺陷患者,如實體器官移植、惡性血液病、AIDS 以及使用大量激素和免疫抑制劑患者,在免疫功能正常者中相對罕見[1-13]。尖端賽多孢子菌肺部定植導致的典型改變是在已經存在的空腔或擴張的支氣管中形成真菌球,患者可表現為咳嗽、咯血;侵襲肺組織可出現暈征、新月形空洞、局部肺實變,部分患者可有壞死性肺炎的影像學表現[2]。
3 討論
在我們的病例中,患者為中年女性,無免疫缺陷病史及服用糖皮質激素、免疫抑制劑等情況。居住地較潮濕,有飼養鴿子。此次患病以咯血為首發癥狀,后逐漸咳嗽咯痰癥狀,痰液為白色黏痰呈拉絲狀。病程中有輕微的呼吸困難癥狀。肺部可聞及濕啰音,但無明顯哮鳴音。血清真菌 G 和 GM 試驗均陰性。纖支鏡管腔未見明顯異常;肺泡灌洗液 GM 試驗陰性,NGS 檢查提示尖端賽多孢子菌。胸部 CT 提示支氣管擴張,擴張支氣管腔內結節。動態分析見患者支氣管腔內結節有逐漸增大、與管腔接觸基底部增寬的趨勢。從病史、癥狀及影像特征上臨床高度提示真菌可能,通過 NGS 檢查確定尖端賽多孢子菌感染。給予伏立康唑抗真菌治療后癥狀改善,治療 1 個月后復查胸部 CT 結節有所縮小。后期擬繼續抗真菌治療,定期復查胸部 CT 評估,待病灶局限后考慮手術治療。
尖端賽多孢子菌所致肺部病變在臨床癥狀和影像改變上與曲霉很相似,可在原有氣道空洞中寄生形成真菌球,也可在機體免疫功能降低時侵襲肺組織導致壞死性肺炎,也可因真菌致敏出現喘息情況。三種狀態可相互轉換[1-2]。本例患者無既往肺部影像資料,尚不清楚真菌與支氣管擴張形成之間的因果關系。就近期影像資料結節的動態變化來看,真菌寄生逐漸發展為侵襲性感染。且患者此次在咳嗽咯血癥狀外,同時伴有活動后氣緊癥狀,IgE 增高,不能除外真菌致敏導致氣道痙攣的情況,因此有積極藥物治療指征。但由于該病變起源于支氣管腔內真菌球,后期藥物治療不能清除,應考慮手術干預。
尖端賽多孢子菌引起的侵襲性真菌感染屬少見的真菌感染,具有侵襲力強、感染部位廣、對多種抗真菌藥物耐藥、預后差等特點。尖端賽多孢子菌感染多發生免疫功能缺陷患者,如實體器官移植、惡性血液病、AIDS 以及使用大量激素和免疫抑制劑患者,在免疫功能正常者中相對罕見[1-13]。尖端賽多孢子菌是溺水后引起的侵襲性感染最常見的真菌,可引起溺水的免疫正常宿主的肺和中樞神經系統感染的臨床綜合征[12]。
尖端賽多孢子菌肺部定植導致的典型改變是在已經存在的空腔或擴張的支氣管中形成真菌球,患者可表現為咳嗽、咯血;侵襲肺組織可出現暈征、新月形空洞、局部肺實變,部分患者可有壞死性肺炎的影像學表現[2]。國外有關肺部尖端賽多孢子菌定植報道多見于肺囊性纖維化和肺移植患者。在對 128 例囊性纖維化患者氣道分離出的常見絲狀霉菌中,尖端賽多孢子菌位列第二,僅次于曲霉[5-6]。肺囊性纖維化患者呼吸道的定植通常是無癥狀的。尖端賽多孢子菌感染經常發生在短暫的曲霉感染或曲霉感染治愈后。這類患者氣道定植賽多孢子菌的可能危險因素包括:細菌和真菌共同定植、使用抗微生物藥物和變應性支氣管肺曲霉病[2]。在肺移植受者中賽多孢子菌氣道定植問題尤需引起關注,定植可能發生于移植之前,后期可進展為侵襲性感染[13]。
尖端賽多孢子菌的肺外感染包括:足菌腫、皮膚和皮下感染、骨關節/肌肉感染、中樞神經系統感染、眼部感染等。因其侵襲力強,在免疫功能嚴重受損的患者中,極易發生播散性感染,可引起休克及多器官衰竭[1]。據文獻報道,對 162 例尖端賽多孢子菌病的數據分析發現,發生此病的危險因素為惡性腫瘤 74/162(45.7%)、囊性纖維化 19/172(11.7%)和實體器官移植 14/162(8.6%);最常見的臨床表現為播散性感染 72/162 例(44.4%)、肺真菌病 47/162 例(29%)和骨及關節感染 17/162 例(10.4%)[3]。
尖端賽多孢子菌感染診斷較困難,因其臨床特征和組織病理學與曲霉病、鐮刀菌病以及其他相對常見的透明絲孢霉病非常相似。不及時診斷及處理易出現全身播散性尖端賽多孢子菌感染,早期診斷率非常低,預后差,病死率高[6]。診斷方法應根據不同患者的特異性因素來個體化選擇,包括有無免疫缺陷病史或外傷污水淹溺史、感染部位、嚴重程度以及宿主的免疫狀態。
尖端賽多孢子菌是波氏假阿利什菌的無性型,在組織病理表現上與曲霉、鐮刀菌以及其他透明真菌相似。但尖端賽多孢子菌的分支不甚規則,可出現頂端或間生厚壁孢子。尖端賽多孢子菌血清學檢查可表現為真菌 G 試驗陽性,GM 試驗陽性。但由于血清學檢查存在一定假陰性和假陽性結果,因此分子生物學技術(如肺泡灌洗液或局部組織的病原學二代基因測序技術)在診斷侵襲性賽多孢子菌感染中有較好的應用前景。鑒于分子生物學技術存在操作流程未標準化等不足,該項檢查結果仍需結合患者臨床特征進一步分析得出最終診斷。
尖端賽多孢子菌感染的治療十分困難。若病情允許,對于局限性的尖端賽多孢子菌感染單獨抗真菌治療療效欠佳時,推薦在抗真菌治療基礎上盡可能手術切除感染病灶。尖端賽多孢子菌肺炎的抗真菌藥物選擇較困難,因其體外藥敏顯示對所有抗真菌藥物的最低抑菌濃度較高。研究報道,唑類藥物中活性最高的是伏立康唑,其次是咪康唑。棘白素類活性最高的是卡泊芬凈。兩性霉素 B 對其活性較差。因此伏立康唑是目前被認為效果最好的藥物(靜脈給藥負荷劑量 600 mg/d,維持劑量 8 mg·kg–1·d–1)。體外藥敏結果顯示,特比萘芬與伊曲康唑、咪康唑和伏立康唑的聯合應用具有明顯協同效應。由于目前該病多為個案報道,治療方案缺乏循證醫學證據的隨機對照試驗。對賽多孢子菌病的回顧性研究結果顯示,藥物治療效果最好的是皮膚或皮下組織感染(91%)和骨感染(79%),療效最差的是中樞神經系統感染(43%)[7-8]。
聯合其他治療如手術切除、免疫調節治療是整體治療重要的組成部分[10]。感染者的免疫缺陷狀態是影響預后的重要因素。對于免疫缺陷患者給予免疫增強劑和及時糾正免疫缺陷狀態對預防賽多孢子菌感染有一定價值,但抗真菌藥物預防用藥不僅無助于減少賽多孢子菌發生率,甚至有可能增加其突破性感染[7-8]。
利益沖突:本研究不涉及任何利益沖突。
尖端賽多孢子菌(Scedosporium apiospermum)是自然環境中常見的一種條件致病性真菌,在土壤、污水、糞便及腐敗的植物中廣泛分布。感染多發生于免疫功能缺陷患者,如血液系統腫瘤、器官移植、骨髓移植、獲得性免疫缺陷綜合征(AIDS)以及使用大量激素和免疫抑制劑患者。在免疫功能正常者中相對罕見,常見于有外傷、污水淹溺史,或有基礎肺疾病患者。尖端賽多孢子菌可侵犯任何部位,引起肺部、中樞神經系統、眼部、關節、皮膚、消化系統、甲狀腺、腎臟等組織器官感染,并常引起致死性感染[1]。尖端賽多孢子菌肺炎的臨床及影像學表現常與肺曲霉病相似,較難鑒別[2],其微生物學診斷困難。近年來,尖端賽多孢子菌病在高危人群的發病率有所上升,但在免疫功能正常宿主中相對罕見。國內文獻近 20 年報道的免疫正常宿主發生尖端賽多孢子菌感染中,外傷后關節及眼部感染 5 例,肺部感染 4 例,腦膿腫 2 例。現將我院收治的 1 例尖端賽多孢子菌致免疫正常者肺部感染的臨床資料報告如下,并結合文獻復習尖端賽多孢子菌感染的臨床特點、診斷方法及治療手段,以提高臨床醫師對此病的認識,減少誤診、漏診。
1 臨床資料
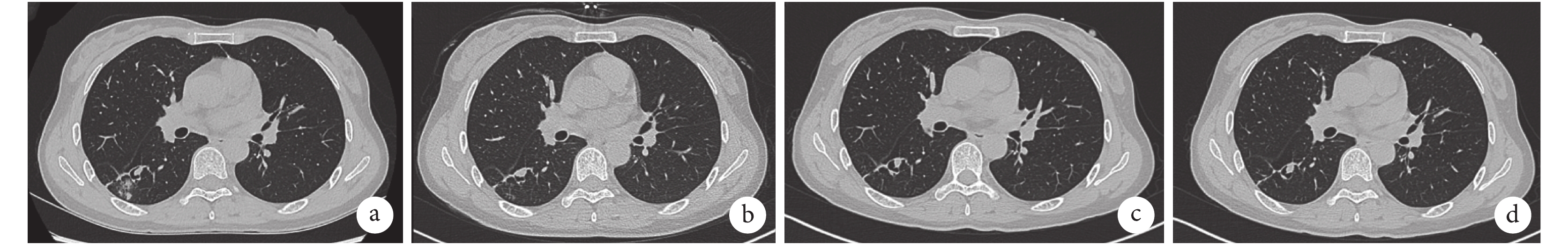
患者女性,47 歲,因“痰中帶血 1+ 個月”于 2020 年 7 月 21 日入院。入院前 1+ 個月,患者重體力勞作后出現痰中帶血,量少,色鮮紅。偶有咽癢、干咳、胸悶心悸不適,無明顯胸痛、喘息、發熱、腹痛、血尿等不適。患者于當地醫院行胸部 CT 檢查提示“右肺下葉背段空洞影,感染性病變可能,真菌?結核?”。痰涂片抗酸染色陰性。痰 TB-DNA 陽性。纖維支氣管鏡(簡稱纖支鏡)檢查示管腔未見明顯異常,支氣管肺泡灌洗液(BALF)中 TB-DNA 陰性。予抗感染治療后癥狀好轉。出院后患者逐漸出現咳嗽咳痰加重,為白色黏痰,呈拉絲狀,易咳出,伴有活動后氣緊不適,無咯血、胸痛、發熱及潮熱盜汗等癥狀,遂至我院門診就診。胸部 CT 檢查提示右肺下葉背段支氣管擴張伴肺部感染,支氣管內結節影(圖 1a);半乳甘露聚糖抗原(GM)試驗陰性、TB-IGRA 陰性、痰涂片未查見抗酸桿菌。為進一步明確診斷收入住院。患者既往體健,近期體重無明顯下降。否認外傷史,無溺水及污水接觸史。居住環境潮濕,家中飼養鴿子,居住地周圍有養雞場,但未近距離接觸。
入院查體:體溫 36.5 ℃,脈搏 71 次/min,呼吸 20 次/min,血壓 103/77 mm Hg(1 mm Hg=0.133 kPa)。神清,慢性病容,全身淺表淋巴結未捫及腫大。頸靜脈無明顯充盈。雙肺呼吸音粗,聞及散在濕啰音。心界正常,心律齊,各瓣膜區未聞及雜音。腹軟無壓痛,肝脾肋下未捫及,雙下肢無水腫。實驗室檢查:血常規:血紅蛋白 124 g/L,血小板 213×109/L,白細胞 4.53×109/L,中性粒細胞 2.64×109/L,淋巴細胞 1.40×109/L,嗜酸性粒細胞 0.19×109/L。降鈣素原<0.02 ng/mL,血沉 27 mm/1 h,C 反應蛋白 1.09 mg/L。生化:丙氨酸氨基轉移酶 8 IU/L,門冬氨酸氨基轉移酶 14 IU/L,肌酐 59 μmol/L。心肌標志物:肌紅蛋白<21 ng/mL,肌鈣蛋白 T 3.7 ng/L,肌酸激酶同工酶 MB 質量 0.31 ng/mL。彌散性血管內凝血常規:凝血酶原時間 10.5 s,國際標準化比值 0.94,活化部分凝血活酶時間 29.5 s,D-二聚體 0.73 mg/L FEU。免疫全套:ANA 可疑,dsDNA、ENA 抗體譜均陰性;免疫球蛋白 M 3 610 mg/L,免疫球蛋白 E 968 IU/mL,補體 C3 0.745 g/L,補體 C4 0.137 g/L,余未見明顯異常。ANCA 陰性。痰細菌及真菌涂片未見異常。3 次痰抗酸染色陰性。真菌 G 實驗、GM 試驗、隱球菌抗原、TB-IGRA 均陰性。血清腫瘤標記:癌胚抗原、甲胎蛋白、糖類抗原 125、細胞角質蛋白 19 片段抗原 21-1、神經元特異性烯醇酶未見明顯異常。輸血前全套 HBsAb、HBeAb、HBcAb 陽性,余陰性。于我院行胸部高分辨率 CT 檢查:右肺下葉背段支氣管擴張并周圍少許感染,局部見空腔伴結節影,多系感染性病變:結核?真菌感染?(圖 1b)。纖支鏡檢查:各級管腔未見明顯異常,未見出血、狹窄及新生物(圖 2)。BALF:涂片查見極少革蘭陰性桿菌,分枝桿菌陰性;細菌真菌培養陰性;TB-DNA 陰性,TB-Xpert 陰性,GM 陰性;BALF 病原微生物高通量基因檢測結果:查見賽多孢子菌屬,相對豐度 72.3%,序列數 260,其中尖端賽多孢子菌序列數 164。診斷:肺尖端賽多孢子菌病,支氣管擴張。給予伏立康唑 200 mg q12h 靜脈滴注。患者咳嗽咯痰減輕,肺部濕啰音消失。出院后繼續口服伏立康唑治療。出院 1 個月后患者復查胸部 CT 見擴張支氣管腔中結節影較前稍縮小(圖 1c、圖 1d)。后因患者某些原因未再隨訪。
 圖2
纖維支氣管鏡檢查像
圖2
纖維支氣管鏡檢查像
各級管腔未見明顯異常,未見出血、狹窄。
2 文獻復習
以“尖端賽多孢子菌”為關鍵詞檢索萬方數據庫和中國知網數據庫,以“Scedosporium apiospermum”為關鍵詞檢索 PubMed 數據庫,檢索時間 2000 年 1 月至 2020 年 9 月,共檢索到 1000 余病例,除國外 1 篇對上百例尖端賽多孢子菌病病例進行回顧性研究外[3],大部分為散發報道或僅有數十個病例的集中報道,其中尖端賽多孢子菌致肺部感染報道 400 余例,多發生于肺囊性纖維化患者及肺移植患者,發生于免疫正常宿主相對罕見,僅 40 余例。
尖端賽多孢子菌感染多發生免疫功能缺陷患者,如實體器官移植、惡性血液病、AIDS 以及使用大量激素和免疫抑制劑患者,在免疫功能正常者中相對罕見[1-13]。尖端賽多孢子菌肺部定植導致的典型改變是在已經存在的空腔或擴張的支氣管中形成真菌球,患者可表現為咳嗽、咯血;侵襲肺組織可出現暈征、新月形空洞、局部肺實變,部分患者可有壞死性肺炎的影像學表現[2]。
3 討論
在我們的病例中,患者為中年女性,無免疫缺陷病史及服用糖皮質激素、免疫抑制劑等情況。居住地較潮濕,有飼養鴿子。此次患病以咯血為首發癥狀,后逐漸咳嗽咯痰癥狀,痰液為白色黏痰呈拉絲狀。病程中有輕微的呼吸困難癥狀。肺部可聞及濕啰音,但無明顯哮鳴音。血清真菌 G 和 GM 試驗均陰性。纖支鏡管腔未見明顯異常;肺泡灌洗液 GM 試驗陰性,NGS 檢查提示尖端賽多孢子菌。胸部 CT 提示支氣管擴張,擴張支氣管腔內結節。動態分析見患者支氣管腔內結節有逐漸增大、與管腔接觸基底部增寬的趨勢。從病史、癥狀及影像特征上臨床高度提示真菌可能,通過 NGS 檢查確定尖端賽多孢子菌感染。給予伏立康唑抗真菌治療后癥狀改善,治療 1 個月后復查胸部 CT 結節有所縮小。后期擬繼續抗真菌治療,定期復查胸部 CT 評估,待病灶局限后考慮手術治療。
尖端賽多孢子菌所致肺部病變在臨床癥狀和影像改變上與曲霉很相似,可在原有氣道空洞中寄生形成真菌球,也可在機體免疫功能降低時侵襲肺組織導致壞死性肺炎,也可因真菌致敏出現喘息情況。三種狀態可相互轉換[1-2]。本例患者無既往肺部影像資料,尚不清楚真菌與支氣管擴張形成之間的因果關系。就近期影像資料結節的動態變化來看,真菌寄生逐漸發展為侵襲性感染。且患者此次在咳嗽咯血癥狀外,同時伴有活動后氣緊癥狀,IgE 增高,不能除外真菌致敏導致氣道痙攣的情況,因此有積極藥物治療指征。但由于該病變起源于支氣管腔內真菌球,后期藥物治療不能清除,應考慮手術干預。
尖端賽多孢子菌引起的侵襲性真菌感染屬少見的真菌感染,具有侵襲力強、感染部位廣、對多種抗真菌藥物耐藥、預后差等特點。尖端賽多孢子菌感染多發生免疫功能缺陷患者,如實體器官移植、惡性血液病、AIDS 以及使用大量激素和免疫抑制劑患者,在免疫功能正常者中相對罕見[1-13]。尖端賽多孢子菌是溺水后引起的侵襲性感染最常見的真菌,可引起溺水的免疫正常宿主的肺和中樞神經系統感染的臨床綜合征[12]。
尖端賽多孢子菌肺部定植導致的典型改變是在已經存在的空腔或擴張的支氣管中形成真菌球,患者可表現為咳嗽、咯血;侵襲肺組織可出現暈征、新月形空洞、局部肺實變,部分患者可有壞死性肺炎的影像學表現[2]。國外有關肺部尖端賽多孢子菌定植報道多見于肺囊性纖維化和肺移植患者。在對 128 例囊性纖維化患者氣道分離出的常見絲狀霉菌中,尖端賽多孢子菌位列第二,僅次于曲霉[5-6]。肺囊性纖維化患者呼吸道的定植通常是無癥狀的。尖端賽多孢子菌感染經常發生在短暫的曲霉感染或曲霉感染治愈后。這類患者氣道定植賽多孢子菌的可能危險因素包括:細菌和真菌共同定植、使用抗微生物藥物和變應性支氣管肺曲霉病[2]。在肺移植受者中賽多孢子菌氣道定植問題尤需引起關注,定植可能發生于移植之前,后期可進展為侵襲性感染[13]。
尖端賽多孢子菌的肺外感染包括:足菌腫、皮膚和皮下感染、骨關節/肌肉感染、中樞神經系統感染、眼部感染等。因其侵襲力強,在免疫功能嚴重受損的患者中,極易發生播散性感染,可引起休克及多器官衰竭[1]。據文獻報道,對 162 例尖端賽多孢子菌病的數據分析發現,發生此病的危險因素為惡性腫瘤 74/162(45.7%)、囊性纖維化 19/172(11.7%)和實體器官移植 14/162(8.6%);最常見的臨床表現為播散性感染 72/162 例(44.4%)、肺真菌病 47/162 例(29%)和骨及關節感染 17/162 例(10.4%)[3]。
尖端賽多孢子菌感染診斷較困難,因其臨床特征和組織病理學與曲霉病、鐮刀菌病以及其他相對常見的透明絲孢霉病非常相似。不及時診斷及處理易出現全身播散性尖端賽多孢子菌感染,早期診斷率非常低,預后差,病死率高[6]。診斷方法應根據不同患者的特異性因素來個體化選擇,包括有無免疫缺陷病史或外傷污水淹溺史、感染部位、嚴重程度以及宿主的免疫狀態。
尖端賽多孢子菌是波氏假阿利什菌的無性型,在組織病理表現上與曲霉、鐮刀菌以及其他透明真菌相似。但尖端賽多孢子菌的分支不甚規則,可出現頂端或間生厚壁孢子。尖端賽多孢子菌血清學檢查可表現為真菌 G 試驗陽性,GM 試驗陽性。但由于血清學檢查存在一定假陰性和假陽性結果,因此分子生物學技術(如肺泡灌洗液或局部組織的病原學二代基因測序技術)在診斷侵襲性賽多孢子菌感染中有較好的應用前景。鑒于分子生物學技術存在操作流程未標準化等不足,該項檢查結果仍需結合患者臨床特征進一步分析得出最終診斷。
尖端賽多孢子菌感染的治療十分困難。若病情允許,對于局限性的尖端賽多孢子菌感染單獨抗真菌治療療效欠佳時,推薦在抗真菌治療基礎上盡可能手術切除感染病灶。尖端賽多孢子菌肺炎的抗真菌藥物選擇較困難,因其體外藥敏顯示對所有抗真菌藥物的最低抑菌濃度較高。研究報道,唑類藥物中活性最高的是伏立康唑,其次是咪康唑。棘白素類活性最高的是卡泊芬凈。兩性霉素 B 對其活性較差。因此伏立康唑是目前被認為效果最好的藥物(靜脈給藥負荷劑量 600 mg/d,維持劑量 8 mg·kg–1·d–1)。體外藥敏結果顯示,特比萘芬與伊曲康唑、咪康唑和伏立康唑的聯合應用具有明顯協同效應。由于目前該病多為個案報道,治療方案缺乏循證醫學證據的隨機對照試驗。對賽多孢子菌病的回顧性研究結果顯示,藥物治療效果最好的是皮膚或皮下組織感染(91%)和骨感染(79%),療效最差的是中樞神經系統感染(43%)[7-8]。
聯合其他治療如手術切除、免疫調節治療是整體治療重要的組成部分[10]。感染者的免疫缺陷狀態是影響預后的重要因素。對于免疫缺陷患者給予免疫增強劑和及時糾正免疫缺陷狀態對預防賽多孢子菌感染有一定價值,但抗真菌藥物預防用藥不僅無助于減少賽多孢子菌發生率,甚至有可能增加其突破性感染[7-8]。
利益沖突:本研究不涉及任何利益沖突。