引用本文: 余伍勇, 張文鋒, 程瑤, 龔建平. PI3K/AKT 通路和 S1PR2 在急性梗阻性膽管炎誘導大鼠全身炎癥反應中的作用. 中國普外基礎與臨床雜志, 2019, 26(11): 1278-1283. doi: 10.7507/1007-9424.201906019 復制
急性梗阻性膽管炎(acute obstructive cholangitis,AOC)是肝膽外科常見疾病,病因主要是膽總管結石、新生物、膽總管狹窄等造成膽汁引流不暢,導致細菌及細菌產物脂多糖等反流入血,從而誘發全身炎癥反應[1]。磷脂酰肌醇-3-羥激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/AKT 通路參與單核巨噬細胞誘導的炎癥反應[1-3],且巨噬細胞中鞘氨醇-1-磷酸受體2(sphingosine 1-phosphate receptor 2,S1PR2)的表達水平與膿毒癥的嚴重程度呈正相關[4];在高糖培養條件下,S1PR2 可通過抑制 PI3K/AKT 激活抑制內皮細胞的功能[5]。但是 PI3K/AKT 通路下游主要作用靶點一直未有定論。在 AOC 模型中,PI3K/AKT 通路和 S1PR2 是否發生作用,目前鮮有報道。因此,本研究將探索在 AOC 模型大鼠中,外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)中 PI3K/AKT 通路和 S1PR2 激活情況以及其對 AOC 大鼠全身炎癥反應的影響。
1 材料與方法
1.1 實驗動物
SD 大鼠(6 周齡,160~200 g,雄性)購于重慶醫科大學動物實驗中心 [生產許可證號:SCXK(渝)2018-0003;使用許可證號:SYXK(渝)2018-0003]。大鼠飼養在獨立通氣籠盒動物房中,可自由進食和飲水。所有實驗操作均符合動物倫理學相關規定。
1.2 主要材料
脂多糖(L5293)購買于美國 Sigma 公司。PI3K 抑制劑 LY294002(產品目錄號:S1105)購買于美國 Selleck Chemicals 公司。大鼠腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和白細胞介素-6(interleukin 6,IL-6)ELISA 試劑盒(產品目錄號分別為:EK0526、EK0412)、兔抗 β-actin 抗體(產品目錄號:BM0626)、辣根過氧化物酶(HRP)標記山羊抗兔 IgG(產品目錄號:BA1050)和 RIPA 裂解液(產品目錄號:AR0102)均購買于武漢博士德科技公司。大鼠 PBMCs 分離液試劑盒(產品目錄號:LDS1080)購買于天津市灝洋生物制品科技有限責任公司。BCA 蛋白濃度測定試劑盒(產品目錄號:KGP902)和超敏型 ECL 化學發光試劑盒(產品目錄號:KGP1127)均購于江蘇凱基生物技術公司。兔抗磷酸化 PI3K 抗體(產品目錄號:ab182651)和 AKT 抗體(產品目錄號:ab131443)均購買于美國 Abcam 公司。兔抗 S1PR2 抗體(產品目錄號:PA5-72868)購買于美國 Thermo Fisher 公司。
1.3 體外實驗
1.3.1 PBMCs 的分離與培養
SD 大鼠乙醚吸入麻醉后,經眼眶靜脈叢取外周血。取 1.5 mL 的抗凝血加入 1.5 mL 的樣品稀釋液,混勻后在稀釋液底部加入 3 mL 的分離液。PBMCs 分離參照試劑盒說明書操作。水平離心機 500×g 離心 30 min,分層后取第二層白細胞層加入 10 mL 清洗液繼續 250×g 離心 10 min,重復 2 遍。最后所得到的細胞沉渣可繼續用來培養。
1.3.2 LY294002 處理體外 PBMCs
一部分 PBMCs 體外培養 12 h 后,加入脂多糖(500 ng/mL)刺激 PBMCs 后繼續培養 0.5、1.0、2.0 h,然后收集細胞上清及提取細胞總蛋白,檢測 PI3K/AKT-S1PR2 激活情況和細胞因子 TNF-α 和 IL-6 的水平,以確定脂多糖對 PBMCs 的刺激效果。一部分 PBMCs 體外培養 12 h 后,按不同處理分為 4 組:空白對照組,PBMCs 中只加入 PBS;LY294002 單獨刺激組,用 LY294002(50 μmol/L)直接刺激 PBMCs;脂多糖單獨刺激組,加入脂多糖(500 ng/mL)直接刺激 PBMCs;LY294002 和脂多糖共同刺激組,加入 LY294002(50 μmol/L)處理 1 h 后再加入脂多糖(500 ng/mL)刺激 PBMCs 2 h。分別在 2 h 后收集各組細胞上清和總蛋白,檢測 PI3K/AKT-S1PR2 激活情況和細胞因子 TNF-α 和 IL-6 的水平。
1.3.3 蛋白印跡法檢測 PI3K、AKT 磷酸化和 S1PR2 蛋白表達
分離的 PBMCs(1×106個)用 100 μL的 RIPA 裂解液提取總蛋白,采用 BCA 法檢測蛋白濃度和定量;然后 10% 的 SDS-PAGE 垂直電泳(100 V,120 min);接著進行轉膜(250 mA,110 min);再利用 5% 脫脂奶粉室溫封閉 PVDF 膜 2 h;一抗 4 ℃孵育 16 h 以上;PVDF 膜洗滌后,加 HRP 標記的山羊抗兔 IgG 抗體室溫孵育 1.5 h 后利用 ECL 法進行顯影。對蛋白進行半定量分析,即目的條帶灰度值與相應 β-actin 條帶灰度值的比值,即為目的蛋白相對表達量。
1.3.4 采用 ELISA 法檢測 TNF-α 和 IL-6 水平
采用市售 ELISA 試劑盒測定,所有的操作均嚴格按照試劑盒說明書進行操作。
1.4 體內實驗
1.4.1 動物分組與處理
取 60 只 SD 大鼠進行編號,通過隨機數生成器將 SD 大鼠隨機分為 4 組:① 假手術組,即大鼠吸入麻醉后,常規備皮、消毒、鋪巾、開腹,然后關腹;② 假手術+LY294002 處理組,即大鼠進行假手術后腹腔注射 LY294002 10 mg/(kg·d)處理;③ AOC 模型組,即大鼠常規開腹后,暴露膽總管下端并結扎后經腹腔注射脂多糖 20 mg/(kg·d)處理;④ AOC 模型+LY294002 處理組,即大鼠在暴露膽總管下端并結扎后經腹腔注射脂多糖 20 mg/(kg·d)的同時腹腔注射 LY29400210 mg/(kg·d)處理。LY294002 安全有效劑量參考 Cheng 等[6]的報道。
1.4.2 大鼠生存情況觀察
每組隨機取 10 只大鼠用于觀察每天生存情況,觀察時間為 7 d。
1.4.3 大鼠血清中炎性因子和肝功能檢測
每組隨機取 5 只大鼠檢測炎性因子和肝功能。各組大鼠飼養 2 d 后,收集大鼠血清以檢測肝功能和炎性因子,然后人道處死,同時收集肝組織以進行組織學觀察。炎性因子檢測采用 ELISA 法,方法參見 1.3.4;肝功能檢測采用美國貝克曼全自動生化分析儀檢測。
1.4.4 蛋白印跡法檢測 PI3K、AKT 磷酸化和 S1PR2 蛋白表達
方法參見 1.3.3。
1.5 統計學方法
采用 SPSS 18.0 統計軟件對數據進行分析。計量資料采用以均數±標準差( ±s)表示。LY294002 及脂多糖處理組數據采用 2×2 的析因設計分析,多組間比較采用單因素方差分析(ANOVA),2 組間比較采用獨立樣本 t 檢驗。檢驗水準 α=0.050。
±s)表示。LY294002 及脂多糖處理組數據采用 2×2 的析因設計分析,多組間比較采用單因素方差分析(ANOVA),2 組間比較采用獨立樣本 t 檢驗。檢驗水準 α=0.050。
2 結果
2.1 體外培養的 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平對脂多糖誘導的炎癥反應的影響
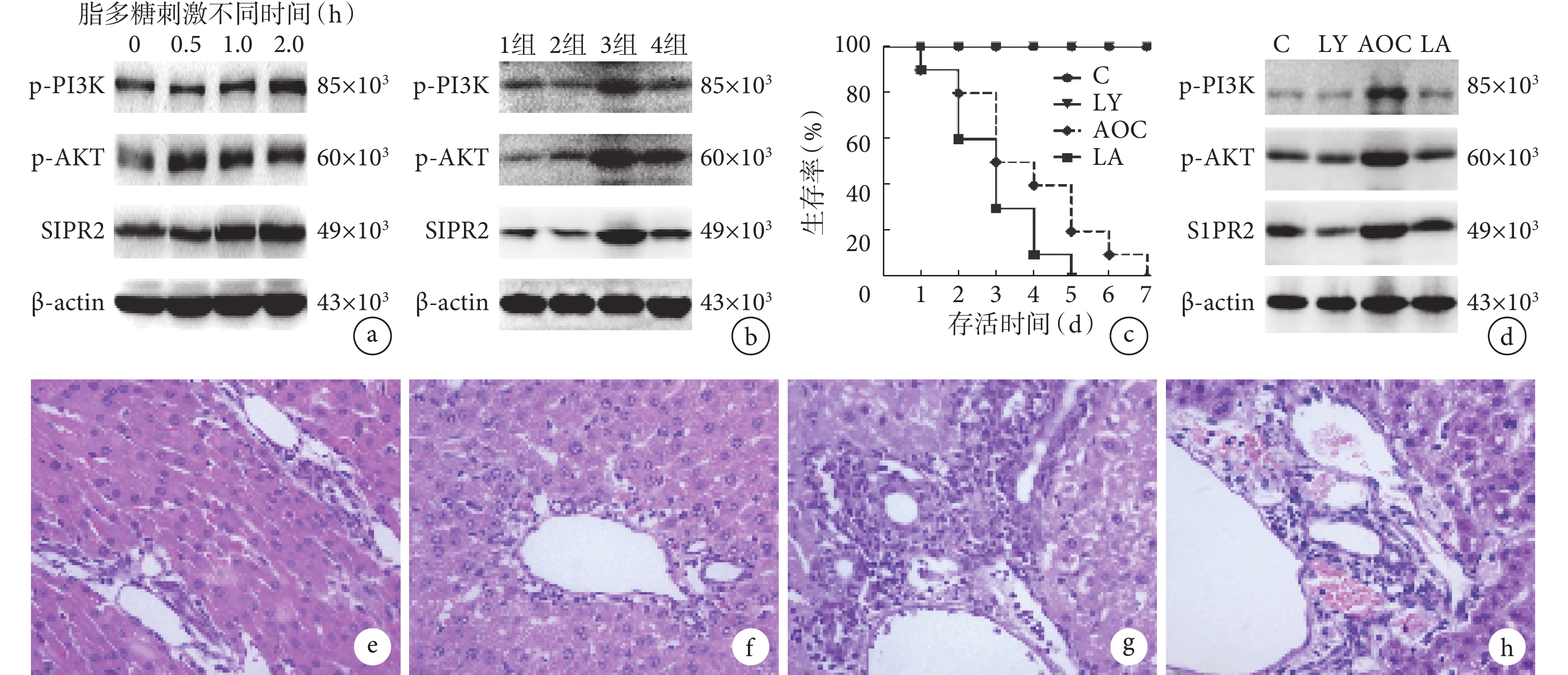
脂多糖刺激 PBMCs 0、0.5、1.0、2.0 h 時,隨著刺激時間的延長,PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達水平逐漸增強或升高(P<0.050),見圖1a 及表1;上清液中 TNF-α 和 IL-6 的水平也明顯升高(P<0.050),見表1。
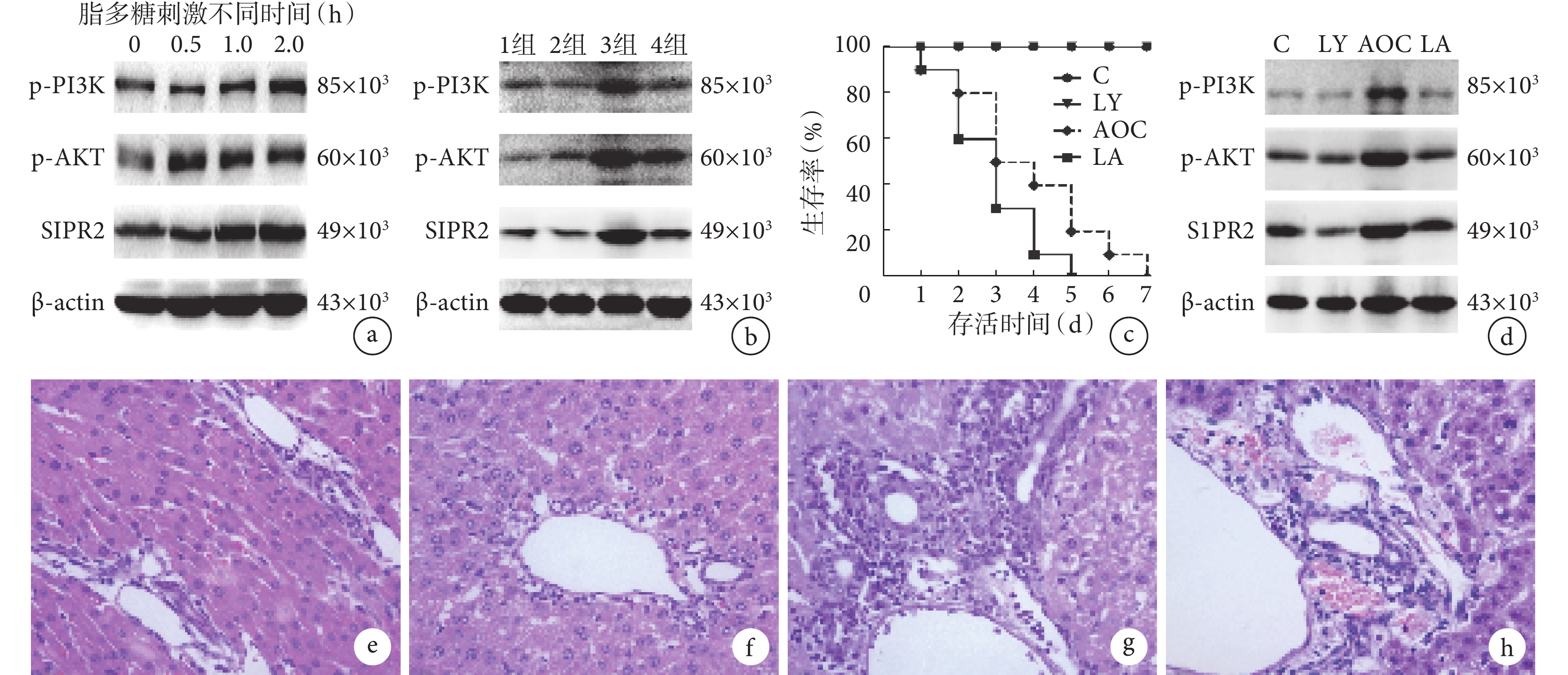 圖1
示脂多糖促進 PBMCs 和 LY294002 抑制脂多糖誘導的 PBMCs 中 PI3K/AKT-S1PR2 激活情況及對全身炎癥反應和肝組織的影響
圖1
示脂多糖促進 PBMCs 和 LY294002 抑制脂多糖誘導的 PBMCs 中 PI3K/AKT-S1PR2 激活情況及對全身炎癥反應和肝組織的影響
a:脂多糖刺激 PBMCs 不同時相時 PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達情況;b:不同措施處理后 PBMCs 中 PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達情況(1 組:空白對照組;2 組:LY294002 單獨刺激組;3 組:脂多糖單獨刺激組;4 組:LY294002 和脂多糖共同刺激組);c:各組大鼠生存情況(C:假手術組;LY:假手術+LY294002 處理組;AOC:AOC 模型組;LA:AOC 模型+LY294002 處理組);d:各組大鼠 PBMCs 中蛋白表達情況(C:假手術組;LY:假手術+LY294002 處理組;AOC:AOC 模型組;LA:AOC 模型+LY294002 處理組);e–h:假手術組(e)、假手術+LY294002 處理組(f)、AOC 模型組(g)及 AOC 模型+LY294002 處理組(h)的肝臟組織病理學改變(HE ×400)
 )
)
LY294002 和脂多糖共同刺激組 PI3K 和 AKT 磷酸化水平及 S1PR2 蛋白表達水平較單獨用脂多糖刺激組明顯減弱或降低(P<0.050),見圖1b 及表2;上清中 TNF-α 和 IL-6 的水平明顯低于單獨用脂多糖刺激組(P<0.050),見表2。
 )
)
2.2 LY294002 對 AOC 模型大鼠全身炎癥反應、肝功能及 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平的影響
2.2.1 各組大鼠生存情況
AOC 模型組大鼠在第 5 天時生存率為 0,而假手術+LY294002 處理組大鼠在第 2~5 天時的生存率均高于 AOC 模型組大鼠,第 5 天時大鼠的生存率為 20%,假手術組和 AOC 模型+LY294002 處理組大鼠 7 d 內生存率為 100%,見圖1c。
2.2.2 各組大鼠 TNF-α 和 IL-6 的水平情況
AOC 模型+LY294002 處理組大鼠血清中 TNF-α 和 IL-6 的水平均明顯低于 AOC 模型組大鼠(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050),見表3。
 )
)
2.2.3 AOC 大鼠 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達情況
結果見圖1d 及表3。從表 3 可見,AOC 模型+LY294002 處理組大鼠 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平均明顯低于 AOC 模型組(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050)。
2.2.4 大鼠肝組織及肝功能情況
AOC 模型+LY294002 處理組大鼠第 2 天時肝組織的炎癥細胞聚集和肝細胞壞死明顯少于 AOC 模型組,但多于假手術組及假手術+LY294002 處理組(圖1e–1h)。AOC 模型+LY294002 處理組肝功能指標 ALT、AST 和 TBIL 水平均明顯低于 AOC 模型組(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050),見表3。
3 討論
PI3K/AKT 通路在細胞周期、凋亡、增殖和分化過程中均發揮著不可忽視的作用,也是細胞信號傳導和放大的重要途徑之一,通過感受外界刺激或者環境變化誘導細胞作出適應性改變[7-9]。Chang 等[10]報道,溶血磷脂酰膽堿通過激活內皮細胞中 PI3K/AKT 通路,促進 IL-8 等促炎因子分泌;抑制 PI3K 磷酸化后,可降低 IL-8 水平并緩解溶血磷脂酰膽堿誘導的細胞毒性和凋亡。Zheng 等[11]報道,骨關節炎小鼠模型中,軟骨細胞中 PI3K/AKT 通路被激活,促進 IL-1β、TNF-α 等促炎因子分泌;抑制 PI3K/AKT 活性后,通過抑制核轉錄因子 κB 激活,可緩解關節軟骨破壞和滑膜炎。Liu 等[12]報道,外源性硫化氫可磷酸化激活 PI3K/AKT 通路,降低膿毒癥小鼠血清心肌酶水平以及炎癥因子的分泌水平。以上這些研究結果提示,抑制 PI3K/AKT 活性可降低炎癥相關疾病中免疫細胞分泌炎癥因子的能力。此外,Shearn 等[13]發現,原發性膽管炎合并炎性腸炎患者的肝組織中 AKT 的磷酸化水平較健康人顯著升高;Wang 等[14]報道抑制 AKT 等磷酸化后,可減輕膽總管結扎模型小鼠中肝損傷。這些研究結果提示,PI3K/AKT 的活性還與膽汁淤積性膽管炎誘導的肝損傷密切相關。在本研究中發現,PBMCs 中 PI3K/AKT 被磷酸化激活且促進炎癥因子 TNF-α 和 IL-6 的分泌,利用 PI3K 抑制劑 LY294002 抑制 PI3K/AKT 活性后炎癥因子 TNF-α 和 IL-6 分泌下降,同時可延長大鼠的生存時間,抑制肝臟炎癥和壞死。結果提示,PI3K/AKT 通路在免疫細胞介導的炎癥反應中可能發揮著關鍵的調節作用,其通過哪種途徑參與炎癥因子分泌,尚需深入研究。
S1PR2 是單核巨噬細胞感受炎癥刺激的重要細胞信使,也是參與膽汁酸代謝重要的細胞表面受體之一[15-17]。巨噬細胞中 S1PR2 的表達程度與膿毒血癥的嚴重程度呈正相關[2],且有文獻[18]報道 S1PR2 通過激活 PI3K/AKT 通路誘導核轉錄因子 κB 激活、促進 TNF-α 等炎癥因子分泌。Cui 等[19]報道,S1PR2 通過抑制一氧化氮合酶表達,從而抑制機體過敏性休克反應;而 Hsu 等[20]發現,抑制 S1PR2 后,可通過抑制 PI3K、核轉錄因子 κB 和絲裂原活化蛋白激酶的活性,降低放線共生放線桿菌誘導小鼠骨髓細胞分泌 TNF-α、IL-6 等炎癥因子水平;Song 等[21]發現抑制 S1PR2 后,降低了巨噬細胞的吞噬作用,并提高了大腸桿菌誘導的膿毒血癥小鼠的存活率。這些研究結果提示,PI3K/AKT 通路與 S1PR2 關系密切,均與細菌感染、膿毒血癥等急性炎癥疾病密切相關。此外,S1PR2 在肝臟中高表達,結合膽汁酸可提高肝細胞中 S1PR2 的表達[22];且選擇性拮抗 S1PR2 可降低膽總管結扎后小鼠門靜脈的壓力[23]。可見,S1PR2 參與膽總管閉塞和膽汁淤積等疾病的病理生理過程。而 Yang 等[24]報道 S1PR2/3 通過激活 toxin/PI3K/Rac1 通路,促進膽總管結扎后誘導的肝損傷和炎癥因子分泌,并加重小鼠的全身炎癥反應;Wang 等[14]報道利用 S1PR2/3 抑制劑 JTE-013 可通過抑制 AKT 和細胞外信號調節激酶 1/2 的活性,可減輕膽總管結扎后膽汁淤積誘導的肝損傷;Xiao 等[25]報道長鏈非編碼 RNA H19 通過抑制膽管結扎模型小鼠中 S1PR2 和鞘氨醇激酶 2 的表達,降低膽管結扎誘導的膽管細胞增殖與肝纖維化。在本研究中,S1PR2 在體外 AOC 模型的 PBMCs 均高表達,且與 PI3K/AKT 通路激活密切相關;抑制 PBMCs 的 PI3K 和 AKT 磷酸化后,S1PR2 表達下降,同時降低細胞和大鼠血清中炎癥因子的水平,從而延長大鼠的生存時間和降低肝臟的炎癥壞死程度。結合文獻報道和本研究結果提示,抑制 PBMCs 中 PI3K/AKT 通路的活化,可通過降低 S1PR2 的表達,抑制 AOC 誘導的大鼠全身炎癥反應。
總之,在 AOC 大鼠模型中,PBMCs 的 PI3K/AKT 通路被激活,可促進 S1PR2 表達,從而誘導炎癥因子的分泌和誘導大鼠全身炎癥反。利用 PI3K 抑制劑 LY294002 抑制 PI3K/AKT 磷酸化后,可下調 S1PR2 的表達,抑制大鼠的全身炎癥反應,從而延長大鼠的生存時間和降低肝臟的炎癥壞死程度。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們無相互競爭的利益。
作者貢獻聲明:余伍勇負責具體動物實驗的實施、數據收集和整理等工作;張文鋒負責具體的實驗設計、細胞實驗的實施和論文撰寫工作;程瑤協助數據整理、收集以及統計方法的指導;龔建平教授提出實驗的研究思路并在論文撰寫、修改過程中提出建議。
倫理聲明:本研究通過了重慶醫科大學倫理委員會審批(倫理編號:審第(2018)-103 號)。
急性梗阻性膽管炎(acute obstructive cholangitis,AOC)是肝膽外科常見疾病,病因主要是膽總管結石、新生物、膽總管狹窄等造成膽汁引流不暢,導致細菌及細菌產物脂多糖等反流入血,從而誘發全身炎癥反應[1]。磷脂酰肌醇-3-羥激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/AKT 通路參與單核巨噬細胞誘導的炎癥反應[1-3],且巨噬細胞中鞘氨醇-1-磷酸受體2(sphingosine 1-phosphate receptor 2,S1PR2)的表達水平與膿毒癥的嚴重程度呈正相關[4];在高糖培養條件下,S1PR2 可通過抑制 PI3K/AKT 激活抑制內皮細胞的功能[5]。但是 PI3K/AKT 通路下游主要作用靶點一直未有定論。在 AOC 模型中,PI3K/AKT 通路和 S1PR2 是否發生作用,目前鮮有報道。因此,本研究將探索在 AOC 模型大鼠中,外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)中 PI3K/AKT 通路和 S1PR2 激活情況以及其對 AOC 大鼠全身炎癥反應的影響。
1 材料與方法
1.1 實驗動物
SD 大鼠(6 周齡,160~200 g,雄性)購于重慶醫科大學動物實驗中心 [生產許可證號:SCXK(渝)2018-0003;使用許可證號:SYXK(渝)2018-0003]。大鼠飼養在獨立通氣籠盒動物房中,可自由進食和飲水。所有實驗操作均符合動物倫理學相關規定。
1.2 主要材料
脂多糖(L5293)購買于美國 Sigma 公司。PI3K 抑制劑 LY294002(產品目錄號:S1105)購買于美國 Selleck Chemicals 公司。大鼠腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和白細胞介素-6(interleukin 6,IL-6)ELISA 試劑盒(產品目錄號分別為:EK0526、EK0412)、兔抗 β-actin 抗體(產品目錄號:BM0626)、辣根過氧化物酶(HRP)標記山羊抗兔 IgG(產品目錄號:BA1050)和 RIPA 裂解液(產品目錄號:AR0102)均購買于武漢博士德科技公司。大鼠 PBMCs 分離液試劑盒(產品目錄號:LDS1080)購買于天津市灝洋生物制品科技有限責任公司。BCA 蛋白濃度測定試劑盒(產品目錄號:KGP902)和超敏型 ECL 化學發光試劑盒(產品目錄號:KGP1127)均購于江蘇凱基生物技術公司。兔抗磷酸化 PI3K 抗體(產品目錄號:ab182651)和 AKT 抗體(產品目錄號:ab131443)均購買于美國 Abcam 公司。兔抗 S1PR2 抗體(產品目錄號:PA5-72868)購買于美國 Thermo Fisher 公司。
1.3 體外實驗
1.3.1 PBMCs 的分離與培養
SD 大鼠乙醚吸入麻醉后,經眼眶靜脈叢取外周血。取 1.5 mL 的抗凝血加入 1.5 mL 的樣品稀釋液,混勻后在稀釋液底部加入 3 mL 的分離液。PBMCs 分離參照試劑盒說明書操作。水平離心機 500×g 離心 30 min,分層后取第二層白細胞層加入 10 mL 清洗液繼續 250×g 離心 10 min,重復 2 遍。最后所得到的細胞沉渣可繼續用來培養。
1.3.2 LY294002 處理體外 PBMCs
一部分 PBMCs 體外培養 12 h 后,加入脂多糖(500 ng/mL)刺激 PBMCs 后繼續培養 0.5、1.0、2.0 h,然后收集細胞上清及提取細胞總蛋白,檢測 PI3K/AKT-S1PR2 激活情況和細胞因子 TNF-α 和 IL-6 的水平,以確定脂多糖對 PBMCs 的刺激效果。一部分 PBMCs 體外培養 12 h 后,按不同處理分為 4 組:空白對照組,PBMCs 中只加入 PBS;LY294002 單獨刺激組,用 LY294002(50 μmol/L)直接刺激 PBMCs;脂多糖單獨刺激組,加入脂多糖(500 ng/mL)直接刺激 PBMCs;LY294002 和脂多糖共同刺激組,加入 LY294002(50 μmol/L)處理 1 h 后再加入脂多糖(500 ng/mL)刺激 PBMCs 2 h。分別在 2 h 后收集各組細胞上清和總蛋白,檢測 PI3K/AKT-S1PR2 激活情況和細胞因子 TNF-α 和 IL-6 的水平。
1.3.3 蛋白印跡法檢測 PI3K、AKT 磷酸化和 S1PR2 蛋白表達
分離的 PBMCs(1×106個)用 100 μL的 RIPA 裂解液提取總蛋白,采用 BCA 法檢測蛋白濃度和定量;然后 10% 的 SDS-PAGE 垂直電泳(100 V,120 min);接著進行轉膜(250 mA,110 min);再利用 5% 脫脂奶粉室溫封閉 PVDF 膜 2 h;一抗 4 ℃孵育 16 h 以上;PVDF 膜洗滌后,加 HRP 標記的山羊抗兔 IgG 抗體室溫孵育 1.5 h 后利用 ECL 法進行顯影。對蛋白進行半定量分析,即目的條帶灰度值與相應 β-actin 條帶灰度值的比值,即為目的蛋白相對表達量。
1.3.4 采用 ELISA 法檢測 TNF-α 和 IL-6 水平
采用市售 ELISA 試劑盒測定,所有的操作均嚴格按照試劑盒說明書進行操作。
1.4 體內實驗
1.4.1 動物分組與處理
取 60 只 SD 大鼠進行編號,通過隨機數生成器將 SD 大鼠隨機分為 4 組:① 假手術組,即大鼠吸入麻醉后,常規備皮、消毒、鋪巾、開腹,然后關腹;② 假手術+LY294002 處理組,即大鼠進行假手術后腹腔注射 LY294002 10 mg/(kg·d)處理;③ AOC 模型組,即大鼠常規開腹后,暴露膽總管下端并結扎后經腹腔注射脂多糖 20 mg/(kg·d)處理;④ AOC 模型+LY294002 處理組,即大鼠在暴露膽總管下端并結扎后經腹腔注射脂多糖 20 mg/(kg·d)的同時腹腔注射 LY29400210 mg/(kg·d)處理。LY294002 安全有效劑量參考 Cheng 等[6]的報道。
1.4.2 大鼠生存情況觀察
每組隨機取 10 只大鼠用于觀察每天生存情況,觀察時間為 7 d。
1.4.3 大鼠血清中炎性因子和肝功能檢測
每組隨機取 5 只大鼠檢測炎性因子和肝功能。各組大鼠飼養 2 d 后,收集大鼠血清以檢測肝功能和炎性因子,然后人道處死,同時收集肝組織以進行組織學觀察。炎性因子檢測采用 ELISA 法,方法參見 1.3.4;肝功能檢測采用美國貝克曼全自動生化分析儀檢測。
1.4.4 蛋白印跡法檢測 PI3K、AKT 磷酸化和 S1PR2 蛋白表達
方法參見 1.3.3。
1.5 統計學方法
采用 SPSS 18.0 統計軟件對數據進行分析。計量資料采用以均數±標準差( ±s)表示。LY294002 及脂多糖處理組數據采用 2×2 的析因設計分析,多組間比較采用單因素方差分析(ANOVA),2 組間比較采用獨立樣本 t 檢驗。檢驗水準 α=0.050。
±s)表示。LY294002 及脂多糖處理組數據采用 2×2 的析因設計分析,多組間比較采用單因素方差分析(ANOVA),2 組間比較采用獨立樣本 t 檢驗。檢驗水準 α=0.050。
2 結果
2.1 體外培養的 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平對脂多糖誘導的炎癥反應的影響
脂多糖刺激 PBMCs 0、0.5、1.0、2.0 h 時,隨著刺激時間的延長,PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達水平逐漸增強或升高(P<0.050),見圖1a 及表1;上清液中 TNF-α 和 IL-6 的水平也明顯升高(P<0.050),見表1。
 圖1
示脂多糖促進 PBMCs 和 LY294002 抑制脂多糖誘導的 PBMCs 中 PI3K/AKT-S1PR2 激活情況及對全身炎癥反應和肝組織的影響
圖1
示脂多糖促進 PBMCs 和 LY294002 抑制脂多糖誘導的 PBMCs 中 PI3K/AKT-S1PR2 激活情況及對全身炎癥反應和肝組織的影響
a:脂多糖刺激 PBMCs 不同時相時 PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達情況;b:不同措施處理后 PBMCs 中 PI3K 和 AKT 磷酸化水平和 S1PR2 蛋白表達情況(1 組:空白對照組;2 組:LY294002 單獨刺激組;3 組:脂多糖單獨刺激組;4 組:LY294002 和脂多糖共同刺激組);c:各組大鼠生存情況(C:假手術組;LY:假手術+LY294002 處理組;AOC:AOC 模型組;LA:AOC 模型+LY294002 處理組);d:各組大鼠 PBMCs 中蛋白表達情況(C:假手術組;LY:假手術+LY294002 處理組;AOC:AOC 模型組;LA:AOC 模型+LY294002 處理組);e–h:假手術組(e)、假手術+LY294002 處理組(f)、AOC 模型組(g)及 AOC 模型+LY294002 處理組(h)的肝臟組織病理學改變(HE ×400)
 )
)
LY294002 和脂多糖共同刺激組 PI3K 和 AKT 磷酸化水平及 S1PR2 蛋白表達水平較單獨用脂多糖刺激組明顯減弱或降低(P<0.050),見圖1b 及表2;上清中 TNF-α 和 IL-6 的水平明顯低于單獨用脂多糖刺激組(P<0.050),見表2。
 )
)
2.2 LY294002 對 AOC 模型大鼠全身炎癥反應、肝功能及 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平的影響
2.2.1 各組大鼠生存情況
AOC 模型組大鼠在第 5 天時生存率為 0,而假手術+LY294002 處理組大鼠在第 2~5 天時的生存率均高于 AOC 模型組大鼠,第 5 天時大鼠的生存率為 20%,假手術組和 AOC 模型+LY294002 處理組大鼠 7 d 內生存率為 100%,見圖1c。
2.2.2 各組大鼠 TNF-α 和 IL-6 的水平情況
AOC 模型+LY294002 處理組大鼠血清中 TNF-α 和 IL-6 的水平均明顯低于 AOC 模型組大鼠(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050),見表3。
 )
)
2.2.3 AOC 大鼠 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達情況
結果見圖1d 及表3。從表 3 可見,AOC 模型+LY294002 處理組大鼠 PBMCs 中 PI3K、AKT 磷酸化水平和 S1PR2 蛋白表達水平均明顯低于 AOC 模型組(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050)。
2.2.4 大鼠肝組織及肝功能情況
AOC 模型+LY294002 處理組大鼠第 2 天時肝組織的炎癥細胞聚集和肝細胞壞死明顯少于 AOC 模型組,但多于假手術組及假手術+LY294002 處理組(圖1e–1h)。AOC 模型+LY294002 處理組肝功能指標 ALT、AST 和 TBIL 水平均明顯低于 AOC 模型組(P<0.050),但高于假手術組(P<0.050)及假手術+LY294002 處理組(P<0.050),見表3。
3 討論
PI3K/AKT 通路在細胞周期、凋亡、增殖和分化過程中均發揮著不可忽視的作用,也是細胞信號傳導和放大的重要途徑之一,通過感受外界刺激或者環境變化誘導細胞作出適應性改變[7-9]。Chang 等[10]報道,溶血磷脂酰膽堿通過激活內皮細胞中 PI3K/AKT 通路,促進 IL-8 等促炎因子分泌;抑制 PI3K 磷酸化后,可降低 IL-8 水平并緩解溶血磷脂酰膽堿誘導的細胞毒性和凋亡。Zheng 等[11]報道,骨關節炎小鼠模型中,軟骨細胞中 PI3K/AKT 通路被激活,促進 IL-1β、TNF-α 等促炎因子分泌;抑制 PI3K/AKT 活性后,通過抑制核轉錄因子 κB 激活,可緩解關節軟骨破壞和滑膜炎。Liu 等[12]報道,外源性硫化氫可磷酸化激活 PI3K/AKT 通路,降低膿毒癥小鼠血清心肌酶水平以及炎癥因子的分泌水平。以上這些研究結果提示,抑制 PI3K/AKT 活性可降低炎癥相關疾病中免疫細胞分泌炎癥因子的能力。此外,Shearn 等[13]發現,原發性膽管炎合并炎性腸炎患者的肝組織中 AKT 的磷酸化水平較健康人顯著升高;Wang 等[14]報道抑制 AKT 等磷酸化后,可減輕膽總管結扎模型小鼠中肝損傷。這些研究結果提示,PI3K/AKT 的活性還與膽汁淤積性膽管炎誘導的肝損傷密切相關。在本研究中發現,PBMCs 中 PI3K/AKT 被磷酸化激活且促進炎癥因子 TNF-α 和 IL-6 的分泌,利用 PI3K 抑制劑 LY294002 抑制 PI3K/AKT 活性后炎癥因子 TNF-α 和 IL-6 分泌下降,同時可延長大鼠的生存時間,抑制肝臟炎癥和壞死。結果提示,PI3K/AKT 通路在免疫細胞介導的炎癥反應中可能發揮著關鍵的調節作用,其通過哪種途徑參與炎癥因子分泌,尚需深入研究。
S1PR2 是單核巨噬細胞感受炎癥刺激的重要細胞信使,也是參與膽汁酸代謝重要的細胞表面受體之一[15-17]。巨噬細胞中 S1PR2 的表達程度與膿毒血癥的嚴重程度呈正相關[2],且有文獻[18]報道 S1PR2 通過激活 PI3K/AKT 通路誘導核轉錄因子 κB 激活、促進 TNF-α 等炎癥因子分泌。Cui 等[19]報道,S1PR2 通過抑制一氧化氮合酶表達,從而抑制機體過敏性休克反應;而 Hsu 等[20]發現,抑制 S1PR2 后,可通過抑制 PI3K、核轉錄因子 κB 和絲裂原活化蛋白激酶的活性,降低放線共生放線桿菌誘導小鼠骨髓細胞分泌 TNF-α、IL-6 等炎癥因子水平;Song 等[21]發現抑制 S1PR2 后,降低了巨噬細胞的吞噬作用,并提高了大腸桿菌誘導的膿毒血癥小鼠的存活率。這些研究結果提示,PI3K/AKT 通路與 S1PR2 關系密切,均與細菌感染、膿毒血癥等急性炎癥疾病密切相關。此外,S1PR2 在肝臟中高表達,結合膽汁酸可提高肝細胞中 S1PR2 的表達[22];且選擇性拮抗 S1PR2 可降低膽總管結扎后小鼠門靜脈的壓力[23]。可見,S1PR2 參與膽總管閉塞和膽汁淤積等疾病的病理生理過程。而 Yang 等[24]報道 S1PR2/3 通過激活 toxin/PI3K/Rac1 通路,促進膽總管結扎后誘導的肝損傷和炎癥因子分泌,并加重小鼠的全身炎癥反應;Wang 等[14]報道利用 S1PR2/3 抑制劑 JTE-013 可通過抑制 AKT 和細胞外信號調節激酶 1/2 的活性,可減輕膽總管結扎后膽汁淤積誘導的肝損傷;Xiao 等[25]報道長鏈非編碼 RNA H19 通過抑制膽管結扎模型小鼠中 S1PR2 和鞘氨醇激酶 2 的表達,降低膽管結扎誘導的膽管細胞增殖與肝纖維化。在本研究中,S1PR2 在體外 AOC 模型的 PBMCs 均高表達,且與 PI3K/AKT 通路激活密切相關;抑制 PBMCs 的 PI3K 和 AKT 磷酸化后,S1PR2 表達下降,同時降低細胞和大鼠血清中炎癥因子的水平,從而延長大鼠的生存時間和降低肝臟的炎癥壞死程度。結合文獻報道和本研究結果提示,抑制 PBMCs 中 PI3K/AKT 通路的活化,可通過降低 S1PR2 的表達,抑制 AOC 誘導的大鼠全身炎癥反應。
總之,在 AOC 大鼠模型中,PBMCs 的 PI3K/AKT 通路被激活,可促進 S1PR2 表達,從而誘導炎癥因子的分泌和誘導大鼠全身炎癥反。利用 PI3K 抑制劑 LY294002 抑制 PI3K/AKT 磷酸化后,可下調 S1PR2 的表達,抑制大鼠的全身炎癥反應,從而延長大鼠的生存時間和降低肝臟的炎癥壞死程度。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們無相互競爭的利益。
作者貢獻聲明:余伍勇負責具體動物實驗的實施、數據收集和整理等工作;張文鋒負責具體的實驗設計、細胞實驗的實施和論文撰寫工作;程瑤協助數據整理、收集以及統計方法的指導;龔建平教授提出實驗的研究思路并在論文撰寫、修改過程中提出建議。
倫理聲明:本研究通過了重慶醫科大學倫理委員會審批(倫理編號:審第(2018)-103 號)。