引用本文: 譚萍, 張凌云, 張國欣, 劉葉榮, 何炎鴻, 劉志漢. 參附注射液對大鼠肢體缺血再灌注后肝臟損傷的保護作用. 中國普外基礎與臨床雜志, 2014, 21(8): 960-964. doi: 10.7507/1007-9424.20140232 復制
肢體缺血再灌注損傷是外科常見的病理生理過程,如止血帶使用時間過長、創傷、斷指再植、血栓再通等都可以引起肢體缺血再灌注損傷。肢體缺血再灌注除了能引起相應的肢體損傷,還可以通過神經-內分泌-免疫機制引發遠隔臟器功能障礙及損傷[1-3]。肢體缺血再灌注對相應肢體損傷的研究已較成熟,但對于肢體缺血再灌注引起的遠隔臟器損傷的研究卻較少見。本實驗通過建立大鼠肢體缺血再灌注模型,觀察參附注射液對肢體缺血再灌注損傷后肝功能及血紅素加氧酶-1(heme oxygenase 1,HO-1)表達的影響來探討其可能的保護機制。
1 材料與方法
1.1 動物及主要材料
1.1.1 動物
清潔級健康雄性SD大鼠64只(由甘肅中醫學院實驗動物中心提供,合格證號:0001093,本實驗在該中心動物倫理管理委員會的指導及同意下進行),體質量(350±20)g,飼養環境溫度(22±2)℃,自由進食、飲水。
1.1.2 藥物
參附注射液,三九制藥有限公司,批號:Z51020664,每支10 mL,1 mL含生藥紅參100 mg、附子100 mg。
1.1.3 試劑
超氧化物歧化酶(superoxide dismu-tase,SOD)和丙二醛(malondialdehyde,MDA)試劑盒購于南京建成生物工程公司;免疫組織化學鏈酶親和素-過氧化物酶復合物(SABC)試劑盒、免抗鼠HO-1多克隆抗體一抗及二抗購于武漢博士德公司;鋅原卟啉Ⅸ(Znpp,批號:282820)購于Sigma公司,美國。
1.1.4 儀器
小動物生命監測儀為成都泰盟400;病理切片機及醫學顯像照相系統為德國萊卡;BI-2000全自動醫學圖像分析系統對免疫組織化學陽性染色進行分析(甘肅省中醫藥研究院中心實驗室)。奧林巴斯全自動生化分析儀用于谷草轉氨酶(GOT)和谷丙轉氨酶(GPT)測定(甘肅省中醫院)。
1.2 方法
1.2.1 缺血再灌注模型制備及分組
①模型制備。實驗前禁食12 h,自由飲水,25%烏拉坦(1 g/kg)腹腔注射,麻醉后氣管切開,接動物呼吸機機械通氣(通氣頻率為75次/min,潮氣量為8 mL,吸呼比為1∶2),腹股溝處解剖出雙側股動脈,用無創動脈夾夾閉,遠端股動脈置管測壓,血壓為零表示缺血成功,保持后肢缺血3 h后去除動脈夾再灌注4 h,恢復后肢血供,血壓升高表示再灌注成功。②分組及取材。64只大鼠,隨機數字法分為4組,每組16只。假手術組:大鼠麻醉后僅分離不夾閉股動脈,分離血管前10 min以7.5 mL/kg腹腔注射生理鹽水;缺血再灌注組:夾閉股動脈前10 min以7.5 mL/kg腹腔注射生理鹽水,夾閉股動脈缺血3 h,再灌注4 h;參附干預組:夾閉股動脈前10 min以7.5 mL/kg腹腔注射參附注射液,夾閉股動脈缺血3 h,再灌注4 h;參附+Znpp干預組:術前30 min腹腔注射Znpp 5 mg/kg,余同參附干預組。各組動物均于再灌注4 h后處死(假手術組術后7 h取材),抽取1 mL靜脈血用于血清GPT、GOT檢測;取一側肝臟,冰磷酸鹽緩沖液(PBS)漂凈,濾干,置于-70℃冰箱保存,用于組織MDA、SOD的測定;另一側肝臟用10%中性甲醛固定,用于組織形態學觀察和免疫組織化學檢測。
1.2.2 血清GPT、GOT檢測
按常規方法檢測。
1.2.3 肝臟組織中SOD和MDA的測定
準確稱取1 g經冰PBS鹽水漂洗、濾干的肝臟組織,加入生理鹽水,手工勻漿制成10%的組織勻漿,低溫3 000 r/min(r=14 cm)離心15 min后取上清液,按說明書操作,采用化學比色法測定組織勻漿上清液中SOD活性和MDA含量。
1.2.4 肝臟組織中HO-1蛋白的檢測
選用SABC即用型免疫組織化學試劑盒,按說明書操作,取石蠟片按程序脫蠟,3% H2O2滅活內源性酶,微波抗原修復10 min,5%牛血清白蛋白(BSA)封閉,加兔抗HO-1多克隆抗體一抗,稀釋度為1∶80,冰箱過夜后加山羊抗鼠免疫球蛋白G,加酶標記物,DAB顯色,光鏡下觀察。HO-1蛋白陽性主要表達于核膜及周圍胞漿,呈棕色。應用Laica圖像分析系統,光鏡放大400倍攝取圖像,輸入圖像分析系統。測定HO-1蛋白陽性表達的吸光度值,每張切片隨機選取60個區域,計算每張切片的平均值。
1.2.5 組織形態學觀察
取10%中性甲醛固定的肝臟,常規制備肝臟全層組織石蠟切片,蘇木素-伊紅(HE)染色,光鏡下觀察肝臟損傷情況。
1.3 統計學方法
采用SPSS 13.0統計軟件,計量數據以均數±標準差(
2 結果
2.1 實驗動物情況
各組實驗過程中大鼠無死亡,缺血損傷造模過程中夾閉股動脈后,血管搏動消失,肢體輕度攣縮,松血管夾后血管搏動恢復。實驗動物麻醉復蘇后,各損傷造模組大鼠精神萎靡,出現不同程度的弓背、豎毛現象,而假手術組則無此表現。
2.2 4組大鼠血清中GOT和GPT含量變化
與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組血清GOT和GPT含量均明顯升高(P<0.05);與缺血再灌注組比較,參附干預組血清GOT和GPT含量明顯降低(P<0.05);與參附干預組比較,參附+Znpp干預組血清GOT和GPT含量明顯升高(P<0.05)。見表 1。
2.3 4組大鼠肝臟組織中MDA含量和SOD活性變化
與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組MDA含量均明顯升高(P<0.05),缺血再灌注組、參附+Znpp干預組SOD活性明顯降低(P<0.05);與缺血再灌注組比較,參附干預組MDA含量明顯降低(P<0.05),SOD活性明顯升高(P<0.05);與參附干預組比較,參附+Znpp干預組MDA含量明顯升高(P<0.05),SOD活性明顯降低(P<0.05)。見表 2。
2.4 光鏡下肝臟組織的病理改變
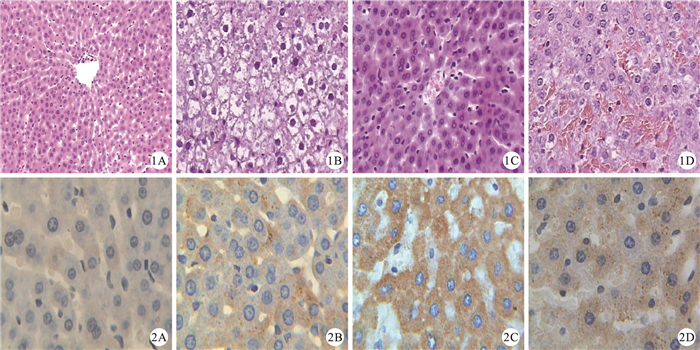
假手術組大鼠肝臟肝細胞索呈放射狀排列,肝血竇呈透明間隙,肝細胞呈多邊形,胞漿著色均勻;缺血再灌注組、參附+Znpp干預組大鼠肝臟組織在光鏡下見明顯的肝細胞索腫脹變寬,肝血竇變窄,尤其以匯管區明顯,嚴重者肝索排列紊亂或出現斷裂,肝細胞出現氣球樣變,病變波及整個肝小葉。參附干預組大鼠見輕度的肝細胞索腫脹變寬,肝血竇變窄。見圖 1。
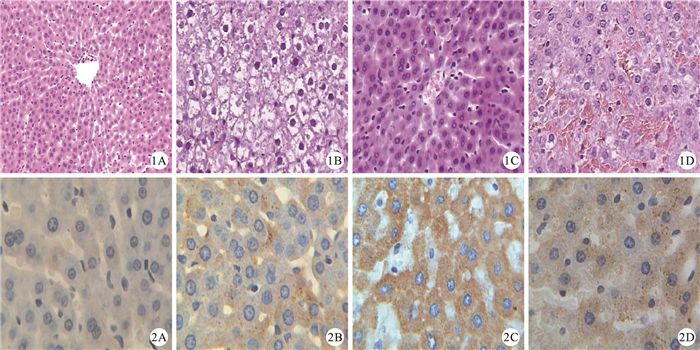 圖1
各組肝臟組織的病理學改變(HE×400)。1A:假手術組;1B:缺血再灌注組;1C:參附干預組;1D:參附+Znpp干預組??圖 2各組肝臟組織中HO-1蛋白表達(SABC×400)。2A:假手術組;2B:缺血再灌注組;2C:參附干預組;2D:參附+Znpp干預組
Figure1.
Changes of pathologic morphology of liver tissues in each group rats(HE×400). 1A: Sham operation group; 1B: Ischemia-reperfusion group; 1C: Shenfu group; 1D: Shenfu +Znpp group??Figure 2 HO-1 protein expressions of liver tissues in each group rats(SABC×400). 2A: Sham operation group; 2B: Ischemia-reperfusion group; 2C: Shenfu group; 2D: Shenfu+Znpp group
圖1
各組肝臟組織的病理學改變(HE×400)。1A:假手術組;1B:缺血再灌注組;1C:參附干預組;1D:參附+Znpp干預組??圖 2各組肝臟組織中HO-1蛋白表達(SABC×400)。2A:假手術組;2B:缺血再灌注組;2C:參附干預組;2D:參附+Znpp干預組
Figure1.
Changes of pathologic morphology of liver tissues in each group rats(HE×400). 1A: Sham operation group; 1B: Ischemia-reperfusion group; 1C: Shenfu group; 1D: Shenfu +Znpp group??Figure 2 HO-1 protein expressions of liver tissues in each group rats(SABC×400). 2A: Sham operation group; 2B: Ischemia-reperfusion group; 2C: Shenfu group; 2D: Shenfu+Znpp group
2.5 肝臟組織中HO-1蛋白表達結果
光鏡下見,各損傷造模組大鼠肝小管上皮細胞內HO-1的表達呈陽性染色,而假手術組呈弱陽性(圖 2)。HO-1蛋白表達在假手術組為0.078±0.010,缺血再灌注組為0.232±0.086,參附干預組為0.364±0.078,參附+Znpp干預組為0.356±0.069,與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組肝組織HO-1表達均明顯升高(P<0.05);與缺血再灌注組比較,參附干預組和參附+Znpp干預組肝組織HO-1表達明顯升高(P<0.05);參附干預組和參附+Znpp干預組2組HO-1蛋白表達比較,差異無統計學意義(P>0.05)。
3 討論
肢體缺血再灌注損傷的機理極為復雜,無復流導致一系列細胞結構、功能障礙;鈣超載導致離子交換變化,能量代謝障礙;中性粒細胞活化引發“呼吸暴發”,產生并釋放大量自由基和一些促炎性細胞因子,如核因子(NF)-κB、腫瘤壞死因子(TNF)-α等,造成組織損傷和血管通透性增加,以及自由基損傷作用等,從而引起全身炎癥反應[4-8]。在肢體缺血再灌注損傷過程中,肝臟是消除肢體源性內毒素和解毒的重要器官,也是體內遭受內毒素攻擊的主要器官。本實驗中,各缺血再灌注組大鼠血清中GOT和GPT含量較假手術組大鼠明顯升高(P<0.05);光鏡下觀察發現,各缺血再灌注組大鼠肝臟組織出現不同程度的損傷,結果提示,肢體源性內毒素在肢體缺血再灌注后肝損害發生機制中具有重要的致病作用。
參附注射液是紅參、黑附片的提取物,有效成分含人參皂苷、烏頭生物堿類等。國內早年的研究[9-10]肯定了參附注射液在減少心肌梗塞面積、維護心臟血流動力學以及抗氧自由基、脂質過氧化等方面的作用。近年來,隨著研究的深入,越來越多的分子生物學機制被提出,主要結論有:參附可以顯著抑制NF-κB活性,并下調多種炎性介質釋放,包括TNF-α、IL-6、IL-8、細胞間黏附分子-1、熱休克蛋白-70等[11-13]。
缺血再灌注損傷中氧自由基通過破壞生物膜的磷脂成分而對幾乎所有的細胞器都具有毒性作用,從而加重炎癥反應。MDA是脂質過氧化反應的代謝產物,可造成細胞脂質過氧化損傷。SOD是組織清除氧自由基的抗氧化酶,反映了組織抗脂質過氧化損傷的能力[14-15]。本研究發現,與假手術組相比,各肢體缺血再灌注組大鼠術后肝臟MDA含量增高,SOD活性下降,MDA、SOD數值變化表明肢體缺血再灌注后氧自由基產生增多,導致細胞膜脂質過氧化,損傷肝小管上皮細胞。組間比較發現,參附干預組較缺血再灌注組GOT和GPT顯著降低,MDA含量降低,SOD活性升高,病理損傷也較輕微,提示參附注射液預處理對肢體缺血再灌注后肝功能損害具有一定保護作用。其中SOD、MDA數值變化提示參附注射液可以部分對抗氧化,利于SOD的活性補充,從而共同維持機體氧化與抗氧化的平衡。
HO是血紅素分解代謝的限速酶,它能催化血紅素在機體內氧化降解,生成膽綠素、CO、Fe2+。其中,HO-1又稱熱休克蛋白32,為誘導生成型,在氧化應激條件下大量生成。近年來越來越多的研究[16-20]認為,HO-1具有抗炎、抗氧化應激損傷的作用。在本實驗中,肢體缺血再灌注組大鼠肝臟組織中HO-1蛋白表達較假手術組明顯提高,但術后肝功能損傷嚴重,說明HO-1升高的幅度不足以對抗缺血再灌注后造成的肝功能損傷。參附干預組大鼠肝臟組織中HO-1蛋白的表達較肢體缺血再灌注組有明顯提高,同時肝臟組織損傷顯著減輕,說明參附注射液有進一步上調HO-1蛋白的作用,并對肢體缺血再灌注后大鼠肝組織產生保護作用。本實驗在參附干預組基礎上通過預先給予HO-1活性抑制劑Znpp(參附+Znpp干預組),結果發現,與參附干預組比較,參附+Znpp干預組大鼠肝臟組織中HO-1蛋白表達相近,但組織損傷明顯加重。以上結果提示,參附注射液抗缺血再灌注損傷的功能一定程度上可能是通過上調HO-1蛋白的表達來實現的,當預先給了HO-1活性抑制劑Znpp后,HO-1活力降低,造成了參附注射液作用的減退。
綜上所述,肢體缺血再灌注可造成肝臟功能損傷,給予參附注射液預處理可以減輕肝臟損害程度,這種保護作用可能與參附注射液預處理上調HO-1蛋白在肝臟組織中的表達及抑制氧自由基生成有關。
肢體缺血再灌注損傷是外科常見的病理生理過程,如止血帶使用時間過長、創傷、斷指再植、血栓再通等都可以引起肢體缺血再灌注損傷。肢體缺血再灌注除了能引起相應的肢體損傷,還可以通過神經-內分泌-免疫機制引發遠隔臟器功能障礙及損傷[1-3]。肢體缺血再灌注對相應肢體損傷的研究已較成熟,但對于肢體缺血再灌注引起的遠隔臟器損傷的研究卻較少見。本實驗通過建立大鼠肢體缺血再灌注模型,觀察參附注射液對肢體缺血再灌注損傷后肝功能及血紅素加氧酶-1(heme oxygenase 1,HO-1)表達的影響來探討其可能的保護機制。
1 材料與方法
1.1 動物及主要材料
1.1.1 動物
清潔級健康雄性SD大鼠64只(由甘肅中醫學院實驗動物中心提供,合格證號:0001093,本實驗在該中心動物倫理管理委員會的指導及同意下進行),體質量(350±20)g,飼養環境溫度(22±2)℃,自由進食、飲水。
1.1.2 藥物
參附注射液,三九制藥有限公司,批號:Z51020664,每支10 mL,1 mL含生藥紅參100 mg、附子100 mg。
1.1.3 試劑
超氧化物歧化酶(superoxide dismu-tase,SOD)和丙二醛(malondialdehyde,MDA)試劑盒購于南京建成生物工程公司;免疫組織化學鏈酶親和素-過氧化物酶復合物(SABC)試劑盒、免抗鼠HO-1多克隆抗體一抗及二抗購于武漢博士德公司;鋅原卟啉Ⅸ(Znpp,批號:282820)購于Sigma公司,美國。
1.1.4 儀器
小動物生命監測儀為成都泰盟400;病理切片機及醫學顯像照相系統為德國萊卡;BI-2000全自動醫學圖像分析系統對免疫組織化學陽性染色進行分析(甘肅省中醫藥研究院中心實驗室)。奧林巴斯全自動生化分析儀用于谷草轉氨酶(GOT)和谷丙轉氨酶(GPT)測定(甘肅省中醫院)。
1.2 方法
1.2.1 缺血再灌注模型制備及分組
①模型制備。實驗前禁食12 h,自由飲水,25%烏拉坦(1 g/kg)腹腔注射,麻醉后氣管切開,接動物呼吸機機械通氣(通氣頻率為75次/min,潮氣量為8 mL,吸呼比為1∶2),腹股溝處解剖出雙側股動脈,用無創動脈夾夾閉,遠端股動脈置管測壓,血壓為零表示缺血成功,保持后肢缺血3 h后去除動脈夾再灌注4 h,恢復后肢血供,血壓升高表示再灌注成功。②分組及取材。64只大鼠,隨機數字法分為4組,每組16只。假手術組:大鼠麻醉后僅分離不夾閉股動脈,分離血管前10 min以7.5 mL/kg腹腔注射生理鹽水;缺血再灌注組:夾閉股動脈前10 min以7.5 mL/kg腹腔注射生理鹽水,夾閉股動脈缺血3 h,再灌注4 h;參附干預組:夾閉股動脈前10 min以7.5 mL/kg腹腔注射參附注射液,夾閉股動脈缺血3 h,再灌注4 h;參附+Znpp干預組:術前30 min腹腔注射Znpp 5 mg/kg,余同參附干預組。各組動物均于再灌注4 h后處死(假手術組術后7 h取材),抽取1 mL靜脈血用于血清GPT、GOT檢測;取一側肝臟,冰磷酸鹽緩沖液(PBS)漂凈,濾干,置于-70℃冰箱保存,用于組織MDA、SOD的測定;另一側肝臟用10%中性甲醛固定,用于組織形態學觀察和免疫組織化學檢測。
1.2.2 血清GPT、GOT檢測
按常規方法檢測。
1.2.3 肝臟組織中SOD和MDA的測定
準確稱取1 g經冰PBS鹽水漂洗、濾干的肝臟組織,加入生理鹽水,手工勻漿制成10%的組織勻漿,低溫3 000 r/min(r=14 cm)離心15 min后取上清液,按說明書操作,采用化學比色法測定組織勻漿上清液中SOD活性和MDA含量。
1.2.4 肝臟組織中HO-1蛋白的檢測
選用SABC即用型免疫組織化學試劑盒,按說明書操作,取石蠟片按程序脫蠟,3% H2O2滅活內源性酶,微波抗原修復10 min,5%牛血清白蛋白(BSA)封閉,加兔抗HO-1多克隆抗體一抗,稀釋度為1∶80,冰箱過夜后加山羊抗鼠免疫球蛋白G,加酶標記物,DAB顯色,光鏡下觀察。HO-1蛋白陽性主要表達于核膜及周圍胞漿,呈棕色。應用Laica圖像分析系統,光鏡放大400倍攝取圖像,輸入圖像分析系統。測定HO-1蛋白陽性表達的吸光度值,每張切片隨機選取60個區域,計算每張切片的平均值。
1.2.5 組織形態學觀察
取10%中性甲醛固定的肝臟,常規制備肝臟全層組織石蠟切片,蘇木素-伊紅(HE)染色,光鏡下觀察肝臟損傷情況。
1.3 統計學方法
采用SPSS 13.0統計軟件,計量數據以均數±標準差(
2 結果
2.1 實驗動物情況
各組實驗過程中大鼠無死亡,缺血損傷造模過程中夾閉股動脈后,血管搏動消失,肢體輕度攣縮,松血管夾后血管搏動恢復。實驗動物麻醉復蘇后,各損傷造模組大鼠精神萎靡,出現不同程度的弓背、豎毛現象,而假手術組則無此表現。
2.2 4組大鼠血清中GOT和GPT含量變化
與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組血清GOT和GPT含量均明顯升高(P<0.05);與缺血再灌注組比較,參附干預組血清GOT和GPT含量明顯降低(P<0.05);與參附干預組比較,參附+Znpp干預組血清GOT和GPT含量明顯升高(P<0.05)。見表 1。
2.3 4組大鼠肝臟組織中MDA含量和SOD活性變化
與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組MDA含量均明顯升高(P<0.05),缺血再灌注組、參附+Znpp干預組SOD活性明顯降低(P<0.05);與缺血再灌注組比較,參附干預組MDA含量明顯降低(P<0.05),SOD活性明顯升高(P<0.05);與參附干預組比較,參附+Znpp干預組MDA含量明顯升高(P<0.05),SOD活性明顯降低(P<0.05)。見表 2。
2.4 光鏡下肝臟組織的病理改變
假手術組大鼠肝臟肝細胞索呈放射狀排列,肝血竇呈透明間隙,肝細胞呈多邊形,胞漿著色均勻;缺血再灌注組、參附+Znpp干預組大鼠肝臟組織在光鏡下見明顯的肝細胞索腫脹變寬,肝血竇變窄,尤其以匯管區明顯,嚴重者肝索排列紊亂或出現斷裂,肝細胞出現氣球樣變,病變波及整個肝小葉。參附干預組大鼠見輕度的肝細胞索腫脹變寬,肝血竇變窄。見圖 1。
 圖1
各組肝臟組織的病理學改變(HE×400)。1A:假手術組;1B:缺血再灌注組;1C:參附干預組;1D:參附+Znpp干預組??圖 2各組肝臟組織中HO-1蛋白表達(SABC×400)。2A:假手術組;2B:缺血再灌注組;2C:參附干預組;2D:參附+Znpp干預組
Figure1.
Changes of pathologic morphology of liver tissues in each group rats(HE×400). 1A: Sham operation group; 1B: Ischemia-reperfusion group; 1C: Shenfu group; 1D: Shenfu +Znpp group??Figure 2 HO-1 protein expressions of liver tissues in each group rats(SABC×400). 2A: Sham operation group; 2B: Ischemia-reperfusion group; 2C: Shenfu group; 2D: Shenfu+Znpp group
圖1
各組肝臟組織的病理學改變(HE×400)。1A:假手術組;1B:缺血再灌注組;1C:參附干預組;1D:參附+Znpp干預組??圖 2各組肝臟組織中HO-1蛋白表達(SABC×400)。2A:假手術組;2B:缺血再灌注組;2C:參附干預組;2D:參附+Znpp干預組
Figure1.
Changes of pathologic morphology of liver tissues in each group rats(HE×400). 1A: Sham operation group; 1B: Ischemia-reperfusion group; 1C: Shenfu group; 1D: Shenfu +Znpp group??Figure 2 HO-1 protein expressions of liver tissues in each group rats(SABC×400). 2A: Sham operation group; 2B: Ischemia-reperfusion group; 2C: Shenfu group; 2D: Shenfu+Znpp group
2.5 肝臟組織中HO-1蛋白表達結果
光鏡下見,各損傷造模組大鼠肝小管上皮細胞內HO-1的表達呈陽性染色,而假手術組呈弱陽性(圖 2)。HO-1蛋白表達在假手術組為0.078±0.010,缺血再灌注組為0.232±0.086,參附干預組為0.364±0.078,參附+Znpp干預組為0.356±0.069,與假手術組比較,缺血再灌注組、參附干預組、參附+Znpp干預組肝組織HO-1表達均明顯升高(P<0.05);與缺血再灌注組比較,參附干預組和參附+Znpp干預組肝組織HO-1表達明顯升高(P<0.05);參附干預組和參附+Znpp干預組2組HO-1蛋白表達比較,差異無統計學意義(P>0.05)。
3 討論
肢體缺血再灌注損傷的機理極為復雜,無復流導致一系列細胞結構、功能障礙;鈣超載導致離子交換變化,能量代謝障礙;中性粒細胞活化引發“呼吸暴發”,產生并釋放大量自由基和一些促炎性細胞因子,如核因子(NF)-κB、腫瘤壞死因子(TNF)-α等,造成組織損傷和血管通透性增加,以及自由基損傷作用等,從而引起全身炎癥反應[4-8]。在肢體缺血再灌注損傷過程中,肝臟是消除肢體源性內毒素和解毒的重要器官,也是體內遭受內毒素攻擊的主要器官。本實驗中,各缺血再灌注組大鼠血清中GOT和GPT含量較假手術組大鼠明顯升高(P<0.05);光鏡下觀察發現,各缺血再灌注組大鼠肝臟組織出現不同程度的損傷,結果提示,肢體源性內毒素在肢體缺血再灌注后肝損害發生機制中具有重要的致病作用。
參附注射液是紅參、黑附片的提取物,有效成分含人參皂苷、烏頭生物堿類等。國內早年的研究[9-10]肯定了參附注射液在減少心肌梗塞面積、維護心臟血流動力學以及抗氧自由基、脂質過氧化等方面的作用。近年來,隨著研究的深入,越來越多的分子生物學機制被提出,主要結論有:參附可以顯著抑制NF-κB活性,并下調多種炎性介質釋放,包括TNF-α、IL-6、IL-8、細胞間黏附分子-1、熱休克蛋白-70等[11-13]。
缺血再灌注損傷中氧自由基通過破壞生物膜的磷脂成分而對幾乎所有的細胞器都具有毒性作用,從而加重炎癥反應。MDA是脂質過氧化反應的代謝產物,可造成細胞脂質過氧化損傷。SOD是組織清除氧自由基的抗氧化酶,反映了組織抗脂質過氧化損傷的能力[14-15]。本研究發現,與假手術組相比,各肢體缺血再灌注組大鼠術后肝臟MDA含量增高,SOD活性下降,MDA、SOD數值變化表明肢體缺血再灌注后氧自由基產生增多,導致細胞膜脂質過氧化,損傷肝小管上皮細胞。組間比較發現,參附干預組較缺血再灌注組GOT和GPT顯著降低,MDA含量降低,SOD活性升高,病理損傷也較輕微,提示參附注射液預處理對肢體缺血再灌注后肝功能損害具有一定保護作用。其中SOD、MDA數值變化提示參附注射液可以部分對抗氧化,利于SOD的活性補充,從而共同維持機體氧化與抗氧化的平衡。
HO是血紅素分解代謝的限速酶,它能催化血紅素在機體內氧化降解,生成膽綠素、CO、Fe2+。其中,HO-1又稱熱休克蛋白32,為誘導生成型,在氧化應激條件下大量生成。近年來越來越多的研究[16-20]認為,HO-1具有抗炎、抗氧化應激損傷的作用。在本實驗中,肢體缺血再灌注組大鼠肝臟組織中HO-1蛋白表達較假手術組明顯提高,但術后肝功能損傷嚴重,說明HO-1升高的幅度不足以對抗缺血再灌注后造成的肝功能損傷。參附干預組大鼠肝臟組織中HO-1蛋白的表達較肢體缺血再灌注組有明顯提高,同時肝臟組織損傷顯著減輕,說明參附注射液有進一步上調HO-1蛋白的作用,并對肢體缺血再灌注后大鼠肝組織產生保護作用。本實驗在參附干預組基礎上通過預先給予HO-1活性抑制劑Znpp(參附+Znpp干預組),結果發現,與參附干預組比較,參附+Znpp干預組大鼠肝臟組織中HO-1蛋白表達相近,但組織損傷明顯加重。以上結果提示,參附注射液抗缺血再灌注損傷的功能一定程度上可能是通過上調HO-1蛋白的表達來實現的,當預先給了HO-1活性抑制劑Znpp后,HO-1活力降低,造成了參附注射液作用的減退。
綜上所述,肢體缺血再灌注可造成肝臟功能損傷,給予參附注射液預處理可以減輕肝臟損害程度,這種保護作用可能與參附注射液預處理上調HO-1蛋白在肝臟組織中的表達及抑制氧自由基生成有關。