引用本文: 陳夢琪, 劉珂萌, 趙華琴, 賀霞. 術前系統免疫炎癥指數對非小細胞肺癌患者預后價值的系統評價與Meta分析. 中國胸心血管外科臨床雜志, 2023, 30(3): 440-446. doi: 10.7507/1007-4848.202202011 復制
肺癌是全球最常見的癌癥類型,癌癥統計數據顯示2020年全球估計有220萬例新發肺癌病例和180萬例死亡[1]。肺癌在組織學上分為兩個主要亞型:小細胞肺癌和非小細胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占所有肺癌的85%[2]。目前,NSCLC的臨床治療決策和預后預測均基于TNM分期,但由于該病早期癥狀隱匿、進展快,預后極差[3]。此外,癌癥患者預后的異質性導致臨床醫生的困惑。因此,尋找一個可靠的預后生物標志物對于患者的治療選擇和預后改善至關重要[4]。
研究[5]表明炎癥在癌癥的發展、腫瘤血管生成和轉移中起著不可或缺的作用。近年來,一些炎癥生物標志物,例如血小板與淋巴細胞比值、中性粒細胞與淋巴細胞比值、單核細胞與淋巴細胞比值等已被證明與癌癥預后相關[6-7]。然而,這些標志物僅整合了兩種類型的免疫細胞,其預測與預后能力尚有不足。系統免疫炎癥指數(systemic immune-inflammation index,SII)是一種基于中性粒細胞、淋巴細胞和血小板計數的新型免疫和炎癥指數。根據以往的研究[8],SII可能對癌癥患者有較高的預后價值。然而,NSCLC患者的術前SII與生存結局之間的關系仍有爭議。因此,我們進行了本Meta分析,以評估術前SII對NSCLC患者的預后作用。
1 資料與方法
1.1 納入和排除標準
1.1.1 研究類型
隊列研究,中文和英文。
1.1.2 研究對象
經病理診斷為NSCLC患者。
1.1.3 結局指標
主要結局指標:總生存期(overall survival,OS);次要結局指標:無病生存期(disease-free survival,DFS)和/或無復發生存期(recurrence-free survival,RFS)。研究確定了術前SII的明確閾值;研究中有足夠的數據來評估生存的風險比(hazard ratio,HR) 和相應的 95% 置信區間(confidence interval,CI)。
1.1.4 排除標準
基礎研究或動物研究;綜述、Meta分析、會議摘要、病例報告和未發表的研究;數據不可用或不充分的研究;重復發表的研究。
1.2 搜索策略
對PubMed、Web of Science、EMbase、The Cochrane Library、萬方和中國知網數據庫進行了系統的檢索以確定符合條件的研究。檢索時間為建庫至2021年12月。中文檢索關鍵詞:系統免疫炎癥指數、中性粒細胞、血小板、淋巴細胞、肺癌、肺腫瘤、非小細胞肺癌等;英文檢索關鍵詞:systemic immune-inflammation index、systemic inflammation-immune status、neutrophil、platelets、lymphocyte、SII、lung cancer、lung tumor、non-small cell lung cancer、NSCLC等。為了避免文獻遺漏,我們還手動搜索了相關綜述和Meta分析的參考文獻列表。如果存在異議則通過討論解決,必要時由第三位作者裁定。
1.3 數據提取
根據預先設定的表格,兩名作者分別從符合條件的文獻中提取以下數據:第一作者姓名、發表年份、研究地區、研究時間、研究設計、腫瘤類型、樣本量、患者年齡、患者性別、SII臨界值、腫瘤分期、生存結局以及中位隨訪時間。此外,所有的生存結果都直接表示為HR和相應的95%CI。該Meta分析的主要結果是OS,而次要結果是DFS和RFS。當研究中同時存在單變量和多變量分析時,使用來自多變量分析的數據。如遇分歧通過協商討論,必要時由第三位作者裁定。
1.4 質量評估
使用紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對納入的每項研究的方法學質量進行評估[9]。評分為7~9分的研究被認為是高質量研究。此步驟由兩名作者獨立完成,并通過商議解決分歧。
1.5 統計學分析
所有的統計分析均使用Stata 15.0(Stata Corp,College Station,TX,USA)進行。采用合并的HR和95%CI來評估術前SII與NSCLC患者預后的相關性。使用Cochrane的Q檢驗和Higgin的I2檢驗來估計研究之間的異質性。I2 >50%或P≤0.10表明研究間存在顯著的異質性。鑒于各研究納入的患者本身存在差異,本Meta分析采用隨機效應模型。進行亞組分析以探索異質性的潛在來源。另外,進行了敏感性分析以評估個體研究數據對生存結果的影響。使用Begg’s檢驗評估潛在的發表偏倚。P≤0.05為差異有統計學意義。
2 結果
2.1 文獻篩選流程
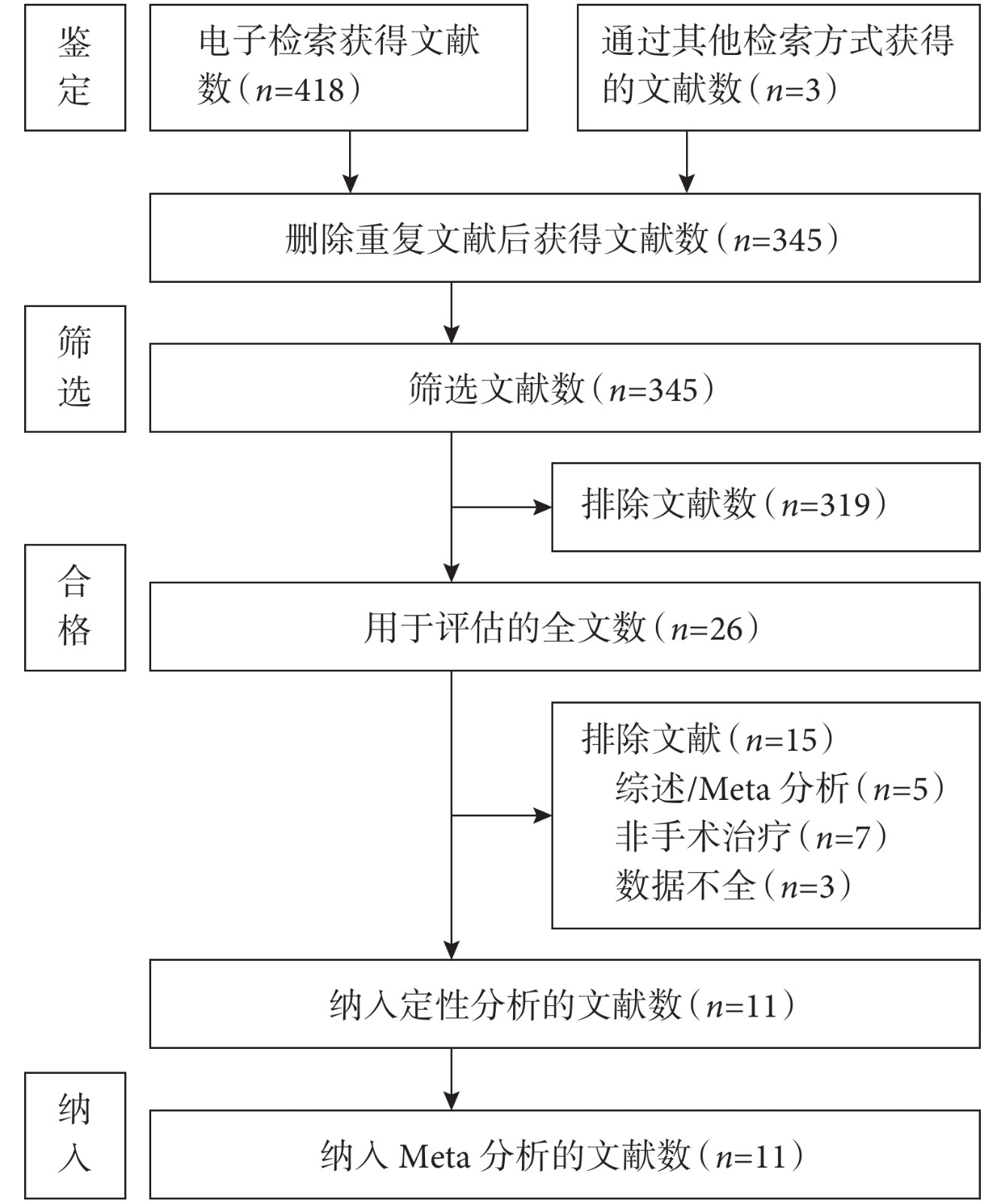
經過搜索最初確定了421篇文獻,刪除重復文獻后剩余345篇。通過閱讀標題和摘要排除了319篇。閱讀26篇文獻全文后,排除了15篇。最后,11篇文獻[4, 10-19]納入Meta分析;見圖1。
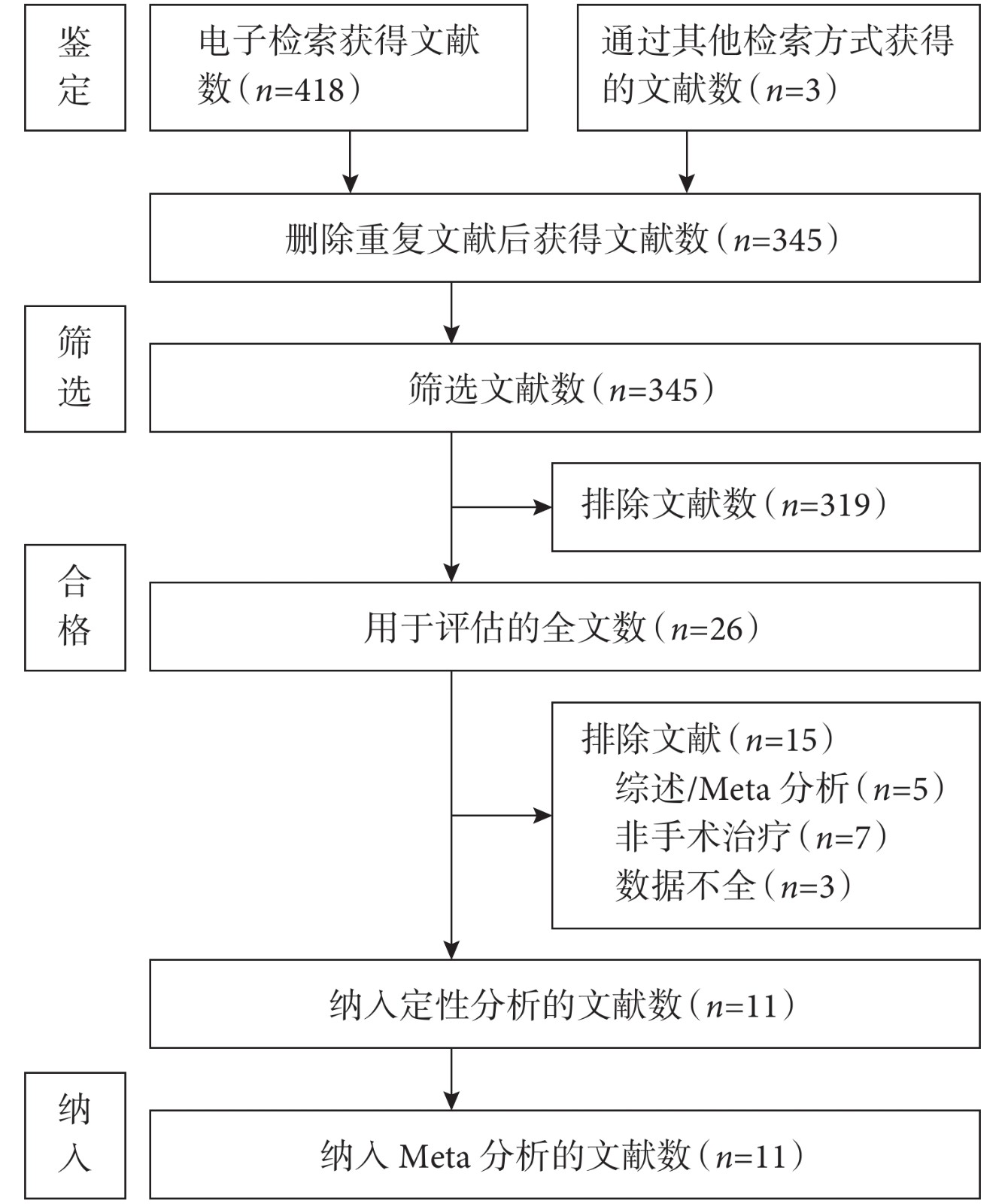 圖1
文獻篩選的詳細流程圖
圖1
文獻篩選的詳細流程圖
2.2 納入研究的基本情況
由于Wang等[12]進行了2項隊列研究(訓練隊列和驗證隊列),故本研究共納入了12項隊列研究。其中11項對列為回顧性設計、1項為前瞻性研究。大部分研究來自中國,只有2項研究[14, 19]來自日本。納入研究的樣本量范圍為124~3 984例,納入患者的中位年齡為60~71歲,SII的臨界值范圍為358~650。納入研究的中位隨訪時間為27.2~63個月,但有1項研究[10]未報告隨訪時間。此外,9項研究[4, 10-13, 15-16, 18]報道了SII與OS之間的關聯,6項研究[10, 12, 14-15, 17]報道了SII與DFS的相關性,3項研究[14, 16, 19]報道了SII與RFS的關系。所有納入研究的NOS評分均≥7分,表明納入研究的整體質量較高。納入研究的主要特征和質量評價結果見表1。
 /M(范圍)]
/M(范圍)]
2.3 Meta分析結果
2.3.1 SII與患者OS的相關性
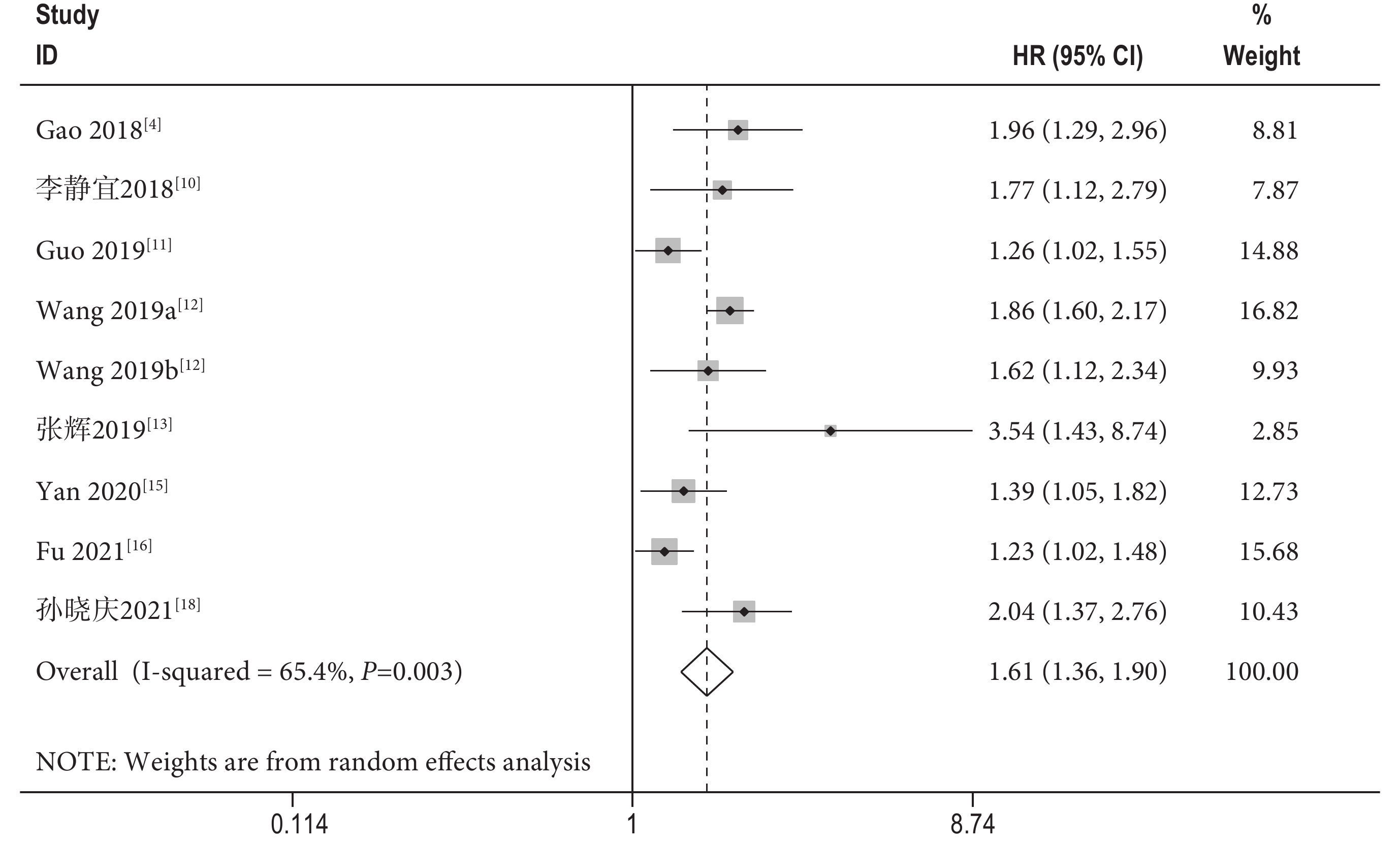
共有8篇文獻[4, 10-13, 15-16, 18](包含9項隊列研究)探討了NSCLC患者的術前SII與OS的相關性。Meta分析結果顯示,術前SII較高的患者OS更差[HR=1.61,95%CI(1.36,1.90),P<0.001],且研究間存在顯著的異質性(I2=65.4%,P=0.003);見圖2。另外,基于樣本量、SII臨界值、臨界值確定方式以及隨訪時間的OS亞組分析進一步支持了上述結果;見表2,并揭示了樣本量、SII臨界值、臨界值確定方式以及隨訪時間都是造成顯著異質性的潛在原因。
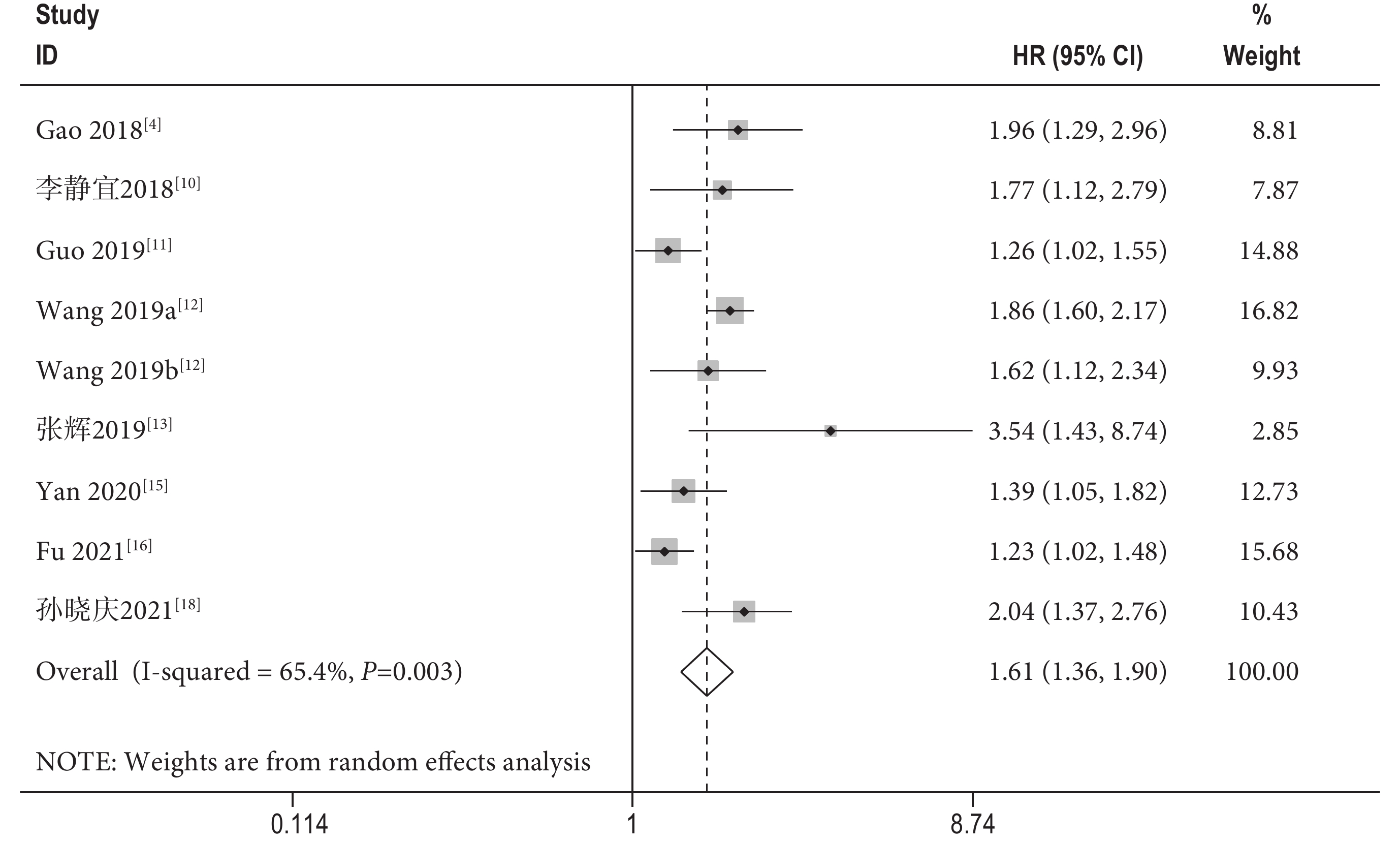 圖2
術前免疫炎癥指數與患者總生存期之間關系的森林圖
圖2
術前免疫炎癥指數與患者總生存期之間關系的森林圖
2.3.2 SII與患者DFS的相關性
共有5篇文獻[10, 12, 14-15, 17](包含6項隊列研究)探討了NSCLC患者術前SII與DFS的相關性。Meta分析結果顯示,升高的SII與患者較差的DFS顯著相關[HR=1.50,95%CI(1.34,1.68),P<0.001],且研究間未觀察到顯著異質性(I2=0.0%,P=0.889)。亞組分析也表明無論樣本量、SII臨界值、臨界值確定方式以及隨訪時間如何,高SII與較差的DFS始終相關;見表2。
2.3.3 SII與患者RFS的相關性
共有3篇文獻[14, 16, 19]探討了NSCLC患者術前SII與RFS的相關性。Meta分析結果顯示,術前SII升高的患者RFS較差[HR=1.17,95%CI(1.04,1.33),P<0.001],且研究間未觀察到顯著異質性(I2=0.0%,P=0.770)。
2.4 敏感性分析
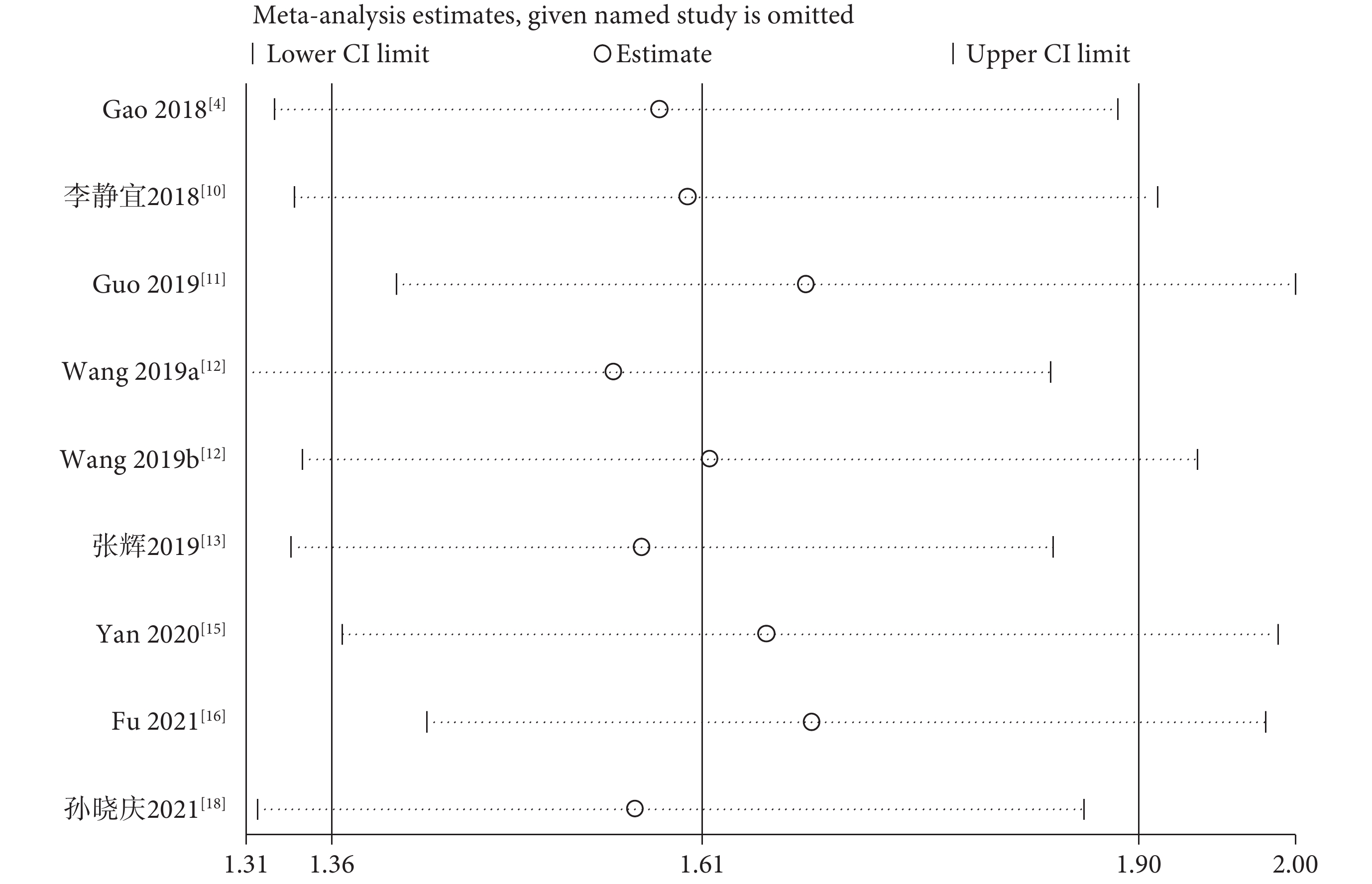
采用敏感性分析評估OS合并結果的可靠性。在分析中依次剔除每項研究后,OS的總體HR估計值沒有顯著改變,表明Meta分析結果相對穩定和可靠;見圖3。
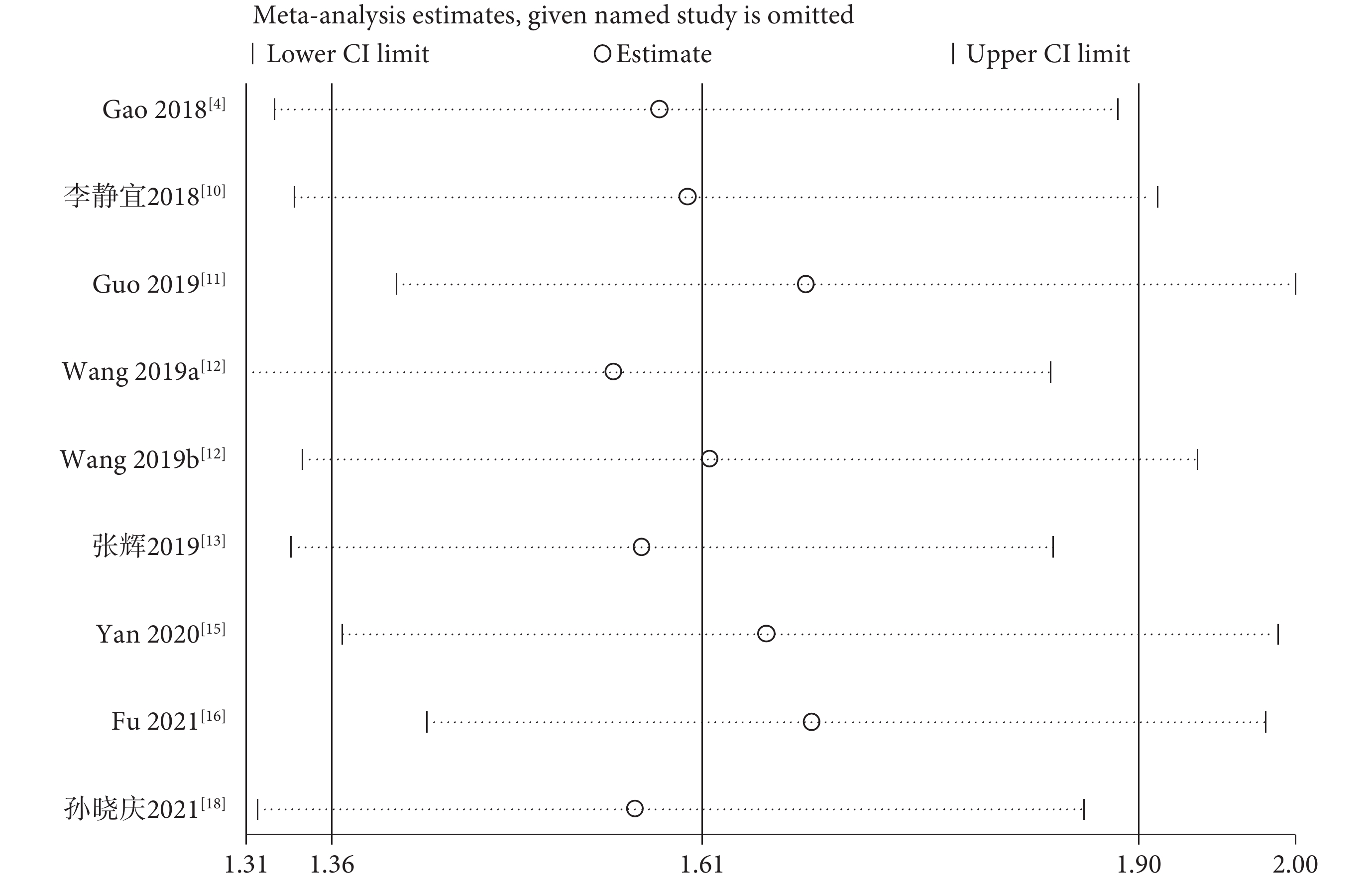 圖3
術前免疫炎癥指數與患者總生存期相關性的敏感性分析
圖3
術前免疫炎癥指數與患者總生存期相關性的敏感性分析
2.5 發表偏倚
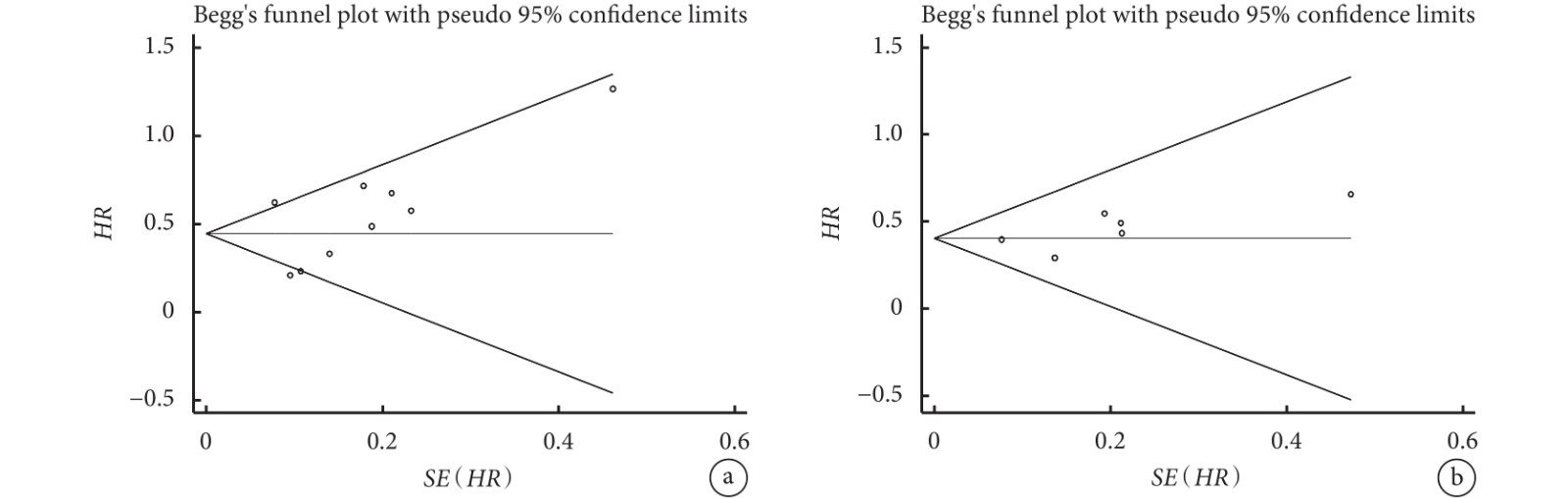
采用Begg’s漏斗圖評估納入研究潛在的發表偏倚。關于術前SII與OS、DFS關系的Meta分析,Begg’s檢驗未見明顯的發表偏倚(OS:P=0.251,DFS:P=0.452);見圖4。
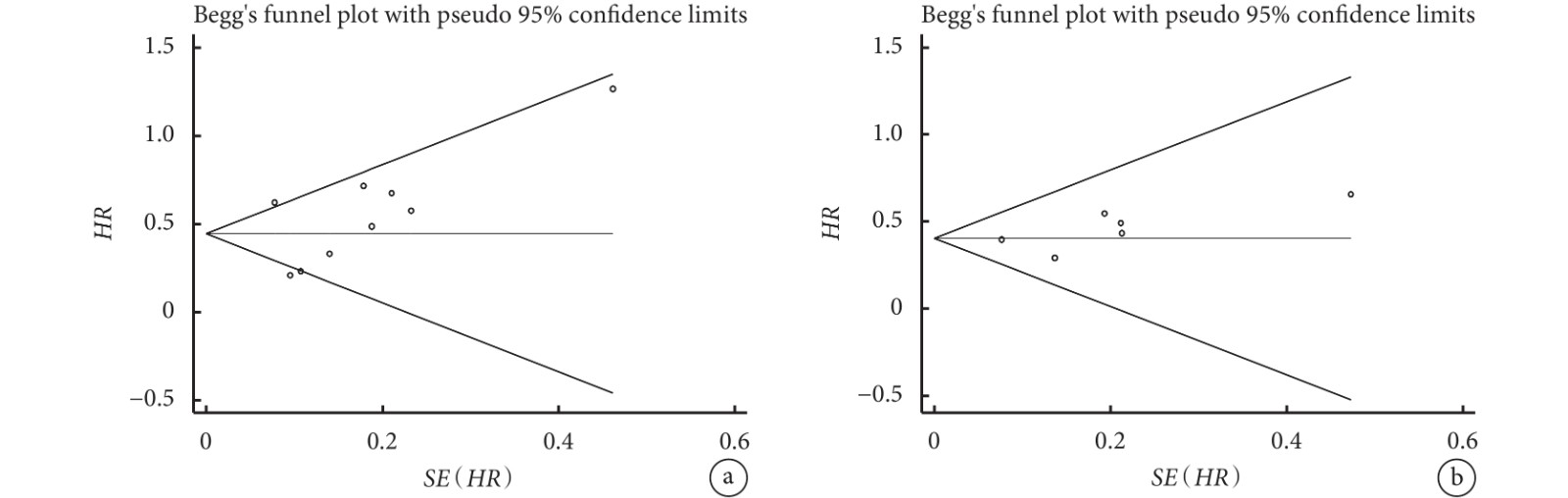 圖4
術前免疫炎癥指數與總生存期、無病生存期之間關系的漏斗圖
圖4
術前免疫炎癥指數與總生存期、無病生存期之間關系的漏斗圖
a:總生存期;b:無病生存期
3 討論
SII作為一種新的預后參數,可以很容易地通過常規全血計數檢測計算出來,并能夠反映癌癥患者免疫系統的整體狀態。雖然之前有一些研究報道了SII與NSCLC之間的關系,但我們發現不同結果之間存在差異。在本Meta分析中,我們收集了來自9 180例患者的11篇文獻數據,以評估SII在接受手術治療的NSCLC患者預后方面的潛在價值。我們的統計分析顯示,術前SII水平的升高更有可能與較差的生存結果相關,如較短的OS、DFS和RFS,不同的亞組分析也強力支持了這一結果。因此,術前SII可能是NSCLC患者有效的預后生物標志物。
近年來,腫瘤微環境在腫瘤免疫學領域受到越來越多的關注。多種炎癥細胞和介質是腫瘤微環境的重要組成部分[20]。SII是根據外周中性粒細胞、血小板和淋巴細胞計數來計算的。高SII對應于高血小板/中性粒細胞和/或低淋巴細胞計數。因此,SII值的升高表明存在具有浸潤性免疫細胞的高炎性腫瘤微環境[21]。外周血中中性粒細胞的存在通常與癌癥患者的預后不良有關[22]。中性粒細胞可以激活內皮細胞和實質細胞,從而促進循環腫瘤細胞(circulating tumor cell,CTC)的轉移[23]。中性粒細胞也通過分泌炎癥介質來介導癌細胞的增殖和轉移[24]。此外,血小板可能保護CTC,以保護其免受抗腫瘤免疫反應,從而促進癌細胞的血管生成和轉移[25]。研究[26]表明血小板還能夠釋放多種生長因子,增強體外癌細胞增殖。淋巴細胞,尤其是腫瘤浸潤淋巴細胞,進一步在宿主對惡性腫瘤的免疫反應中發揮關鍵作用。淋巴細胞可誘導細胞毒性細胞死亡并抑制腫瘤細胞增殖[27]。因此,SII也可能反映了宿主炎癥和免疫通路的激活。此外,SII的測量方式便宜、易于執行且可重復,這使得SII在臨床實踐中成為 NSCLC預后有前途的標志物。
之前的幾項研究調查了SII在實體瘤中的預后作用。在對22項研究數據的匯總分析中,Yang等[8]發現高SII可能是各種癌癥中OS較差的可靠預后因素。 Qiu等[28]的研究表明,治療前高SII與胃癌患者較差的OS(HR=1.40,P=0.010)以及一些臨床特征(如更高的腫瘤分期、陽性淋巴結轉移和更大的腫瘤)顯著相關,故他們建議可以監測SII以指導預后并提供有關胃癌疾病進展風險的可靠信息。Biswas 等[29]報道SII是Ⅲ期局部晚期NSCLC患者OS和無進展生存期的重要預測因子。有學者[30]也表明治療前SII較高的ⅢA/N2 期NSCLC患者可能需要更有力的輔助治療。此外,最近的一項研究[31]證實SII是肺癌切除術后肺部并發癥的最重要預測因素。在這里,我們證明了SII對NSCLC中OS、DFS和RFS的預后效果,這與其他癌癥類型的發現一致。根據我們的發現和其他相關研究,SII作為NSCLC的有效預后標志物可用于幫助患者進行風險分層并制定適當的臨床治療策略。
盡管該研究為NSCLC患者術前SII的預后價值提供了額外的實質性證據,但仍存在一些局限性:(1)納入的研究基本是回顧性的,因此與回顧性研究相關的固有結構偏倚可能導致研究間的異質性;(2)所有研究均來自于亞洲地區(中國或日本),這可能存在較大的地區和人群偏倚;(3)盡管NSCLC患者均接受了手術治療,但術后輔助治療策略和病理適應證因機構而異,可能具有不同的生存結局;(4)納入研究中不同的SII臨界值和測量方法可能導致結果偏差;(5)由于研究之間的異質性,目前無法確定SII預測NSCLC患者術后結果的最佳臨界值。
綜上,術前SII升高與NSCLC患者的不良生存結果顯著相關。SII可能在改善NSCLC的臨床決策中發揮重要作用。然而,由于本研究的局限性,仍需要更大規模的前瞻性研究來驗證我們的研究結果。
利益沖突:無。
作者貢獻:賀霞負責論文設計、審閱與修改,實施研究;陳夢琪負責實施研究,數據整理與分析,論文撰寫與修改;劉珂萌、趙華琴負責數據整理與分析。
肺癌是全球最常見的癌癥類型,癌癥統計數據顯示2020年全球估計有220萬例新發肺癌病例和180萬例死亡[1]。肺癌在組織學上分為兩個主要亞型:小細胞肺癌和非小細胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占所有肺癌的85%[2]。目前,NSCLC的臨床治療決策和預后預測均基于TNM分期,但由于該病早期癥狀隱匿、進展快,預后極差[3]。此外,癌癥患者預后的異質性導致臨床醫生的困惑。因此,尋找一個可靠的預后生物標志物對于患者的治療選擇和預后改善至關重要[4]。
研究[5]表明炎癥在癌癥的發展、腫瘤血管生成和轉移中起著不可或缺的作用。近年來,一些炎癥生物標志物,例如血小板與淋巴細胞比值、中性粒細胞與淋巴細胞比值、單核細胞與淋巴細胞比值等已被證明與癌癥預后相關[6-7]。然而,這些標志物僅整合了兩種類型的免疫細胞,其預測與預后能力尚有不足。系統免疫炎癥指數(systemic immune-inflammation index,SII)是一種基于中性粒細胞、淋巴細胞和血小板計數的新型免疫和炎癥指數。根據以往的研究[8],SII可能對癌癥患者有較高的預后價值。然而,NSCLC患者的術前SII與生存結局之間的關系仍有爭議。因此,我們進行了本Meta分析,以評估術前SII對NSCLC患者的預后作用。
1 資料與方法
1.1 納入和排除標準
1.1.1 研究類型
隊列研究,中文和英文。
1.1.2 研究對象
經病理診斷為NSCLC患者。
1.1.3 結局指標
主要結局指標:總生存期(overall survival,OS);次要結局指標:無病生存期(disease-free survival,DFS)和/或無復發生存期(recurrence-free survival,RFS)。研究確定了術前SII的明確閾值;研究中有足夠的數據來評估生存的風險比(hazard ratio,HR) 和相應的 95% 置信區間(confidence interval,CI)。
1.1.4 排除標準
基礎研究或動物研究;綜述、Meta分析、會議摘要、病例報告和未發表的研究;數據不可用或不充分的研究;重復發表的研究。
1.2 搜索策略
對PubMed、Web of Science、EMbase、The Cochrane Library、萬方和中國知網數據庫進行了系統的檢索以確定符合條件的研究。檢索時間為建庫至2021年12月。中文檢索關鍵詞:系統免疫炎癥指數、中性粒細胞、血小板、淋巴細胞、肺癌、肺腫瘤、非小細胞肺癌等;英文檢索關鍵詞:systemic immune-inflammation index、systemic inflammation-immune status、neutrophil、platelets、lymphocyte、SII、lung cancer、lung tumor、non-small cell lung cancer、NSCLC等。為了避免文獻遺漏,我們還手動搜索了相關綜述和Meta分析的參考文獻列表。如果存在異議則通過討論解決,必要時由第三位作者裁定。
1.3 數據提取
根據預先設定的表格,兩名作者分別從符合條件的文獻中提取以下數據:第一作者姓名、發表年份、研究地區、研究時間、研究設計、腫瘤類型、樣本量、患者年齡、患者性別、SII臨界值、腫瘤分期、生存結局以及中位隨訪時間。此外,所有的生存結果都直接表示為HR和相應的95%CI。該Meta分析的主要結果是OS,而次要結果是DFS和RFS。當研究中同時存在單變量和多變量分析時,使用來自多變量分析的數據。如遇分歧通過協商討論,必要時由第三位作者裁定。
1.4 質量評估
使用紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對納入的每項研究的方法學質量進行評估[9]。評分為7~9分的研究被認為是高質量研究。此步驟由兩名作者獨立完成,并通過商議解決分歧。
1.5 統計學分析
所有的統計分析均使用Stata 15.0(Stata Corp,College Station,TX,USA)進行。采用合并的HR和95%CI來評估術前SII與NSCLC患者預后的相關性。使用Cochrane的Q檢驗和Higgin的I2檢驗來估計研究之間的異質性。I2 >50%或P≤0.10表明研究間存在顯著的異質性。鑒于各研究納入的患者本身存在差異,本Meta分析采用隨機效應模型。進行亞組分析以探索異質性的潛在來源。另外,進行了敏感性分析以評估個體研究數據對生存結果的影響。使用Begg’s檢驗評估潛在的發表偏倚。P≤0.05為差異有統計學意義。
2 結果
2.1 文獻篩選流程
經過搜索最初確定了421篇文獻,刪除重復文獻后剩余345篇。通過閱讀標題和摘要排除了319篇。閱讀26篇文獻全文后,排除了15篇。最后,11篇文獻[4, 10-19]納入Meta分析;見圖1。
 圖1
文獻篩選的詳細流程圖
圖1
文獻篩選的詳細流程圖
2.2 納入研究的基本情況
由于Wang等[12]進行了2項隊列研究(訓練隊列和驗證隊列),故本研究共納入了12項隊列研究。其中11項對列為回顧性設計、1項為前瞻性研究。大部分研究來自中國,只有2項研究[14, 19]來自日本。納入研究的樣本量范圍為124~3 984例,納入患者的中位年齡為60~71歲,SII的臨界值范圍為358~650。納入研究的中位隨訪時間為27.2~63個月,但有1項研究[10]未報告隨訪時間。此外,9項研究[4, 10-13, 15-16, 18]報道了SII與OS之間的關聯,6項研究[10, 12, 14-15, 17]報道了SII與DFS的相關性,3項研究[14, 16, 19]報道了SII與RFS的關系。所有納入研究的NOS評分均≥7分,表明納入研究的整體質量較高。納入研究的主要特征和質量評價結果見表1。
 /M(范圍)]
/M(范圍)]
2.3 Meta分析結果
2.3.1 SII與患者OS的相關性
共有8篇文獻[4, 10-13, 15-16, 18](包含9項隊列研究)探討了NSCLC患者的術前SII與OS的相關性。Meta分析結果顯示,術前SII較高的患者OS更差[HR=1.61,95%CI(1.36,1.90),P<0.001],且研究間存在顯著的異質性(I2=65.4%,P=0.003);見圖2。另外,基于樣本量、SII臨界值、臨界值確定方式以及隨訪時間的OS亞組分析進一步支持了上述結果;見表2,并揭示了樣本量、SII臨界值、臨界值確定方式以及隨訪時間都是造成顯著異質性的潛在原因。
 圖2
術前免疫炎癥指數與患者總生存期之間關系的森林圖
圖2
術前免疫炎癥指數與患者總生存期之間關系的森林圖
2.3.2 SII與患者DFS的相關性
共有5篇文獻[10, 12, 14-15, 17](包含6項隊列研究)探討了NSCLC患者術前SII與DFS的相關性。Meta分析結果顯示,升高的SII與患者較差的DFS顯著相關[HR=1.50,95%CI(1.34,1.68),P<0.001],且研究間未觀察到顯著異質性(I2=0.0%,P=0.889)。亞組分析也表明無論樣本量、SII臨界值、臨界值確定方式以及隨訪時間如何,高SII與較差的DFS始終相關;見表2。
2.3.3 SII與患者RFS的相關性
共有3篇文獻[14, 16, 19]探討了NSCLC患者術前SII與RFS的相關性。Meta分析結果顯示,術前SII升高的患者RFS較差[HR=1.17,95%CI(1.04,1.33),P<0.001],且研究間未觀察到顯著異質性(I2=0.0%,P=0.770)。
2.4 敏感性分析
采用敏感性分析評估OS合并結果的可靠性。在分析中依次剔除每項研究后,OS的總體HR估計值沒有顯著改變,表明Meta分析結果相對穩定和可靠;見圖3。
 圖3
術前免疫炎癥指數與患者總生存期相關性的敏感性分析
圖3
術前免疫炎癥指數與患者總生存期相關性的敏感性分析
2.5 發表偏倚
采用Begg’s漏斗圖評估納入研究潛在的發表偏倚。關于術前SII與OS、DFS關系的Meta分析,Begg’s檢驗未見明顯的發表偏倚(OS:P=0.251,DFS:P=0.452);見圖4。
 圖4
術前免疫炎癥指數與總生存期、無病生存期之間關系的漏斗圖
圖4
術前免疫炎癥指數與總生存期、無病生存期之間關系的漏斗圖
a:總生存期;b:無病生存期
3 討論
SII作為一種新的預后參數,可以很容易地通過常規全血計數檢測計算出來,并能夠反映癌癥患者免疫系統的整體狀態。雖然之前有一些研究報道了SII與NSCLC之間的關系,但我們發現不同結果之間存在差異。在本Meta分析中,我們收集了來自9 180例患者的11篇文獻數據,以評估SII在接受手術治療的NSCLC患者預后方面的潛在價值。我們的統計分析顯示,術前SII水平的升高更有可能與較差的生存結果相關,如較短的OS、DFS和RFS,不同的亞組分析也強力支持了這一結果。因此,術前SII可能是NSCLC患者有效的預后生物標志物。
近年來,腫瘤微環境在腫瘤免疫學領域受到越來越多的關注。多種炎癥細胞和介質是腫瘤微環境的重要組成部分[20]。SII是根據外周中性粒細胞、血小板和淋巴細胞計數來計算的。高SII對應于高血小板/中性粒細胞和/或低淋巴細胞計數。因此,SII值的升高表明存在具有浸潤性免疫細胞的高炎性腫瘤微環境[21]。外周血中中性粒細胞的存在通常與癌癥患者的預后不良有關[22]。中性粒細胞可以激活內皮細胞和實質細胞,從而促進循環腫瘤細胞(circulating tumor cell,CTC)的轉移[23]。中性粒細胞也通過分泌炎癥介質來介導癌細胞的增殖和轉移[24]。此外,血小板可能保護CTC,以保護其免受抗腫瘤免疫反應,從而促進癌細胞的血管生成和轉移[25]。研究[26]表明血小板還能夠釋放多種生長因子,增強體外癌細胞增殖。淋巴細胞,尤其是腫瘤浸潤淋巴細胞,進一步在宿主對惡性腫瘤的免疫反應中發揮關鍵作用。淋巴細胞可誘導細胞毒性細胞死亡并抑制腫瘤細胞增殖[27]。因此,SII也可能反映了宿主炎癥和免疫通路的激活。此外,SII的測量方式便宜、易于執行且可重復,這使得SII在臨床實踐中成為 NSCLC預后有前途的標志物。
之前的幾項研究調查了SII在實體瘤中的預后作用。在對22項研究數據的匯總分析中,Yang等[8]發現高SII可能是各種癌癥中OS較差的可靠預后因素。 Qiu等[28]的研究表明,治療前高SII與胃癌患者較差的OS(HR=1.40,P=0.010)以及一些臨床特征(如更高的腫瘤分期、陽性淋巴結轉移和更大的腫瘤)顯著相關,故他們建議可以監測SII以指導預后并提供有關胃癌疾病進展風險的可靠信息。Biswas 等[29]報道SII是Ⅲ期局部晚期NSCLC患者OS和無進展生存期的重要預測因子。有學者[30]也表明治療前SII較高的ⅢA/N2 期NSCLC患者可能需要更有力的輔助治療。此外,最近的一項研究[31]證實SII是肺癌切除術后肺部并發癥的最重要預測因素。在這里,我們證明了SII對NSCLC中OS、DFS和RFS的預后效果,這與其他癌癥類型的發現一致。根據我們的發現和其他相關研究,SII作為NSCLC的有效預后標志物可用于幫助患者進行風險分層并制定適當的臨床治療策略。
盡管該研究為NSCLC患者術前SII的預后價值提供了額外的實質性證據,但仍存在一些局限性:(1)納入的研究基本是回顧性的,因此與回顧性研究相關的固有結構偏倚可能導致研究間的異質性;(2)所有研究均來自于亞洲地區(中國或日本),這可能存在較大的地區和人群偏倚;(3)盡管NSCLC患者均接受了手術治療,但術后輔助治療策略和病理適應證因機構而異,可能具有不同的生存結局;(4)納入研究中不同的SII臨界值和測量方法可能導致結果偏差;(5)由于研究之間的異質性,目前無法確定SII預測NSCLC患者術后結果的最佳臨界值。
綜上,術前SII升高與NSCLC患者的不良生存結果顯著相關。SII可能在改善NSCLC的臨床決策中發揮重要作用。然而,由于本研究的局限性,仍需要更大規模的前瞻性研究來驗證我們的研究結果。
利益沖突:無。
作者貢獻:賀霞負責論文設計、審閱與修改,實施研究;陳夢琪負責實施研究,數據整理與分析,論文撰寫與修改;劉珂萌、趙華琴負責數據整理與分析。