引用本文: 梁云, 謝寧, 刁晶艷, 任蒙蒙, 劉曙亮. 人工智能量化參數預測肺結節浸潤程度的臨床價值. 中國胸心血管外科臨床雜志, 2022, 29(7): 878-885. doi: 10.7507/1007-4848.202112041 復制
近年來胸部CT的應用和普及使越來越多的肺部小結節被發現。美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南推薦低劑量胸部CT(low-dose computed tomography,LDCT)作為肺結節篩查首選檢查方法,有利于肺癌的早發現、早診斷、早治療,降低肺癌患者病死率[1]。早期肺癌多表現為肺部磨玻璃結節(ground-glass nodule,GGN),根據實性成分多少,可分為純磨玻璃結節(pure ground-glass nodule,pGGN)、混合磨玻璃結節(mixed ground-glass nodule,mGGN)、實性結節[2]。篩查出有肺結節的患者,需要進行高分辨率CT(high-resolution computed tomography,HRCT)檢查,好比拿著“放大鏡”觀察肺結節的影像學特點。GGN在肺窗上表現為局限性磨玻璃樣的密度增高區域,其內可見細支氣管或肺血管影;有實性成分的GGN在縱隔窗上表現為局限性軟組織密度區域,可呈淺分葉、不規則狀或點狀高密度影,而pGGN在縱隔窗無以上表現。惡性GGN在病理學診斷多為肺腺癌,肺腺癌可分為非典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸潤腺癌(minimally-invasive adenocarcinoma,MIA)、浸潤性腺癌(invasive adenocarcinoma,IAC)。最新2021版世界衛生組織肺癌組織學分類將AAH和AIS稱為腺體前驅病變,腺癌僅包含MIA和IAC。那么如何從影像學上判斷GGN是否是浸潤性病變呢?日本臨床腫瘤學組織(Japan Clinical Oncology Group,JCOG)定義了GGN放射學非浸潤標準,即GGN長徑≤2 cm,腫瘤實性成分比值(consolidation/tumor ratio,CTR)≤0.25。在此基礎上JCOG0804研究[3]表明,長徑2 cm以內外周型pGGN為主的患者行亞肺葉切除隨訪5年無復發生存率為99.7%。上述研究均提示放射學非浸潤病變行亞肺葉切除安全有效且預后良好。而放射學考慮為浸潤病變的GGN,首選肺葉切除聯合系統性淋巴結清掃,術后易復發且預后較差。由于不同浸潤程度GGN的手術術式選擇及預后差異很大,術前鑒別GGN浸潤程度顯得至關重要。傳統手工測量GGN方法存在測量誤差、主觀偏倚、重復性差等局限性,對早期肺癌浸潤程度預測價值有限。由于胸部CT篩查90%以上GGN是良性的,診斷惡性GGN的低特異度導致疾病的過度診斷,進一步引起患者恐慌和加重醫療負擔。隨著AI的發展,應用卷積神經網絡已成為“人工智能(artificial intelligence,AI)+醫學”的主流,基于深度學習和大數據的AI輔助診斷軟件可智能識別和預測GGN良惡性,其量化參數客觀、準確反映GGN影像學特點,具有更高的敏感性和可重復性,減少臨床醫生的漏診和誤診[4]。本研究旨在探討AI量化參數預測早期惡性GGN浸潤程度的可行性和臨床價值。
1 資料與方法
1.1 臨床資料
回顧性分析2019年10月—2021年5月在濱州醫學院附屬煙臺山醫院行HRCT掃描符合納入標準的168例患者的臨床資料,其中男43例、女125例,年齡21~78(55.76±10.88)歲。所有患者經胸腔鏡手術病理證實為肺腺癌,部分病例表現為多發GGN,且同一患者的不同病灶作為獨立樣本進行分析。其中,GGN 178個,包括AIS 24個、MIA 77個和IAC 77個。納入標準:(1)病理確診為肺腺癌且肺結節長徑≤3 cm且≥5 mm;(2)術前1周內行CT檢查且圖像層厚0.67 mm;(3)GGN為純、部分實性或實性GGN; (4)術前未行抗腫瘤治療。排除標準:(1)肺部多發性或彌漫性病變,無法排除炎癥表現;(2)圖像有質量欠佳或嚴重偽影;(3)未取得病理結果或病理診斷不明確;(4)術前有惡性腫瘤病史或已行抗腫瘤治療。將AIS(24 個)和MIA(77 個)劃分為非浸潤組,IAC(77 個)劃分為浸潤組。
1.2 檢查方法
采用Philips 64排128層Incisive CT進行胸部HRCT掃描。掃描范圍從肺尖至肺底,兩側包括胸壁、腋窩。掃描參數:管電壓140 kV,管電流300 mAs,自動管電流調制,螺距0.6 mm,重建層厚0.67 mm,層間距0.335 mm。圖像分析采用肺窗(窗寬1 600 Hu,窗位–600 Hu)。患者采集胸部HRCT圖像后自動生成相應CT編號,將CT編號或者患者姓名輸入AI軟件搜索框中,點擊回車后自動將CT圖像調入AI肺結節篩查軟件系統(推想預測inferRead CT Chest 版本:R8.2)中,得到相關肺結節量化參數。
1.3 圖像分析
AI肺結節篩查軟件系統識別肺結節后,得到相關量化參數:肺結節長徑、肺結節短徑、CTR、惡性概率、結節危險度(高危結節占比)、平均CT值、最大CT值、最小CT值;見圖1~3。
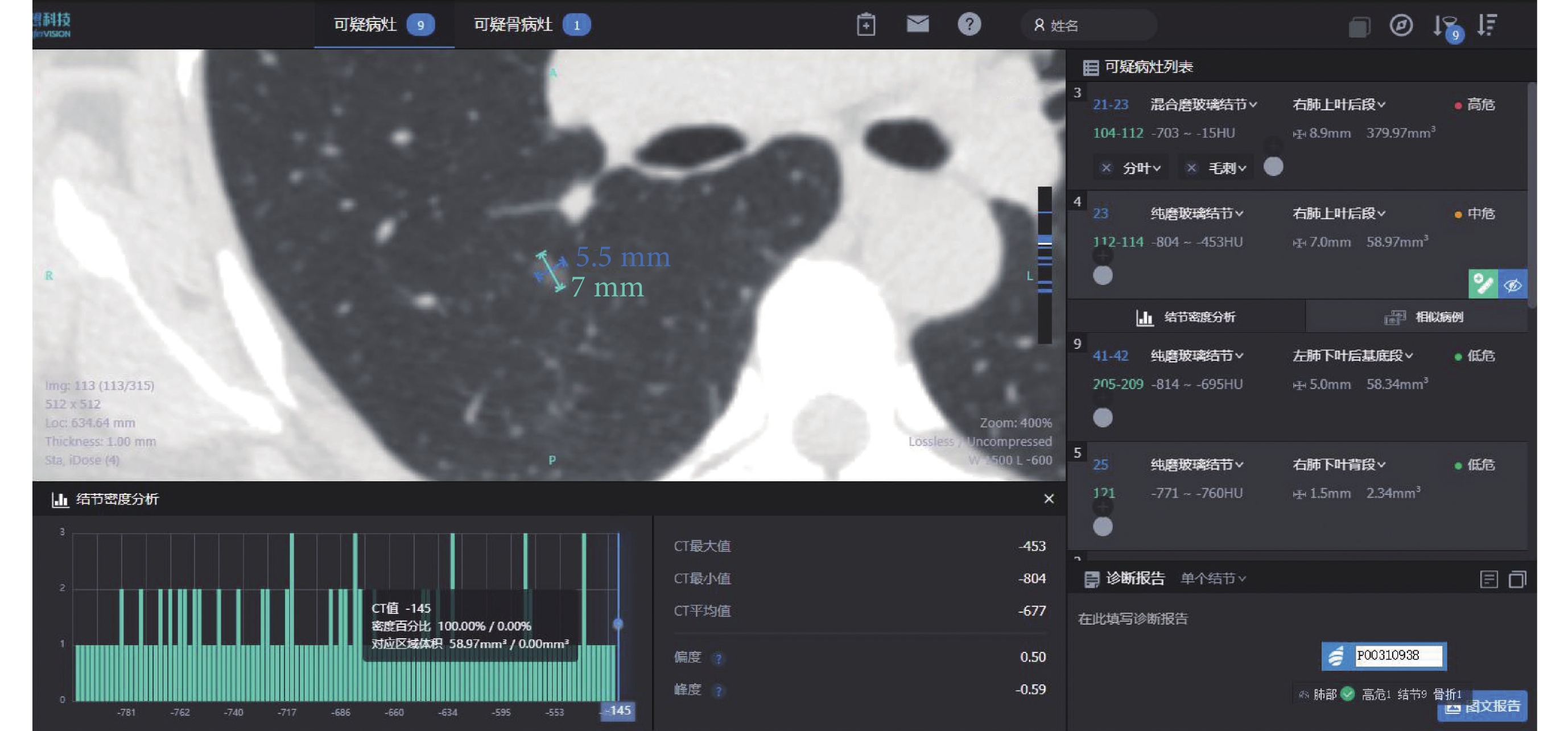
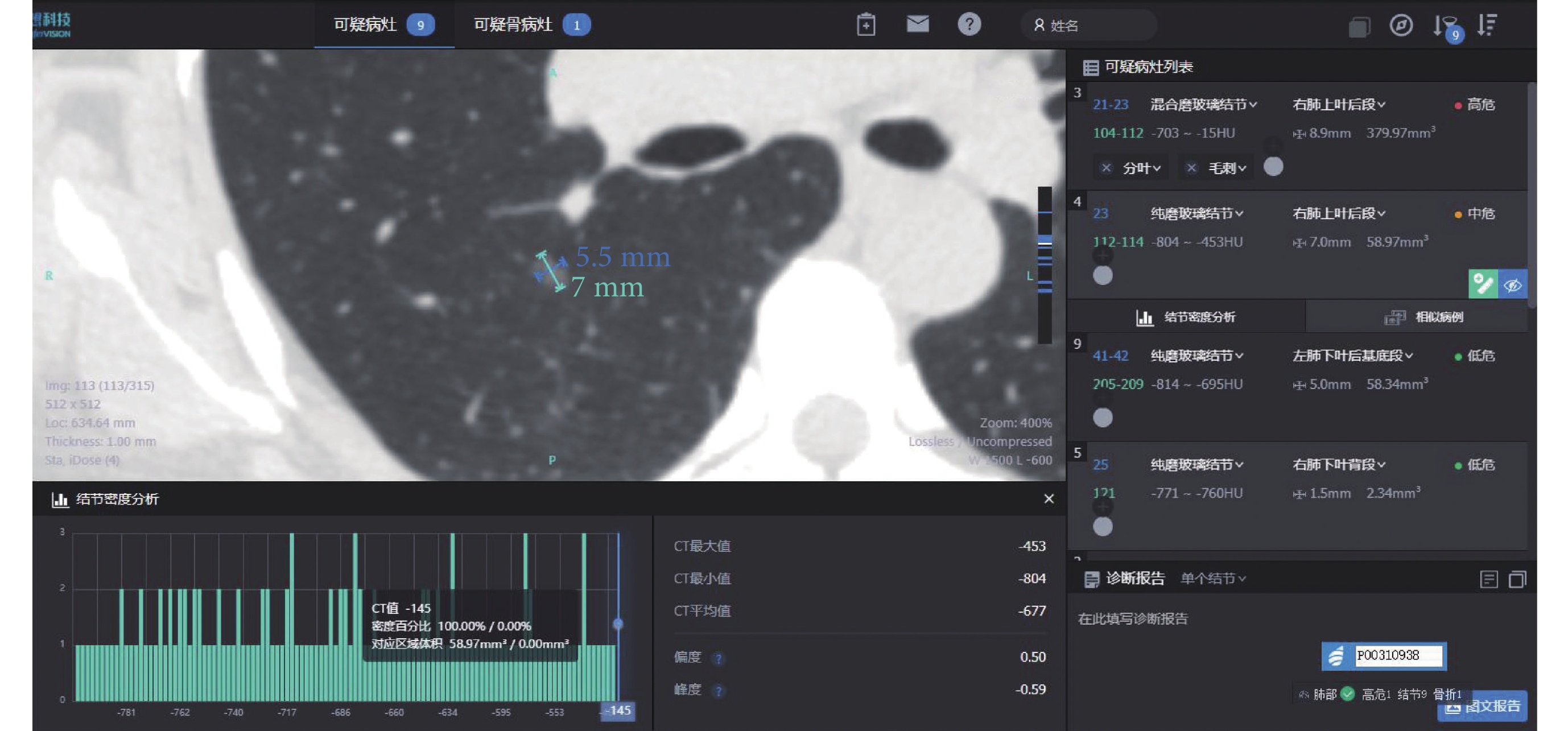 圖1
病例1 AI 量化參數
圖1
病例1 AI 量化參數
女,50歲,病灶位于右肺上葉,AI量化參數:長徑7 mm,短徑5.5 mm,腫瘤實性成分比值0%,惡性概率61.92%,危險度分級為中危,平均CT值–677 Hu,最大CT值–453 Hu,最小CT值–804 Hu,術后病理診斷為原位腺癌
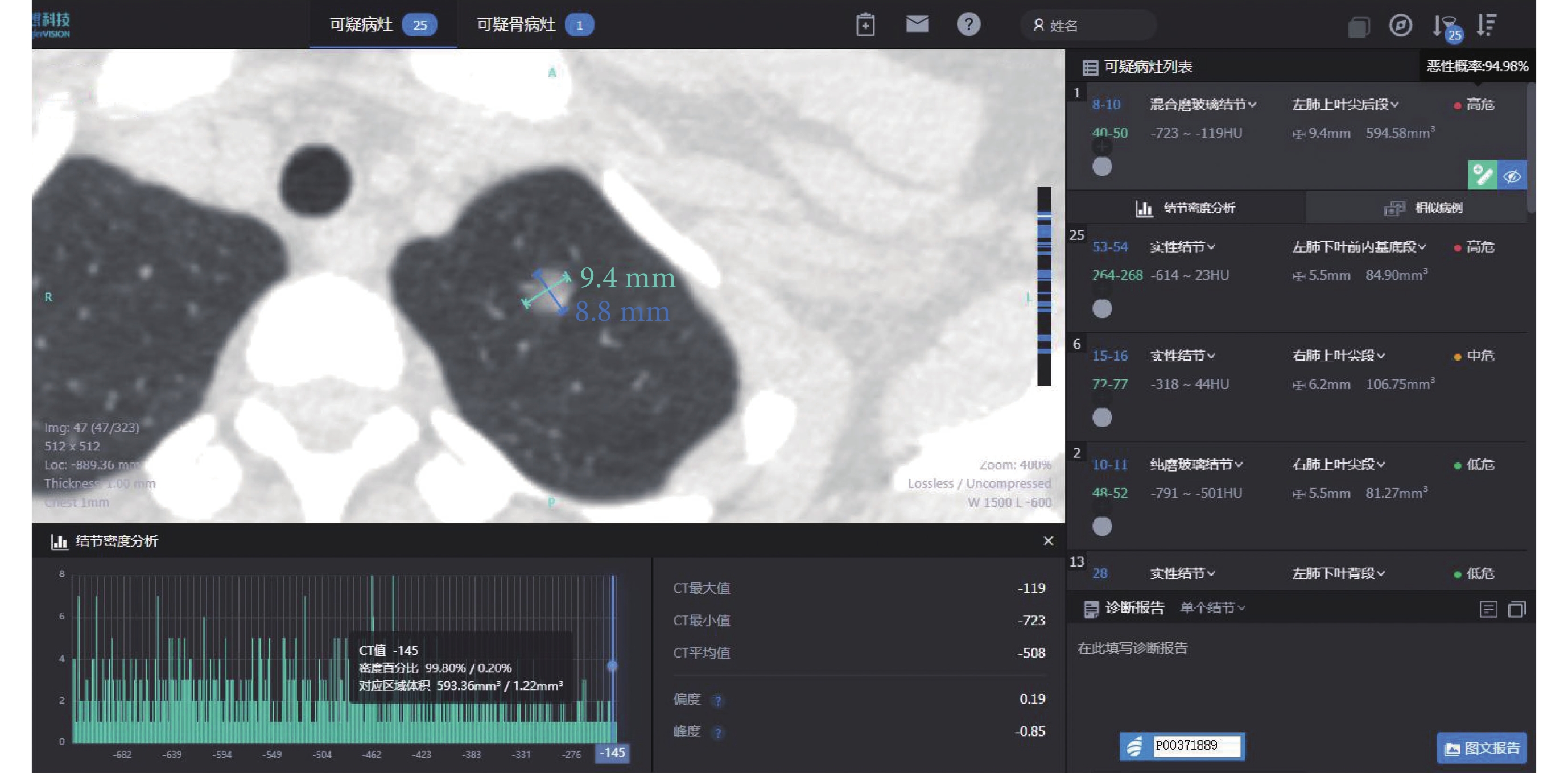
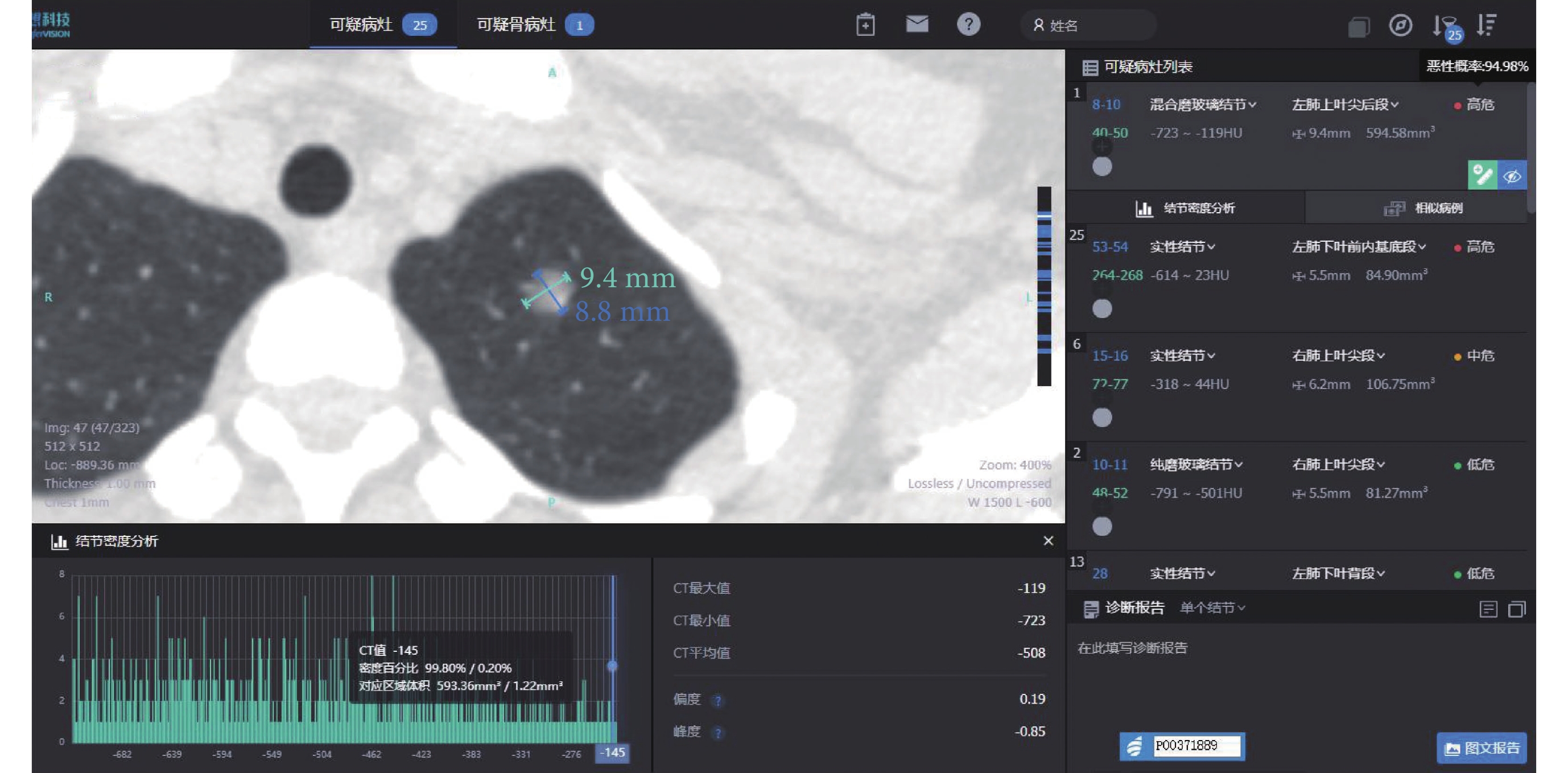 圖2
病例2 AI 量化參數
圖2
病例2 AI 量化參數
女,40歲,病灶位于左肺上葉,AI量化參數:長徑9.4 mm,短徑8.8 mm,腫瘤實性成分比值0.2%,惡性概率94.98%,危險度分級為高危,平均CT值–508 Hu,最大CT值–119 Hu,最小CT值–723 Hu,術后病理診斷為微浸潤腺癌
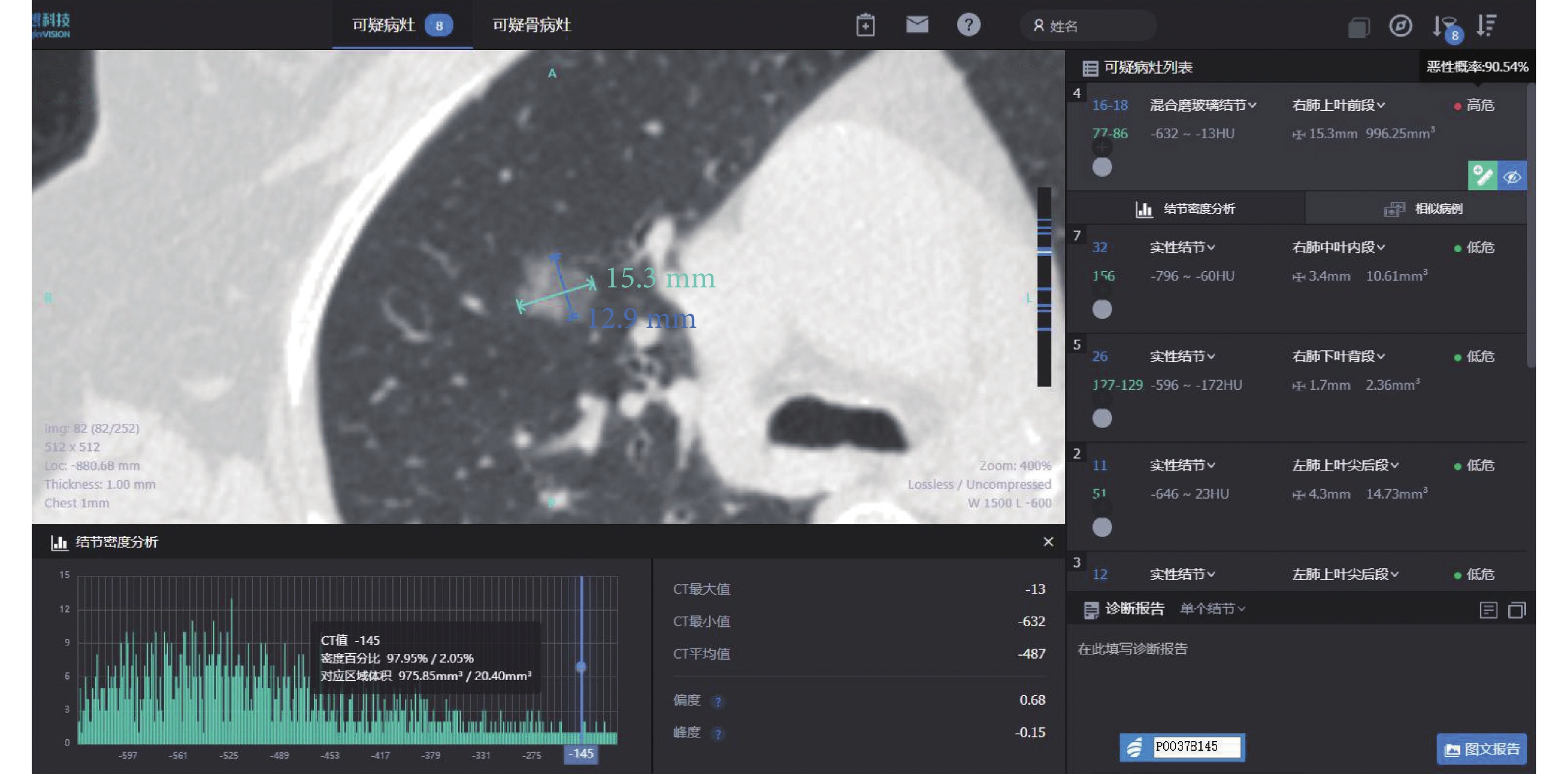
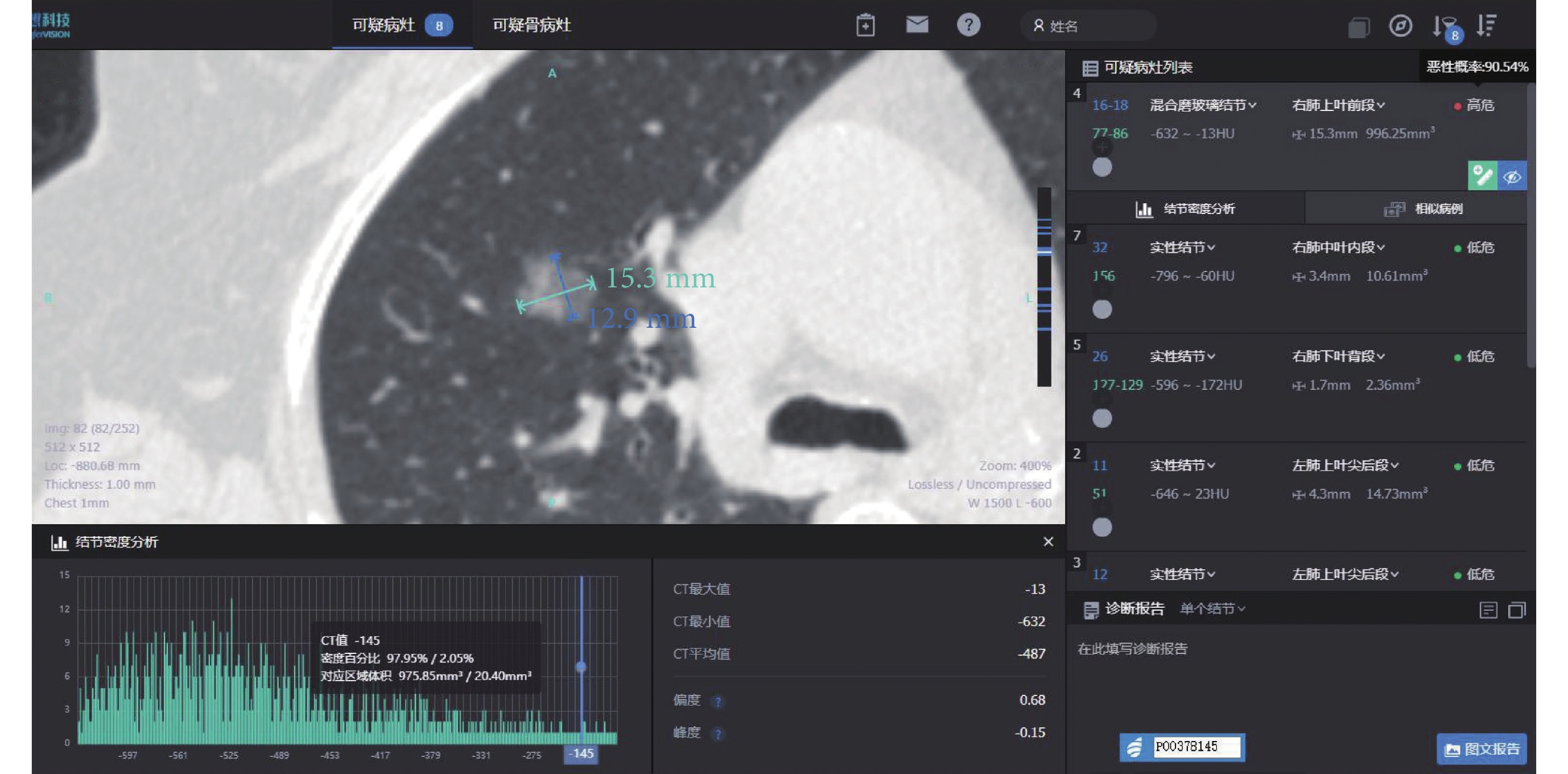 圖3
病例3 AI 量化參數
圖3
病例3 AI 量化參數
女,61歲,病灶位于右肺上葉,AI量化參數:長徑15.3 mm,短徑12.9 mm,腫瘤實性成分比值2.05%,惡性概率90.54%,危險度分級為高危,平均CT值–487 Hu,最大CT值–13 Hu,最小CT值–632 Hu,術后病理診斷為浸潤性腺癌
1.4 統計學分析
采用SPSS 19.0軟件進行統計學分析。正態分布的計量資料采用均數±標準差( ±s)描述,組間比較采用t檢驗;不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用秩和檢驗。結節危險度分析采用χ2 檢驗。采用受試者工作特征(receiver operating characteristic,ROC)曲線及曲線下面積(area under the curve,AUC)分析各量化參數對GGN侵襲性的預測價值和閾值。通過二元logistic回歸模型分析,量化參數預測GGN浸潤程度的臨床價值。檢驗水準α=0.05。
±s)描述,組間比較采用t檢驗;不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用秩和檢驗。結節危險度分析采用χ2 檢驗。采用受試者工作特征(receiver operating characteristic,ROC)曲線及曲線下面積(area under the curve,AUC)分析各量化參數對GGN侵襲性的預測價值和閾值。通過二元logistic回歸模型分析,量化參數預測GGN浸潤程度的臨床價值。檢驗水準α=0.05。
1.5 倫理審查
本研究經煙臺市煙臺山醫院醫學倫理委員會批準,批準號:煙山倫準2022009號。
2 結果
2.1 兩組磨玻璃結節的量化參數比較
兩組間長徑、短徑、CTR、平均CT值、最大CT值、最小CT值、惡性概率、結節危險度及年齡差異均有統計學意義(P均<0.001);見表1。兩組性別差異無統計學意義(P=0.115),但在肺腺癌組中男性GGN占45個(25.3%)、女性GGN占133個(74.7%)。
 /n(%)/M(P25,P75)]
/n(%)/M(P25,P75)]
2.2 量化參數的受試者工作特征曲線分析
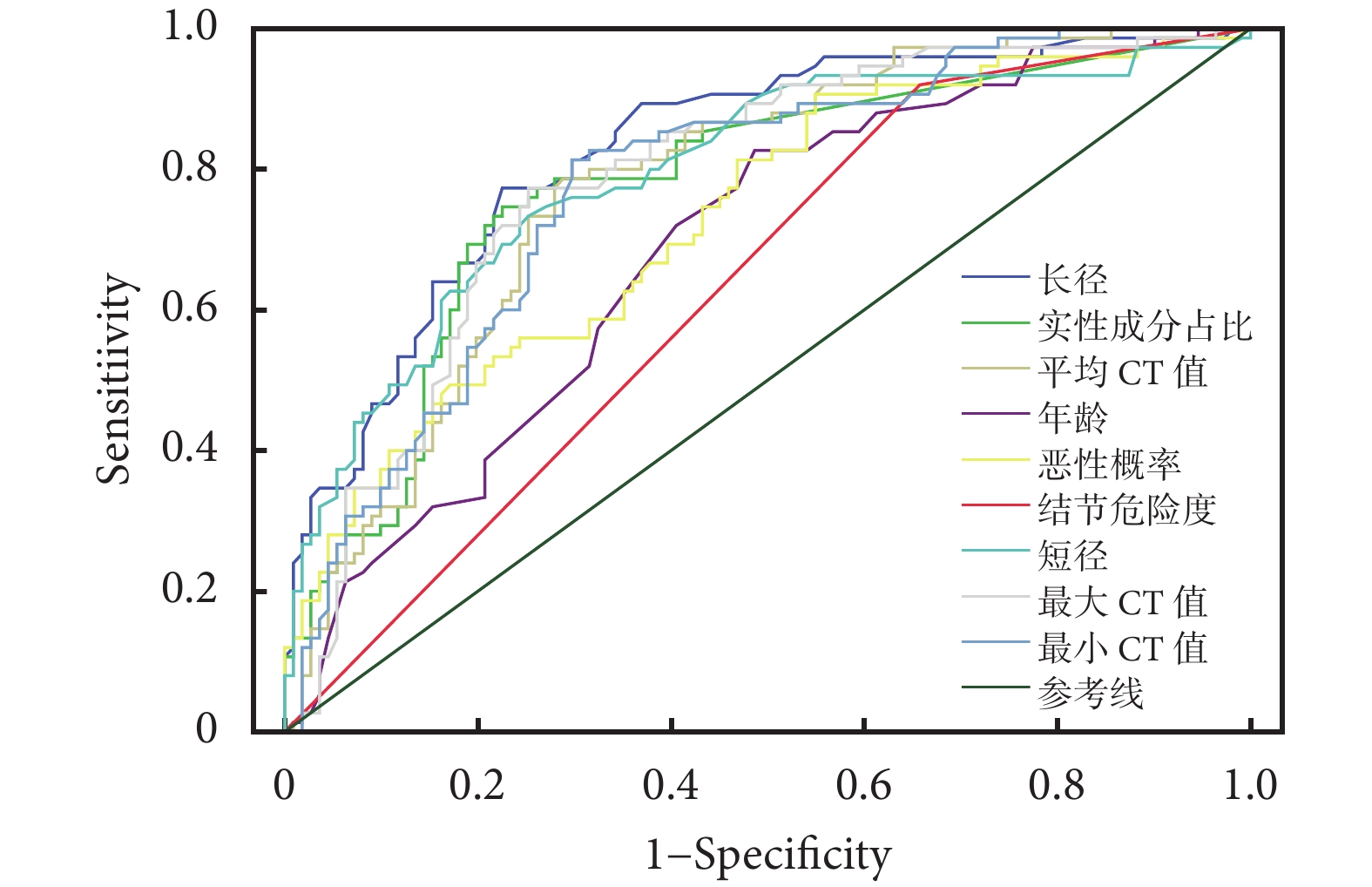
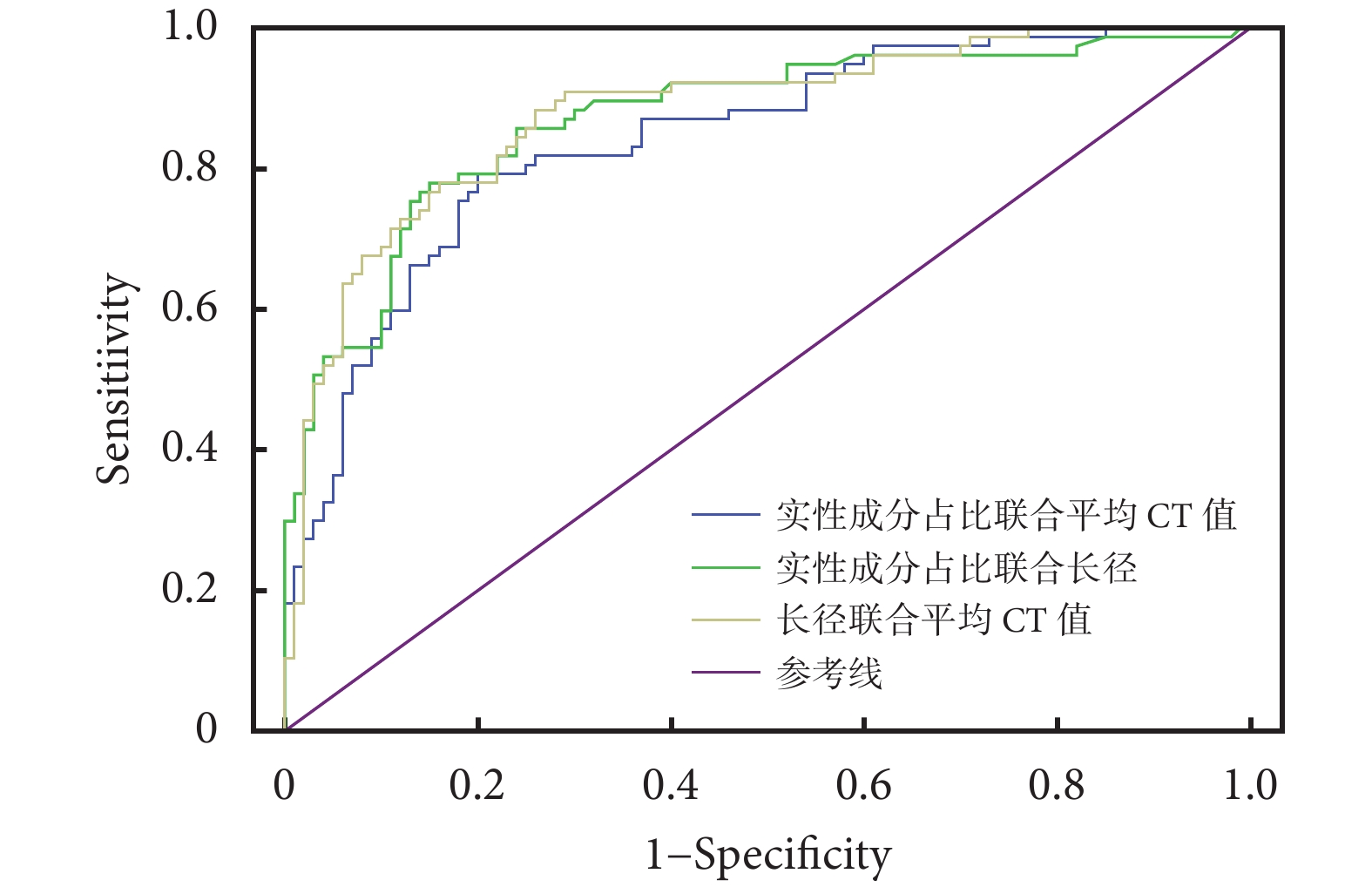
通過ROC曲線分析各AI量化參數對GGN侵襲性的預測價值;見表2、圖4~5。預測價值從高到低分別為肺結節長徑(AUC=0.843)、最大CT值(AUC=0.840)、CTR(AUC=0.836)、平均CT值(AUC=0.834)、最小CT值(AUC=0.827)、肺結節短徑(AUC=0.804)、惡性概率(AUC=0.737)、年齡(AUC=0.701)、結節危險度(AUC=0.627);兩種量化參數聯合:CTR聯合平均CT值、CTR聯合肺結節長徑、肺結節長徑聯合平均CT值,分別提高AI的預測價值(AUC分別為0.843、0.867、0.877)。聯合指標之間的相關性:計算變量兩兩之間的Pearson相關系數,指標之間具有相關性,相關系數分別為0.817,0.517,0.468(P均<0.05)。
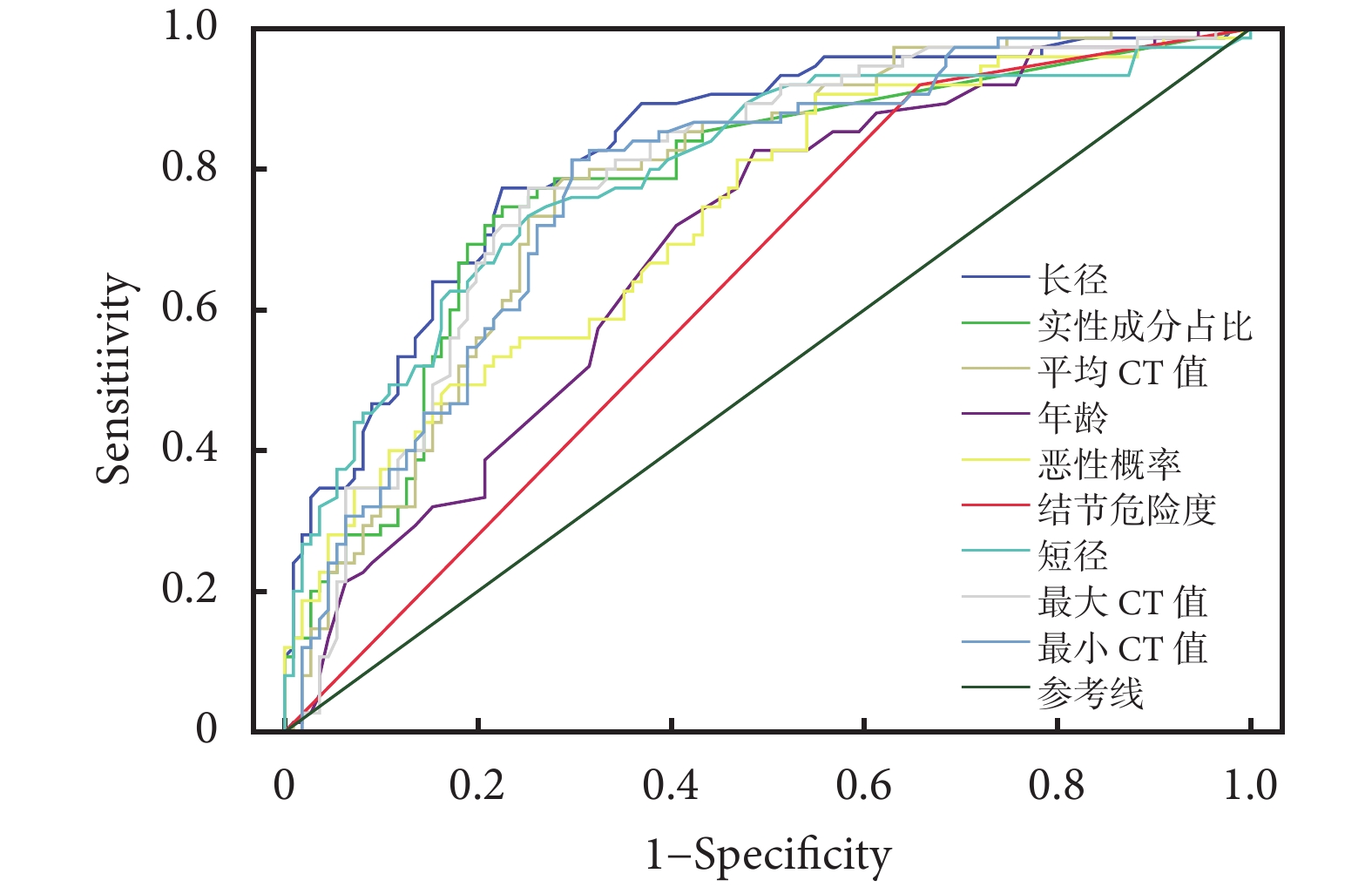 圖4
單一量化參數的受試者工作特征曲線
圖4
單一量化參數的受試者工作特征曲線
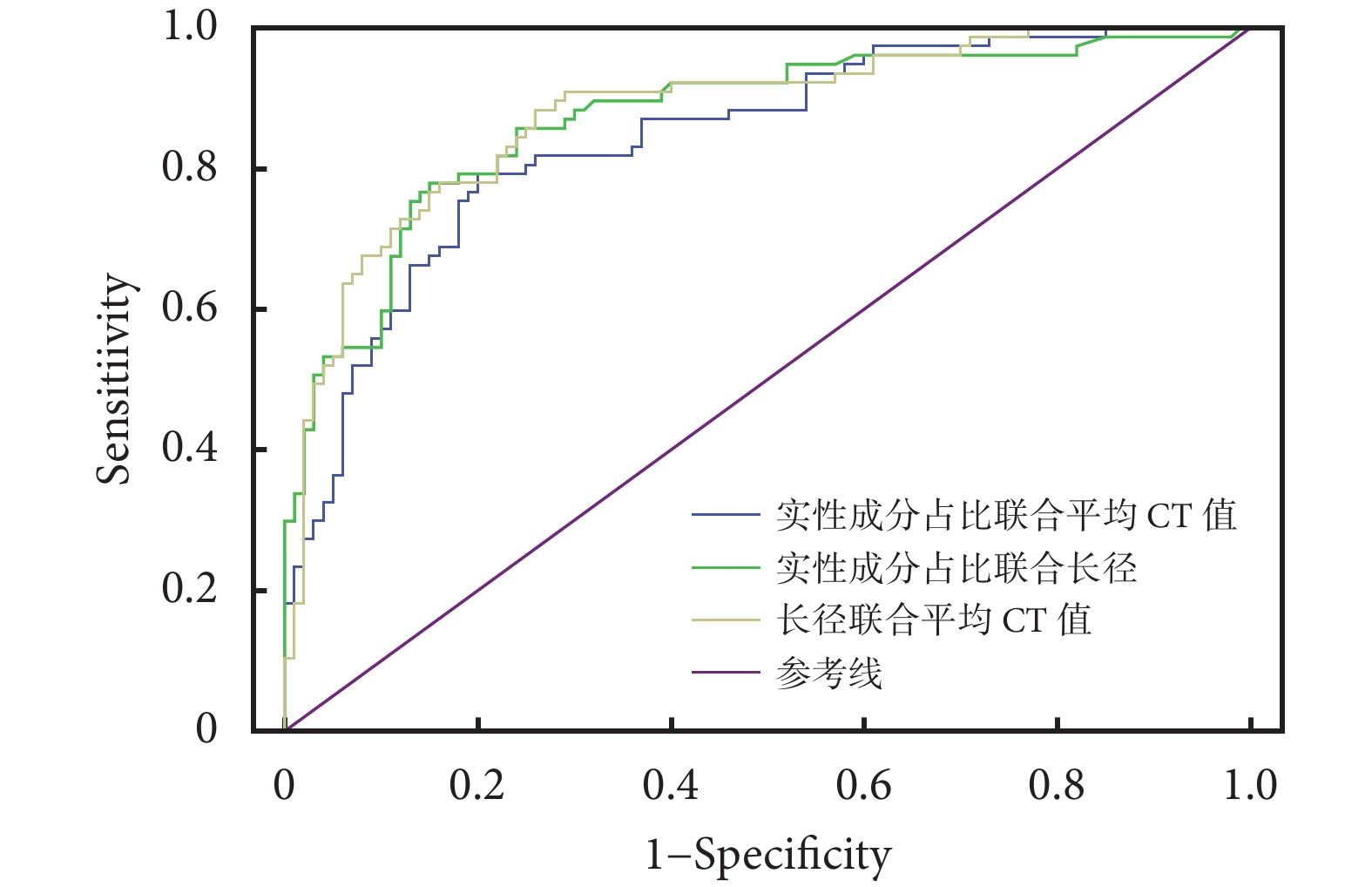 圖5
聯合量化參數的受試者工作特征曲線
圖5
聯合量化參數的受試者工作特征曲線
2.3 獨立預測因子分析
以各量化參數為自變量,以浸潤程度不同的GGN為因變量,通過二元logistic回歸進一步分析預測侵襲程度的獨立危險因素;見表3。結果顯示肺結節長徑(OR=1.264,P<0.001)及平均CT值(OR=1.005,P<0.001)是預測IAC的獨立危險因素,診斷閾值分別為肺結節長徑11.45 mm、平均CT值–503.5 Hu。
2.4 腫瘤實性成分比值
分析兩組間CTR(CT臨界值為–145 Hu),浸潤組明顯高于非浸潤組(P<0.001);當CTR閾值為1.775%時,診斷IAC靈敏度為0.753、特異度為0.851。
3 討論
肺癌是發病率與死亡率均位居前列的惡性腫瘤。隨著LDCT的應用和普及,越來越多的肺部小結節被發現。當篩查發現需要外科干預的肺結節時,高分辨胸部CT能夠清晰呈現肺結節的真實面貌,如肺結節長徑、肺結節短徑、CT灰度值、毛刺征、胸膜凹陷征、支氣管截斷等影像學特點,傳統手工測量方法量化影像學指標存在一定局限性,而李大勝等[5]發現AI在多原發GGN患者篩查和診斷中存在優勢。另外,Chen等[6]發現基于深度學習和人口大數據,AI輔助診斷通過CT閾值、模板匹配、形態學特征等方法可提高識別惡性結節的特異度和敏感度;可清晰呈現良惡性肺結節的位置及體積分布圖,良性結節多分布于外周胸膜,惡性結節多分布于肺尖部。
在臨床工作中,如何讓需要外科干預的肺結節患者既保留更多肺功能又能從術后長期生存中獲益?這是一個值得思考的問題。這需要臨床醫生結合GGN影像學特點和患者身心狀態綜合評估,以患者為中心制定個性化的手術方案。NCCN指南推薦,肺葉切除+肺門縱隔淋巴結清掃作為IAC患者的首選術式[7]。胸腔鏡手術已經被證實與傳統開胸手術有等效的治療效果,并且具有切口小、疼痛輕、恢復快等優勢。日本JCOG0201研究[8]表明,與肺葉切除相比,符合放射學非浸潤標準的惡性GGN(長徑≤3 cm,CTR≤0.5)在保證切緣足夠的前提下行亞肺葉切除(楔形或肺段)患者預后良好。這與Dembitzer等[9]研究結果一致。Bedetti等[10]的Meta分析證明,與肺葉切除相比,Ⅰ期非小細胞肺癌患者行肺段切除術后總體生存期無差異。另外,Qu等[11]的Meta分析表明Ⅰ期非小細胞肺癌患者行肺段切除聯合正確淋巴結處理,與肺葉切除相比在總體生存期和肺癌特異生存率上無差異。隨著多中心前瞻性研究數據的披露,如日本JCOG0802、美國CALGB140503研究,亞肺葉切除很有可能成為Ⅰ期非小細胞肺癌患者的首選術式[12]。雖然,亞肺葉切除較肺葉切除保留更多肺組織,但對術后肺功能的評估和保護還存在爭議。Tane等[13]發現肺段切除術后剩余肺功能優于肺葉。而Gu等[14]發現,與肺葉切除相比,肺楔形切除對肺功能影響最小,肺段切除可減小用力肺活量的損失,而一秒用力呼氣容積和一氧化碳擴散肺容量無差異。Chen等[15]發現只有當切除范圍小于相應肺葉的一半時,肺段切除比肺葉切除有助于保護更多的肺功能,而用力肺活量兩者無差異。這些研究結果提示肺段切除的適應證在逐漸擴大,與肺葉切除相比,它有利于保護更多的肺功能,但應避免同時多個肺段或復雜肺段手術。
本研究分析比較兩組之間GGN影像學特點發現,浸潤組GGN具有更大的直徑、更高的密度和實性成分、更多惡性征象等特點,這與腺癌病理學發生發展密切相關。早期腺癌細胞多沿著肺泡壁生長,隨著病情進展,慢慢累及肺泡間質結構,進而使肺泡腔萎縮塌陷,出現GGN直徑增大、密度增高、實性成分變多。浸潤程度進一步加重,腫瘤生長速度的不均質、肺泡結構塌陷牽拉胸膜可表現為分葉征、胸膜凹陷征等惡性征象。肺腺癌細胞在“向外拓展領地”的過程中,可發生氣道、血道及淋巴轉移,進而轉移至肺內其它部位或者遠處臟器。
陳琦等[16]指出GGN最大直徑和CT值有效預測肺癌的惡性程度,但手工測量GGN量化數值存在測量誤差、主觀偏倚,且重復性差。蔡雅倩等[17]表明,AI肺結節篩查輔助診斷軟件可有效檢出GGN,并可初步鑒別肺結節良惡性。周小君等[18]提出AI肺結節相關量化參數可有效預測早期GGN肺癌的浸潤程度,尤其肺結節長徑和平均CT值的預測價值較高。而本研究團隊采用另一種AI肺結節輔助診斷軟件(推想預測,北京推想科技研發)進行數據量化分析,新增量化指標包括CTR、惡性概率、危險分度。與周小君等研究結果不同的是,兩組GGN的量化參數比較:兩組GGN的短徑、CTR、惡性概率、結節危險度及年齡的差異均有統計學意義(P均<0.001)。在腺癌組中,女性GGN的占比(133個,74.7%)顯著高于男性GGN(45個,25.3%),提示女性更易患肺腺癌。浸潤組年齡[(59.93±8.53)歲]顯著大于非浸潤組[(52.04±12.10)歲],這提示高齡(≥54.5歲)患者更易患IAC,腺癌發生發展是一個緩慢的過程。病理確診為腺癌的高危結節好發部位分別為右肺上葉(45個)、左肺上葉(31個)、右肺下葉(27個)、左肺下葉(22個)、右肺中葉(13個),占比分別是25.2%、17.4%、15.1%、12.3%、7.3%。提示上葉比下葉多發,右肺比左肺多發,尤其以右肺上葉最多發,這與Chen等[6]的研究結果一致;而右肺中葉的占比最少,這可能與中葉體積比較小有關。另外,本研究結果證明肺結節長徑聯合平均CT值、長徑聯合CTR、平均CT值聯合CTR均可提高AI的預測價值(AUC分別為0.877、0.867、0.843)。Logistic回歸結果顯示長徑和平均CT值是預測IAC的獨立危險因素,這與既往研究[18]結果一致。JCOG0201研究[8]結果證明CTR與GGN的病理分期及預后密切相關。而本研究表明,浸潤組中腫瘤實性成分比值顯著高于非浸潤組,提示CTR是鑒別肺癌浸潤和侵襲有效指標之一。與既往研究二維平面中CTR與腫瘤的長徑比值不同,本研究特色在于三維空間中實性成分(CT臨界值為–145 Hu)與腫瘤的體積比值,更加客觀準確呈現GGN中實性成分多少。本研究結果提示當CTR>1.775%,診斷IAC的敏感度和特異度為0.753、0.851。但是AI識別實性成分容易被腫瘤內血管、鈣化等因素影響,Singh等[19]運用具有血管抑制功能的AI軟件可以降低這種影響。本研究使用的軟件缺乏該功能,可能存在一定的測量誤差。孫炎冰等[20]的研究表明,長徑在GGN臨床隨訪中存在價值。而在本研究中當肺結節長徑>11.45 mm時,診斷IAC的敏感度和特異度分別為0.779、0.802。Zhang等[21]的研究指出GGN的平均CT值對預測腫瘤生長、鑒別病理分期有較大臨床價值。本研究中當平均CT值>–503.5 Hu時,診斷IAC的敏感度和特異度分別為0.779、0.790。綜合CTR和平均CT值能夠更加準確地呈現GGN密度和實性成分的變化。因此,當肺結節長徑>11.45 mm、平均CT值>–503.5 Hu、CTR>1.775%,需高度警惕GGN為IAC。胸外科醫生可以根據GGN影像學特點和AI量化參數,保證足夠切緣范圍和淋巴結充分評估的前提下,選擇適合患者的最佳手術方案。
本研究屬于單中心回顧性分析,缺乏前瞻性隨訪研究數據,這是我們研究團隊后期努力的目標和方向。另外,數據集偏小,醫學統計分析論證強度不強。AI是新一代科技革命中產生的新生事物,雖然它還處于初級階段,存在一定的漏診和誤診情況,功能有待完善和升級,目前AI僅能識別T分期特點,無法識別肺門、縱隔淋巴結及全身器官有無轉移等情況,但“AI+醫學”的結合無疑會促進精準醫學的發展,造福越來越多的患者。我們相信在不遠的將來,AI可以提供更加智能且準確的醫學數據,幫助臨床醫生做出最佳的臨床決策。
利益沖突:無。
作者貢獻:梁云負責查閱資料、收集數據、撰寫論文;刁晶艷、任蒙蒙負責論文數據整理與分析;劉曙亮、謝寧負責選題,論文設計、審校及修改。
致謝 感謝羅光華、費秀渠為文章審校及修改做出的貢獻!
近年來胸部CT的應用和普及使越來越多的肺部小結節被發現。美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南推薦低劑量胸部CT(low-dose computed tomography,LDCT)作為肺結節篩查首選檢查方法,有利于肺癌的早發現、早診斷、早治療,降低肺癌患者病死率[1]。早期肺癌多表現為肺部磨玻璃結節(ground-glass nodule,GGN),根據實性成分多少,可分為純磨玻璃結節(pure ground-glass nodule,pGGN)、混合磨玻璃結節(mixed ground-glass nodule,mGGN)、實性結節[2]。篩查出有肺結節的患者,需要進行高分辨率CT(high-resolution computed tomography,HRCT)檢查,好比拿著“放大鏡”觀察肺結節的影像學特點。GGN在肺窗上表現為局限性磨玻璃樣的密度增高區域,其內可見細支氣管或肺血管影;有實性成分的GGN在縱隔窗上表現為局限性軟組織密度區域,可呈淺分葉、不規則狀或點狀高密度影,而pGGN在縱隔窗無以上表現。惡性GGN在病理學診斷多為肺腺癌,肺腺癌可分為非典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸潤腺癌(minimally-invasive adenocarcinoma,MIA)、浸潤性腺癌(invasive adenocarcinoma,IAC)。最新2021版世界衛生組織肺癌組織學分類將AAH和AIS稱為腺體前驅病變,腺癌僅包含MIA和IAC。那么如何從影像學上判斷GGN是否是浸潤性病變呢?日本臨床腫瘤學組織(Japan Clinical Oncology Group,JCOG)定義了GGN放射學非浸潤標準,即GGN長徑≤2 cm,腫瘤實性成分比值(consolidation/tumor ratio,CTR)≤0.25。在此基礎上JCOG0804研究[3]表明,長徑2 cm以內外周型pGGN為主的患者行亞肺葉切除隨訪5年無復發生存率為99.7%。上述研究均提示放射學非浸潤病變行亞肺葉切除安全有效且預后良好。而放射學考慮為浸潤病變的GGN,首選肺葉切除聯合系統性淋巴結清掃,術后易復發且預后較差。由于不同浸潤程度GGN的手術術式選擇及預后差異很大,術前鑒別GGN浸潤程度顯得至關重要。傳統手工測量GGN方法存在測量誤差、主觀偏倚、重復性差等局限性,對早期肺癌浸潤程度預測價值有限。由于胸部CT篩查90%以上GGN是良性的,診斷惡性GGN的低特異度導致疾病的過度診斷,進一步引起患者恐慌和加重醫療負擔。隨著AI的發展,應用卷積神經網絡已成為“人工智能(artificial intelligence,AI)+醫學”的主流,基于深度學習和大數據的AI輔助診斷軟件可智能識別和預測GGN良惡性,其量化參數客觀、準確反映GGN影像學特點,具有更高的敏感性和可重復性,減少臨床醫生的漏診和誤診[4]。本研究旨在探討AI量化參數預測早期惡性GGN浸潤程度的可行性和臨床價值。
1 資料與方法
1.1 臨床資料
回顧性分析2019年10月—2021年5月在濱州醫學院附屬煙臺山醫院行HRCT掃描符合納入標準的168例患者的臨床資料,其中男43例、女125例,年齡21~78(55.76±10.88)歲。所有患者經胸腔鏡手術病理證實為肺腺癌,部分病例表現為多發GGN,且同一患者的不同病灶作為獨立樣本進行分析。其中,GGN 178個,包括AIS 24個、MIA 77個和IAC 77個。納入標準:(1)病理確診為肺腺癌且肺結節長徑≤3 cm且≥5 mm;(2)術前1周內行CT檢查且圖像層厚0.67 mm;(3)GGN為純、部分實性或實性GGN; (4)術前未行抗腫瘤治療。排除標準:(1)肺部多發性或彌漫性病變,無法排除炎癥表現;(2)圖像有質量欠佳或嚴重偽影;(3)未取得病理結果或病理診斷不明確;(4)術前有惡性腫瘤病史或已行抗腫瘤治療。將AIS(24 個)和MIA(77 個)劃分為非浸潤組,IAC(77 個)劃分為浸潤組。
1.2 檢查方法
采用Philips 64排128層Incisive CT進行胸部HRCT掃描。掃描范圍從肺尖至肺底,兩側包括胸壁、腋窩。掃描參數:管電壓140 kV,管電流300 mAs,自動管電流調制,螺距0.6 mm,重建層厚0.67 mm,層間距0.335 mm。圖像分析采用肺窗(窗寬1 600 Hu,窗位–600 Hu)。患者采集胸部HRCT圖像后自動生成相應CT編號,將CT編號或者患者姓名輸入AI軟件搜索框中,點擊回車后自動將CT圖像調入AI肺結節篩查軟件系統(推想預測inferRead CT Chest 版本:R8.2)中,得到相關肺結節量化參數。
1.3 圖像分析
AI肺結節篩查軟件系統識別肺結節后,得到相關量化參數:肺結節長徑、肺結節短徑、CTR、惡性概率、結節危險度(高危結節占比)、平均CT值、最大CT值、最小CT值;見圖1~3。
 圖1
病例1 AI 量化參數
圖1
病例1 AI 量化參數
女,50歲,病灶位于右肺上葉,AI量化參數:長徑7 mm,短徑5.5 mm,腫瘤實性成分比值0%,惡性概率61.92%,危險度分級為中危,平均CT值–677 Hu,最大CT值–453 Hu,最小CT值–804 Hu,術后病理診斷為原位腺癌
 圖2
病例2 AI 量化參數
圖2
病例2 AI 量化參數
女,40歲,病灶位于左肺上葉,AI量化參數:長徑9.4 mm,短徑8.8 mm,腫瘤實性成分比值0.2%,惡性概率94.98%,危險度分級為高危,平均CT值–508 Hu,最大CT值–119 Hu,最小CT值–723 Hu,術后病理診斷為微浸潤腺癌
 圖3
病例3 AI 量化參數
圖3
病例3 AI 量化參數
女,61歲,病灶位于右肺上葉,AI量化參數:長徑15.3 mm,短徑12.9 mm,腫瘤實性成分比值2.05%,惡性概率90.54%,危險度分級為高危,平均CT值–487 Hu,最大CT值–13 Hu,最小CT值–632 Hu,術后病理診斷為浸潤性腺癌
1.4 統計學分析
采用SPSS 19.0軟件進行統計學分析。正態分布的計量資料采用均數±標準差( ±s)描述,組間比較采用t檢驗;不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用秩和檢驗。結節危險度分析采用χ2 檢驗。采用受試者工作特征(receiver operating characteristic,ROC)曲線及曲線下面積(area under the curve,AUC)分析各量化參數對GGN侵襲性的預測價值和閾值。通過二元logistic回歸模型分析,量化參數預測GGN浸潤程度的臨床價值。檢驗水準α=0.05。
±s)描述,組間比較采用t檢驗;不符合正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用秩和檢驗。結節危險度分析采用χ2 檢驗。采用受試者工作特征(receiver operating characteristic,ROC)曲線及曲線下面積(area under the curve,AUC)分析各量化參數對GGN侵襲性的預測價值和閾值。通過二元logistic回歸模型分析,量化參數預測GGN浸潤程度的臨床價值。檢驗水準α=0.05。
1.5 倫理審查
本研究經煙臺市煙臺山醫院醫學倫理委員會批準,批準號:煙山倫準2022009號。
2 結果
2.1 兩組磨玻璃結節的量化參數比較
兩組間長徑、短徑、CTR、平均CT值、最大CT值、最小CT值、惡性概率、結節危險度及年齡差異均有統計學意義(P均<0.001);見表1。兩組性別差異無統計學意義(P=0.115),但在肺腺癌組中男性GGN占45個(25.3%)、女性GGN占133個(74.7%)。
 /n(%)/M(P25,P75)]
/n(%)/M(P25,P75)]
2.2 量化參數的受試者工作特征曲線分析
通過ROC曲線分析各AI量化參數對GGN侵襲性的預測價值;見表2、圖4~5。預測價值從高到低分別為肺結節長徑(AUC=0.843)、最大CT值(AUC=0.840)、CTR(AUC=0.836)、平均CT值(AUC=0.834)、最小CT值(AUC=0.827)、肺結節短徑(AUC=0.804)、惡性概率(AUC=0.737)、年齡(AUC=0.701)、結節危險度(AUC=0.627);兩種量化參數聯合:CTR聯合平均CT值、CTR聯合肺結節長徑、肺結節長徑聯合平均CT值,分別提高AI的預測價值(AUC分別為0.843、0.867、0.877)。聯合指標之間的相關性:計算變量兩兩之間的Pearson相關系數,指標之間具有相關性,相關系數分別為0.817,0.517,0.468(P均<0.05)。
 圖4
單一量化參數的受試者工作特征曲線
圖4
單一量化參數的受試者工作特征曲線
 圖5
聯合量化參數的受試者工作特征曲線
圖5
聯合量化參數的受試者工作特征曲線
2.3 獨立預測因子分析
以各量化參數為自變量,以浸潤程度不同的GGN為因變量,通過二元logistic回歸進一步分析預測侵襲程度的獨立危險因素;見表3。結果顯示肺結節長徑(OR=1.264,P<0.001)及平均CT值(OR=1.005,P<0.001)是預測IAC的獨立危險因素,診斷閾值分別為肺結節長徑11.45 mm、平均CT值–503.5 Hu。
2.4 腫瘤實性成分比值
分析兩組間CTR(CT臨界值為–145 Hu),浸潤組明顯高于非浸潤組(P<0.001);當CTR閾值為1.775%時,診斷IAC靈敏度為0.753、特異度為0.851。
3 討論
肺癌是發病率與死亡率均位居前列的惡性腫瘤。隨著LDCT的應用和普及,越來越多的肺部小結節被發現。當篩查發現需要外科干預的肺結節時,高分辨胸部CT能夠清晰呈現肺結節的真實面貌,如肺結節長徑、肺結節短徑、CT灰度值、毛刺征、胸膜凹陷征、支氣管截斷等影像學特點,傳統手工測量方法量化影像學指標存在一定局限性,而李大勝等[5]發現AI在多原發GGN患者篩查和診斷中存在優勢。另外,Chen等[6]發現基于深度學習和人口大數據,AI輔助診斷通過CT閾值、模板匹配、形態學特征等方法可提高識別惡性結節的特異度和敏感度;可清晰呈現良惡性肺結節的位置及體積分布圖,良性結節多分布于外周胸膜,惡性結節多分布于肺尖部。
在臨床工作中,如何讓需要外科干預的肺結節患者既保留更多肺功能又能從術后長期生存中獲益?這是一個值得思考的問題。這需要臨床醫生結合GGN影像學特點和患者身心狀態綜合評估,以患者為中心制定個性化的手術方案。NCCN指南推薦,肺葉切除+肺門縱隔淋巴結清掃作為IAC患者的首選術式[7]。胸腔鏡手術已經被證實與傳統開胸手術有等效的治療效果,并且具有切口小、疼痛輕、恢復快等優勢。日本JCOG0201研究[8]表明,與肺葉切除相比,符合放射學非浸潤標準的惡性GGN(長徑≤3 cm,CTR≤0.5)在保證切緣足夠的前提下行亞肺葉切除(楔形或肺段)患者預后良好。這與Dembitzer等[9]研究結果一致。Bedetti等[10]的Meta分析證明,與肺葉切除相比,Ⅰ期非小細胞肺癌患者行肺段切除術后總體生存期無差異。另外,Qu等[11]的Meta分析表明Ⅰ期非小細胞肺癌患者行肺段切除聯合正確淋巴結處理,與肺葉切除相比在總體生存期和肺癌特異生存率上無差異。隨著多中心前瞻性研究數據的披露,如日本JCOG0802、美國CALGB140503研究,亞肺葉切除很有可能成為Ⅰ期非小細胞肺癌患者的首選術式[12]。雖然,亞肺葉切除較肺葉切除保留更多肺組織,但對術后肺功能的評估和保護還存在爭議。Tane等[13]發現肺段切除術后剩余肺功能優于肺葉。而Gu等[14]發現,與肺葉切除相比,肺楔形切除對肺功能影響最小,肺段切除可減小用力肺活量的損失,而一秒用力呼氣容積和一氧化碳擴散肺容量無差異。Chen等[15]發現只有當切除范圍小于相應肺葉的一半時,肺段切除比肺葉切除有助于保護更多的肺功能,而用力肺活量兩者無差異。這些研究結果提示肺段切除的適應證在逐漸擴大,與肺葉切除相比,它有利于保護更多的肺功能,但應避免同時多個肺段或復雜肺段手術。
本研究分析比較兩組之間GGN影像學特點發現,浸潤組GGN具有更大的直徑、更高的密度和實性成分、更多惡性征象等特點,這與腺癌病理學發生發展密切相關。早期腺癌細胞多沿著肺泡壁生長,隨著病情進展,慢慢累及肺泡間質結構,進而使肺泡腔萎縮塌陷,出現GGN直徑增大、密度增高、實性成分變多。浸潤程度進一步加重,腫瘤生長速度的不均質、肺泡結構塌陷牽拉胸膜可表現為分葉征、胸膜凹陷征等惡性征象。肺腺癌細胞在“向外拓展領地”的過程中,可發生氣道、血道及淋巴轉移,進而轉移至肺內其它部位或者遠處臟器。
陳琦等[16]指出GGN最大直徑和CT值有效預測肺癌的惡性程度,但手工測量GGN量化數值存在測量誤差、主觀偏倚,且重復性差。蔡雅倩等[17]表明,AI肺結節篩查輔助診斷軟件可有效檢出GGN,并可初步鑒別肺結節良惡性。周小君等[18]提出AI肺結節相關量化參數可有效預測早期GGN肺癌的浸潤程度,尤其肺結節長徑和平均CT值的預測價值較高。而本研究團隊采用另一種AI肺結節輔助診斷軟件(推想預測,北京推想科技研發)進行數據量化分析,新增量化指標包括CTR、惡性概率、危險分度。與周小君等研究結果不同的是,兩組GGN的量化參數比較:兩組GGN的短徑、CTR、惡性概率、結節危險度及年齡的差異均有統計學意義(P均<0.001)。在腺癌組中,女性GGN的占比(133個,74.7%)顯著高于男性GGN(45個,25.3%),提示女性更易患肺腺癌。浸潤組年齡[(59.93±8.53)歲]顯著大于非浸潤組[(52.04±12.10)歲],這提示高齡(≥54.5歲)患者更易患IAC,腺癌發生發展是一個緩慢的過程。病理確診為腺癌的高危結節好發部位分別為右肺上葉(45個)、左肺上葉(31個)、右肺下葉(27個)、左肺下葉(22個)、右肺中葉(13個),占比分別是25.2%、17.4%、15.1%、12.3%、7.3%。提示上葉比下葉多發,右肺比左肺多發,尤其以右肺上葉最多發,這與Chen等[6]的研究結果一致;而右肺中葉的占比最少,這可能與中葉體積比較小有關。另外,本研究結果證明肺結節長徑聯合平均CT值、長徑聯合CTR、平均CT值聯合CTR均可提高AI的預測價值(AUC分別為0.877、0.867、0.843)。Logistic回歸結果顯示長徑和平均CT值是預測IAC的獨立危險因素,這與既往研究[18]結果一致。JCOG0201研究[8]結果證明CTR與GGN的病理分期及預后密切相關。而本研究表明,浸潤組中腫瘤實性成分比值顯著高于非浸潤組,提示CTR是鑒別肺癌浸潤和侵襲有效指標之一。與既往研究二維平面中CTR與腫瘤的長徑比值不同,本研究特色在于三維空間中實性成分(CT臨界值為–145 Hu)與腫瘤的體積比值,更加客觀準確呈現GGN中實性成分多少。本研究結果提示當CTR>1.775%,診斷IAC的敏感度和特異度為0.753、0.851。但是AI識別實性成分容易被腫瘤內血管、鈣化等因素影響,Singh等[19]運用具有血管抑制功能的AI軟件可以降低這種影響。本研究使用的軟件缺乏該功能,可能存在一定的測量誤差。孫炎冰等[20]的研究表明,長徑在GGN臨床隨訪中存在價值。而在本研究中當肺結節長徑>11.45 mm時,診斷IAC的敏感度和特異度分別為0.779、0.802。Zhang等[21]的研究指出GGN的平均CT值對預測腫瘤生長、鑒別病理分期有較大臨床價值。本研究中當平均CT值>–503.5 Hu時,診斷IAC的敏感度和特異度分別為0.779、0.790。綜合CTR和平均CT值能夠更加準確地呈現GGN密度和實性成分的變化。因此,當肺結節長徑>11.45 mm、平均CT值>–503.5 Hu、CTR>1.775%,需高度警惕GGN為IAC。胸外科醫生可以根據GGN影像學特點和AI量化參數,保證足夠切緣范圍和淋巴結充分評估的前提下,選擇適合患者的最佳手術方案。
本研究屬于單中心回顧性分析,缺乏前瞻性隨訪研究數據,這是我們研究團隊后期努力的目標和方向。另外,數據集偏小,醫學統計分析論證強度不強。AI是新一代科技革命中產生的新生事物,雖然它還處于初級階段,存在一定的漏診和誤診情況,功能有待完善和升級,目前AI僅能識別T分期特點,無法識別肺門、縱隔淋巴結及全身器官有無轉移等情況,但“AI+醫學”的結合無疑會促進精準醫學的發展,造福越來越多的患者。我們相信在不遠的將來,AI可以提供更加智能且準確的醫學數據,幫助臨床醫生做出最佳的臨床決策。
利益沖突:無。
作者貢獻:梁云負責查閱資料、收集數據、撰寫論文;刁晶艷、任蒙蒙負責論文數據整理與分析;劉曙亮、謝寧負責選題,論文設計、審校及修改。
致謝 感謝羅光華、費秀渠為文章審校及修改做出的貢獻!