引用本文: 周洪霞, 楊梅, 廖虎, 賴玉田, 戢艷麗, 邱舫, 李為民, 車國衛. 胸腔鏡肺葉切除術后16F尿管胸腔引流可行性的前瞻性隊列研究. 中國胸心血管外科臨床雜志, 2016, 23(4): 334-340. doi: 10.7507/1007-4848.20160078 復制
胸腔鏡肺葉切除術的應用使患者快速康復成為現實,影響肺葉切除術后住院時間的主要因素一是是否行微創手術,二是管道管理,尤其是胸腔引流管的管理[1]。電視胸腔鏡手術(VATS)肺葉切除術后28F聚氯乙烯(polyvinylchlorid,PVC)材料單管引流效果及臨床舒適度方面均具有優勢[2]。但28F PVC引流管仍存在以下不足:①材質硬度高;②需要固定線;③需要預置線用于拔管后切口密封[3]。這些問題是導致患者術后引流管脫落、引流管口疼痛、不適、管口愈合慢、瘢痕愈合和感染的主要原因,從而影響患者住院舒適度并延長術后住院時間[4]。為何選擇16F尿管作為術后引流?主要有以下原因:①16F尿管具有材質軟,有氣囊,克服28F PVC引流管的不足;②胸腔鏡肺葉切除術后總體引流量少且對胸膜重吸收能力影響小,主要是解決術后積氣,小管徑引流管是可行的[5-6];③16F尿管不易脫落并利于患者術后活動和余肺復張。但是其用于胸腔術后引流是否具有同樣的引流效果且不增加并發癥,尚無相關報道。我們前瞻性分析了16 F尿管和28 F引流管在肺葉切除術后的引流效果及相關臨床資料,初步探討16F尿管應用于胸腔引流的可行性及臨床優勢。
1 資料與方法
1.1 臨床資料和分組
連續納入2015年10~12月在四川大學華西醫院胸外科兩個醫療組行胸腔鏡肺葉切除術的患者134例。納入標準:①胸腔鏡肺葉切除術患者(video-assisted thoracic surgery,VATS)肺葉(單葉或雙葉),肺癌患者行系統淋巴結清掃術;②年齡20~85歲;③入組患者需簽署知情同意書。排除標準:①病歷資料不完整;②開放手術或全肺切除患者,術中胸膜腔完全閉鎖或出血量大于500 ml患者;③術后出現乳糜胸量大于500 ml/d;④術后出血或持續漏氣需要再次手術的患者。最終納入分析患者102例(圖 1),男 50例,女 52例;肺良性疾病26例,肺癌76例(腺癌60例,鱗癌12例,小細胞肺癌2例,大細胞肺癌1例,類癌1例)。根據引流管型號將患者分為兩組:16F組,49例,采用16F尿管引流;28F組,53例,采用28F引流管。肺癌患者術后分期采用國際抗癌聯盟(Union for International Cancer Control,UICC,2009)肺癌分期標準。患者臨床特征見表 1。
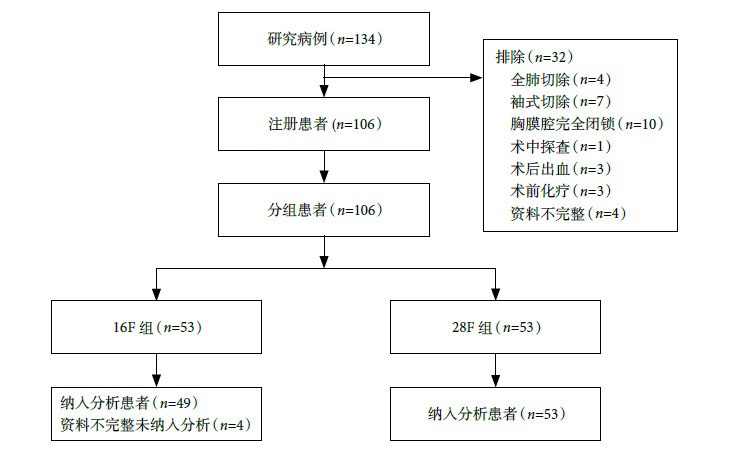 圖1
研究患者篩選流程
圖1
研究患者篩選流程
1.2 方法
1.2.1 手術方法
采用單向式胸腔鏡肺葉切除法[7]。肺癌患者需行系統淋巴結清掃,左側必須清掃第5、6、7、8、9、10組淋巴結,右側包括第2、3、4、7、8、9、10組淋巴結[8]。引流管應用方法:28F胸腔引流管(揚州市邗江華飛醫療器件廠)和16F尿管(大連庫利艾特醫療制品有限公司,圖 2),所有患者術后均應用單根引流管,將16F尿管或28F引流管從第7肋間鏡孔置入胸腔內,28F引流管常規從后胸壁放在胸頂,16F尿管自然放入胸腔內。兩組患者術后均采用相同的水封引流瓶,且均不加用負壓吸引;16F組不需固定線或加用留置線,28F引流管需線結固定和留置線[9-10]。
 圖2
28F胸腔引流管和16F尿管
圖2
28F胸腔引流管和16F尿管
1.2.2 術后處理[10 ]
拔管后均鼓勵患者咳嗽,必要時刺激患者咳嗽。術后第1天均行胸部X線片檢查,若無肺漏氣且每天引流量小于300 ml,肺已復張則拔除引流管。術后疼痛處理:均應用鎮痛泵(5 mg loading dose followed by 1.0~1.5 mg/h),均早期促使患者下床活動。必要時應用非甾體類止痛藥(泰勒寧或芬必得)。鎮痛泵于引流管拔除的同時也一起停止。
1.2.3 觀察指標
1.2.3.1 術后并發癥[11 ]
術后胸腔積氣(胸部X線片提示:胸腔積氣>30%)、術后胸腔積液(胸部X線片提示:胸腔積液中量以上)、30 d后胸腔積液標準:一是胸部X線片提示胸腔積液中量以上,二是患者有癥狀且和胸腔積液有關。肺部感染[12](①明確的病原學證據;②影像學提示肺不張或大片狀影;③發熱;④白細胞總數大于10 000/ml或15 000/ml)。手術后觀察胸腔引流量、引流時間、術后住院時間、再次置管率等。
1.2.3.2 舒適度評分標準[13 ]
采用視覺模擬(visual analogue scale/score,VAS)評分法,根據患者主觀感覺記錄疼痛發生率與程度。Ⅰ度:術后自由下床活動疼痛評分為0~3分;Ⅱ度:術后下床活動需要幫助,疼痛評分4~7分;Ⅲ度:術后不能下床活動疼痛評分8~10分。
1.2.3.3 疼痛評分[14 ]
采用VAS法:是將疼痛的程度用0至10共11個數字表示,0表示無痛,10代表最痛,患者根據自身疼痛程度在這11個數字中挑選一個數字代表疼痛程度。0分,無疼痛;1~3分,輕微疼痛,患者能忍受;4~6分:疼痛并影響睡眠,尚能忍受,需要臨床處置;7~10分:患者有強烈疼痛,疼痛劇烈或難忍,必需臨床處理。
1.2.3.4 胸膜粘連
有粘連:粘連范圍大于或等于1/3;無粘連:粘連范圍小于1/3。
1.2.3.5 手術時間
從切皮開始到關胸結束時間。術前住院日是從入院到手術當日,術后住院日包括手術當日到出院。
1.2.3.6 胸腔引流量
24 h引流量是指第1 d引流量,48 h引流量包括第1d引流量,72 h引流量是指3 d總引流量。
1.3 統計學分析
統計分析采用SPSS 16.0 軟件包,計數資料采用實際例數及百分比表示,計量資料采用均數±標準差(
2 結果
2.1 兩組患者臨床特征分析
兩組患者年齡、性別、吸煙史、疾病種類和切除范圍、術中胸膜粘連情況、肺葉切除時間及術中出血量差異均無統計學意義;而伴隨疾病比例在16F組(36.7%)顯著低于28F組(58.5%,P=0.041)。但高血壓病和糖尿病患者比例在16F組 (27.8%,16.7%)顯著高于28F組(19.34%,6.45%,P=0.047,P=0.023,表 1、表 2)。
2.2 兩組患者術后胸腔引流量及相關并發癥分析
16F組胸腔引流總量[(587.3±323.7)ml]顯著低于28F組[(824.1±444.3)ml,P=0.000]。16F組拔管前胸腔積氣(不需處理)率(38.8%)顯著高于28F組(18.9%,P=0.026);16F組拔管前胸腔少量積液(不需處理)率(42.9%)顯著低于28F組(58.5%,P=0.031)。兩組一次性拔管成功率差異無統計學意義(98.0% vs. 94.3%,P=0.347)。兩組患者術后肺部并發癥發生率(16F組:30.6%;28F組:28.3%)差異無統計學意義(P=0.102)。16F組術后再置管率(2.0%)顯著低于28F組(5.7%,P=0.048)。但30 d后兩組胸腔積液發生率差異無統計學意義(2.0% vs. 1.9%,P=0.601)。但16F組不需臨床處理的皮下氣腫發生率(60.0%)顯著高于28F組(6.7%,P=0.011)。兩組肺部感染和肺栓塞發生率差異無統計學意義(表 2)。
2.3 兩組患者術后臨床效果比較
兩組患者術前住院時間、拔管前后疼痛及舒適度評分差異均無統計學意義。但拔管前鎮痛藥(嗎啡類)應用比例在16F組(2.0%)顯著低于28F組(13.2%,P=0.000,表 3)。16F組引流時間和術后住院時間[(54.2±28.6)h,(4.2±1.4)d]均顯著短于28F組[(95.6±65.5)h,(6.5±3.0)d,P=0.000,P=0.000]。術后第3 d16F組一秒率(FEV1 /FVC,61.2%)顯著高于28F組(45.3%,P=0.025)。16F組引流管口拆線時間[(8.1±1.2)d]顯著短于28F組[(14.3±4.1)d,P=0.033];而16F組引流管口Ⅰ級愈合率(100.0%)顯著高于28F組(58.5%,P=0.014,表 3)。
3 討論
胸腔鏡肺葉切除術已成為肺手術的主流方法,也是加速康復外科(enhanced recovery after surgery,eras)的主要手段,被外科醫師接受并廣泛運用[15]。ERAS的核心理念是降低術后并發癥和縮短住院時間,反映在臨床是促進患者早日活動和減少不必要醫療干預;因此,基于病種圍繞微創外科技術優化管理流程成為ERAS的必要條件[16]。胸外科術后肺快速康復一方面需要微創肺葉切除術,另一方面是優化管道管理,尤其是胸腔引流管[17]。
近20年來,肺葉切除術后胸腔引流管理的主要管理體現在以下幾方面:①單管引流代替雙管引流,只有個別醫生因個人習慣仍沿用雙管引流[9, 18];②吸氣末拔管到呼氣末拔管,呼氣末拔管后胸腔積氣和肺不張的比例更低[19];③術后引流量小于100~500 ml/d就可以拔管,只要肺不漏氣[20];④甚至不安置引流管或不考慮引流量,只要肺不漏氣就可以拔管[21];⑤電子引流裝置代替目前常用的胸腔閉式引流系統,可以更加客觀掌握(主要是漏氣) [22]。這些臨床研究結果使術后早期拔除引流管成為可能且改善患者住院舒適度,但仍不能反映目前外科技術發展所帶來的變化。
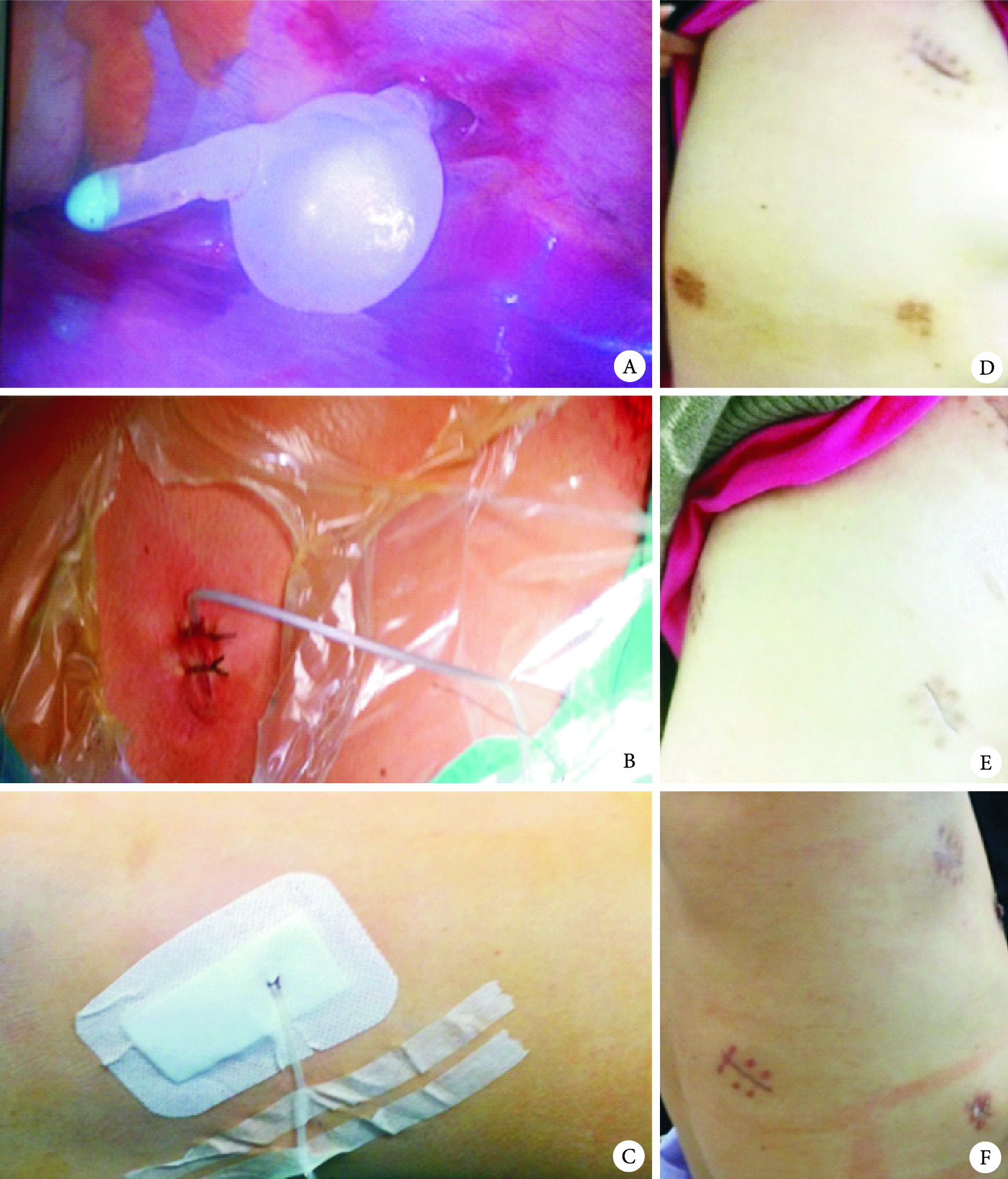
從根本上改變術后胸腔引流的觀念、方法的時機成熟了嗎?答案是肯定的,主要理由:一是微創外科理論、技術(胸腔鏡、超聲刀、切割縫合器等)及相關新材料的應用(止血材料、醫用膠等)縮短手術時間和手術對機體的創傷;二是術中出血和術后滲液減少,保留胸膜腔重吸收功能,二者共同效應是胸腔引流液顯著減少,多項研究證實肺葉切除術后胸腔總引流量約500 ml左右[10];三是快速肺康復核心內容是早期活動,而胸腔引流管是限制患者術后活動的主要因素之一[23];四是胸腔引流管的固定和管口的閉合方式均由絲線完成,是術后疼痛和管口皮膚壞死、感染的主要原因(圖 3),引流管口愈合慢即延長住院時間和降低住院舒適度,又降低患者滿意度[24]。
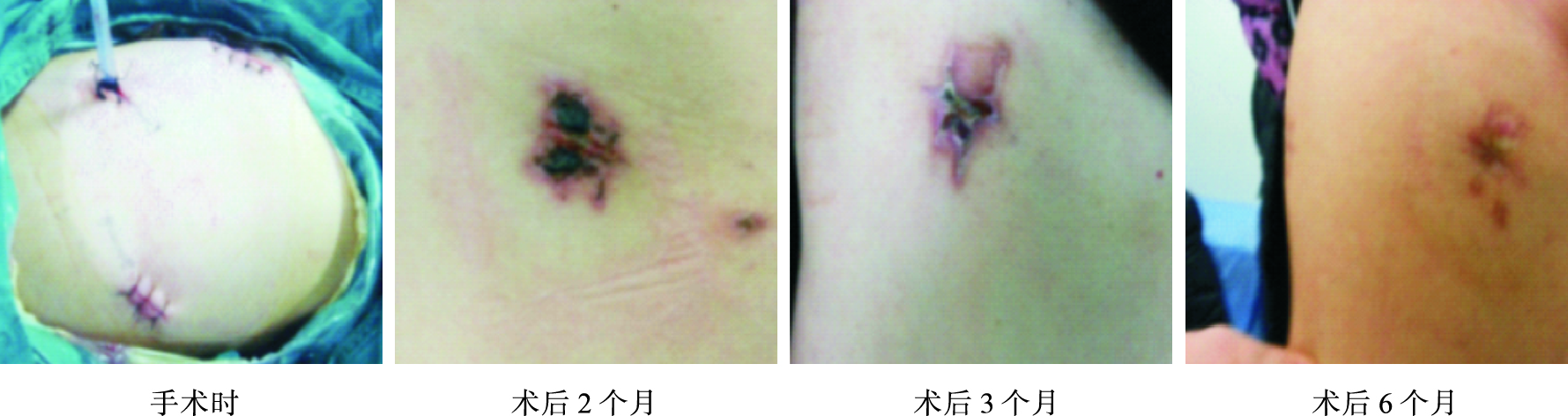 圖3
28F胸腔引流管術后管口愈合情況
圖3
28F胸腔引流管術后管口愈合情況
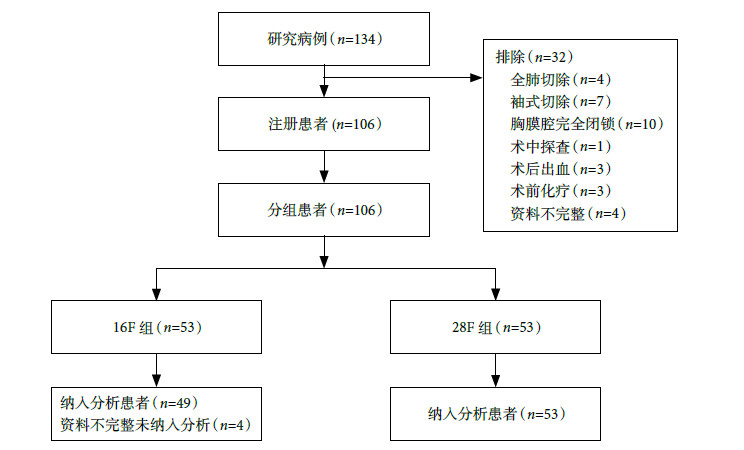
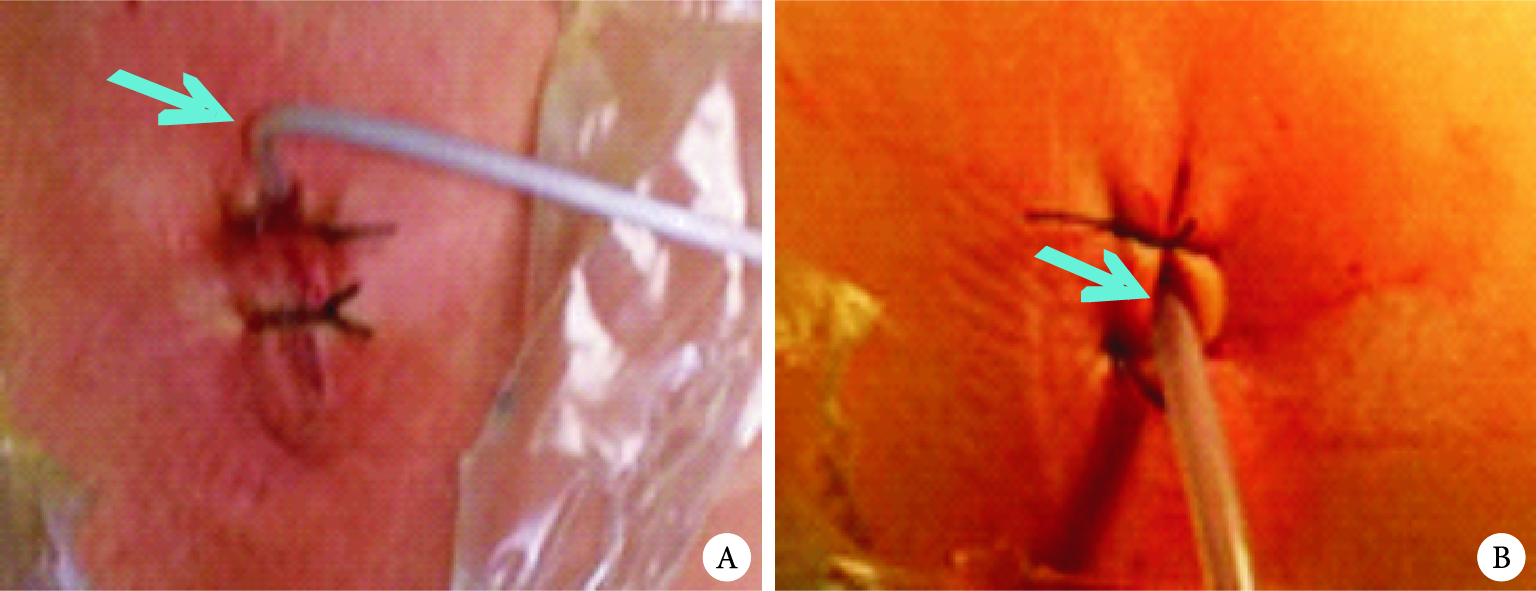
胸腔引流的目的應從主要引流液體向氣體轉變,更加關注術后漏氣;同時關注引流管口愈合,從降低引流管徑、固定方式和切口閉合方法等入手[25]。研究發現16F尿管和28F胸腔引流管術后引流效果相當,但在減少術后疼痛和促進切口愈合方面具有優勢[10];但28F引流管仍存在材質硬,固定用切口縫合線易導致引流管脫落和松動,且拔管后部分仍需要縫合(帶管時間長于5 d),這給臨床管理帶來難度[10, 26]。16F尿管因材質軟且有氣囊,引流時不需絲線固定優勢;雙腔(充氣腔)使內徑小、胸腔內留置長度短的缺點,是否影響術后引流效果呢?通過對102例連續收治的行胸腔鏡肺葉切除術患者前瞻性研究發現,16F尿管代替胸腔引流管用于術后引流是可行的(圖 4A、B、C),主要體現在引流效果與28F引流管效果相當且術后不需要常規加用負壓吸引。16F尿管引流優勢體現:①沒有增加術后與引流管密切相關的并發癥(如住院期間和30 d后胸腔積液或積氣);②術后引流量顯著減少;③改善了術后第3 d的肺功能;④引流持續時間、管口拆線時間及術后住院時間顯著縮短;⑤引流管口Ⅰ級愈合率可以達到100.0%(圖 4 D、E、F)。但是16F尿管術后拔管前的皮下氣腫比例增加,盡管不需臨床特殊處理,是否與16F尿管管徑小有關呢?觀察后發現原因可能如下:一是與尿管放置位置有關,尿管不能放在切口邊緣(圖 5A箭頭所示),應放在切口中間(圖 5B箭頭所示);二是縫合有關,縫合肌層和皮下,打結前置入引流管,收緊打結。改進后皮下氣腫發生率降低(目前仍在研究,資料尚未發表)。
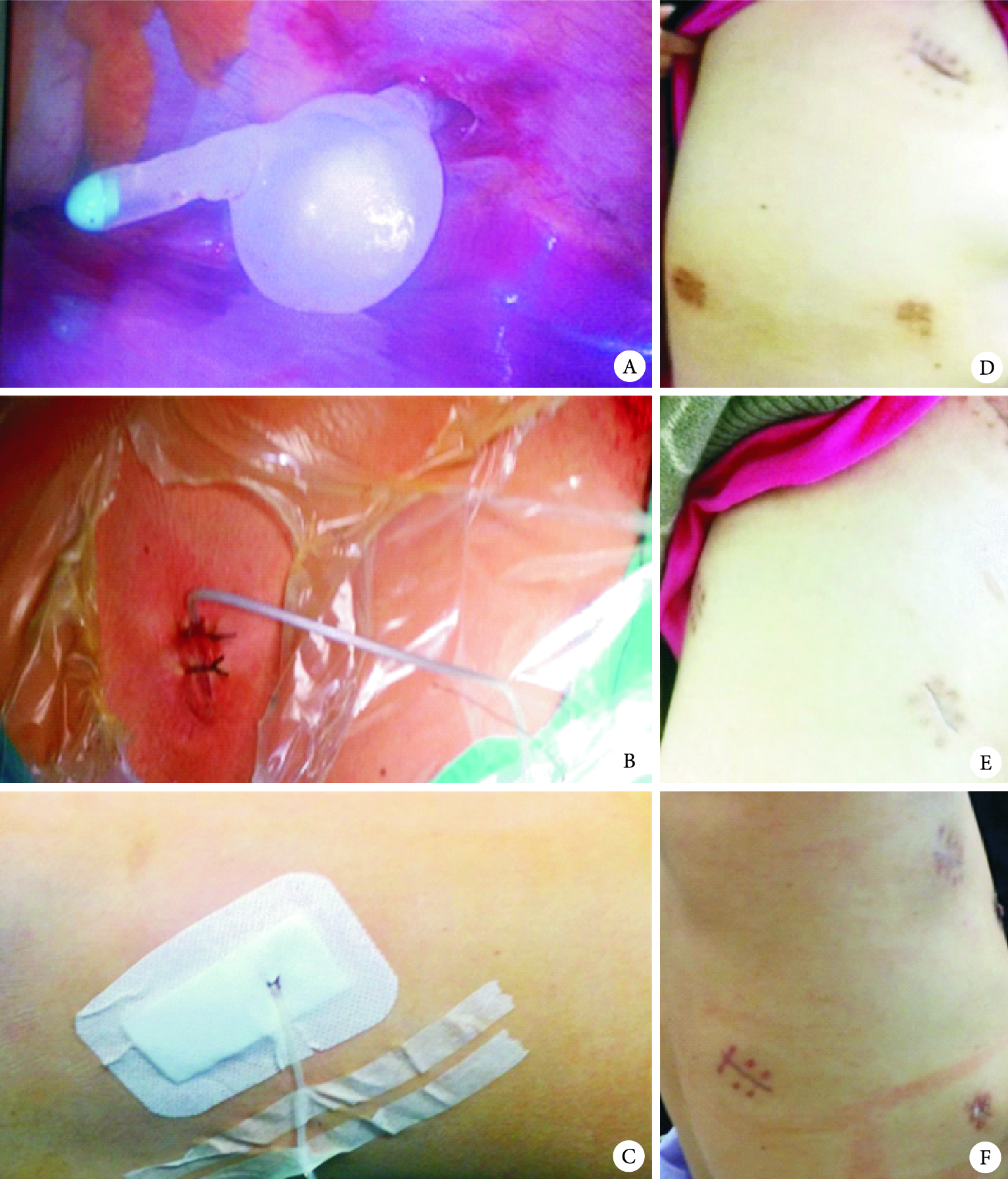 圖4
16F尿管術中安置示意圖
圖4
16F尿管術中安置示意圖
注:A為尿管氣囊在胸腔內;B為尿管在皮膚切口位置(邊緣);C為尿管胸壁包扎簡單;D、E、F是三例患者術后30 d時愈合情況
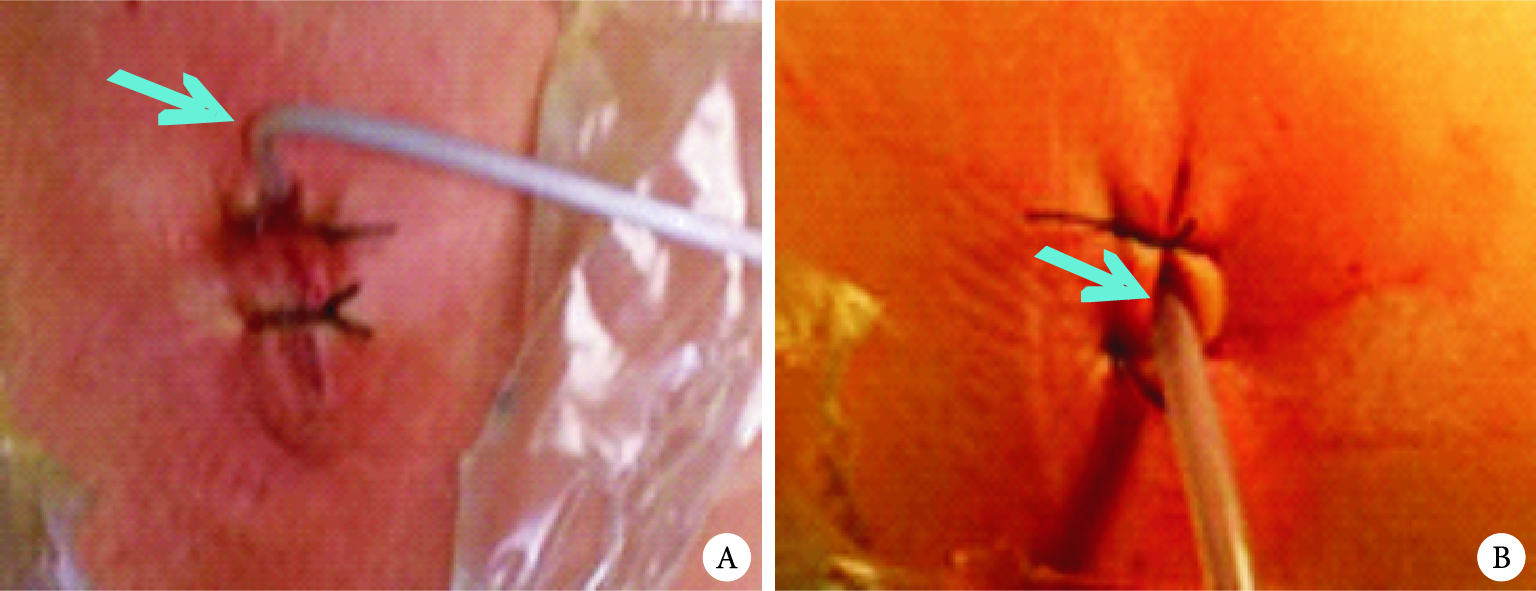 圖5
16F尿管術中安置位置
圖5
16F尿管術中安置位置
注:A為邊緣;B為中間
本研究也存在以下不足:一是兩組患者總體伴隨疾病差異無統計學意義,但16F組高血壓病和糖尿病患者比例較28F組高。二是16F組沒有改善拔管前后疼痛及舒適度評分,這可能與術后充分鎮痛有關,28F組術后鎮痛強度和頻次均高于16F組,尤其是嗎啡類藥物應用。這些均需要設計更好的臨床試驗進行研究。
總之,16F尿管用于選擇性VATS肺葉切除術后胸腔引流可行,利于早期拔管和患者活動、顯著改善術后肺功能,促進切口愈合而達到快速康復的效果。
胸腔鏡肺葉切除術的應用使患者快速康復成為現實,影響肺葉切除術后住院時間的主要因素一是是否行微創手術,二是管道管理,尤其是胸腔引流管的管理[1]。電視胸腔鏡手術(VATS)肺葉切除術后28F聚氯乙烯(polyvinylchlorid,PVC)材料單管引流效果及臨床舒適度方面均具有優勢[2]。但28F PVC引流管仍存在以下不足:①材質硬度高;②需要固定線;③需要預置線用于拔管后切口密封[3]。這些問題是導致患者術后引流管脫落、引流管口疼痛、不適、管口愈合慢、瘢痕愈合和感染的主要原因,從而影響患者住院舒適度并延長術后住院時間[4]。為何選擇16F尿管作為術后引流?主要有以下原因:①16F尿管具有材質軟,有氣囊,克服28F PVC引流管的不足;②胸腔鏡肺葉切除術后總體引流量少且對胸膜重吸收能力影響小,主要是解決術后積氣,小管徑引流管是可行的[5-6];③16F尿管不易脫落并利于患者術后活動和余肺復張。但是其用于胸腔術后引流是否具有同樣的引流效果且不增加并發癥,尚無相關報道。我們前瞻性分析了16 F尿管和28 F引流管在肺葉切除術后的引流效果及相關臨床資料,初步探討16F尿管應用于胸腔引流的可行性及臨床優勢。
1 資料與方法
1.1 臨床資料和分組
連續納入2015年10~12月在四川大學華西醫院胸外科兩個醫療組行胸腔鏡肺葉切除術的患者134例。納入標準:①胸腔鏡肺葉切除術患者(video-assisted thoracic surgery,VATS)肺葉(單葉或雙葉),肺癌患者行系統淋巴結清掃術;②年齡20~85歲;③入組患者需簽署知情同意書。排除標準:①病歷資料不完整;②開放手術或全肺切除患者,術中胸膜腔完全閉鎖或出血量大于500 ml患者;③術后出現乳糜胸量大于500 ml/d;④術后出血或持續漏氣需要再次手術的患者。最終納入分析患者102例(圖 1),男 50例,女 52例;肺良性疾病26例,肺癌76例(腺癌60例,鱗癌12例,小細胞肺癌2例,大細胞肺癌1例,類癌1例)。根據引流管型號將患者分為兩組:16F組,49例,采用16F尿管引流;28F組,53例,采用28F引流管。肺癌患者術后分期采用國際抗癌聯盟(Union for International Cancer Control,UICC,2009)肺癌分期標準。患者臨床特征見表 1。
 圖1
研究患者篩選流程
圖1
研究患者篩選流程
1.2 方法
1.2.1 手術方法
采用單向式胸腔鏡肺葉切除法[7]。肺癌患者需行系統淋巴結清掃,左側必須清掃第5、6、7、8、9、10組淋巴結,右側包括第2、3、4、7、8、9、10組淋巴結[8]。引流管應用方法:28F胸腔引流管(揚州市邗江華飛醫療器件廠)和16F尿管(大連庫利艾特醫療制品有限公司,圖 2),所有患者術后均應用單根引流管,將16F尿管或28F引流管從第7肋間鏡孔置入胸腔內,28F引流管常規從后胸壁放在胸頂,16F尿管自然放入胸腔內。兩組患者術后均采用相同的水封引流瓶,且均不加用負壓吸引;16F組不需固定線或加用留置線,28F引流管需線結固定和留置線[9-10]。
 圖2
28F胸腔引流管和16F尿管
圖2
28F胸腔引流管和16F尿管
1.2.2 術后處理[10 ]
拔管后均鼓勵患者咳嗽,必要時刺激患者咳嗽。術后第1天均行胸部X線片檢查,若無肺漏氣且每天引流量小于300 ml,肺已復張則拔除引流管。術后疼痛處理:均應用鎮痛泵(5 mg loading dose followed by 1.0~1.5 mg/h),均早期促使患者下床活動。必要時應用非甾體類止痛藥(泰勒寧或芬必得)。鎮痛泵于引流管拔除的同時也一起停止。
1.2.3 觀察指標
1.2.3.1 術后并發癥[11 ]
術后胸腔積氣(胸部X線片提示:胸腔積氣>30%)、術后胸腔積液(胸部X線片提示:胸腔積液中量以上)、30 d后胸腔積液標準:一是胸部X線片提示胸腔積液中量以上,二是患者有癥狀且和胸腔積液有關。肺部感染[12](①明確的病原學證據;②影像學提示肺不張或大片狀影;③發熱;④白細胞總數大于10 000/ml或15 000/ml)。手術后觀察胸腔引流量、引流時間、術后住院時間、再次置管率等。
1.2.3.2 舒適度評分標準[13 ]
采用視覺模擬(visual analogue scale/score,VAS)評分法,根據患者主觀感覺記錄疼痛發生率與程度。Ⅰ度:術后自由下床活動疼痛評分為0~3分;Ⅱ度:術后下床活動需要幫助,疼痛評分4~7分;Ⅲ度:術后不能下床活動疼痛評分8~10分。
1.2.3.3 疼痛評分[14 ]
采用VAS法:是將疼痛的程度用0至10共11個數字表示,0表示無痛,10代表最痛,患者根據自身疼痛程度在這11個數字中挑選一個數字代表疼痛程度。0分,無疼痛;1~3分,輕微疼痛,患者能忍受;4~6分:疼痛并影響睡眠,尚能忍受,需要臨床處置;7~10分:患者有強烈疼痛,疼痛劇烈或難忍,必需臨床處理。
1.2.3.4 胸膜粘連
有粘連:粘連范圍大于或等于1/3;無粘連:粘連范圍小于1/3。
1.2.3.5 手術時間
從切皮開始到關胸結束時間。術前住院日是從入院到手術當日,術后住院日包括手術當日到出院。
1.2.3.6 胸腔引流量
24 h引流量是指第1 d引流量,48 h引流量包括第1d引流量,72 h引流量是指3 d總引流量。
1.3 統計學分析
統計分析采用SPSS 16.0 軟件包,計數資料采用實際例數及百分比表示,計量資料采用均數±標準差(
2 結果
2.1 兩組患者臨床特征分析
兩組患者年齡、性別、吸煙史、疾病種類和切除范圍、術中胸膜粘連情況、肺葉切除時間及術中出血量差異均無統計學意義;而伴隨疾病比例在16F組(36.7%)顯著低于28F組(58.5%,P=0.041)。但高血壓病和糖尿病患者比例在16F組 (27.8%,16.7%)顯著高于28F組(19.34%,6.45%,P=0.047,P=0.023,表 1、表 2)。
2.2 兩組患者術后胸腔引流量及相關并發癥分析
16F組胸腔引流總量[(587.3±323.7)ml]顯著低于28F組[(824.1±444.3)ml,P=0.000]。16F組拔管前胸腔積氣(不需處理)率(38.8%)顯著高于28F組(18.9%,P=0.026);16F組拔管前胸腔少量積液(不需處理)率(42.9%)顯著低于28F組(58.5%,P=0.031)。兩組一次性拔管成功率差異無統計學意義(98.0% vs. 94.3%,P=0.347)。兩組患者術后肺部并發癥發生率(16F組:30.6%;28F組:28.3%)差異無統計學意義(P=0.102)。16F組術后再置管率(2.0%)顯著低于28F組(5.7%,P=0.048)。但30 d后兩組胸腔積液發生率差異無統計學意義(2.0% vs. 1.9%,P=0.601)。但16F組不需臨床處理的皮下氣腫發生率(60.0%)顯著高于28F組(6.7%,P=0.011)。兩組肺部感染和肺栓塞發生率差異無統計學意義(表 2)。
2.3 兩組患者術后臨床效果比較
兩組患者術前住院時間、拔管前后疼痛及舒適度評分差異均無統計學意義。但拔管前鎮痛藥(嗎啡類)應用比例在16F組(2.0%)顯著低于28F組(13.2%,P=0.000,表 3)。16F組引流時間和術后住院時間[(54.2±28.6)h,(4.2±1.4)d]均顯著短于28F組[(95.6±65.5)h,(6.5±3.0)d,P=0.000,P=0.000]。術后第3 d16F組一秒率(FEV1 /FVC,61.2%)顯著高于28F組(45.3%,P=0.025)。16F組引流管口拆線時間[(8.1±1.2)d]顯著短于28F組[(14.3±4.1)d,P=0.033];而16F組引流管口Ⅰ級愈合率(100.0%)顯著高于28F組(58.5%,P=0.014,表 3)。
3 討論
胸腔鏡肺葉切除術已成為肺手術的主流方法,也是加速康復外科(enhanced recovery after surgery,eras)的主要手段,被外科醫師接受并廣泛運用[15]。ERAS的核心理念是降低術后并發癥和縮短住院時間,反映在臨床是促進患者早日活動和減少不必要醫療干預;因此,基于病種圍繞微創外科技術優化管理流程成為ERAS的必要條件[16]。胸外科術后肺快速康復一方面需要微創肺葉切除術,另一方面是優化管道管理,尤其是胸腔引流管[17]。
近20年來,肺葉切除術后胸腔引流管理的主要管理體現在以下幾方面:①單管引流代替雙管引流,只有個別醫生因個人習慣仍沿用雙管引流[9, 18];②吸氣末拔管到呼氣末拔管,呼氣末拔管后胸腔積氣和肺不張的比例更低[19];③術后引流量小于100~500 ml/d就可以拔管,只要肺不漏氣[20];④甚至不安置引流管或不考慮引流量,只要肺不漏氣就可以拔管[21];⑤電子引流裝置代替目前常用的胸腔閉式引流系統,可以更加客觀掌握(主要是漏氣) [22]。這些臨床研究結果使術后早期拔除引流管成為可能且改善患者住院舒適度,但仍不能反映目前外科技術發展所帶來的變化。
從根本上改變術后胸腔引流的觀念、方法的時機成熟了嗎?答案是肯定的,主要理由:一是微創外科理論、技術(胸腔鏡、超聲刀、切割縫合器等)及相關新材料的應用(止血材料、醫用膠等)縮短手術時間和手術對機體的創傷;二是術中出血和術后滲液減少,保留胸膜腔重吸收功能,二者共同效應是胸腔引流液顯著減少,多項研究證實肺葉切除術后胸腔總引流量約500 ml左右[10];三是快速肺康復核心內容是早期活動,而胸腔引流管是限制患者術后活動的主要因素之一[23];四是胸腔引流管的固定和管口的閉合方式均由絲線完成,是術后疼痛和管口皮膚壞死、感染的主要原因(圖 3),引流管口愈合慢即延長住院時間和降低住院舒適度,又降低患者滿意度[24]。
 圖3
28F胸腔引流管術后管口愈合情況
圖3
28F胸腔引流管術后管口愈合情況
胸腔引流的目的應從主要引流液體向氣體轉變,更加關注術后漏氣;同時關注引流管口愈合,從降低引流管徑、固定方式和切口閉合方法等入手[25]。研究發現16F尿管和28F胸腔引流管術后引流效果相當,但在減少術后疼痛和促進切口愈合方面具有優勢[10];但28F引流管仍存在材質硬,固定用切口縫合線易導致引流管脫落和松動,且拔管后部分仍需要縫合(帶管時間長于5 d),這給臨床管理帶來難度[10, 26]。16F尿管因材質軟且有氣囊,引流時不需絲線固定優勢;雙腔(充氣腔)使內徑小、胸腔內留置長度短的缺點,是否影響術后引流效果呢?通過對102例連續收治的行胸腔鏡肺葉切除術患者前瞻性研究發現,16F尿管代替胸腔引流管用于術后引流是可行的(圖 4A、B、C),主要體現在引流效果與28F引流管效果相當且術后不需要常規加用負壓吸引。16F尿管引流優勢體現:①沒有增加術后與引流管密切相關的并發癥(如住院期間和30 d后胸腔積液或積氣);②術后引流量顯著減少;③改善了術后第3 d的肺功能;④引流持續時間、管口拆線時間及術后住院時間顯著縮短;⑤引流管口Ⅰ級愈合率可以達到100.0%(圖 4 D、E、F)。但是16F尿管術后拔管前的皮下氣腫比例增加,盡管不需臨床特殊處理,是否與16F尿管管徑小有關呢?觀察后發現原因可能如下:一是與尿管放置位置有關,尿管不能放在切口邊緣(圖 5A箭頭所示),應放在切口中間(圖 5B箭頭所示);二是縫合有關,縫合肌層和皮下,打結前置入引流管,收緊打結。改進后皮下氣腫發生率降低(目前仍在研究,資料尚未發表)。
 圖4
16F尿管術中安置示意圖
圖4
16F尿管術中安置示意圖
注:A為尿管氣囊在胸腔內;B為尿管在皮膚切口位置(邊緣);C為尿管胸壁包扎簡單;D、E、F是三例患者術后30 d時愈合情況
 圖5
16F尿管術中安置位置
圖5
16F尿管術中安置位置
注:A為邊緣;B為中間
本研究也存在以下不足:一是兩組患者總體伴隨疾病差異無統計學意義,但16F組高血壓病和糖尿病患者比例較28F組高。二是16F組沒有改善拔管前后疼痛及舒適度評分,這可能與術后充分鎮痛有關,28F組術后鎮痛強度和頻次均高于16F組,尤其是嗎啡類藥物應用。這些均需要設計更好的臨床試驗進行研究。
總之,16F尿管用于選擇性VATS肺葉切除術后胸腔引流可行,利于早期拔管和患者活動、顯著改善術后肺功能,促進切口愈合而達到快速康復的效果。