引用本文: 王江文, 易陽艷, 朱元正, 王朝慧, 吳舒, 張靜, 胡玄, 聶佳瑩. 脂肪干細胞來源外泌體促進糖尿病小鼠創面愈合的實驗研究. 中國修復重建外科雜志, 2020, 34(1): 124-131. doi: 10.7507/1002-1892.201903058 復制
據世界衛生組織(WHO)統計,全球有近 4.22 億名糖尿病患者,預計 2035 年將增加到 5.92 億[1]。糖尿病創面愈合遲緩是糖尿病并發癥之一[2],雖然治療方法較多,但是效果不理想,探討新的促進糖尿病創面愈合方法成為研究熱點[3]。
外泌體(exosomes, Exos)是一種大小為 30~150 nm 的膜性囊泡[4],能參與細胞間通訊,并在組織修復和再生、疾病診斷方面發揮重要作用[5]。研究表明,人臍帶間充質干細胞來源的 Exos 可以促進相關細胞增殖及遷移、增強血管生成、再上皮化和調節免疫應答,進而促進皮膚再生以及糖尿病創面愈合[6-8]。脂肪干細胞(adipose-derived stem cells,ADSCs)也是一種 MSCs,因具有獲取方便、對供區損傷小、儲存量大等優勢,常用于組織再生和修復[9],ADSCs 移植后可促進血管新生[10]。最近,有研究證實了 ADSC-Exos 在創面愈合中的作用[11]。本課題組前期研究也發現 ADSC-Exos 能促進人臍靜脈血管內皮細胞(human umbilical vein endothelial cells,HUVECs) 增殖、遷移及管樣分化,植入裸鼠體內后還能促血管新生[12]。結合上述研究結果,我們分析 ADSC-Exos 可能促進糖尿病小鼠創面愈合,為此進行了進一步研究,為臨床應用 Exos 治療慢性糖尿病創面奠定實驗基礎。報告如下。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康 8 周齡 Balb/c 雄性小鼠 24 只,體質量(30±5)g,由南昌大學實驗動物中心提供。實驗用游離脂肪組織由南昌大學第二附屬醫院整形美容科行吸脂術的女性患者自愿捐贈,患者年齡 25~36 歲。實驗用皮膚組織由南昌大學第二附屬醫院整形美容科行上瞼下垂矯正術的女性患者自愿捐贈,患者年齡 24~30 歲。
DMEM 培養基、FBS、0.25% 胰蛋白酶-0.02%EDTA、分散酶 Ⅱ(GIBCO 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8;同仁公司,日本)。超高速離心機(Beckman 公司,美國);倒置相差顯微鏡(Olympus 公司,日本);流式細胞儀(BD 公司,美國);透射電鏡(ZEISS 公司,德國);納米顆粒跟蹤分析儀(Malvern 公司,英國);CO2 培養箱、多功能酶標儀(Thermo 公司,美國);共聚焦熒光顯微鏡(Leica 公司,德國)。
1.2 ADSCs 分離培養及鑒定
取 12 mL 脂肪組織,PBS 液反復沖洗,用 12 mL 0.2%Ⅰ 型膠原酶消化至糊狀;4℃、以 300×g 離心 5 min,棄上清;用培養基將沉淀重懸后接種至培養瓶內,置于 37℃、5%CO2 孵箱中培養。2 d 后首次換液,以后隔天換液 1 次,當細胞融合至 80% 時傳代。
取第 3 代細胞于倒置相差顯微鏡下觀察,細胞呈均一長梭形,細胞生長密集后呈漩渦狀排列。流式細胞術鑒定細胞表面標志性抗原,CD49d、CD90、CD105 呈陽性表達,CD34、CD45、CD106 呈陰性表達。上述結果提示培養細胞為 ADSCs。
1.3 ADSC-Exos 分離培養及鑒定
取第 3 代 ADSCs,更換為去除 Exos 的完全培養基培養,48 h 后收集上清培養液,參照本課題組前期研究采用的密度梯度離心法分離 ADSC-Exos[12]。具體步驟:4℃、以 300×g 離心 10 min,取上清;3 000×g 離心 20 min,取上清;10 000×g 離心 30 min,取上清;10 000×g 離心 60 min,PBS 重懸收集沉淀;100 000×g 離心 60 min,PBS 重懸收集沉淀,用 0.22 μm 濾頭過濾后獲得 ADSC-Exos,置于–80℃ 保存備用。
采用透射電鏡觀察 ADSC-Exos 形態;Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 Alix、CD63;納米顆粒跟蹤分析儀檢測 ADSC-Exos 粒徑分布。
1.4 成纖維細胞分離培養
將皮膚組織置于含 1% 抗生素的無菌 PBS 中洗滌,修剪脂肪和皮下組織后切成片,置于 4 mg/mL 分散酶 Ⅱ 過夜以分離表皮和真皮。將真皮切成小塊,置于 0.1%Ⅰ型膠原酶、37℃ 消化 4 h,以分離成纖維細胞,經過濾、300×g 離心 10 min 及重懸后,置于 DMEM 培養基中,于 37℃、5%CO2 培養箱中培養,每 2~3 天更換培養基,傳代培養。
1.5 ADSC-Exos 與成纖維細胞復合培養觀察
1.5.1 ADSC-Exos 被成纖維細胞攝取分析
取 100 μL 濃度為 100 μg/mL 的 ADSC-Exos 重懸于 1 mL PBS,加入 4 μL PKH26 熒光染料溶液,37℃ 孵育 20 min,以 100 000×g 離心 70 min,棄上清液,將 ADSC-Exos 重懸于 10 mL PBS 中;4℃、以 100 000×g 離心 70 min,去除多余染料,棄上清;將 ADSC-Exos 重懸于 100 μL PBS 中備用。
取第 5 代成纖維細胞重懸于無血清培養基中,置于 37℃、5%CO2 培養箱中,待細胞貼壁后加入上述 PKH26 熒光標記的 ADSC-Exos,孵育 12 h 后采用 PBS 洗滌細胞 2 次,4% 多聚甲醛固定、DAPI 染色。共聚焦熒光顯微鏡下觀察 PKH26 熒光標記的 ADSC-Exos(呈紅色)是否進入成纖維細胞。
1.5.2 ADSC-Exos 對成纖維細胞增殖及遷移影響
① 采用 CCK-8 法檢測 ADSC-Exos 對成纖維細胞增殖的影響。將第 3 代成纖維細胞以 2×103個/孔接種于 96 孔板,每孔加入無血清培養基 90 μL。將細胞均分成實驗組和對照組,實驗組添加 10 μL 濃度為 100 ng/mL 的 ADSC-Exos,對照組加入等量 PBS;培養 1、2、3、4、5 d 每組取 5 孔,每孔加入 10 μL CCK-8 溶液,繼續孵育 4 h 后,采用多功能酶標儀檢測 450 nm 波長下吸光度(A)值。實驗重復 5 次。
② 采用劃痕法檢測 ADSC-Exos 對成纖維細胞遷移的影響。取第 3 代成纖維細胞以 7×104個/孔接種于 6 孔板中,每孔加入一定量培養基培養,待細胞匯集達 95% 以上時,棄去培養基,以無血清培養基饑餓培養 12~16 h 后,以絲裂霉素 C 處理 30 min,PBS 洗滌 2 次。采用 10 μL 移液器吸頭直尺比照劃痕,PBS 洗滌脫落細胞,10 倍鏡下拍照;再將細胞分成對照組和實驗組,實驗組加入 0.5 mL 濃度為 100 ng/mL 的 ADSC-Exos,對照組加入等量 PBS,用無血清培養基培養 24 h 后拍照。采用 Photoshop CS6 軟件測量細胞遷移距離,按照以下公式計算 24 h 遷移率:(0 h 劃痕寬度-24 h 劃痕寬度)/0 h 劃痕寬度×100%。實驗重復 3 次。
1.6 動物實驗觀察
1.6.1 糖尿病小鼠創面模型制備及分組
24 只小鼠于 12 h 光照/黑暗循環、室溫 25℃ 條件下飼養。為了誘導糖尿病,在飲食調節 1 周后,給予高蔗糖和高脂肪飲食 10 周,然后在第 10、11 周時腹膜內注射鏈脲佐菌素(65 mg/kg)。每周監測小鼠空腹血糖和體質量水平,隨機血糖>16.7 mmol/L 定義為糖尿病小鼠誘導成功。本實驗 24 只小鼠均造模成功。
將 24 只糖尿病小鼠隨機分成實驗組及對照組,每組 12 只。兩組小鼠腹腔注射 10% 水合氯醛(0.04 mL/10 g)麻醉后背部剃毛,采用定制的直徑 8 mm 空心柱狀旋轉鐵片制備圓形全層皮膚創面;然后用內徑 12 mm 環狀塑料環固定創面,5-0 不可吸收絲線間斷縫合,使創面在塑料環內環正中央。創面制備后,實驗組將 0.2 mL ADSC-Exos 溶液于 6 個方向均勻注射于創面邊緣真皮層;對照組同法注射等量 PBS。凡士林紗布覆蓋創面,醫用紗布纏繞傷口處固定。見圖 1。
 圖1
糖尿病小鼠創面模型制備示意圖
圖1
糖尿病小鼠創面模型制備示意圖
a. 背部創面;b. 塑料環固定創面;c. 注射層次示意圖
Figure1. Schematic diagram of preparation of wound model of diabetic micea. The wound at the back; b. The wound was fixed with plastic ring; c. Injection level diagram
1.6.2 觀測指標
① 創面愈合觀測:第 1、4、7、11、16、21 天大體觀察創面愈合情況,創面照相后以 Image J 軟件測量其面積,按以下公式計算創面愈合率:(初始創面面積?單位時間點創面面積)/初始創面面積×100%。
② 組織學及免疫組織化學染色觀察:第 7、14、21 天每組各取 4 只小鼠,頸椎脫臼處死后切取創面組織,經 4% 多聚甲醛固定、乙醇梯度脫水、石蠟包埋,制備 4 μm 厚切片。取第 7、14、21 天切片行 HE 染色,第 14、21 天切片行 Masson 染色。于 HE 染色圖片測量創面缺損長度;Masson 染色切片觀察膠原纖維情況,400 倍鏡下每張切片隨機取 6 個視野,采用 Image Pro Plus 6.0 軟件測定膠原纖維沉積百分比。
取第 7、14 天切片行 CD31 免疫組織化學染色,DAPI 復染,鏡下觀察兩組創面血管新生情況,CD31 陽性染色呈棕色。400 倍鏡下每張切片隨機取 6 個視野,計數每個視野中微血管數,取均值。
1.7 統計學方法
采用 Graphpad Prism 8 統計軟件進行分析。數據以均數±標準差表示,組間比較采用獨立樣本 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 ADSC-Exos 鑒定
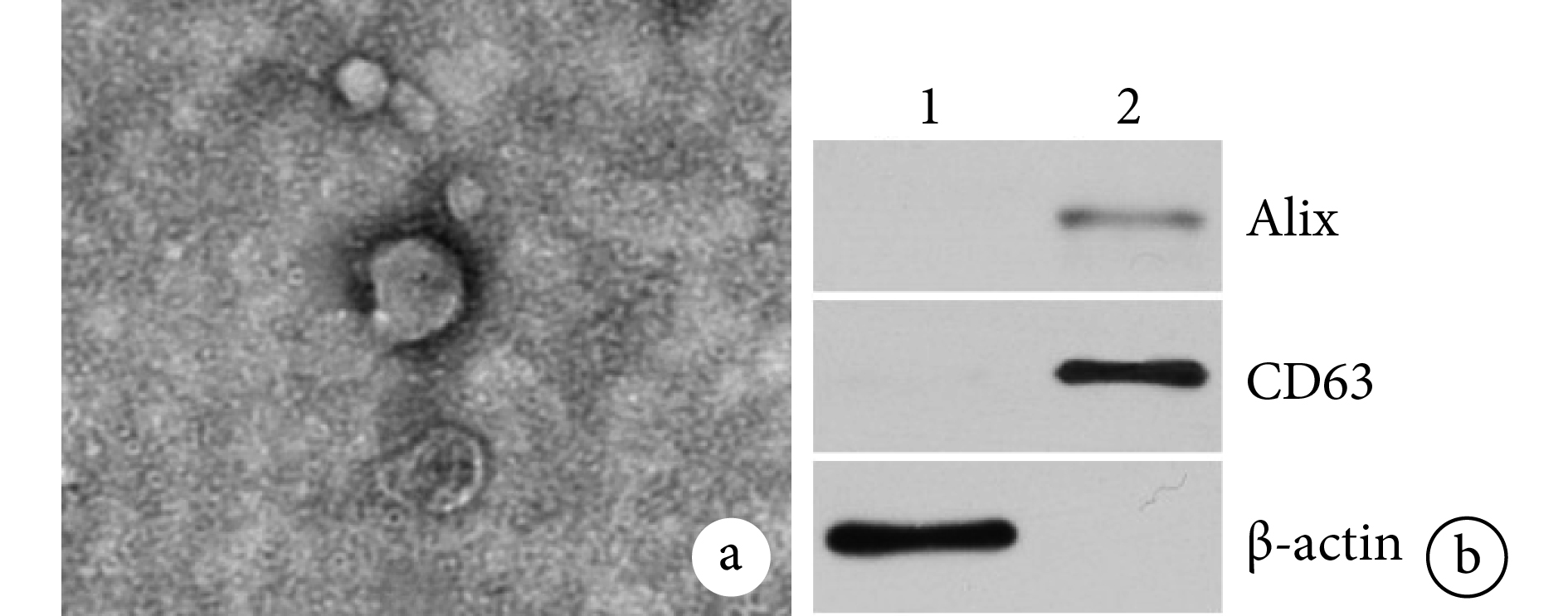
透射電鏡下 ADSC-Exos 為邊緣清晰、圓形、大小分布均勻的膜性囊泡(圖 2a)。納米顆粒跟蹤分析儀檢測 ADSC-Exos 粒徑為 40~200 nm,平均 102.1 nm。Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 Alix、CD63 表達均呈陽性(圖 2b)。
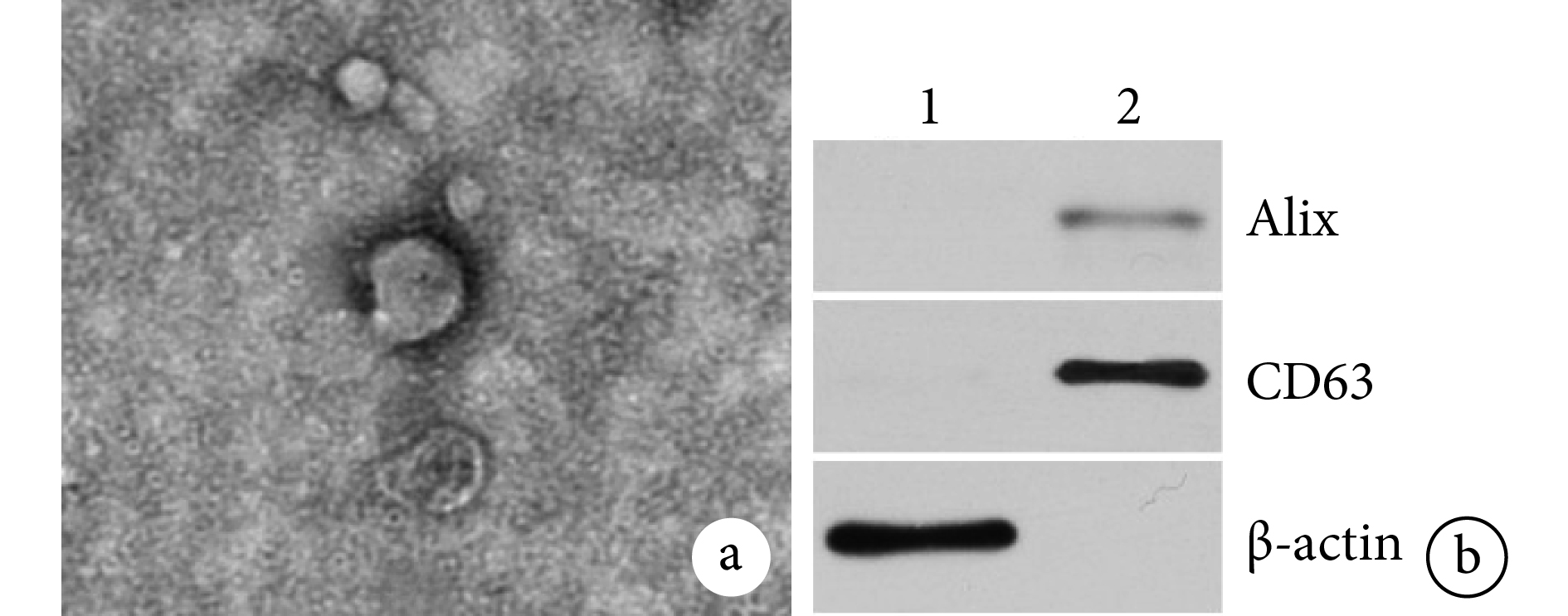 圖2
ADSC-Exos 鑒定觀察
圖2
ADSC-Exos 鑒定觀察
a. 透射電鏡觀察(×50 k);b. Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 1:ADSCs2:ADSC-Exos
Figure2. Identification and observation of ADSC-Exosa. Transmission electron microscopy observation (×50 k); b. The membrane-labeled proteins of ADSC-Exos were detected by Western blot 1: ADSCs 2: ADSC-Exos
2.2 ADSC-Exos 與成纖維細胞復合培養觀察
2.2.1 ADSC-Exos 被成纖維細胞攝取分析
共聚焦熒光顯微鏡下可見 ADSC-Exos 被成纖維細胞攝取并分布于細胞核周圍,表明 ADSC-Exos 可進入成纖維細胞內(圖 3a)。
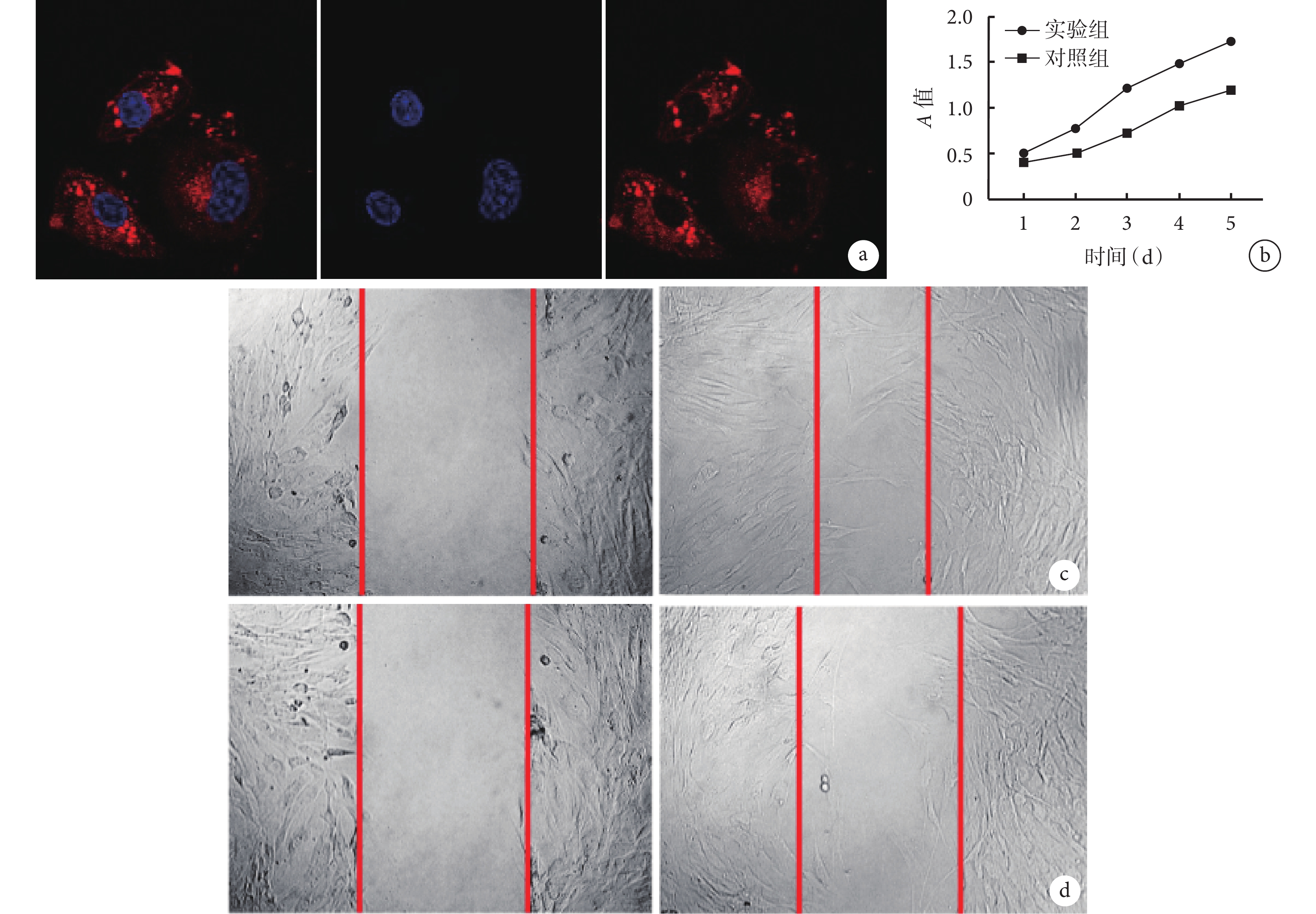 圖3
ADSC-Exos 與成纖維細胞復合培養觀察
圖3
ADSC-Exos 與成纖維細胞復合培養觀察
a. 共聚焦熒光顯微鏡觀察 ADSC-Exos 進入成纖維細胞情況(×630) 從左至右分別為 DAPI、PKH26 及二者重疊;b. 兩組 CCK-8 法檢測成纖維細胞體外增殖;c. 實驗組細胞遷移觀察 左側為 0 h、右側為 24 h;d. 對照組細胞遷移觀察 左側為 0 h、右側為 24 h
Figure3. Observation after ADSC-Exos and fibroblasts co-cultureda. Confocal fluorescence microscopy observation of ADSC-Exos into fibroblasts (×630) From left to right for DAPI, PKH26, and merge, respectively; b. Cell proliferation of the two groups by CCK-8; c. Cell migration observation of experimental group Left for 0 hour and right for 24 hours; d. Cell migration observation of control group Left for 0 hour and right for 24 hours
2.2.2 ADSC-Exos 對成纖維細胞增殖及遷移的影響
CCK-8 法檢測示,培養 1、2、3、4、5 d,實驗組 A 值均明顯高于對照組,差異有統計學意義(t=9.899,P=0.001;t=18.250,P=0.001;t=21.850,P=0.001;t=17.090,P=0.001;t=20.330,P=0.001)。見圖 3b。細胞劃痕遷移分析顯示,實驗組 24 h 遷移率為 80.0%±0.2%,明顯高于對照組的 40.0%±0.1%,差異有統計學意義(t=4.534,P=0.001)。見圖 3c、d。
2.3 動物實驗觀察
2.3.1 創面愈合觀測
大體觀察顯示,實驗組小鼠背部創面愈合明顯快于對照組;實驗組小鼠創面在第 21 天基本完全愈合,對照組仍有少量創面未愈合(圖 4a、b)。實驗組第 1、4、7、11、16、21 天創面愈合率分別為 2.068%±0.091%、15.283%±0.422%、37.453%±1.020%、61.240%±0.738%、80.285%±0.703%、98.033%±0.713%,對照組分別為 0.860%±0.147%、7.708%±0.323%、26.205%±0.955%、50.378%±0.484%、68.228%±0.878%、81.135%±0.795%,各時間點兩組間差異均有統計學意義(t=14.000,P=0.001;t=28.530,P=0.001;t=16.100,P=0.001;t=24.620,P=0.001;t=21.440,P=0.001;t=31.660,P=0.001)。
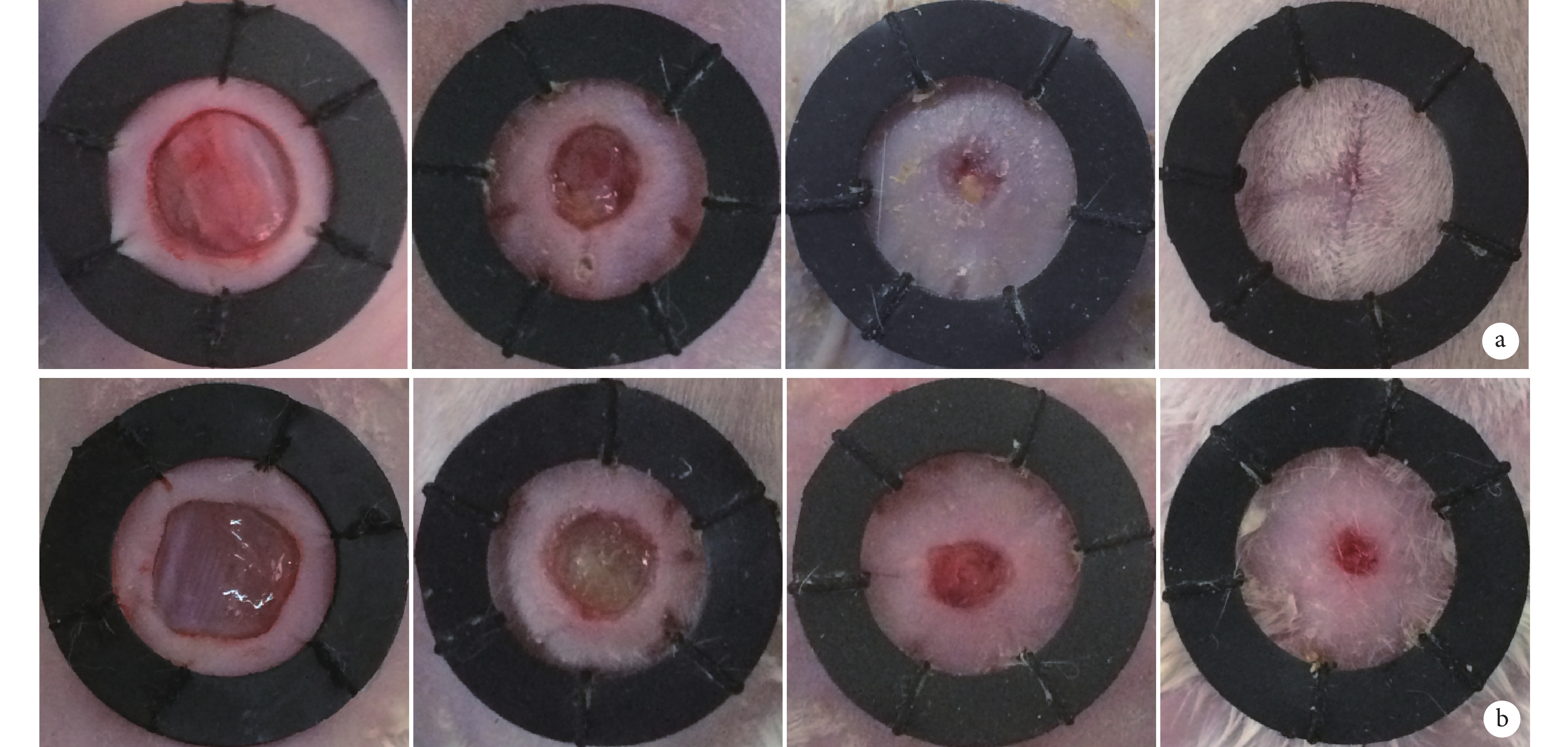 圖4
兩組創面愈合大體觀察
圖4
兩組創面愈合大體觀察
從左至右分別為第 1、7、16、21 天 a. 實驗組;b. 對照組
Figure4. Wound healing observation of two groupsFrom left to right for the 1st, 7th, 16th, and 21st days, respectively a. Experimental group; b. Control group
2.3.2 組織學觀察
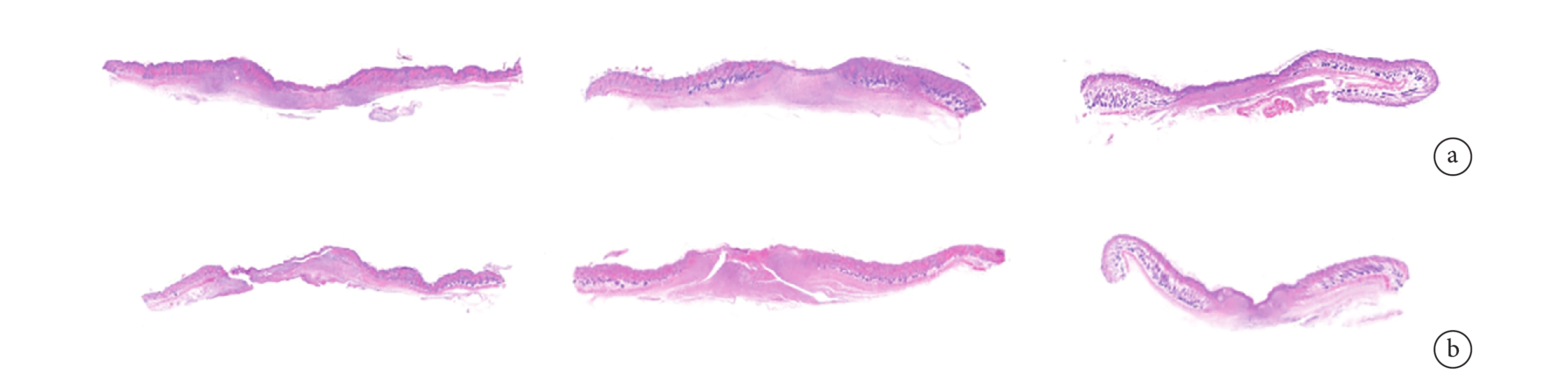
① HE 染色:各時間點實驗組創面新上皮長度比對照組短,第 21 天時實驗組創面缺損長度基本接近于 0,對照組仍有一定缺損。見圖 5。第 7、14、21 天實驗組創面缺損長度分別為(0.39±0.04)、(0.12±0.02)、(0.01±0.01)cm,對照組分別為(0.49±0.06)、(0.22±0.03)、(0.10±0.01)cm,差異均有統計學意義(t=2.774,P=0.032;t=5.547,P=0.001;t=12.730,P=0.001)。
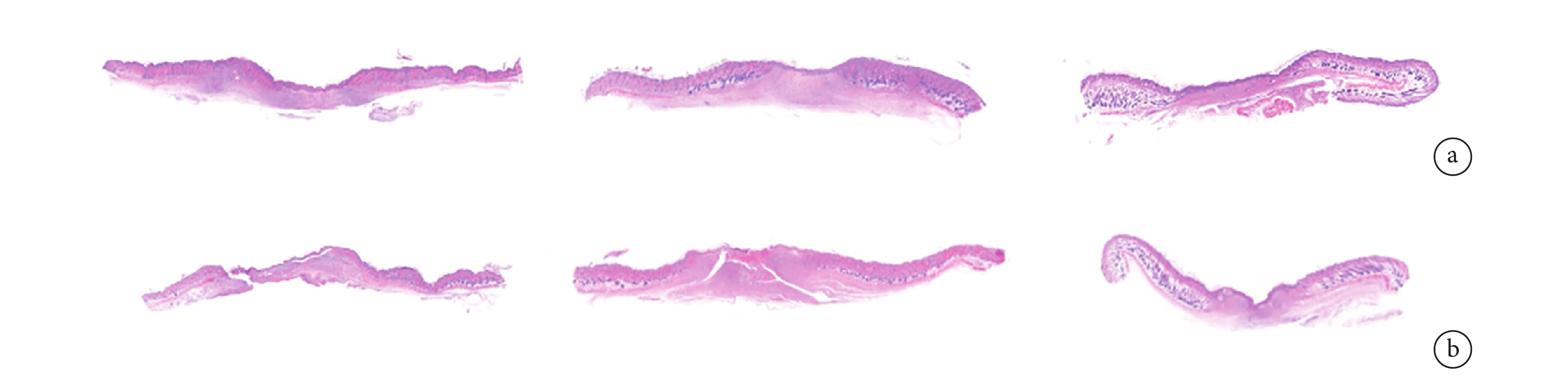 圖5
兩組各時間點 HE 染色觀察(×40)
圖5
兩組各時間點 HE 染色觀察(×40)
從左至右分別為第 7、14、21 天 a. 實驗組;b. 對照組
Figure5. HE staining of the two groups at each time point (×40)From left to right for the 7th, 14th, and 21st days, respectively a. Experimental group; b. Control group
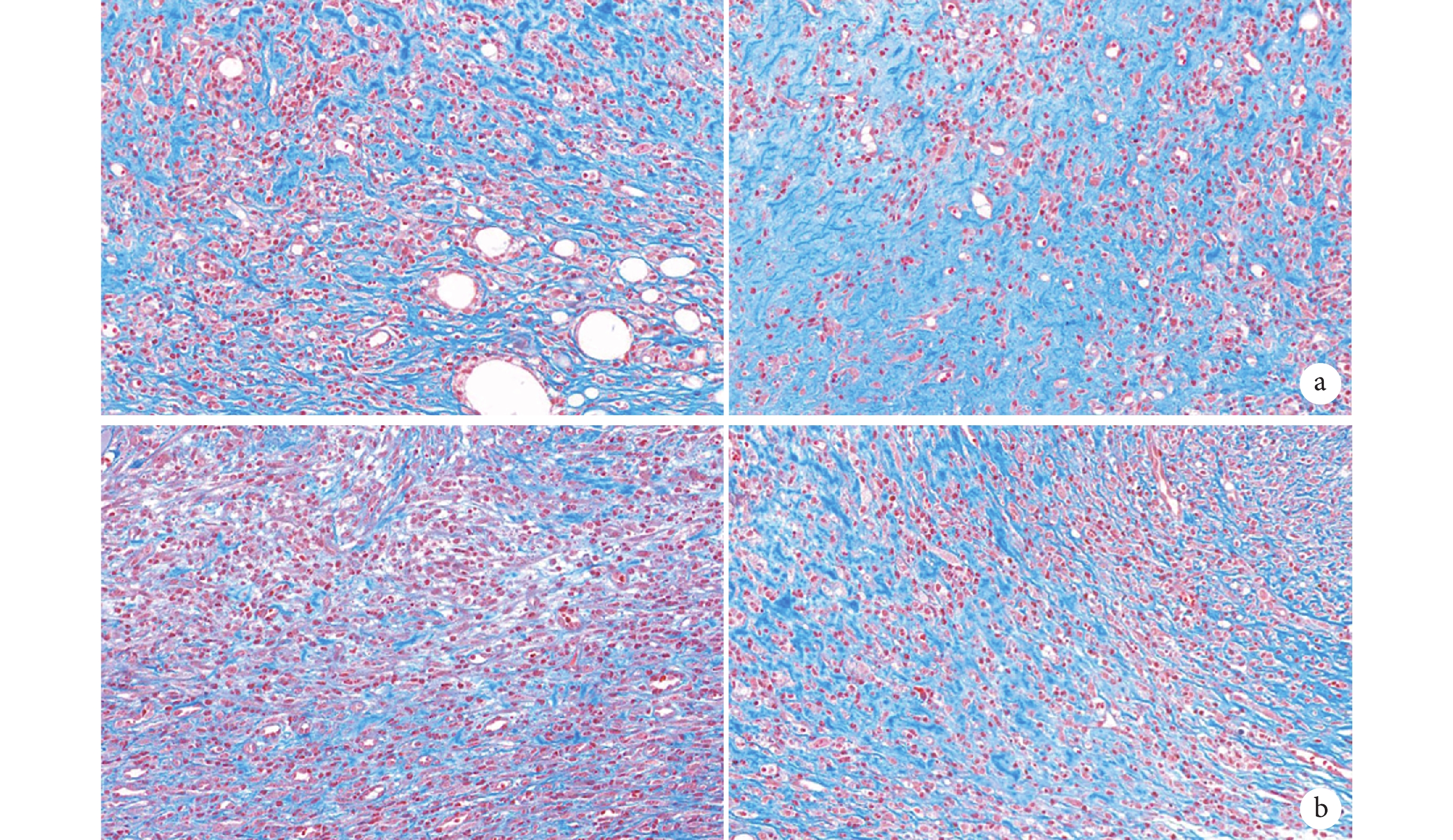
② Masson 染色:鏡下觀察創面床中膠原纖維廣泛沉積且排列整齊,各時間點實驗組膠原沉積和膠原纖維均多于對照組。見圖 6。第 14、21 天實驗組膠原纖維沉積百分比分別為 50.23%±1.03%、80.10%±2.05%,對照組分別為 30.50%±1.20%、51.51%±0.36%,差異均有統計學意義(t=24.950,P=0.001;t=28.430, P=0.001)。
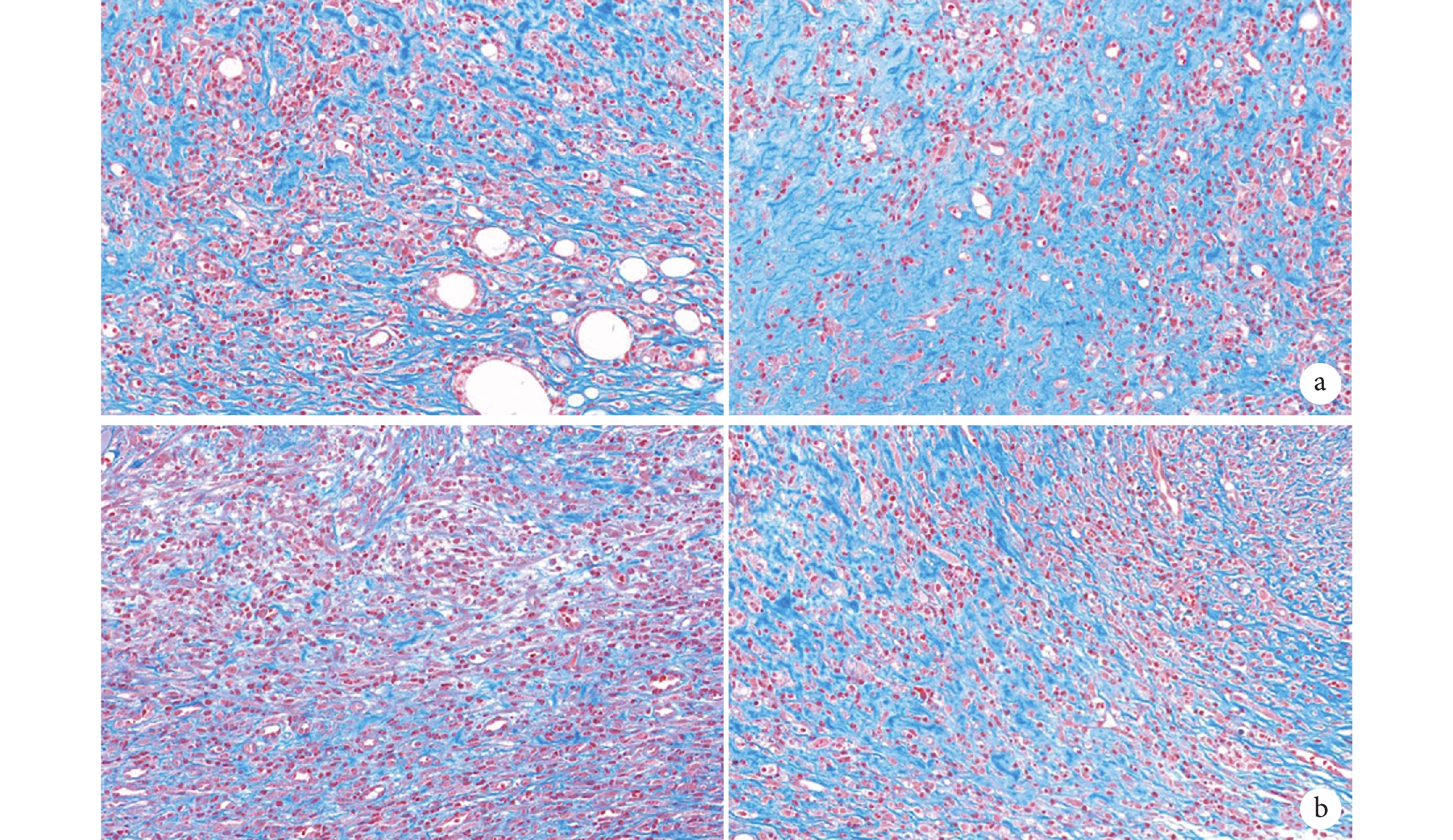 圖6
兩組各時間點 Masson 染色觀察(×400)
圖6
兩組各時間點 Masson 染色觀察(×400)
從左至右分別為第 14、21 天 a. 實驗組;b. 對照組
Figure6. Masson staining of the two groups at each time point (×400)From left to right for the 14th and 21st days, respectively a. Experimental group; b. Control group
2.3.3 CD31 免疫組織化學染色
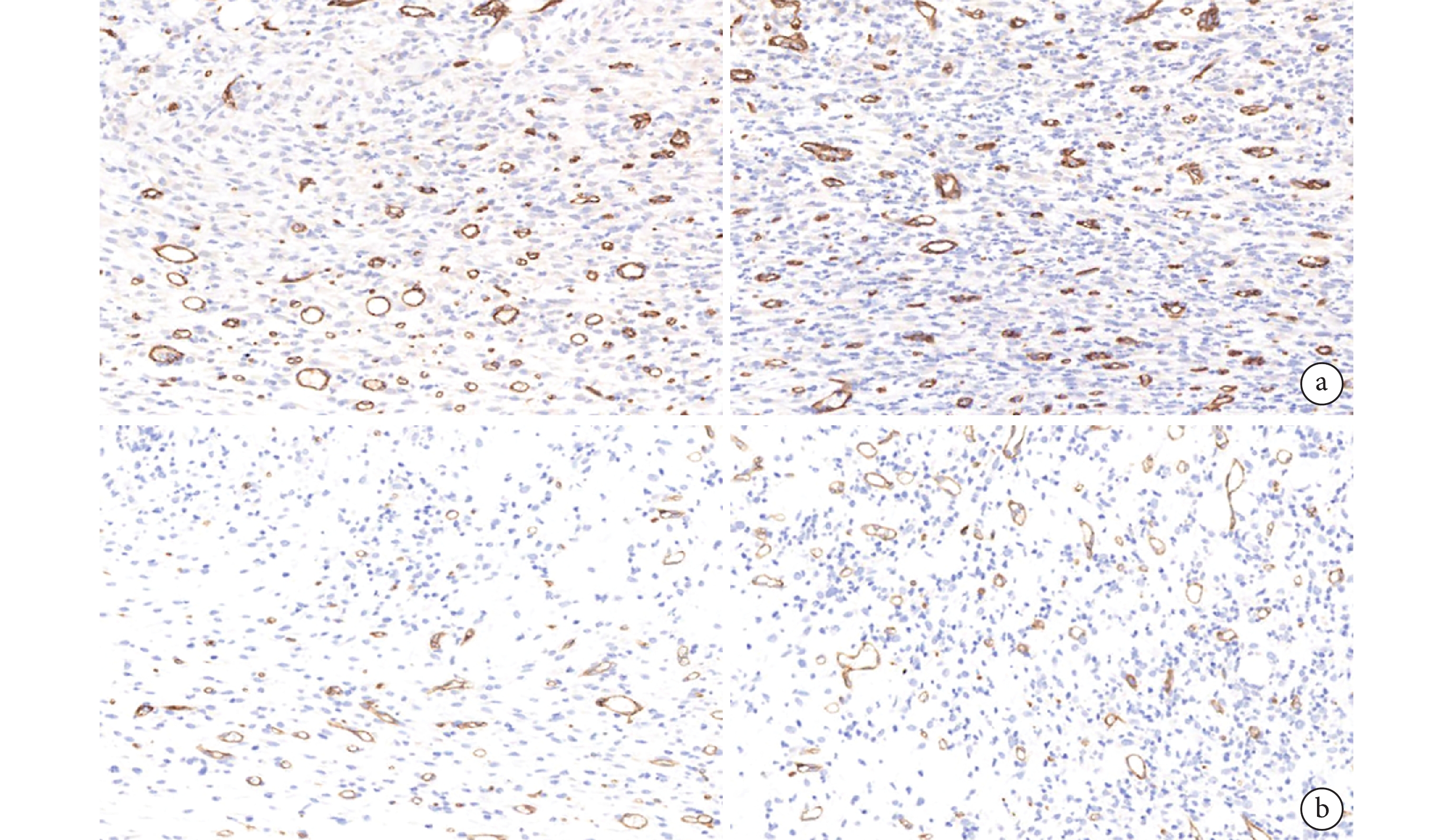
鏡下觀察示,第 7 天實驗組新生血管多于對照組,并且呈平行排列;第 14 天實驗組中觀察到更典型的圓形或橢圓形微血管,且數量多于對照組。見圖 7。
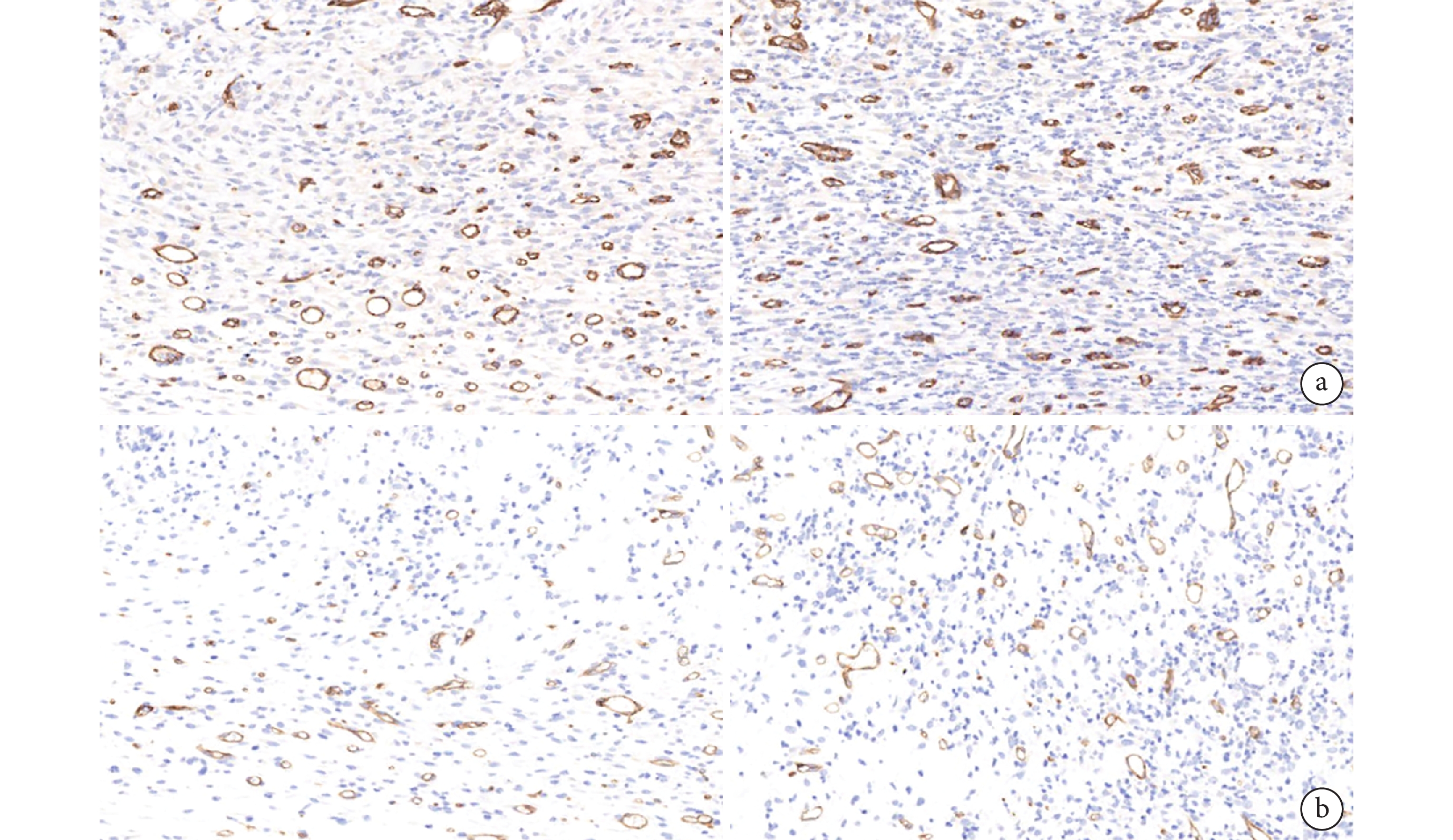 圖7
兩組各時間點 CD31 免疫組織化學染色觀察(×400)
圖7
兩組各時間點 CD31 免疫組織化學染色觀察(×400)
從左至右分別為第 7、14 天 a. 實驗組;b. 對照組
Figure7. CD31 immunohistochemical staining of the two groups at each time point (×400)From left to right for the 7th and 14th days, respectively a. Experimental group; b. Control group
定量分析顯示第 7、14 天實驗組微血管數量分別為(59.51±2.02)、(57.62±3.14)個/視野,明顯高于對照組的(21.32±1.23)、(36.65±2.34)個/視野,差異均有統計學意義(t=32.300,P=0.001;t=10.710, P=0.001)。
3 討論
慢性皮膚創面臨床常見,可由多種原因導致,如糖尿病、老化、應激等[13],其中成纖維細胞是慢性創面愈合的主要靶細胞和效應細胞[14]。干細胞治療已被證明在慢性創面愈合上發揮重要作用,其中治療效果比較好的干細胞為 ADSCs[15]。但是由于干細胞在體內易致瘤、易誘導畸形、栓塞等[16],其移植治療尚存在爭議,為此需要尋找一種風險較低的治療方法[17]。越來越多研究發現,ADSCs 能分泌許多蛋白質、細胞因子以及細胞外囊泡,這些細胞外囊泡具有與 ADSCs 相似的作用[18]。其中,人 ADSCs 能夠刺激皮膚成纖維細胞增殖和遷移,是由于其分泌的一種細胞外囊泡——Exos[19]。因此,我們推測 ADSC-Exos 能促進糖尿病創面的愈合。
血管新生是創面愈合和組織修復的關鍵步驟[14]。研究發現,人臍帶間充質干細胞來源 Exos 能促進內皮細胞增殖和遷移,從而促進血管生成,這可能是一個重要的皮膚傷口愈合機制[7]。本研究結果也提示 ADSC-Exos 能夠在創面愈合前中期促進糖尿病創面血管新生。結合本課題組前期研究發現的 ADSC-Exos 可以進入 HUVECs 細胞質,并促進 HUVECs 增殖、遷移及管樣分化[12],表明 ADSC-Exos 具有促進內皮細胞增殖、遷移和分化,從而促進創面血管新生的作用。
成纖維細胞增殖和遷移也是創面愈合的重要步驟[14]。近期研究發現,在糖尿病大鼠模型中,富血小板血漿來源 Exos 可促進成纖維細胞增殖、遷移以及創面皮膚再上皮化[20]。Geiger 等[21]研究發現人纖維細胞來源 Exos 含有多種生物活性的微小 RNA 和蛋白質,能加速成纖維細胞及上皮細胞增殖、遷移,促進創面愈合。本研究體外細胞實驗結果顯示,成纖維細胞能內化 ADSC-Exos,而且進入成纖維細胞內的 ADSC-Exos 能促進成纖維細胞增殖和遷移,但 ADSC-Exos 攜帶的何種信號分子在成纖維細胞內發揮作用有待深入研究。另外,動物實驗中實驗組創面愈合更快,說明與皮膚愈合密切相關的成纖維細胞在其中發揮重要作用,進一步驗證了體外細胞實驗中 ADSC-Exos 對成纖維細胞的作用。
在創面愈合后期,創面膠原沉積量對創面愈合質量有顯著影響。Zhao 等[22]報道在大鼠創面模型中,高濃度人羊膜上皮細胞來源 Exos 通過刺激基質金屬蛋白酶 1 的表達來調控細胞外基質沉積,從而促進創面愈合。本研究中,我們采用 Masson 染色觀察創面愈合后期膠原沉積量,發現 ADSC-Exos 能促進膠原沉積。但是有學者提出在創面愈合后期膠原過量沉積會導致瘢痕增生,從而不利于創面愈合[19]。因此 ADSC-Exos 促進膠原沉積能否促進創面愈合,還需要繼續探討。
綜上述,ADSC-Exos 可通過促進創面血管新生及優化成纖維細胞特性來促進糖尿病大鼠創面愈合。但 Exos 中的微小 RNA 及蛋白成分復雜[23],具體哪些微小 RNA 及蛋白能促進血管新生及優化成纖維細胞特性以及其具體機制,將在后續研究中進一步明確。
作者貢獻:王江文負責文章撰寫;朱元正負責數據收集整理及統計分析;張靜負責體外細胞實驗;胡玄負責動物飼養;聶佳瑩、王朝慧負責動物實驗;吳舒負責臨床標本收集;易陽艷負責科研設計。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經南昌大學第二附屬醫院醫學/動物實驗倫理委員會批準,批準號:研臨審[2018]第(023)號。實驗動物生產許可證號:SCXK(湘)2016-0002,實驗動物使用許可證號:SYXK(贛)2015-0001。
據世界衛生組織(WHO)統計,全球有近 4.22 億名糖尿病患者,預計 2035 年將增加到 5.92 億[1]。糖尿病創面愈合遲緩是糖尿病并發癥之一[2],雖然治療方法較多,但是效果不理想,探討新的促進糖尿病創面愈合方法成為研究熱點[3]。
外泌體(exosomes, Exos)是一種大小為 30~150 nm 的膜性囊泡[4],能參與細胞間通訊,并在組織修復和再生、疾病診斷方面發揮重要作用[5]。研究表明,人臍帶間充質干細胞來源的 Exos 可以促進相關細胞增殖及遷移、增強血管生成、再上皮化和調節免疫應答,進而促進皮膚再生以及糖尿病創面愈合[6-8]。脂肪干細胞(adipose-derived stem cells,ADSCs)也是一種 MSCs,因具有獲取方便、對供區損傷小、儲存量大等優勢,常用于組織再生和修復[9],ADSCs 移植后可促進血管新生[10]。最近,有研究證實了 ADSC-Exos 在創面愈合中的作用[11]。本課題組前期研究也發現 ADSC-Exos 能促進人臍靜脈血管內皮細胞(human umbilical vein endothelial cells,HUVECs) 增殖、遷移及管樣分化,植入裸鼠體內后還能促血管新生[12]。結合上述研究結果,我們分析 ADSC-Exos 可能促進糖尿病小鼠創面愈合,為此進行了進一步研究,為臨床應用 Exos 治療慢性糖尿病創面奠定實驗基礎。報告如下。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康 8 周齡 Balb/c 雄性小鼠 24 只,體質量(30±5)g,由南昌大學實驗動物中心提供。實驗用游離脂肪組織由南昌大學第二附屬醫院整形美容科行吸脂術的女性患者自愿捐贈,患者年齡 25~36 歲。實驗用皮膚組織由南昌大學第二附屬醫院整形美容科行上瞼下垂矯正術的女性患者自愿捐贈,患者年齡 24~30 歲。
DMEM 培養基、FBS、0.25% 胰蛋白酶-0.02%EDTA、分散酶 Ⅱ(GIBCO 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8;同仁公司,日本)。超高速離心機(Beckman 公司,美國);倒置相差顯微鏡(Olympus 公司,日本);流式細胞儀(BD 公司,美國);透射電鏡(ZEISS 公司,德國);納米顆粒跟蹤分析儀(Malvern 公司,英國);CO2 培養箱、多功能酶標儀(Thermo 公司,美國);共聚焦熒光顯微鏡(Leica 公司,德國)。
1.2 ADSCs 分離培養及鑒定
取 12 mL 脂肪組織,PBS 液反復沖洗,用 12 mL 0.2%Ⅰ 型膠原酶消化至糊狀;4℃、以 300×g 離心 5 min,棄上清;用培養基將沉淀重懸后接種至培養瓶內,置于 37℃、5%CO2 孵箱中培養。2 d 后首次換液,以后隔天換液 1 次,當細胞融合至 80% 時傳代。
取第 3 代細胞于倒置相差顯微鏡下觀察,細胞呈均一長梭形,細胞生長密集后呈漩渦狀排列。流式細胞術鑒定細胞表面標志性抗原,CD49d、CD90、CD105 呈陽性表達,CD34、CD45、CD106 呈陰性表達。上述結果提示培養細胞為 ADSCs。
1.3 ADSC-Exos 分離培養及鑒定
取第 3 代 ADSCs,更換為去除 Exos 的完全培養基培養,48 h 后收集上清培養液,參照本課題組前期研究采用的密度梯度離心法分離 ADSC-Exos[12]。具體步驟:4℃、以 300×g 離心 10 min,取上清;3 000×g 離心 20 min,取上清;10 000×g 離心 30 min,取上清;10 000×g 離心 60 min,PBS 重懸收集沉淀;100 000×g 離心 60 min,PBS 重懸收集沉淀,用 0.22 μm 濾頭過濾后獲得 ADSC-Exos,置于–80℃ 保存備用。
采用透射電鏡觀察 ADSC-Exos 形態;Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 Alix、CD63;納米顆粒跟蹤分析儀檢測 ADSC-Exos 粒徑分布。
1.4 成纖維細胞分離培養
將皮膚組織置于含 1% 抗生素的無菌 PBS 中洗滌,修剪脂肪和皮下組織后切成片,置于 4 mg/mL 分散酶 Ⅱ 過夜以分離表皮和真皮。將真皮切成小塊,置于 0.1%Ⅰ型膠原酶、37℃ 消化 4 h,以分離成纖維細胞,經過濾、300×g 離心 10 min 及重懸后,置于 DMEM 培養基中,于 37℃、5%CO2 培養箱中培養,每 2~3 天更換培養基,傳代培養。
1.5 ADSC-Exos 與成纖維細胞復合培養觀察
1.5.1 ADSC-Exos 被成纖維細胞攝取分析
取 100 μL 濃度為 100 μg/mL 的 ADSC-Exos 重懸于 1 mL PBS,加入 4 μL PKH26 熒光染料溶液,37℃ 孵育 20 min,以 100 000×g 離心 70 min,棄上清液,將 ADSC-Exos 重懸于 10 mL PBS 中;4℃、以 100 000×g 離心 70 min,去除多余染料,棄上清;將 ADSC-Exos 重懸于 100 μL PBS 中備用。
取第 5 代成纖維細胞重懸于無血清培養基中,置于 37℃、5%CO2 培養箱中,待細胞貼壁后加入上述 PKH26 熒光標記的 ADSC-Exos,孵育 12 h 后采用 PBS 洗滌細胞 2 次,4% 多聚甲醛固定、DAPI 染色。共聚焦熒光顯微鏡下觀察 PKH26 熒光標記的 ADSC-Exos(呈紅色)是否進入成纖維細胞。
1.5.2 ADSC-Exos 對成纖維細胞增殖及遷移影響
① 采用 CCK-8 法檢測 ADSC-Exos 對成纖維細胞增殖的影響。將第 3 代成纖維細胞以 2×103個/孔接種于 96 孔板,每孔加入無血清培養基 90 μL。將細胞均分成實驗組和對照組,實驗組添加 10 μL 濃度為 100 ng/mL 的 ADSC-Exos,對照組加入等量 PBS;培養 1、2、3、4、5 d 每組取 5 孔,每孔加入 10 μL CCK-8 溶液,繼續孵育 4 h 后,采用多功能酶標儀檢測 450 nm 波長下吸光度(A)值。實驗重復 5 次。
② 采用劃痕法檢測 ADSC-Exos 對成纖維細胞遷移的影響。取第 3 代成纖維細胞以 7×104個/孔接種于 6 孔板中,每孔加入一定量培養基培養,待細胞匯集達 95% 以上時,棄去培養基,以無血清培養基饑餓培養 12~16 h 后,以絲裂霉素 C 處理 30 min,PBS 洗滌 2 次。采用 10 μL 移液器吸頭直尺比照劃痕,PBS 洗滌脫落細胞,10 倍鏡下拍照;再將細胞分成對照組和實驗組,實驗組加入 0.5 mL 濃度為 100 ng/mL 的 ADSC-Exos,對照組加入等量 PBS,用無血清培養基培養 24 h 后拍照。采用 Photoshop CS6 軟件測量細胞遷移距離,按照以下公式計算 24 h 遷移率:(0 h 劃痕寬度-24 h 劃痕寬度)/0 h 劃痕寬度×100%。實驗重復 3 次。
1.6 動物實驗觀察
1.6.1 糖尿病小鼠創面模型制備及分組
24 只小鼠于 12 h 光照/黑暗循環、室溫 25℃ 條件下飼養。為了誘導糖尿病,在飲食調節 1 周后,給予高蔗糖和高脂肪飲食 10 周,然后在第 10、11 周時腹膜內注射鏈脲佐菌素(65 mg/kg)。每周監測小鼠空腹血糖和體質量水平,隨機血糖>16.7 mmol/L 定義為糖尿病小鼠誘導成功。本實驗 24 只小鼠均造模成功。
將 24 只糖尿病小鼠隨機分成實驗組及對照組,每組 12 只。兩組小鼠腹腔注射 10% 水合氯醛(0.04 mL/10 g)麻醉后背部剃毛,采用定制的直徑 8 mm 空心柱狀旋轉鐵片制備圓形全層皮膚創面;然后用內徑 12 mm 環狀塑料環固定創面,5-0 不可吸收絲線間斷縫合,使創面在塑料環內環正中央。創面制備后,實驗組將 0.2 mL ADSC-Exos 溶液于 6 個方向均勻注射于創面邊緣真皮層;對照組同法注射等量 PBS。凡士林紗布覆蓋創面,醫用紗布纏繞傷口處固定。見圖 1。
 圖1
糖尿病小鼠創面模型制備示意圖
圖1
糖尿病小鼠創面模型制備示意圖
a. 背部創面;b. 塑料環固定創面;c. 注射層次示意圖
Figure1. Schematic diagram of preparation of wound model of diabetic micea. The wound at the back; b. The wound was fixed with plastic ring; c. Injection level diagram
1.6.2 觀測指標
① 創面愈合觀測:第 1、4、7、11、16、21 天大體觀察創面愈合情況,創面照相后以 Image J 軟件測量其面積,按以下公式計算創面愈合率:(初始創面面積?單位時間點創面面積)/初始創面面積×100%。
② 組織學及免疫組織化學染色觀察:第 7、14、21 天每組各取 4 只小鼠,頸椎脫臼處死后切取創面組織,經 4% 多聚甲醛固定、乙醇梯度脫水、石蠟包埋,制備 4 μm 厚切片。取第 7、14、21 天切片行 HE 染色,第 14、21 天切片行 Masson 染色。于 HE 染色圖片測量創面缺損長度;Masson 染色切片觀察膠原纖維情況,400 倍鏡下每張切片隨機取 6 個視野,采用 Image Pro Plus 6.0 軟件測定膠原纖維沉積百分比。
取第 7、14 天切片行 CD31 免疫組織化學染色,DAPI 復染,鏡下觀察兩組創面血管新生情況,CD31 陽性染色呈棕色。400 倍鏡下每張切片隨機取 6 個視野,計數每個視野中微血管數,取均值。
1.7 統計學方法
采用 Graphpad Prism 8 統計軟件進行分析。數據以均數±標準差表示,組間比較采用獨立樣本 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 ADSC-Exos 鑒定
透射電鏡下 ADSC-Exos 為邊緣清晰、圓形、大小分布均勻的膜性囊泡(圖 2a)。納米顆粒跟蹤分析儀檢測 ADSC-Exos 粒徑為 40~200 nm,平均 102.1 nm。Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 Alix、CD63 表達均呈陽性(圖 2b)。
 圖2
ADSC-Exos 鑒定觀察
圖2
ADSC-Exos 鑒定觀察
a. 透射電鏡觀察(×50 k);b. Western blot 檢測 ADSC-Exos 膜表面標志性蛋白 1:ADSCs2:ADSC-Exos
Figure2. Identification and observation of ADSC-Exosa. Transmission electron microscopy observation (×50 k); b. The membrane-labeled proteins of ADSC-Exos were detected by Western blot 1: ADSCs 2: ADSC-Exos
2.2 ADSC-Exos 與成纖維細胞復合培養觀察
2.2.1 ADSC-Exos 被成纖維細胞攝取分析
共聚焦熒光顯微鏡下可見 ADSC-Exos 被成纖維細胞攝取并分布于細胞核周圍,表明 ADSC-Exos 可進入成纖維細胞內(圖 3a)。
 圖3
ADSC-Exos 與成纖維細胞復合培養觀察
圖3
ADSC-Exos 與成纖維細胞復合培養觀察
a. 共聚焦熒光顯微鏡觀察 ADSC-Exos 進入成纖維細胞情況(×630) 從左至右分別為 DAPI、PKH26 及二者重疊;b. 兩組 CCK-8 法檢測成纖維細胞體外增殖;c. 實驗組細胞遷移觀察 左側為 0 h、右側為 24 h;d. 對照組細胞遷移觀察 左側為 0 h、右側為 24 h
Figure3. Observation after ADSC-Exos and fibroblasts co-cultureda. Confocal fluorescence microscopy observation of ADSC-Exos into fibroblasts (×630) From left to right for DAPI, PKH26, and merge, respectively; b. Cell proliferation of the two groups by CCK-8; c. Cell migration observation of experimental group Left for 0 hour and right for 24 hours; d. Cell migration observation of control group Left for 0 hour and right for 24 hours
2.2.2 ADSC-Exos 對成纖維細胞增殖及遷移的影響
CCK-8 法檢測示,培養 1、2、3、4、5 d,實驗組 A 值均明顯高于對照組,差異有統計學意義(t=9.899,P=0.001;t=18.250,P=0.001;t=21.850,P=0.001;t=17.090,P=0.001;t=20.330,P=0.001)。見圖 3b。細胞劃痕遷移分析顯示,實驗組 24 h 遷移率為 80.0%±0.2%,明顯高于對照組的 40.0%±0.1%,差異有統計學意義(t=4.534,P=0.001)。見圖 3c、d。
2.3 動物實驗觀察
2.3.1 創面愈合觀測
大體觀察顯示,實驗組小鼠背部創面愈合明顯快于對照組;實驗組小鼠創面在第 21 天基本完全愈合,對照組仍有少量創面未愈合(圖 4a、b)。實驗組第 1、4、7、11、16、21 天創面愈合率分別為 2.068%±0.091%、15.283%±0.422%、37.453%±1.020%、61.240%±0.738%、80.285%±0.703%、98.033%±0.713%,對照組分別為 0.860%±0.147%、7.708%±0.323%、26.205%±0.955%、50.378%±0.484%、68.228%±0.878%、81.135%±0.795%,各時間點兩組間差異均有統計學意義(t=14.000,P=0.001;t=28.530,P=0.001;t=16.100,P=0.001;t=24.620,P=0.001;t=21.440,P=0.001;t=31.660,P=0.001)。
 圖4
兩組創面愈合大體觀察
圖4
兩組創面愈合大體觀察
從左至右分別為第 1、7、16、21 天 a. 實驗組;b. 對照組
Figure4. Wound healing observation of two groupsFrom left to right for the 1st, 7th, 16th, and 21st days, respectively a. Experimental group; b. Control group
2.3.2 組織學觀察
① HE 染色:各時間點實驗組創面新上皮長度比對照組短,第 21 天時實驗組創面缺損長度基本接近于 0,對照組仍有一定缺損。見圖 5。第 7、14、21 天實驗組創面缺損長度分別為(0.39±0.04)、(0.12±0.02)、(0.01±0.01)cm,對照組分別為(0.49±0.06)、(0.22±0.03)、(0.10±0.01)cm,差異均有統計學意義(t=2.774,P=0.032;t=5.547,P=0.001;t=12.730,P=0.001)。
 圖5
兩組各時間點 HE 染色觀察(×40)
圖5
兩組各時間點 HE 染色觀察(×40)
從左至右分別為第 7、14、21 天 a. 實驗組;b. 對照組
Figure5. HE staining of the two groups at each time point (×40)From left to right for the 7th, 14th, and 21st days, respectively a. Experimental group; b. Control group
② Masson 染色:鏡下觀察創面床中膠原纖維廣泛沉積且排列整齊,各時間點實驗組膠原沉積和膠原纖維均多于對照組。見圖 6。第 14、21 天實驗組膠原纖維沉積百分比分別為 50.23%±1.03%、80.10%±2.05%,對照組分別為 30.50%±1.20%、51.51%±0.36%,差異均有統計學意義(t=24.950,P=0.001;t=28.430, P=0.001)。
 圖6
兩組各時間點 Masson 染色觀察(×400)
圖6
兩組各時間點 Masson 染色觀察(×400)
從左至右分別為第 14、21 天 a. 實驗組;b. 對照組
Figure6. Masson staining of the two groups at each time point (×400)From left to right for the 14th and 21st days, respectively a. Experimental group; b. Control group
2.3.3 CD31 免疫組織化學染色
鏡下觀察示,第 7 天實驗組新生血管多于對照組,并且呈平行排列;第 14 天實驗組中觀察到更典型的圓形或橢圓形微血管,且數量多于對照組。見圖 7。
 圖7
兩組各時間點 CD31 免疫組織化學染色觀察(×400)
圖7
兩組各時間點 CD31 免疫組織化學染色觀察(×400)
從左至右分別為第 7、14 天 a. 實驗組;b. 對照組
Figure7. CD31 immunohistochemical staining of the two groups at each time point (×400)From left to right for the 7th and 14th days, respectively a. Experimental group; b. Control group
定量分析顯示第 7、14 天實驗組微血管數量分別為(59.51±2.02)、(57.62±3.14)個/視野,明顯高于對照組的(21.32±1.23)、(36.65±2.34)個/視野,差異均有統計學意義(t=32.300,P=0.001;t=10.710, P=0.001)。
3 討論
慢性皮膚創面臨床常見,可由多種原因導致,如糖尿病、老化、應激等[13],其中成纖維細胞是慢性創面愈合的主要靶細胞和效應細胞[14]。干細胞治療已被證明在慢性創面愈合上發揮重要作用,其中治療效果比較好的干細胞為 ADSCs[15]。但是由于干細胞在體內易致瘤、易誘導畸形、栓塞等[16],其移植治療尚存在爭議,為此需要尋找一種風險較低的治療方法[17]。越來越多研究發現,ADSCs 能分泌許多蛋白質、細胞因子以及細胞外囊泡,這些細胞外囊泡具有與 ADSCs 相似的作用[18]。其中,人 ADSCs 能夠刺激皮膚成纖維細胞增殖和遷移,是由于其分泌的一種細胞外囊泡——Exos[19]。因此,我們推測 ADSC-Exos 能促進糖尿病創面的愈合。
血管新生是創面愈合和組織修復的關鍵步驟[14]。研究發現,人臍帶間充質干細胞來源 Exos 能促進內皮細胞增殖和遷移,從而促進血管生成,這可能是一個重要的皮膚傷口愈合機制[7]。本研究結果也提示 ADSC-Exos 能夠在創面愈合前中期促進糖尿病創面血管新生。結合本課題組前期研究發現的 ADSC-Exos 可以進入 HUVECs 細胞質,并促進 HUVECs 增殖、遷移及管樣分化[12],表明 ADSC-Exos 具有促進內皮細胞增殖、遷移和分化,從而促進創面血管新生的作用。
成纖維細胞增殖和遷移也是創面愈合的重要步驟[14]。近期研究發現,在糖尿病大鼠模型中,富血小板血漿來源 Exos 可促進成纖維細胞增殖、遷移以及創面皮膚再上皮化[20]。Geiger 等[21]研究發現人纖維細胞來源 Exos 含有多種生物活性的微小 RNA 和蛋白質,能加速成纖維細胞及上皮細胞增殖、遷移,促進創面愈合。本研究體外細胞實驗結果顯示,成纖維細胞能內化 ADSC-Exos,而且進入成纖維細胞內的 ADSC-Exos 能促進成纖維細胞增殖和遷移,但 ADSC-Exos 攜帶的何種信號分子在成纖維細胞內發揮作用有待深入研究。另外,動物實驗中實驗組創面愈合更快,說明與皮膚愈合密切相關的成纖維細胞在其中發揮重要作用,進一步驗證了體外細胞實驗中 ADSC-Exos 對成纖維細胞的作用。
在創面愈合后期,創面膠原沉積量對創面愈合質量有顯著影響。Zhao 等[22]報道在大鼠創面模型中,高濃度人羊膜上皮細胞來源 Exos 通過刺激基質金屬蛋白酶 1 的表達來調控細胞外基質沉積,從而促進創面愈合。本研究中,我們采用 Masson 染色觀察創面愈合后期膠原沉積量,發現 ADSC-Exos 能促進膠原沉積。但是有學者提出在創面愈合后期膠原過量沉積會導致瘢痕增生,從而不利于創面愈合[19]。因此 ADSC-Exos 促進膠原沉積能否促進創面愈合,還需要繼續探討。
綜上述,ADSC-Exos 可通過促進創面血管新生及優化成纖維細胞特性來促進糖尿病大鼠創面愈合。但 Exos 中的微小 RNA 及蛋白成分復雜[23],具體哪些微小 RNA 及蛋白能促進血管新生及優化成纖維細胞特性以及其具體機制,將在后續研究中進一步明確。
作者貢獻:王江文負責文章撰寫;朱元正負責數據收集整理及統計分析;張靜負責體外細胞實驗;胡玄負責動物飼養;聶佳瑩、王朝慧負責動物實驗;吳舒負責臨床標本收集;易陽艷負責科研設計。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經南昌大學第二附屬醫院醫學/動物實驗倫理委員會批準,批準號:研臨審[2018]第(023)號。實驗動物生產許可證號:SCXK(湘)2016-0002,實驗動物使用許可證號:SYXK(贛)2015-0001。