引用本文: 李俊男, 陳嘉勇, 陳仲, 楊洪昌, 侯開宇. 妊娠大鼠來源脂肪干細胞在急性肝損傷中的修復作用. 中國修復重建外科雜志, 2017, 31(3): 357-362. doi: 10.7507/1002-1892.201610076 復制
脂肪干細胞(adipose-derived stem cells,ADSCs)來源于中胚層,具有多向分化潛能,可分化為脂肪、肌肉、軟骨等,甚至能在一定條件下分化為內胚層來源的肝實質細胞、外胚層來源的神經細胞等[1]。較強的可塑性和取材便利性使得 ADSCs 迅速成為組織工程學研究熱點。動物體內研究發現,ADSCs 能修復骨骼、心臟、腎臟和肝臟等組織[2-4]。目前,越來越多研究證實 MSCs 能在損傷微環境中分化為多種特定細胞類型,參與不同組織的修復[5],同時外源性刺激能夠增強其修復能力[6-8]。本課題組在前期研究中發現,妊娠大鼠來源 ADSCs 較正常大鼠來源 ADSCs 具有更強的增殖能力;在相同誘導條件下,前者分化為類肝細胞的時間較后者更短,類肝細胞功能更強。本次研究通過觀察妊娠大鼠來源 ADSCs 修復大鼠損傷肝組織作用,進一步驗證其修復效果是否優于正常大鼠來源 ADSCs,以期為提高 ADSCs 移植治療肝損傷效率提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
18 周齡 SPF 級 SD 大鼠 29 只,其中雌性 26 只、雄性 3 只,體質量約 250 g,由昆明醫科大學實驗動物科提供。正常大鼠來源 ADSCs 購自廣州賽業生物科技有限公司。
DMEM 培養基、0.25% 胰蛋白酶、Ⅰ型膠原酶(HyClone 公司,美國);FBS(GIBCO 公司,美國);CCl4(Sigma 公司,美國);10% 中性甲醛、二甲苯、蘇木素染液、鹽酸酒精、伊紅、枸緣酸鈉溶液、免疫組織化學檢測試劑盒(福州邁新生物技術開發有限公司);兔抗甲胎蛋白(alpha-fetoprotein, AFP)多克隆抗體、兔抗白蛋白(albumin,ALB)多克隆抗體、兔抗細胞增殖核抗原 Ki67 多克隆抗體(Santa Cruz公司,美國)。自動生化分析儀(貝克曼公司,美國);DMI6000B 倒置熒光顯微鏡(Leica 公司,德國)。
1.2 妊娠大鼠來源 ADSCs 分離培養及鑒定
取 SD 大鼠 9 只(雌性 6 只、雄性 3 只)按雌雄比例 2∶1 進行合籠過夜,第 2 天觀察見雌鼠陰道栓即選為實驗用妊娠大鼠。懷孕 7 d 后取材并分離培養 ADSCs。
具體步驟:頸椎脫臼法處死 SD 大鼠,無菌條件下解剖腹腔,取出約 5 mL 大網膜脂肪組織,置于 90 cm 培養皿中,PBS 反復沖洗去除肉眼可見的非脂肪組織。組織剪剪碎至 1 mm3 大小后,置于Ⅰ型膠原酶 37℃ 消化 1 h;隨后 200 目濾網濾棄未消化的組織。將過濾后的細胞懸液以離心半徑 10 cm、1 500 r/min 離心 10 min,收集濾液,加入含 10% FBS 的 L-DMEM 培養液進行細胞重懸,進行原代細胞培養。24 h 后更換培養基,去除未貼壁細胞,待細胞融合達 80%~90% 后進行消化傳代。倒置相差顯微鏡下觀察細胞貼壁及死亡情況,并取第 3 代細胞用流式細胞術進行干細胞表面標志物(CD44、CD45、CD90)鑒定。
1.3 實驗分組及方法
取 SD 大鼠 20 只隨機分為 A、B、C、D 4 組,每組 5 只。A 組大鼠不作處理,作為正常對照;B~D 組大鼠腹腔注射(7 mL/kg)CCl4(CCl4 以 10% 比例溶于橄欖油中)制備急性肝損傷模型,每 24 小時注射 1 次,連續 2 次。造模后 2 h,A 組于大鼠脾臟注射 0.1 mL DPBS;B 組不注射任何試劑;C、D 組分別于大鼠脾臟注射 0.1 mL 正常大鼠來源 ADSCs(2×106 個/mL)和妊娠大鼠來源 ADSCs(2×106 個/mL)。
1.4 觀測指標
1.4.1 血清指標比較 注射后 7 d,采用頸椎脫臼法處死各組大鼠,摘取眼球后抽血 3 mL,以離心半徑 10 cm、3 000 r/min 離心 15 min 分離血清,自動生化分析儀檢測血清中總膽紅素(total bilirubin,TBIL)、丙氨酸氨基轉移酶(alanine aminotrans-ferase,ALT)、天門冬氨酸氨基轉移酶(aspartic acid transaminase,AST)、白蛋白(albumin,ALB)和肝功能總蛋白(total protein,TP)含量。
1.4.2 組織學觀察 注射后 7 d,取各組大鼠肝臟,置于 4% 多聚甲醛固定 3 d 后行石蠟包埋,切片,片厚 5 μm。取部分切片行HE染色,倒置相差顯微鏡下觀察肝組織損傷情況。
1.4.3 免疫組織化學染色觀察 取上述部分切片,按試劑盒說明進行免疫組織化學染色,檢測細胞增殖和肝細胞標志物表達。Ki67、AFP 和 ALB 抗體稀釋比例均為 1∶100,采用 DAB 法進行顯色,顯色后自來水沖洗 3 min,蘇木素復染,中性樹膠封片,倒置相差顯微鏡下觀察。隨機選取 5 個視野,以細胞質或細胞核出現棕黃色顆粒記為陽性細胞,記數陽性細胞,并計算陽性細胞率,公式為:陽性細胞數/總細胞數×100%。
1.5 統計學方法
采用 GraphPrism 6.0 軟件進行分析。數據以均數±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;兩組間比較采用獨立樣本t 檢驗;檢驗水準α=0.05。
2 結果
2.1 ADSCs 形態學觀察及鑒定
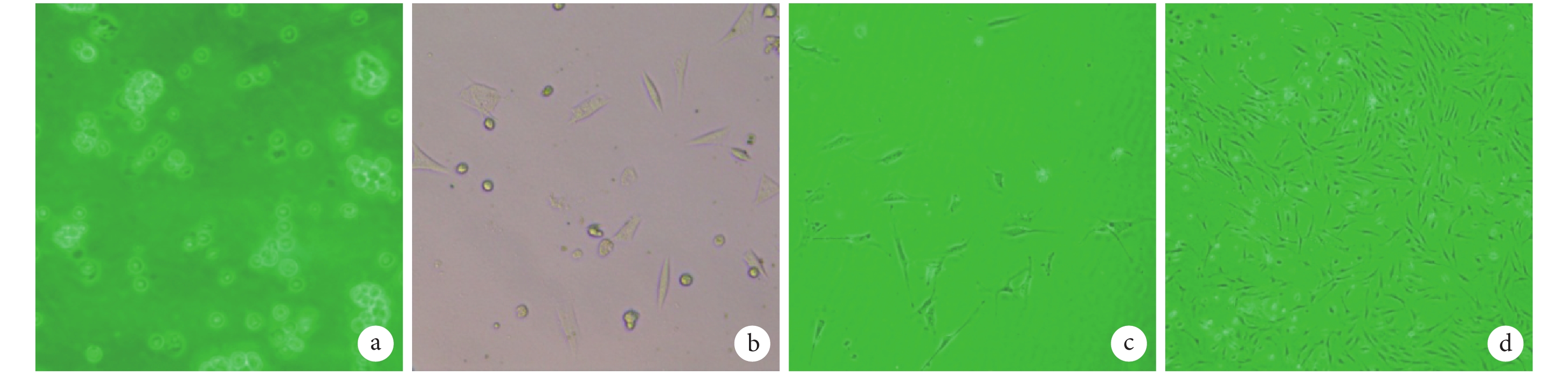
原代 ADSCs 呈圓形,30~60 min 內開始貼壁,24 h 后基本完成貼壁,此時可見部分貼壁細胞細胞質變長,開始伸出偽足。傳代后細胞形態伸展為三角形、多角形,最終逐漸變為典型的短梭形。見圖 1。流式細胞術結果顯示,培養的細胞 CD44 和 CD90 為陽性表達,CD45 為陰性表達,符合干細胞表面分子標志物特性。
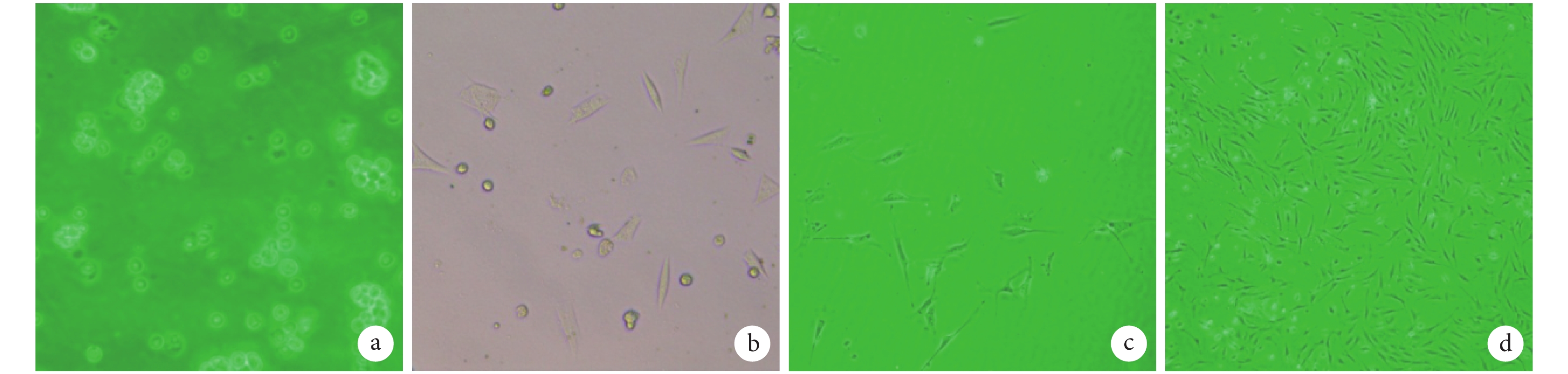 圖1
妊娠大鼠來源 ADSCs 形態學觀察(倒置相差顯微鏡×100) a. 原代接種細胞;b. 原代細胞培養24 h;c. 第1代細胞;d. 第3代細胞
Figure1.
Morphological observation of ADSCs isolated from pregnant Sprague Dawley rat (Inverted phase contrast microscope×100) a. Primary cells; b. Primary cells cultured for 24 hours; c. ADSCs at passage 1; d. ADSCs at passage 3
圖1
妊娠大鼠來源 ADSCs 形態學觀察(倒置相差顯微鏡×100) a. 原代接種細胞;b. 原代細胞培養24 h;c. 第1代細胞;d. 第3代細胞
Figure1.
Morphological observation of ADSCs isolated from pregnant Sprague Dawley rat (Inverted phase contrast microscope×100) a. Primary cells; b. Primary cells cultured for 24 hours; c. ADSCs at passage 1; d. ADSCs at passage 3
2.2 血清指標比較
注射后 7 d,B 組血清中 TBIL、ALT、AST 含量顯著高于 A、C、D 組,ALB、TP 含量顯著低于 A、C、D 組,差異均有統計學意義(P<0.05)。C、D 組血清中 TBIL、ALT、AST 含量顯著高于 A 組,C 組高于 D 組,差異均有統計學意義(P<0.05);A、C、D 組血清中 ALB 含量比較差異無統計學意義(P>0.05);C、D 組血清中 TP 含量顯著低于 A 組(P<0.05),C、D 組間比較差異無統計學意義(P>0.05)。見表 1。
2.3 組織學觀察
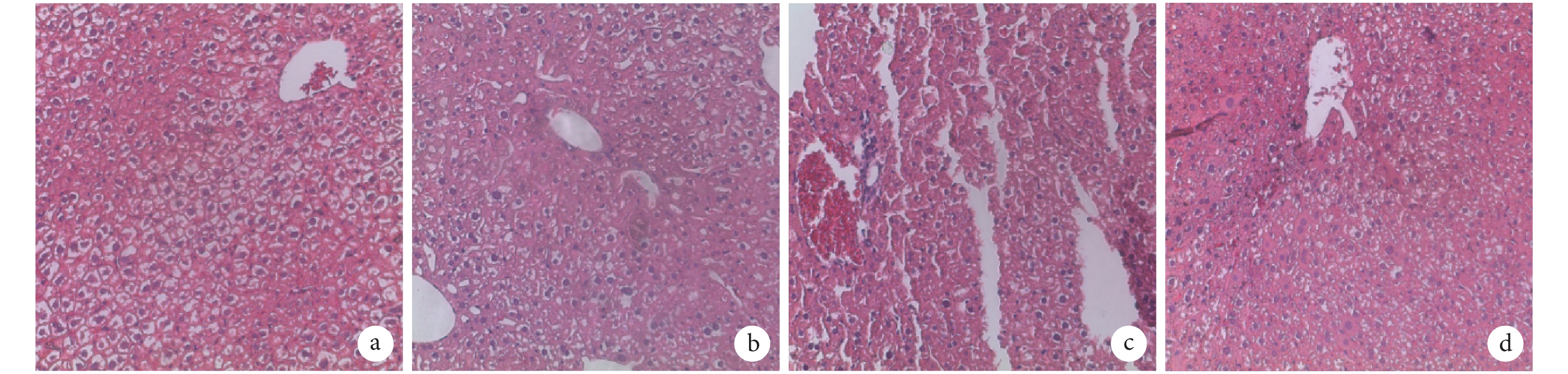
HE 染色示,A 組大鼠肝組織結構清晰,細胞排列整齊,大小均勻;B 組大鼠肝細胞明顯出現水腫,細胞排列紊亂,可見肝小葉內點狀壞死,組織出現彌漫性炎性細胞浸潤;C、D 組大鼠肝組織炎癥和肝細胞壞死程度較 B 組明顯減輕,同時由線粒體和粗面內質網擴張造成的空泡數量降低,其中 D 組肝損傷改善程度較 C 組更顯著。見圖 2。
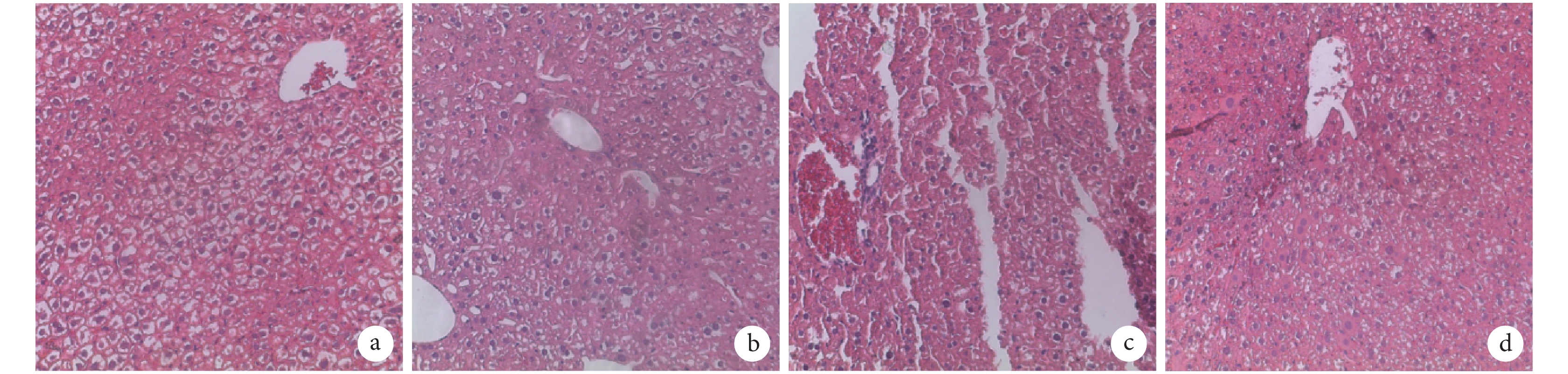 圖2
注射后 7 d 各組肝組織 HE 染色觀察(倒置相差顯微鏡×100) a. A組;b. B組;c. C組;d. D組
Figure2.
HE staining of live tissue in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖2
注射后 7 d 各組肝組織 HE 染色觀察(倒置相差顯微鏡×100) a. A組;b. B組;c. C組;d. D組
Figure2.
HE staining of live tissue in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
2.4 免疫組織化學染色觀察
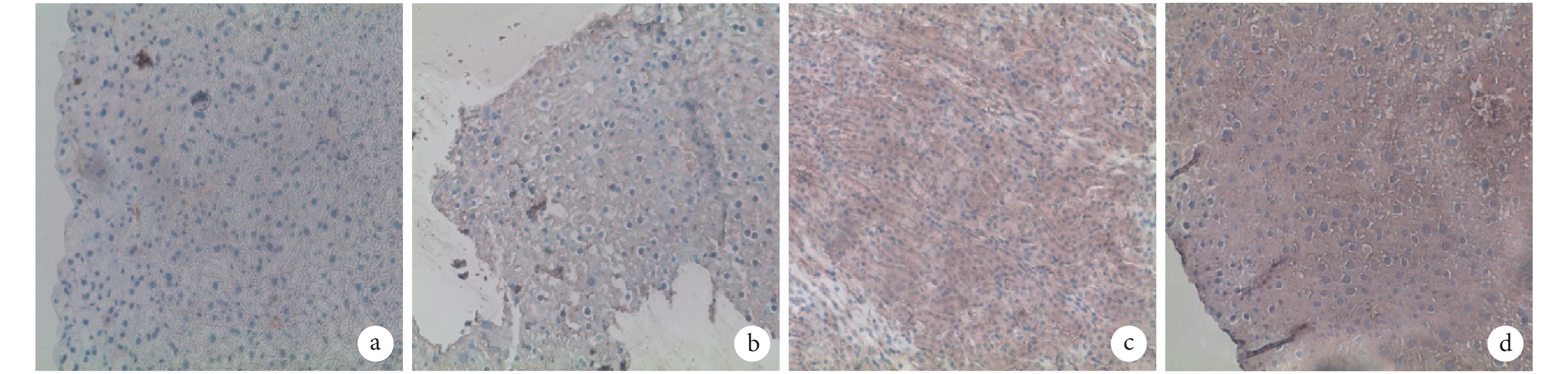
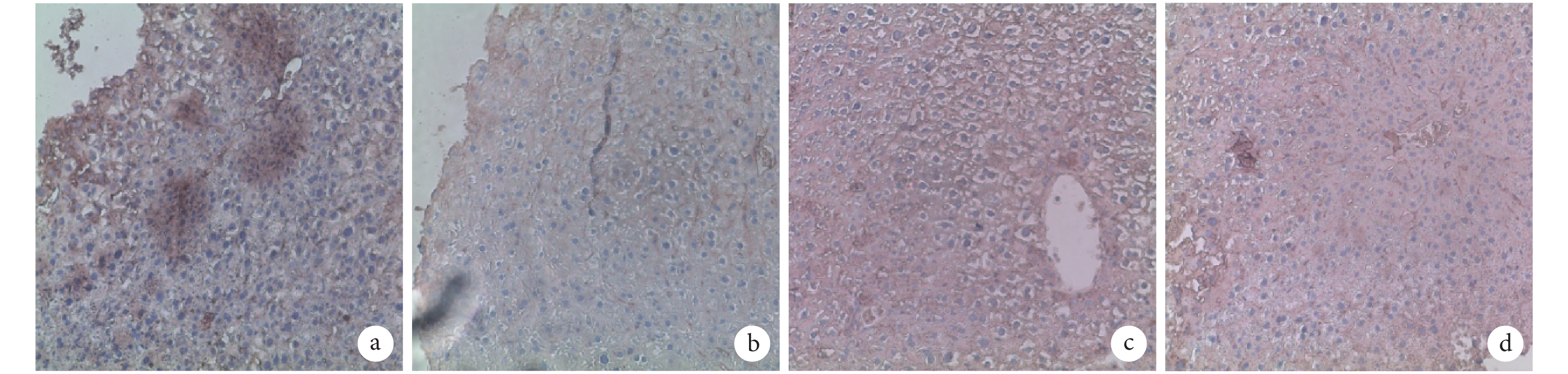
A、B 組 Ki67 呈弱陽性表達,B 組表達高于 A 組;C、D 組呈強陽性表達,D 組表達高于 C 組。見圖 3。A、B、C、D 組 Ki67 陽性細胞率分別為 5.646%±1.443%、16.550%±3.077%、64.600%±3.060%、77.590%±3.545%,C、D 組顯著高于 A、B 組,B 組高于 A 組,D 組高于 C 組,差異均有統計學意義(P<0.05)。
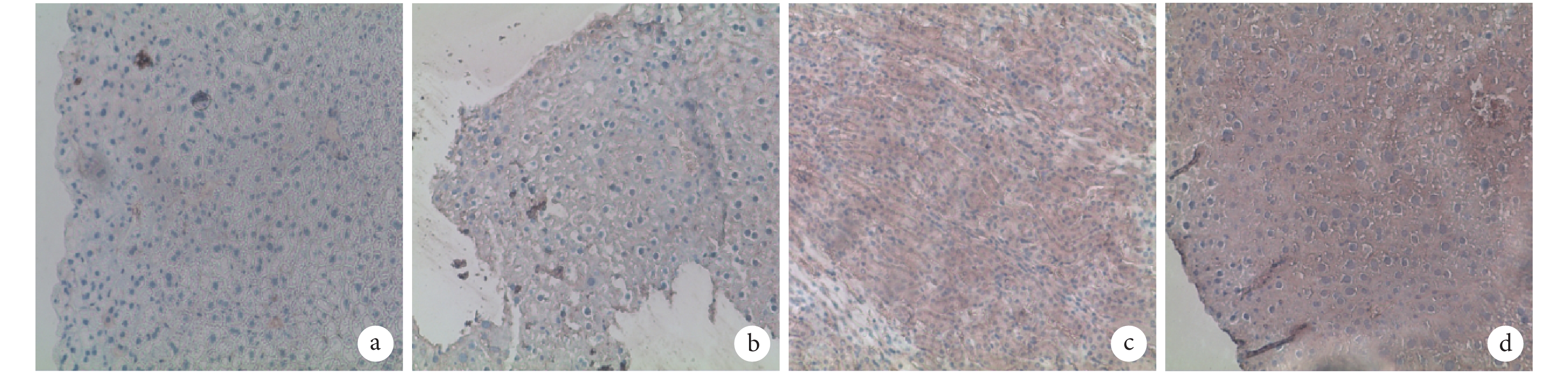 圖3
注射后 7 d 各組 Ki67 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B組;c. C 組;d. D 組
Figure3.
Immunohistochemical staining of Ki67 in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖3
注射后 7 d 各組 Ki67 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B組;c. C 組;d. D 組
Figure3.
Immunohistochemical staining of Ki67 in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
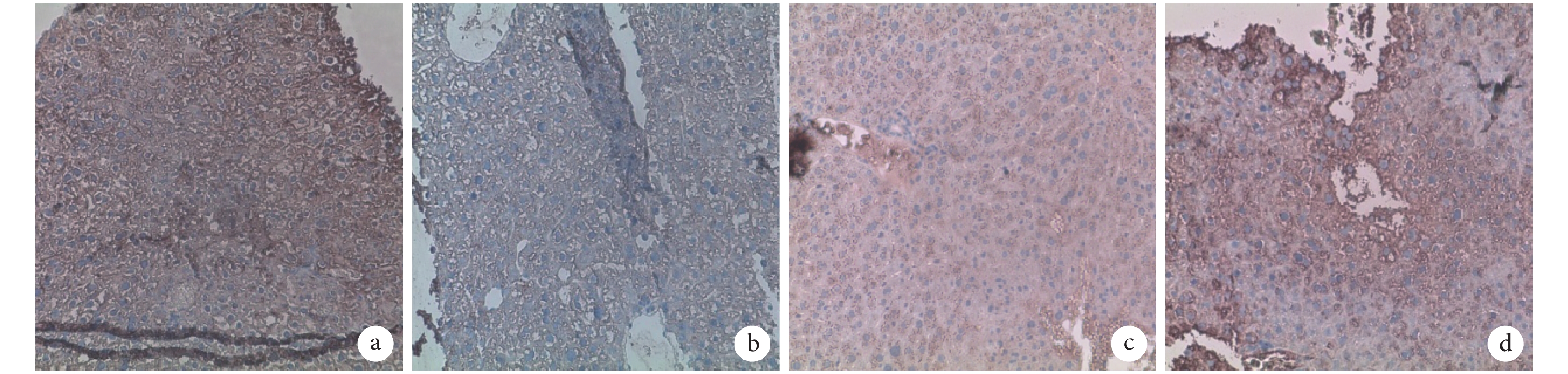
A、B 組 AFP 均無表達,而 ALB 呈強陽性表達;C、D 組 AFP 和 ALB 表達均顯著高于 A、B 組,D 組高于 C 組。見圖 4、5。C、D 組 AFP 陽性細胞率分別為 14.000%±2.230%、19.590%±3.510%,比較差異有統計學意義(t=3.006,P=0.017);A、B、C、D 組 ALB 陽性細胞率分別為 11.880%±1.025%、8.502%±1.638%、22.920%±2.448%、31.760%±5.571%,C、D 組顯著高于 A、B 組,D 組高于 C 組,差異均有統計學意義(P<0.05)。
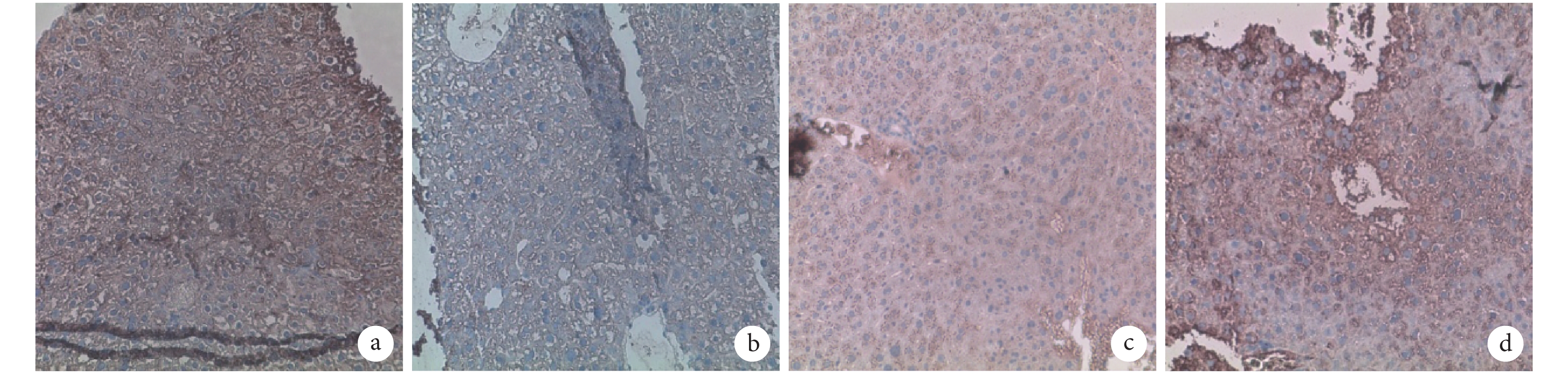 圖4
注射后 7 d 各組 AFP 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure4.
Immunohistochemical staining of AFP in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖4
注射后 7 d 各組 AFP 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure4.
Immunohistochemical staining of AFP in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
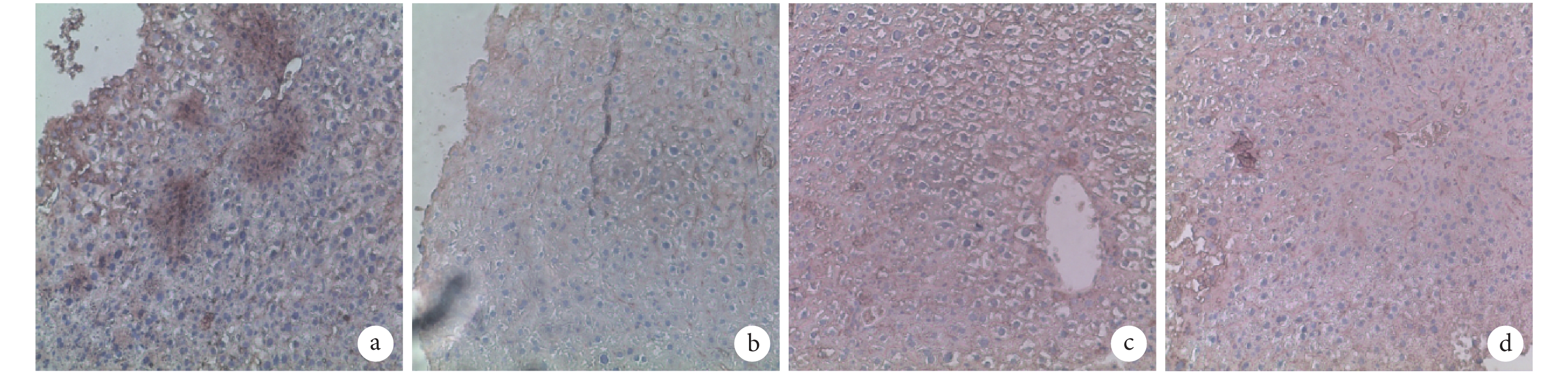 圖5
注射后 7 d 各組 ALB 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure5.
Immunohistochemical staining of ALB in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖5
注射后 7 d 各組 ALB 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure5.
Immunohistochemical staining of ALB in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
3 討論
目前,諸多研究報道了干細胞在不同肝臟疾病中的廣泛作用,如降低氧化應激反應[9]、參與干細胞旁分泌營養信號[10]、抑制免疫應答[11]、減少肝纖維化[12]以及促進肝損傷組織修復[13]。越來越多外源性因子(包括雌激素[14])被證實能夠增強 ADSCs 的這種潛在治療作用[15-16]。因此,雌激素分泌最活躍的妊娠期來源 ADSCs 是否對肝損傷修復效果更佳,值得我們關注。
本研究中,我們發現不同來源的 ADSCs 移植均能夠顯著減輕 CCl4 引起的大鼠急性肝損傷,包括血清肝功能以及肝臟病理等指標。細胞增殖標志物 Ki67 和肝細胞標志物免疫組織化學染色結果顯示,ADSCs 能夠促進肝細胞增殖,類肝細胞數量也有所增加。同時,妊娠大鼠來源 ADSCs 對肝損傷的修復功能明顯優于正常大鼠來源的 ADSCs,表明妊娠狀態能夠促進 ADSCs 對急性肝損傷的治療效果。我們分析可能與以下兩方面有關:其一,妊娠期來源 ADSCs 增殖能力較正常來源 ADSCs 強,在植入動物體內后存活率高。Ng 等[17]對取自不同時期婦女的 ADSCs(包括妊娠期來源、絕經前期來源和絕經期來源)進行研究,結果顯示妊娠期來源 ADSCs 的生物學活性較其他來源的 ADSCs 顯著提高,提示妊娠期母體來源的干細胞可能處于動員狀態,該時期的干細胞生物學活性高于非妊娠期狀態。而我們的前期研究也發現了同樣結果,且 17-β 雌二醇能夠促進 ADSCs 的增殖,而孕酮未表現該作用。其二,妊娠期來源 ADSCs 對損傷部位的肝細胞增殖促進作用更強,因此對肝功能改善更佳。Ki67 免疫組織化學染色結果也證實了此點。Ki67 用于檢測與增殖相關的核抗原的出現,能夠分析細胞增殖情況[18]。Ki-67 染色陰性細胞為 G0 期細胞,在肝臟正常狀態下,多數肝細胞處于 G0 期;但當慢性肝炎、肝硬化和肝癌等發生時,肝細胞生長增殖活動顯著增強[19]。本研究顯示,正常肝組織表達 Ki67 抗原為弱陽性,在 CCl4 處理的大鼠組織中,肝細胞出現少量增殖,與既往研究一致[20-21]。而不同來源 ADSCs 移植后明顯促進了受損組織中的肝細胞增殖,相比于正常來源 ADSCs,妊娠期來源 ADSCs 作用更明顯。此外,本研究中肝細胞早期分化標志物 AFP 和 ALB 陽性率的變化也提示肝細胞處于增殖分化狀態。
綜上述,采用妊娠大鼠來源 ADSCs 移植治療 CCl4 誘導的大鼠肝損傷較正常來源 ADSCs 具有一定優勢,可能與細胞較高的自我增殖能力和促肝細胞增殖能力相關。但目前妊娠狀態對 ADSCs 的促進機制仍不明確,是下一步研究方向。
脂肪干細胞(adipose-derived stem cells,ADSCs)來源于中胚層,具有多向分化潛能,可分化為脂肪、肌肉、軟骨等,甚至能在一定條件下分化為內胚層來源的肝實質細胞、外胚層來源的神經細胞等[1]。較強的可塑性和取材便利性使得 ADSCs 迅速成為組織工程學研究熱點。動物體內研究發現,ADSCs 能修復骨骼、心臟、腎臟和肝臟等組織[2-4]。目前,越來越多研究證實 MSCs 能在損傷微環境中分化為多種特定細胞類型,參與不同組織的修復[5],同時外源性刺激能夠增強其修復能力[6-8]。本課題組在前期研究中發現,妊娠大鼠來源 ADSCs 較正常大鼠來源 ADSCs 具有更強的增殖能力;在相同誘導條件下,前者分化為類肝細胞的時間較后者更短,類肝細胞功能更強。本次研究通過觀察妊娠大鼠來源 ADSCs 修復大鼠損傷肝組織作用,進一步驗證其修復效果是否優于正常大鼠來源 ADSCs,以期為提高 ADSCs 移植治療肝損傷效率提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
18 周齡 SPF 級 SD 大鼠 29 只,其中雌性 26 只、雄性 3 只,體質量約 250 g,由昆明醫科大學實驗動物科提供。正常大鼠來源 ADSCs 購自廣州賽業生物科技有限公司。
DMEM 培養基、0.25% 胰蛋白酶、Ⅰ型膠原酶(HyClone 公司,美國);FBS(GIBCO 公司,美國);CCl4(Sigma 公司,美國);10% 中性甲醛、二甲苯、蘇木素染液、鹽酸酒精、伊紅、枸緣酸鈉溶液、免疫組織化學檢測試劑盒(福州邁新生物技術開發有限公司);兔抗甲胎蛋白(alpha-fetoprotein, AFP)多克隆抗體、兔抗白蛋白(albumin,ALB)多克隆抗體、兔抗細胞增殖核抗原 Ki67 多克隆抗體(Santa Cruz公司,美國)。自動生化分析儀(貝克曼公司,美國);DMI6000B 倒置熒光顯微鏡(Leica 公司,德國)。
1.2 妊娠大鼠來源 ADSCs 分離培養及鑒定
取 SD 大鼠 9 只(雌性 6 只、雄性 3 只)按雌雄比例 2∶1 進行合籠過夜,第 2 天觀察見雌鼠陰道栓即選為實驗用妊娠大鼠。懷孕 7 d 后取材并分離培養 ADSCs。
具體步驟:頸椎脫臼法處死 SD 大鼠,無菌條件下解剖腹腔,取出約 5 mL 大網膜脂肪組織,置于 90 cm 培養皿中,PBS 反復沖洗去除肉眼可見的非脂肪組織。組織剪剪碎至 1 mm3 大小后,置于Ⅰ型膠原酶 37℃ 消化 1 h;隨后 200 目濾網濾棄未消化的組織。將過濾后的細胞懸液以離心半徑 10 cm、1 500 r/min 離心 10 min,收集濾液,加入含 10% FBS 的 L-DMEM 培養液進行細胞重懸,進行原代細胞培養。24 h 后更換培養基,去除未貼壁細胞,待細胞融合達 80%~90% 后進行消化傳代。倒置相差顯微鏡下觀察細胞貼壁及死亡情況,并取第 3 代細胞用流式細胞術進行干細胞表面標志物(CD44、CD45、CD90)鑒定。
1.3 實驗分組及方法
取 SD 大鼠 20 只隨機分為 A、B、C、D 4 組,每組 5 只。A 組大鼠不作處理,作為正常對照;B~D 組大鼠腹腔注射(7 mL/kg)CCl4(CCl4 以 10% 比例溶于橄欖油中)制備急性肝損傷模型,每 24 小時注射 1 次,連續 2 次。造模后 2 h,A 組于大鼠脾臟注射 0.1 mL DPBS;B 組不注射任何試劑;C、D 組分別于大鼠脾臟注射 0.1 mL 正常大鼠來源 ADSCs(2×106 個/mL)和妊娠大鼠來源 ADSCs(2×106 個/mL)。
1.4 觀測指標
1.4.1 血清指標比較 注射后 7 d,采用頸椎脫臼法處死各組大鼠,摘取眼球后抽血 3 mL,以離心半徑 10 cm、3 000 r/min 離心 15 min 分離血清,自動生化分析儀檢測血清中總膽紅素(total bilirubin,TBIL)、丙氨酸氨基轉移酶(alanine aminotrans-ferase,ALT)、天門冬氨酸氨基轉移酶(aspartic acid transaminase,AST)、白蛋白(albumin,ALB)和肝功能總蛋白(total protein,TP)含量。
1.4.2 組織學觀察 注射后 7 d,取各組大鼠肝臟,置于 4% 多聚甲醛固定 3 d 后行石蠟包埋,切片,片厚 5 μm。取部分切片行HE染色,倒置相差顯微鏡下觀察肝組織損傷情況。
1.4.3 免疫組織化學染色觀察 取上述部分切片,按試劑盒說明進行免疫組織化學染色,檢測細胞增殖和肝細胞標志物表達。Ki67、AFP 和 ALB 抗體稀釋比例均為 1∶100,采用 DAB 法進行顯色,顯色后自來水沖洗 3 min,蘇木素復染,中性樹膠封片,倒置相差顯微鏡下觀察。隨機選取 5 個視野,以細胞質或細胞核出現棕黃色顆粒記為陽性細胞,記數陽性細胞,并計算陽性細胞率,公式為:陽性細胞數/總細胞數×100%。
1.5 統計學方法
采用 GraphPrism 6.0 軟件進行分析。數據以均數±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;兩組間比較采用獨立樣本t 檢驗;檢驗水準α=0.05。
2 結果
2.1 ADSCs 形態學觀察及鑒定
原代 ADSCs 呈圓形,30~60 min 內開始貼壁,24 h 后基本完成貼壁,此時可見部分貼壁細胞細胞質變長,開始伸出偽足。傳代后細胞形態伸展為三角形、多角形,最終逐漸變為典型的短梭形。見圖 1。流式細胞術結果顯示,培養的細胞 CD44 和 CD90 為陽性表達,CD45 為陰性表達,符合干細胞表面分子標志物特性。
 圖1
妊娠大鼠來源 ADSCs 形態學觀察(倒置相差顯微鏡×100) a. 原代接種細胞;b. 原代細胞培養24 h;c. 第1代細胞;d. 第3代細胞
Figure1.
Morphological observation of ADSCs isolated from pregnant Sprague Dawley rat (Inverted phase contrast microscope×100) a. Primary cells; b. Primary cells cultured for 24 hours; c. ADSCs at passage 1; d. ADSCs at passage 3
圖1
妊娠大鼠來源 ADSCs 形態學觀察(倒置相差顯微鏡×100) a. 原代接種細胞;b. 原代細胞培養24 h;c. 第1代細胞;d. 第3代細胞
Figure1.
Morphological observation of ADSCs isolated from pregnant Sprague Dawley rat (Inverted phase contrast microscope×100) a. Primary cells; b. Primary cells cultured for 24 hours; c. ADSCs at passage 1; d. ADSCs at passage 3
2.2 血清指標比較
注射后 7 d,B 組血清中 TBIL、ALT、AST 含量顯著高于 A、C、D 組,ALB、TP 含量顯著低于 A、C、D 組,差異均有統計學意義(P<0.05)。C、D 組血清中 TBIL、ALT、AST 含量顯著高于 A 組,C 組高于 D 組,差異均有統計學意義(P<0.05);A、C、D 組血清中 ALB 含量比較差異無統計學意義(P>0.05);C、D 組血清中 TP 含量顯著低于 A 組(P<0.05),C、D 組間比較差異無統計學意義(P>0.05)。見表 1。
2.3 組織學觀察
HE 染色示,A 組大鼠肝組織結構清晰,細胞排列整齊,大小均勻;B 組大鼠肝細胞明顯出現水腫,細胞排列紊亂,可見肝小葉內點狀壞死,組織出現彌漫性炎性細胞浸潤;C、D 組大鼠肝組織炎癥和肝細胞壞死程度較 B 組明顯減輕,同時由線粒體和粗面內質網擴張造成的空泡數量降低,其中 D 組肝損傷改善程度較 C 組更顯著。見圖 2。
 圖2
注射后 7 d 各組肝組織 HE 染色觀察(倒置相差顯微鏡×100) a. A組;b. B組;c. C組;d. D組
Figure2.
HE staining of live tissue in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖2
注射后 7 d 各組肝組織 HE 染色觀察(倒置相差顯微鏡×100) a. A組;b. B組;c. C組;d. D組
Figure2.
HE staining of live tissue in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
2.4 免疫組織化學染色觀察
A、B 組 Ki67 呈弱陽性表達,B 組表達高于 A 組;C、D 組呈強陽性表達,D 組表達高于 C 組。見圖 3。A、B、C、D 組 Ki67 陽性細胞率分別為 5.646%±1.443%、16.550%±3.077%、64.600%±3.060%、77.590%±3.545%,C、D 組顯著高于 A、B 組,B 組高于 A 組,D 組高于 C 組,差異均有統計學意義(P<0.05)。
 圖3
注射后 7 d 各組 Ki67 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B組;c. C 組;d. D 組
Figure3.
Immunohistochemical staining of Ki67 in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖3
注射后 7 d 各組 Ki67 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B組;c. C 組;d. D 組
Figure3.
Immunohistochemical staining of Ki67 in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
A、B 組 AFP 均無表達,而 ALB 呈強陽性表達;C、D 組 AFP 和 ALB 表達均顯著高于 A、B 組,D 組高于 C 組。見圖 4、5。C、D 組 AFP 陽性細胞率分別為 14.000%±2.230%、19.590%±3.510%,比較差異有統計學意義(t=3.006,P=0.017);A、B、C、D 組 ALB 陽性細胞率分別為 11.880%±1.025%、8.502%±1.638%、22.920%±2.448%、31.760%±5.571%,C、D 組顯著高于 A、B 組,D 組高于 C 組,差異均有統計學意義(P<0.05)。
 圖4
注射后 7 d 各組 AFP 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure4.
Immunohistochemical staining of AFP in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖4
注射后 7 d 各組 AFP 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure4.
Immunohistochemical staining of AFP in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
 圖5
注射后 7 d 各組 ALB 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure5.
Immunohistochemical staining of ALB in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
圖5
注射后 7 d 各組 ALB 免疫組織化學染色觀察(倒置相差顯微鏡×100) a. A 組;b. B 組;c. C 組;d. D 組
Figure5.
Immunohistochemical staining of ALB in every group after 7 days (Inverted phase contrast microscope×100) a. Group A; b. Group B; c. Group C; d. Group D
3 討論
目前,諸多研究報道了干細胞在不同肝臟疾病中的廣泛作用,如降低氧化應激反應[9]、參與干細胞旁分泌營養信號[10]、抑制免疫應答[11]、減少肝纖維化[12]以及促進肝損傷組織修復[13]。越來越多外源性因子(包括雌激素[14])被證實能夠增強 ADSCs 的這種潛在治療作用[15-16]。因此,雌激素分泌最活躍的妊娠期來源 ADSCs 是否對肝損傷修復效果更佳,值得我們關注。
本研究中,我們發現不同來源的 ADSCs 移植均能夠顯著減輕 CCl4 引起的大鼠急性肝損傷,包括血清肝功能以及肝臟病理等指標。細胞增殖標志物 Ki67 和肝細胞標志物免疫組織化學染色結果顯示,ADSCs 能夠促進肝細胞增殖,類肝細胞數量也有所增加。同時,妊娠大鼠來源 ADSCs 對肝損傷的修復功能明顯優于正常大鼠來源的 ADSCs,表明妊娠狀態能夠促進 ADSCs 對急性肝損傷的治療效果。我們分析可能與以下兩方面有關:其一,妊娠期來源 ADSCs 增殖能力較正常來源 ADSCs 強,在植入動物體內后存活率高。Ng 等[17]對取自不同時期婦女的 ADSCs(包括妊娠期來源、絕經前期來源和絕經期來源)進行研究,結果顯示妊娠期來源 ADSCs 的生物學活性較其他來源的 ADSCs 顯著提高,提示妊娠期母體來源的干細胞可能處于動員狀態,該時期的干細胞生物學活性高于非妊娠期狀態。而我們的前期研究也發現了同樣結果,且 17-β 雌二醇能夠促進 ADSCs 的增殖,而孕酮未表現該作用。其二,妊娠期來源 ADSCs 對損傷部位的肝細胞增殖促進作用更強,因此對肝功能改善更佳。Ki67 免疫組織化學染色結果也證實了此點。Ki67 用于檢測與增殖相關的核抗原的出現,能夠分析細胞增殖情況[18]。Ki-67 染色陰性細胞為 G0 期細胞,在肝臟正常狀態下,多數肝細胞處于 G0 期;但當慢性肝炎、肝硬化和肝癌等發生時,肝細胞生長增殖活動顯著增強[19]。本研究顯示,正常肝組織表達 Ki67 抗原為弱陽性,在 CCl4 處理的大鼠組織中,肝細胞出現少量增殖,與既往研究一致[20-21]。而不同來源 ADSCs 移植后明顯促進了受損組織中的肝細胞增殖,相比于正常來源 ADSCs,妊娠期來源 ADSCs 作用更明顯。此外,本研究中肝細胞早期分化標志物 AFP 和 ALB 陽性率的變化也提示肝細胞處于增殖分化狀態。
綜上述,采用妊娠大鼠來源 ADSCs 移植治療 CCl4 誘導的大鼠肝損傷較正常來源 ADSCs 具有一定優勢,可能與細胞較高的自我增殖能力和促肝細胞增殖能力相關。但目前妊娠狀態對 ADSCs 的促進機制仍不明確,是下一步研究方向。