引用本文: 張廣德, 蘇成帥, 靳霞, 楊世茂, 房殿吉, 郭延偉. 重組腺病毒介導BMP-9及促紅細胞生成素雙基因共轉染促進脂肪來源干細胞體外成骨的研究. 中國修復重建外科雜志, 2016, 30(3): 272-278. doi: 10.7507/1002-1892.20160055 復制
脂肪來源干細胞(adipose-derived stem cells,AD SCs)因具有自我更新、多向分化和低免疫原性等優勢,成為組織工程研究熱點[1-2]。BMP-9是TGF-β家族成員之一,能夠調節干細胞向骨、軟骨、肌腱和脂肪等組織的分化[3-5]。促紅細胞生成素(erythropoietin,EPO)是一種低氧誘導激素,通過參與MARK、PI3K等信號傳導途徑調節細胞發育和完整性,還能通過動員骨髓內皮祖細胞刺激網狀細胞和內皮細胞增殖、分化,促進細胞再生和血管生成,并且在干細胞成骨過程中有促進作用[6-7]。以往研究發現,雙基因轉染干細胞能有效穩定釋放兩種具有協同作用的生長因子并作用于宿主體內,其效果明顯優于單基因轉染[8-9]。本實驗利用腺病毒介導BMP-9、EPO共轉染ADSCs,觀察其促進AD SCs體外成骨效果。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康4月齡新西蘭兔6只,雌雄不限,體質量2~3 kg,由武警山東省總隊醫院動物實驗中心提供。雙基因共表達載體pIRES1neo、重組質粒pcDNA-hBMP-9、重組質粒pMD18T-EPO、綠色熒光蛋白(green fluorescent protein,GFP)、BCA蛋白定量試劑盒、DMEM培養基、FBS、胰蛋白酶、Ⅰ型膠原酶(GIBCO公司,美國);感受態細胞DH5α、BP clonase enzyme mixⅡ、LR clonase enzyme mixⅡ(Invitrogen公司,美國);紅色熒光共表達載體p-IRES2-DSRED、質粒表達載體p-DONR221、腺病毒表達載體pAD/CMV/v5-DEST、胰島素、地塞米松、抗壞血酸、β-甘油磷酸鈉、ALP活性檢測試劑盒、CelLyticTM NuCLEARTM Extraction Kit(Sigma公司,美國);2×SYBR Green Mix(With ROX)試劑盒(BIOMIGA公司,美國)。PCR儀、全自動生化分析儀、倒置相差顯微鏡、熒光顯微鏡(Olympus公司,日本)。
1.2 ADSCs分離培養及鑒定
6只新西蘭兔耳緣靜脈注射20%烏拉坦(5?mL/kg)麻醉后,取兩側腹股溝脂肪組織,去除結締組織,PBS緩沖液反復沖洗3次,眼科剪剪碎成漿糊狀。加入0.1%Ⅰ型膠原酶并轉移至15 mL離心管中,置于37℃搖床中消化60 min。以離心半徑10 cm、2 600 r/min離心10 min,去除上層脂肪組織和液體,D-Hank液洗滌沉淀2次。用含10%FBS的DMEM培養基稀釋,200目濾網過濾。以離心半徑10 cm、3 000 r/min離心10 min,收集細胞懸液于37℃、飽和濕度培養箱中培養。倒置相差顯微鏡下觀察細胞生長情況,待細胞融合達80%~90%時,0.25%胰蛋白酶消化傳代培養。取第3代細胞進行實驗并進行成脂、成骨誘導培養鑒定。
1.3 構建BMP-9及EPO重組腺病毒
首先測序驗證含有BMP-9 ORF克隆的序列信息,然后進行BMP-9 ORF克隆序列的PCR擴增:根據序列信息設計PCR擴增引物,以ORF克隆質粒為模板,擴增帶有BglⅡ及SalⅠ酶切位點的目的基因片段,電泳回收,通過Primer5.0設計引物:上游,5' -GAGGCAGTTEAGGACCTCAG-3' ;下游,5' -CTTAGGCAGGAGACGGTCAG-3' 。將回收后帶有酶切位點的目的基因片段用BglⅡ和SalⅠ酶切后連接至目的載體p-IRES2-DSRED,并轉化至感受態細胞DH5α中。紅色熒光共表達基因RES-RED的序列測定后對目標質粒進行PCR擴增,設計PCR擴增引物:上游,5' -GGACAGTCCCGATTAGCTAGCATC-3' ,下游,5' -GGGCATCAAGTCAGTACTGAGT-3' 。以BMP-9-(IRES-RED)共表達質粒為模板,擴增帶att B1和att B2的BMP-9-(IRES-RED)片段,電泳回收。使用BP重組系統將上述目的基因片段重組至質粒表達載體p-DONR221,然后使用LR重組系統將目的序列重組至腺病毒表達載體pAD/CMV/v5-DEST。對最終重組的BMP-9-(IRES-RED)-腺病毒表達載體質粒進行測序。腺病毒包裝:將重組的BMP-9-(IRES-RED)-腺病毒表達載體質粒采用PacⅠ單酶切,再將重組質粒置入酶切體系中,37°C酶切2 h。采用經典酚氯仿抽提法對單酶切質粒進行純化,將質粒線性化。最終獲得BMP-9重組腺病毒。同上法制備EPO重組腺病毒。轉染操作按Lipofectamine 2000轉染手冊進行,通過比較不同轉染復數(multiplicity of infection,MOI)轉染ADSCs后的病毒轉染效率,確定最佳MOI。其中,BMP-9重組腺病毒最佳MOI為90,EPO重組腺病毒為120。
1.4 實驗分組及方法
根據處理方法不同,將ADSCs分為5組:A組為正常細胞,B組為pCMV-AD-GFP空質粒轉染組,C組為單純BMP-9轉染組,D組為單純EPO轉染組,E組為BMP-9/EPO共轉染組。取第3代ADSCs,以5×104個/cm2密度接種于6孔板,待細胞達80%貼壁時,根據分組進行相應處理。其中A組加入含10%FBS的DMEM培養基,B組采用不添加目的基因的空質粒轉染,C、D組分別加入最佳MOI的BMP-9重組腺病毒和EPO重組腺病毒,E組同時加入最佳MOI的BMP-9、EPO重組腺病毒。于37℃、5%CO2培養箱中培養24 h后更換新鮮培養液。
1.5 觀測指標
1.5.1 細胞轉染觀察
①病毒轉染效率檢測:培養7 d后倒置相差顯微鏡下觀察細胞生長情況。培養14?d后各組細胞用0.25%胰蛋白酶消化,吹打形成單個細胞,PBS清洗5 min后棄上清,再用PBS重新清洗2次,熒光顯微鏡下觀察。成功轉染細胞呈綠色或紅色熒光表達。培養48?h時取各組細胞于100倍鏡下隨機取10個視野,計數熒光表達細胞數,并計算轉染效率:熒光表達細胞數/同視野下細胞總數×100%。
②Western blot檢測BMP-9和EPO蛋白表達:取各組培養14 d細胞,PBS清洗后采用Western blot細胞蛋白提取試劑盒CelLyticTM NuCLEARTM Extraction Kit提取蛋白,檢測蛋白含量。根據待測蛋白相對分子質量常規配膠、轉膜及封閉后孵育,最后配置發光液,暗室中進行顯影定影。以GAPDH作為內參,蛋白分析軟件掃描各條帶吸光度(A)值,以BMP-9和EPO蛋白與內參A值比值作為目的蛋白相對表達量。實驗重復3次。
1.5.2 成骨誘導培養觀察
取各組轉染培養14 d細胞,更換成骨誘導液進行成骨誘導培養。①茜素紅染色觀察:誘導培養3周取各組細胞行茜素紅染色,倒置相差顯微鏡下觀察鈣結節形成情況。每組取10張切片,每張切片取6個視野,于200倍鏡下計數鈣結節,取均數。②ALP活性檢測:誘導培養3、7、14 d,取各組細胞以1×106個/孔密度接種于6孔板,參照ALP活性檢測試劑盒說明,于酶聯免疫檢測儀波長520 nm處測量A值。實驗重復3次。③實時熒光定量PCR檢測:誘導培養3周取各組細胞,PBS清洗,根據試劑盒說明提取細胞總RNA,反轉錄成cDNA后進行熒光定量PCR擴增,檢測骨橋蛋白(osteopontin,OPN)、骨鈣素(osteocalcin,OCN)相對表達量。實驗重復3次。引物序列見表 1。
1.6 統計學方法
采用SPSS13.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;檢驗水準α=0.05。
2 結果
2.1 ADSCs形態學觀察及鑒定
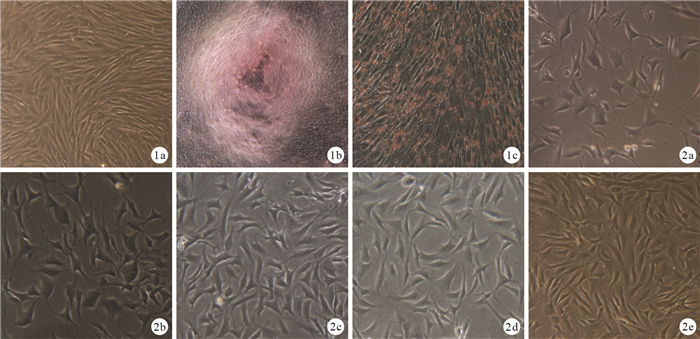
原代細胞接種后多呈圓形,大小不一,散在分布,懸浮于培養液;約2周后細胞基本融合,細胞之間相互重疊,排列緊密,呈紡錘形。第3代細胞呈梭形旋渦狀生長,形態均一。經成骨及成脂誘導后,細胞可以形成鈣結節和脂肪顆粒,符合干細胞多向誘導分化的特性。見圖 1。
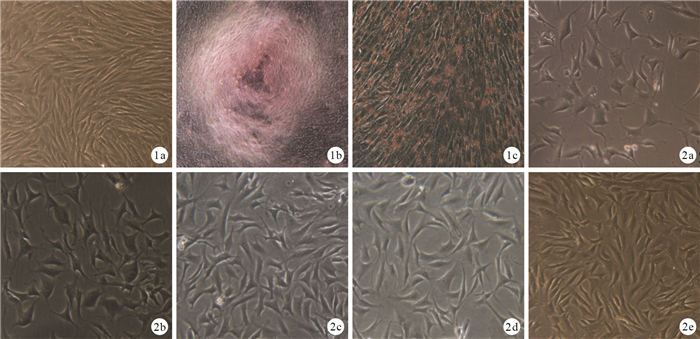 圖1
ADSCs形態學觀察及鑒定 ? 第3代ADSCs(倒置相差顯微鏡×100) ? 成骨誘導培養(茜素紅染色×300) ? 成脂誘導培養(油紅O染色×100) 圖 2轉染培養7 d各組倒置相差顯微鏡下細胞形態(×300) ? A組 ? B組 ? C組 ? D組 ? E組
Figure1.
Morphology observation and indentification of ADSCs ? The 3rd generation ADSCs (Inverted phase contrast microscope×100) ? Osteogenic culture (Alizarin red staining×300) ? Adipogenic culture (Oil red O staining×100) Fig. 2 Cell morphology under inverted phase contrast microscope at 7 days after transfected (×300) ? Group A ? Group B ? Group C ? Group D ? Group E
圖1
ADSCs形態學觀察及鑒定 ? 第3代ADSCs(倒置相差顯微鏡×100) ? 成骨誘導培養(茜素紅染色×300) ? 成脂誘導培養(油紅O染色×100) 圖 2轉染培養7 d各組倒置相差顯微鏡下細胞形態(×300) ? A組 ? B組 ? C組 ? D組 ? E組
Figure1.
Morphology observation and indentification of ADSCs ? The 3rd generation ADSCs (Inverted phase contrast microscope×100) ? Osteogenic culture (Alizarin red staining×300) ? Adipogenic culture (Oil red O staining×100) Fig. 2 Cell morphology under inverted phase contrast microscope at 7 days after transfected (×300) ? Group A ? Group B ? Group C ? Group D ? Group E
2.2 細胞轉染觀察
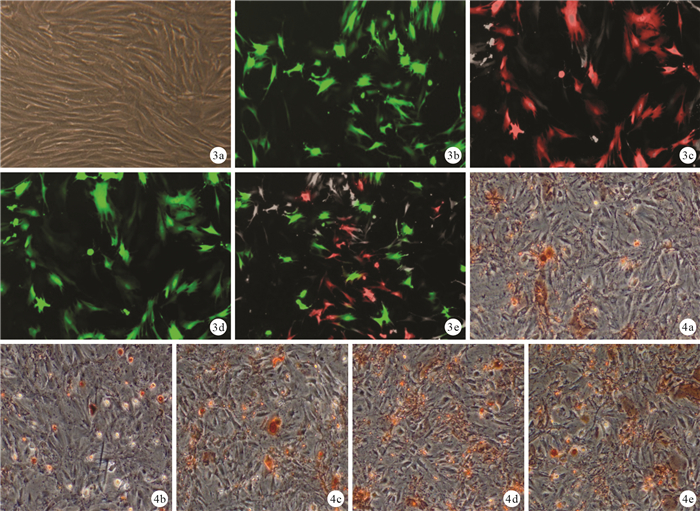
轉染培養7 d,倒置相差顯微鏡觀察示A、B組部分細胞變為橢圓形、圓形和不規則形;C、D組可見少量長梭形細胞;E組長梭形細胞明顯增多,僅見少量圓形細胞。見圖 2。48 h后B、C、D、E組病毒轉染效率為80%~93%。14 d時熒光顯微鏡觀察示A組細胞內無熒光表達,C組可見紅色熒光表達,B、D組可見綠色熒光表達,E組同時可見紅色、綠色熒光,提示重組腺病毒成功轉染細胞。見圖 3。
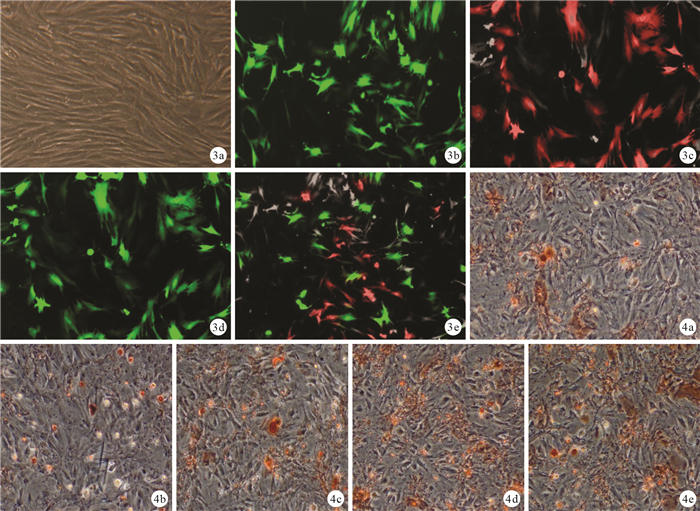 圖3
轉染培養14 d各組熒光顯微鏡觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200) 圖 4誘導培養3周各組茜素紅染色觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200)
Figure3.
Fluorescence microscope observation in each group at 14 days after transfected ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200) Fig. 4 Alizarin red staining observation in each group at 3 weeks after osteogenic induction ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200)
圖3
轉染培養14 d各組熒光顯微鏡觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200) 圖 4誘導培養3周各組茜素紅染色觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200)
Figure3.
Fluorescence microscope observation in each group at 14 days after transfected ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200) Fig. 4 Alizarin red staining observation in each group at 3 weeks after osteogenic induction ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200)
2.3 Western blot檢測
E組BMP-9蛋白相對表達量較其他組明顯增高,C組高于A、B、D組,D組高于A、B組,比較差異有統計學意義(P < 0.05);E組EPO蛋白相對表達量較其他組明顯增高,D組高于A、B、C組,C組高于A、B組,比較差異有統計學意義(P < 0.05)。見表 2。
2.4 成骨誘導培養觀察
2.4.1 茜素紅染色
成骨誘導培養3周,倒置相差顯微鏡觀察示A、B組有鈣鹽沉積,但鈣結節少有形成或不明顯;C、D組鈣鹽沉積均較明顯,形成的鈣結節較大,C組優于D組;E組鈣鹽沉積與鈣結節形成較其他4組更為明顯。見圖 4。A、B、C、D、E組鈣結節數分別為(7.33±0.13)、(6.67±0.26)、(13.67±0.65)、(12.00±0.42)、(22.67±0.73)個,C、D、E組鈣結節數顯著多于A、B組,E組多于C、D組,C組多于D組,比較差異均有統計學意義(P < 0.05)。
2.4.2 ALP活性檢測
成骨誘導培養3、7、14 d時各組細胞胞質ALP染色均呈陽性反應。E組A值顯著高于其余各組,C、D組高于A、B組,D組高于C組,比較差異均有統計學意義(P < 0.05)。見表 3。
2.4.3 實時熒光定量PCR檢測
誘導培養3周時,E組OPN和OCN基因相對表達量較其他組明顯增高,C、D組高于A、B組,比較差異有統計學意義(P < 0.05)。C組OPN基因相對表達量高于D組,OCN低于D組,但差異無統計學意義(P > 0.05)。見表 4。
3 討論
骨形成是一個復雜過程,骨形成開始和骨細胞增殖必須具備3個條件:誘導刺激、具備有分化能力的間充質細胞、利于骨形成的體內環境[10-11]。骨前體細胞分化與ALP、OCN、OPN、中心結合因子等的形成密切相關。BMP和EPO均是特殊的骨生長因子,在一定條件下可以誘導未分化間葉細胞、骨髓中的骨母細胞分化成軟骨細胞和成骨細胞,進而誘導軟骨和骨形成[12-14]。BMP-9是目前已知的BMP家族中誘導成骨作用最強因子之一,有望作為促進細胞成骨分化的細胞因子替代品用于臨床[15-16]。本實驗Western blot檢測分析,E組細胞經雙基因共轉染后BMP-9蛋白相對表達量明顯優于其他各組,C、D組高于A、B組,提示E組促進ADSCs體外成骨作用最明顯。EPO是一種小分子糖蛋白感應激素,參與調節許多細胞的生長發育過程,能促進血管再生和神經發育等[17-18]。EPO可以活化造血干細胞中的JAK/STAT信號,誘導BMP的產生并可直接作用于BMSCs誘導成骨細胞表型,增加Runx2、Ⅰ型膠原和ALP等成骨細胞相關基因的表達[19]。ADSCs表型和BMSCs表型大致相同,提示EPO也可以促進ADSCs成骨。本實驗ALP活性檢測和茜素紅染色結果提示,D組細胞經EPO基因轉染后ALP活性及鈣結節數均顯著高于A、B對照組,進一步驗證了EPO在ADSCs體外成骨過程中具有促進作用。
成骨過程中需要大量BMP,但在臨床研究和治療骨性疾病中若大量使用BMP,價格較為昂貴[20]。為此,本實驗利用BMP-9促進ADSCs成骨分化和EPO促進ADSCs增殖遷移和成骨的特點,將BMP-9和EPO基因共轉染ADSCs以獲得穩定表達,達到一方面降低BMP蛋白用量,另一方面通過ADSCs成骨分化直接參與新骨形成的目的。對于組織工程骨的構建,種子細胞和支架材料的篩選非常重要。本實驗培養的ADSCs在細胞培養和傳代過程中均表現出較好的生長和分化能力,轉染BMP-9和EPO基因后檢測轉染率較高,具備良好種子細胞的特點。茜素紅染色及ALP活性檢測是觀察細胞成骨分化的常用檢測指標,本實驗對體外成骨誘導后的細胞也進行了以上觀測,結果顯示E組ALP活性和鈣結節數最優,而C、D組高于A、B組。實時熒光定量PCR檢測亦發現E組OPN、OCN基因表達明顯高于其他各組,而C、D組也高于A、B組。提示采用重組腺病毒介導目的基因轉染方法能有效促進體外培養ADSCs的成骨分化,雙基因共轉染促進細胞成骨作用優于單基因轉染。
綜上述,本實驗通過將BMP-9和EPO基因聯合轉染ADSCs獲得二者的穩定表達,且觀測結果提示BMP-9和EPO基因在促進ADSCs成骨分化方面具有協同作用。但關于BMP-9、EPO最佳比例和共轉染后相關信號通路尚不十分清楚,有待進一步研究。
脂肪來源干細胞(adipose-derived stem cells,AD SCs)因具有自我更新、多向分化和低免疫原性等優勢,成為組織工程研究熱點[1-2]。BMP-9是TGF-β家族成員之一,能夠調節干細胞向骨、軟骨、肌腱和脂肪等組織的分化[3-5]。促紅細胞生成素(erythropoietin,EPO)是一種低氧誘導激素,通過參與MARK、PI3K等信號傳導途徑調節細胞發育和完整性,還能通過動員骨髓內皮祖細胞刺激網狀細胞和內皮細胞增殖、分化,促進細胞再生和血管生成,并且在干細胞成骨過程中有促進作用[6-7]。以往研究發現,雙基因轉染干細胞能有效穩定釋放兩種具有協同作用的生長因子并作用于宿主體內,其效果明顯優于單基因轉染[8-9]。本實驗利用腺病毒介導BMP-9、EPO共轉染ADSCs,觀察其促進AD SCs體外成骨效果。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康4月齡新西蘭兔6只,雌雄不限,體質量2~3 kg,由武警山東省總隊醫院動物實驗中心提供。雙基因共表達載體pIRES1neo、重組質粒pcDNA-hBMP-9、重組質粒pMD18T-EPO、綠色熒光蛋白(green fluorescent protein,GFP)、BCA蛋白定量試劑盒、DMEM培養基、FBS、胰蛋白酶、Ⅰ型膠原酶(GIBCO公司,美國);感受態細胞DH5α、BP clonase enzyme mixⅡ、LR clonase enzyme mixⅡ(Invitrogen公司,美國);紅色熒光共表達載體p-IRES2-DSRED、質粒表達載體p-DONR221、腺病毒表達載體pAD/CMV/v5-DEST、胰島素、地塞米松、抗壞血酸、β-甘油磷酸鈉、ALP活性檢測試劑盒、CelLyticTM NuCLEARTM Extraction Kit(Sigma公司,美國);2×SYBR Green Mix(With ROX)試劑盒(BIOMIGA公司,美國)。PCR儀、全自動生化分析儀、倒置相差顯微鏡、熒光顯微鏡(Olympus公司,日本)。
1.2 ADSCs分離培養及鑒定
6只新西蘭兔耳緣靜脈注射20%烏拉坦(5?mL/kg)麻醉后,取兩側腹股溝脂肪組織,去除結締組織,PBS緩沖液反復沖洗3次,眼科剪剪碎成漿糊狀。加入0.1%Ⅰ型膠原酶并轉移至15 mL離心管中,置于37℃搖床中消化60 min。以離心半徑10 cm、2 600 r/min離心10 min,去除上層脂肪組織和液體,D-Hank液洗滌沉淀2次。用含10%FBS的DMEM培養基稀釋,200目濾網過濾。以離心半徑10 cm、3 000 r/min離心10 min,收集細胞懸液于37℃、飽和濕度培養箱中培養。倒置相差顯微鏡下觀察細胞生長情況,待細胞融合達80%~90%時,0.25%胰蛋白酶消化傳代培養。取第3代細胞進行實驗并進行成脂、成骨誘導培養鑒定。
1.3 構建BMP-9及EPO重組腺病毒
首先測序驗證含有BMP-9 ORF克隆的序列信息,然后進行BMP-9 ORF克隆序列的PCR擴增:根據序列信息設計PCR擴增引物,以ORF克隆質粒為模板,擴增帶有BglⅡ及SalⅠ酶切位點的目的基因片段,電泳回收,通過Primer5.0設計引物:上游,5' -GAGGCAGTTEAGGACCTCAG-3' ;下游,5' -CTTAGGCAGGAGACGGTCAG-3' 。將回收后帶有酶切位點的目的基因片段用BglⅡ和SalⅠ酶切后連接至目的載體p-IRES2-DSRED,并轉化至感受態細胞DH5α中。紅色熒光共表達基因RES-RED的序列測定后對目標質粒進行PCR擴增,設計PCR擴增引物:上游,5' -GGACAGTCCCGATTAGCTAGCATC-3' ,下游,5' -GGGCATCAAGTCAGTACTGAGT-3' 。以BMP-9-(IRES-RED)共表達質粒為模板,擴增帶att B1和att B2的BMP-9-(IRES-RED)片段,電泳回收。使用BP重組系統將上述目的基因片段重組至質粒表達載體p-DONR221,然后使用LR重組系統將目的序列重組至腺病毒表達載體pAD/CMV/v5-DEST。對最終重組的BMP-9-(IRES-RED)-腺病毒表達載體質粒進行測序。腺病毒包裝:將重組的BMP-9-(IRES-RED)-腺病毒表達載體質粒采用PacⅠ單酶切,再將重組質粒置入酶切體系中,37°C酶切2 h。采用經典酚氯仿抽提法對單酶切質粒進行純化,將質粒線性化。最終獲得BMP-9重組腺病毒。同上法制備EPO重組腺病毒。轉染操作按Lipofectamine 2000轉染手冊進行,通過比較不同轉染復數(multiplicity of infection,MOI)轉染ADSCs后的病毒轉染效率,確定最佳MOI。其中,BMP-9重組腺病毒最佳MOI為90,EPO重組腺病毒為120。
1.4 實驗分組及方法
根據處理方法不同,將ADSCs分為5組:A組為正常細胞,B組為pCMV-AD-GFP空質粒轉染組,C組為單純BMP-9轉染組,D組為單純EPO轉染組,E組為BMP-9/EPO共轉染組。取第3代ADSCs,以5×104個/cm2密度接種于6孔板,待細胞達80%貼壁時,根據分組進行相應處理。其中A組加入含10%FBS的DMEM培養基,B組采用不添加目的基因的空質粒轉染,C、D組分別加入最佳MOI的BMP-9重組腺病毒和EPO重組腺病毒,E組同時加入最佳MOI的BMP-9、EPO重組腺病毒。于37℃、5%CO2培養箱中培養24 h后更換新鮮培養液。
1.5 觀測指標
1.5.1 細胞轉染觀察
①病毒轉染效率檢測:培養7 d后倒置相差顯微鏡下觀察細胞生長情況。培養14?d后各組細胞用0.25%胰蛋白酶消化,吹打形成單個細胞,PBS清洗5 min后棄上清,再用PBS重新清洗2次,熒光顯微鏡下觀察。成功轉染細胞呈綠色或紅色熒光表達。培養48?h時取各組細胞于100倍鏡下隨機取10個視野,計數熒光表達細胞數,并計算轉染效率:熒光表達細胞數/同視野下細胞總數×100%。
②Western blot檢測BMP-9和EPO蛋白表達:取各組培養14 d細胞,PBS清洗后采用Western blot細胞蛋白提取試劑盒CelLyticTM NuCLEARTM Extraction Kit提取蛋白,檢測蛋白含量。根據待測蛋白相對分子質量常規配膠、轉膜及封閉后孵育,最后配置發光液,暗室中進行顯影定影。以GAPDH作為內參,蛋白分析軟件掃描各條帶吸光度(A)值,以BMP-9和EPO蛋白與內參A值比值作為目的蛋白相對表達量。實驗重復3次。
1.5.2 成骨誘導培養觀察
取各組轉染培養14 d細胞,更換成骨誘導液進行成骨誘導培養。①茜素紅染色觀察:誘導培養3周取各組細胞行茜素紅染色,倒置相差顯微鏡下觀察鈣結節形成情況。每組取10張切片,每張切片取6個視野,于200倍鏡下計數鈣結節,取均數。②ALP活性檢測:誘導培養3、7、14 d,取各組細胞以1×106個/孔密度接種于6孔板,參照ALP活性檢測試劑盒說明,于酶聯免疫檢測儀波長520 nm處測量A值。實驗重復3次。③實時熒光定量PCR檢測:誘導培養3周取各組細胞,PBS清洗,根據試劑盒說明提取細胞總RNA,反轉錄成cDNA后進行熒光定量PCR擴增,檢測骨橋蛋白(osteopontin,OPN)、骨鈣素(osteocalcin,OCN)相對表達量。實驗重復3次。引物序列見表 1。
1.6 統計學方法
采用SPSS13.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;檢驗水準α=0.05。
2 結果
2.1 ADSCs形態學觀察及鑒定
原代細胞接種后多呈圓形,大小不一,散在分布,懸浮于培養液;約2周后細胞基本融合,細胞之間相互重疊,排列緊密,呈紡錘形。第3代細胞呈梭形旋渦狀生長,形態均一。經成骨及成脂誘導后,細胞可以形成鈣結節和脂肪顆粒,符合干細胞多向誘導分化的特性。見圖 1。
 圖1
ADSCs形態學觀察及鑒定 ? 第3代ADSCs(倒置相差顯微鏡×100) ? 成骨誘導培養(茜素紅染色×300) ? 成脂誘導培養(油紅O染色×100) 圖 2轉染培養7 d各組倒置相差顯微鏡下細胞形態(×300) ? A組 ? B組 ? C組 ? D組 ? E組
Figure1.
Morphology observation and indentification of ADSCs ? The 3rd generation ADSCs (Inverted phase contrast microscope×100) ? Osteogenic culture (Alizarin red staining×300) ? Adipogenic culture (Oil red O staining×100) Fig. 2 Cell morphology under inverted phase contrast microscope at 7 days after transfected (×300) ? Group A ? Group B ? Group C ? Group D ? Group E
圖1
ADSCs形態學觀察及鑒定 ? 第3代ADSCs(倒置相差顯微鏡×100) ? 成骨誘導培養(茜素紅染色×300) ? 成脂誘導培養(油紅O染色×100) 圖 2轉染培養7 d各組倒置相差顯微鏡下細胞形態(×300) ? A組 ? B組 ? C組 ? D組 ? E組
Figure1.
Morphology observation and indentification of ADSCs ? The 3rd generation ADSCs (Inverted phase contrast microscope×100) ? Osteogenic culture (Alizarin red staining×300) ? Adipogenic culture (Oil red O staining×100) Fig. 2 Cell morphology under inverted phase contrast microscope at 7 days after transfected (×300) ? Group A ? Group B ? Group C ? Group D ? Group E
2.2 細胞轉染觀察
轉染培養7 d,倒置相差顯微鏡觀察示A、B組部分細胞變為橢圓形、圓形和不規則形;C、D組可見少量長梭形細胞;E組長梭形細胞明顯增多,僅見少量圓形細胞。見圖 2。48 h后B、C、D、E組病毒轉染效率為80%~93%。14 d時熒光顯微鏡觀察示A組細胞內無熒光表達,C組可見紅色熒光表達,B、D組可見綠色熒光表達,E組同時可見紅色、綠色熒光,提示重組腺病毒成功轉染細胞。見圖 3。
 圖3
轉染培養14 d各組熒光顯微鏡觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200) 圖 4誘導培養3周各組茜素紅染色觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200)
Figure3.
Fluorescence microscope observation in each group at 14 days after transfected ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200) Fig. 4 Alizarin red staining observation in each group at 3 weeks after osteogenic induction ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200)
圖3
轉染培養14 d各組熒光顯微鏡觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200) 圖 4誘導培養3周各組茜素紅染色觀察 ? A組(×100) ? B組(×200) ? C組(×200) ? D組(×200) ? E組(×200)
Figure3.
Fluorescence microscope observation in each group at 14 days after transfected ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200) Fig. 4 Alizarin red staining observation in each group at 3 weeks after osteogenic induction ? Group A (×100) ? Group B (×200) ? Group C (×200) ? Group D (×200) ? Group E (×200)
2.3 Western blot檢測
E組BMP-9蛋白相對表達量較其他組明顯增高,C組高于A、B、D組,D組高于A、B組,比較差異有統計學意義(P < 0.05);E組EPO蛋白相對表達量較其他組明顯增高,D組高于A、B、C組,C組高于A、B組,比較差異有統計學意義(P < 0.05)。見表 2。
2.4 成骨誘導培養觀察
2.4.1 茜素紅染色
成骨誘導培養3周,倒置相差顯微鏡觀察示A、B組有鈣鹽沉積,但鈣結節少有形成或不明顯;C、D組鈣鹽沉積均較明顯,形成的鈣結節較大,C組優于D組;E組鈣鹽沉積與鈣結節形成較其他4組更為明顯。見圖 4。A、B、C、D、E組鈣結節數分別為(7.33±0.13)、(6.67±0.26)、(13.67±0.65)、(12.00±0.42)、(22.67±0.73)個,C、D、E組鈣結節數顯著多于A、B組,E組多于C、D組,C組多于D組,比較差異均有統計學意義(P < 0.05)。
2.4.2 ALP活性檢測
成骨誘導培養3、7、14 d時各組細胞胞質ALP染色均呈陽性反應。E組A值顯著高于其余各組,C、D組高于A、B組,D組高于C組,比較差異均有統計學意義(P < 0.05)。見表 3。
2.4.3 實時熒光定量PCR檢測
誘導培養3周時,E組OPN和OCN基因相對表達量較其他組明顯增高,C、D組高于A、B組,比較差異有統計學意義(P < 0.05)。C組OPN基因相對表達量高于D組,OCN低于D組,但差異無統計學意義(P > 0.05)。見表 4。
3 討論
骨形成是一個復雜過程,骨形成開始和骨細胞增殖必須具備3個條件:誘導刺激、具備有分化能力的間充質細胞、利于骨形成的體內環境[10-11]。骨前體細胞分化與ALP、OCN、OPN、中心結合因子等的形成密切相關。BMP和EPO均是特殊的骨生長因子,在一定條件下可以誘導未分化間葉細胞、骨髓中的骨母細胞分化成軟骨細胞和成骨細胞,進而誘導軟骨和骨形成[12-14]。BMP-9是目前已知的BMP家族中誘導成骨作用最強因子之一,有望作為促進細胞成骨分化的細胞因子替代品用于臨床[15-16]。本實驗Western blot檢測分析,E組細胞經雙基因共轉染后BMP-9蛋白相對表達量明顯優于其他各組,C、D組高于A、B組,提示E組促進ADSCs體外成骨作用最明顯。EPO是一種小分子糖蛋白感應激素,參與調節許多細胞的生長發育過程,能促進血管再生和神經發育等[17-18]。EPO可以活化造血干細胞中的JAK/STAT信號,誘導BMP的產生并可直接作用于BMSCs誘導成骨細胞表型,增加Runx2、Ⅰ型膠原和ALP等成骨細胞相關基因的表達[19]。ADSCs表型和BMSCs表型大致相同,提示EPO也可以促進ADSCs成骨。本實驗ALP活性檢測和茜素紅染色結果提示,D組細胞經EPO基因轉染后ALP活性及鈣結節數均顯著高于A、B對照組,進一步驗證了EPO在ADSCs體外成骨過程中具有促進作用。
成骨過程中需要大量BMP,但在臨床研究和治療骨性疾病中若大量使用BMP,價格較為昂貴[20]。為此,本實驗利用BMP-9促進ADSCs成骨分化和EPO促進ADSCs增殖遷移和成骨的特點,將BMP-9和EPO基因共轉染ADSCs以獲得穩定表達,達到一方面降低BMP蛋白用量,另一方面通過ADSCs成骨分化直接參與新骨形成的目的。對于組織工程骨的構建,種子細胞和支架材料的篩選非常重要。本實驗培養的ADSCs在細胞培養和傳代過程中均表現出較好的生長和分化能力,轉染BMP-9和EPO基因后檢測轉染率較高,具備良好種子細胞的特點。茜素紅染色及ALP活性檢測是觀察細胞成骨分化的常用檢測指標,本實驗對體外成骨誘導后的細胞也進行了以上觀測,結果顯示E組ALP活性和鈣結節數最優,而C、D組高于A、B組。實時熒光定量PCR檢測亦發現E組OPN、OCN基因表達明顯高于其他各組,而C、D組也高于A、B組。提示采用重組腺病毒介導目的基因轉染方法能有效促進體外培養ADSCs的成骨分化,雙基因共轉染促進細胞成骨作用優于單基因轉染。
綜上述,本實驗通過將BMP-9和EPO基因聯合轉染ADSCs獲得二者的穩定表達,且觀測結果提示BMP-9和EPO基因在促進ADSCs成骨分化方面具有協同作用。但關于BMP-9、EPO最佳比例和共轉染后相關信號通路尚不十分清楚,有待進一步研究。