引用本文: 夏德林, 黃銘柯, 付光新, 馬征, 吳雙江, 周航宇. Triton X-100對脂質體介導的BMP-2基因轉染大鼠BMSCs的作用. 中國修復重建外科雜志, 2015, 29(1): 69-73. doi: 10.7507/1002-1892.20150016 復制
隨著基因工程與組織工程技術迅速發展,應用基因治療技術將分泌成骨誘導因子的目的基因導入靶細胞,在局部持續、穩定釋放內源性細胞因子,促進成骨成為研究熱點[1]。高效率轉染是提高成骨效率的關鍵。目前國內外對陽離子脂質體的研究較多,但均面臨共同難題,即轉染效率低。Triton X-100,中文名為曲拉通,是一種非離子型去垢劑,可以提高真核細胞細胞膜的通透性,促進抗原等大分子進入細胞內。我們嘗試采用Triton X-100來提高BMSCs的通透性,以增加脂質體介導的BMP-2轉染效率。報告如下。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8周齡 Wistar大鼠1只,雄性,體質量120 g,由瀘州醫學院實驗動物中心提供。DH5α大腸桿菌購自長沙贏瑞生物科技有限公司。質粒BMP-2由長沙贏瑞生物科技有限公司構建。Lipofect2000脂質體(Invitrogen公司,美國);質粒提取試劑盒、Triton X-100、PCR引物(上海生工生物工程股份有限公司);TaKaRa ExscriptTMRT-PCR試劑盒(大連寶生物工程有限公司)。倒置熒光顯微鏡(Olympus公司,日本);ABl9700PCR擴增儀(上海宏潤醫療設備有限公司);ABl9700熒光PCR定量擴增儀(Applied Biosystems 公司,美國);紫外可見分光光度計(上海元析儀器有限公司)。
1.2 實驗方法
1.2.1 大鼠BMSCs分離培養及鑒定
無菌條件下取Wistar大鼠股骨、脛骨骨髓,采用貼壁培養法分離培養BMSCs[2]。2周左右貼壁細胞基本長滿單層,即得到原代細胞。按1∶3或1∶4比例分瓶傳代培養,倒置顯微鏡觀察BMSCs形態變化。取生長狀態良好的細胞,制備細胞懸液,調整細胞濃度為1×107/ L。取細胞懸液,于離心半徑15 cm、2 000 轉 / min離心10 min,棄上清,分別加入抗CD34、CD45、CD44于樣品管中,混勻后避光室溫孵育30 min。經PBS洗滌2次后與FITC標記的二抗避光反應15 min,流式細胞儀檢測細胞表面標志CD34、CD45、CD44表達。
1.2.2 質粒擴增和提取
按照文獻[3-4]方法進行質粒擴增和提取。大腸桿菌菌種復蘇、劃盤,37℃培養過夜。挑取單克隆接種于5 mL LB液體培養基,恒溫振蕩器上37℃、200轉 / min振蕩12~16 h。取100 μL感受態細胞,加入DNA 1 μL (25 ng),混勻。冰上放置30 min,冰浴2 min。每管加400 μL LB液體培養基,于37℃培養1 h。將已轉化的感受態細胞涂在含有氨芐青霉素 (100 mg/ mL)的培養皿中。倒置平皿,37℃培養過夜(12~16 h),挑取單菌落,接種于2.0 mL LB液體培養基(含氨芐青霉素),37℃、250 × g振蕩培養過夜(12~14 h)。取1.5 mL菌液室溫10 000 × g離心1 min,棄上清。將細菌沉淀重懸于100 μL預冷的溶液Ⅰ(含RNase A)中,劇烈振蕩,使菌體分散混勻。加200 μL新鮮配制的溶液Ⅱ,顛倒數次混勻,并將離心管放置于冰上2~3 min,使細胞膜裂解。加350 μL溶液Ⅲ,溫和顛倒數次混合,至出現白色絮狀沉淀,室溫10 000 × g離心10 min。移上清至微量離心管中,加入2.5倍體積預冷的無水乙醇,混勻,室溫放置2 min,4℃、12 000 × g離心15 min。1 mL預冷的70%乙醇洗滌沉淀1~2 次,4℃、8 000 × g離心7 min,棄上清,將沉淀于室溫晾干。沉淀溶于20 μL TE(含RNase A 20 μg/ mL),37℃水浴30 min以降解RNA分子,- 20℃保存備用。取1 μL提取的質粒樣品行瓊脂糖凝膠電泳。
1.2.3 篩選Triton X-100適宜濃度
取第3代BM SCs,以細胞密度103~104個/孔(100~200 μL)接種至96孔板,37℃、5%CO2孵箱中培養過夜,次日換液。逐孔加入用含血清培養基調配的不同濃度(0%、0.001%、0.005%、0.010%、0.050%、0.100%、0.500%、1.000%)Triton X-100。配制方法:以0.100%濃度為例,孔中加入900 μL含血清培養基和100 μL1% Triton X-100。同時設置調零孔(培養基、MTT、二甲基亞砜),對照孔(細胞、相同濃度的藥物溶解介質、培養液、MTT、二甲基亞砜)。加入5% MTT 10~20 μL/ 孔,培養4~24 h,棄培養液,加入DMSO 150 μL/孔,震蕩5~10 min。于酶聯免疫檢測儀490 nm波長處檢測各孔吸光度(A)值。以Tri ton X-100濃度為橫坐標,A值為縱坐標,繪制曲線。
1.2.4 脂質體介導BMP-2基因轉染BMSCs
實驗分3組:實驗組、常規轉染組以及空白對照組。實驗組:BMP-2+脂質體+0.010% Triton X-100+BMSCs,按Lipofect2000說明書操作步驟進行轉染;常規轉染組:BMP-2+脂質體+BMSCs,轉染步驟同實驗組;空白對照組:BMSCs+血清培養基。
將第3代BMSCs以細胞密度(1~3)×105接種至6孔板,加入1 mL完全培養基,孵箱中培養過夜。待細胞生長至50%~80%融合時,準備轉染。轉染前4 h,每孔更換新鮮培養基,加轉染液。轉染前分別用無血清培養基稀釋2 μg質粒,定容至100 μL,稀釋25 μL Lipofect2000,定容至100 μL。上述兩種溶液混勻30 min后,滴加至含800 μL無血清培養基的培養孔中,總量1 000 μL。將脂質體復合物滴加至含750 μL無血清培養基的培養孔,混勻,加入50 μL 1%Triton X-100混勻。置于5%CO2、37℃孵育箱中培養。6 h后完全培養基換液,停止轉染。
1.2.5 觀測指標
① 倒置熒光顯微鏡觀察:轉染48 h,倒置熒光顯微鏡下觀察各組綠色熒光蛋白表達情況。② 實時熒光定量PCR檢測BMP-2 mRNA表達:轉染72 h,實驗組和常規轉染組行實時熒光定量PCR檢測。采用相對定量2-△△Ct法檢測目的基因表達,即△△CT=CT目的基因-CT管家基因;△△CT=實驗組(CT目的基因-CT管家基因)-常規轉染組(CT目的基因-CT 管家基因);目的基因相對總量為F=2-△△Ct。在ABI9700熒光PCR 系統行實時熒光定量PCR反應,系統將自動記錄熒光曲線并計算CT值。CT值是指每個反應管內熒光信號達到設定閡值時所經歷的循環數,CT值與BMP-2 mRNA表達水平成負相關,即CT值增加表示BMP-2 mRNA表達水平下降。由于空白對照組未見熒光表達,故未作相關檢測。
1.3 統計學方法
采用SAS16.0 統計軟件進行分析。數據以均數 ±標準差表示,組間比較采用方差分析,兩兩比較采用SNK 檢驗;檢驗水準α=0.05。
2 結果
2.1 BMSCs培養
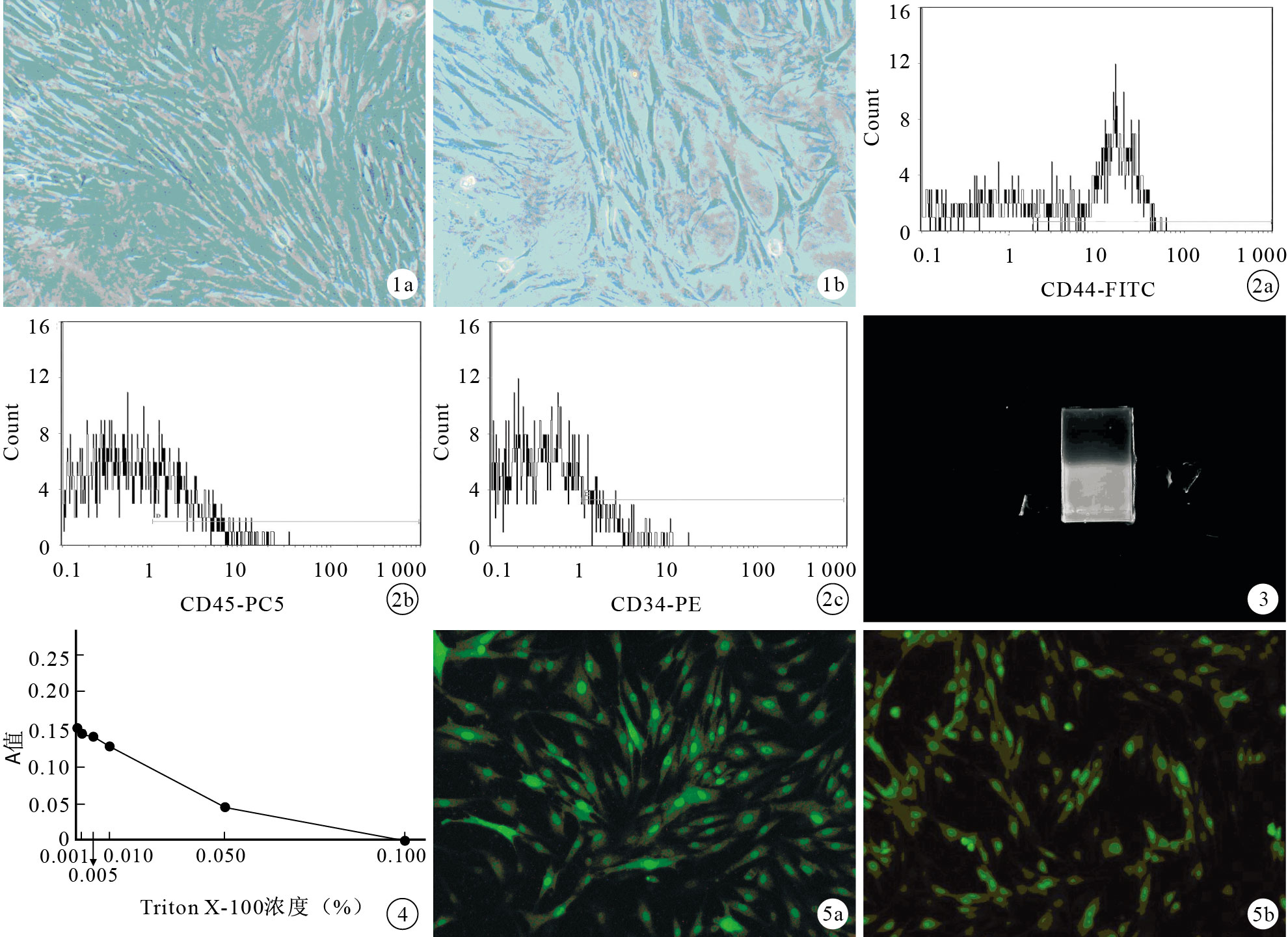
BMSCs培養24 h,細胞開始貼壁,胞體呈圓形或多邊形。培養3 d,貼壁細胞胞體明顯增大并開始分裂增殖,此時細胞形態漸變為梭形或紡錘形,呈成纖維細胞樣生長,形成大小不一的集落。培養5 d,貼壁BMSCs呈脊梁狀、魚群狀、漩渦狀、網狀或輻射狀排列,細胞分裂增殖十分明顯,胞漿豐富,核大,呈橢圓形。培養7 d,細胞長滿培養瓶底80%~90%并融合,開始傳代。傳至第3~4代,細胞呈長梭形(圖 1)。流式細胞儀檢測顯示,培養細胞CD44陽性表達,而CD34、CD45呈陰性表達(圖 2)。
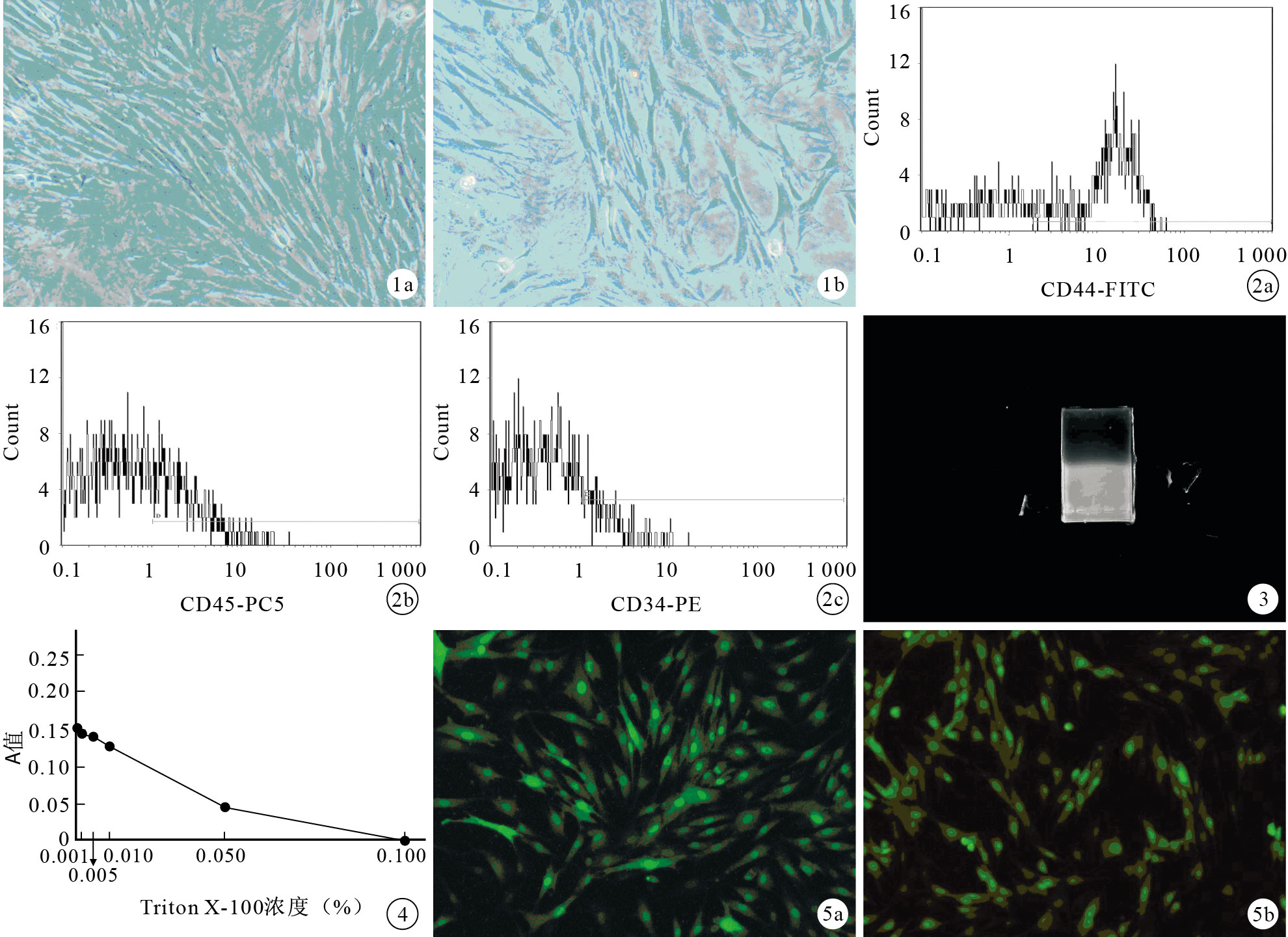 圖1
BMSCs形態學觀察(倒置顯微鏡×100) ? 第3代細胞 ? 第4代細胞 ? ?
圖1
BMSCs形態學觀察(倒置顯微鏡×100) ? 第3代細胞 ? 第4代細胞 ? ?2.2 質粒BMP-2擴增
經質粒提取試劑盒提取后,質粒BMP-2總量達1 000 μL,濃度為0.2 μg/μL,能夠滿足轉染需要。將提取質粒經瓊脂糖凝膠電泳鑒定,出現超螺旋條帶,表明提取的質粒純度高(圖 3)。
2.3 Triton X-100適宜濃度篩選
不同濃度Triton X-100作用后,MTT檢測結果見圖 4。0.001%~0.010% Triton X-100 A值差異無統計學意義(P>0.05),Triton X-100濃度大于0.050%時,A值差異有統計學意義(P<0.05)。因此0.010%Triton X-100既能使BMSCs保持一定活力,又能促進細胞膜表面的DNA-脂質體復合物被細胞內吞提高轉染效率,故確定其為適宜濃度。
2.4 倒置熒光顯微鏡觀察
轉染48 h后,倒置熒光顯微鏡下見常規轉染組和實驗組均有綠色熒光蛋白表達(圖 5),空白對照組無綠色熒光蛋白表達。
2.5 實時熒光定量PCR檢測
轉染后72 h,實驗組BMP-2 mRNA相對表達量為5.94±0.12;常規轉染組為4.99±0.08,差異有統計學意義(t=360.28,P=0.02)。實驗組轉染效率較常規轉染組平均提高了19%。
3 討論
基因治療是指通過載體將核苷酸轉入體內以達到治療目的。將外源基因引入細胞時,DNA會被體內的核酸酶降解,在未進入靶細胞,甚至未到達靶器官時便被降解成小分子核苷酸,從而失去治療作用。因此基因治療的關鍵在于選擇合適的載體將外源基因有效保護,并完成穿膜入胞-入核-表達這一完整過程[5-6]。目前基因治療載體分為病毒載體和非病毒載體兩大類。非病毒載體中脂質體以其免疫原性和細胞毒性低、與外源基因結合能力強、可大規模制備等特點,被廣泛應用于基因治療研究中[7-8]。提高脂質體轉染效率是有效應用脂質體載體的關鍵。已有較多提高脂質體轉染效率的研究,如在脂質體聚合物中引入非離子型親水基團、可降解基團或引入內涵體破壞基團,來促進基因傳輸,進而提高轉染效率[9-13]。這些方法存在的共同缺點在于制作復雜,可控性不強,大多尚處于實驗探索階段。目前認為脂質體轉染機制是:脂質體表面帶正電茼,能通過靜電作用將帶負電的DNA分子包裹,形成DNA-脂質體復合物。后者表面仍有富余的正電荷,能被表面帶負電的細胞膜吸附,再通過細胞內吞或膜融合方式,將DNA導入細胞內,形成包涵體進入溶酶體。其中部分DNA能從包涵體內釋放,進入細胞質,再進入核內轉錄、表達[14-17]。因此,DNA-脂質體復合物進入細胞內是實現轉染的關鍵步驟。
Triton X-100是一種無離子除垢劑,能改變細胞膜脂類結構,提高細胞膜通透性,促進抗原等大分子進入細胞[18-20]。因此嘗試用Triton X-100在細胞膜上打孔,提高細胞膜的通透性,以促進DNA-脂質體復合物進入BMSCs,從而提高基因的轉染效率。我們的研究表明,Triton X-100可以促進脂質體介導的BMP-2基因轉染BMSCs,轉染效率平均提高了19%。其機制可能為Triton X-100的聚乙二醇辛基苯基醚因具有溶解脂質體與細胞膜上脂類物質的能力,從而促進因靜電作用貼附于細胞膜表面的DNA-脂質體復合物被細胞內吞,或直接因膜之間的融合提高轉染效率[21-22]。與既往方法相比,本法具有操作簡便,成本低廉的優點。
在研究Triton X-100對基因轉染影響時,需要確定Triton X-100的適宜濃度。在免疫組織化學中,Triton X-100處理細胞的濃度是0.1%~0.5%,能夠有效提高細胞膜通透性,以促進抗原等大分子物質進入細胞,同時又能很好保持細胞完整性[18-22]。但是免疫組織化學處理的對象是已經死亡的細胞,而基因轉染時的細胞是活細胞,高濃度Triton X-100可作為裂解液殺死細胞,所以確定Triton X-100適宜濃度是實驗第一步。我們的研究表明,0.010%Triton X-100既能使BMSCs保持一定活力,又能促進細胞膜表面的DNA-脂質體復合物被細胞內吞提高轉染效率,故確定其為適宜濃度。但該濃度對細胞生長有何影響,是否為最佳濃度仍需進一步研究。
隨著基因工程與組織工程技術迅速發展,應用基因治療技術將分泌成骨誘導因子的目的基因導入靶細胞,在局部持續、穩定釋放內源性細胞因子,促進成骨成為研究熱點[1]。高效率轉染是提高成骨效率的關鍵。目前國內外對陽離子脂質體的研究較多,但均面臨共同難題,即轉染效率低。Triton X-100,中文名為曲拉通,是一種非離子型去垢劑,可以提高真核細胞細胞膜的通透性,促進抗原等大分子進入細胞內。我們嘗試采用Triton X-100來提高BMSCs的通透性,以增加脂質體介導的BMP-2轉染效率。報告如下。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8周齡 Wistar大鼠1只,雄性,體質量120 g,由瀘州醫學院實驗動物中心提供。DH5α大腸桿菌購自長沙贏瑞生物科技有限公司。質粒BMP-2由長沙贏瑞生物科技有限公司構建。Lipofect2000脂質體(Invitrogen公司,美國);質粒提取試劑盒、Triton X-100、PCR引物(上海生工生物工程股份有限公司);TaKaRa ExscriptTMRT-PCR試劑盒(大連寶生物工程有限公司)。倒置熒光顯微鏡(Olympus公司,日本);ABl9700PCR擴增儀(上海宏潤醫療設備有限公司);ABl9700熒光PCR定量擴增儀(Applied Biosystems 公司,美國);紫外可見分光光度計(上海元析儀器有限公司)。
1.2 實驗方法
1.2.1 大鼠BMSCs分離培養及鑒定
無菌條件下取Wistar大鼠股骨、脛骨骨髓,采用貼壁培養法分離培養BMSCs[2]。2周左右貼壁細胞基本長滿單層,即得到原代細胞。按1∶3或1∶4比例分瓶傳代培養,倒置顯微鏡觀察BMSCs形態變化。取生長狀態良好的細胞,制備細胞懸液,調整細胞濃度為1×107/ L。取細胞懸液,于離心半徑15 cm、2 000 轉 / min離心10 min,棄上清,分別加入抗CD34、CD45、CD44于樣品管中,混勻后避光室溫孵育30 min。經PBS洗滌2次后與FITC標記的二抗避光反應15 min,流式細胞儀檢測細胞表面標志CD34、CD45、CD44表達。
1.2.2 質粒擴增和提取
按照文獻[3-4]方法進行質粒擴增和提取。大腸桿菌菌種復蘇、劃盤,37℃培養過夜。挑取單克隆接種于5 mL LB液體培養基,恒溫振蕩器上37℃、200轉 / min振蕩12~16 h。取100 μL感受態細胞,加入DNA 1 μL (25 ng),混勻。冰上放置30 min,冰浴2 min。每管加400 μL LB液體培養基,于37℃培養1 h。將已轉化的感受態細胞涂在含有氨芐青霉素 (100 mg/ mL)的培養皿中。倒置平皿,37℃培養過夜(12~16 h),挑取單菌落,接種于2.0 mL LB液體培養基(含氨芐青霉素),37℃、250 × g振蕩培養過夜(12~14 h)。取1.5 mL菌液室溫10 000 × g離心1 min,棄上清。將細菌沉淀重懸于100 μL預冷的溶液Ⅰ(含RNase A)中,劇烈振蕩,使菌體分散混勻。加200 μL新鮮配制的溶液Ⅱ,顛倒數次混勻,并將離心管放置于冰上2~3 min,使細胞膜裂解。加350 μL溶液Ⅲ,溫和顛倒數次混合,至出現白色絮狀沉淀,室溫10 000 × g離心10 min。移上清至微量離心管中,加入2.5倍體積預冷的無水乙醇,混勻,室溫放置2 min,4℃、12 000 × g離心15 min。1 mL預冷的70%乙醇洗滌沉淀1~2 次,4℃、8 000 × g離心7 min,棄上清,將沉淀于室溫晾干。沉淀溶于20 μL TE(含RNase A 20 μg/ mL),37℃水浴30 min以降解RNA分子,- 20℃保存備用。取1 μL提取的質粒樣品行瓊脂糖凝膠電泳。
1.2.3 篩選Triton X-100適宜濃度
取第3代BM SCs,以細胞密度103~104個/孔(100~200 μL)接種至96孔板,37℃、5%CO2孵箱中培養過夜,次日換液。逐孔加入用含血清培養基調配的不同濃度(0%、0.001%、0.005%、0.010%、0.050%、0.100%、0.500%、1.000%)Triton X-100。配制方法:以0.100%濃度為例,孔中加入900 μL含血清培養基和100 μL1% Triton X-100。同時設置調零孔(培養基、MTT、二甲基亞砜),對照孔(細胞、相同濃度的藥物溶解介質、培養液、MTT、二甲基亞砜)。加入5% MTT 10~20 μL/ 孔,培養4~24 h,棄培養液,加入DMSO 150 μL/孔,震蕩5~10 min。于酶聯免疫檢測儀490 nm波長處檢測各孔吸光度(A)值。以Tri ton X-100濃度為橫坐標,A值為縱坐標,繪制曲線。
1.2.4 脂質體介導BMP-2基因轉染BMSCs
實驗分3組:實驗組、常規轉染組以及空白對照組。實驗組:BMP-2+脂質體+0.010% Triton X-100+BMSCs,按Lipofect2000說明書操作步驟進行轉染;常規轉染組:BMP-2+脂質體+BMSCs,轉染步驟同實驗組;空白對照組:BMSCs+血清培養基。
將第3代BMSCs以細胞密度(1~3)×105接種至6孔板,加入1 mL完全培養基,孵箱中培養過夜。待細胞生長至50%~80%融合時,準備轉染。轉染前4 h,每孔更換新鮮培養基,加轉染液。轉染前分別用無血清培養基稀釋2 μg質粒,定容至100 μL,稀釋25 μL Lipofect2000,定容至100 μL。上述兩種溶液混勻30 min后,滴加至含800 μL無血清培養基的培養孔中,總量1 000 μL。將脂質體復合物滴加至含750 μL無血清培養基的培養孔,混勻,加入50 μL 1%Triton X-100混勻。置于5%CO2、37℃孵育箱中培養。6 h后完全培養基換液,停止轉染。
1.2.5 觀測指標
① 倒置熒光顯微鏡觀察:轉染48 h,倒置熒光顯微鏡下觀察各組綠色熒光蛋白表達情況。② 實時熒光定量PCR檢測BMP-2 mRNA表達:轉染72 h,實驗組和常規轉染組行實時熒光定量PCR檢測。采用相對定量2-△△Ct法檢測目的基因表達,即△△CT=CT目的基因-CT管家基因;△△CT=實驗組(CT目的基因-CT管家基因)-常規轉染組(CT目的基因-CT 管家基因);目的基因相對總量為F=2-△△Ct。在ABI9700熒光PCR 系統行實時熒光定量PCR反應,系統將自動記錄熒光曲線并計算CT值。CT值是指每個反應管內熒光信號達到設定閡值時所經歷的循環數,CT值與BMP-2 mRNA表達水平成負相關,即CT值增加表示BMP-2 mRNA表達水平下降。由于空白對照組未見熒光表達,故未作相關檢測。
1.3 統計學方法
采用SAS16.0 統計軟件進行分析。數據以均數 ±標準差表示,組間比較采用方差分析,兩兩比較采用SNK 檢驗;檢驗水準α=0.05。
2 結果
2.1 BMSCs培養
BMSCs培養24 h,細胞開始貼壁,胞體呈圓形或多邊形。培養3 d,貼壁細胞胞體明顯增大并開始分裂增殖,此時細胞形態漸變為梭形或紡錘形,呈成纖維細胞樣生長,形成大小不一的集落。培養5 d,貼壁BMSCs呈脊梁狀、魚群狀、漩渦狀、網狀或輻射狀排列,細胞分裂增殖十分明顯,胞漿豐富,核大,呈橢圓形。培養7 d,細胞長滿培養瓶底80%~90%并融合,開始傳代。傳至第3~4代,細胞呈長梭形(圖 1)。流式細胞儀檢測顯示,培養細胞CD44陽性表達,而CD34、CD45呈陰性表達(圖 2)。
 圖1
BMSCs形態學觀察(倒置顯微鏡×100) ? 第3代細胞 ? 第4代細胞 ? ?
圖1
BMSCs形態學觀察(倒置顯微鏡×100) ? 第3代細胞 ? 第4代細胞 ? ?2.2 質粒BMP-2擴增
經質粒提取試劑盒提取后,質粒BMP-2總量達1 000 μL,濃度為0.2 μg/μL,能夠滿足轉染需要。將提取質粒經瓊脂糖凝膠電泳鑒定,出現超螺旋條帶,表明提取的質粒純度高(圖 3)。
2.3 Triton X-100適宜濃度篩選
不同濃度Triton X-100作用后,MTT檢測結果見圖 4。0.001%~0.010% Triton X-100 A值差異無統計學意義(P>0.05),Triton X-100濃度大于0.050%時,A值差異有統計學意義(P<0.05)。因此0.010%Triton X-100既能使BMSCs保持一定活力,又能促進細胞膜表面的DNA-脂質體復合物被細胞內吞提高轉染效率,故確定其為適宜濃度。
2.4 倒置熒光顯微鏡觀察
轉染48 h后,倒置熒光顯微鏡下見常規轉染組和實驗組均有綠色熒光蛋白表達(圖 5),空白對照組無綠色熒光蛋白表達。
2.5 實時熒光定量PCR檢測
轉染后72 h,實驗組BMP-2 mRNA相對表達量為5.94±0.12;常規轉染組為4.99±0.08,差異有統計學意義(t=360.28,P=0.02)。實驗組轉染效率較常規轉染組平均提高了19%。
3 討論
基因治療是指通過載體將核苷酸轉入體內以達到治療目的。將外源基因引入細胞時,DNA會被體內的核酸酶降解,在未進入靶細胞,甚至未到達靶器官時便被降解成小分子核苷酸,從而失去治療作用。因此基因治療的關鍵在于選擇合適的載體將外源基因有效保護,并完成穿膜入胞-入核-表達這一完整過程[5-6]。目前基因治療載體分為病毒載體和非病毒載體兩大類。非病毒載體中脂質體以其免疫原性和細胞毒性低、與外源基因結合能力強、可大規模制備等特點,被廣泛應用于基因治療研究中[7-8]。提高脂質體轉染效率是有效應用脂質體載體的關鍵。已有較多提高脂質體轉染效率的研究,如在脂質體聚合物中引入非離子型親水基團、可降解基團或引入內涵體破壞基團,來促進基因傳輸,進而提高轉染效率[9-13]。這些方法存在的共同缺點在于制作復雜,可控性不強,大多尚處于實驗探索階段。目前認為脂質體轉染機制是:脂質體表面帶正電茼,能通過靜電作用將帶負電的DNA分子包裹,形成DNA-脂質體復合物。后者表面仍有富余的正電荷,能被表面帶負電的細胞膜吸附,再通過細胞內吞或膜融合方式,將DNA導入細胞內,形成包涵體進入溶酶體。其中部分DNA能從包涵體內釋放,進入細胞質,再進入核內轉錄、表達[14-17]。因此,DNA-脂質體復合物進入細胞內是實現轉染的關鍵步驟。
Triton X-100是一種無離子除垢劑,能改變細胞膜脂類結構,提高細胞膜通透性,促進抗原等大分子進入細胞[18-20]。因此嘗試用Triton X-100在細胞膜上打孔,提高細胞膜的通透性,以促進DNA-脂質體復合物進入BMSCs,從而提高基因的轉染效率。我們的研究表明,Triton X-100可以促進脂質體介導的BMP-2基因轉染BMSCs,轉染效率平均提高了19%。其機制可能為Triton X-100的聚乙二醇辛基苯基醚因具有溶解脂質體與細胞膜上脂類物質的能力,從而促進因靜電作用貼附于細胞膜表面的DNA-脂質體復合物被細胞內吞,或直接因膜之間的融合提高轉染效率[21-22]。與既往方法相比,本法具有操作簡便,成本低廉的優點。
在研究Triton X-100對基因轉染影響時,需要確定Triton X-100的適宜濃度。在免疫組織化學中,Triton X-100處理細胞的濃度是0.1%~0.5%,能夠有效提高細胞膜通透性,以促進抗原等大分子物質進入細胞,同時又能很好保持細胞完整性[18-22]。但是免疫組織化學處理的對象是已經死亡的細胞,而基因轉染時的細胞是活細胞,高濃度Triton X-100可作為裂解液殺死細胞,所以確定Triton X-100適宜濃度是實驗第一步。我們的研究表明,0.010%Triton X-100既能使BMSCs保持一定活力,又能促進細胞膜表面的DNA-脂質體復合物被細胞內吞提高轉染效率,故確定其為適宜濃度。但該濃度對細胞生長有何影響,是否為最佳濃度仍需進一步研究。