引用本文: 李揚, 黃巧容, 李雪, 曾婷婷, 朱煥玲, 孟文彤. 建立九色流式細胞術定量檢測血漿中不同來源微粒. 華西醫學, 2016, 31(12): 1989-1994. doi: 10.7507/1002-0179.201600546 復制
微粒是存在于血漿中的直徑為0.1~1.0 μm的膜性小囊[1],血小板、紅細胞、內皮細胞、單核細胞、粒細胞和淋巴細胞等受到活化或凋亡刺激時均可產生微粒,其具有促凝、促炎癥、促進血管生成和調節內皮功能等作用。不同來源的微粒與多種疾病的發生密切相關,如心血管疾病、腫瘤、糖尿病、免疫性疾病和感染等。抑制微粒產生,可作為特定疾病治療新策略[1-4]。分析微粒的類型及數量的變化,可為診斷疾病及治療監測提供一個潛在的和有用的工具[1]。檢測微粒的方法較多,不同實驗室的檢測方法也不盡相同,如電子顯微鏡、酶聯免疫吸附測定(ELISA)、蛋白質印跡法和流式細胞術等[2, 5-6]。近年來,流式細胞術逐漸成為檢測微粒的首選方法,但用多色流式細胞術同時檢測多種來源的微粒的報道少見,尚未見到使用多色流式細胞術同時檢測紅細胞、血小板、粒細胞、內皮細胞、單核細胞、B淋巴細胞和T淋巴細胞來源微粒的報道[4, 7]。我們建立了九色流式細胞術定量檢測血漿中不同來源微粒的方法。現報告如下。
1 材料與方法
1.1 一般資料
2014年12月-2015年1月收集10例正常成人的體檢標本,年齡20~35歲,男女比例1:1,無高血壓、高血脂、糖尿病及腫瘤性疾病史。另有2例糖尿病酮癥酸中毒患者作稀釋試驗用,均為男性,年齡分別為45和57歲。
1.2 材料
Annexin-V和細胞表面抗體CD235a、CD41a、CD45、CD34、CD66b、CD20、CD3和CD14,均購自美國BD公司(抗體染色方案見表 1)。平均直徑為10.0 μm的定量熒光微球(濃度1 045個/μL),購自美國Beckman Coulter公司;平均直徑分別為0.22、0.45、0.88、1.34 μm的系列標準直徑微球,直徑范圍分別為0.1~0.3 μm、0.4~0.6 μm、0.7~0.9 μm和1.0~1.9 μm,購自美國Spherotech公司。10×結合緩沖液(binding buffer),購自美國BD公司。
1.3 方法
1.3.1 標本收集
所有血液標本均為采集空腹靜脈血2.0 mL,枸櫞酸鈉抗凝。室溫條件下,2 500×g離心10 min,取上清液,2 500×g再次離心10 min,取上清液于塑料試管中,得到乏血小板血漿(PPP),-80℃冰箱凍存。
1.3.2 單色染色
正常人的PPP準備9管,其中第1管作為空白對照。每管取PPP 10.0 μL,加入Annexin-V和10×結合緩沖液各1.0 μL,充分混勻后室溫避光孵育10 min,然后按表 1方案在其中的8管中分別加入1種特異性抗體1.0 μL,空白對照管不加入特異性抗體,充分混勻后室溫避光孵育20 min,再加入1×結合緩沖液130 μL,充分混勻后上流式細胞儀檢測。分析時,利用前向散射FSA/Annexin-V設門,確定微粒群,對設門微粒取雙對數參數分析補償,并作相應調整。
1.3.3 缺一色染色
正常人PPP樣品準備8管,按照1.3.2中操作步驟分別加入表 1方案中缺1個抗體的染色后上機檢測。分析時,將缺一色染色與單色染色后各抗體的陽性微粒群比例進行比較,以該樣品的單色染色目的微粒群陽性比例為靶值,計算缺一色染色中目的微粒群陽性比例變化值,計算方法為:變化值(%)=(單色染色陽性比例-缺一色染色陽性比例)/單色染色陽性比例×100%。
1.3.4 標本檢測
取正常人PPP標本10.0 μL,加入Annexin-V和10×結合緩沖液各1.0 μL,充分混勻后室溫避光孵育10 min;按表 1方案加入各種特異性抗體各1.0 μL,充分混勻后室溫避光孵育20 min;加入1×結合緩沖液130 μL,再加入10.0 μL定量熒光微球(濃度1 045個/μL),充分混勻后上流式細胞儀(BD FACSAria)檢測,低速獲取至少記錄1.5×105個顆粒,用FACSDiva(BD)軟件分析數據。在每次實驗時,均有1管不加抗體,而加入PPP、Annexin-V和標準直徑微球(平均直徑分別為0.22、0.45、0.88和1.34 μm),用于直徑范圍設定微粒門區域。
1.3.5 檢測及分析
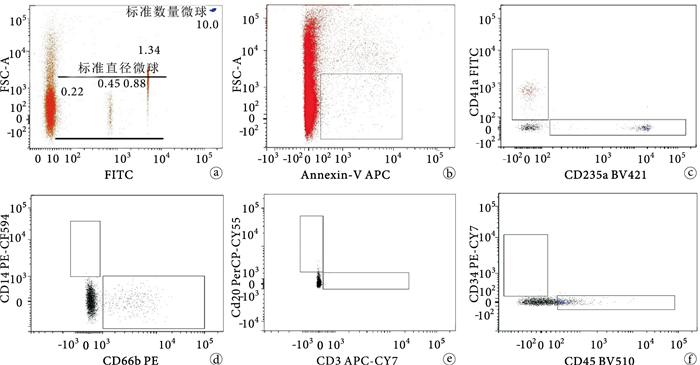
完成單色染色和缺一色染色,確定補償和電壓后,按照1.3.4中的操作步驟做正常人標本檢測。確定不同來源微粒的流式細胞術分析策略如下(圖 1):①用平均直徑分別為0.22、0.45、0.88、1.34 μm的標準直徑熒光微球設定前向檢測區,確定微粒大小(直徑0.1~1.0 μm);②以FSA/Annexin-V設門來確定微粒群;③微粒群中,以CD41a/CD235a設門分別確定血小板及紅細胞來源,CD14/CD66b設門分別確定單核細胞及粒細胞來源,CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源,CD34/CD45設門確定內皮細胞來源;④按照以下計算公式,分別計算不同來源微粒的絕對數:微粒絕對數(個/μL)=定量熒光微球濃度×不同來源熒光抗體陽性顆粒檢測值/血漿稀釋倍數×定量熒光微球檢測值。
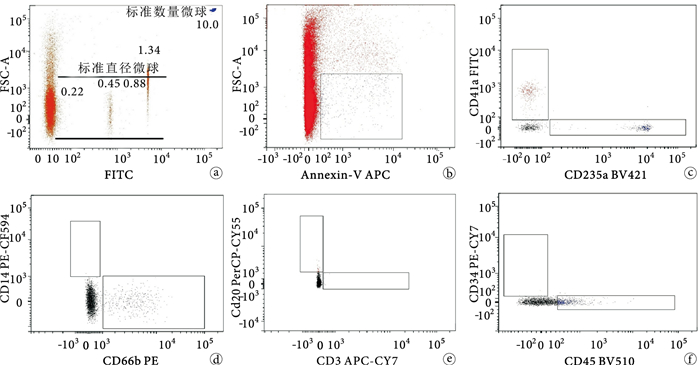 圖1
不同來源微粒流式分析策略 a.用標準直徑微球設定前向檢測區,確定微粒大小范圍;圖中右上角可見用于定量分析的直徑為10.0 μm的標準數量微球b. FSA/Annexin-V設門來確定微粒群c.微粒群中,CD41a/CD235a設門分別確定血小板及紅細胞來源微粒d. CD14/CD66b設門分別確定單核細胞及粒細胞來源微粒e. CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源微粒f. CD34/D45設門確定內皮細胞來源微粒
圖1
不同來源微粒流式分析策略 a.用標準直徑微球設定前向檢測區,確定微粒大小范圍;圖中右上角可見用于定量分析的直徑為10.0 μm的標準數量微球b. FSA/Annexin-V設門來確定微粒群c.微粒群中,CD41a/CD235a設門分別確定血小板及紅細胞來源微粒d. CD14/CD66b設門分別確定單核細胞及粒細胞來源微粒e. CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源微粒f. CD34/D45設門確定內皮細胞來源微粒
1.4 方法學評價
1.4.1 重復試驗
在相同的實驗條件下按1.3.4中步驟重復測定同一PPP標本10次,再按1.3.5中策略進行分析,求出各種不同來源微粒的濃度均數及變異系數。
1.4.2 稀釋試驗
篩選出血小板和紅細胞來源微粒濃度分別較高的2例糖尿病酮癥酸中毒患者PPP標本,其中血小板來源微粒濃度較高的PPP用磷酸鹽緩沖液連續對倍稀釋8個梯度(1/1,1/2,1/4,1/8,1/16,1/32,1/64,1/128),做血小板來源微粒稀釋試驗用;紅細胞來源微粒濃度較高的PPP標本用磷酸鹽緩沖液連續對倍稀釋5個梯度(1/1,1/2,1/4,1/8,1/16),做紅細胞來源微粒稀釋試驗用。按1.3.4中步驟上流式細胞儀檢測,再按1.3.5中策略進行分析,以PPP稀釋度為橫坐標,分別以血小板和紅細胞來源微粒濃度為縱坐標作圖。
2 結果
2.1 單色染色
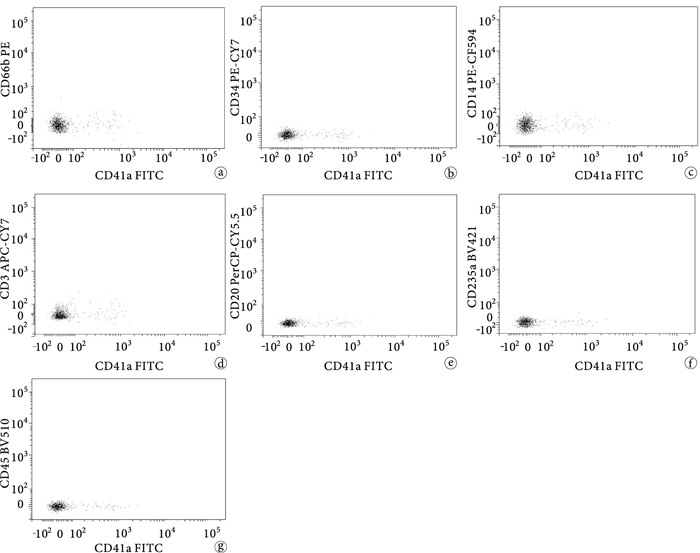
分別作了Annexin-V和8種抗體的單色染色,確定了檢測電壓并調節熒光補償,各熒光檢測通路間信號檢測無影響,見圖 2。
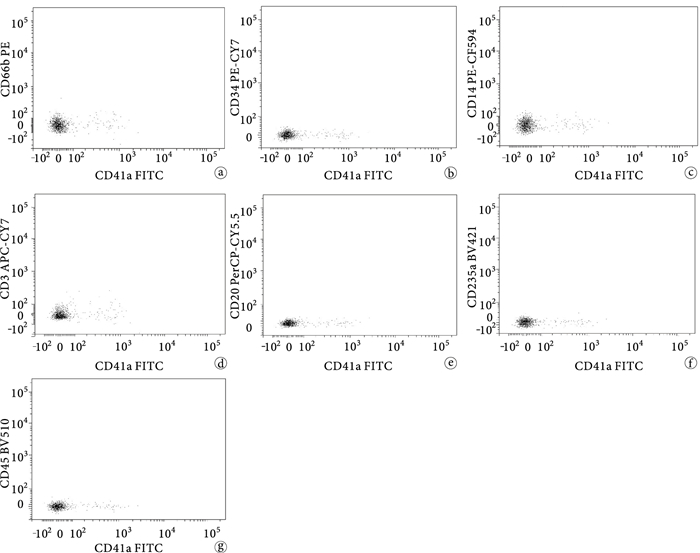 圖2
CD41a-FITC單色染色實驗 a~g.分別表示CD41a-FITC陽性微粒對PE、PE-Cy7、PE-CF594、PerCP-Cy5.5、APC-Cy7、BV421、BV510的熒光檢測通路的信號無影響
圖2
CD41a-FITC單色染色實驗 a~g.分別表示CD41a-FITC陽性微粒對PE、PE-Cy7、PE-CF594、PerCP-Cy5.5、APC-Cy7、BV421、BV510的熒光檢測通路的信號無影響
2.2 缺一色染色
比較了3例正常成人的PPP標本分別用8種抗體單色染色及缺一色染色中的陽性微粒群比例變化(表 2),其中CD41a為(2.2±1.1)%,變化最小,變化較大的是CD3和CD14,分別為(12.1±2.7)%和(12.7±0.8)%,但這些變化均<15%,表明方案中使用的各抗體的相互作用小。
2.3 檢測并分析標本
檢測10例正常成人的PPP標本,分別計算出標本不同來源微粒的濃度均數及實際檢測范圍。見表 3。
2.4 方法學評價
2.4.1 重復試驗
紅細胞、血小板和粒細胞來源微粒的變異系數均<10%;內皮細胞、單核細胞、B淋巴細胞及T淋巴細胞來源微粒的變異系數均>10%,但均<20%,體現了其具有較好的穩定性。見表 4。
2.4.2 稀釋試驗
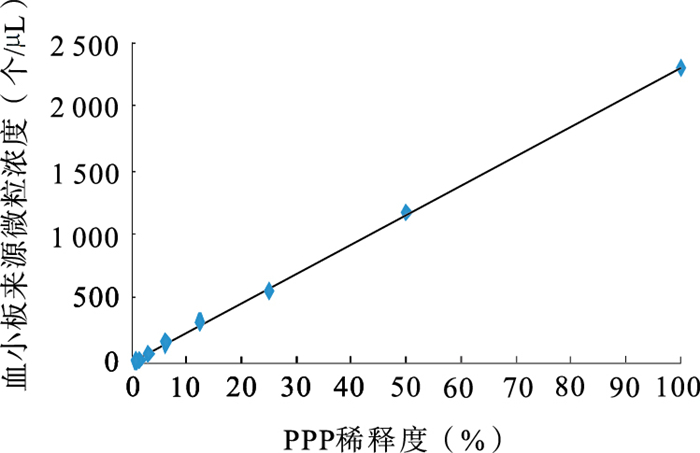
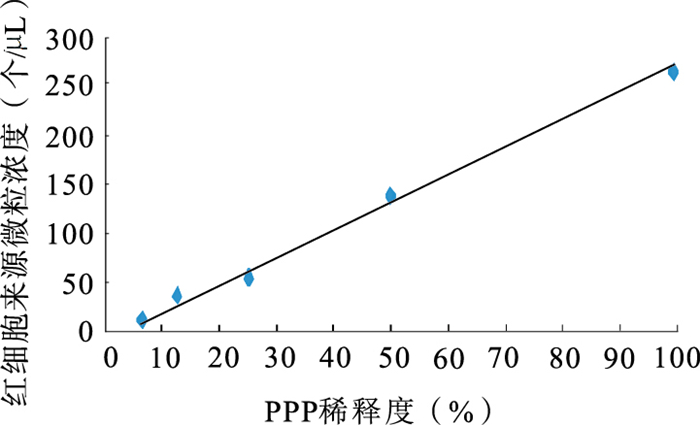
將PPP標本系列對倍稀釋后,分別進行了血小板和紅細胞來源微粒檢測并作微粒濃度和稀釋度的相關性分析,其直線相關系數分別為0.999 6和0.995 4,有良好的線性關系,見圖 3、4。
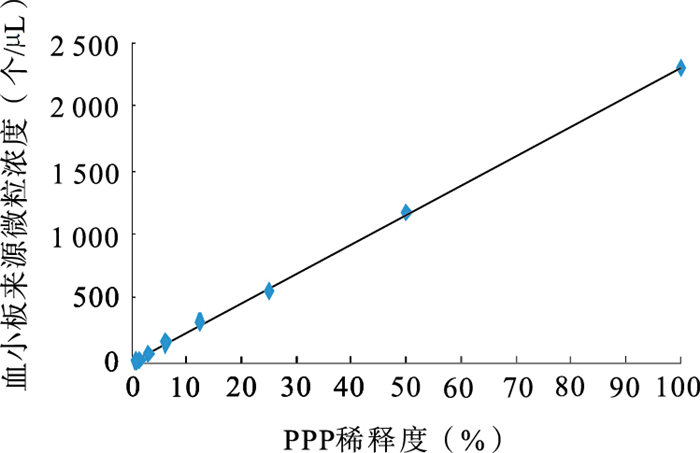 圖3
血小板來源微粒稀釋試驗
圖3
血小板來源微粒稀釋試驗
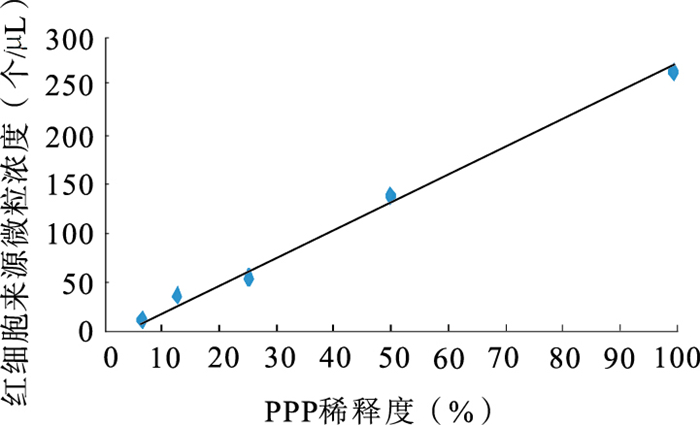 圖4
紅細胞來源微粒稀釋試驗
圖4
紅細胞來源微粒稀釋試驗
3 討論
微粒是哺乳動物細胞在不同因素作用下,細胞膜內層帶有負電荷的磷脂酰絲氨酸翻轉暴露于膜外層,細胞膜向外伸展變形,以出芽的方式形成小泡或偽足脫落進入微循環中形成微粒[1]。微粒的直徑為0.1~1.0 μm,其檢測方法較多,不同實驗室的方法也不盡相同,如電子顯微鏡、ELISA、蛋白質印跡法和流式細胞術等[2, 5-6]。與流式細胞術相比,電子顯微鏡能準確檢測微粒大小及形態,但操作繁瑣,且不能確定微粒的來源和進行定量分析[2];ELISA能確定微粒的來源和進行定量分析,但卻不能將微粒與標本中混入的細胞、凋亡小體和其他細胞外小囊泡進行區分[7];蛋白質免疫法為半定量分析,靈敏度低,適合于微粒含量高的標本[6]。隨著流式細胞術及單克隆抗體技術的發展,流式細胞術在對微粒的定性及定量研究等方面展現出明顯優勢,其檢測方便快速,能識別微粒來源,已成為研究微粒的首選方法[7-8]。近年來,基于能同時檢測6種及以上不同熒光的多色流式分析技術逐漸運用到臨床領域,并顯示了其強大的分析功能和適宜性[9-10]。在微粒的檢測分析中,高通量的多色流式分析技術與常規流式分析技術(6色以下)相比有明顯優勢:其不僅能提高識別微粒的準確性,而且處理的管數減少,節約了樣本及抗體用量、上樣檢測及處理樣本時間,能更有效地計數大量微粒,并便于實驗標準化。目前微粒的流式檢測方法并未標準化,不同的實驗室采用不同的抗體組合來分析特定疾病中的微粒,然而多數的抗體組合都包含相似的骨干抗體,因而可總結出標準化的微粒流式檢測方案[8]。
目前檢測微粒使用的血漿標本有3種:富血小板血漿、PPP和無血小板血漿。本實驗采用抗凝血2 500×g離心2次后取上清液,得到PPP后于-80℃冰箱凍存。該方法操作簡便快捷,便于標本儲存,是多數實驗室常用的方法[11]。多色流式細胞術檢測微粒是基于微粒大小及表面含有的親本細胞抗原,通過識別表面抗原的熒光抗體對各種微粒進行鑒別[8]。由于同一種細胞表面可表達多種特異性抗原,且親本細胞及其來源的微粒細胞表面抗原分布存在差異,因此不同的實驗室之間選用的熒光抗體也有差別[7-8, 11-12]。本實驗采用的檢測微粒選用8種抗體:CD235a(紅細胞)、CD41a(血小板)、CD14(單核細胞)、CD66b(粒細胞)、CD20(B淋巴細胞)、CD3(T淋巴細胞)、CD45和CD34(內皮細胞),這些抗體對應的抗原穩定性好,均在親本細胞及其微粒表面特異性強表達或無表達[7-8, 13]。采用的大部分抗體與其他實驗室一致[8],不同的是針對內皮細胞的抗體,在不同實驗室基于不同實驗目的存在較大差異,如CD31、CD51、CD105、CD144、CD146等[5, 7-8, 12],但這幾種抗原在其他細胞表面也存在不同程度的異質性表達[8, 13-14],不能完全反映內皮來源微粒;而CD45-和CD34+能更好地鑒別內皮細胞及其來源微粒[14],故本實驗選用CD45- CD34+作為內皮來源微粒的標記。本實驗采用在一個樣品管同時測定血小板、紅細胞、內皮細胞、單核細胞、粒細胞、T淋巴細胞和B淋巴細胞來源的微粒。先用標準直徑微球設定前向檢測區,確定微粒大小(直徑0.1~1.0 μm),再用Annexin-V陽性確定微粒,針對不同細胞表面抗原的特異性熒光抗體確定微粒來源。由于要檢測9種熒光,使熒光之間的相互干擾較強,熒光補償的調節復雜,需要對方案中的抗體進行單色染色來確定熒光補償;同時使用抗體數量增加,抗體間相互作用的機會也伴隨增加,利用缺一色染色來確定抗體間的相互作用,比較實驗中缺一色時各陽性微粒群的比例和平均熒光強度的變化,觀察抗體間的是否作用及強度[15-16]。結果顯示3例正常成人的PPP標本缺一色染色中陽性微粒群比例變化均<15%,表明方案中使用的各抗體的相互作用小且具有較強的穩定性。
另外,在稀釋試驗中,血小板及紅細胞來源微粒實測最小濃度分別為17、13個/μL;同時,檢測都呈現了良好的直線相關性。在重復試驗中,紅細胞、血小板、粒細胞來源微粒的變異系數均<10%,內皮細胞、單核細胞、B淋巴細胞和T淋巴細胞來源微粒的變異系數均>10%但<20%,也體現了較好的穩定性;其中內皮細胞、單核細胞、B淋巴細胞和T淋巴來源微粒變異系數>10%,主要是因為它們在PPP中絕對含量低,也受到常規流式細胞儀光學系統設計的限制所致。目前有高速熒光檢測和顆粒照相技術的有效組合的影像流式細胞術,可根據拍攝顆粒的像素來確定微粒的大小,克服常規流式光電系統檢測限制的不足,提高實驗穩定性,但該儀器2007年開始商業提供,且設備昂貴,目前很少有臨床實驗室采用[8, 17]。用建立的九色方案檢測了10例正常人的PPP標本,均檢測到了血小板、紅細胞、內皮細胞、單核細胞、粒細胞、B淋巴細胞及T淋巴細胞來源微粒,其中血小板來源微粒濃度為60.6~288.9個/μL,平均132.6個/μL。Yuana等[11]采用同樣的離心方法得到PPP,用CD41作為血小板來源微粒的標記,測得的正常人血小板來源微粒平均濃度為63~291個/μL,平均141個/μL,本實驗與其結果具有一致性。
綜上所述,我們成功建立了九色流式細胞術定量檢測人血漿中不同來源微粒的實驗方案,該方法簡單實用,適合臨床推廣應用。
微粒是存在于血漿中的直徑為0.1~1.0 μm的膜性小囊[1],血小板、紅細胞、內皮細胞、單核細胞、粒細胞和淋巴細胞等受到活化或凋亡刺激時均可產生微粒,其具有促凝、促炎癥、促進血管生成和調節內皮功能等作用。不同來源的微粒與多種疾病的發生密切相關,如心血管疾病、腫瘤、糖尿病、免疫性疾病和感染等。抑制微粒產生,可作為特定疾病治療新策略[1-4]。分析微粒的類型及數量的變化,可為診斷疾病及治療監測提供一個潛在的和有用的工具[1]。檢測微粒的方法較多,不同實驗室的檢測方法也不盡相同,如電子顯微鏡、酶聯免疫吸附測定(ELISA)、蛋白質印跡法和流式細胞術等[2, 5-6]。近年來,流式細胞術逐漸成為檢測微粒的首選方法,但用多色流式細胞術同時檢測多種來源的微粒的報道少見,尚未見到使用多色流式細胞術同時檢測紅細胞、血小板、粒細胞、內皮細胞、單核細胞、B淋巴細胞和T淋巴細胞來源微粒的報道[4, 7]。我們建立了九色流式細胞術定量檢測血漿中不同來源微粒的方法。現報告如下。
1 材料與方法
1.1 一般資料
2014年12月-2015年1月收集10例正常成人的體檢標本,年齡20~35歲,男女比例1:1,無高血壓、高血脂、糖尿病及腫瘤性疾病史。另有2例糖尿病酮癥酸中毒患者作稀釋試驗用,均為男性,年齡分別為45和57歲。
1.2 材料
Annexin-V和細胞表面抗體CD235a、CD41a、CD45、CD34、CD66b、CD20、CD3和CD14,均購自美國BD公司(抗體染色方案見表 1)。平均直徑為10.0 μm的定量熒光微球(濃度1 045個/μL),購自美國Beckman Coulter公司;平均直徑分別為0.22、0.45、0.88、1.34 μm的系列標準直徑微球,直徑范圍分別為0.1~0.3 μm、0.4~0.6 μm、0.7~0.9 μm和1.0~1.9 μm,購自美國Spherotech公司。10×結合緩沖液(binding buffer),購自美國BD公司。
1.3 方法
1.3.1 標本收集
所有血液標本均為采集空腹靜脈血2.0 mL,枸櫞酸鈉抗凝。室溫條件下,2 500×g離心10 min,取上清液,2 500×g再次離心10 min,取上清液于塑料試管中,得到乏血小板血漿(PPP),-80℃冰箱凍存。
1.3.2 單色染色
正常人的PPP準備9管,其中第1管作為空白對照。每管取PPP 10.0 μL,加入Annexin-V和10×結合緩沖液各1.0 μL,充分混勻后室溫避光孵育10 min,然后按表 1方案在其中的8管中分別加入1種特異性抗體1.0 μL,空白對照管不加入特異性抗體,充分混勻后室溫避光孵育20 min,再加入1×結合緩沖液130 μL,充分混勻后上流式細胞儀檢測。分析時,利用前向散射FSA/Annexin-V設門,確定微粒群,對設門微粒取雙對數參數分析補償,并作相應調整。
1.3.3 缺一色染色
正常人PPP樣品準備8管,按照1.3.2中操作步驟分別加入表 1方案中缺1個抗體的染色后上機檢測。分析時,將缺一色染色與單色染色后各抗體的陽性微粒群比例進行比較,以該樣品的單色染色目的微粒群陽性比例為靶值,計算缺一色染色中目的微粒群陽性比例變化值,計算方法為:變化值(%)=(單色染色陽性比例-缺一色染色陽性比例)/單色染色陽性比例×100%。
1.3.4 標本檢測
取正常人PPP標本10.0 μL,加入Annexin-V和10×結合緩沖液各1.0 μL,充分混勻后室溫避光孵育10 min;按表 1方案加入各種特異性抗體各1.0 μL,充分混勻后室溫避光孵育20 min;加入1×結合緩沖液130 μL,再加入10.0 μL定量熒光微球(濃度1 045個/μL),充分混勻后上流式細胞儀(BD FACSAria)檢測,低速獲取至少記錄1.5×105個顆粒,用FACSDiva(BD)軟件分析數據。在每次實驗時,均有1管不加抗體,而加入PPP、Annexin-V和標準直徑微球(平均直徑分別為0.22、0.45、0.88和1.34 μm),用于直徑范圍設定微粒門區域。
1.3.5 檢測及分析
完成單色染色和缺一色染色,確定補償和電壓后,按照1.3.4中的操作步驟做正常人標本檢測。確定不同來源微粒的流式細胞術分析策略如下(圖 1):①用平均直徑分別為0.22、0.45、0.88、1.34 μm的標準直徑熒光微球設定前向檢測區,確定微粒大小(直徑0.1~1.0 μm);②以FSA/Annexin-V設門來確定微粒群;③微粒群中,以CD41a/CD235a設門分別確定血小板及紅細胞來源,CD14/CD66b設門分別確定單核細胞及粒細胞來源,CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源,CD34/CD45設門確定內皮細胞來源;④按照以下計算公式,分別計算不同來源微粒的絕對數:微粒絕對數(個/μL)=定量熒光微球濃度×不同來源熒光抗體陽性顆粒檢測值/血漿稀釋倍數×定量熒光微球檢測值。
 圖1
不同來源微粒流式分析策略 a.用標準直徑微球設定前向檢測區,確定微粒大小范圍;圖中右上角可見用于定量分析的直徑為10.0 μm的標準數量微球b. FSA/Annexin-V設門來確定微粒群c.微粒群中,CD41a/CD235a設門分別確定血小板及紅細胞來源微粒d. CD14/CD66b設門分別確定單核細胞及粒細胞來源微粒e. CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源微粒f. CD34/D45設門確定內皮細胞來源微粒
圖1
不同來源微粒流式分析策略 a.用標準直徑微球設定前向檢測區,確定微粒大小范圍;圖中右上角可見用于定量分析的直徑為10.0 μm的標準數量微球b. FSA/Annexin-V設門來確定微粒群c.微粒群中,CD41a/CD235a設門分別確定血小板及紅細胞來源微粒d. CD14/CD66b設門分別確定單核細胞及粒細胞來源微粒e. CD20/CD3設門分別確定B淋巴細胞及T淋巴細胞來源微粒f. CD34/D45設門確定內皮細胞來源微粒
1.4 方法學評價
1.4.1 重復試驗
在相同的實驗條件下按1.3.4中步驟重復測定同一PPP標本10次,再按1.3.5中策略進行分析,求出各種不同來源微粒的濃度均數及變異系數。
1.4.2 稀釋試驗
篩選出血小板和紅細胞來源微粒濃度分別較高的2例糖尿病酮癥酸中毒患者PPP標本,其中血小板來源微粒濃度較高的PPP用磷酸鹽緩沖液連續對倍稀釋8個梯度(1/1,1/2,1/4,1/8,1/16,1/32,1/64,1/128),做血小板來源微粒稀釋試驗用;紅細胞來源微粒濃度較高的PPP標本用磷酸鹽緩沖液連續對倍稀釋5個梯度(1/1,1/2,1/4,1/8,1/16),做紅細胞來源微粒稀釋試驗用。按1.3.4中步驟上流式細胞儀檢測,再按1.3.5中策略進行分析,以PPP稀釋度為橫坐標,分別以血小板和紅細胞來源微粒濃度為縱坐標作圖。
2 結果
2.1 單色染色
分別作了Annexin-V和8種抗體的單色染色,確定了檢測電壓并調節熒光補償,各熒光檢測通路間信號檢測無影響,見圖 2。
 圖2
CD41a-FITC單色染色實驗 a~g.分別表示CD41a-FITC陽性微粒對PE、PE-Cy7、PE-CF594、PerCP-Cy5.5、APC-Cy7、BV421、BV510的熒光檢測通路的信號無影響
圖2
CD41a-FITC單色染色實驗 a~g.分別表示CD41a-FITC陽性微粒對PE、PE-Cy7、PE-CF594、PerCP-Cy5.5、APC-Cy7、BV421、BV510的熒光檢測通路的信號無影響
2.2 缺一色染色
比較了3例正常成人的PPP標本分別用8種抗體單色染色及缺一色染色中的陽性微粒群比例變化(表 2),其中CD41a為(2.2±1.1)%,變化最小,變化較大的是CD3和CD14,分別為(12.1±2.7)%和(12.7±0.8)%,但這些變化均<15%,表明方案中使用的各抗體的相互作用小。
2.3 檢測并分析標本
檢測10例正常成人的PPP標本,分別計算出標本不同來源微粒的濃度均數及實際檢測范圍。見表 3。
2.4 方法學評價
2.4.1 重復試驗
紅細胞、血小板和粒細胞來源微粒的變異系數均<10%;內皮細胞、單核細胞、B淋巴細胞及T淋巴細胞來源微粒的變異系數均>10%,但均<20%,體現了其具有較好的穩定性。見表 4。
2.4.2 稀釋試驗
將PPP標本系列對倍稀釋后,分別進行了血小板和紅細胞來源微粒檢測并作微粒濃度和稀釋度的相關性分析,其直線相關系數分別為0.999 6和0.995 4,有良好的線性關系,見圖 3、4。
 圖3
血小板來源微粒稀釋試驗
圖3
血小板來源微粒稀釋試驗
 圖4
紅細胞來源微粒稀釋試驗
圖4
紅細胞來源微粒稀釋試驗
3 討論
微粒是哺乳動物細胞在不同因素作用下,細胞膜內層帶有負電荷的磷脂酰絲氨酸翻轉暴露于膜外層,細胞膜向外伸展變形,以出芽的方式形成小泡或偽足脫落進入微循環中形成微粒[1]。微粒的直徑為0.1~1.0 μm,其檢測方法較多,不同實驗室的方法也不盡相同,如電子顯微鏡、ELISA、蛋白質印跡法和流式細胞術等[2, 5-6]。與流式細胞術相比,電子顯微鏡能準確檢測微粒大小及形態,但操作繁瑣,且不能確定微粒的來源和進行定量分析[2];ELISA能確定微粒的來源和進行定量分析,但卻不能將微粒與標本中混入的細胞、凋亡小體和其他細胞外小囊泡進行區分[7];蛋白質免疫法為半定量分析,靈敏度低,適合于微粒含量高的標本[6]。隨著流式細胞術及單克隆抗體技術的發展,流式細胞術在對微粒的定性及定量研究等方面展現出明顯優勢,其檢測方便快速,能識別微粒來源,已成為研究微粒的首選方法[7-8]。近年來,基于能同時檢測6種及以上不同熒光的多色流式分析技術逐漸運用到臨床領域,并顯示了其強大的分析功能和適宜性[9-10]。在微粒的檢測分析中,高通量的多色流式分析技術與常規流式分析技術(6色以下)相比有明顯優勢:其不僅能提高識別微粒的準確性,而且處理的管數減少,節約了樣本及抗體用量、上樣檢測及處理樣本時間,能更有效地計數大量微粒,并便于實驗標準化。目前微粒的流式檢測方法并未標準化,不同的實驗室采用不同的抗體組合來分析特定疾病中的微粒,然而多數的抗體組合都包含相似的骨干抗體,因而可總結出標準化的微粒流式檢測方案[8]。
目前檢測微粒使用的血漿標本有3種:富血小板血漿、PPP和無血小板血漿。本實驗采用抗凝血2 500×g離心2次后取上清液,得到PPP后于-80℃冰箱凍存。該方法操作簡便快捷,便于標本儲存,是多數實驗室常用的方法[11]。多色流式細胞術檢測微粒是基于微粒大小及表面含有的親本細胞抗原,通過識別表面抗原的熒光抗體對各種微粒進行鑒別[8]。由于同一種細胞表面可表達多種特異性抗原,且親本細胞及其來源的微粒細胞表面抗原分布存在差異,因此不同的實驗室之間選用的熒光抗體也有差別[7-8, 11-12]。本實驗采用的檢測微粒選用8種抗體:CD235a(紅細胞)、CD41a(血小板)、CD14(單核細胞)、CD66b(粒細胞)、CD20(B淋巴細胞)、CD3(T淋巴細胞)、CD45和CD34(內皮細胞),這些抗體對應的抗原穩定性好,均在親本細胞及其微粒表面特異性強表達或無表達[7-8, 13]。采用的大部分抗體與其他實驗室一致[8],不同的是針對內皮細胞的抗體,在不同實驗室基于不同實驗目的存在較大差異,如CD31、CD51、CD105、CD144、CD146等[5, 7-8, 12],但這幾種抗原在其他細胞表面也存在不同程度的異質性表達[8, 13-14],不能完全反映內皮來源微粒;而CD45-和CD34+能更好地鑒別內皮細胞及其來源微粒[14],故本實驗選用CD45- CD34+作為內皮來源微粒的標記。本實驗采用在一個樣品管同時測定血小板、紅細胞、內皮細胞、單核細胞、粒細胞、T淋巴細胞和B淋巴細胞來源的微粒。先用標準直徑微球設定前向檢測區,確定微粒大小(直徑0.1~1.0 μm),再用Annexin-V陽性確定微粒,針對不同細胞表面抗原的特異性熒光抗體確定微粒來源。由于要檢測9種熒光,使熒光之間的相互干擾較強,熒光補償的調節復雜,需要對方案中的抗體進行單色染色來確定熒光補償;同時使用抗體數量增加,抗體間相互作用的機會也伴隨增加,利用缺一色染色來確定抗體間的相互作用,比較實驗中缺一色時各陽性微粒群的比例和平均熒光強度的變化,觀察抗體間的是否作用及強度[15-16]。結果顯示3例正常成人的PPP標本缺一色染色中陽性微粒群比例變化均<15%,表明方案中使用的各抗體的相互作用小且具有較強的穩定性。
另外,在稀釋試驗中,血小板及紅細胞來源微粒實測最小濃度分別為17、13個/μL;同時,檢測都呈現了良好的直線相關性。在重復試驗中,紅細胞、血小板、粒細胞來源微粒的變異系數均<10%,內皮細胞、單核細胞、B淋巴細胞和T淋巴細胞來源微粒的變異系數均>10%但<20%,也體現了較好的穩定性;其中內皮細胞、單核細胞、B淋巴細胞和T淋巴來源微粒變異系數>10%,主要是因為它們在PPP中絕對含量低,也受到常規流式細胞儀光學系統設計的限制所致。目前有高速熒光檢測和顆粒照相技術的有效組合的影像流式細胞術,可根據拍攝顆粒的像素來確定微粒的大小,克服常規流式光電系統檢測限制的不足,提高實驗穩定性,但該儀器2007年開始商業提供,且設備昂貴,目前很少有臨床實驗室采用[8, 17]。用建立的九色方案檢測了10例正常人的PPP標本,均檢測到了血小板、紅細胞、內皮細胞、單核細胞、粒細胞、B淋巴細胞及T淋巴細胞來源微粒,其中血小板來源微粒濃度為60.6~288.9個/μL,平均132.6個/μL。Yuana等[11]采用同樣的離心方法得到PPP,用CD41作為血小板來源微粒的標記,測得的正常人血小板來源微粒平均濃度為63~291個/μL,平均141個/μL,本實驗與其結果具有一致性。
綜上所述,我們成功建立了九色流式細胞術定量檢測人血漿中不同來源微粒的實驗方案,該方法簡單實用,適合臨床推廣應用。