引用本文: 徐嫚鴻, 王林妮, 林婷婷, 任新軍, 柯屹峰, 胡立穎, 焦明菲, 王勇, 王瓊, 洪雅茹, 李筱榮, 東莉潔. 多聚嘧啶序列結合蛋白相關剪接因子對缺氧誘導人視網膜微血管內皮細胞功能的影響. 中華眼底病雜志, 2020, 36(2): 135-142. doi: 10.3760/cma.j.issn.1005-1015.2020.02.010 復制
生理條件下,眼內的促血管生成分子和抑制血管生成分子之間存在著動態平衡,但在病理情況下由于缺氧、局部缺血和炎癥會影響包括VEGF和色素上皮衍生因子在內的許多生長因子表達,從而導致視網膜新生血管(RNV)產生[1]。盡管激光光凝治療和抗VEGF藥物治療在臨床上取得一定的治療效果,但由于對RNV的確切機制尚未研究透徹,臨床上仍缺乏RNV的特異性和高效的治療措施,因此挖掘抑制RNV形成的調控因子并深入探究其作用機制具有重要的臨床意義[2-5]。多聚嘧啶序列結合蛋白相關剪接因子(PSF)是參與多種基因調節過程的核酸結合蛋白[6]。我們的前期研究發現,重組腺相關病毒PSF可以下調氧誘導視網膜病變(OIR)模型鼠視網膜VEGF的表達水平,提示PSF對缺氧狀態下RNV形成和人視網膜微血管內皮細胞(hRMECs)存在潛在的調控作用[7]。為深入探討PSF的作用,本研究構建可穩定表達PSF的重組慢病毒(LV-PSF),一方面通過體內實驗驗證PSF對OIR模型鼠RNV的抑制作用;另一方面將LV-PSF引入缺氧狀態下細胞實驗體系中,旨在探究PSF對缺氧誘導hRMECs增生和遷移等功能的影響并挖掘PSF的作用機制,從而為以RNV為病理特征的眼部疾病治療提供潛在靶點。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
人腎上皮細胞系(293T)細胞株由天津醫科大學眼科研究所張曉敏主任惠贈。hRMECs購自北京北納科技有限公司。LV-PSF和空載慢病毒(LV-Vec)由本實驗室自行構建。10%胎牛血清(FBS)、青霉素/鏈霉素(P/S)、1倍DMEM培養基(美國Gibco公司),缺氧誘導裝置(美國Billups-Rothenberg公司),Lipofectamine 2000轉染試劑、cDNA逆轉錄試劑盒、BCA蛋白濃度檢測試劑盒、恒溫培養箱,超凈工作臺(美國Thermo Fisher公司),去內毒素質粒大量提取試劑盒、封閉山羊血清、5%BSA封閉液、抗熒光衰減封片劑、MTT、1倍PBS、Triton X-100、4%多聚甲醛(北京索萊寶科技有限公司),Trizol試劑、Isolectin GS-IB4、Alexa Fluor? 488 Conjugate(美國Invitrogen公司)。胰酶消化液(江蘇碧云天生物技術研究所),細胞培養板(美國Costar公司),移液器、Tip頭(德國Eppendorf公司),EP管、離心管(上海生物工程技術有限公司)。7900HT實時熒光定量PCR儀(美國ABI公司),FACSCalibur流式細胞儀(美國BD公司),熒光顯微鏡(日本Olympus公司),TDL-40B型臺式離心機(上海安亭科學儀器廠),DK-600A型電熱恒溫水浴箱(上海一恒科學儀器有限公司),細胞計數板(北京六一實驗儀器廠)。
1.2 細胞培養、重組慢病毒包裝及病毒滴度測定
正常細胞培養:293T細胞和hRMECs均使用含有10% FBS、P/S的DMEM培養基,置于37 ℃、95%空氣、5% CO2的密閉恒溫培養箱中進行培養。缺氧刺激細胞:將處于對數生長期的細胞或病毒感染后的細胞置于缺氧誘導裝置中,向裝置中充氮氣直至氧氣濃度達到2%,將缺氧誘導裝置置于37 ℃、5% CO2培養箱中培養。
質粒提取及測定:在NCBI基因數據庫中查詢獲取人類PSF的核酸序列,基因序列號為NM_005066.2,由本實驗室自行設計并合成重組質粒及大腸桿菌菌液。按照去內毒素質粒大量提取試劑盒說明書步驟提取質粒,通過酶切法和測序法鑒定目的質粒。重組慢病毒包裝及濃縮:將293T細胞以2×107個/ml的密度復蘇在75 cm塑料培養瓶中,待其生長到80%~90%融合度時進行傳代,傳至3~4代且融合度為60%以上時用于病毒包裝。將目的質粒(pCDH-CMV-PSF-EF1-copGFP)和空載質粒(pEGFP-Vec)分別與穿梭質粒(pCMV-VSV-G)及包裝質粒(psPAX2)以4:1:3的質量比構成三質粒系統,并和Lipofectamine 2000轉染試劑(5~6 μl/ml)混合,室溫孵育30 min。棄去細胞培養瓶中的培養液,加入孵育好的混合物后培養30 min,再加入等量完全培養液培養4~6 h后更換一次培養液。感染后24~48 h可觀察到綠色熒光蛋白(GFP)表達情況,48~72 h可以收集病毒。將培養瓶中的上清液轉移至50 ml離心管中,以離心半徑15 cm、1500 r/min在4 ℃條件下離心10 min,再經0.45 μm過濾器過濾。將上清液、濃縮液按8:3的比例向過濾后的上清液中添加濃縮液,以4500×g在4 ℃條件下離心15 min,小心棄去液體,用完全培養液重懸病毒顆粒,分裝凍存于?80 ℃冰箱或直接使用。采用批量快速測定法測定病毒滴度,后續實驗中按照測定的病毒滴度計算體內實驗和體外實驗的作用濃度。
1.3 重組慢病毒感染hRMECs、流式細胞儀測定感染效率及實時熒光定量PCR(RT-PCR)測量hRMECs中PSF mRNA表達
將hRMECs以5×105個/ml的密度接種于12孔板,并將其分為正常組、空載組、PSF高表達組。正常組為正常體外培養的hRMECs;空載組為經LV-Vec感染的hRMECs;PSF高表達組為經LV-PSF感染的hRMECs。當細胞融合度達50%左右時,正常組繼續培養,空載組和PSF組細胞棄去培養基,加入6 μg/ml聚凝胺孵育30 min后棄上清液,分別加入LV-Vec和LV- PSF感染,并于6 h后換完全培養液,48 h后于熒光顯微鏡下觀察GFP的表達情況。
正常組、空載組和PSF高表達組細胞按分組處理后,消化離心并棄去上清液,分別用500 μl PBS重懸成單細胞懸液加入到流式管中上機檢測。LV-Vec和LV-PSF表達GFP,可在波長為488 nm的藍光雷射激發下發出綠色熒光,選用FL-1通道檢測熒光信號。先檢測正常組樣品,調節電壓使細胞群處于陰性區,再檢測空載組和PSF高表達組,調節補償使陽性群細胞處于合適位置。每組樣品設置3個副孔,每孔獲取50 000個微粒信號,實驗重復進行3次,檢測結果通過Flowjo 7.6軟件進行分析。
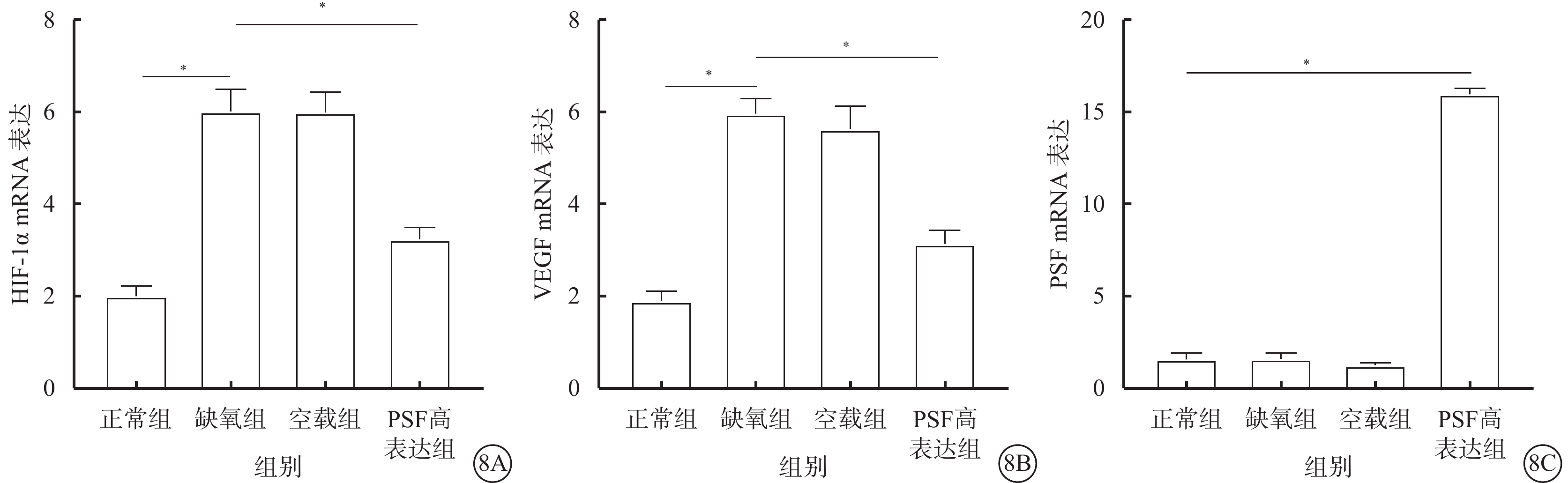
正常組、空載組和PSF高表達組細胞按分組處理后,按Trizol Reagent說明書提取總RNA,反轉錄合成cDNA模板,行RT-PCR。引物序列由本實驗室設計,由蘇州金唯智公司合成(表1)。擴增條件:95 ℃預變性30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40個循環。目的基因擴增產物的相對含量用2-ΔΔCt計算。
1.4 PSF對OIR模型小鼠RNV的作用
7日齡健康C57B/L6小鼠20只,雌雄不限,體重(3.52±0.35)g,購自斯貝福(北京)生物技術有限公司。采用隨機數字表法將小鼠分為正常組、OIR組、OIR+LV-Vec組和OIR+LV-PSF組,每組5只。后3組小鼠置于氧氣濃度為(75±5)%的飼養箱中,溫度維持在(23±2)℃。OIR+LV-Vec組和OIR+LV-PSF組小鼠于12日齡時,經復方托吡卡胺滴眼液散瞳,0.4%鹽酸奧布卡因滴眼液表面麻醉后,手術顯微鏡下各組玻璃體腔分別注射1 μl LV-Vec和LV-PSF,注射完畢后給予左氧氟沙星滴眼液點眼。OIR組小鼠不做玻璃體腔注射,于12日齡時置于正常室內空氣中飼養。小鼠15日齡時,再次對OIR+LV-Vec組和OIR+LV-PSF組小鼠進行玻璃體腔注射重組慢病毒處理。正常組小鼠始終置于正常空氣環境中飼養,未做任何處理。
小鼠17日齡時,各組小鼠腹腔注射過量10%水合氯醛處死,立即摘取右眼眼球在4%多聚甲醛中室溫固定15 min,更換PBS冰上處理10 min。手術顯微鏡下剝離完整的視網膜,用100%甲醇固定15 min后,采用通透緩沖液(PBS緩沖液、1% BSA封閉液、0.5% Triton X-100及5%封閉山羊血清)處理視網膜2 h后用Alexa-488標記的Isolectin GS-IB4在4 ℃條件下孵育過夜。用PBS洗3遍后,將視網膜以RGC層向上平鋪于載玻片上,并滴加抗熒光衰減封片劑,蓋上蓋玻片,在熒光顯微鏡下用相同的光學參數拍照。
1.5 PSF對缺氧誘導hRMECs增生和遷移功能的影響
將hRMECs分為正常組(正常培養的hRMECs)、缺氧組(缺氧刺激3 h恢復正常培養條件24 h的hRMECs)、空載組(用LV-Vec感染hRMECs 48 h,再用缺氧刺激3 h恢復正常培養條件24 h)和PSF高表達組(用LV-PSF感染hRMECs 48 h,再用缺氧刺激3 h恢復正常培養條件24 h)。缺氧刺激3 h恢復正常培養條件24 h這一條件根據預實驗結果獲得。各組細胞以1×105個/ml的密度接種于96孔板,在分別進行各組刺激后,加入MTT孵育4 h后棄去培養上清液,加入150 μl DMSO,室溫靜置15 min后通過酶聯免疫檢測儀在490 nm波長處讀取吸光度[A,舊稱光密度(OD)]值。每組設置3個副孔,實驗重復進行3次。
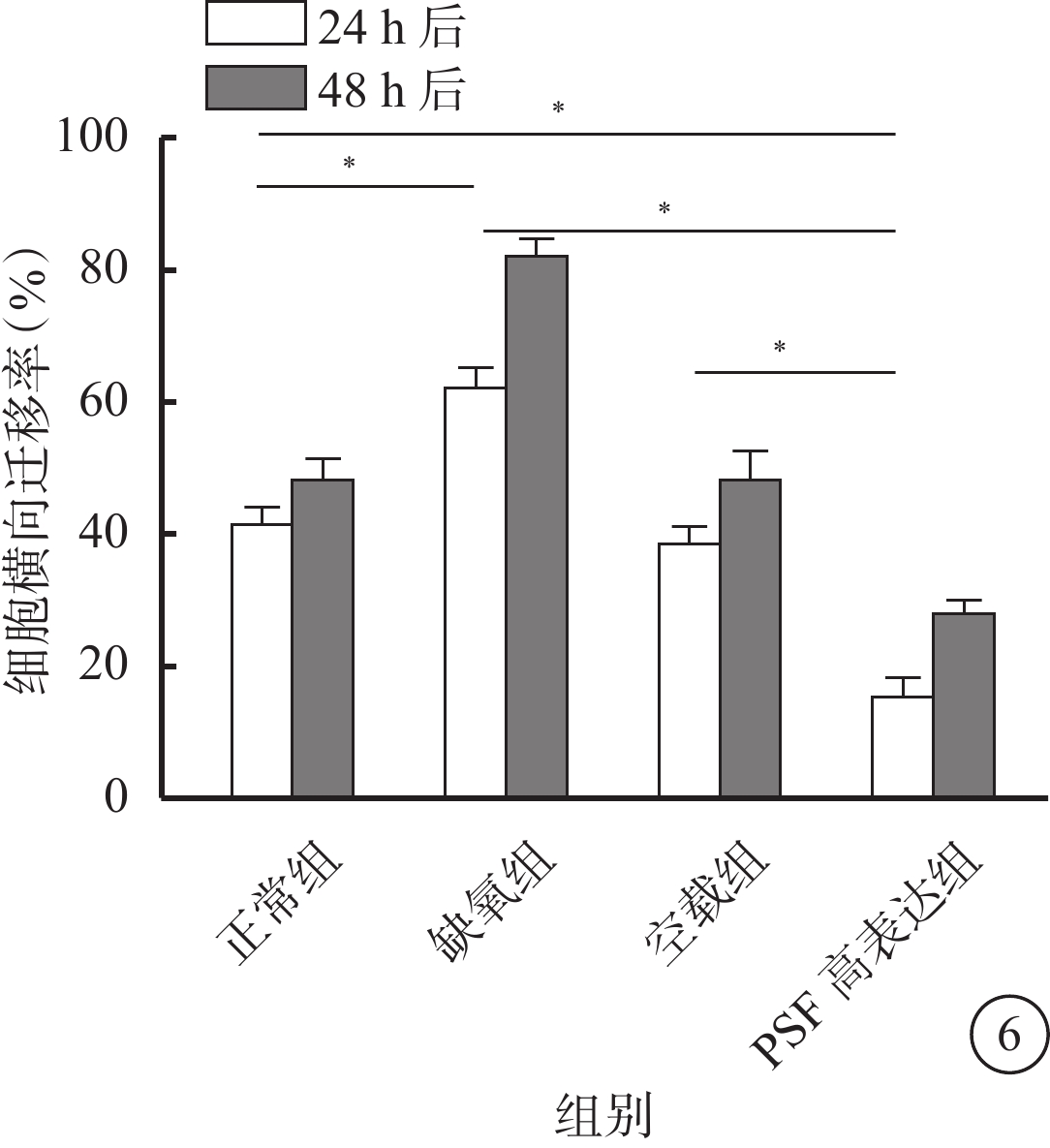
將hRMECs以5×105個/ml的密度接種于12孔板,培養過夜后按正常組、缺氧組、空載組和PSF過表達組進行相應處理。除正常組之外,其余3組均進行缺氧培養3 h,進行劃痕處理并將此時計作0 h,繼續培養48 h。分別在培養24、48 h時,于4倍光學顯微鏡下隨機選取3個視野測量劃痕無細胞部分的面積,分別計算出24、48 h細胞遷移率。細胞遷移率=(最初劃痕面積?檢測時無細胞部分的面積)/最初劃痕面積。
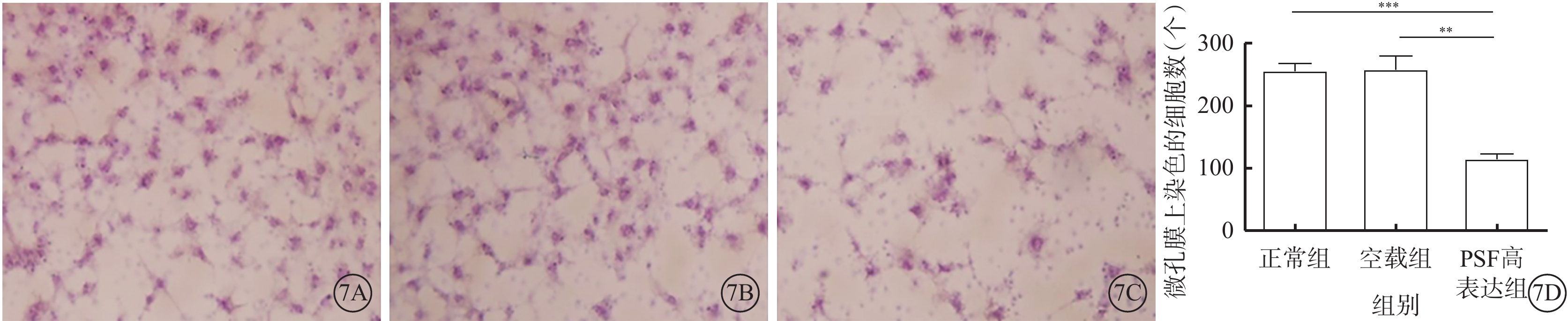
hRMECs分為正常組、空載組和PSF過表達組,后兩組細胞在病毒感染后分別缺氧刺激3 h并恢復正常條件培養24 h。將3組細胞消化后以1.5×105個的密度接種于Transwell小室上室內,無血清培養基培養;下室加入100% FBS,培養10 h后吸出小室和24孔板內液體,用棉簽將小室上表面細胞輕輕擦掉,4%多聚甲醛固定Transwell小室下表面細胞15 min后PBS洗3次,經常規HE染色。將小室晾干,用無菌尖刀片將小室表面切下,進行中性樹膠封片。每組設置3個復孔,本實驗共重復3次。
1.6 統計學分析
采用SPSS18.0統計軟件行統計學分析。多樣本計量資料均數比較采用方差齊性檢驗,方差齊時采用方差分析,總體均數有差異時采用兩兩比較。P<0.05為差異有統計學意義。
2 結果
2.1 LV-PSF鑒定
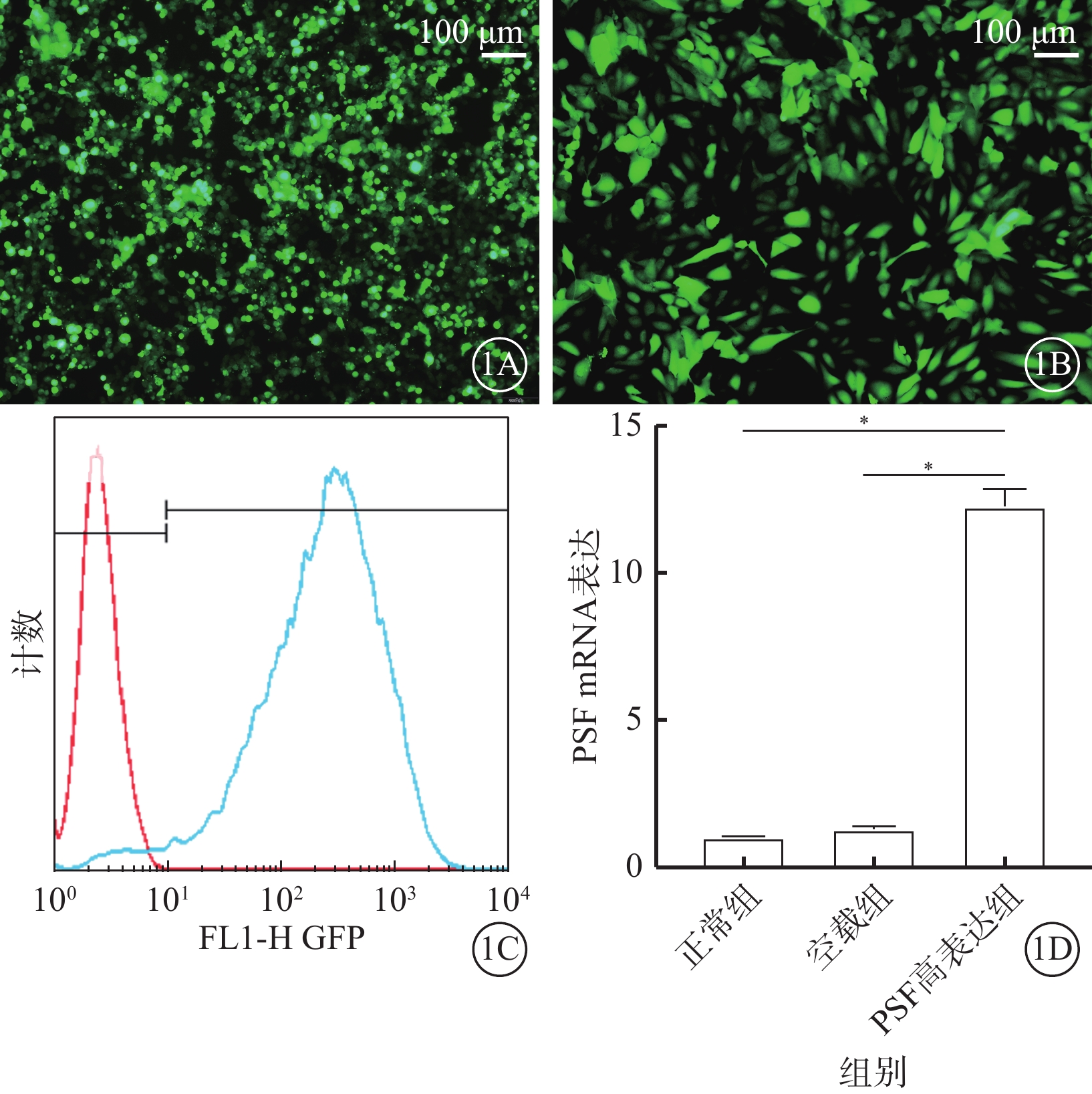
熒光顯微鏡觀察發現,三質粒系統共同轉染293T細胞48 h后可見GFP表達(圖1A);在LV-PSF感染hRMECs 48 h后也可觀察到GFP表達(圖1B)。流式細胞儀計數測得LV-PSF感染效率為97%(圖1C)。RT-PCT測定結果顯示,感染后48 h,PSF高表達組hRMECs中PSF mRNA表達較正常組、空載組明顯增多,差異有統計學意義(t=32.85、30.60,P<0.05)(圖1D)。
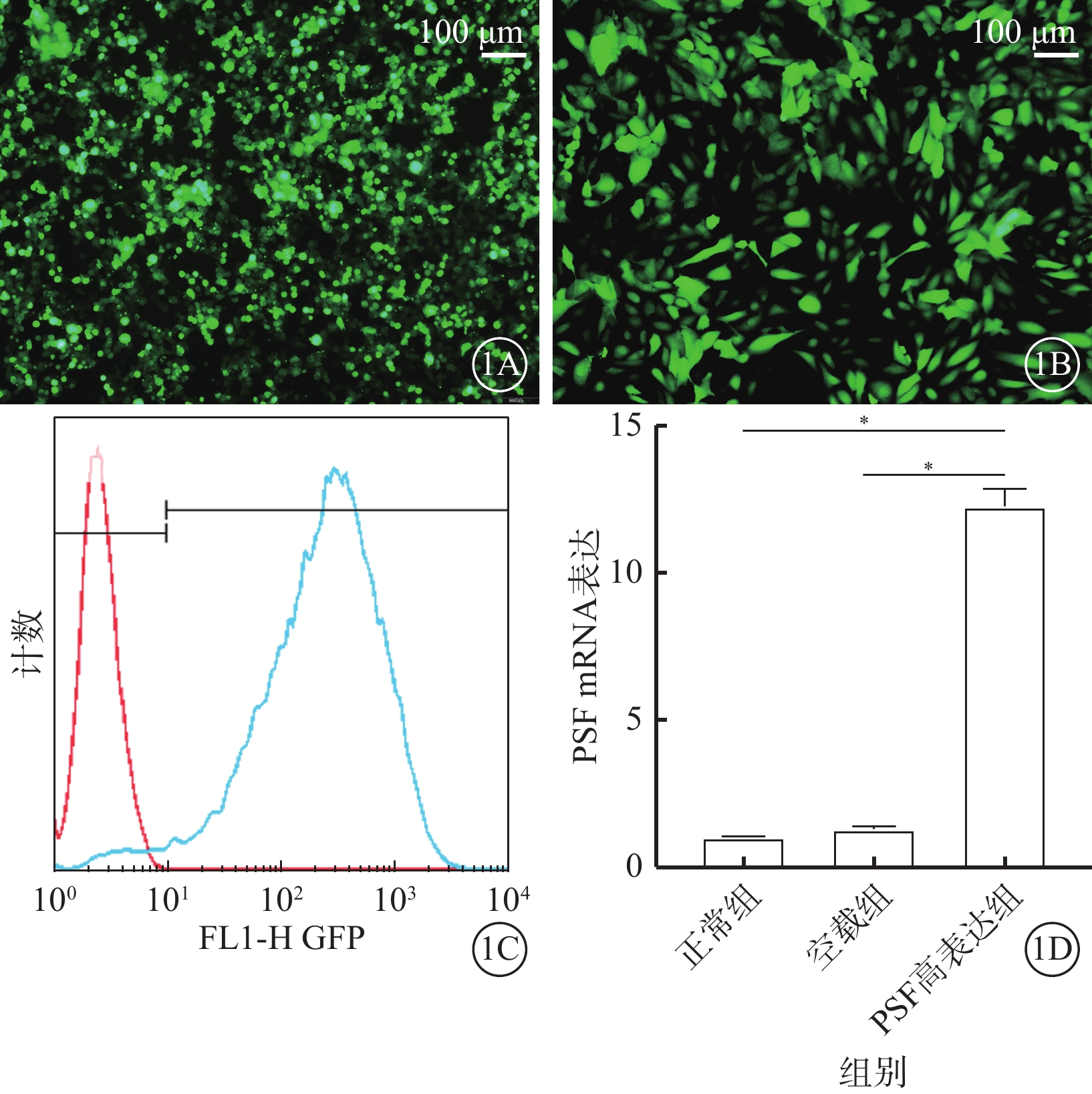 圖1
LV-PSF鑒定結果圖。1A示三質粒系統轉染293T細胞48 h后熒光顯微鏡像,可見293T細胞綠色熒光著染;1B示LV-PSF感染hRMECs 48 h后熒光顯微鏡像,可見hRMECs呈均勻綠色熒光著染;1C示流式細胞儀分析圖,LV-PSF感染效率為97%;1D示正常組、空載組、PSF高表達組hRMECs中PSF mRNA表達比較,*P<0.05。1A、1B標尺:100 μm
圖1
LV-PSF鑒定結果圖。1A示三質粒系統轉染293T細胞48 h后熒光顯微鏡像,可見293T細胞綠色熒光著染;1B示LV-PSF感染hRMECs 48 h后熒光顯微鏡像,可見hRMECs呈均勻綠色熒光著染;1C示流式細胞儀分析圖,LV-PSF感染效率為97%;1D示正常組、空載組、PSF高表達組hRMECs中PSF mRNA表達比較,*P<0.05。1A、1B標尺:100 μm
2.2 LV-PSF可顯著抑制OIR小鼠模型RNV形成
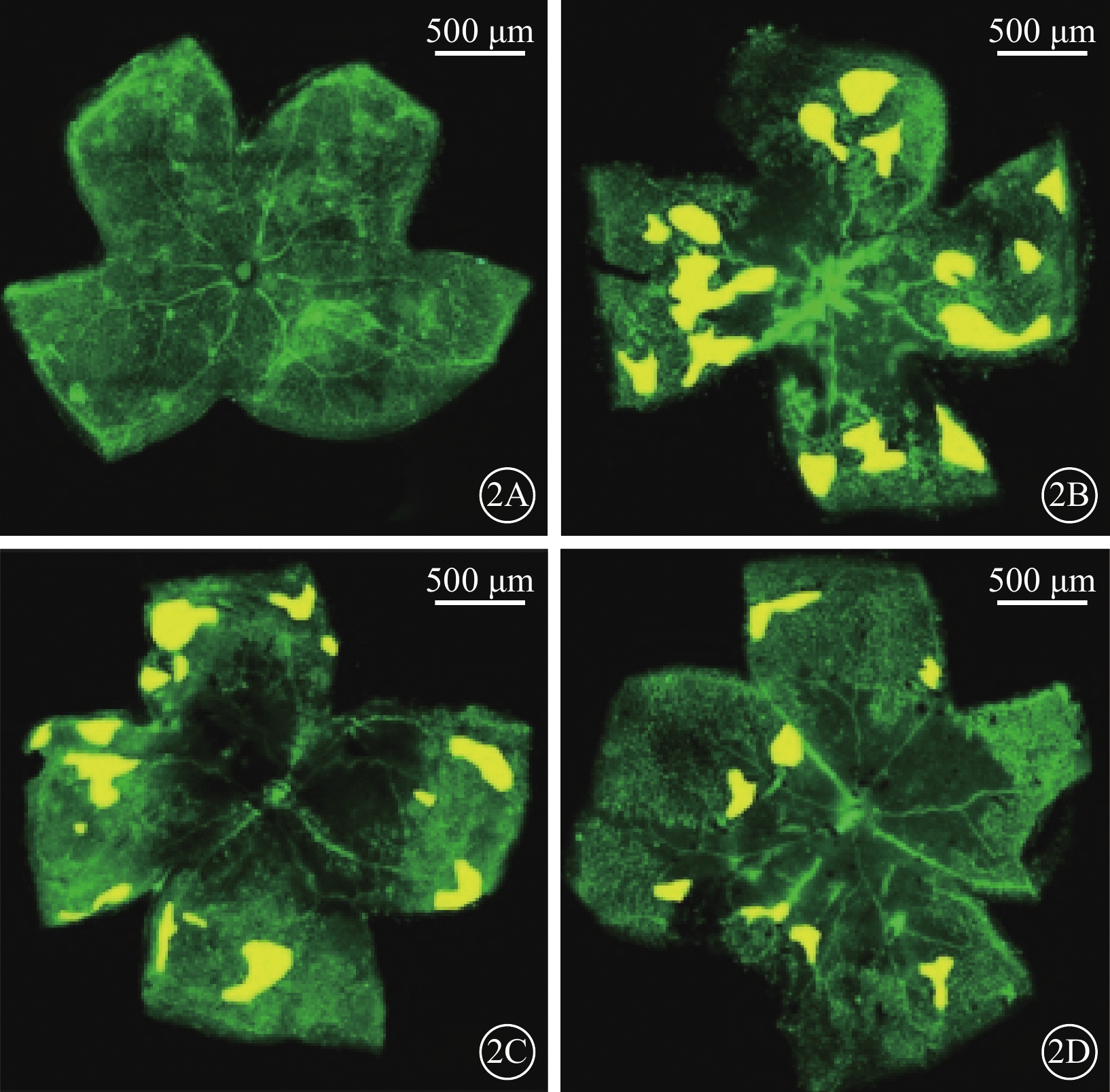
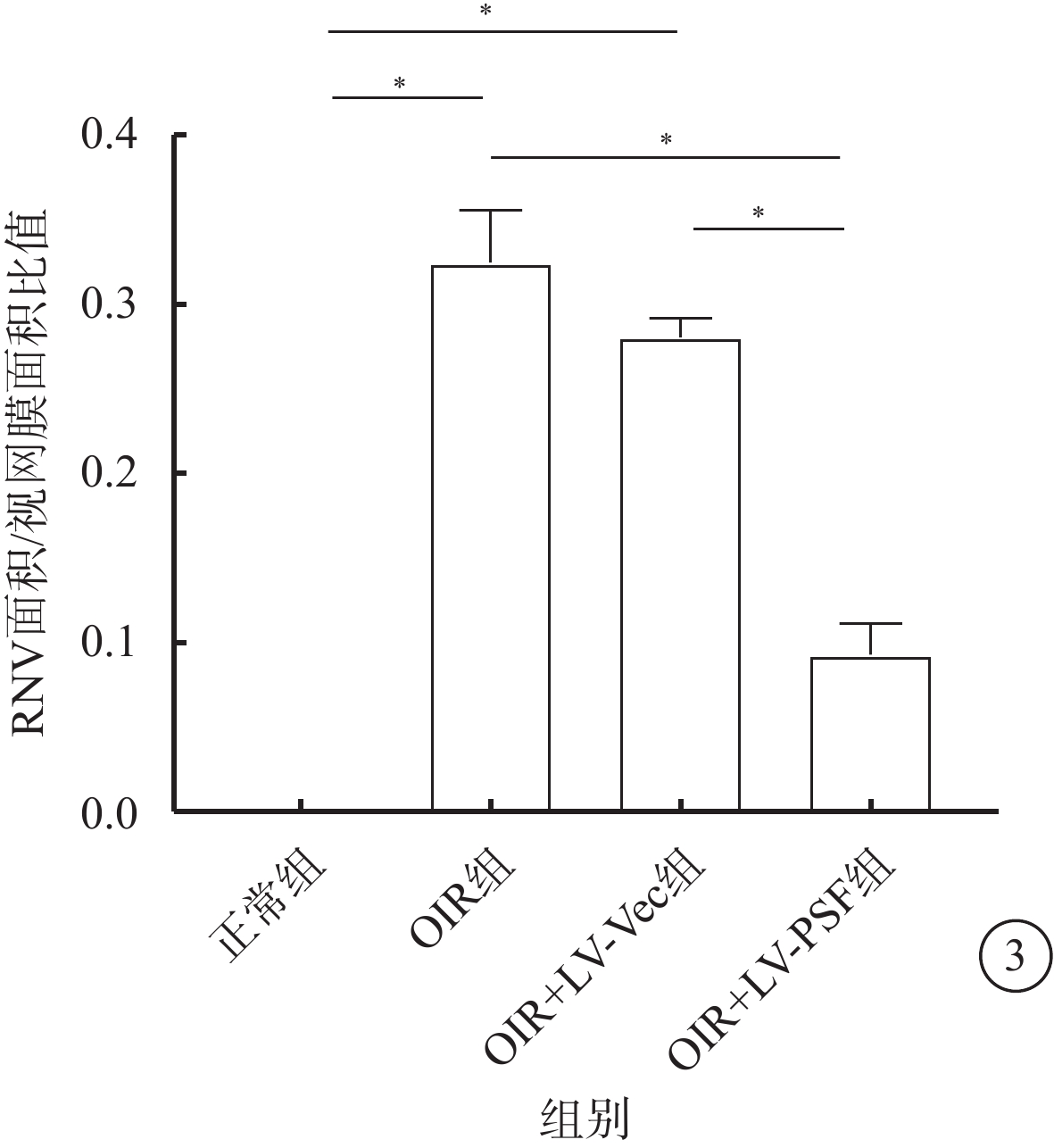
熒光顯微鏡觀察發現,正常組小鼠視網膜血管呈綠色熒光著染,未見異常視網膜血管;OIR組及OIR+LV-Vec組小鼠視網膜可見明顯的、位于視網膜中央的無灌注區以及位于無灌注區和血管分布區交界處的病理性新生血管簇;OIR+LV-PSF組小鼠視網膜可見少量分散分布的病理性新生血管簇(圖2)。正常組、OIR組、OIR+LV-Vec組和OIR+LV-PSF組小鼠RNV面積/視網膜面積比較,差異有統計學意義(F=204.90,P<0.05)。組間兩兩比較,OIR組、OIR+LV-Vec組小鼠RNV面積較正常組明顯增加(t=18.31、43.71),OIR+LV-PSF組小鼠RNV面積較OIR組、OIR+LV-Vec組明顯減小(t=11.30、15.47),差異均有統計學意義(P<0.05)(圖3)。
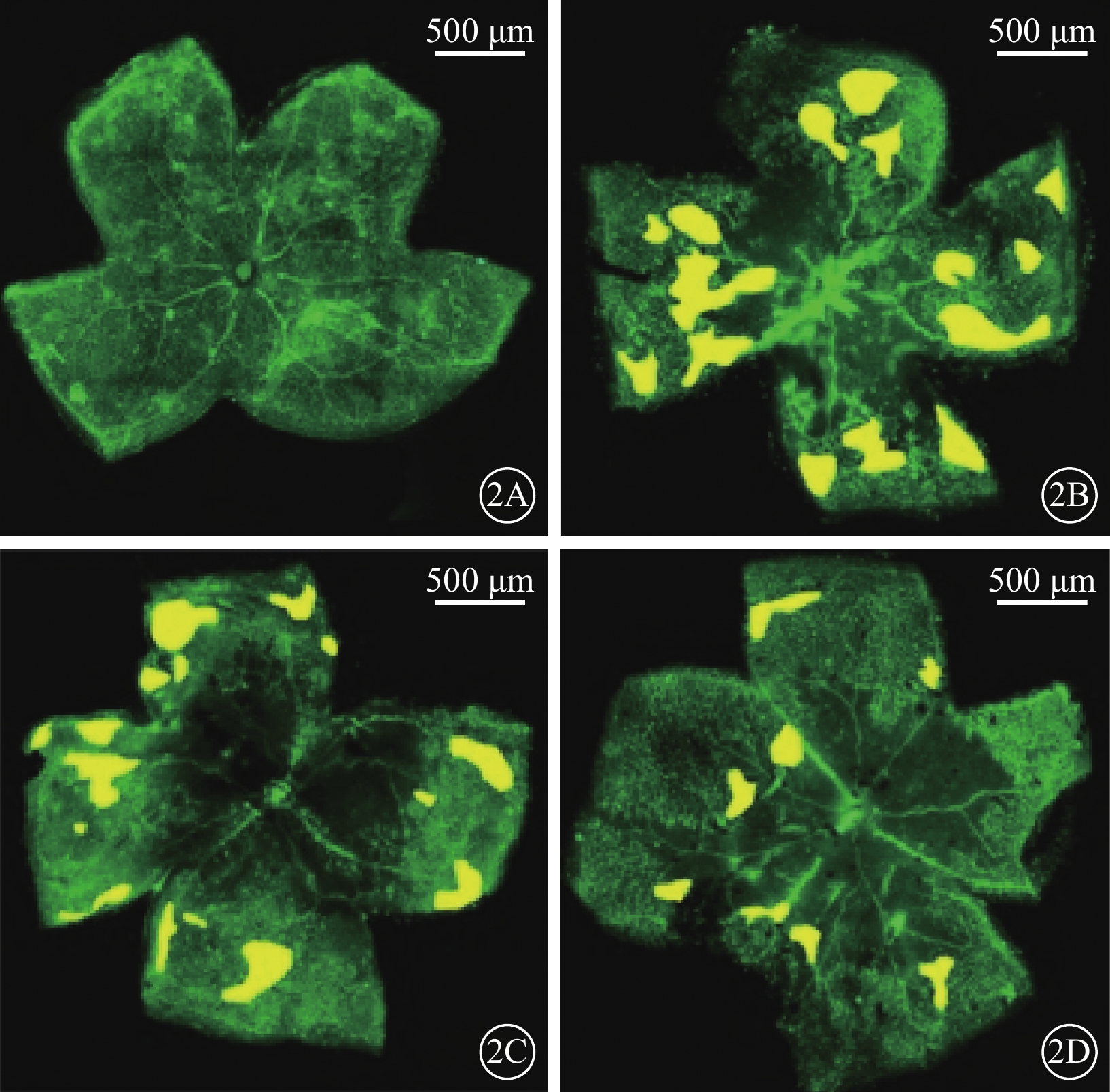 圖2
小鼠視網膜鋪片熒光顯微鏡像。2A示正常組;2B示OIR組;2C示OIR+LV-Vec組;2D示OIR+LV-PSF組。OIR組、OIR+LV-Vec組小鼠RNV簇較正常組明顯增加,OIR+LV-PSF組小鼠RNV簇較OIR組、OIR+LV-Vec組明顯減少 標尺:500 μm
圖2
小鼠視網膜鋪片熒光顯微鏡像。2A示正常組;2B示OIR組;2C示OIR+LV-Vec組;2D示OIR+LV-PSF組。OIR組、OIR+LV-Vec組小鼠RNV簇較正常組明顯增加,OIR+LV-PSF組小鼠RNV簇較OIR組、OIR+LV-Vec組明顯減少 標尺:500 μm
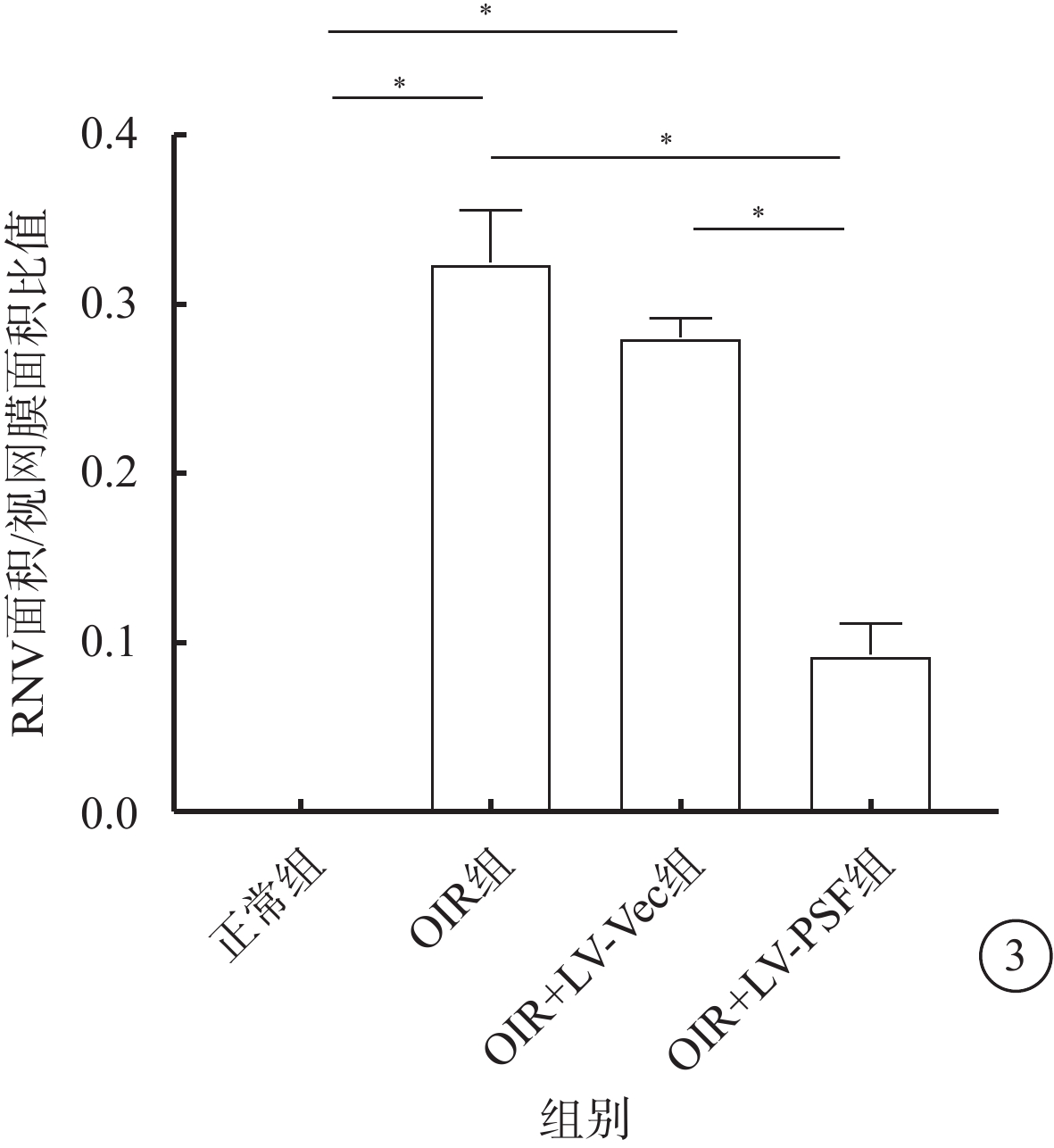 圖3
各組小鼠RNV面積/視網膜面積的比值比較。*P<0.05
圖3
各組小鼠RNV面積/視網膜面積的比值比較。*P<0.05
2.3 PSF可抑制缺氧刺激后hRMECs的增生、遷移能力
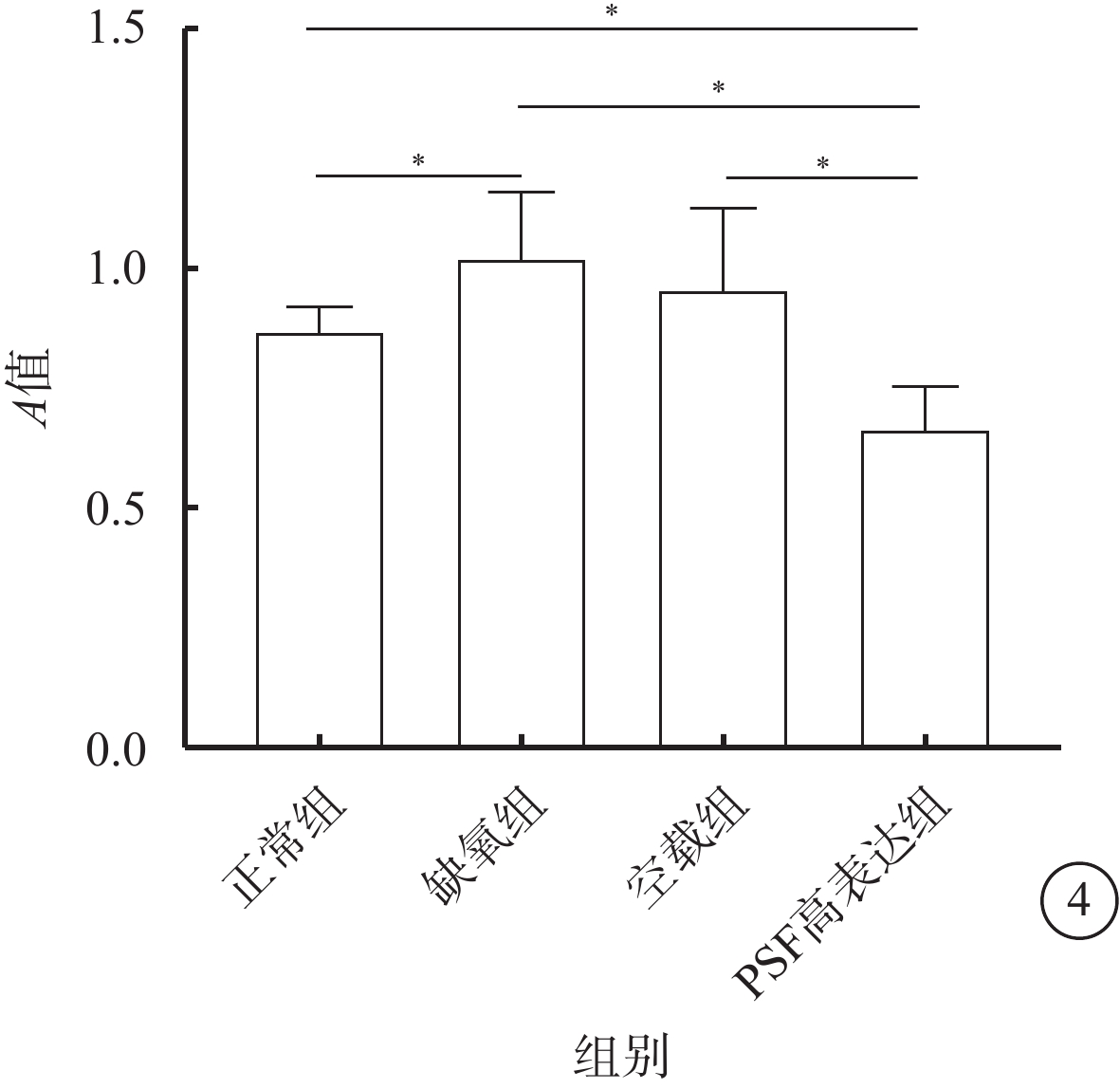
MTT比色法檢測結果顯示,缺氧組hRMECs增生能力較正常組明顯升高(t=2.57),PSF高表達組hRMECs增生能力較正常組、缺氧組和空載組明顯降低(t=5.26、5.46、3.73),差異均有統計學意義(P<0.05)(圖4)。
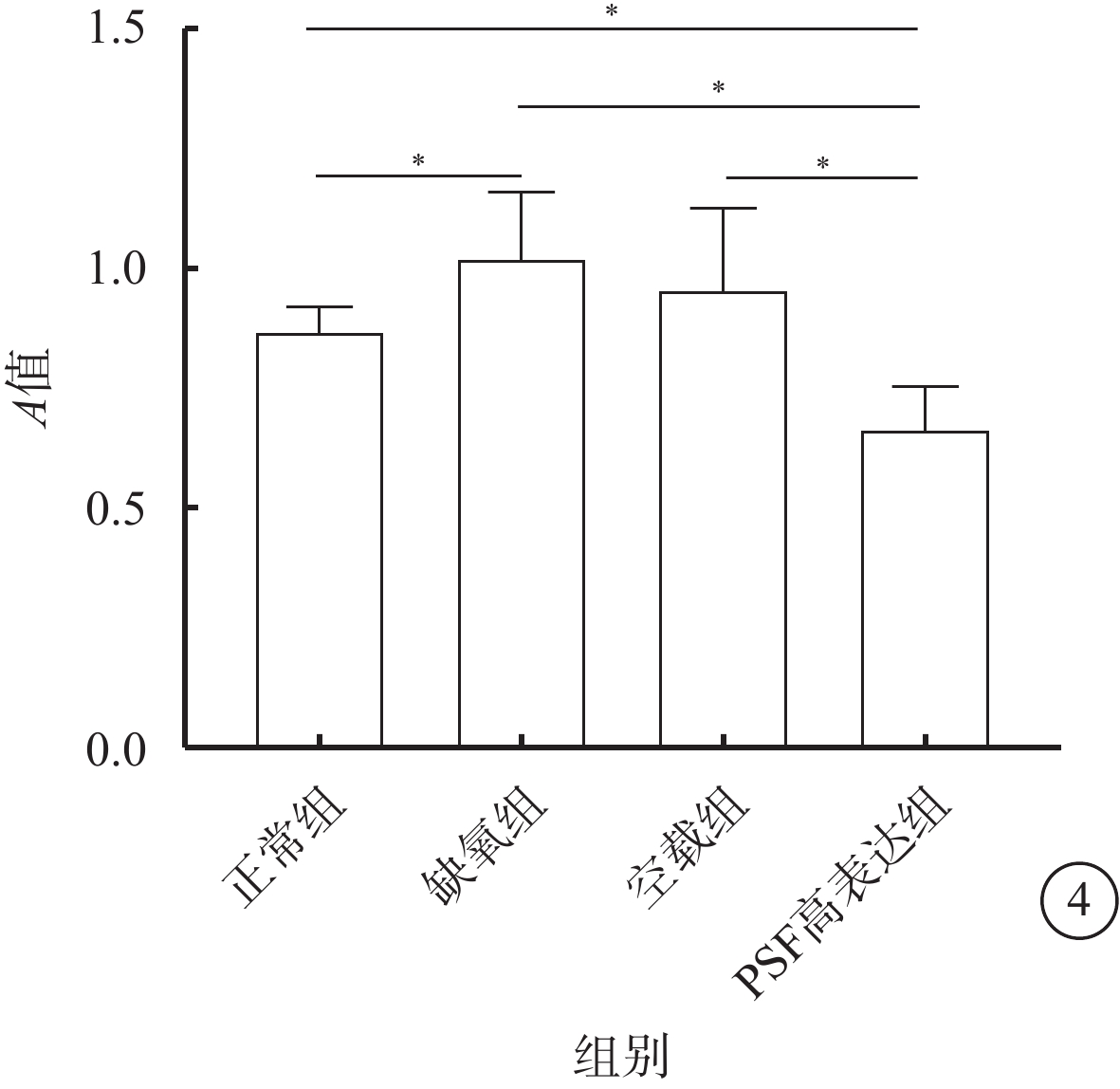 圖4
各組細胞增生能力比較。*P<0.05
圖4
各組細胞增生能力比較。*P<0.05
細胞劃痕實驗結果顯示,缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯(圖5)。定量分析結果顯示,缺氧刺激3 h恢復正常條件24 h或48 h均可刺激hRMECs遷移(t=8.35、13.84,P<0.05)。PSF高表達組hRMECs遷移率相對正常組、缺氧組和空載組明顯降低,差異有統計學意義(t=10.99、18.27、9.75、8.93、26.94、7.01,P<0.05)(圖6)。
 圖5
細胞劃痕實驗光學顯微鏡像。6A~6D示正常組、缺氧組、空載組、PSF高表達組0 h;6E~6H示正常組、缺氧組、空載組、PSF高表達組24 h;6I~6L示正常組、缺氧組、空載組、PSF高表達組48 h。缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯 ×20
圖5
細胞劃痕實驗光學顯微鏡像。6A~6D示正常組、缺氧組、空載組、PSF高表達組0 h;6E~6H示正常組、缺氧組、空載組、PSF高表達組24 h;6I~6L示正常組、缺氧組、空載組、PSF高表達組48 h。缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯 ×20
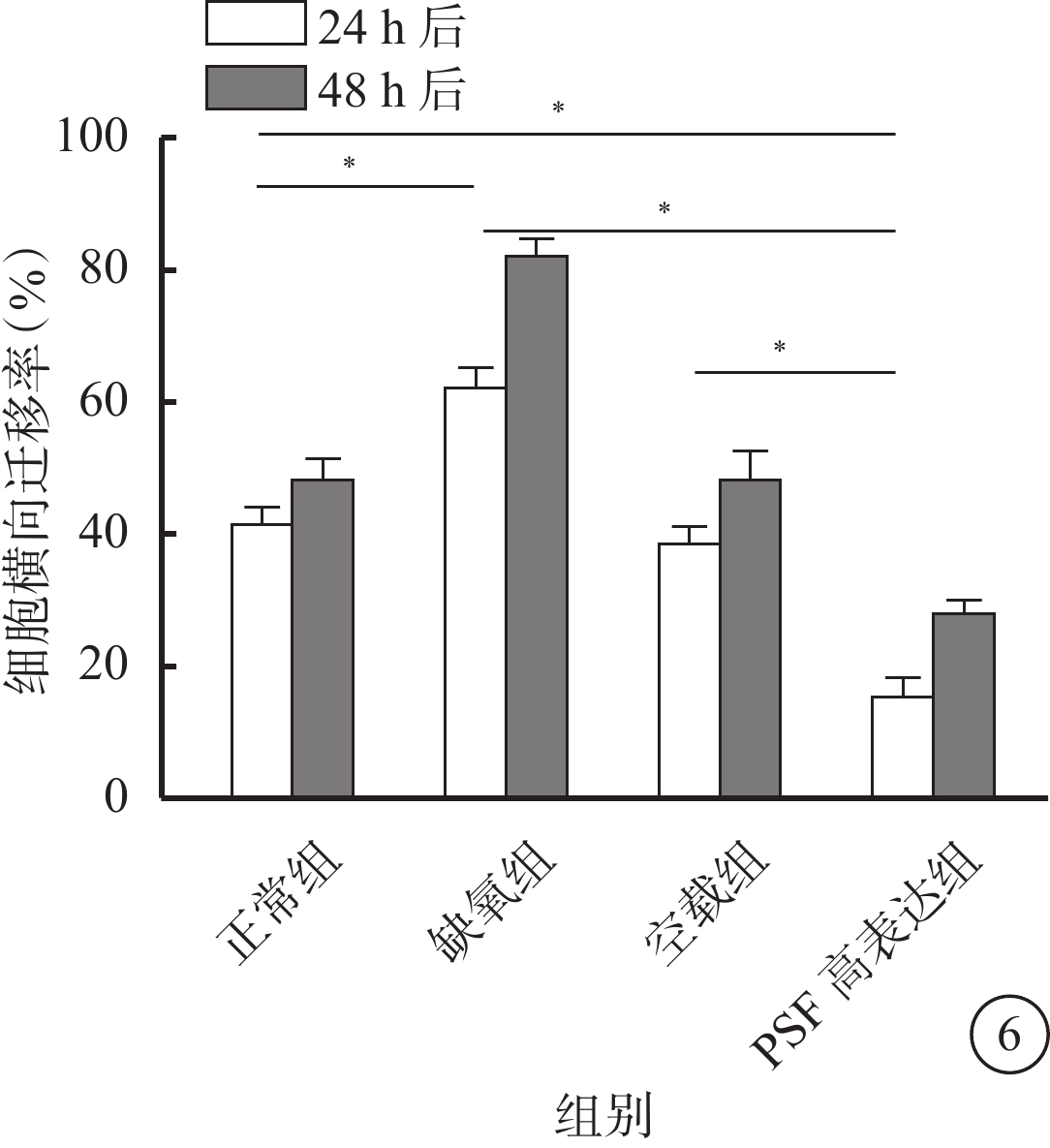 圖6
各組細胞橫向遷移率比較。*P<0.05
圖6
各組細胞橫向遷移率比較。*P<0.05
Transwell小室實驗結果顯示,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少(圖7A~7C)。PSF高表達組微孔膜上染色的細胞數較正常組、空載組明顯減少,差異有統計學意義(t=9.334、6.149,P<0.05)(圖7D)。
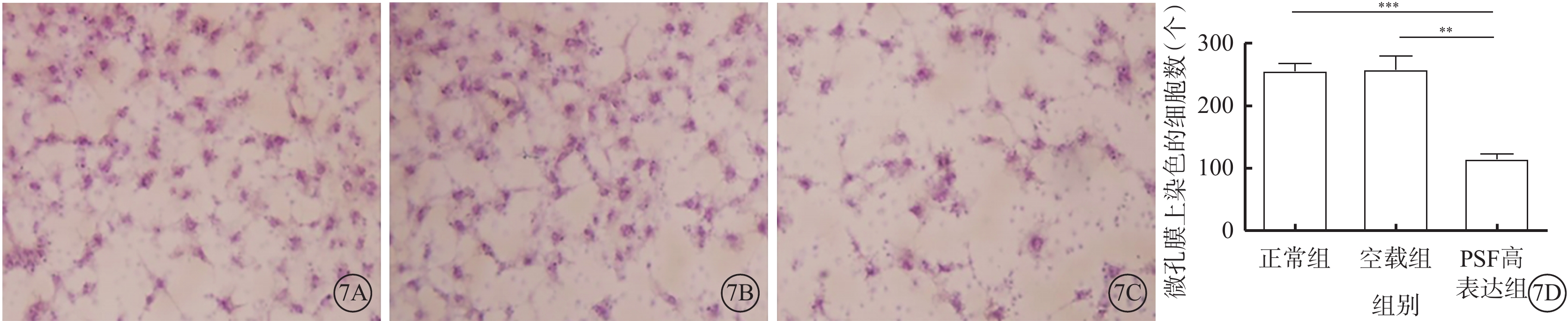 圖7
Transwell細胞遷移實驗光學顯微鏡像及各組細胞縱向遷移率比較圖。7A~7C分別示正常組、空載組、PSF高表達組光學顯微鏡像,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少 ×10;7D示各組細胞縱向遷移率比較,*P<0.05
圖7
Transwell細胞遷移實驗光學顯微鏡像及各組細胞縱向遷移率比較圖。7A~7C分別示正常組、空載組、PSF高表達組光學顯微鏡像,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少 ×10;7D示各組細胞縱向遷移率比較,*P<0.05
2.4 PSF通過HIF-1α/VEGF信號通路抑制hRMECs功能
RT-PCR檢測結果顯示,與正常組比較,缺氧組、空載組hRMECs中HIF-1α、VEGF的mRNA表達明顯增加,差異有統計學意義(t=15.23、21.09,P<0.05);PSF mRNA表達無明顯變化,差異無統計學意義(t=0.12、2.15,P>0.05)。與缺氧組、空載組比較,PSF高表達組hRMECs中HIF-1α、VEGF的mRNA表達明顯下降(t=10.18、13.10),PSF mRNA表達明顯增加(t=65.00、85.79),差異均有統計學意義(P<0.05)(圖8)。
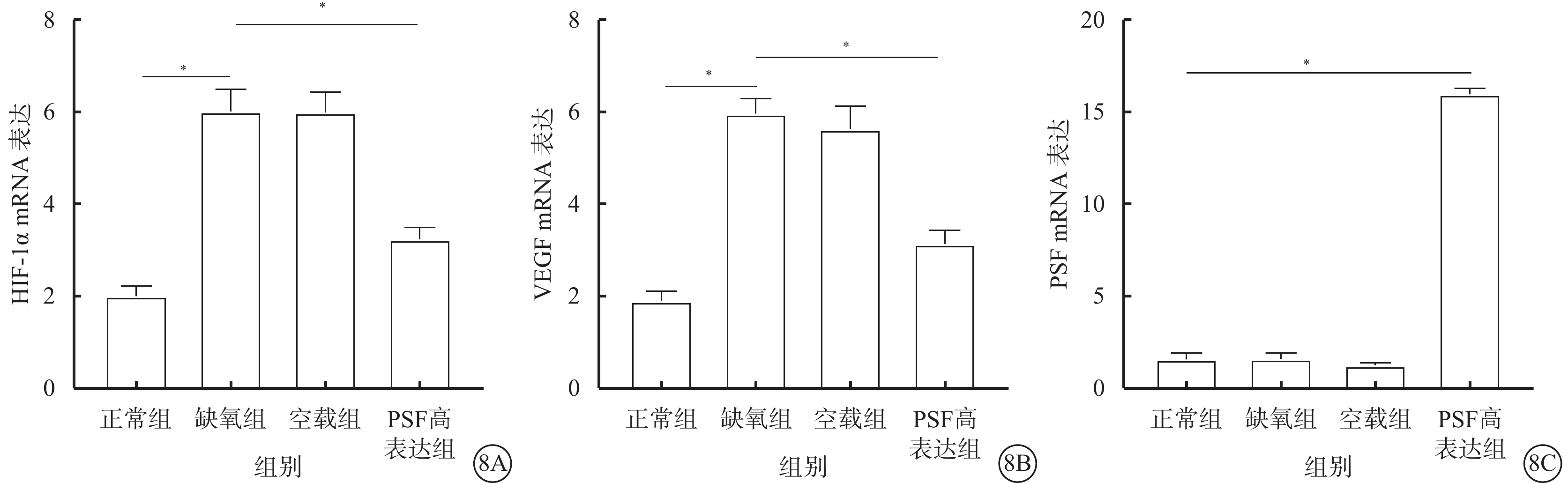 圖8
各組細胞HIF-1α、VEGF、PSF mRNA表達比較。8A示HIF-1α;8B示VEGF;8C示PSF。*P<0.05
圖8
各組細胞HIF-1α、VEGF、PSF mRNA表達比較。8A示HIF-1α;8B示VEGF;8C示PSF。*P<0.05
3 討論
我們的前期體外實驗結果顯示,高表達的PSF可以活化磷脂酰肌醇3激酶/絲氨酸-蘇氨酸蛋白激酶信號通路,下調VEGF的表達[8];體內實驗結果顯示,玻璃體腔注射PSF可有效下調小鼠視網膜組織中VEGF表達水平[9]。通過這些研究成果不難發現PSF的作用方式是多途徑、多層面的,涉及的細胞類型也不局限于血管內皮細胞。基因治療是一種基于外源性引入遺傳物質以改變細胞基因表達情況從而達到治療疾病目的的新措施,可以將外源性具有較強治療作用的基因片段導入眼內,使其在眼內表達治療基因產物,以達到持續而高效地治療眼內疾病的目的。病毒載體現已成為基因治療載體的研究熱點[10-12]。本研究選擇的慢病毒載體,具有基因整合功能,病毒基因組整合于目的細胞后可以長時間、穩定地表達目的基因,感染細胞類型包括分裂細胞和不分裂細胞,并且適用于感染難度較大的細胞[13]。在此基礎之上進一步選擇OIR模型來進行體內實驗,觀察PSF對缺氧誘導的RNV的影響,并通過在體外試驗中采用更為貼近人體的hRMECs作為缺氧模型的細胞,以期收集更為全面的生物學信息,解讀PSF在RNV中的作用。
本研究首先通過MTT比色法預實驗選擇缺氧刺激hRMECs增生的最佳條件,結果表明在2%氧濃度作用3 h恢復正常培養條件24 h能顯著誘導hRMECs增生;高表達hRMECs中PSF水平則可明顯抑制細胞的增生能力。其次,我們還研究了PSF對hRMECs遷移能力的影響,一方面依據細胞劃痕實驗可以觀察細胞橫向遷移使劃痕愈合的能力;另一方面Transwell細胞遷移實驗通過觀察細胞能否縱向穿過Transwell小室基底膜上的微孔進入下室,從而評價細胞的縱向遷移能力。通過這兩種方式,可以更為全面立體地模擬體內視網膜血管內皮細胞的遷移過程。細胞劃痕實驗結果表明,缺氧可刺激缺氧組和空載組hRMECs水平遷移能力,但PSF組hRMECs的遷移程度卻受到抑制。Transwell細胞遷移實驗結果顯示,相對于正常組和空載組,PSF過表達可以抑制hRMECs的垂直遷移能力。這兩項實驗結果證明,PSF可以抑制缺氧刺激hRMECs的橫向和縱向遷移能力,從而發揮抑制缺氧誘導細胞遷移的作用。我們還發現,體外缺氧誘導的hRMECs中HIF-1α和VEGF的轉錄水平均明顯升高,但細胞中高水平的PSF則會明顯抑制兩者的表達。這提示在體外缺氧刺激的條件下,PSF通過負性調控HIF-1α/VEGF信號通路轉錄而發揮抑制hRMECs功能的作用。
本研究通過體內和體外實驗較全面地揭示了PSF對RNV的作用,并闡述了其作用機制,為RNV性疾病的治療提供了新的思路和方向。
生理條件下,眼內的促血管生成分子和抑制血管生成分子之間存在著動態平衡,但在病理情況下由于缺氧、局部缺血和炎癥會影響包括VEGF和色素上皮衍生因子在內的許多生長因子表達,從而導致視網膜新生血管(RNV)產生[1]。盡管激光光凝治療和抗VEGF藥物治療在臨床上取得一定的治療效果,但由于對RNV的確切機制尚未研究透徹,臨床上仍缺乏RNV的特異性和高效的治療措施,因此挖掘抑制RNV形成的調控因子并深入探究其作用機制具有重要的臨床意義[2-5]。多聚嘧啶序列結合蛋白相關剪接因子(PSF)是參與多種基因調節過程的核酸結合蛋白[6]。我們的前期研究發現,重組腺相關病毒PSF可以下調氧誘導視網膜病變(OIR)模型鼠視網膜VEGF的表達水平,提示PSF對缺氧狀態下RNV形成和人視網膜微血管內皮細胞(hRMECs)存在潛在的調控作用[7]。為深入探討PSF的作用,本研究構建可穩定表達PSF的重組慢病毒(LV-PSF),一方面通過體內實驗驗證PSF對OIR模型鼠RNV的抑制作用;另一方面將LV-PSF引入缺氧狀態下細胞實驗體系中,旨在探究PSF對缺氧誘導hRMECs增生和遷移等功能的影響并挖掘PSF的作用機制,從而為以RNV為病理特征的眼部疾病治療提供潛在靶點。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
人腎上皮細胞系(293T)細胞株由天津醫科大學眼科研究所張曉敏主任惠贈。hRMECs購自北京北納科技有限公司。LV-PSF和空載慢病毒(LV-Vec)由本實驗室自行構建。10%胎牛血清(FBS)、青霉素/鏈霉素(P/S)、1倍DMEM培養基(美國Gibco公司),缺氧誘導裝置(美國Billups-Rothenberg公司),Lipofectamine 2000轉染試劑、cDNA逆轉錄試劑盒、BCA蛋白濃度檢測試劑盒、恒溫培養箱,超凈工作臺(美國Thermo Fisher公司),去內毒素質粒大量提取試劑盒、封閉山羊血清、5%BSA封閉液、抗熒光衰減封片劑、MTT、1倍PBS、Triton X-100、4%多聚甲醛(北京索萊寶科技有限公司),Trizol試劑、Isolectin GS-IB4、Alexa Fluor? 488 Conjugate(美國Invitrogen公司)。胰酶消化液(江蘇碧云天生物技術研究所),細胞培養板(美國Costar公司),移液器、Tip頭(德國Eppendorf公司),EP管、離心管(上海生物工程技術有限公司)。7900HT實時熒光定量PCR儀(美國ABI公司),FACSCalibur流式細胞儀(美國BD公司),熒光顯微鏡(日本Olympus公司),TDL-40B型臺式離心機(上海安亭科學儀器廠),DK-600A型電熱恒溫水浴箱(上海一恒科學儀器有限公司),細胞計數板(北京六一實驗儀器廠)。
1.2 細胞培養、重組慢病毒包裝及病毒滴度測定
正常細胞培養:293T細胞和hRMECs均使用含有10% FBS、P/S的DMEM培養基,置于37 ℃、95%空氣、5% CO2的密閉恒溫培養箱中進行培養。缺氧刺激細胞:將處于對數生長期的細胞或病毒感染后的細胞置于缺氧誘導裝置中,向裝置中充氮氣直至氧氣濃度達到2%,將缺氧誘導裝置置于37 ℃、5% CO2培養箱中培養。
質粒提取及測定:在NCBI基因數據庫中查詢獲取人類PSF的核酸序列,基因序列號為NM_005066.2,由本實驗室自行設計并合成重組質粒及大腸桿菌菌液。按照去內毒素質粒大量提取試劑盒說明書步驟提取質粒,通過酶切法和測序法鑒定目的質粒。重組慢病毒包裝及濃縮:將293T細胞以2×107個/ml的密度復蘇在75 cm塑料培養瓶中,待其生長到80%~90%融合度時進行傳代,傳至3~4代且融合度為60%以上時用于病毒包裝。將目的質粒(pCDH-CMV-PSF-EF1-copGFP)和空載質粒(pEGFP-Vec)分別與穿梭質粒(pCMV-VSV-G)及包裝質粒(psPAX2)以4:1:3的質量比構成三質粒系統,并和Lipofectamine 2000轉染試劑(5~6 μl/ml)混合,室溫孵育30 min。棄去細胞培養瓶中的培養液,加入孵育好的混合物后培養30 min,再加入等量完全培養液培養4~6 h后更換一次培養液。感染后24~48 h可觀察到綠色熒光蛋白(GFP)表達情況,48~72 h可以收集病毒。將培養瓶中的上清液轉移至50 ml離心管中,以離心半徑15 cm、1500 r/min在4 ℃條件下離心10 min,再經0.45 μm過濾器過濾。將上清液、濃縮液按8:3的比例向過濾后的上清液中添加濃縮液,以4500×g在4 ℃條件下離心15 min,小心棄去液體,用完全培養液重懸病毒顆粒,分裝凍存于?80 ℃冰箱或直接使用。采用批量快速測定法測定病毒滴度,后續實驗中按照測定的病毒滴度計算體內實驗和體外實驗的作用濃度。
1.3 重組慢病毒感染hRMECs、流式細胞儀測定感染效率及實時熒光定量PCR(RT-PCR)測量hRMECs中PSF mRNA表達
將hRMECs以5×105個/ml的密度接種于12孔板,并將其分為正常組、空載組、PSF高表達組。正常組為正常體外培養的hRMECs;空載組為經LV-Vec感染的hRMECs;PSF高表達組為經LV-PSF感染的hRMECs。當細胞融合度達50%左右時,正常組繼續培養,空載組和PSF組細胞棄去培養基,加入6 μg/ml聚凝胺孵育30 min后棄上清液,分別加入LV-Vec和LV- PSF感染,并于6 h后換完全培養液,48 h后于熒光顯微鏡下觀察GFP的表達情況。
正常組、空載組和PSF高表達組細胞按分組處理后,消化離心并棄去上清液,分別用500 μl PBS重懸成單細胞懸液加入到流式管中上機檢測。LV-Vec和LV-PSF表達GFP,可在波長為488 nm的藍光雷射激發下發出綠色熒光,選用FL-1通道檢測熒光信號。先檢測正常組樣品,調節電壓使細胞群處于陰性區,再檢測空載組和PSF高表達組,調節補償使陽性群細胞處于合適位置。每組樣品設置3個副孔,每孔獲取50 000個微粒信號,實驗重復進行3次,檢測結果通過Flowjo 7.6軟件進行分析。
正常組、空載組和PSF高表達組細胞按分組處理后,按Trizol Reagent說明書提取總RNA,反轉錄合成cDNA模板,行RT-PCR。引物序列由本實驗室設計,由蘇州金唯智公司合成(表1)。擴增條件:95 ℃預變性30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40個循環。目的基因擴增產物的相對含量用2-ΔΔCt計算。
1.4 PSF對OIR模型小鼠RNV的作用
7日齡健康C57B/L6小鼠20只,雌雄不限,體重(3.52±0.35)g,購自斯貝福(北京)生物技術有限公司。采用隨機數字表法將小鼠分為正常組、OIR組、OIR+LV-Vec組和OIR+LV-PSF組,每組5只。后3組小鼠置于氧氣濃度為(75±5)%的飼養箱中,溫度維持在(23±2)℃。OIR+LV-Vec組和OIR+LV-PSF組小鼠于12日齡時,經復方托吡卡胺滴眼液散瞳,0.4%鹽酸奧布卡因滴眼液表面麻醉后,手術顯微鏡下各組玻璃體腔分別注射1 μl LV-Vec和LV-PSF,注射完畢后給予左氧氟沙星滴眼液點眼。OIR組小鼠不做玻璃體腔注射,于12日齡時置于正常室內空氣中飼養。小鼠15日齡時,再次對OIR+LV-Vec組和OIR+LV-PSF組小鼠進行玻璃體腔注射重組慢病毒處理。正常組小鼠始終置于正常空氣環境中飼養,未做任何處理。
小鼠17日齡時,各組小鼠腹腔注射過量10%水合氯醛處死,立即摘取右眼眼球在4%多聚甲醛中室溫固定15 min,更換PBS冰上處理10 min。手術顯微鏡下剝離完整的視網膜,用100%甲醇固定15 min后,采用通透緩沖液(PBS緩沖液、1% BSA封閉液、0.5% Triton X-100及5%封閉山羊血清)處理視網膜2 h后用Alexa-488標記的Isolectin GS-IB4在4 ℃條件下孵育過夜。用PBS洗3遍后,將視網膜以RGC層向上平鋪于載玻片上,并滴加抗熒光衰減封片劑,蓋上蓋玻片,在熒光顯微鏡下用相同的光學參數拍照。
1.5 PSF對缺氧誘導hRMECs增生和遷移功能的影響
將hRMECs分為正常組(正常培養的hRMECs)、缺氧組(缺氧刺激3 h恢復正常培養條件24 h的hRMECs)、空載組(用LV-Vec感染hRMECs 48 h,再用缺氧刺激3 h恢復正常培養條件24 h)和PSF高表達組(用LV-PSF感染hRMECs 48 h,再用缺氧刺激3 h恢復正常培養條件24 h)。缺氧刺激3 h恢復正常培養條件24 h這一條件根據預實驗結果獲得。各組細胞以1×105個/ml的密度接種于96孔板,在分別進行各組刺激后,加入MTT孵育4 h后棄去培養上清液,加入150 μl DMSO,室溫靜置15 min后通過酶聯免疫檢測儀在490 nm波長處讀取吸光度[A,舊稱光密度(OD)]值。每組設置3個副孔,實驗重復進行3次。
將hRMECs以5×105個/ml的密度接種于12孔板,培養過夜后按正常組、缺氧組、空載組和PSF過表達組進行相應處理。除正常組之外,其余3組均進行缺氧培養3 h,進行劃痕處理并將此時計作0 h,繼續培養48 h。分別在培養24、48 h時,于4倍光學顯微鏡下隨機選取3個視野測量劃痕無細胞部分的面積,分別計算出24、48 h細胞遷移率。細胞遷移率=(最初劃痕面積?檢測時無細胞部分的面積)/最初劃痕面積。
hRMECs分為正常組、空載組和PSF過表達組,后兩組細胞在病毒感染后分別缺氧刺激3 h并恢復正常條件培養24 h。將3組細胞消化后以1.5×105個的密度接種于Transwell小室上室內,無血清培養基培養;下室加入100% FBS,培養10 h后吸出小室和24孔板內液體,用棉簽將小室上表面細胞輕輕擦掉,4%多聚甲醛固定Transwell小室下表面細胞15 min后PBS洗3次,經常規HE染色。將小室晾干,用無菌尖刀片將小室表面切下,進行中性樹膠封片。每組設置3個復孔,本實驗共重復3次。
1.6 統計學分析
采用SPSS18.0統計軟件行統計學分析。多樣本計量資料均數比較采用方差齊性檢驗,方差齊時采用方差分析,總體均數有差異時采用兩兩比較。P<0.05為差異有統計學意義。
2 結果
2.1 LV-PSF鑒定
熒光顯微鏡觀察發現,三質粒系統共同轉染293T細胞48 h后可見GFP表達(圖1A);在LV-PSF感染hRMECs 48 h后也可觀察到GFP表達(圖1B)。流式細胞儀計數測得LV-PSF感染效率為97%(圖1C)。RT-PCT測定結果顯示,感染后48 h,PSF高表達組hRMECs中PSF mRNA表達較正常組、空載組明顯增多,差異有統計學意義(t=32.85、30.60,P<0.05)(圖1D)。
 圖1
LV-PSF鑒定結果圖。1A示三質粒系統轉染293T細胞48 h后熒光顯微鏡像,可見293T細胞綠色熒光著染;1B示LV-PSF感染hRMECs 48 h后熒光顯微鏡像,可見hRMECs呈均勻綠色熒光著染;1C示流式細胞儀分析圖,LV-PSF感染效率為97%;1D示正常組、空載組、PSF高表達組hRMECs中PSF mRNA表達比較,*P<0.05。1A、1B標尺:100 μm
圖1
LV-PSF鑒定結果圖。1A示三質粒系統轉染293T細胞48 h后熒光顯微鏡像,可見293T細胞綠色熒光著染;1B示LV-PSF感染hRMECs 48 h后熒光顯微鏡像,可見hRMECs呈均勻綠色熒光著染;1C示流式細胞儀分析圖,LV-PSF感染效率為97%;1D示正常組、空載組、PSF高表達組hRMECs中PSF mRNA表達比較,*P<0.05。1A、1B標尺:100 μm
2.2 LV-PSF可顯著抑制OIR小鼠模型RNV形成
熒光顯微鏡觀察發現,正常組小鼠視網膜血管呈綠色熒光著染,未見異常視網膜血管;OIR組及OIR+LV-Vec組小鼠視網膜可見明顯的、位于視網膜中央的無灌注區以及位于無灌注區和血管分布區交界處的病理性新生血管簇;OIR+LV-PSF組小鼠視網膜可見少量分散分布的病理性新生血管簇(圖2)。正常組、OIR組、OIR+LV-Vec組和OIR+LV-PSF組小鼠RNV面積/視網膜面積比較,差異有統計學意義(F=204.90,P<0.05)。組間兩兩比較,OIR組、OIR+LV-Vec組小鼠RNV面積較正常組明顯增加(t=18.31、43.71),OIR+LV-PSF組小鼠RNV面積較OIR組、OIR+LV-Vec組明顯減小(t=11.30、15.47),差異均有統計學意義(P<0.05)(圖3)。
 圖2
小鼠視網膜鋪片熒光顯微鏡像。2A示正常組;2B示OIR組;2C示OIR+LV-Vec組;2D示OIR+LV-PSF組。OIR組、OIR+LV-Vec組小鼠RNV簇較正常組明顯增加,OIR+LV-PSF組小鼠RNV簇較OIR組、OIR+LV-Vec組明顯減少 標尺:500 μm
圖2
小鼠視網膜鋪片熒光顯微鏡像。2A示正常組;2B示OIR組;2C示OIR+LV-Vec組;2D示OIR+LV-PSF組。OIR組、OIR+LV-Vec組小鼠RNV簇較正常組明顯增加,OIR+LV-PSF組小鼠RNV簇較OIR組、OIR+LV-Vec組明顯減少 標尺:500 μm
 圖3
各組小鼠RNV面積/視網膜面積的比值比較。*P<0.05
圖3
各組小鼠RNV面積/視網膜面積的比值比較。*P<0.05
2.3 PSF可抑制缺氧刺激后hRMECs的增生、遷移能力
MTT比色法檢測結果顯示,缺氧組hRMECs增生能力較正常組明顯升高(t=2.57),PSF高表達組hRMECs增生能力較正常組、缺氧組和空載組明顯降低(t=5.26、5.46、3.73),差異均有統計學意義(P<0.05)(圖4)。
 圖4
各組細胞增生能力比較。*P<0.05
圖4
各組細胞增生能力比較。*P<0.05
細胞劃痕實驗結果顯示,缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯(圖5)。定量分析結果顯示,缺氧刺激3 h恢復正常條件24 h或48 h均可刺激hRMECs遷移(t=8.35、13.84,P<0.05)。PSF高表達組hRMECs遷移率相對正常組、缺氧組和空載組明顯降低,差異有統計學意義(t=10.99、18.27、9.75、8.93、26.94、7.01,P<0.05)(圖6)。
 圖5
細胞劃痕實驗光學顯微鏡像。6A~6D示正常組、缺氧組、空載組、PSF高表達組0 h;6E~6H示正常組、缺氧組、空載組、PSF高表達組24 h;6I~6L示正常組、缺氧組、空載組、PSF高表達組48 h。缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯 ×20
圖5
細胞劃痕實驗光學顯微鏡像。6A~6D示正常組、缺氧組、空載組、PSF高表達組0 h;6E~6H示正常組、缺氧組、空載組、PSF高表達組24 h;6I~6L示正常組、缺氧組、空載組、PSF高表達組48 h。缺氧組與空載組細胞在缺氧刺激后明顯遷移,而PSF高表達組細胞在缺氧刺激后遷移不明顯 ×20
 圖6
各組細胞橫向遷移率比較。*P<0.05
圖6
各組細胞橫向遷移率比較。*P<0.05
Transwell小室實驗結果顯示,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少(圖7A~7C)。PSF高表達組微孔膜上染色的細胞數較正常組、空載組明顯減少,差異有統計學意義(t=9.334、6.149,P<0.05)(圖7D)。
 圖7
Transwell細胞遷移實驗光學顯微鏡像及各組細胞縱向遷移率比較圖。7A~7C分別示正常組、空載組、PSF高表達組光學顯微鏡像,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少 ×10;7D示各組細胞縱向遷移率比較,*P<0.05
圖7
Transwell細胞遷移實驗光學顯微鏡像及各組細胞縱向遷移率比較圖。7A~7C分別示正常組、空載組、PSF高表達組光學顯微鏡像,正常組和空載組微孔膜上染色的細胞數較多,而PSF高表達組微孔膜上染色的細胞數明顯減少 ×10;7D示各組細胞縱向遷移率比較,*P<0.05
2.4 PSF通過HIF-1α/VEGF信號通路抑制hRMECs功能
RT-PCR檢測結果顯示,與正常組比較,缺氧組、空載組hRMECs中HIF-1α、VEGF的mRNA表達明顯增加,差異有統計學意義(t=15.23、21.09,P<0.05);PSF mRNA表達無明顯變化,差異無統計學意義(t=0.12、2.15,P>0.05)。與缺氧組、空載組比較,PSF高表達組hRMECs中HIF-1α、VEGF的mRNA表達明顯下降(t=10.18、13.10),PSF mRNA表達明顯增加(t=65.00、85.79),差異均有統計學意義(P<0.05)(圖8)。
 圖8
各組細胞HIF-1α、VEGF、PSF mRNA表達比較。8A示HIF-1α;8B示VEGF;8C示PSF。*P<0.05
圖8
各組細胞HIF-1α、VEGF、PSF mRNA表達比較。8A示HIF-1α;8B示VEGF;8C示PSF。*P<0.05
3 討論
我們的前期體外實驗結果顯示,高表達的PSF可以活化磷脂酰肌醇3激酶/絲氨酸-蘇氨酸蛋白激酶信號通路,下調VEGF的表達[8];體內實驗結果顯示,玻璃體腔注射PSF可有效下調小鼠視網膜組織中VEGF表達水平[9]。通過這些研究成果不難發現PSF的作用方式是多途徑、多層面的,涉及的細胞類型也不局限于血管內皮細胞。基因治療是一種基于外源性引入遺傳物質以改變細胞基因表達情況從而達到治療疾病目的的新措施,可以將外源性具有較強治療作用的基因片段導入眼內,使其在眼內表達治療基因產物,以達到持續而高效地治療眼內疾病的目的。病毒載體現已成為基因治療載體的研究熱點[10-12]。本研究選擇的慢病毒載體,具有基因整合功能,病毒基因組整合于目的細胞后可以長時間、穩定地表達目的基因,感染細胞類型包括分裂細胞和不分裂細胞,并且適用于感染難度較大的細胞[13]。在此基礎之上進一步選擇OIR模型來進行體內實驗,觀察PSF對缺氧誘導的RNV的影響,并通過在體外試驗中采用更為貼近人體的hRMECs作為缺氧模型的細胞,以期收集更為全面的生物學信息,解讀PSF在RNV中的作用。
本研究首先通過MTT比色法預實驗選擇缺氧刺激hRMECs增生的最佳條件,結果表明在2%氧濃度作用3 h恢復正常培養條件24 h能顯著誘導hRMECs增生;高表達hRMECs中PSF水平則可明顯抑制細胞的增生能力。其次,我們還研究了PSF對hRMECs遷移能力的影響,一方面依據細胞劃痕實驗可以觀察細胞橫向遷移使劃痕愈合的能力;另一方面Transwell細胞遷移實驗通過觀察細胞能否縱向穿過Transwell小室基底膜上的微孔進入下室,從而評價細胞的縱向遷移能力。通過這兩種方式,可以更為全面立體地模擬體內視網膜血管內皮細胞的遷移過程。細胞劃痕實驗結果表明,缺氧可刺激缺氧組和空載組hRMECs水平遷移能力,但PSF組hRMECs的遷移程度卻受到抑制。Transwell細胞遷移實驗結果顯示,相對于正常組和空載組,PSF過表達可以抑制hRMECs的垂直遷移能力。這兩項實驗結果證明,PSF可以抑制缺氧刺激hRMECs的橫向和縱向遷移能力,從而發揮抑制缺氧誘導細胞遷移的作用。我們還發現,體外缺氧誘導的hRMECs中HIF-1α和VEGF的轉錄水平均明顯升高,但細胞中高水平的PSF則會明顯抑制兩者的表達。這提示在體外缺氧刺激的條件下,PSF通過負性調控HIF-1α/VEGF信號通路轉錄而發揮抑制hRMECs功能的作用。
本研究通過體內和體外實驗較全面地揭示了PSF對RNV的作用,并闡述了其作用機制,為RNV性疾病的治療提供了新的思路和方向。