引用本文: 崔莉, 周靜, 馬景學, 尚慶麗, 戴麗. 非腫瘤性自身免疫性視網膜病變一例. 中華眼底病雜志, 2019, 35(4): 395-396. doi: 10.3760/cma.j.issn.1005-1015.2019.04.019 復制
患者女,48歲。因雙眼閃光感、畏光、辨色困難、視物不清3個月,于2018年7月到我院就診。既往身體健康,無高血壓、糖尿病、心腦血管病史;無全身用藥及遺傳性疾病家族史;否認毒物接觸史。眼科檢查:右眼視力0.12,左眼視力0.1,矯正不能提高。雙眼眼壓正常。雙眼眼前節、眼底彩色照相、FFA、VEP檢查結果均未見明顯異常。FAF檢查,雙眼黃斑中心凹旁強自身熒光環(圖1)。OCT檢查,雙眼視網膜光感受器細胞-RPE復合層萎縮性改變(圖2);雙眼黃斑區RGC層厚度不同程度降低,右眼、左眼分別為73、74 μm。電腦視野檢查,右眼與生理盲點相連的鼻下方及顳側的弓形視野缺損,左眼上方及下方視野缺損及旁中心暗點(圖3A,3B);微視野(MP-3)檢查,黃斑區10°范圍內暗點存在及敏感度下降(圖3C,3D)。閃光視網膜電圖(FERG)檢查,暗適應、明適應、30 Hz閃爍光雙眼a、b波振幅重度降低。頭顱MRI,眼眶、肺、縱膈CT,正電子發射斷層成像(PET-CT),腹部、婦科、甲狀腺、雙側頸動脈彩色超聲,血、尿、凝血常規,生化全項檢查均未見異常。乙肝五項,丙肝、艾滋病抗體,梅毒血清特異性抗體均為陰性。血清免疫指標檢查中除血清總補體活性:20.7↓U/ml,免疫球蛋白E:191.20↑KU/L其余正常。癌胚抗原,甲胎蛋白,神經元特異性烯醇化酶,CA-125、CA-153、CA-199均在正常范圍。抗α-烯醇化酶抗體:強陽性;抗碳酸酐酶Ⅱ抗體抗體:陽性;抗CRMP-5抗體:陽性;抗恢復蛋白抗體:陰性。診斷:非腫瘤性自身免疫性視網膜病變(npAIR)。給予患者雙眼玻璃體腔注射曲安奈德試驗性治療。治療后7 d復查,雙眼RGC層厚度有所恢復,右眼、左眼均為76 μm;雙眼視野缺損范圍較治療前明顯縮小;微視野檢查,黃斑區10°范圍內敏感度較治療前提高(圖4)。
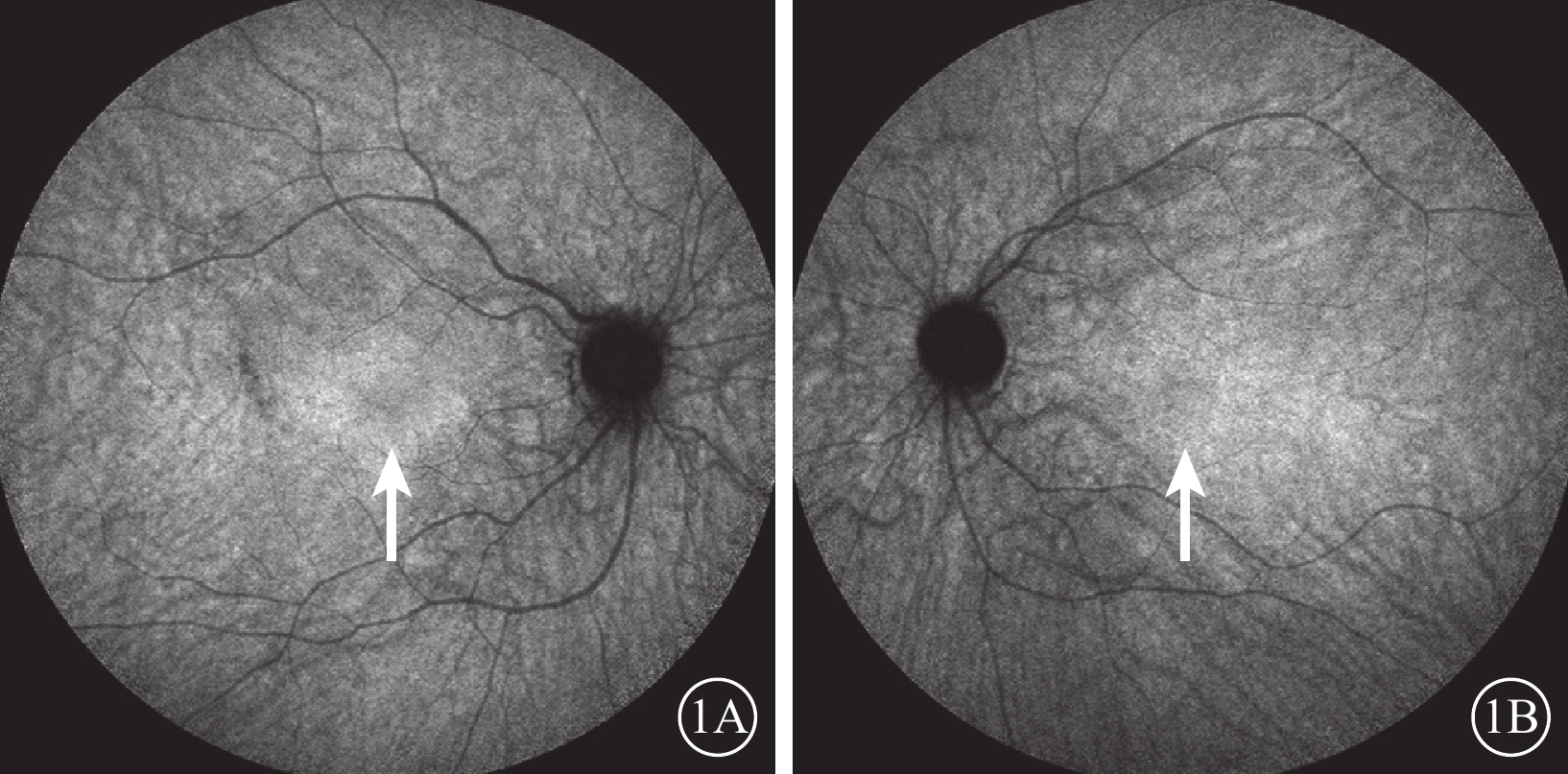 圖1
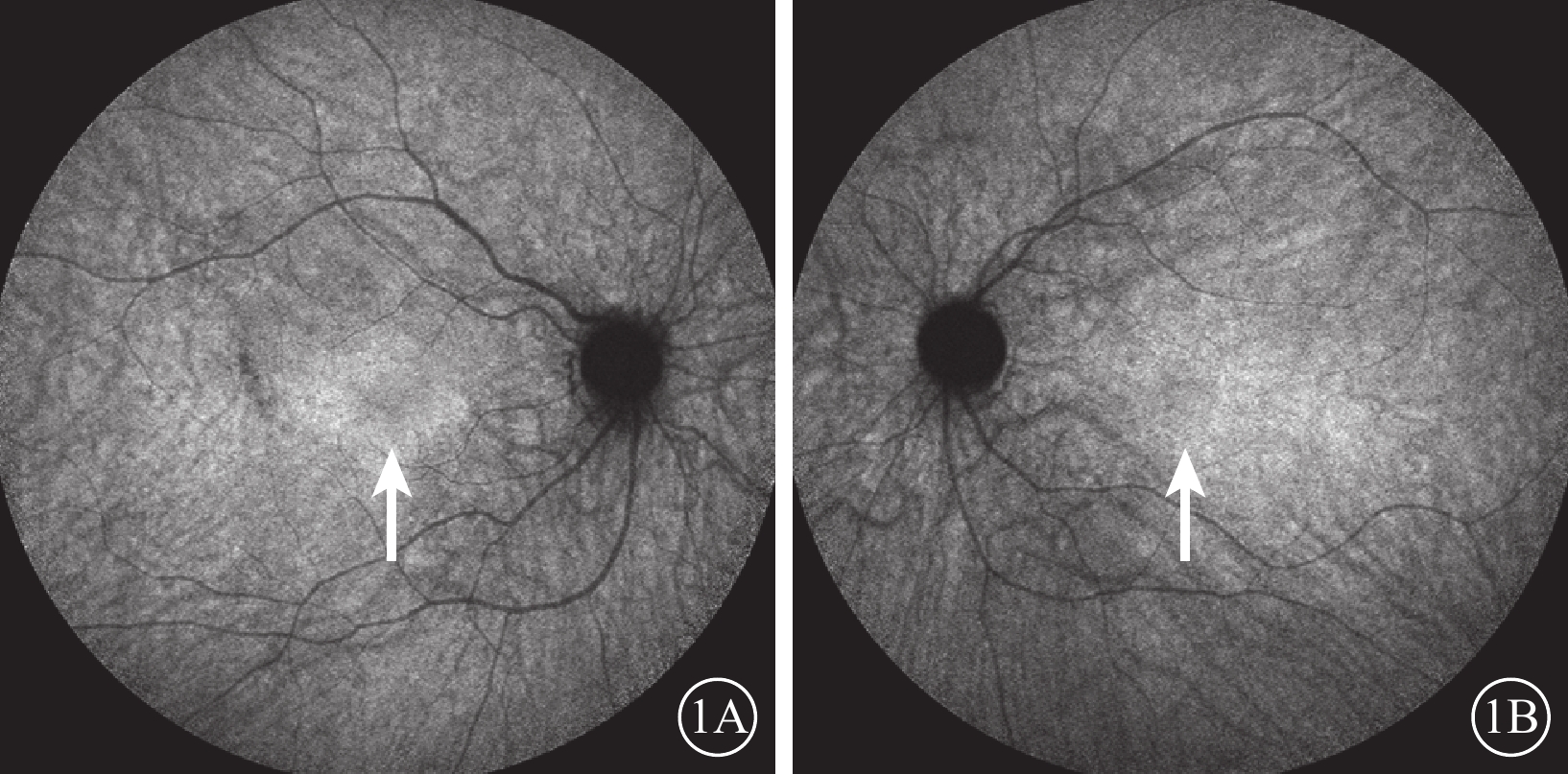
患者治療前FAF像。1A示右眼;1B示左眼。黃斑中心凹旁邊界清晰強自身熒光環(白箭)
圖1
患者治療前FAF像。1A示右眼;1B示左眼。黃斑中心凹旁邊界清晰強自身熒光環(白箭)
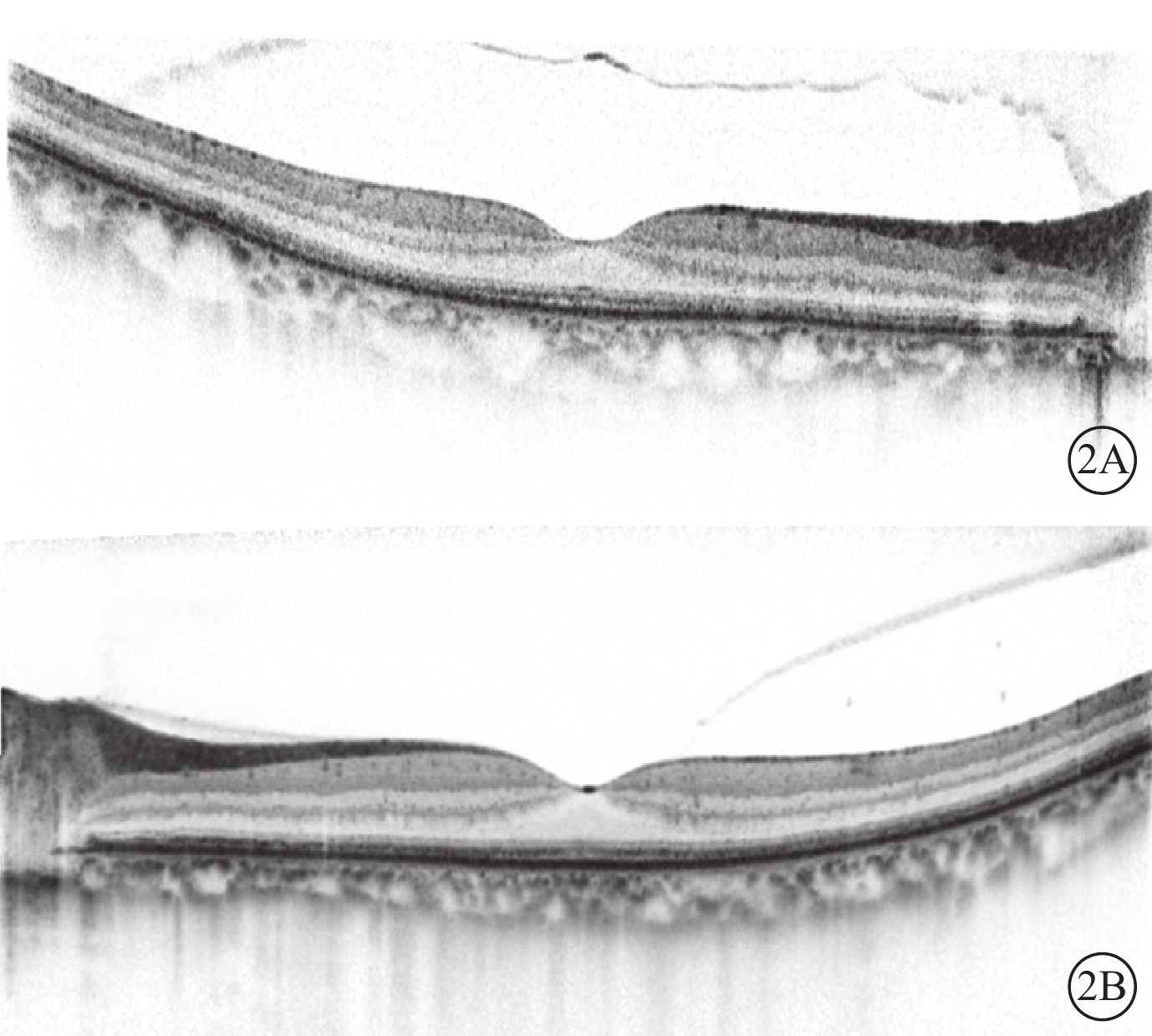 圖2
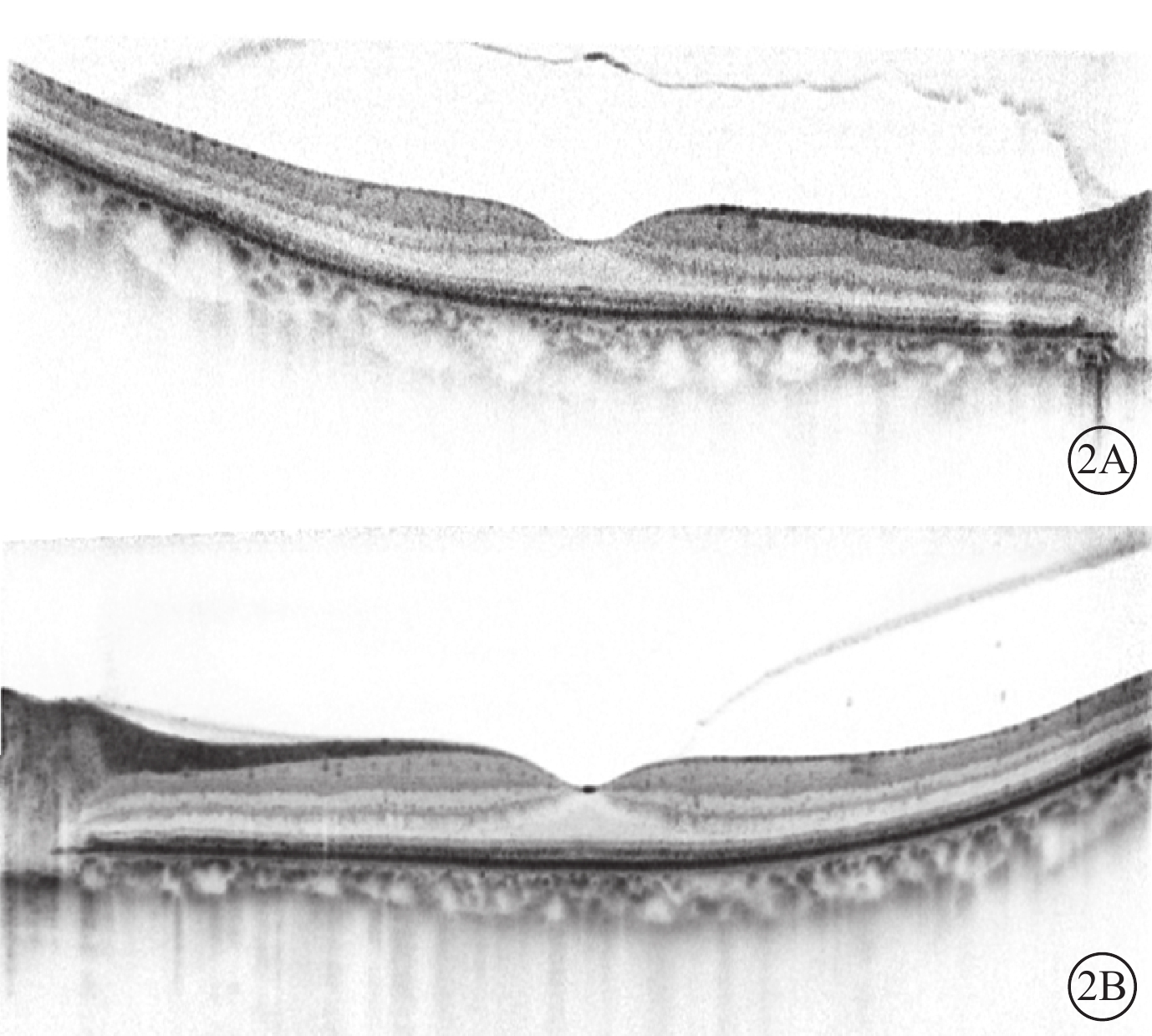
患者治療前OCT像。2A示右眼;2B示左眼。視網膜橢圓體帶反射信號不均勻減弱缺失、紊亂,部分外核層變薄,RPE層內側不連續、斑點狀反射信號,脈絡膜毛細血管層變薄或缺失
圖2
患者治療前OCT像。2A示右眼;2B示左眼。視網膜橢圓體帶反射信號不均勻減弱缺失、紊亂,部分外核層變薄,RPE層內側不連續、斑點狀反射信號,脈絡膜毛細血管層變薄或缺失
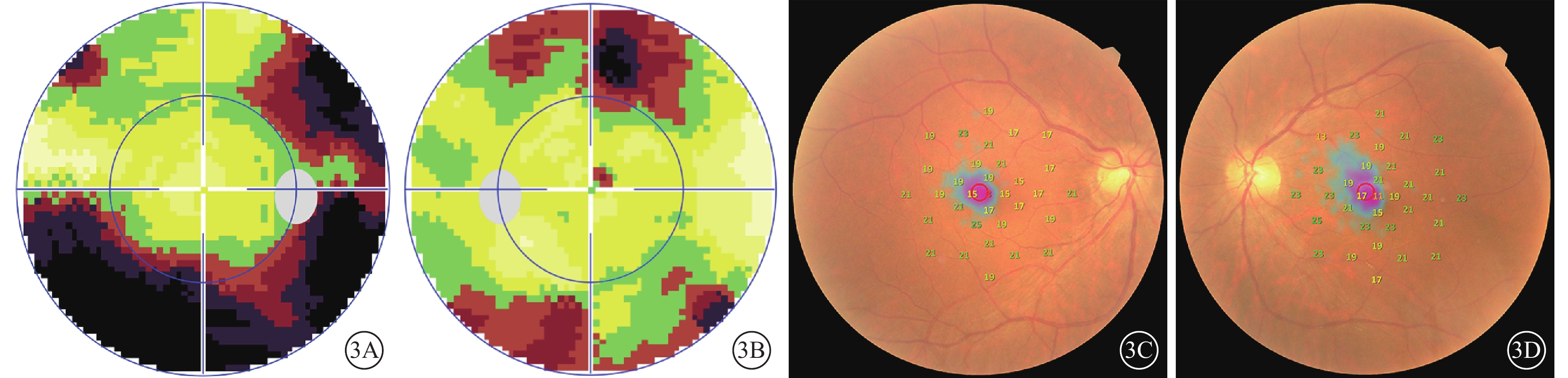 圖3
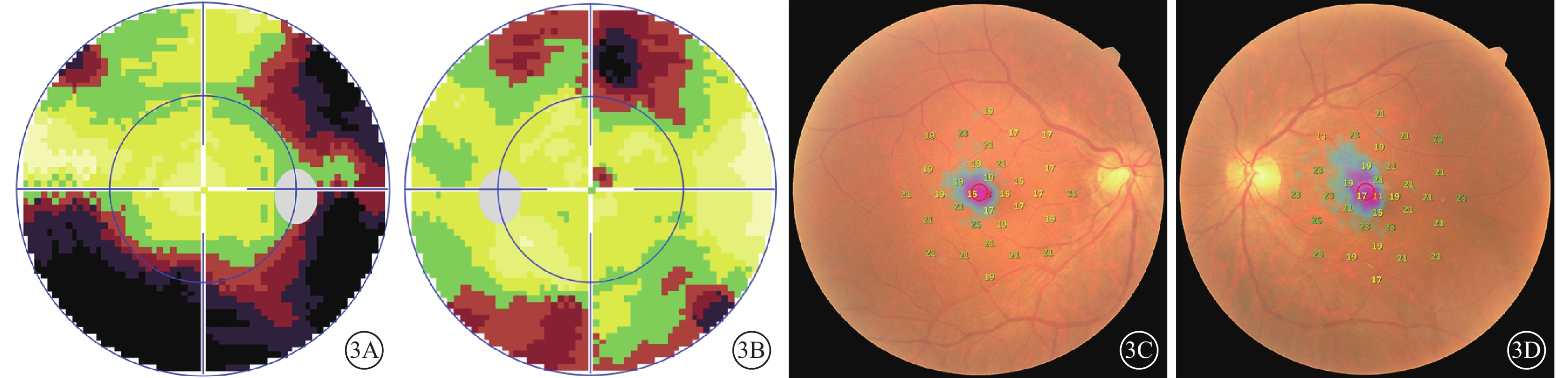
患者治療前視野檢查像。3A示右眼電腦視野像,可見與生理盲點相連的鼻下方及顳側的弓形視野缺損;3B示左眼電腦視野像,可見上方及下方視野缺損及旁中心暗點;3C、3D示右眼、左眼微視野像,可見黃斑區10°范圍內暗點存在及敏感度下降
圖3
患者治療前視野檢查像。3A示右眼電腦視野像,可見與生理盲點相連的鼻下方及顳側的弓形視野缺損;3B示左眼電腦視野像,可見上方及下方視野缺損及旁中心暗點;3C、3D示右眼、左眼微視野像,可見黃斑區10°范圍內暗點存在及敏感度下降
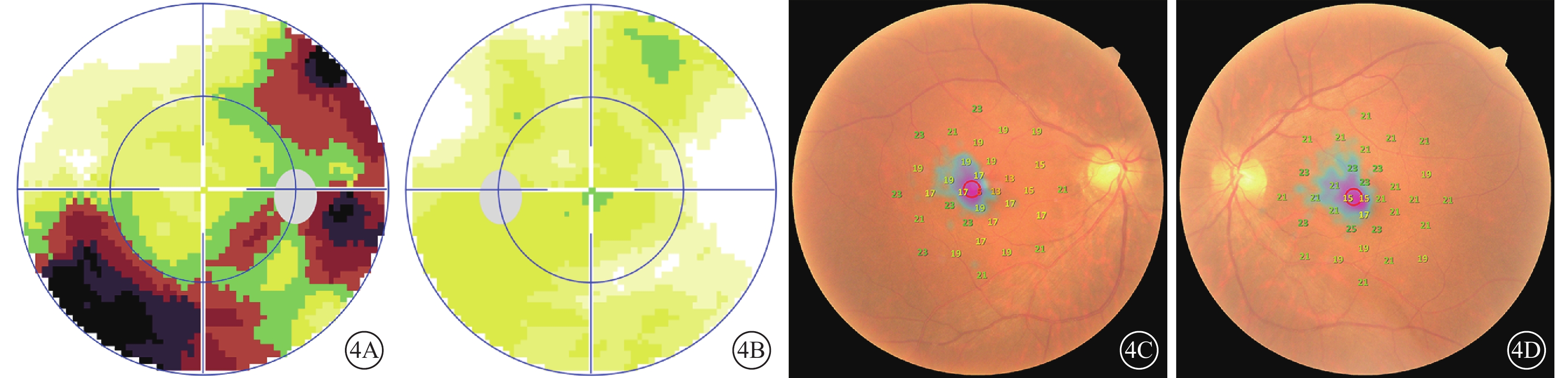 圖4
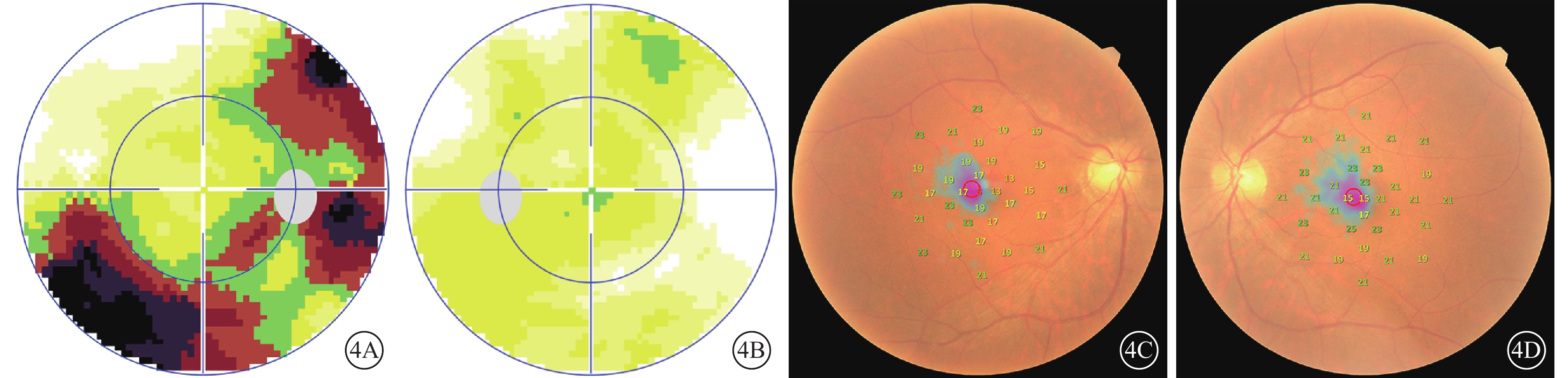
患者治療后視野檢查像。4A、4B示右眼、左眼電腦視野像,可見視野缺損范圍較治療前縮小;4C、4D示右眼、左眼微視野像,可見黃斑區10°范圍內敏感度較治療前提高
圖4
患者治療后視野檢查像。4A、4B示右眼、左眼電腦視野像,可見視野缺損范圍較治療前縮小;4C、4D示右眼、左眼微視野像,可見黃斑區10°范圍內敏感度較治療前提高
討論 npAIR與腫瘤相關視網膜病變、黑色素瘤相關視網膜病變統稱為自身免疫性視網膜病變[1]。npAIR較為少見,常發生于女性,可有自身免疫疾病史,但無腫瘤病史;是一類由特定自身抗體通過免疫炎癥介導作用導致的視網膜疾病[2-3]。其中以抗α-烯醇化酶抗體最為常見,其特異性通過鈣離子途徑引起光感受器細胞、雙極細胞、RGC凋亡[4]。因此患者可有閃光感、畏光、中心暗點、視野缺損、辨色困難以及不對稱、亞急性、無痛性、進行性雙眼視力下降等癥狀;早期視力及眼底檢查可表現正常,晚期出現視網膜動脈變細,廣泛的RPE層變薄或呈斑紋狀改變,少見眼內炎癥細胞、視網膜血管炎改變[5-6]。閃光ERG顯示暗適應、明適應和或雙極細胞反應異常。OCT顯示橢圓體帶及下方嵌合體帶信號明顯減弱或缺失,甚至外核層及黃斑中心凹萎縮變薄[7]。因此50~60歲女性,在閃光感、暗點發生前無視覺異常并徹底排除癌癥,結合眼科檢查及血清自身抗體陽性結果即可診斷npAIR[5]。本例患者亞急性不對稱雙眼視力下降,眼前閃光感、畏光、色覺障礙;眼底及FFA檢查未發現血管性或炎癥性病變;通過頭顱MRI及VEP檢查排除了顱內及視神經病變;通過癌癥相關檢查排除腫瘤相關視網膜病變及黑色素瘤相關視網膜病變。結合主要癥狀及OCT、FAF、ERG、視野檢查異常并且血清抗視網膜抗體陽性可明確診斷為npAIR。此外,本例患者FAF出現特征性的黃斑中心凹旁強自身熒光環。我們分析認為,亞急性起病導致熒光環內RPE細胞不健康但有功能,而熒光環外界到周邊視網膜則為更徹底的RPE細胞損傷[8]。我們還應用OCT檢查發現,患者雙眼黃斑區出現不同程度RGC層厚度降低。這證實強陽性的抗α-烯醇化酶抗體可以損傷RGC層[4]。
本病需與急性區域性隱匿性外層視網膜病變相鑒別,后者多為年輕女性單眼發病,呈區域性、自限性,不伴色覺異常,npAIR則呈進行性彌漫發展。此外,晚期npAIR與視網膜色素變性較難鑒別,但npAIR常無視網膜色素沉著[9]。
自身免疫性視網膜病變常用治療方法為局部或全身應用糖皮質激素、免疫球蛋白、鈣通道抑制劑、阿侖珠單抗等[1]。本例患者經玻璃體腔注射曲安奈德試驗性治療后閃光感、畏光、辨色困難癥狀明顯減輕;電腦視野、RGC層厚度、微視野檢查結果均較治療前明顯改善。
由于npAIR較低的發病率導致在臨床工作中對其認識不夠,當臨床上遇到眼底檢查不能解釋的雙眼亞急性視力下降伴閃光感及視野、ERG明顯異常的病例,應仔細進行眼科及血清抗視網膜抗體檢驗,以免誤診漏診。
患者女,48歲。因雙眼閃光感、畏光、辨色困難、視物不清3個月,于2018年7月到我院就診。既往身體健康,無高血壓、糖尿病、心腦血管病史;無全身用藥及遺傳性疾病家族史;否認毒物接觸史。眼科檢查:右眼視力0.12,左眼視力0.1,矯正不能提高。雙眼眼壓正常。雙眼眼前節、眼底彩色照相、FFA、VEP檢查結果均未見明顯異常。FAF檢查,雙眼黃斑中心凹旁強自身熒光環(圖1)。OCT檢查,雙眼視網膜光感受器細胞-RPE復合層萎縮性改變(圖2);雙眼黃斑區RGC層厚度不同程度降低,右眼、左眼分別為73、74 μm。電腦視野檢查,右眼與生理盲點相連的鼻下方及顳側的弓形視野缺損,左眼上方及下方視野缺損及旁中心暗點(圖3A,3B);微視野(MP-3)檢查,黃斑區10°范圍內暗點存在及敏感度下降(圖3C,3D)。閃光視網膜電圖(FERG)檢查,暗適應、明適應、30 Hz閃爍光雙眼a、b波振幅重度降低。頭顱MRI,眼眶、肺、縱膈CT,正電子發射斷層成像(PET-CT),腹部、婦科、甲狀腺、雙側頸動脈彩色超聲,血、尿、凝血常規,生化全項檢查均未見異常。乙肝五項,丙肝、艾滋病抗體,梅毒血清特異性抗體均為陰性。血清免疫指標檢查中除血清總補體活性:20.7↓U/ml,免疫球蛋白E:191.20↑KU/L其余正常。癌胚抗原,甲胎蛋白,神經元特異性烯醇化酶,CA-125、CA-153、CA-199均在正常范圍。抗α-烯醇化酶抗體:強陽性;抗碳酸酐酶Ⅱ抗體抗體:陽性;抗CRMP-5抗體:陽性;抗恢復蛋白抗體:陰性。診斷:非腫瘤性自身免疫性視網膜病變(npAIR)。給予患者雙眼玻璃體腔注射曲安奈德試驗性治療。治療后7 d復查,雙眼RGC層厚度有所恢復,右眼、左眼均為76 μm;雙眼視野缺損范圍較治療前明顯縮小;微視野檢查,黃斑區10°范圍內敏感度較治療前提高(圖4)。
 圖1
患者治療前FAF像。1A示右眼;1B示左眼。黃斑中心凹旁邊界清晰強自身熒光環(白箭)
圖1
患者治療前FAF像。1A示右眼;1B示左眼。黃斑中心凹旁邊界清晰強自身熒光環(白箭)
 圖2
患者治療前OCT像。2A示右眼;2B示左眼。視網膜橢圓體帶反射信號不均勻減弱缺失、紊亂,部分外核層變薄,RPE層內側不連續、斑點狀反射信號,脈絡膜毛細血管層變薄或缺失
圖2
患者治療前OCT像。2A示右眼;2B示左眼。視網膜橢圓體帶反射信號不均勻減弱缺失、紊亂,部分外核層變薄,RPE層內側不連續、斑點狀反射信號,脈絡膜毛細血管層變薄或缺失
 圖3
患者治療前視野檢查像。3A示右眼電腦視野像,可見與生理盲點相連的鼻下方及顳側的弓形視野缺損;3B示左眼電腦視野像,可見上方及下方視野缺損及旁中心暗點;3C、3D示右眼、左眼微視野像,可見黃斑區10°范圍內暗點存在及敏感度下降
圖3
患者治療前視野檢查像。3A示右眼電腦視野像,可見與生理盲點相連的鼻下方及顳側的弓形視野缺損;3B示左眼電腦視野像,可見上方及下方視野缺損及旁中心暗點;3C、3D示右眼、左眼微視野像,可見黃斑區10°范圍內暗點存在及敏感度下降
 圖4
患者治療后視野檢查像。4A、4B示右眼、左眼電腦視野像,可見視野缺損范圍較治療前縮小;4C、4D示右眼、左眼微視野像,可見黃斑區10°范圍內敏感度較治療前提高
圖4
患者治療后視野檢查像。4A、4B示右眼、左眼電腦視野像,可見視野缺損范圍較治療前縮小;4C、4D示右眼、左眼微視野像,可見黃斑區10°范圍內敏感度較治療前提高
討論 npAIR與腫瘤相關視網膜病變、黑色素瘤相關視網膜病變統稱為自身免疫性視網膜病變[1]。npAIR較為少見,常發生于女性,可有自身免疫疾病史,但無腫瘤病史;是一類由特定自身抗體通過免疫炎癥介導作用導致的視網膜疾病[2-3]。其中以抗α-烯醇化酶抗體最為常見,其特異性通過鈣離子途徑引起光感受器細胞、雙極細胞、RGC凋亡[4]。因此患者可有閃光感、畏光、中心暗點、視野缺損、辨色困難以及不對稱、亞急性、無痛性、進行性雙眼視力下降等癥狀;早期視力及眼底檢查可表現正常,晚期出現視網膜動脈變細,廣泛的RPE層變薄或呈斑紋狀改變,少見眼內炎癥細胞、視網膜血管炎改變[5-6]。閃光ERG顯示暗適應、明適應和或雙極細胞反應異常。OCT顯示橢圓體帶及下方嵌合體帶信號明顯減弱或缺失,甚至外核層及黃斑中心凹萎縮變薄[7]。因此50~60歲女性,在閃光感、暗點發生前無視覺異常并徹底排除癌癥,結合眼科檢查及血清自身抗體陽性結果即可診斷npAIR[5]。本例患者亞急性不對稱雙眼視力下降,眼前閃光感、畏光、色覺障礙;眼底及FFA檢查未發現血管性或炎癥性病變;通過頭顱MRI及VEP檢查排除了顱內及視神經病變;通過癌癥相關檢查排除腫瘤相關視網膜病變及黑色素瘤相關視網膜病變。結合主要癥狀及OCT、FAF、ERG、視野檢查異常并且血清抗視網膜抗體陽性可明確診斷為npAIR。此外,本例患者FAF出現特征性的黃斑中心凹旁強自身熒光環。我們分析認為,亞急性起病導致熒光環內RPE細胞不健康但有功能,而熒光環外界到周邊視網膜則為更徹底的RPE細胞損傷[8]。我們還應用OCT檢查發現,患者雙眼黃斑區出現不同程度RGC層厚度降低。這證實強陽性的抗α-烯醇化酶抗體可以損傷RGC層[4]。
本病需與急性區域性隱匿性外層視網膜病變相鑒別,后者多為年輕女性單眼發病,呈區域性、自限性,不伴色覺異常,npAIR則呈進行性彌漫發展。此外,晚期npAIR與視網膜色素變性較難鑒別,但npAIR常無視網膜色素沉著[9]。
自身免疫性視網膜病變常用治療方法為局部或全身應用糖皮質激素、免疫球蛋白、鈣通道抑制劑、阿侖珠單抗等[1]。本例患者經玻璃體腔注射曲安奈德試驗性治療后閃光感、畏光、辨色困難癥狀明顯減輕;電腦視野、RGC層厚度、微視野檢查結果均較治療前明顯改善。
由于npAIR較低的發病率導致在臨床工作中對其認識不夠,當臨床上遇到眼底檢查不能解釋的雙眼亞急性視力下降伴閃光感及視野、ERG明顯異常的病例,應仔細進行眼科及血清抗視網膜抗體檢驗,以免誤診漏診。