引用本文: 戴旭鋒, 保金華, 陳曉萍, 黃海笑, 李文炯, 陳浩. 模擬失重對成年小鼠閃光視網膜電圖明視負波反應的影響. 中華眼底病雜志, 2019, 35(4): 379-384. doi: 10.3760/cma.j.issn.1005-1015.2019.04.013 復制
航天員進入太空后,所處的失重環境會對全身多個組織器官產生不同程度的影響,比如下半身體液頭向轉移,可導致顱內壓的變化[1]。一些嚙齒類動物在地面通過改變體位的方式,來模擬失重狀態下體液重新分布,也發現顱內壓產生波動[2-4]。小鼠顱內壓升高,可能引起視神經和(或)RGC病變[5-6]。全視野閃光ERG明視負波反應(PhNR)是接受視錐細胞信號的視網膜第三級神經元產生,被認為是反映視網膜內層RGC及其軸突功能的一個比較敏感的指標[7]。臨床上特發性顱內壓增高,PhNR可表現為異常[8]。本研究在地球表面重力條件下,通過持續改變動物體位的方式,使下半身的體液發生頭向轉移,從而建立起模擬失重的動物模型;然后觀察后者閃光ERG-PhNR、閃光VEP(FVEP)、OCT、視網膜顯微結構和視行為等指標的變化情況,初步評價模擬失重對小鼠視網膜內層神經組織和整體視功能的影響。現將結果報道如下。
1 材料和方法
健康雄性2個月齡清潔級C57BL/6J小鼠48只,體重(22.5±4.0)g,由北京維通利華實驗動物技術有限公司提供[許可證號:SCXK(蘇)2016-0003]。0.5%復方托吡卡胺滴眼液(日本參天制藥株式會社),鹽酸氯胺酮(0.1 g∶2 ml,福建古田藥業有限公司),鹽酸賽拉嗪(吉林省康達動物藥業有限責任公司),1%羧甲基纖維素鈉(艾爾建愛爾蘭制藥公司),小動物眼球石蠟切片專用固定液(80%乙醇、甲醛和冰醋酸按照8∶1∶1的容量比均勻混合配制),HE染色液(北京雷根生物技術有限公司)。可調式小鼠尾吊籠(中國航天員科研訓練中心人因工程重點實驗室授權后,委托蘇州市蘇杭科技器材有限公司制造),動物視覺電生理檢測系統(德國Roland公司),小動物視網膜OCT檢測系統(美國Phenix Research Labs公司),光學顯微鏡(日本Olympus公司)。
按完全隨機原則,將小鼠分為模擬失重組和對照組,每組再分為A、B、C 3個亞組,各亞組8只小鼠。模擬失重組小鼠單籠飼養,尾部懸吊于籠頂,后肢自然懸空不受力。根據小鼠成長情況,可隨時方便地對懸吊高度進行微調,使軀干長軸與籠底水平始終保持30°角。前肢正常抓地,小鼠可在籠底一定范圍自由活動,但始終保持頭低位且基本上不影響正常進食和飲水。對照組小鼠也單籠飼養,尾部裝置同模擬失重組,但不懸吊,保持正常體位。對照組小鼠的攝食量與相應的模擬失重組前一天的攝入量相同。模擬失重組A、B亞組懸尾時間分別為15、30 d,懸尾時間達到要求后,馬上對觀察指標進行檢測;模擬失重組C亞組懸尾30 d,在檢測指標前先恢復正常體位30 d。對照組A、B、C亞組小鼠分別保持正常體位15、30、60 d,然后同對應天數的模擬失重組一起進行實驗指標的檢測。
小鼠用復方托吡卡胺滴眼液充分散瞳,氯胺酮(72 mg/kg)和賽拉嗪(4 mg/kg)混合液通過腹腔注射。動物全身麻醉后在角膜緣輕放環狀細金絲電極,作為記錄電極;雙耳正中頭皮下插入針狀電極作為參考電極,尾根部皮下插入針狀電極作為接地電極。記錄電極和角膜之間滴入少量羧甲基纖維素鈉,以促進電極和角膜之間的導電性,同時減少干擾。參考國際視覺電生理協會(ISCEV)的PhNR標準化建議[7],對刺激光的參數稍加修改,使之適用于嚙齒類動物。關鍵參數:明適應10 min(背景白光的亮度為30 cd·m?2),10 cd·s·m?2的白光刺激,單次閃光持續時間2 ms,記錄ERG反應。ERG信號經過50次疊加(刺激間隔為1 s)后取平均以提高信噪比,通頻帶設為0.3~300.0 Hz。以基線到波谷為PhNR振幅。
小鼠全身麻醉后記錄FVEP[9]。記錄電極從兩耳根連線中點的位置插入到皮下,電極的針尖深達骨膜并固定,針尖位置正好與小鼠視皮質的中線對應。參考電位插入頰部皮下,地電極插入尾根部皮下。FVEP信號采集器的濾波頻率為1.0~100.0 Hz,記錄暗適應狀態下小鼠FVEP。刺激光強度為3 cd·s·m?2,刺激間隔為3 s,VEP信號經過30~60次疊加后取平均以提高信噪比。記錄小鼠FVEP,測量N1波的峰時和P1-N1振幅。
參照文獻[10]的方法,定制直徑為1.2 m的圓形塑料盆,內壁及底部噴上均勻的黑色油漆以減少視覺干擾,小鼠在水中無法站立。水盆正中固定一個直徑約10.5 cm的浮島,島上設置紅白相間的三角旗,作為明顯標志物(唯一的視覺線索)。小鼠落水后由于憎水的特點,訓練小鼠在盡可能短的時間內尋找到具有明顯標志的浮島,并盡快游過去實現逃生。小鼠從落水直至游到浮島并上岸的時長,計為逃生時間。訓練后受試動物均能夠在盡量短的時間內完成視覺引導的水迷宮游泳任務。正式實驗在明適應(環境照明為18 Lux)狀態下進行,每只小鼠在4個固定的起點落水各一次,分別進行計時,最后取平均值作為最終逃生時間。小鼠如果游泳時間超過60 s仍無法找到浮島實現逃生,則逃生時間記錄為60 s。建模前小鼠先進行訓練,建模后進行正式實驗。
小鼠視網膜OCT檢查前,被檢眼充分散瞳。動物全身麻醉后置于專用的檢查臺上,使用人工淚液防止角膜干燥及屈光間質混濁。調整小鼠眼位,同時鏡頭向角膜緩慢推進,不斷調焦直至眼底清晰可見,且視盤基本居中為止。選擇相應的檢測區域進行視網膜OCT掃描,掃描信號經過調節、增益及降噪處理,最終獲得視網膜OCT像。在距離視盤0.4 mm處測量視網膜內層厚度。
采用CO2氣體處死小鼠后立刻摘取眼球,置于小動物眼球石蠟切片專用固定液中固定24 h(4 ℃);常規脫水、浸蠟和包埋后,將含眼球標本的蠟塊沿著平行于視軸方向切片,片厚4 μm,貼片于0.05%多聚賴氨酸特殊處理(防止脫片)過的載玻片上。常規HE染色后中性樹膠封片,光學顯微鏡下觀察視網膜顯微結構。
采用SPSS 17.0軟件進行統計學分析。研究數據經Shapiro-Wilk檢驗呈正態分布,所以用均數±標準差( )表示。組間數據比較采用獨立樣本 t 檢驗,以雙尾檢測法。P<0.05為差異有統計學意義。
)表示。組間數據比較采用獨立樣本 t 檢驗,以雙尾檢測法。P<0.05為差異有統計學意義。
2 結果
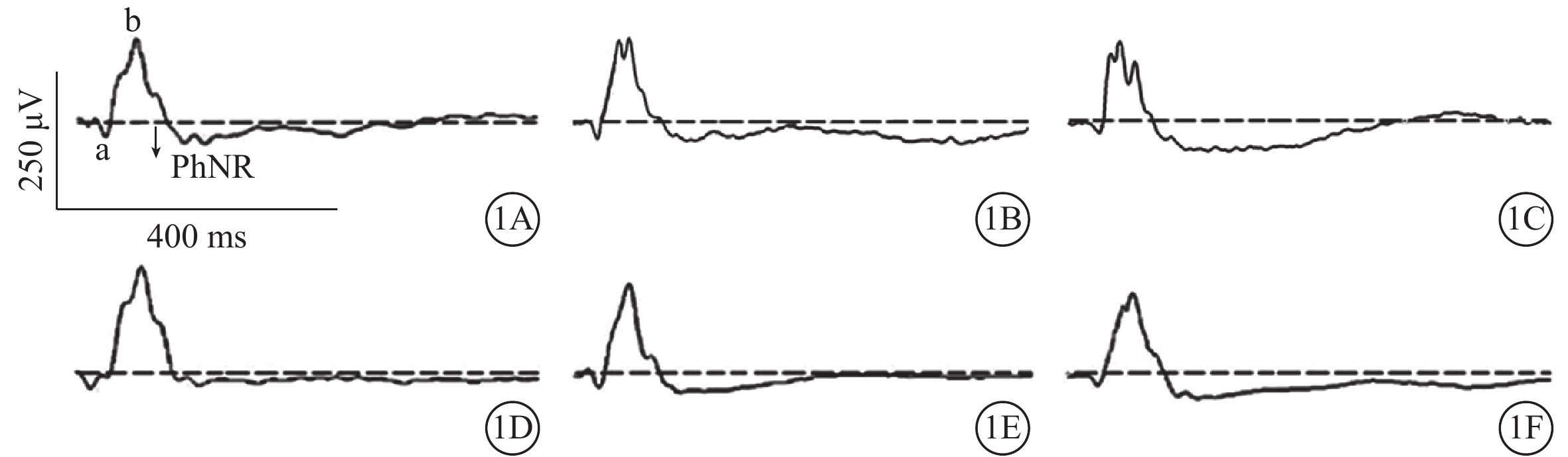
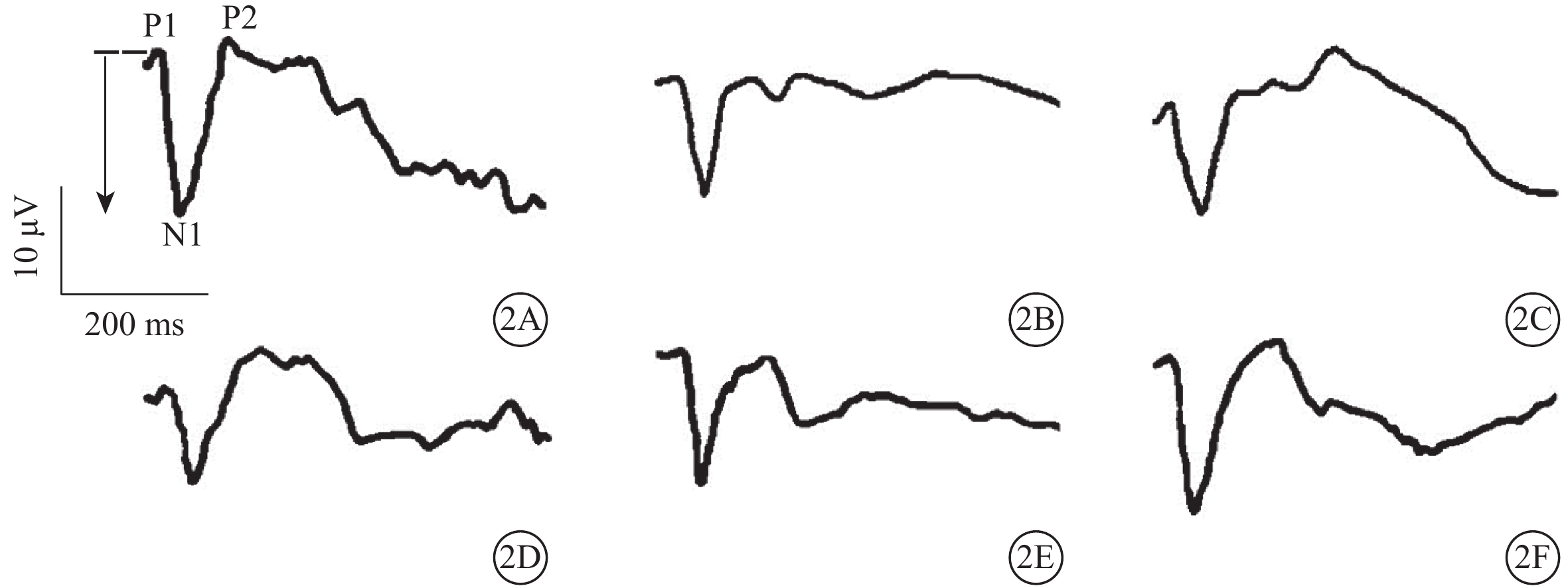
模擬失重組A、B、C亞組PhNR振幅分別為(36.0±7.4)、(43.1±8.8)、(48.8±8.2)μV;對照組A、B、C亞組PhNR振幅分別為(46.8±5.9)、(49.9±4.1)、(47.8±5.7)μV。模擬失重組A亞組PhNR振幅明顯降低,為對照組A亞組的79.6%,兩者差異有統計學意義(t=?3.196,P<0.01);模擬失重組B、C亞組分別與對照組B、C亞組PhNR振幅比較,差異均無統計學意義(t=?1.976、0.285,P>0.05)(圖1)。其中,模擬失重組B亞組PhNR振幅為對照組B亞組的86.4%。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時(t=1.850、1.503、0.405)、P1-N1振幅(t=?1.958、?2.054、0.187)比較,差異均無統計學意義(P>0.05)(圖1,2;表1)。
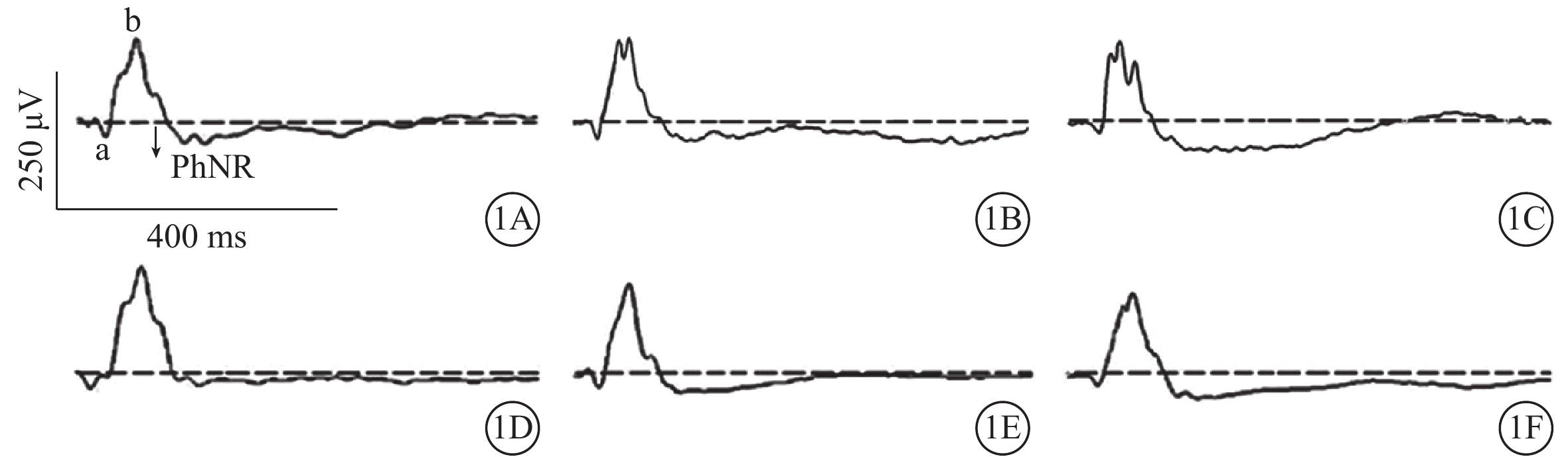 圖1
模擬失重組與對照組各亞組ERG-PhNR比較。1A示對照組A亞組;1B示對照組B亞組;1C示對照組C亞組;1D示模擬失重組A亞組;1E示模擬失重組B亞組;1F示模擬失重組C亞組。模擬失重組A亞組PhNR振幅較對照組A亞組明顯降低,模擬失重組B、C亞組與對照組B、C亞組PhNR振幅無明顯差異
圖1
模擬失重組與對照組各亞組ERG-PhNR比較。1A示對照組A亞組;1B示對照組B亞組;1C示對照組C亞組;1D示模擬失重組A亞組;1E示模擬失重組B亞組;1F示模擬失重組C亞組。模擬失重組A亞組PhNR振幅較對照組A亞組明顯降低,模擬失重組B、C亞組與對照組B、C亞組PhNR振幅無明顯差異
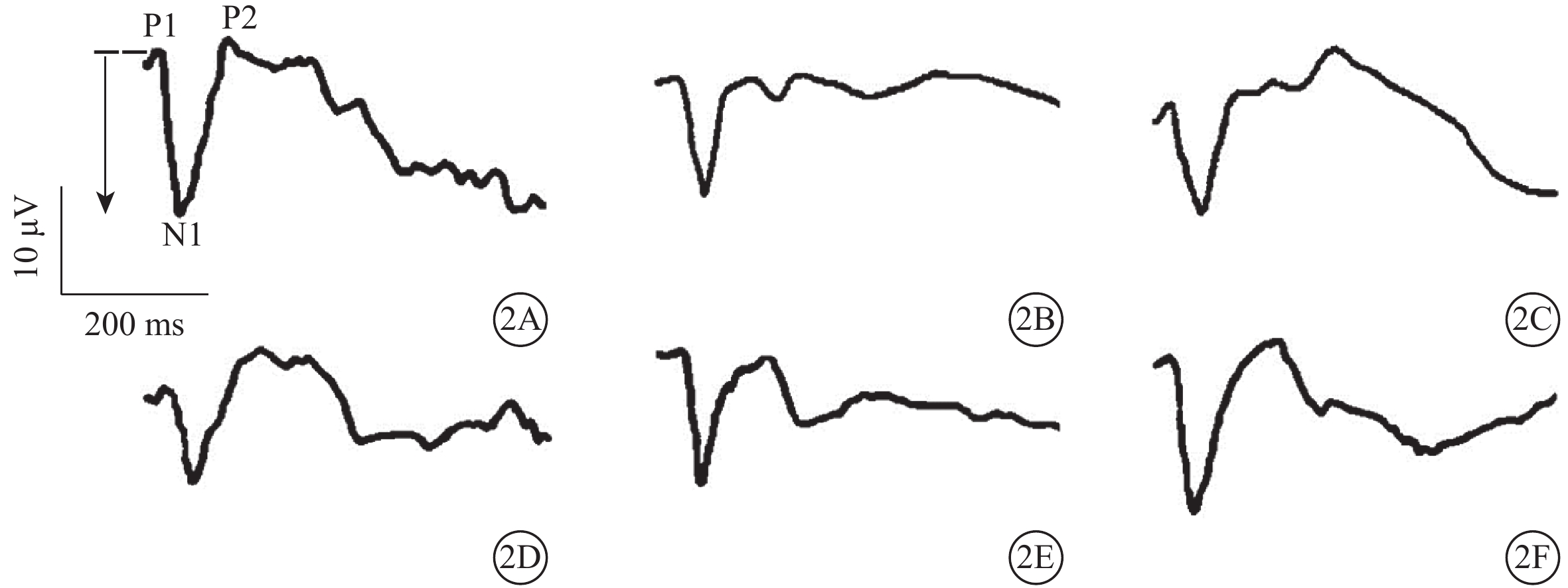 圖2
模擬失重組與對照組各亞組FVEP比較。2A示對照組A亞組;2B示對照組B亞組;2C示對照組C亞組;2D示模擬失重組A亞組;2E示模擬失重組B亞組;2F示模擬失重組C亞組。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時、P1-N1振幅無明顯差異
圖2
模擬失重組與對照組各亞組FVEP比較。2A示對照組A亞組;2B示對照組B亞組;2C示對照組C亞組;2D示模擬失重組A亞組;2E示模擬失重組B亞組;2F示模擬失重組C亞組。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時、P1-N1振幅無明顯差異
模擬失重組A、B、C亞組小鼠視網膜內層厚度分別為(65.4±6.5)、(70.1±5.0)、(62.3±7.5)μm,對照組A、B、C亞組小鼠視網膜內層厚度分別為(66.6±4.1)、(64.8±5.4)、(63.8±7.4)μm。模擬失重組A、B、C亞組與對照組A、B、C亞組視網膜內層厚度比較,差異均無統計學意義(t=?0.461、2.073、?0.402,P>0.05)。
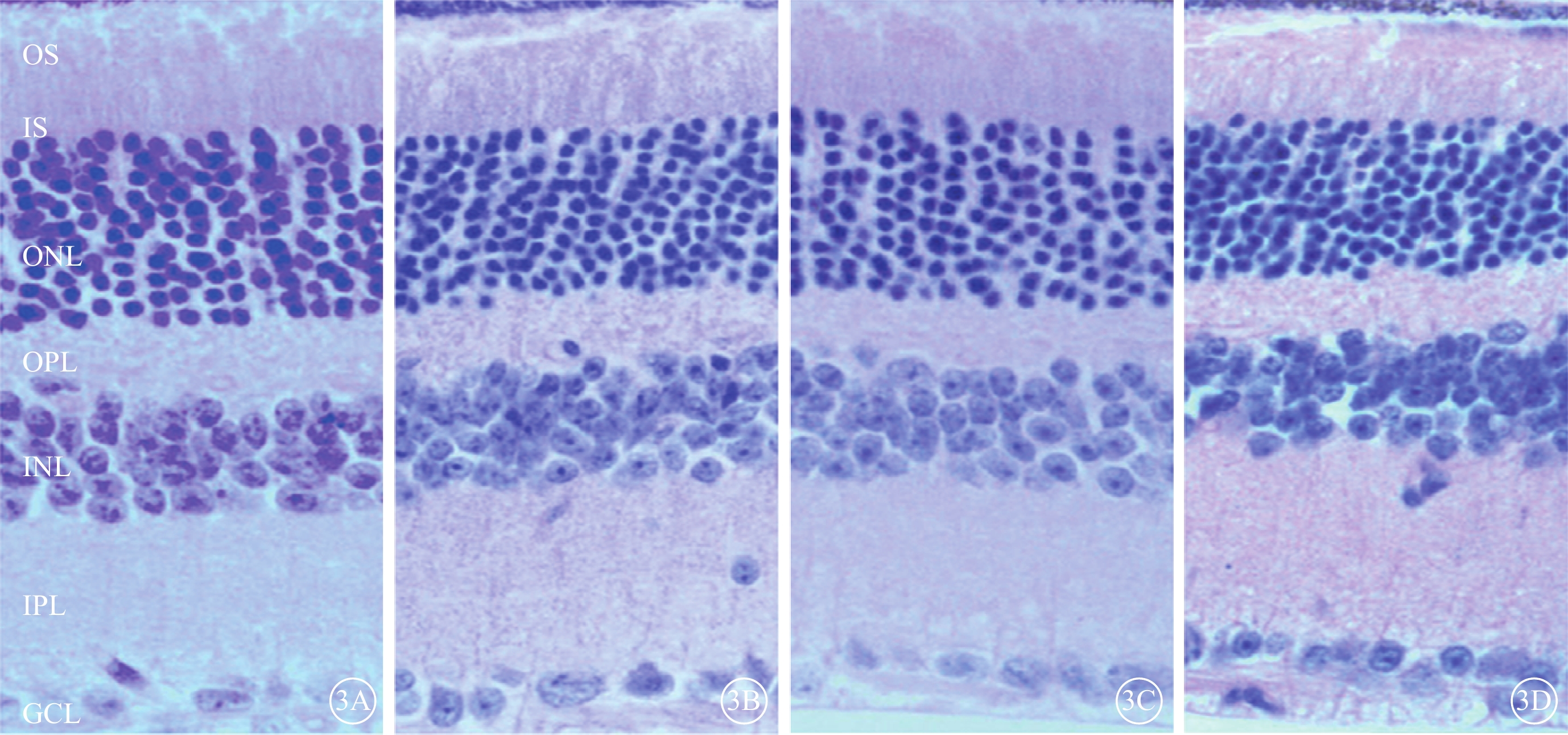
模擬失重組各亞組小鼠RGC層(GCL)、內叢狀層(IPL)、內核層(INL)、外叢狀層(OPL)、外核層(ONL)、橢圓體帶和RPE等結構均未見異常(圖3)。
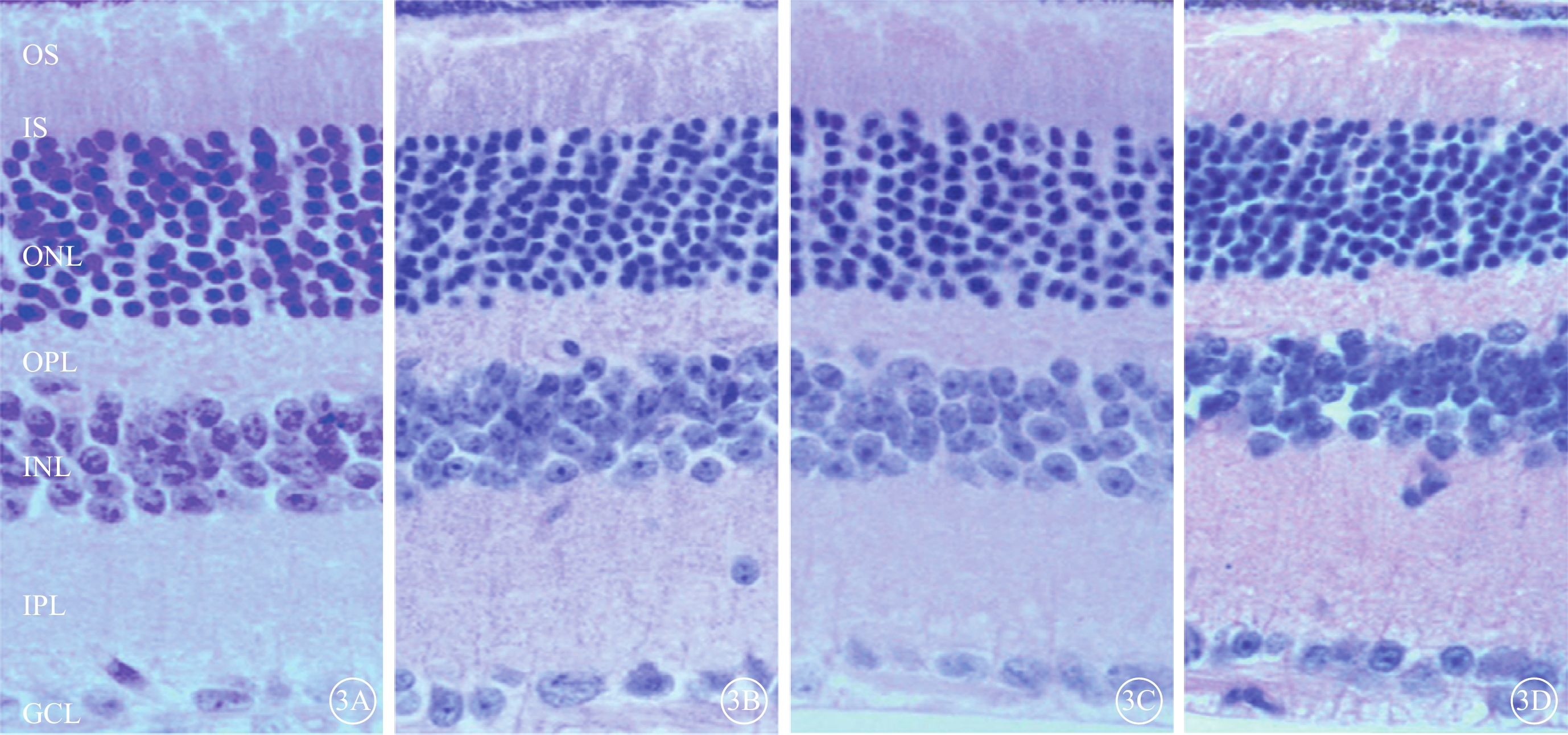 圖3
模擬失重組與對照組小鼠視網膜光學顯微鏡像。3A示對照組A亞組;3B示模擬失重組A亞組;3C示模擬失重組B亞組;3D示模擬失重組C亞組。對照組與模擬失重組各亞組小鼠視網膜結構正常 HE ×200
圖3
模擬失重組與對照組小鼠視網膜光學顯微鏡像。3A示對照組A亞組;3B示模擬失重組A亞組;3C示模擬失重組B亞組;3D示模擬失重組C亞組。對照組與模擬失重組各亞組小鼠視網膜結構正常 HE ×200
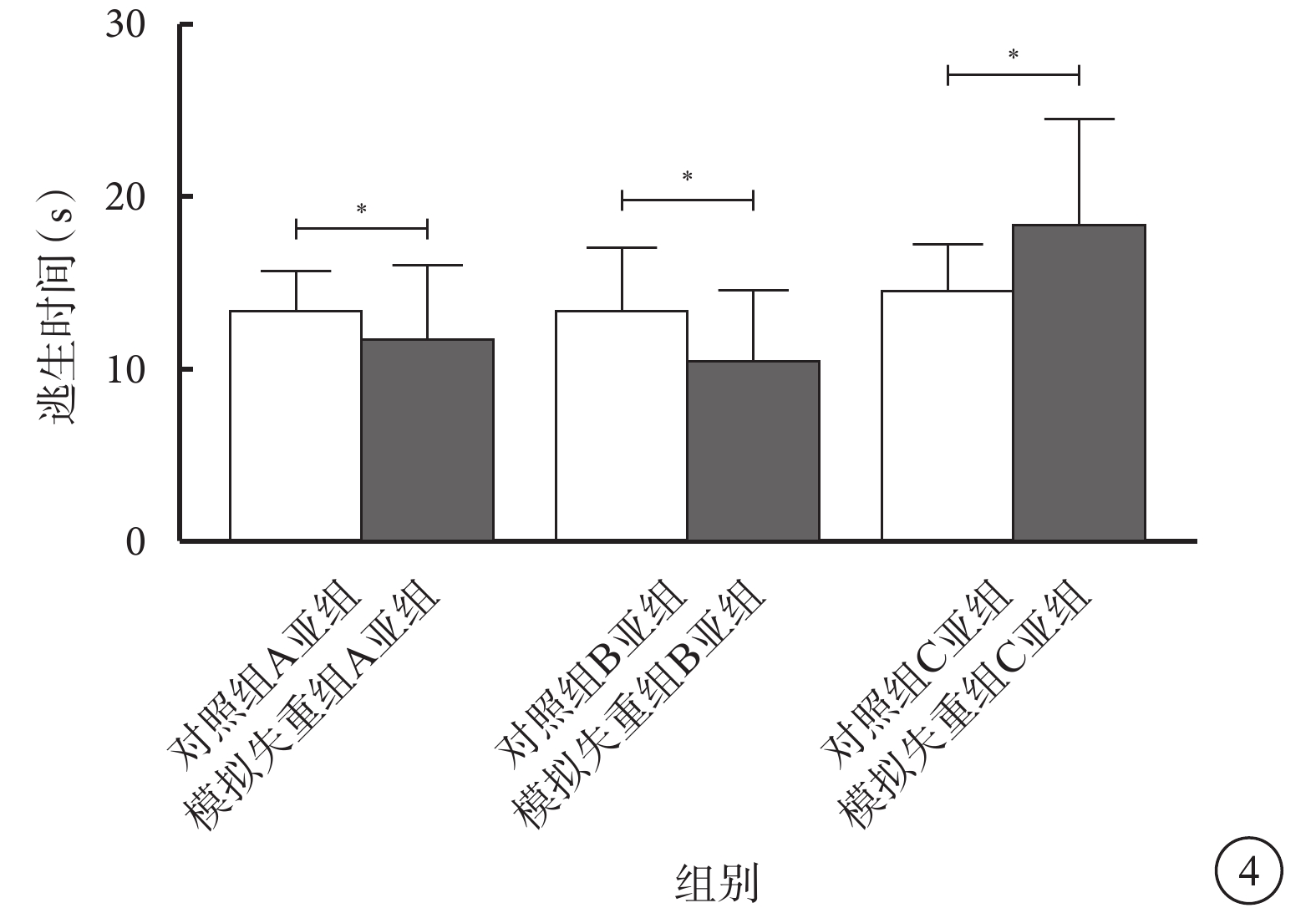
模擬失重組A、B、C亞組與對照組A、B、C亞組小鼠逃生時間比較,差異均無統計學意義(t=?0.637、?0.955、1.297,P>0.05)(圖4)。
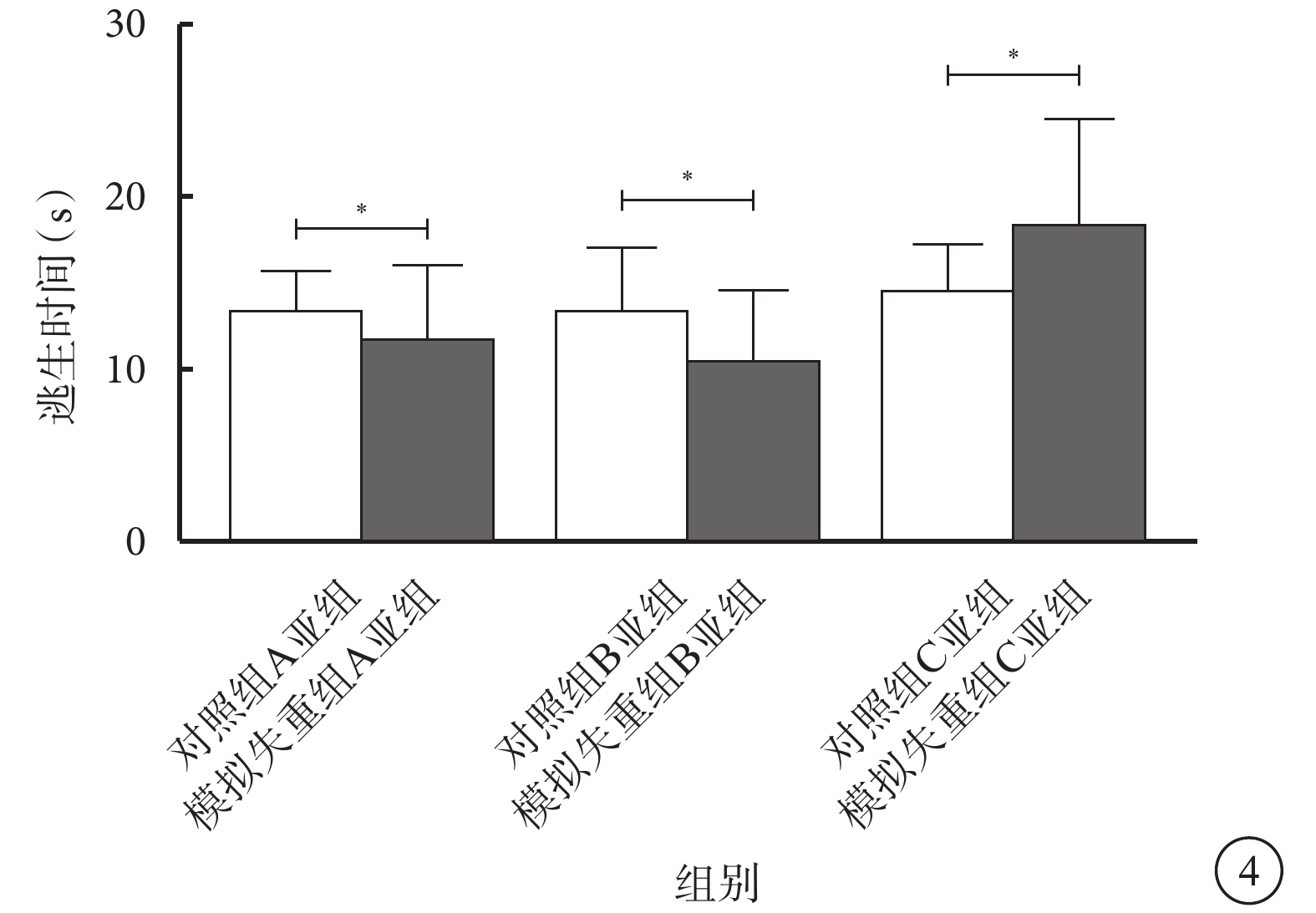 圖4
模擬失重組與對照組各亞組小鼠明適應狀態下逃生時間比較。*P>0.05
圖4
模擬失重組與對照組各亞組小鼠明適應狀態下逃生時間比較。*P>0.05
3 討論
宇航員進入太空后,由于沒有地心引力作用,會處于失重狀態。失重對人體的影響,越來越成為太空生命科學關注的一大焦點。由于進入太空成本很高,目前絕大多數的研究還是在地面實施。失重狀態下,下半身的體液向上半身轉移[2]。目前國際公認的模擬方法主要有頭低位臥床試驗和小動物尾部懸吊實驗[2, 11-12]。我們使用可調式尾部懸吊籠,隨時方便對懸尾高度進行微調,使小鼠始終保持頭低位30°的造模要求。尤其是我們的懸尾方法是非創傷性的,可使動物免受痛苦和感染等影響,因此實驗的干擾因素明顯減少。
太空失重狀態下,大量的血液由下身轉移到胸腔和頭部,頭部灌流壓增高20~30 mmHg(1 mmHg=0.133 kPa)[13]。失重或模擬失重狀態剛開始不久,眼壓會出現較大波動;但對視神經和(或)RGC真正造成損傷的,很可能是顱內壓增高,后者會通過蛛網膜下腔進行傳遞,導致視神經和視盤腫脹[3, 14-16]。失重也可能引起腦脊液的產生和吸收發生失衡,增多的腦脊液容易壓迫位于神經鞘膜內的視神經[17]。本研究選擇了對RGC及其軸突(視神經)功能比較敏感的指標PhNR來觀察模擬失重的效應之一[7]。我們發現,正常成年小鼠明適應狀態下,接受的刺激光從弱(0.1 cd·s·m?2)逐漸增強,當強度達到10 cd·s·m?2左右時,PhNR波形趨于穩定。如果刺激光繼續增強,此時幅值變大并不明顯,反而容易引起視細胞光損傷。根據以上反應特點,我們選擇最適合小鼠的刺激強度10 cd·s·m?2來記錄穩定的PhNR波形。本研究PhNR振幅采集的時間點為小鼠懸尾后15、30 d,大致反映模擬失重后短、中期的狀態。模擬失重短期內視網膜內層RGC及其軸突呈現功能下降,表現為PhNR振幅為正常水平的76.9%;模擬失重中期,可能隨著小鼠視網膜自身調節機制的啟動,相關功能又出現回升,表現為PhNR振幅恢復到正常水平的86.4%;懸尾小鼠恢復正常體位30 d后,受失重影響的視網膜內層RGC及其軸突的功能,基本上能完全恢復。我們分析認為,小鼠懸尾后短期內的PhNR變化可能與模擬失重引起的顱內壓波動有關。由于FVEP對顱內壓的波動比較敏感[18],因此我們同時檢測了小鼠的FVEP。結果顯示,FVEP部分反應波的峰時有延遲傾向,尤其是懸尾15 d時較明顯。
小鼠天生能游泳,但厭惡處于水中,在水中看見逃生浮島會迅速游過去并登上。根據這個特點,我們先對小鼠進行訓練,使其能根據視覺線索確定逃生平臺的位置。經過訓練的小鼠形成記憶,會在盡可能短的時間內,完成視覺引導的水迷宮游泳任務。正式實驗,根據逃生時間的長短,將小鼠整體視功能的狀態進行量化處理[10]。結果顯示,懸吊并未引起小鼠逃生時間的明顯變化。說明短期懸尾后PhNR的變化,對整體視功能的影響并不顯著。
小鼠短期懸尾后,視網膜內層RGC及其軸突的功能出現異常,可能與模擬失重引起的顱內壓波動有關,但并不影響視網膜顯微結構及整體視功能。從航天員經歷過的短、中期在軌飛行情況來看,也未出現視網膜和視路功能的明顯障礙,從而影響在軌工作和生活。然而長期失重對于視網膜的影響,目前國內外尚未得出明確的結論,這將是下一步研究關注的重點。
航天員進入太空后,所處的失重環境會對全身多個組織器官產生不同程度的影響,比如下半身體液頭向轉移,可導致顱內壓的變化[1]。一些嚙齒類動物在地面通過改變體位的方式,來模擬失重狀態下體液重新分布,也發現顱內壓產生波動[2-4]。小鼠顱內壓升高,可能引起視神經和(或)RGC病變[5-6]。全視野閃光ERG明視負波反應(PhNR)是接受視錐細胞信號的視網膜第三級神經元產生,被認為是反映視網膜內層RGC及其軸突功能的一個比較敏感的指標[7]。臨床上特發性顱內壓增高,PhNR可表現為異常[8]。本研究在地球表面重力條件下,通過持續改變動物體位的方式,使下半身的體液發生頭向轉移,從而建立起模擬失重的動物模型;然后觀察后者閃光ERG-PhNR、閃光VEP(FVEP)、OCT、視網膜顯微結構和視行為等指標的變化情況,初步評價模擬失重對小鼠視網膜內層神經組織和整體視功能的影響。現將結果報道如下。
1 材料和方法
健康雄性2個月齡清潔級C57BL/6J小鼠48只,體重(22.5±4.0)g,由北京維通利華實驗動物技術有限公司提供[許可證號:SCXK(蘇)2016-0003]。0.5%復方托吡卡胺滴眼液(日本參天制藥株式會社),鹽酸氯胺酮(0.1 g∶2 ml,福建古田藥業有限公司),鹽酸賽拉嗪(吉林省康達動物藥業有限責任公司),1%羧甲基纖維素鈉(艾爾建愛爾蘭制藥公司),小動物眼球石蠟切片專用固定液(80%乙醇、甲醛和冰醋酸按照8∶1∶1的容量比均勻混合配制),HE染色液(北京雷根生物技術有限公司)。可調式小鼠尾吊籠(中國航天員科研訓練中心人因工程重點實驗室授權后,委托蘇州市蘇杭科技器材有限公司制造),動物視覺電生理檢測系統(德國Roland公司),小動物視網膜OCT檢測系統(美國Phenix Research Labs公司),光學顯微鏡(日本Olympus公司)。
按完全隨機原則,將小鼠分為模擬失重組和對照組,每組再分為A、B、C 3個亞組,各亞組8只小鼠。模擬失重組小鼠單籠飼養,尾部懸吊于籠頂,后肢自然懸空不受力。根據小鼠成長情況,可隨時方便地對懸吊高度進行微調,使軀干長軸與籠底水平始終保持30°角。前肢正常抓地,小鼠可在籠底一定范圍自由活動,但始終保持頭低位且基本上不影響正常進食和飲水。對照組小鼠也單籠飼養,尾部裝置同模擬失重組,但不懸吊,保持正常體位。對照組小鼠的攝食量與相應的模擬失重組前一天的攝入量相同。模擬失重組A、B亞組懸尾時間分別為15、30 d,懸尾時間達到要求后,馬上對觀察指標進行檢測;模擬失重組C亞組懸尾30 d,在檢測指標前先恢復正常體位30 d。對照組A、B、C亞組小鼠分別保持正常體位15、30、60 d,然后同對應天數的模擬失重組一起進行實驗指標的檢測。
小鼠用復方托吡卡胺滴眼液充分散瞳,氯胺酮(72 mg/kg)和賽拉嗪(4 mg/kg)混合液通過腹腔注射。動物全身麻醉后在角膜緣輕放環狀細金絲電極,作為記錄電極;雙耳正中頭皮下插入針狀電極作為參考電極,尾根部皮下插入針狀電極作為接地電極。記錄電極和角膜之間滴入少量羧甲基纖維素鈉,以促進電極和角膜之間的導電性,同時減少干擾。參考國際視覺電生理協會(ISCEV)的PhNR標準化建議[7],對刺激光的參數稍加修改,使之適用于嚙齒類動物。關鍵參數:明適應10 min(背景白光的亮度為30 cd·m?2),10 cd·s·m?2的白光刺激,單次閃光持續時間2 ms,記錄ERG反應。ERG信號經過50次疊加(刺激間隔為1 s)后取平均以提高信噪比,通頻帶設為0.3~300.0 Hz。以基線到波谷為PhNR振幅。
小鼠全身麻醉后記錄FVEP[9]。記錄電極從兩耳根連線中點的位置插入到皮下,電極的針尖深達骨膜并固定,針尖位置正好與小鼠視皮質的中線對應。參考電位插入頰部皮下,地電極插入尾根部皮下。FVEP信號采集器的濾波頻率為1.0~100.0 Hz,記錄暗適應狀態下小鼠FVEP。刺激光強度為3 cd·s·m?2,刺激間隔為3 s,VEP信號經過30~60次疊加后取平均以提高信噪比。記錄小鼠FVEP,測量N1波的峰時和P1-N1振幅。
參照文獻[10]的方法,定制直徑為1.2 m的圓形塑料盆,內壁及底部噴上均勻的黑色油漆以減少視覺干擾,小鼠在水中無法站立。水盆正中固定一個直徑約10.5 cm的浮島,島上設置紅白相間的三角旗,作為明顯標志物(唯一的視覺線索)。小鼠落水后由于憎水的特點,訓練小鼠在盡可能短的時間內尋找到具有明顯標志的浮島,并盡快游過去實現逃生。小鼠從落水直至游到浮島并上岸的時長,計為逃生時間。訓練后受試動物均能夠在盡量短的時間內完成視覺引導的水迷宮游泳任務。正式實驗在明適應(環境照明為18 Lux)狀態下進行,每只小鼠在4個固定的起點落水各一次,分別進行計時,最后取平均值作為最終逃生時間。小鼠如果游泳時間超過60 s仍無法找到浮島實現逃生,則逃生時間記錄為60 s。建模前小鼠先進行訓練,建模后進行正式實驗。
小鼠視網膜OCT檢查前,被檢眼充分散瞳。動物全身麻醉后置于專用的檢查臺上,使用人工淚液防止角膜干燥及屈光間質混濁。調整小鼠眼位,同時鏡頭向角膜緩慢推進,不斷調焦直至眼底清晰可見,且視盤基本居中為止。選擇相應的檢測區域進行視網膜OCT掃描,掃描信號經過調節、增益及降噪處理,最終獲得視網膜OCT像。在距離視盤0.4 mm處測量視網膜內層厚度。
采用CO2氣體處死小鼠后立刻摘取眼球,置于小動物眼球石蠟切片專用固定液中固定24 h(4 ℃);常規脫水、浸蠟和包埋后,將含眼球標本的蠟塊沿著平行于視軸方向切片,片厚4 μm,貼片于0.05%多聚賴氨酸特殊處理(防止脫片)過的載玻片上。常規HE染色后中性樹膠封片,光學顯微鏡下觀察視網膜顯微結構。
采用SPSS 17.0軟件進行統計學分析。研究數據經Shapiro-Wilk檢驗呈正態分布,所以用均數±標準差( )表示。組間數據比較采用獨立樣本 t 檢驗,以雙尾檢測法。P<0.05為差異有統計學意義。
)表示。組間數據比較采用獨立樣本 t 檢驗,以雙尾檢測法。P<0.05為差異有統計學意義。
2 結果
模擬失重組A、B、C亞組PhNR振幅分別為(36.0±7.4)、(43.1±8.8)、(48.8±8.2)μV;對照組A、B、C亞組PhNR振幅分別為(46.8±5.9)、(49.9±4.1)、(47.8±5.7)μV。模擬失重組A亞組PhNR振幅明顯降低,為對照組A亞組的79.6%,兩者差異有統計學意義(t=?3.196,P<0.01);模擬失重組B、C亞組分別與對照組B、C亞組PhNR振幅比較,差異均無統計學意義(t=?1.976、0.285,P>0.05)(圖1)。其中,模擬失重組B亞組PhNR振幅為對照組B亞組的86.4%。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時(t=1.850、1.503、0.405)、P1-N1振幅(t=?1.958、?2.054、0.187)比較,差異均無統計學意義(P>0.05)(圖1,2;表1)。
 圖1
模擬失重組與對照組各亞組ERG-PhNR比較。1A示對照組A亞組;1B示對照組B亞組;1C示對照組C亞組;1D示模擬失重組A亞組;1E示模擬失重組B亞組;1F示模擬失重組C亞組。模擬失重組A亞組PhNR振幅較對照組A亞組明顯降低,模擬失重組B、C亞組與對照組B、C亞組PhNR振幅無明顯差異
圖1
模擬失重組與對照組各亞組ERG-PhNR比較。1A示對照組A亞組;1B示對照組B亞組;1C示對照組C亞組;1D示模擬失重組A亞組;1E示模擬失重組B亞組;1F示模擬失重組C亞組。模擬失重組A亞組PhNR振幅較對照組A亞組明顯降低,模擬失重組B、C亞組與對照組B、C亞組PhNR振幅無明顯差異
 圖2
模擬失重組與對照組各亞組FVEP比較。2A示對照組A亞組;2B示對照組B亞組;2C示對照組C亞組;2D示模擬失重組A亞組;2E示模擬失重組B亞組;2F示模擬失重組C亞組。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時、P1-N1振幅無明顯差異
圖2
模擬失重組與對照組各亞組FVEP比較。2A示對照組A亞組;2B示對照組B亞組;2C示對照組C亞組;2D示模擬失重組A亞組;2E示模擬失重組B亞組;2F示模擬失重組C亞組。模擬失重組A、B、C亞組與對照組A、B、C亞組FVEP的N1波峰時、P1-N1振幅無明顯差異
模擬失重組A、B、C亞組小鼠視網膜內層厚度分別為(65.4±6.5)、(70.1±5.0)、(62.3±7.5)μm,對照組A、B、C亞組小鼠視網膜內層厚度分別為(66.6±4.1)、(64.8±5.4)、(63.8±7.4)μm。模擬失重組A、B、C亞組與對照組A、B、C亞組視網膜內層厚度比較,差異均無統計學意義(t=?0.461、2.073、?0.402,P>0.05)。
模擬失重組各亞組小鼠RGC層(GCL)、內叢狀層(IPL)、內核層(INL)、外叢狀層(OPL)、外核層(ONL)、橢圓體帶和RPE等結構均未見異常(圖3)。
 圖3
模擬失重組與對照組小鼠視網膜光學顯微鏡像。3A示對照組A亞組;3B示模擬失重組A亞組;3C示模擬失重組B亞組;3D示模擬失重組C亞組。對照組與模擬失重組各亞組小鼠視網膜結構正常 HE ×200
圖3
模擬失重組與對照組小鼠視網膜光學顯微鏡像。3A示對照組A亞組;3B示模擬失重組A亞組;3C示模擬失重組B亞組;3D示模擬失重組C亞組。對照組與模擬失重組各亞組小鼠視網膜結構正常 HE ×200
模擬失重組A、B、C亞組與對照組A、B、C亞組小鼠逃生時間比較,差異均無統計學意義(t=?0.637、?0.955、1.297,P>0.05)(圖4)。
 圖4
模擬失重組與對照組各亞組小鼠明適應狀態下逃生時間比較。*P>0.05
圖4
模擬失重組與對照組各亞組小鼠明適應狀態下逃生時間比較。*P>0.05
3 討論
宇航員進入太空后,由于沒有地心引力作用,會處于失重狀態。失重對人體的影響,越來越成為太空生命科學關注的一大焦點。由于進入太空成本很高,目前絕大多數的研究還是在地面實施。失重狀態下,下半身的體液向上半身轉移[2]。目前國際公認的模擬方法主要有頭低位臥床試驗和小動物尾部懸吊實驗[2, 11-12]。我們使用可調式尾部懸吊籠,隨時方便對懸尾高度進行微調,使小鼠始終保持頭低位30°的造模要求。尤其是我們的懸尾方法是非創傷性的,可使動物免受痛苦和感染等影響,因此實驗的干擾因素明顯減少。
太空失重狀態下,大量的血液由下身轉移到胸腔和頭部,頭部灌流壓增高20~30 mmHg(1 mmHg=0.133 kPa)[13]。失重或模擬失重狀態剛開始不久,眼壓會出現較大波動;但對視神經和(或)RGC真正造成損傷的,很可能是顱內壓增高,后者會通過蛛網膜下腔進行傳遞,導致視神經和視盤腫脹[3, 14-16]。失重也可能引起腦脊液的產生和吸收發生失衡,增多的腦脊液容易壓迫位于神經鞘膜內的視神經[17]。本研究選擇了對RGC及其軸突(視神經)功能比較敏感的指標PhNR來觀察模擬失重的效應之一[7]。我們發現,正常成年小鼠明適應狀態下,接受的刺激光從弱(0.1 cd·s·m?2)逐漸增強,當強度達到10 cd·s·m?2左右時,PhNR波形趨于穩定。如果刺激光繼續增強,此時幅值變大并不明顯,反而容易引起視細胞光損傷。根據以上反應特點,我們選擇最適合小鼠的刺激強度10 cd·s·m?2來記錄穩定的PhNR波形。本研究PhNR振幅采集的時間點為小鼠懸尾后15、30 d,大致反映模擬失重后短、中期的狀態。模擬失重短期內視網膜內層RGC及其軸突呈現功能下降,表現為PhNR振幅為正常水平的76.9%;模擬失重中期,可能隨著小鼠視網膜自身調節機制的啟動,相關功能又出現回升,表現為PhNR振幅恢復到正常水平的86.4%;懸尾小鼠恢復正常體位30 d后,受失重影響的視網膜內層RGC及其軸突的功能,基本上能完全恢復。我們分析認為,小鼠懸尾后短期內的PhNR變化可能與模擬失重引起的顱內壓波動有關。由于FVEP對顱內壓的波動比較敏感[18],因此我們同時檢測了小鼠的FVEP。結果顯示,FVEP部分反應波的峰時有延遲傾向,尤其是懸尾15 d時較明顯。
小鼠天生能游泳,但厭惡處于水中,在水中看見逃生浮島會迅速游過去并登上。根據這個特點,我們先對小鼠進行訓練,使其能根據視覺線索確定逃生平臺的位置。經過訓練的小鼠形成記憶,會在盡可能短的時間內,完成視覺引導的水迷宮游泳任務。正式實驗,根據逃生時間的長短,將小鼠整體視功能的狀態進行量化處理[10]。結果顯示,懸吊并未引起小鼠逃生時間的明顯變化。說明短期懸尾后PhNR的變化,對整體視功能的影響并不顯著。
小鼠短期懸尾后,視網膜內層RGC及其軸突的功能出現異常,可能與模擬失重引起的顱內壓波動有關,但并不影響視網膜顯微結構及整體視功能。從航天員經歷過的短、中期在軌飛行情況來看,也未出現視網膜和視路功能的明顯障礙,從而影響在軌工作和生活。然而長期失重對于視網膜的影響,目前國內外尚未得出明確的結論,這將是下一步研究關注的重點。