引用本文: 王薇, 李爽, 李紅陽, 王康. 急性中心性漿液性脈絡膜視網膜病變患者脈絡膜血管指數及中心凹下脈絡膜厚度測量分析. 中華眼底病雜志, 2019, 35(4): 353-357. doi: 10.3760/cma.j.issn.1005-1015.2019.04.008 復制
脈絡膜結構異常是引發中心性漿液性脈絡膜視網膜病變(CSC)的重要原因[1-3]。通過ICGA可以發現CSC患眼脈絡膜毛細血管通透性增加、脈絡膜動脈充盈延遲及脈絡膜靜脈擴張或阻塞[4-5]。通過OCT深度增強成像(EDI-OCT)技術可以發現,不僅CSC患眼中心凹下脈絡膜厚度(SFCT)明顯增厚,其對側眼SFCT也較正常健康眼有所增加[2, 6-9]。但SFCT只能通過數值反應出脈絡膜厚度的變化,卻不能解釋脈絡膜內的血管或者基質成分在病變過程中發生的改變[10]。因此,深入探索脈絡膜內部結構變化對疾病的影響十分重要[11]。脈絡膜血管指數(CVI)是血管(或管腔)面積(LA)與脈絡膜總面積(TCA)的比值,其既可以反應出脈絡膜內血管成分的改變,又可作為后續治療效果的觀察指標。CVI是一種新的生物測量指標,正在逐漸被應用于各種眼部疾病的脈絡膜結構觀測中[12]。本研究通過測量CSC患眼及其對側眼、正常健康眼中心凹下1500 μm范圍的CVI及SFCT,以期觀察CSC患眼及對側眼的脈絡膜內部結構變化;同時,對CVI和SFCT這兩種測量方法在穩定性、可重復性及一致性等方面存在的差異進行比較。現將結果報道如下。
1 對象和方法
本研究為獲得醫院倫理委員會審核批準的回顧性研究(批準號2018-P2-205-01)。
2016年11月1日至2018年3月18日首次就診于首都醫科大學附屬北京友誼醫院眼科并確診為單眼急性CSC的31例患者納入本研究。所有患者均行BCVA、眼壓、裂隙燈顯微鏡、散瞳眼底、眼部超聲、OCT、FFA及ICGA檢查。所有患眼OCT檢查均可見視網膜神經上皮層漿液性脫離,其下RPE層呈不光滑狀態或漿液性隆起狀態;FFA、ICGA檢查均可發現1個或多個早期滲漏點,晚期可呈煙霧擴散狀的滲漏形態。31例CSC患者均符合單眼急性CSC(病程<6個月)的診斷標準[13]。排除慢性CSC、弱視、斜視、高度近視(>?6.0 D)、遠視(>+3.0 D)、青光眼、白內障、葡萄膜炎、老年性黃斑變性、視網膜脫離、視網膜增生性病變、視網膜及脈絡膜萎縮性疾病、脈絡膜脫離;眼底激光治療病史、眼部手術史;球內及球后占位性病變;高血壓、糖尿病以及全身系統性疾病。
CSC患者中,男性25例,女性6例。年齡27~58歲,平均年齡(41.90±7.96)歲。CSC患眼等效球鏡屈光度?3.81~2.07 D,平均等效球鏡屈光度(?0.40±1.64)D;對側眼等效球鏡屈光度?3.81~2.07 D,平均等效球鏡屈光度(?0.45±1.68)D。納入同期在我院體檢的年齡與CSC患者匹配的正常健康者31名作為對照。其中,男性20名,女性11名。年齡25~58歲,平均年齡(42.06±8.71)歲。等效球鏡屈光度?3.51~1.54 D,平均等效球鏡屈光度(?1.06±1.44)D。CSC患者與正常健康者年齡(t=?0.093,P=0.926)、性別(χ2=2.026,P=0.155)比較,差異無統計學意義;CSC患眼、對側眼和正常眼之間等效球鏡屈光度(F=1.675,P=0.193)比較,差異無統計學意義。
CSC患眼及其對側眼、正常健康眼均接受EDI-OCT經黃斑中心凹單線掃描。選用30°鏡頭,掃描線長度調至最長,每只眼掃描3次,所有操作均由同一名技師完成。單線掃描圖像均由100幅二維圖像疊加組成,用于增強圖像的清晰度并去除圖像偽跡。選取圖像質量最清晰的一幅進行圖像分析處理,并由兩位眼科專家共同對其進行評定。
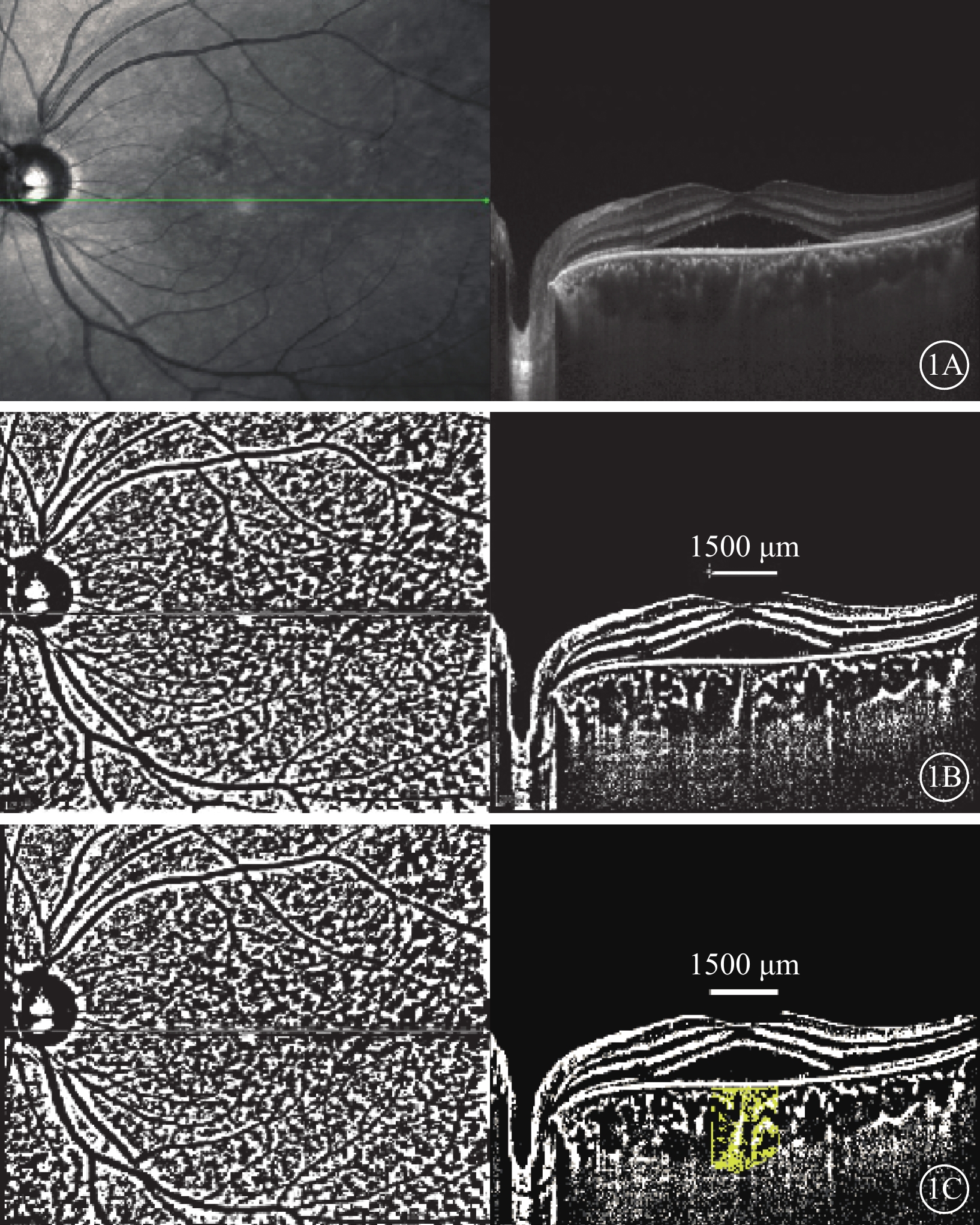
對所獲取的EDI-OCT圖像進行二值化處理。在Image J軟件中,先設定圖像的比例尺,對圖像進行閾值分割及降噪處理。將圖像設置為8-Bit格式,選擇Niblack選項進行圖像自動閾值處理,通過多邊形工具選取中心凹下1500 μm范圍的脈絡膜區域進行分析;即以中心凹為對稱中心,左右兩側各延伸至750 μm的范圍(圖1)。測量該1500 μm范圍的TCA。在二值化圖像中,低像素區域為脈絡膜血管,高像素區域為脈絡膜基質。將圖像設置為RGB color格式進行彩色閾值分析,勾勒出血管腔與基質的邊界,計算低像素區域的LA。通過LA與TCA的比值,得到CVI數值。
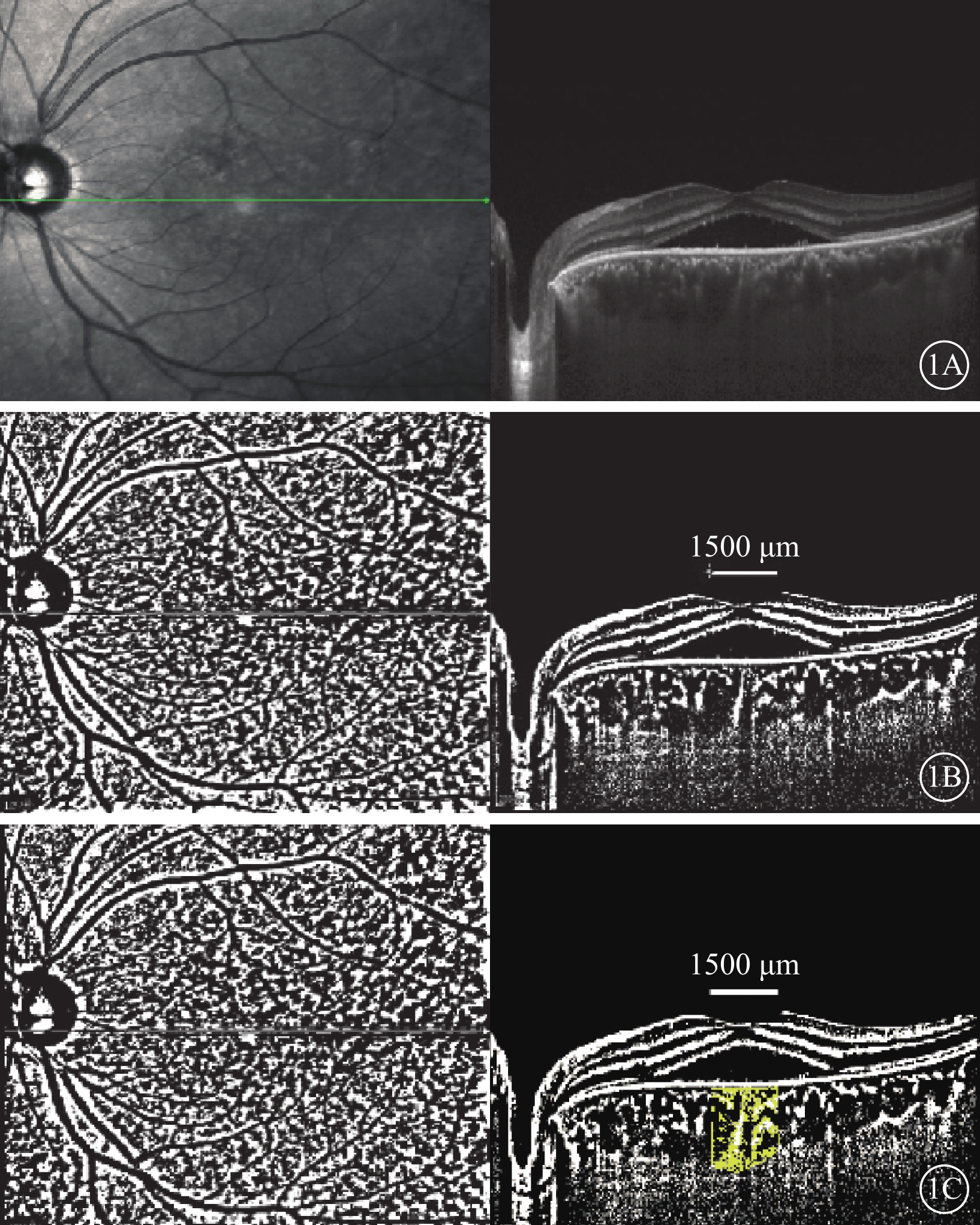 圖1
CVI測量示意圖。1A示脈絡膜層結構;1B示經過ImageJ軟件Niblack選項將圖像進行自動閾值處理,脈絡膜內部結構分別由低像素區(血管腔)和高像素區(脈絡膜基質)組成;1C示利用多邊形工具選定中心凹下1500 μm范圍進行測量計算,通過偽彩色方式勾勒出脈絡膜血管與脈絡膜基質的邊界
圖1
CVI測量示意圖。1A示脈絡膜層結構;1B示經過ImageJ軟件Niblack選項將圖像進行自動閾值處理,脈絡膜內部結構分別由低像素區(血管腔)和高像素區(脈絡膜基質)組成;1C示利用多邊形工具選定中心凹下1500 μm范圍進行測量計算,通過偽彩色方式勾勒出脈絡膜血管與脈絡膜基質的邊界
采用SPSS 21.0軟件進行統計分析。CSC患者及正常健康者之間的年齡、屈光度比較采用 t 檢驗;性別比較采用χ2 檢驗;CSC患眼、對側眼及正常健康眼之間CVI、SFCT的比較采用方差分析。采用組內相關系數(ICC)分析CVI和SFCT這兩種測量方法的一致性與可重復性。ICC<0.4表示一致性較差;0.4≤ICC<0.75表示一致性較好;ICC≥0.75表示一致性非常好[14]。采用Medcalc18.2.1軟件繪制Bland-Altman曲線,觀察兩種測量方法的一致性。通過變異系數(CV)分析兩種測量方法的穩定性,CV=(s/  )×100%。其中,s代表標準差,
)×100%。其中,s代表標準差, 代表均數。P<0.05為差異有統計學意義。
代表均數。P<0.05為差異有統計學意義。
2 結果
CSC患眼、對側眼、正常健康眼三者之間CVI、SFCT兩兩比較,CSC患眼與對側眼(t=3.470、2.844,P=0.001、0.006)、CSC患眼與正常健康眼(t=6.977、6.277,P<0.001、<0.001)、對側眼與正常健康眼(t=3.508、3.433,P=0.001、0.001)之間的差異均有統計學意義(表1)。
CVI單一測量、平均測量的相對一致性分析結果顯示,其ICC分別為0.967(95%CI 0.932~0.984)、0.983(95%CI 0.965~0.992)。SFCT單一測量、平均測量的相對一致性分析結果顯示,其ICC分別為0.937(95%CI 0.873~0.969)、0.967(95%CI 0.932~0.984)。CVI、SFCT可重復性均非常好,CVI的ICC數值略高于SFCT。
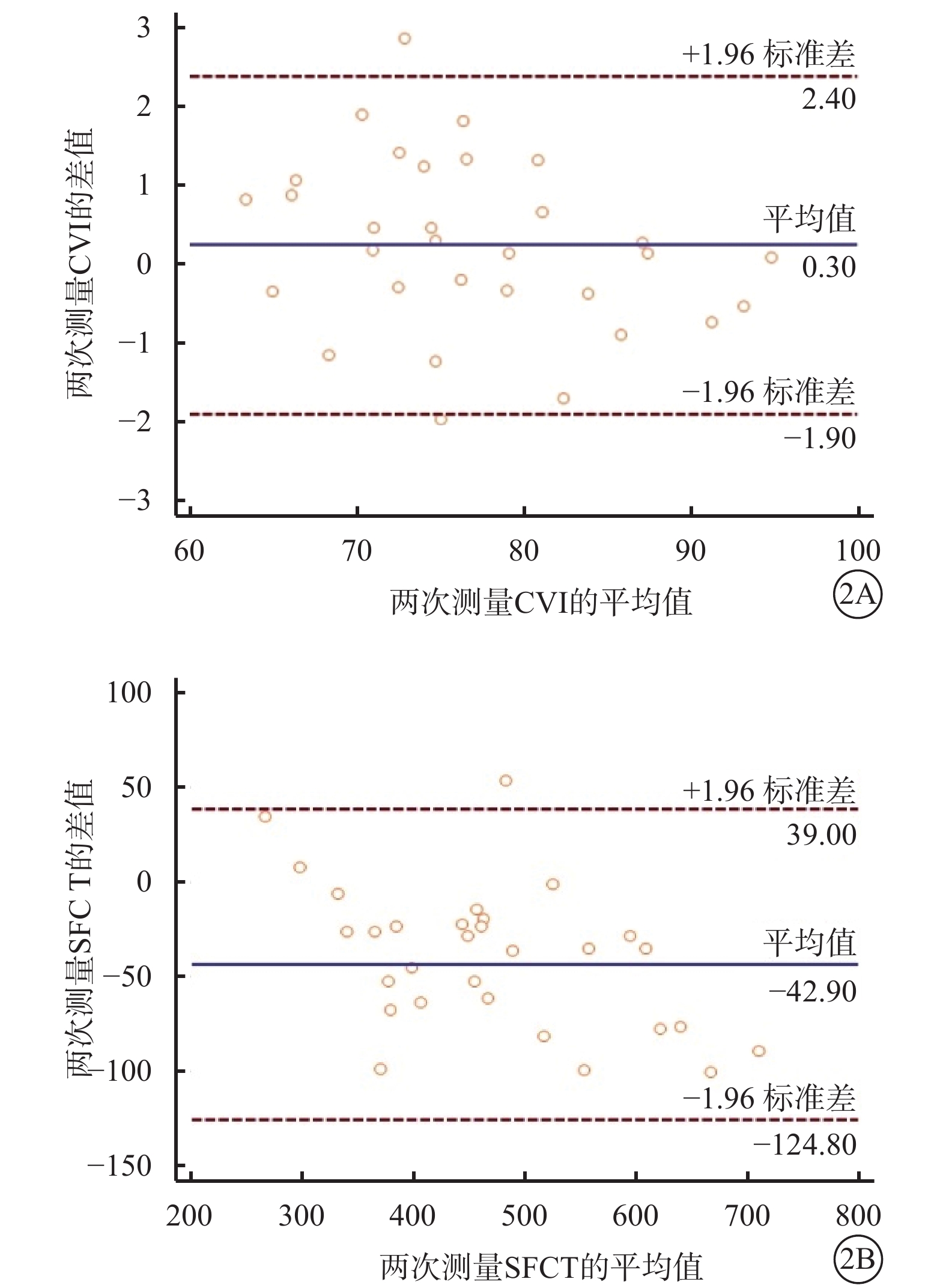
CVI和SFCT這兩種測量方法的一致性分析結果顯示,在CSC患眼的重復測量中兩種測量方法均有6.45%(2/31)的點在95%一致性界限以外。兩次測量CVI的均值為(76.99±8.20)%,差值絕對值最大為2.87%,絕對值最小為0.10%;兩次測量SFCT的均值為(462.63 ±115.54)μm,差值絕對值最大為146.00 μm,絕對值最小為1.00 μm。兩次測量CVI的差值幅度較小,而兩次測量SFCT的差值幅度較大(圖2)。
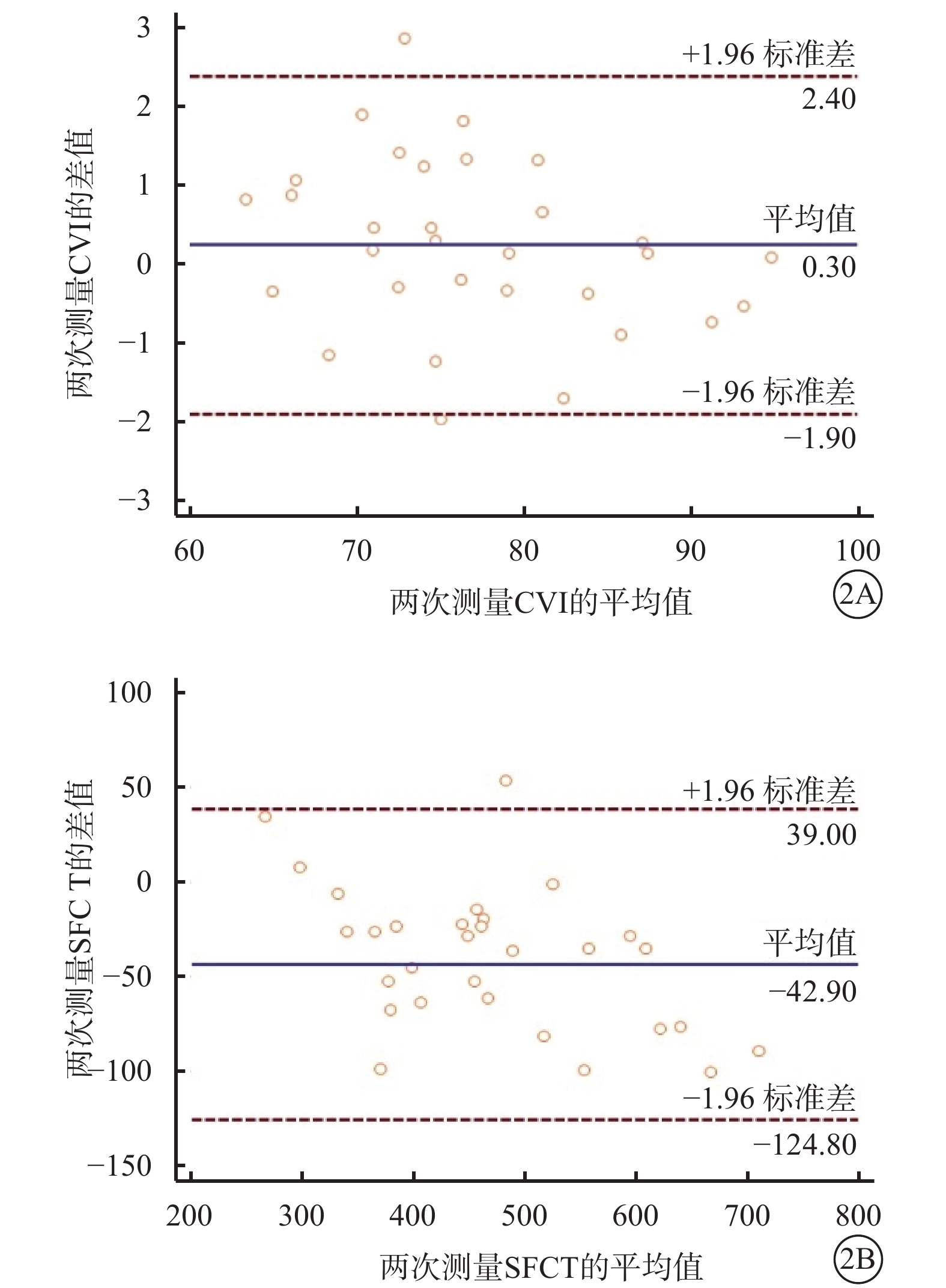 圖2
CVI、SFCT可重復性分析Bland-Altman圖。2A示CVI;2B示SFCT
圖2
CVI、SFCT可重復性分析Bland-Altman圖。2A示CVI;2B示SFCT
CVI、SFCT穩定性分析結果顯示,CVI、SFCT的CV分別為10.5%、25.3%;CVI的CV較SFCT更小。
3 討論
CSC發病與脈絡膜改變密切相關。CSC脈絡膜厚度增加可能主要由兩個原因引起:(1)脈絡膜血管擴張;(2)血管滲透性增加可使脈絡膜層間液體積聚導致脈絡膜基質水腫[7, 13]。這也進一步解釋了CSC的發病機制,即脈絡膜血管內流體靜壓力增高會引起血管擴張伴隨通透性增加,隨后發生RPE脫離以及RPE功能障礙,積液便可由此處滲漏至視網膜神經上皮下的空間[3]。CSC經常表現為單眼首先發病,對側眼有相應改變但無明顯癥狀。本研究結果顯示,CSC患眼SFCT明顯高于對側眼,對側眼SFCT明顯高于正常健康眼。雖然CSC伴有脈絡膜厚度增加的現象,但是目前還沒有前瞻性研究可以證實脈絡膜變厚會增加CSC的發病率[15]。因此我們嘗試通過計算CVI來觀察CSC患者脈絡膜血管結構的變化特點。
因為CSC患者的脈絡膜血管存在明顯擴張,并且管腔面積的增加幅度高于基質面積的增加幅度,從而導致CVI測量數值也會隨之增加[1]。在使用ImageJ軟件對EDI-OCT圖像進行二值化處理后,可以將脈絡膜結構中的血管組織與基質成分相互區分。其中低像素區域代表脈絡膜血管管腔(或液體積聚處),高像素區域代表脈絡膜基質成分。盡管這種成分劃分尚未得到證實,但是其圖像形態符合脈絡膜組織學與大量實驗觀察的結果[3, 16]。本研究結果顯示,CSC患眼中心凹下1500 μm范圍CVI數值明顯高于對側眼與正常健康眼,而對側眼CVI數值明顯高于正常健康眼。因此,CVI指數不僅可以反應出急性CSC患眼脈絡膜內部結構比例的變化,還可以定量地計算出血管面積增加的程度。對側眼的CVI數值增加也可作為脈絡膜血管逐漸擴張的一種提示,即在臨床工作中,我們要同時關注急性CSC患者雙眼脈絡膜的結構變化,通過CVI數值的增減,從而預估疾病的發展趨勢。CVI分析可作為疾病早期診斷和評估治療效果的一種有利工具。
CVI計算是一種新的脈絡膜生物測量方法。CVI較SFCT的優勢包括:(1)CVI可同時描述脈絡膜內部血管及基質成分在病變發展過程中的變化。SFCT雖然可以較便捷地反應出脈絡膜厚度的變化,但是我們無從得知導致其變化的主要原因是來自血管成分還是基質成分,又或是兩者同時引起[16]。(2)CVI在計算過程中的干擾因素相對較少。在基于健康人群脈絡膜厚度的研究中發現,SFCT測量的標準差可達到100 μm以上[17]。這樣的差異主要來源于年齡、種族、屈光度、眼軸長度以及設備種類等因素的影響[2, 6, 18]。對于正常人的CVI研究中,目前只觀察到其影響因素與年齡和眼軸長度有關[16, 19]。(3)CVI較SFCT測量數值的波動性小,可重復性更高。我們通過ICC和Bland-Altman圖形來衡量兩種測量方法的可重復性與一致性,CVI的測量結果均優于SFCT的測量結果。而從CSC患眼整體數據的變異性比較,CVI的波動性小,變異程度低。這提示,與SFCT比較,CVI用于觀測脈絡膜內部血管結構變化是更加穩定且可靠的一個生物測量指標。
本研究存在以下不足:(1)本研究為回顧性研究,樣本例數較少。未來若樣本數量足夠大,可設計前瞻性研究,動態觀察各組數值的變化,獲得更加令人信服的結果。(2)在本研究中,我們只選取了水平方向的黃斑中心凹EDI-OCT圖像進行測量。若選取水平和垂直兩方向中心凹圖像進行測量并取平均值,可提高測量結果的準確性[5]。(3)在兩種指標的測量過程中均存在手動標圖的誤差,結果不可避免會受到主觀因素的影響。在獲取CSC患眼中心凹圖像的過程中,當脈絡膜厚度大于400 μm時,圖像質量會受到影響,因脈絡膜與鞏膜交接處圖像顯影模糊,從而可引起SFCT的測量誤差增大[20]。(4)本研究只選取了黃斑中心凹下方1500 μm范圍的單一圖像進行CVI分析。雖然對于正常健康眼的研究中,中心凹下方的CVI與黃斑其他部位的CVI數值相似[12],但是這個結論是否適用于CSC患眼并不十分明確。(5)目前由于技術水平的限制,EDI-OCT尚不能清晰顯示脈絡膜內部更加細微的結構,因此二值化技術的精準性也有待進一步的研究[19]。我們也期待未來OCT技術的進步能夠帶來更加清晰的圖像,從而提高CVI結果的準確性和臨床應用價值。
脈絡膜結構異常是引發中心性漿液性脈絡膜視網膜病變(CSC)的重要原因[1-3]。通過ICGA可以發現CSC患眼脈絡膜毛細血管通透性增加、脈絡膜動脈充盈延遲及脈絡膜靜脈擴張或阻塞[4-5]。通過OCT深度增強成像(EDI-OCT)技術可以發現,不僅CSC患眼中心凹下脈絡膜厚度(SFCT)明顯增厚,其對側眼SFCT也較正常健康眼有所增加[2, 6-9]。但SFCT只能通過數值反應出脈絡膜厚度的變化,卻不能解釋脈絡膜內的血管或者基質成分在病變過程中發生的改變[10]。因此,深入探索脈絡膜內部結構變化對疾病的影響十分重要[11]。脈絡膜血管指數(CVI)是血管(或管腔)面積(LA)與脈絡膜總面積(TCA)的比值,其既可以反應出脈絡膜內血管成分的改變,又可作為后續治療效果的觀察指標。CVI是一種新的生物測量指標,正在逐漸被應用于各種眼部疾病的脈絡膜結構觀測中[12]。本研究通過測量CSC患眼及其對側眼、正常健康眼中心凹下1500 μm范圍的CVI及SFCT,以期觀察CSC患眼及對側眼的脈絡膜內部結構變化;同時,對CVI和SFCT這兩種測量方法在穩定性、可重復性及一致性等方面存在的差異進行比較。現將結果報道如下。
1 對象和方法
本研究為獲得醫院倫理委員會審核批準的回顧性研究(批準號2018-P2-205-01)。
2016年11月1日至2018年3月18日首次就診于首都醫科大學附屬北京友誼醫院眼科并確診為單眼急性CSC的31例患者納入本研究。所有患者均行BCVA、眼壓、裂隙燈顯微鏡、散瞳眼底、眼部超聲、OCT、FFA及ICGA檢查。所有患眼OCT檢查均可見視網膜神經上皮層漿液性脫離,其下RPE層呈不光滑狀態或漿液性隆起狀態;FFA、ICGA檢查均可發現1個或多個早期滲漏點,晚期可呈煙霧擴散狀的滲漏形態。31例CSC患者均符合單眼急性CSC(病程<6個月)的診斷標準[13]。排除慢性CSC、弱視、斜視、高度近視(>?6.0 D)、遠視(>+3.0 D)、青光眼、白內障、葡萄膜炎、老年性黃斑變性、視網膜脫離、視網膜增生性病變、視網膜及脈絡膜萎縮性疾病、脈絡膜脫離;眼底激光治療病史、眼部手術史;球內及球后占位性病變;高血壓、糖尿病以及全身系統性疾病。
CSC患者中,男性25例,女性6例。年齡27~58歲,平均年齡(41.90±7.96)歲。CSC患眼等效球鏡屈光度?3.81~2.07 D,平均等效球鏡屈光度(?0.40±1.64)D;對側眼等效球鏡屈光度?3.81~2.07 D,平均等效球鏡屈光度(?0.45±1.68)D。納入同期在我院體檢的年齡與CSC患者匹配的正常健康者31名作為對照。其中,男性20名,女性11名。年齡25~58歲,平均年齡(42.06±8.71)歲。等效球鏡屈光度?3.51~1.54 D,平均等效球鏡屈光度(?1.06±1.44)D。CSC患者與正常健康者年齡(t=?0.093,P=0.926)、性別(χ2=2.026,P=0.155)比較,差異無統計學意義;CSC患眼、對側眼和正常眼之間等效球鏡屈光度(F=1.675,P=0.193)比較,差異無統計學意義。
CSC患眼及其對側眼、正常健康眼均接受EDI-OCT經黃斑中心凹單線掃描。選用30°鏡頭,掃描線長度調至最長,每只眼掃描3次,所有操作均由同一名技師完成。單線掃描圖像均由100幅二維圖像疊加組成,用于增強圖像的清晰度并去除圖像偽跡。選取圖像質量最清晰的一幅進行圖像分析處理,并由兩位眼科專家共同對其進行評定。
對所獲取的EDI-OCT圖像進行二值化處理。在Image J軟件中,先設定圖像的比例尺,對圖像進行閾值分割及降噪處理。將圖像設置為8-Bit格式,選擇Niblack選項進行圖像自動閾值處理,通過多邊形工具選取中心凹下1500 μm范圍的脈絡膜區域進行分析;即以中心凹為對稱中心,左右兩側各延伸至750 μm的范圍(圖1)。測量該1500 μm范圍的TCA。在二值化圖像中,低像素區域為脈絡膜血管,高像素區域為脈絡膜基質。將圖像設置為RGB color格式進行彩色閾值分析,勾勒出血管腔與基質的邊界,計算低像素區域的LA。通過LA與TCA的比值,得到CVI數值。
 圖1
CVI測量示意圖。1A示脈絡膜層結構;1B示經過ImageJ軟件Niblack選項將圖像進行自動閾值處理,脈絡膜內部結構分別由低像素區(血管腔)和高像素區(脈絡膜基質)組成;1C示利用多邊形工具選定中心凹下1500 μm范圍進行測量計算,通過偽彩色方式勾勒出脈絡膜血管與脈絡膜基質的邊界
圖1
CVI測量示意圖。1A示脈絡膜層結構;1B示經過ImageJ軟件Niblack選項將圖像進行自動閾值處理,脈絡膜內部結構分別由低像素區(血管腔)和高像素區(脈絡膜基質)組成;1C示利用多邊形工具選定中心凹下1500 μm范圍進行測量計算,通過偽彩色方式勾勒出脈絡膜血管與脈絡膜基質的邊界
采用SPSS 21.0軟件進行統計分析。CSC患者及正常健康者之間的年齡、屈光度比較采用 t 檢驗;性別比較采用χ2 檢驗;CSC患眼、對側眼及正常健康眼之間CVI、SFCT的比較采用方差分析。采用組內相關系數(ICC)分析CVI和SFCT這兩種測量方法的一致性與可重復性。ICC<0.4表示一致性較差;0.4≤ICC<0.75表示一致性較好;ICC≥0.75表示一致性非常好[14]。采用Medcalc18.2.1軟件繪制Bland-Altman曲線,觀察兩種測量方法的一致性。通過變異系數(CV)分析兩種測量方法的穩定性,CV=(s/  )×100%。其中,s代表標準差,
)×100%。其中,s代表標準差, 代表均數。P<0.05為差異有統計學意義。
代表均數。P<0.05為差異有統計學意義。
2 結果
CSC患眼、對側眼、正常健康眼三者之間CVI、SFCT兩兩比較,CSC患眼與對側眼(t=3.470、2.844,P=0.001、0.006)、CSC患眼與正常健康眼(t=6.977、6.277,P<0.001、<0.001)、對側眼與正常健康眼(t=3.508、3.433,P=0.001、0.001)之間的差異均有統計學意義(表1)。
CVI單一測量、平均測量的相對一致性分析結果顯示,其ICC分別為0.967(95%CI 0.932~0.984)、0.983(95%CI 0.965~0.992)。SFCT單一測量、平均測量的相對一致性分析結果顯示,其ICC分別為0.937(95%CI 0.873~0.969)、0.967(95%CI 0.932~0.984)。CVI、SFCT可重復性均非常好,CVI的ICC數值略高于SFCT。
CVI和SFCT這兩種測量方法的一致性分析結果顯示,在CSC患眼的重復測量中兩種測量方法均有6.45%(2/31)的點在95%一致性界限以外。兩次測量CVI的均值為(76.99±8.20)%,差值絕對值最大為2.87%,絕對值最小為0.10%;兩次測量SFCT的均值為(462.63 ±115.54)μm,差值絕對值最大為146.00 μm,絕對值最小為1.00 μm。兩次測量CVI的差值幅度較小,而兩次測量SFCT的差值幅度較大(圖2)。
 圖2
CVI、SFCT可重復性分析Bland-Altman圖。2A示CVI;2B示SFCT
圖2
CVI、SFCT可重復性分析Bland-Altman圖。2A示CVI;2B示SFCT
CVI、SFCT穩定性分析結果顯示,CVI、SFCT的CV分別為10.5%、25.3%;CVI的CV較SFCT更小。
3 討論
CSC發病與脈絡膜改變密切相關。CSC脈絡膜厚度增加可能主要由兩個原因引起:(1)脈絡膜血管擴張;(2)血管滲透性增加可使脈絡膜層間液體積聚導致脈絡膜基質水腫[7, 13]。這也進一步解釋了CSC的發病機制,即脈絡膜血管內流體靜壓力增高會引起血管擴張伴隨通透性增加,隨后發生RPE脫離以及RPE功能障礙,積液便可由此處滲漏至視網膜神經上皮下的空間[3]。CSC經常表現為單眼首先發病,對側眼有相應改變但無明顯癥狀。本研究結果顯示,CSC患眼SFCT明顯高于對側眼,對側眼SFCT明顯高于正常健康眼。雖然CSC伴有脈絡膜厚度增加的現象,但是目前還沒有前瞻性研究可以證實脈絡膜變厚會增加CSC的發病率[15]。因此我們嘗試通過計算CVI來觀察CSC患者脈絡膜血管結構的變化特點。
因為CSC患者的脈絡膜血管存在明顯擴張,并且管腔面積的增加幅度高于基質面積的增加幅度,從而導致CVI測量數值也會隨之增加[1]。在使用ImageJ軟件對EDI-OCT圖像進行二值化處理后,可以將脈絡膜結構中的血管組織與基質成分相互區分。其中低像素區域代表脈絡膜血管管腔(或液體積聚處),高像素區域代表脈絡膜基質成分。盡管這種成分劃分尚未得到證實,但是其圖像形態符合脈絡膜組織學與大量實驗觀察的結果[3, 16]。本研究結果顯示,CSC患眼中心凹下1500 μm范圍CVI數值明顯高于對側眼與正常健康眼,而對側眼CVI數值明顯高于正常健康眼。因此,CVI指數不僅可以反應出急性CSC患眼脈絡膜內部結構比例的變化,還可以定量地計算出血管面積增加的程度。對側眼的CVI數值增加也可作為脈絡膜血管逐漸擴張的一種提示,即在臨床工作中,我們要同時關注急性CSC患者雙眼脈絡膜的結構變化,通過CVI數值的增減,從而預估疾病的發展趨勢。CVI分析可作為疾病早期診斷和評估治療效果的一種有利工具。
CVI計算是一種新的脈絡膜生物測量方法。CVI較SFCT的優勢包括:(1)CVI可同時描述脈絡膜內部血管及基質成分在病變發展過程中的變化。SFCT雖然可以較便捷地反應出脈絡膜厚度的變化,但是我們無從得知導致其變化的主要原因是來自血管成分還是基質成分,又或是兩者同時引起[16]。(2)CVI在計算過程中的干擾因素相對較少。在基于健康人群脈絡膜厚度的研究中發現,SFCT測量的標準差可達到100 μm以上[17]。這樣的差異主要來源于年齡、種族、屈光度、眼軸長度以及設備種類等因素的影響[2, 6, 18]。對于正常人的CVI研究中,目前只觀察到其影響因素與年齡和眼軸長度有關[16, 19]。(3)CVI較SFCT測量數值的波動性小,可重復性更高。我們通過ICC和Bland-Altman圖形來衡量兩種測量方法的可重復性與一致性,CVI的測量結果均優于SFCT的測量結果。而從CSC患眼整體數據的變異性比較,CVI的波動性小,變異程度低。這提示,與SFCT比較,CVI用于觀測脈絡膜內部血管結構變化是更加穩定且可靠的一個生物測量指標。
本研究存在以下不足:(1)本研究為回顧性研究,樣本例數較少。未來若樣本數量足夠大,可設計前瞻性研究,動態觀察各組數值的變化,獲得更加令人信服的結果。(2)在本研究中,我們只選取了水平方向的黃斑中心凹EDI-OCT圖像進行測量。若選取水平和垂直兩方向中心凹圖像進行測量并取平均值,可提高測量結果的準確性[5]。(3)在兩種指標的測量過程中均存在手動標圖的誤差,結果不可避免會受到主觀因素的影響。在獲取CSC患眼中心凹圖像的過程中,當脈絡膜厚度大于400 μm時,圖像質量會受到影響,因脈絡膜與鞏膜交接處圖像顯影模糊,從而可引起SFCT的測量誤差增大[20]。(4)本研究只選取了黃斑中心凹下方1500 μm范圍的單一圖像進行CVI分析。雖然對于正常健康眼的研究中,中心凹下方的CVI與黃斑其他部位的CVI數值相似[12],但是這個結論是否適用于CSC患眼并不十分明確。(5)目前由于技術水平的限制,EDI-OCT尚不能清晰顯示脈絡膜內部更加細微的結構,因此二值化技術的精準性也有待進一步的研究[19]。我們也期待未來OCT技術的進步能夠帶來更加清晰的圖像,從而提高CVI結果的準確性和臨床應用價值。