引用本文: 王應利, 周玉梅, 靳揚揚, 陶俊, 陳冉. T細胞識別的黑色素瘤抗原1在人脈絡膜黑色素瘤細胞系中的表達. 中華眼底病雜志, 2019, 35(3): 279-283. doi: 10.3760/cma.j.issn.1005-1015.2019.03.014 復制
脈絡膜黑色素瘤是成年人最常見的眼內原發性惡性腫瘤,惡性程度高,容易發生遠處轉移;不僅可致患者視力喪失,而且嚴重威脅其生命。目前的治療以綜合治療和個體化治療為主,包括放射治療、經瞳孔溫熱療法、激光光凝、局部切除等,但是對于臨床早期診斷及晚期腫瘤轉移后的免疫治療手段十分匱乏[1]。因此,積極探索脈絡膜黑色素瘤的腫瘤標記物對其早期診斷和治療大有裨益。近年來,利用腫瘤相關抗原(TAA)誘發體內腫瘤免疫監視和排斥反應進行皮膚黑色素瘤治療的研究取得很大突破,某些TAA多肽疫苗已應用于臨床[2-3]。其中,T細胞識別的黑色素瘤抗原1(MART-1)是幾種黑色素瘤相關抗原中特異性最高、抗原性較強的跨膜蛋白,最易被外周血淋巴細胞和腫瘤浸潤淋巴細胞所識別,是黑色素瘤免疫靶向治療的最佳候選分子[4-5]。有研究表明,皮膚惡性黑色素瘤可以通過抑制MART-1啟動子活性從而下調其表達以逃避免疫攻擊,但具體機制不清[6-7]。既往研究主要集中于皮膚黑色素瘤,而針對脈絡膜黑色素瘤是否表達MART-1及其轉錄調控機制的研究較少。為此,本研究擬通過檢測人脈絡膜黑色素瘤細胞系中MART-1表達和初步探索其表達調節機制,為脈絡膜黑色素瘤的早期診斷及免疫靶向治療提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要材料和儀器
人脈絡膜黑色素瘤細胞系92-1、92-2、Me1285和Ocm3,由荷蘭萊頓大學醫學院L. C. van Dinten教授惠贈。Iscove改良Dulbecco培養基(IMDM培養基)、胎牛血清(FCS)、禽成髓細胞瘤逆轉錄酶(AMV-RT,美國Gibco公司),單克隆鼠抗MART-1抗體[MART-1 Ab-4(clone A103)]、異硫氰酸熒光素(FITC)標記的羊抗鼠IgG(美國Neomarkers公司),豬抗鼠二抗(丹麥DAKO公司)。蛋白提取試劑盒、RNA提取試劑盒(美國Gibcobrl公司)。SDS-PAGE(美國Invitrogen公司),尼龍膜(美國Boehringer Mannheim公司)。流式細胞儀(美國Becton Dickinson公司),PCR反應儀(Gene Amp PCR System 2400,美國PE公司),電泳儀(Power PAC-300型,美國Bio-Rad公司)。
1.2 細胞復蘇和培養
取人脈絡膜黑色素瘤細胞系92-1、92-2、Me1285和Ocm3凍存細胞,立即置于60 ℃水中迅速解凍,10%FCS/IMDM置換凍存液,調整細胞密度為5×104個/ml接種于75 cm2培養瓶中,37 ℃ 5%CO2孵箱中培養。3~4 d換液1次,細胞長滿瓶底80%~90%后,0.25%胰蛋白酶消化,1:2傳代。
1.3 免疫熒光染色及流式細胞儀細胞計數
單細胞懸液制備。0.01 mol/L PBS 4 ml混勻約5×106~6×106個/ml細胞,混懸液等分熒光染色組和對照組。
免疫熒光染色。加MART-1鼠抗單克隆抗體(1:200)50 μl,4 ℃孵育45 min,含1% FCS的PBS漂洗2次,以離心半徑8 cm、1300 r/min離心5 min收集細胞。加FITC標記的羊抗鼠IgG二抗50 μl,4℃避光放置30 min。以PBS代替一抗作為陰性對照。另設2組陰性對照:一組不加一抗和二抗,用于熒光強度的基線校正;另一組單加二抗,作為非特異性結合對照。
流式細胞儀細胞計數。所有樣品分別加400 μl流式細胞儀保存液,4 ℃避光保存,1周內流式細胞儀檢測。實驗重復2次,取均值。所得數據用Cellquest v3.3圖像系統分析。
1.4 Western blot檢測
按照蛋白提取試劑盒操作。提取物加入1/100體積 0.5 mol/L EDTA后,-80 °C低溫保存。制備15%聚丙烯酰胺凝膠,待膠凝集好后,上樣,以高分子量預染色蛋白作為標記,SDS-PAGE電泳1.5 h。0 °C、100 V、150 mA條件下將蛋白轉印至聚偏氟乙烯膜。室溫下PBS/0.5% Tween 20(PBS/T)/5%牛奶封閉膜1 h。單克隆鼠抗MART-1抗體(1∶200)與聚偏氟乙烯膜室溫下孵育1 h,PBS/T洗膜3次后,與豬抗鼠二抗(1∶1000)孵育1 h,PBS/T洗膜3次,辣根過氧化物酶法DAB顯色20 min。將膜放于成像儀中測量各條帶的吸光度[A,舊稱光密度(OD)]值。
1.5 RT-PCR檢測
細胞總RNA提取,按照RNA提取試劑盒操作,測量RNA濃度。cDNA合成。總RNA 5 μg和2.5 μg隨機六聚引物混合后于70 ℃變性,然后加入1.5 μl AMV-RT,2.5 μl 10 mmol/L脫氧核糖核苷三磷酸(dNTP),20 U RNA酶抑制劑和5 μl逆轉錄緩沖液加入cDNA合成體系于42 ℃反應60 min,70 ℃孵育10 min。99 ℃ 5 min滅活AMV-RT。PCR反應體系:18 μl PCR反應體系中含2 μl cDNA模板,2 μl 10倍TaqMan緩沖液,MART-1正反向引物各10 pmol,0.5 μl Taq多聚酶,0.8 μl 10 mmol/L dNTP,2.4 μl 25 mmol/L MgCl2。MART-1正向引物5’-CAAGATGCCAAGAGAAGATGCTCACT-3’,反向引物5’-GCTTGCATTTTCCTACACCATTCCA-3’。每一PCR反應均包括空白對照組、RNA對照組及GAPDH對照。PCR反應條件:95 ℃變性3 min,之后進行25個循環,包括95 ℃變性1 min,60 ℃退火1 min,72 ℃延伸2 min,循環完成后72 ℃保溫10 min。取5 μl PCR產物采用1%瓊脂糖凝膠電泳進行分析。電泳使用梯度為1 kb的DNA分子量標準品。
1.6 Southern印跡雜交
細胞核基因組DNA提取。將5~6×106個細胞與1 ml細胞裂解液(pH 8.0的0.1 mol/L EDTA,pH 7.6的0.01 mol/L Tris-HCl,0.02 mol/L NaCl,100 μg蛋白酶K)混勻,56 °C孵育過夜。常規酚氯仿抽提純化,紫外可見分光光度計檢測DNA的濃度與純度。
基因組酶切和電泳。每種細胞系的DNA樣本各取10 μg加入以下列酶復合物40 U消化:Hind Ⅲ,Hind Ⅲ/HpaⅡ,Hind Ⅲ/MspⅠ或Hind Ⅲ/NruⅠ。瓊脂糖凝膠電泳分離DNA片段,紫外燈下測量標準分子量梯度上DNA遷移的距離。
轉膜、雜交、洗膜。把已轉移上DNA的尼龍膜加入雜交液10 ml,用含100~500 ng探針的雜交液65 °C下雜交。探針為MART-1啟動子包含外顯子1和內含子1,隨機引物法進行α-[32P]-dNTP標記。雜交后在65 °C 2倍SSC/0.1% SDS中重復洗膜,去除未雜交上的同位素。放射自顯影,觀察雜交結果。
2 結果
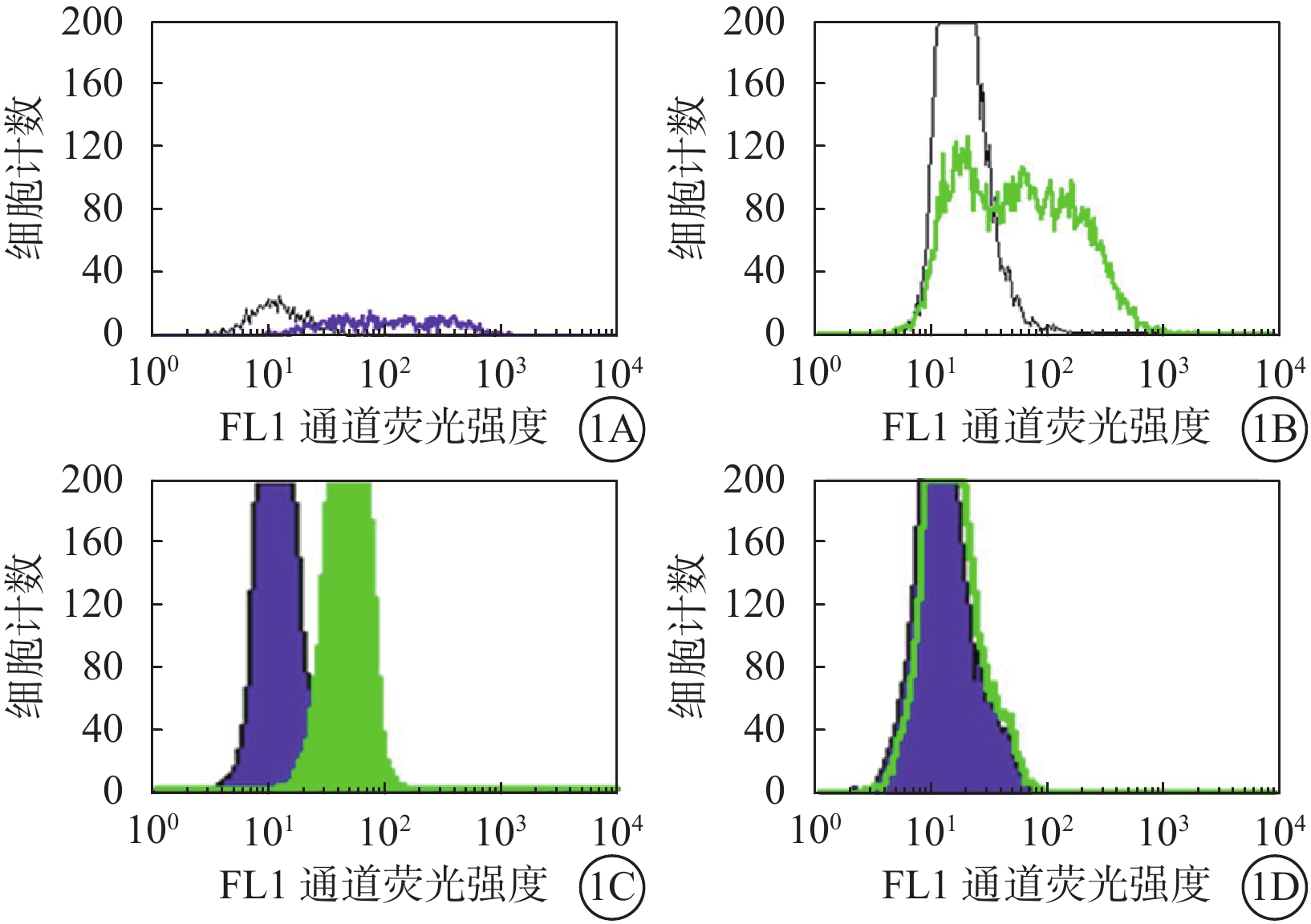
抗MART-1熒光抗體及流式細胞儀檢測結果顯示,92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性(圖1)。
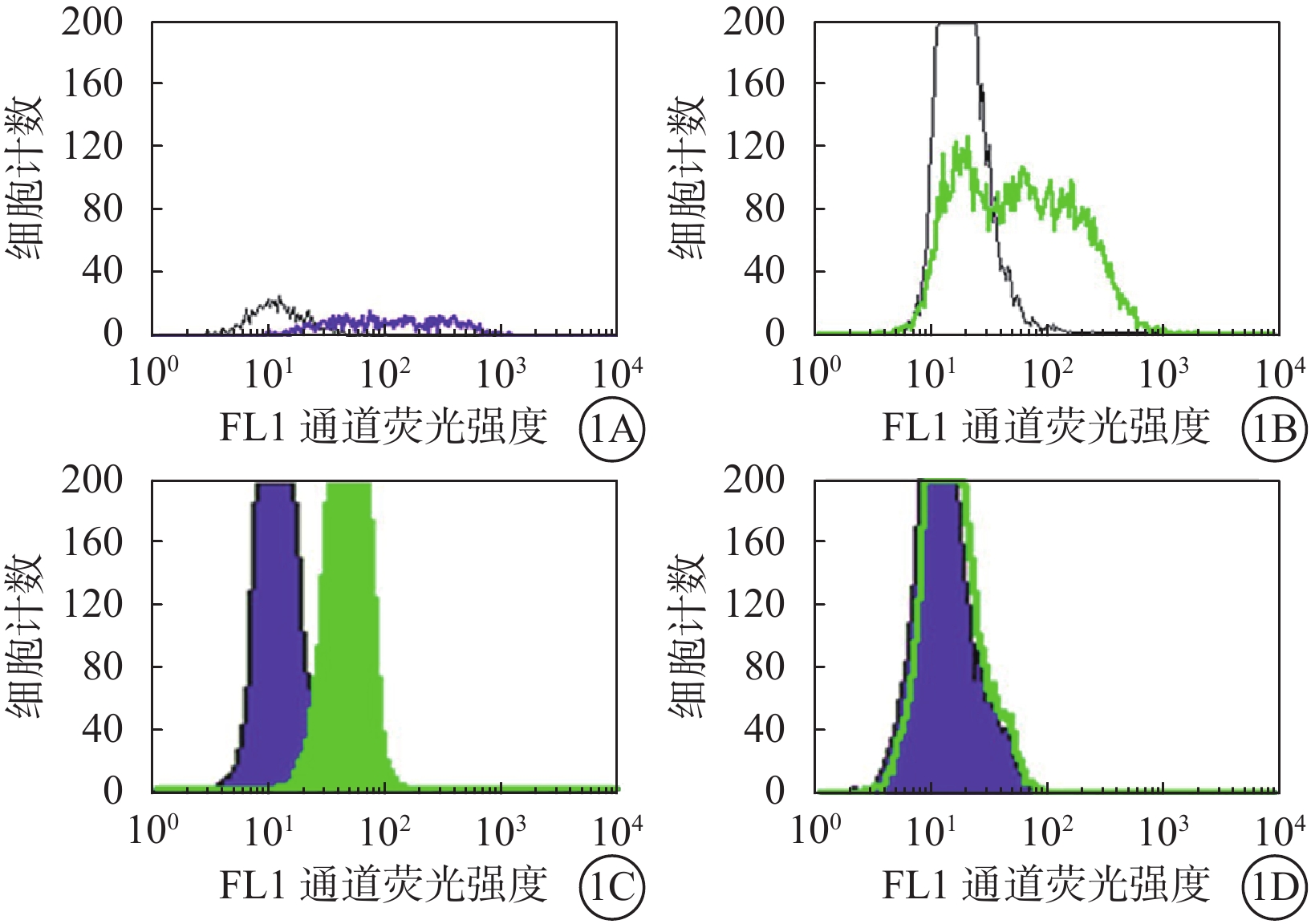 圖1
抗MART-1熒光抗體標記的脈絡膜黑色素瘤細胞系流式細胞儀分析圖。1A~1D分別示92-1、92-2、Ocm3、Me1285細胞系。92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性
圖1
抗MART-1熒光抗體標記的脈絡膜黑色素瘤細胞系流式細胞儀分析圖。1A~1D分別示92-1、92-2、Ocm3、Me1285細胞系。92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性
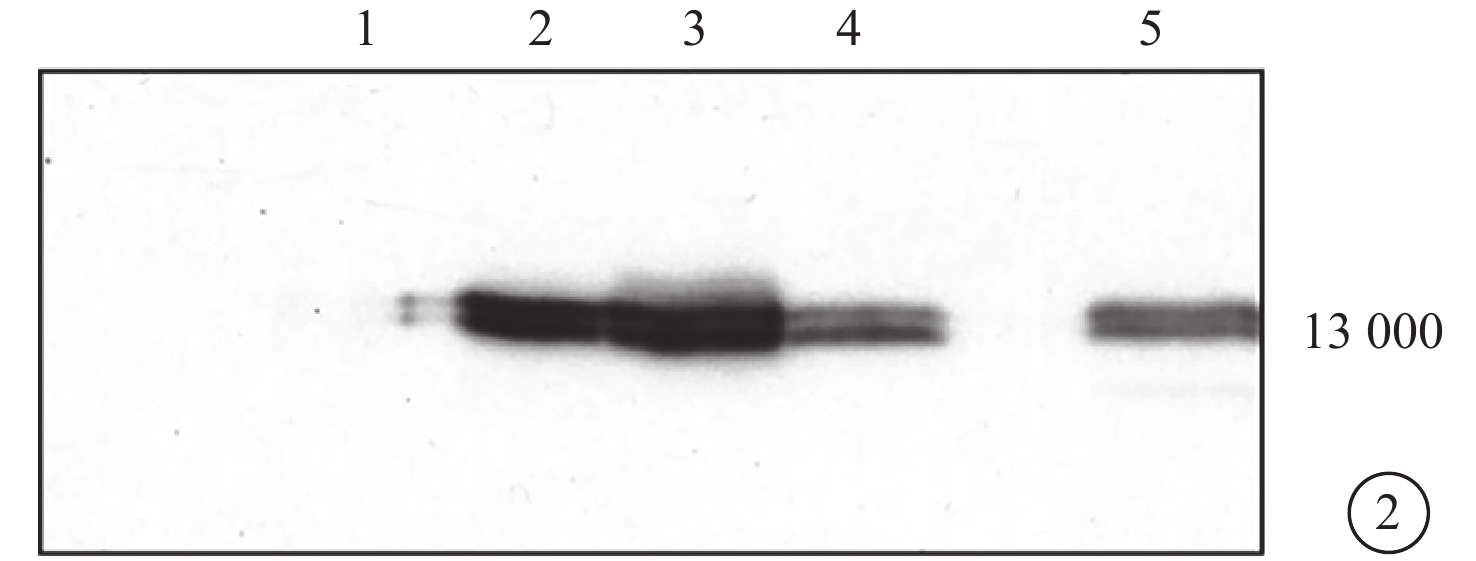
Western blot檢測結果顯示,MART-1蛋白條帶約位于相對分子質量13×103處。Me1285細胞系完全缺如此蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達(圖2)。
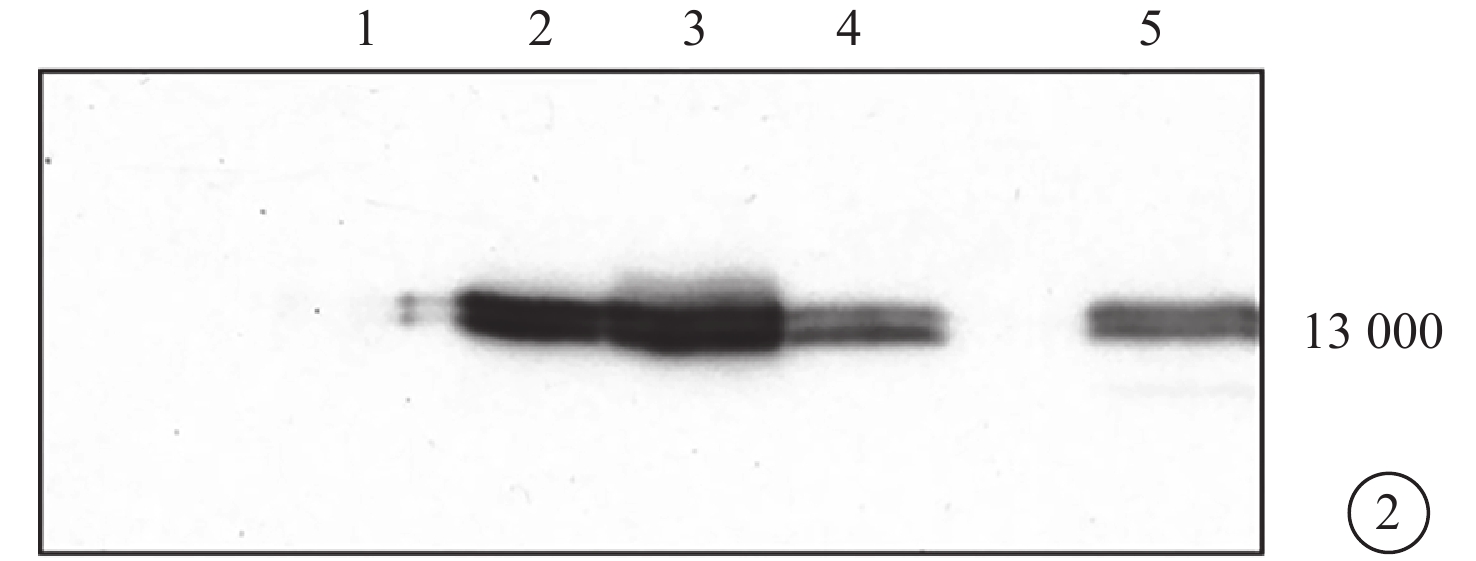 圖2
Western blot電泳像。泳道1~4分別為Me1285、Ocm3、92-2、92-1細胞系,泳道5為陽性對照。可見MART-1蛋白條帶約位于相對分子質量13×103處;Me1285細胞系完全缺如MART-1蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達
圖2
Western blot電泳像。泳道1~4分別為Me1285、Ocm3、92-2、92-1細胞系,泳道5為陽性對照。可見MART-1蛋白條帶約位于相對分子質量13×103處;Me1285細胞系完全缺如MART-1蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達
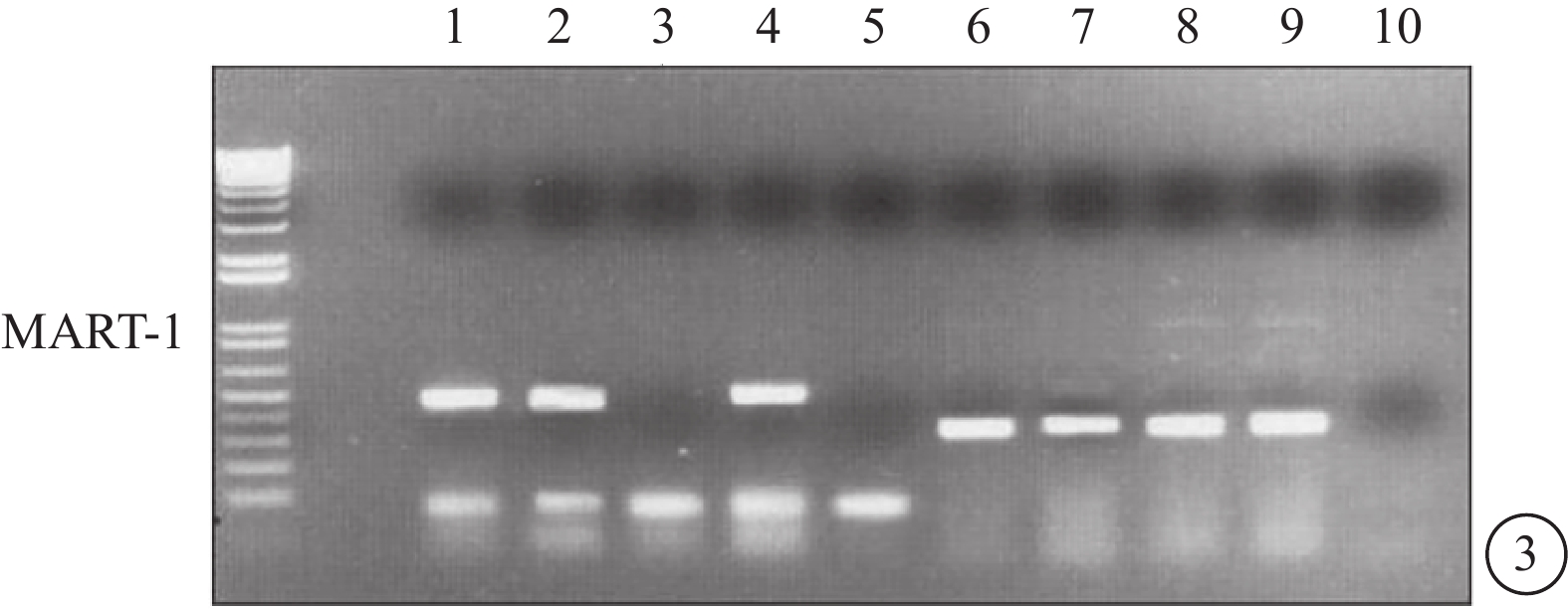
RT-PCR檢測結果顯示,92-1、92-2和Ocm3細胞系可觀察到MART-1 mRNA轉錄。與Western blot檢測結果對應,RT-PCR中也未觀察到Me1285細胞系中MART-1 mRNA轉錄(圖3)。
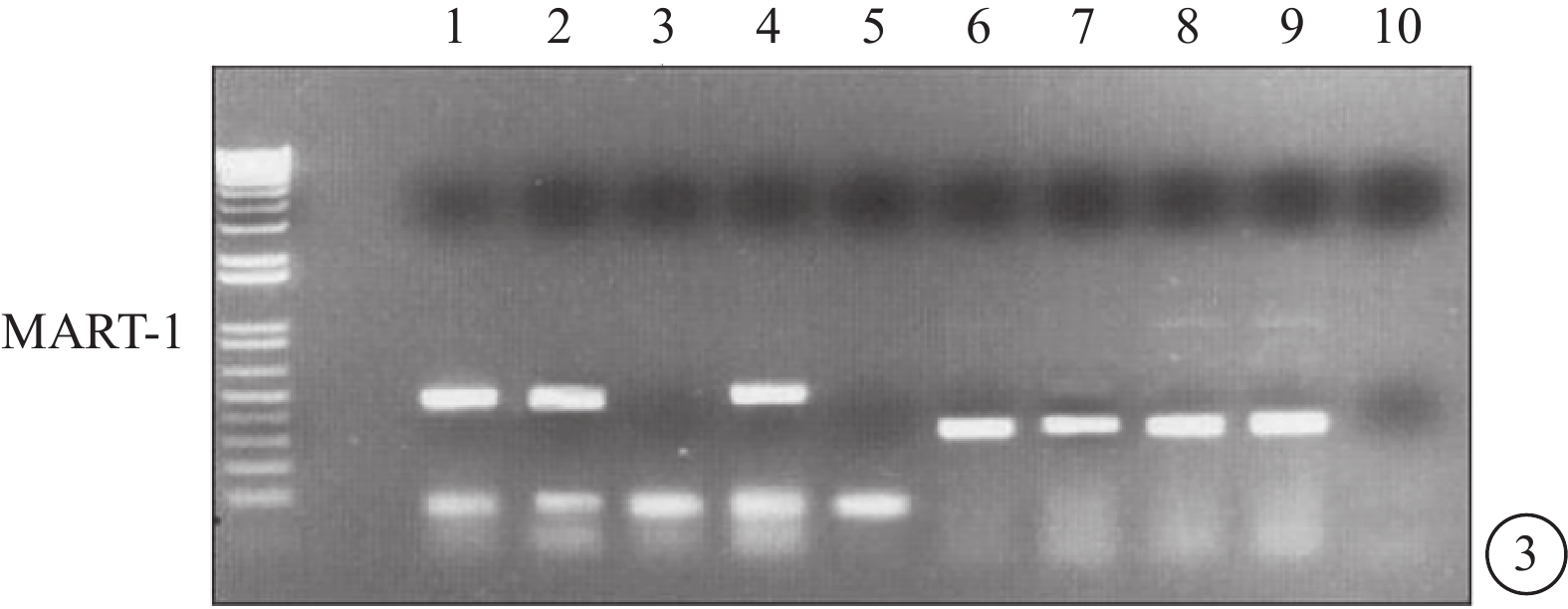 圖3
RT-PCR電泳像。泳道1~4分別為92-1、92-2、Mel285、Ocm3細胞系的RT-PCR產物,泳道6~9為GAPDH對照,泳道5、10為水對照
圖3
RT-PCR電泳像。泳道1~4分別為92-1、92-2、Mel285、Ocm3細胞系的RT-PCR產物,泳道6~9為GAPDH對照,泳道5、10為水對照
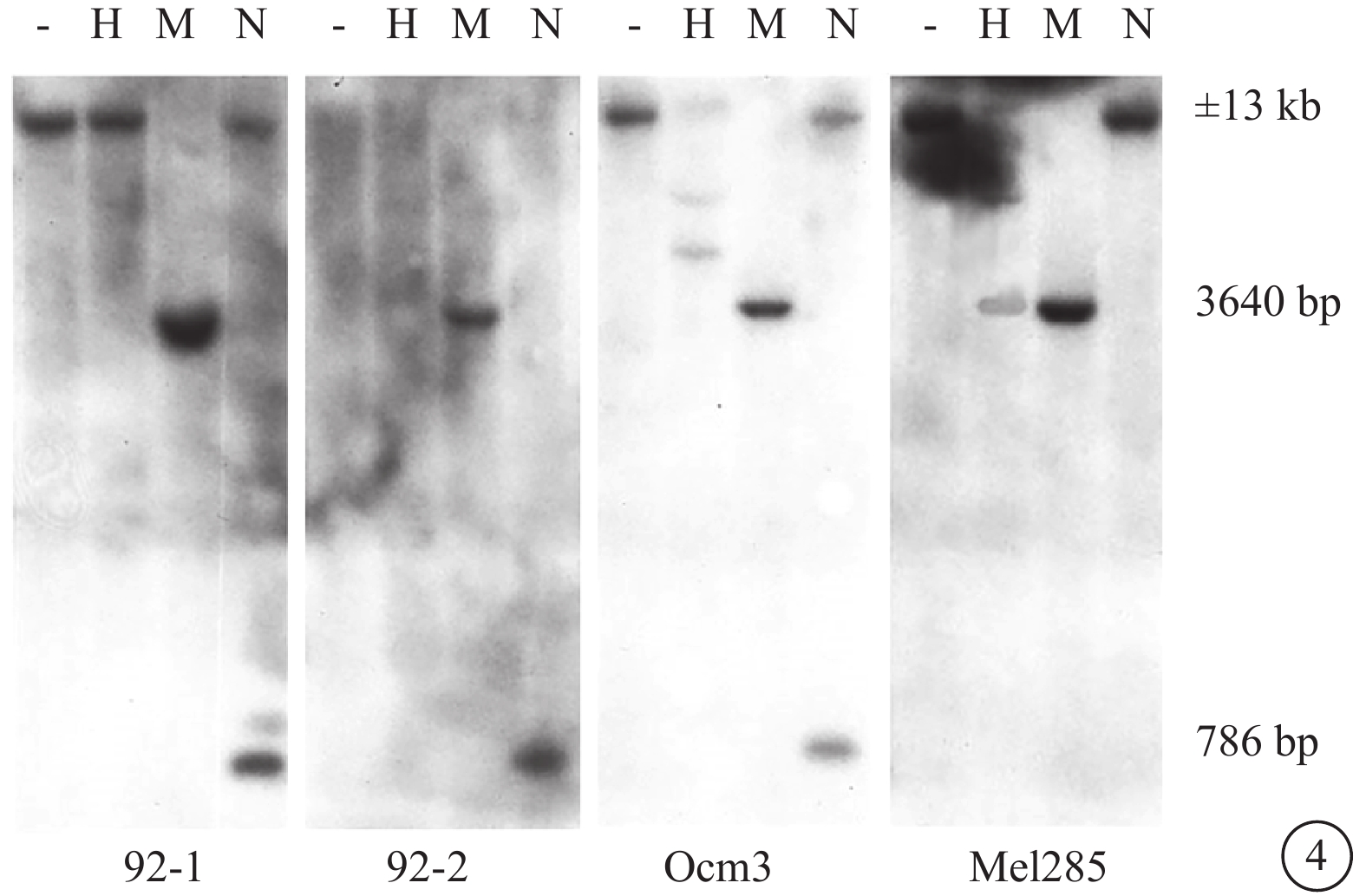
Hind Ⅲ消化后可得到約13 kb的DNA片段。甲基化DNA無法被NruⅠ或HpaⅡ消化。MspⅠ是HpaⅡ的同切點酶,但是它可于甲基化及未甲基化位點切斷DNA。用HindⅢ/NruⅠ雙消化可獲得786 bp和約12.5 kb的DNA片段。Hind Ⅲ/MspⅠ或Hind Ⅲ/HpaⅡ雙消化可獲得3640 bp和約9.5 kb大小的DNA片段。
MART-1陰性細胞系Mel285在內含子NruⅠ位點顯示為過甲基化(圖4),此區域缺乏786 bp的NruⅠ片斷。5’正向區域的MspⅠ/HpaⅡ位點未甲基化,其相應泳道僅有少量DNA。MART-1陽性細胞系 92-1、92-2、Ocm3在MspⅠ/HpaⅡ位點甲基化,此區域缺乏3640 bp條帶。所有陽性細胞系的NruⅠ位點未甲基化,而是消化出786 bp的NruⅠ片斷。
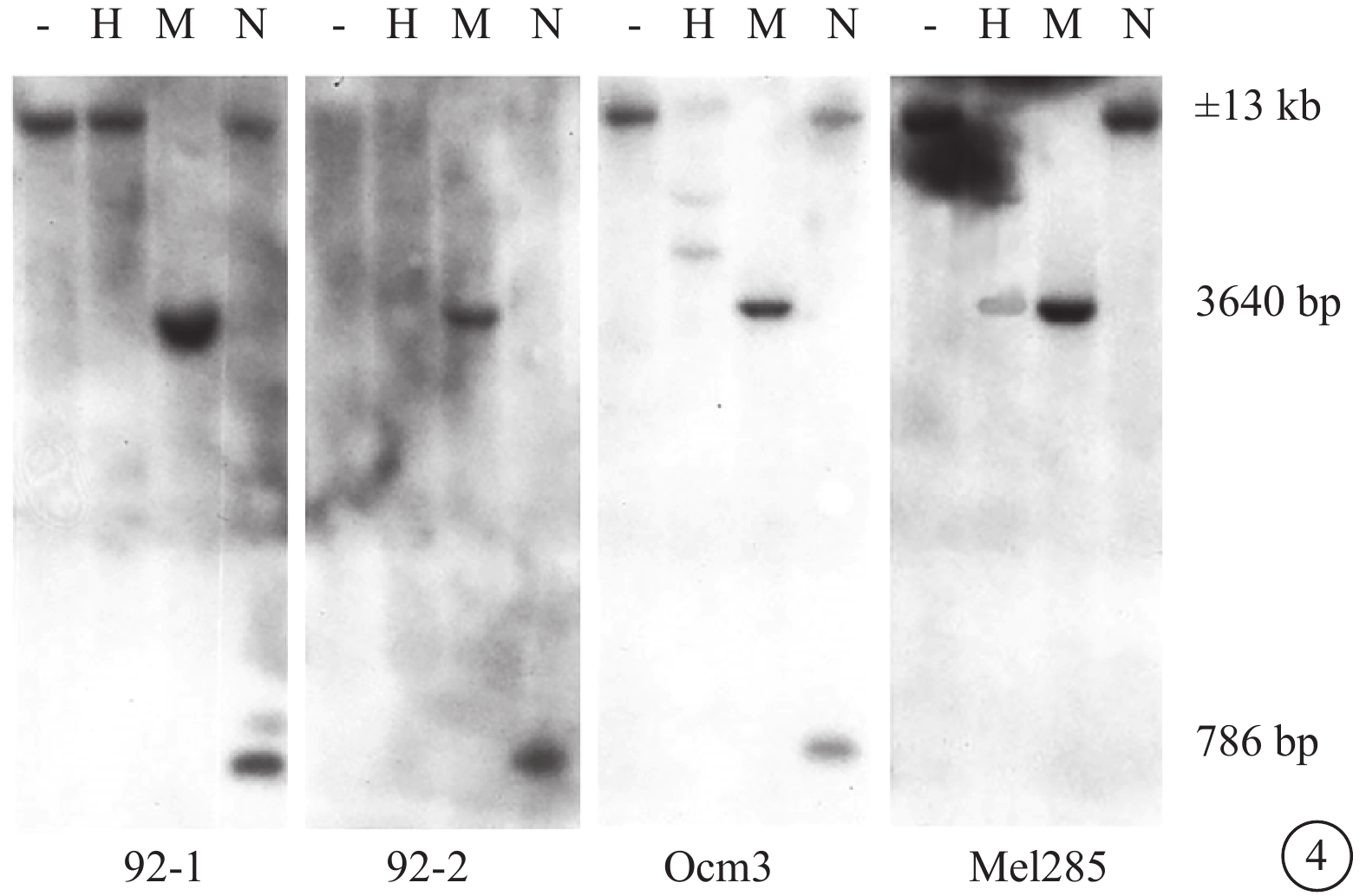 圖4
DNA由甲基敏感的限制性內切酶消化后Southern blots分析圖。H為Hpa Ⅱ,M為MspⅠ,N為NruⅠ
圖4
DNA由甲基敏感的限制性內切酶消化后Southern blots分析圖。H為Hpa Ⅱ,M為MspⅠ,N為NruⅠ
3 討論
MART-1是黑色素瘤和黑色素細胞所特有的TAA,可與HLA分子結合成復合物表達于腫瘤細胞表面,能為HLA限制性的腫瘤特異性細胞毒性T淋巴細胞(CTL)所識別,而誘發腫瘤免疫排斥反應來消滅或減小腫瘤,是黑色素瘤治療的研究熱點[3]。這一類僅表達于黑色素細胞和黑色素瘤細胞的TAA還有酪氨酸酶、酪氨酸酶相關蛋白1(TRP-1)、gp75、gp100。其中MART-1被幾乎所有新鮮黑色素瘤標本表達,是最易被外周血淋巴細胞和腫瘤浸潤淋巴細胞所識別的黑色素瘤相關抗原[8-9]。MART-1是抗原性較強的跨膜蛋白,相對分子質量約為13~18×103,主要集中在高爾基復合體中,在黑色素體、內質網中亦可觀察到。其基因已被克隆由5個外顯子和4個內含子組成,啟動子包含233 bp組織特異性激活區,抗原的性質及呈遞MART-1的HLA分子已得到部分闡明[10-11],因而被認為是黑色素瘤特異性免疫治療的最佳候選者。
既往對于皮膚黑色素瘤的研究較多,而針對脈絡膜黑色素瘤的研究尚缺乏;兩者在臨床和基因上的差異需要我們積極尋找針對脈絡膜黑色素瘤的免疫治療[12]。MART-1引起的機體免疫反應可導致原發性皮膚黑色素瘤回退,腫瘤的回退與外周血MART-1特異性CTL的出現和MART-1陽性瘤細胞的減少相關[13]。令人鼓舞的是治療晚期皮膚黑色素瘤的免疫抑制劑伊匹單抗已經上市,并取得較好效果,明顯增加了皮膚黑色素瘤患者晚期CD45RO+CD8+的應答[14-15]。而對于脈絡膜黑色素瘤,目前還沒有明確的免疫治療試劑。部分原發性和轉移性脈絡膜黑色素瘤患者的外周血中可檢測到針對MART-1、gp100、酪氨酸酶的細胞和體液免疫反應[16]。
92-1、92-2細胞系由荷蘭萊頓大學醫學中心分離培養成功,其來源的脈絡膜黑色素瘤生長很快;HMB45抗原免疫組織化學染色陽性;腫瘤組織分型不明,其中有很多噬黑色素細胞[17]。Mel285細胞系由邁阿密大學眼科研究所分離成功,MART-1和HMB免疫組織化學染色陽性;腫瘤組織屬于混合型,20%是上皮細胞;Mel285的原發腫瘤MART-1陽性,而細胞系的MART-1陰性[18]。由于Mel285細胞系是從原發脈絡膜黑色素瘤的部分細胞簇里培養增生而來,不能代表原有腫瘤的所有特質[18];因此,關于Mel285細胞系中MART-1抗原的缺失是因為該細胞系在長期體外增生傳代過程中丟失了,還是細胞系來源的原發腫瘤部分就沒有表達這些抗原目前并不清楚。我們采用抗MART-1熒光抗體及流式細胞儀檢測了人脈絡膜黑色素細胞系92-1、92-2、Ocm3、Me1285的MART-1抗原表達,顯示92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性。這提示MART-1抗原并非在所有的脈絡膜黑色素瘤細胞中都有表達。進一步采用Western blot分析這4個細胞系,以蛋白分子量確認MART-1的表達,顯示MART-1蛋白電泳帶在相對分子質量13×103左右。Me1285細胞系完全缺如此蛋白,另3種細胞系可見MART-1蛋白表達,與流式細胞儀分析結果一致。RT-PCR可觀察到92-1、92-2和Ocm3細胞系MART-1 mRNA轉錄,而Me1285細胞系無MART-1 mRNA轉錄。這證實了部分脈絡膜黑色素瘤細胞系轉錄并表達MART-1抗原。與本研究所得結果一致,van Dinten等[17]發現,MART-1陽性細胞系還表達Tyr、Dct、gp100等其他黑色素瘤相關抗原(MAA),而MART-1陰性細胞系同樣不表達其他MAA。4種細胞系均來源于原發性脈絡膜黑色素瘤,而非轉移性瘤。我們分析Mel285細胞系陰性表達MART-1的可能原因為,Mel285細胞系不攜帶92-1、92-2、OCM3細胞系均攜帶的GNAQ、GNA11基因突變,所以缺乏MART-1這類黑色素相關性細胞標志物。這些基因突變對于脈絡膜黑色素細胞早期的惡化很重要,可以使腫瘤細胞對抗腫瘤藥物更敏感[19]。
以往研究認為,黑色素瘤發病相關基因啟動子的甲基化狀態(甲基化、未甲基化、過甲基化)的改變與腫瘤細胞的生長和分化密切相關[20]。對脈絡膜黑色素瘤高度相關基因pRb、Wnt、TGF-β和p53的研究發現,pRb信號通路中p14ARF和p16(INK4A)啟動子的甲基化是這幾種基因通路檢測出的唯一突變[21-22]。所以認為基因位點甲基化改變在脈絡膜黑色素瘤中可能起重要作用。因此,我們檢測了4種細胞系MART-1啟動子的甲基化狀態。結果顯示,MART-1陽性細胞系92-1、92-2和Ocm3在MspⅠ/HpaⅡ位點甲基化,NruⅠ位點未甲基化,而是消化出786 bp的NruⅠ片斷。MART-1陰性細胞系Mel285在內含子NruⅠ位點顯示為過甲基化,MspⅠ/HpaⅡ位點未甲基化。這表明MART-1陽性和陰性細胞系有不同的甲基化模式,包括5’正向區域和內含子。提示甲基化模式在脈絡膜黑色素瘤MART-1轉錄的調控中起重要作用,甲基化的改變可下調MART-1的轉錄。但這種作用還需深入研究,包括去甲基化研究和染色質免疫沉淀實驗,以發現轉錄因子結合在甲基化區和非甲基化區的不同。
本研究只觀察到了啟動子甲基化的改變可能與MART-1表達相關,之后需要從基因水平改變MART-1啟動子甲基化狀態,從而明確二者是否存在調控的因果關系。今后研究需要納入更多細胞系,如原發性、轉移性脈絡膜黑色素瘤以及不同分型、不同階段的腫瘤細胞系,從而更為全面地研究MART-1表達變化及其可能的調控機制和基因突變。這對于增強MART-1的抗原性和誘導CTL應答都有更深遠的意義,甚至為脈絡膜黑色素瘤的特異性免疫治療提供依據。
脈絡膜黑色素瘤是成年人最常見的眼內原發性惡性腫瘤,惡性程度高,容易發生遠處轉移;不僅可致患者視力喪失,而且嚴重威脅其生命。目前的治療以綜合治療和個體化治療為主,包括放射治療、經瞳孔溫熱療法、激光光凝、局部切除等,但是對于臨床早期診斷及晚期腫瘤轉移后的免疫治療手段十分匱乏[1]。因此,積極探索脈絡膜黑色素瘤的腫瘤標記物對其早期診斷和治療大有裨益。近年來,利用腫瘤相關抗原(TAA)誘發體內腫瘤免疫監視和排斥反應進行皮膚黑色素瘤治療的研究取得很大突破,某些TAA多肽疫苗已應用于臨床[2-3]。其中,T細胞識別的黑色素瘤抗原1(MART-1)是幾種黑色素瘤相關抗原中特異性最高、抗原性較強的跨膜蛋白,最易被外周血淋巴細胞和腫瘤浸潤淋巴細胞所識別,是黑色素瘤免疫靶向治療的最佳候選分子[4-5]。有研究表明,皮膚惡性黑色素瘤可以通過抑制MART-1啟動子活性從而下調其表達以逃避免疫攻擊,但具體機制不清[6-7]。既往研究主要集中于皮膚黑色素瘤,而針對脈絡膜黑色素瘤是否表達MART-1及其轉錄調控機制的研究較少。為此,本研究擬通過檢測人脈絡膜黑色素瘤細胞系中MART-1表達和初步探索其表達調節機制,為脈絡膜黑色素瘤的早期診斷及免疫靶向治療提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要材料和儀器
人脈絡膜黑色素瘤細胞系92-1、92-2、Me1285和Ocm3,由荷蘭萊頓大學醫學院L. C. van Dinten教授惠贈。Iscove改良Dulbecco培養基(IMDM培養基)、胎牛血清(FCS)、禽成髓細胞瘤逆轉錄酶(AMV-RT,美國Gibco公司),單克隆鼠抗MART-1抗體[MART-1 Ab-4(clone A103)]、異硫氰酸熒光素(FITC)標記的羊抗鼠IgG(美國Neomarkers公司),豬抗鼠二抗(丹麥DAKO公司)。蛋白提取試劑盒、RNA提取試劑盒(美國Gibcobrl公司)。SDS-PAGE(美國Invitrogen公司),尼龍膜(美國Boehringer Mannheim公司)。流式細胞儀(美國Becton Dickinson公司),PCR反應儀(Gene Amp PCR System 2400,美國PE公司),電泳儀(Power PAC-300型,美國Bio-Rad公司)。
1.2 細胞復蘇和培養
取人脈絡膜黑色素瘤細胞系92-1、92-2、Me1285和Ocm3凍存細胞,立即置于60 ℃水中迅速解凍,10%FCS/IMDM置換凍存液,調整細胞密度為5×104個/ml接種于75 cm2培養瓶中,37 ℃ 5%CO2孵箱中培養。3~4 d換液1次,細胞長滿瓶底80%~90%后,0.25%胰蛋白酶消化,1:2傳代。
1.3 免疫熒光染色及流式細胞儀細胞計數
單細胞懸液制備。0.01 mol/L PBS 4 ml混勻約5×106~6×106個/ml細胞,混懸液等分熒光染色組和對照組。
免疫熒光染色。加MART-1鼠抗單克隆抗體(1:200)50 μl,4 ℃孵育45 min,含1% FCS的PBS漂洗2次,以離心半徑8 cm、1300 r/min離心5 min收集細胞。加FITC標記的羊抗鼠IgG二抗50 μl,4℃避光放置30 min。以PBS代替一抗作為陰性對照。另設2組陰性對照:一組不加一抗和二抗,用于熒光強度的基線校正;另一組單加二抗,作為非特異性結合對照。
流式細胞儀細胞計數。所有樣品分別加400 μl流式細胞儀保存液,4 ℃避光保存,1周內流式細胞儀檢測。實驗重復2次,取均值。所得數據用Cellquest v3.3圖像系統分析。
1.4 Western blot檢測
按照蛋白提取試劑盒操作。提取物加入1/100體積 0.5 mol/L EDTA后,-80 °C低溫保存。制備15%聚丙烯酰胺凝膠,待膠凝集好后,上樣,以高分子量預染色蛋白作為標記,SDS-PAGE電泳1.5 h。0 °C、100 V、150 mA條件下將蛋白轉印至聚偏氟乙烯膜。室溫下PBS/0.5% Tween 20(PBS/T)/5%牛奶封閉膜1 h。單克隆鼠抗MART-1抗體(1∶200)與聚偏氟乙烯膜室溫下孵育1 h,PBS/T洗膜3次后,與豬抗鼠二抗(1∶1000)孵育1 h,PBS/T洗膜3次,辣根過氧化物酶法DAB顯色20 min。將膜放于成像儀中測量各條帶的吸光度[A,舊稱光密度(OD)]值。
1.5 RT-PCR檢測
細胞總RNA提取,按照RNA提取試劑盒操作,測量RNA濃度。cDNA合成。總RNA 5 μg和2.5 μg隨機六聚引物混合后于70 ℃變性,然后加入1.5 μl AMV-RT,2.5 μl 10 mmol/L脫氧核糖核苷三磷酸(dNTP),20 U RNA酶抑制劑和5 μl逆轉錄緩沖液加入cDNA合成體系于42 ℃反應60 min,70 ℃孵育10 min。99 ℃ 5 min滅活AMV-RT。PCR反應體系:18 μl PCR反應體系中含2 μl cDNA模板,2 μl 10倍TaqMan緩沖液,MART-1正反向引物各10 pmol,0.5 μl Taq多聚酶,0.8 μl 10 mmol/L dNTP,2.4 μl 25 mmol/L MgCl2。MART-1正向引物5’-CAAGATGCCAAGAGAAGATGCTCACT-3’,反向引物5’-GCTTGCATTTTCCTACACCATTCCA-3’。每一PCR反應均包括空白對照組、RNA對照組及GAPDH對照。PCR反應條件:95 ℃變性3 min,之后進行25個循環,包括95 ℃變性1 min,60 ℃退火1 min,72 ℃延伸2 min,循環完成后72 ℃保溫10 min。取5 μl PCR產物采用1%瓊脂糖凝膠電泳進行分析。電泳使用梯度為1 kb的DNA分子量標準品。
1.6 Southern印跡雜交
細胞核基因組DNA提取。將5~6×106個細胞與1 ml細胞裂解液(pH 8.0的0.1 mol/L EDTA,pH 7.6的0.01 mol/L Tris-HCl,0.02 mol/L NaCl,100 μg蛋白酶K)混勻,56 °C孵育過夜。常規酚氯仿抽提純化,紫外可見分光光度計檢測DNA的濃度與純度。
基因組酶切和電泳。每種細胞系的DNA樣本各取10 μg加入以下列酶復合物40 U消化:Hind Ⅲ,Hind Ⅲ/HpaⅡ,Hind Ⅲ/MspⅠ或Hind Ⅲ/NruⅠ。瓊脂糖凝膠電泳分離DNA片段,紫外燈下測量標準分子量梯度上DNA遷移的距離。
轉膜、雜交、洗膜。把已轉移上DNA的尼龍膜加入雜交液10 ml,用含100~500 ng探針的雜交液65 °C下雜交。探針為MART-1啟動子包含外顯子1和內含子1,隨機引物法進行α-[32P]-dNTP標記。雜交后在65 °C 2倍SSC/0.1% SDS中重復洗膜,去除未雜交上的同位素。放射自顯影,觀察雜交結果。
2 結果
抗MART-1熒光抗體及流式細胞儀檢測結果顯示,92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性(圖1)。
 圖1
抗MART-1熒光抗體標記的脈絡膜黑色素瘤細胞系流式細胞儀分析圖。1A~1D分別示92-1、92-2、Ocm3、Me1285細胞系。92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性
圖1
抗MART-1熒光抗體標記的脈絡膜黑色素瘤細胞系流式細胞儀分析圖。1A~1D分別示92-1、92-2、Ocm3、Me1285細胞系。92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性
Western blot檢測結果顯示,MART-1蛋白條帶約位于相對分子質量13×103處。Me1285細胞系完全缺如此蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達(圖2)。
 圖2
Western blot電泳像。泳道1~4分別為Me1285、Ocm3、92-2、92-1細胞系,泳道5為陽性對照。可見MART-1蛋白條帶約位于相對分子質量13×103處;Me1285細胞系完全缺如MART-1蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達
圖2
Western blot電泳像。泳道1~4分別為Me1285、Ocm3、92-2、92-1細胞系,泳道5為陽性對照。可見MART-1蛋白條帶約位于相對分子質量13×103處;Me1285細胞系完全缺如MART-1蛋白,92-1、92-2、Ocm3細胞系可見MART-1蛋白表達
RT-PCR檢測結果顯示,92-1、92-2和Ocm3細胞系可觀察到MART-1 mRNA轉錄。與Western blot檢測結果對應,RT-PCR中也未觀察到Me1285細胞系中MART-1 mRNA轉錄(圖3)。
 圖3
RT-PCR電泳像。泳道1~4分別為92-1、92-2、Mel285、Ocm3細胞系的RT-PCR產物,泳道6~9為GAPDH對照,泳道5、10為水對照
圖3
RT-PCR電泳像。泳道1~4分別為92-1、92-2、Mel285、Ocm3細胞系的RT-PCR產物,泳道6~9為GAPDH對照,泳道5、10為水對照
Hind Ⅲ消化后可得到約13 kb的DNA片段。甲基化DNA無法被NruⅠ或HpaⅡ消化。MspⅠ是HpaⅡ的同切點酶,但是它可于甲基化及未甲基化位點切斷DNA。用HindⅢ/NruⅠ雙消化可獲得786 bp和約12.5 kb的DNA片段。Hind Ⅲ/MspⅠ或Hind Ⅲ/HpaⅡ雙消化可獲得3640 bp和約9.5 kb大小的DNA片段。
MART-1陰性細胞系Mel285在內含子NruⅠ位點顯示為過甲基化(圖4),此區域缺乏786 bp的NruⅠ片斷。5’正向區域的MspⅠ/HpaⅡ位點未甲基化,其相應泳道僅有少量DNA。MART-1陽性細胞系 92-1、92-2、Ocm3在MspⅠ/HpaⅡ位點甲基化,此區域缺乏3640 bp條帶。所有陽性細胞系的NruⅠ位點未甲基化,而是消化出786 bp的NruⅠ片斷。
 圖4
DNA由甲基敏感的限制性內切酶消化后Southern blots分析圖。H為Hpa Ⅱ,M為MspⅠ,N為NruⅠ
圖4
DNA由甲基敏感的限制性內切酶消化后Southern blots分析圖。H為Hpa Ⅱ,M為MspⅠ,N為NruⅠ
3 討論
MART-1是黑色素瘤和黑色素細胞所特有的TAA,可與HLA分子結合成復合物表達于腫瘤細胞表面,能為HLA限制性的腫瘤特異性細胞毒性T淋巴細胞(CTL)所識別,而誘發腫瘤免疫排斥反應來消滅或減小腫瘤,是黑色素瘤治療的研究熱點[3]。這一類僅表達于黑色素細胞和黑色素瘤細胞的TAA還有酪氨酸酶、酪氨酸酶相關蛋白1(TRP-1)、gp75、gp100。其中MART-1被幾乎所有新鮮黑色素瘤標本表達,是最易被外周血淋巴細胞和腫瘤浸潤淋巴細胞所識別的黑色素瘤相關抗原[8-9]。MART-1是抗原性較強的跨膜蛋白,相對分子質量約為13~18×103,主要集中在高爾基復合體中,在黑色素體、內質網中亦可觀察到。其基因已被克隆由5個外顯子和4個內含子組成,啟動子包含233 bp組織特異性激活區,抗原的性質及呈遞MART-1的HLA分子已得到部分闡明[10-11],因而被認為是黑色素瘤特異性免疫治療的最佳候選者。
既往對于皮膚黑色素瘤的研究較多,而針對脈絡膜黑色素瘤的研究尚缺乏;兩者在臨床和基因上的差異需要我們積極尋找針對脈絡膜黑色素瘤的免疫治療[12]。MART-1引起的機體免疫反應可導致原發性皮膚黑色素瘤回退,腫瘤的回退與外周血MART-1特異性CTL的出現和MART-1陽性瘤細胞的減少相關[13]。令人鼓舞的是治療晚期皮膚黑色素瘤的免疫抑制劑伊匹單抗已經上市,并取得較好效果,明顯增加了皮膚黑色素瘤患者晚期CD45RO+CD8+的應答[14-15]。而對于脈絡膜黑色素瘤,目前還沒有明確的免疫治療試劑。部分原發性和轉移性脈絡膜黑色素瘤患者的外周血中可檢測到針對MART-1、gp100、酪氨酸酶的細胞和體液免疫反應[16]。
92-1、92-2細胞系由荷蘭萊頓大學醫學中心分離培養成功,其來源的脈絡膜黑色素瘤生長很快;HMB45抗原免疫組織化學染色陽性;腫瘤組織分型不明,其中有很多噬黑色素細胞[17]。Mel285細胞系由邁阿密大學眼科研究所分離成功,MART-1和HMB免疫組織化學染色陽性;腫瘤組織屬于混合型,20%是上皮細胞;Mel285的原發腫瘤MART-1陽性,而細胞系的MART-1陰性[18]。由于Mel285細胞系是從原發脈絡膜黑色素瘤的部分細胞簇里培養增生而來,不能代表原有腫瘤的所有特質[18];因此,關于Mel285細胞系中MART-1抗原的缺失是因為該細胞系在長期體外增生傳代過程中丟失了,還是細胞系來源的原發腫瘤部分就沒有表達這些抗原目前并不清楚。我們采用抗MART-1熒光抗體及流式細胞儀檢測了人脈絡膜黑色素細胞系92-1、92-2、Ocm3、Me1285的MART-1抗原表達,顯示92-1、92-2、Ocm3細胞系MART-1表達陽性,Me1285細胞系MART-1表達陰性。這提示MART-1抗原并非在所有的脈絡膜黑色素瘤細胞中都有表達。進一步采用Western blot分析這4個細胞系,以蛋白分子量確認MART-1的表達,顯示MART-1蛋白電泳帶在相對分子質量13×103左右。Me1285細胞系完全缺如此蛋白,另3種細胞系可見MART-1蛋白表達,與流式細胞儀分析結果一致。RT-PCR可觀察到92-1、92-2和Ocm3細胞系MART-1 mRNA轉錄,而Me1285細胞系無MART-1 mRNA轉錄。這證實了部分脈絡膜黑色素瘤細胞系轉錄并表達MART-1抗原。與本研究所得結果一致,van Dinten等[17]發現,MART-1陽性細胞系還表達Tyr、Dct、gp100等其他黑色素瘤相關抗原(MAA),而MART-1陰性細胞系同樣不表達其他MAA。4種細胞系均來源于原發性脈絡膜黑色素瘤,而非轉移性瘤。我們分析Mel285細胞系陰性表達MART-1的可能原因為,Mel285細胞系不攜帶92-1、92-2、OCM3細胞系均攜帶的GNAQ、GNA11基因突變,所以缺乏MART-1這類黑色素相關性細胞標志物。這些基因突變對于脈絡膜黑色素細胞早期的惡化很重要,可以使腫瘤細胞對抗腫瘤藥物更敏感[19]。
以往研究認為,黑色素瘤發病相關基因啟動子的甲基化狀態(甲基化、未甲基化、過甲基化)的改變與腫瘤細胞的生長和分化密切相關[20]。對脈絡膜黑色素瘤高度相關基因pRb、Wnt、TGF-β和p53的研究發現,pRb信號通路中p14ARF和p16(INK4A)啟動子的甲基化是這幾種基因通路檢測出的唯一突變[21-22]。所以認為基因位點甲基化改變在脈絡膜黑色素瘤中可能起重要作用。因此,我們檢測了4種細胞系MART-1啟動子的甲基化狀態。結果顯示,MART-1陽性細胞系92-1、92-2和Ocm3在MspⅠ/HpaⅡ位點甲基化,NruⅠ位點未甲基化,而是消化出786 bp的NruⅠ片斷。MART-1陰性細胞系Mel285在內含子NruⅠ位點顯示為過甲基化,MspⅠ/HpaⅡ位點未甲基化。這表明MART-1陽性和陰性細胞系有不同的甲基化模式,包括5’正向區域和內含子。提示甲基化模式在脈絡膜黑色素瘤MART-1轉錄的調控中起重要作用,甲基化的改變可下調MART-1的轉錄。但這種作用還需深入研究,包括去甲基化研究和染色質免疫沉淀實驗,以發現轉錄因子結合在甲基化區和非甲基化區的不同。
本研究只觀察到了啟動子甲基化的改變可能與MART-1表達相關,之后需要從基因水平改變MART-1啟動子甲基化狀態,從而明確二者是否存在調控的因果關系。今后研究需要納入更多細胞系,如原發性、轉移性脈絡膜黑色素瘤以及不同分型、不同階段的腫瘤細胞系,從而更為全面地研究MART-1表達變化及其可能的調控機制和基因突變。這對于增強MART-1的抗原性和誘導CTL應答都有更深遠的意義,甚至為脈絡膜黑色素瘤的特異性免疫治療提供依據。