引用本文: 劉玨君, 陳長征, 李璐, 易佐慧子, 鄭紅梅. 非動脈炎性前部缺血性視神經病變視盤及黃斑血流灌注變化的觀察. 中華眼底病雜志, 2019, 35(3): 219-225. doi: 10.3760/cma.j.issn.1005-1015.2019.03.002 復制
非動脈炎性缺血性視神經病變(NAION)是因供應視盤的睫狀后短動脈發生急性低灌注而導致的視神經損傷性疾病[1]。既往FFA、ICGA、彩色多普勒血流成像等檢查均證實NAION視盤血流灌注降低[1-2]。然而,這些檢查方法難以實現在長期隨訪過程中動態觀察血流灌注隨病程進展的變化。視神經損傷及血流灌注之間的相互影響、演變關系尚無定論,缺乏有效監測手段。OCT血管成像(OCTA)為無創血管成像技術,較傳統眼底血管造影能高分辨率地顯示視盤及黃斑區微血管分布情況并量化其血流灌注,在疾病隨訪應用中具有獨特優勢[3]。目前OCTA應用于NAION的觀察以視盤水腫消退后的橫斷面研究為主[4-7]。本研究利用OCTA動態觀察了一組NAION患眼視盤及黃斑區血流灌注在病程發展中的變化,為探索NAION血流灌注與視神經損傷的變化特點提供參考。現將結果報道如下。
1 對象和方法
回顧性隊列研究。2017年11月至2019年1月于武漢大學人民醫院眼科中心確診的NAION患者19例(NAION組)納入研究。參照文獻[8]標準確立本組患者的納入標準:(1)突發單眼無痛性視力下降或視物遮擋;(2)發病時視盤水腫;(3)與生理盲點相連的象限性視野缺損;(4)圖形VEP(P-VEP)以振幅下降為主;(5)FFA早期視盤局限性弱熒光或強熒光;(5)隨訪過程中視盤水腫消退;(6)實驗室紅細胞沉降率及C反應蛋白等檢查排除動脈炎性前部缺血性視神經病變可能,頭顱CT和(或)MRI檢查排除其他影響視功能或引起視盤水腫、視野缺損的眼部、全身或神經系統疾病。排除標準:青光眼、既往行眼內手術、激光光凝治療者;OCT及OCTA成像差影響數據分析者。
NAION組19例中,男性10例,女性9例;年齡45~70歲,平均年齡(55.05±7.11)歲;發病時間2~14 d,平均發病時間(5.84±3.84)d。均為單眼急性發病,其中對側眼既往有NAION發病史2例。將NION組的患眼、對側眼分別設為患眼組、對側眼組,分別為19、17只眼。選取年齡及性別匹配眼底檢查正常者20名40只眼作為正常對照組。其中,男性11名,女性9名;年齡46~66歲,平均年齡(56.10±5.51)歲。BCVA≥0.6。排除青光眼、高度近視、白內障等屈光間質差者以及既往有糖尿病病史或高血壓病史者。NAION組、正常對照組受檢者年齡(Z=-0.619)、性別構成比(χ2=0.022)比較,差異無統計學意義(P=0.550、0.882)。
患眼組、對側眼組均行BCVA、間接檢驗鏡、視野、P-VEP、眼底彩色照相(CFP)、FFA、頻域OCT(SD-OCT)及OCTA檢查;正常對照組受檢眼均行間接檢眼鏡、BCVA、SD-OCT、OCTA檢查。BCVA檢查采用國際標準視力表,以小數記錄并換算為logMAR視力。所有檢查由同一位經驗豐富的眼科醫師完成。
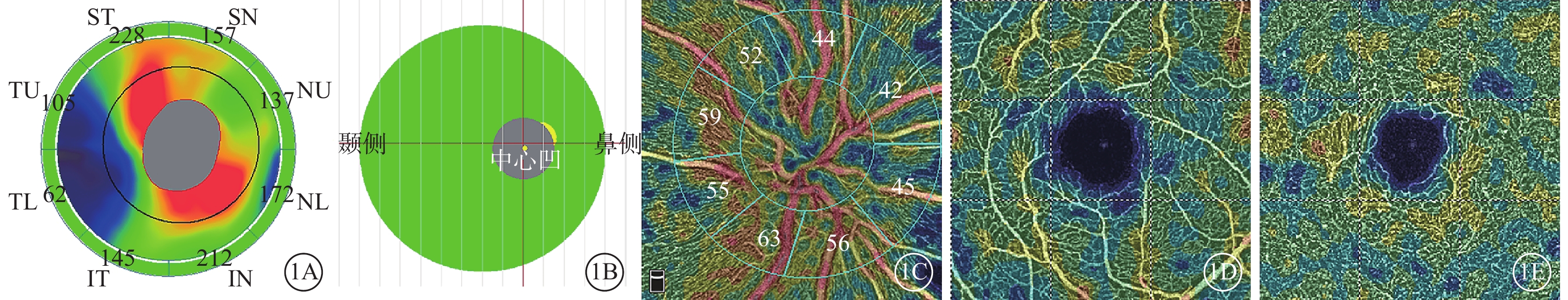
采用美國Optovue公司RTVue OCT(量化2.0)儀行SD-OCT、OCTA檢查。開啟眼球追蹤模式,按操作標準完成多次掃描[8]。圖像掃描質量≥7/10。SD-OCT光源波長840 nm,頻寬45 nm,軸向掃描頻率70 kHz。記錄視盤OCT-ONH模式的視盤周圍視網膜神經纖維層(RNFL)平均厚度及其上半側(s)、下半側(i)RNFL厚度(圖1A),黃斑OCT-GCC模式的平均神經節細胞復合體(GCC)厚度及其sGCC、iGCC厚度(圖1B)。OCTA利用分頻幅去相干血管成像算法。掃描范圍:視盤4.5 mm×4.5 mm,黃斑中心凹為中心3 mm×3 mm。單次OCTA圖像采集包含1次水平掃描疊加1次垂直掃描,包含304或400次B掃描、304×304或400×400次A掃描;耗時3.0~4.5 s[9]。在HD Angio Disc 4.5 mm×4.5 mm模式下,記錄九宮格分區法中全視盤平均血流密度(RPC)(圖1C),Garway-Heath分區法中sRPC、iRPC(圖1C)。Angio Retina 3 mm×3 mm模式下,記錄黃斑區淺層視網膜平均血流密度(SVD)及sSVD、iSVD(圖1D),深層視網膜平均血流密度(DVD)(圖1E),平均黃斑中心凹無血管區面積(FAZ)。采用軟件默認分層,淺層視網膜上邊界為內界膜,下邊界為內叢狀層(IPL)上10 μm;深層視網膜上邊界為IPL上10 μm,下邊界為外叢狀層下10 μm。
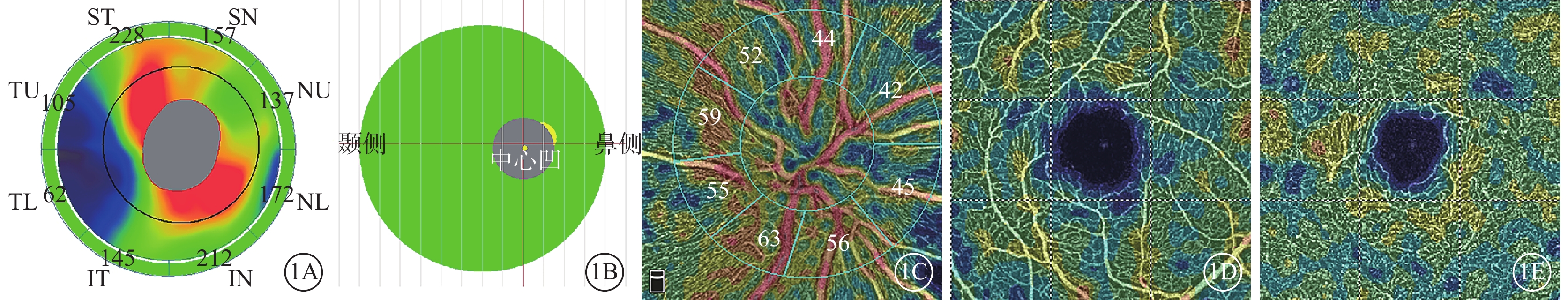 圖1
基線時視盤、黃斑區OCT及OCTA像。1A示視盤RNFL測量示意圖,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;圖中數據為RNFL測量值,平均RNFL 152 μm。1B示黃斑GCC測量示意圖,平均GCC 102 μm;1C示視盤RPC測量示意圖,圖中數據為RPC測量值,平均RPC 49.4%;1D示SVD測量示意圖,平均SVD 44.4%;1E示DVD測量示意圖,平均DVD 46.1%
圖1
基線時視盤、黃斑區OCT及OCTA像。1A示視盤RNFL測量示意圖,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;圖中數據為RNFL測量值,平均RNFL 152 μm。1B示黃斑GCC測量示意圖,平均GCC 102 μm;1C示視盤RPC測量示意圖,圖中數據為RPC測量值,平均RPC 49.4%;1D示SVD測量示意圖,平均SVD 44.4%;1E示DVD測量示意圖,平均DVD 46.1%
參照我國NAION診斷和治療專家共識(2015年)[10],所有NAION患者均行口服醋酸潑尼松及改善循環營養神經藥物治療。19例患者中,治療后隨訪1~2、3~5個月分別為19、11例。治療后1~2周,1~2個月,3~5個月采用與治療前相同設備和方法行BCVA、CFP、SD-OCT、OCTA檢查。
采用SPSS 23.0軟件行統計學分析。計量資料以均數±標準差( ±s)表示,正態分布采用Kolmogorov Smirnov檢驗。患眼組、對側眼組、正常眼組之間比較行獨立樣本t檢驗、配對樣本t檢驗或兩獨立樣本非參數秩和檢驗。患眼組基線時、1~2周、1~2個月、3~5個之間比較,采用單因素重復方差分析或多個獨立樣本的非參數秩和檢驗后的兩兩分析。采用Pearson法或Spearman法行RNFL與RPC、GCC與SVD、RNFL與GCC、RPC與SVD的相關性分析。P<0.05為差異有統計學意義。
±s)表示,正態分布采用Kolmogorov Smirnov檢驗。患眼組、對側眼組、正常眼組之間比較行獨立樣本t檢驗、配對樣本t檢驗或兩獨立樣本非參數秩和檢驗。患眼組基線時、1~2周、1~2個月、3~5個之間比較,采用單因素重復方差分析或多個獨立樣本的非參數秩和檢驗后的兩兩分析。采用Pearson法或Spearman法行RNFL與RPC、GCC與SVD、RNFL與GCC、RPC與SVD的相關性分析。P<0.05為差異有統計學意義。
2 結果
基線時,患眼組、對側眼組、正常對照組平均logMAR BCVA分別為0.336±0.163、0.166±0.163、0.094±0.086。與正常對照組、對側眼組比較,患眼組平均RNFL增厚(Z=?6.168、?5.098,P=0.000、0.000),平均RPC(Z=?5.112、?4.152,P=0.000、0.000)、DVD(Z=?3.457、?1.316,P=0.001、0.196)顯著降低;對側眼組RNFL、RPC與正常對照組比較,差異均無統計學意義(P=0.479、0.972)。三組間GCC(Z=?1.440、?0.875、?1.621,P=0.150、0.381、0.107)、SVD(Z=?0.389、?1.475、?1.015,P=0.697、0.140、0.315)、FAZ(Z=?1.136、?0.323、?0.983,P=0.256、0.747、0.330)比較差異均無統計學意義;對側眼組與正常對照組比較,平均DVD顯著降低(Z=?2.382,P=0.017)(表1)。患眼組平均sRNFL、iRNFL分別(184.74±23.29)、(171.89±19.44)μm,差異有統計學意義(t=2.389,P=0.028);sRPC、iRPC分別為(46.66±3.55)、(48.14±5.78)%,差異有統計學意義(t=?1.067,P=0.030);sGCC、iGCC分別為(101.74±6.53)、(104.58±7.55)μm,sSVD、iSVD分別為(46.12±2.06)、(45.63±2.19)%,差異均無統計學意義(t=?2.317、1.736,P=0.032、0.100)。
 ±s)
±s)
治療后1~2周以及1~2、3~5個月,患眼組視盤平均DVD分別為(45.38±3.87)、(47.05±2.37)、(47.23±3.49)%,平均FAZ分別為(0.359±0.084)、(0.383±0.081)、(0.403±0.123)mm2。與基線時比較,治療后不同時間視盤平均DVD、FAZ差異均無統計學意義(H=5.140,2.381,P=0.162、0.497);平均RNFL、RPC、GCC、SVD差異均有統計學意義(P<0.05)(圖2,3;表2)。兩兩比較:平均RNFL,基線與1~2、3~5個月(P=0.000、0.000),1~2周與1~2、3~5個月(P=0.019、0.000)差異有統計學意義。平均RPC,基線與1~2、3~5個月(P=0.001、0.000),1~2周與3~5個月(P=0.001、0.000)差異有統計學意義。平均GCC厚度,基線與1~2、3~5個月(P=0.000、0.000),1~2周與1~2、3~5個月(P=0.000、0.000)差異有統計學意義。平均SVD,基線與1~2、3~5個月(P=0.000、0.000),1~2周與3~5個月(P=0.002)差異有統計學意義。
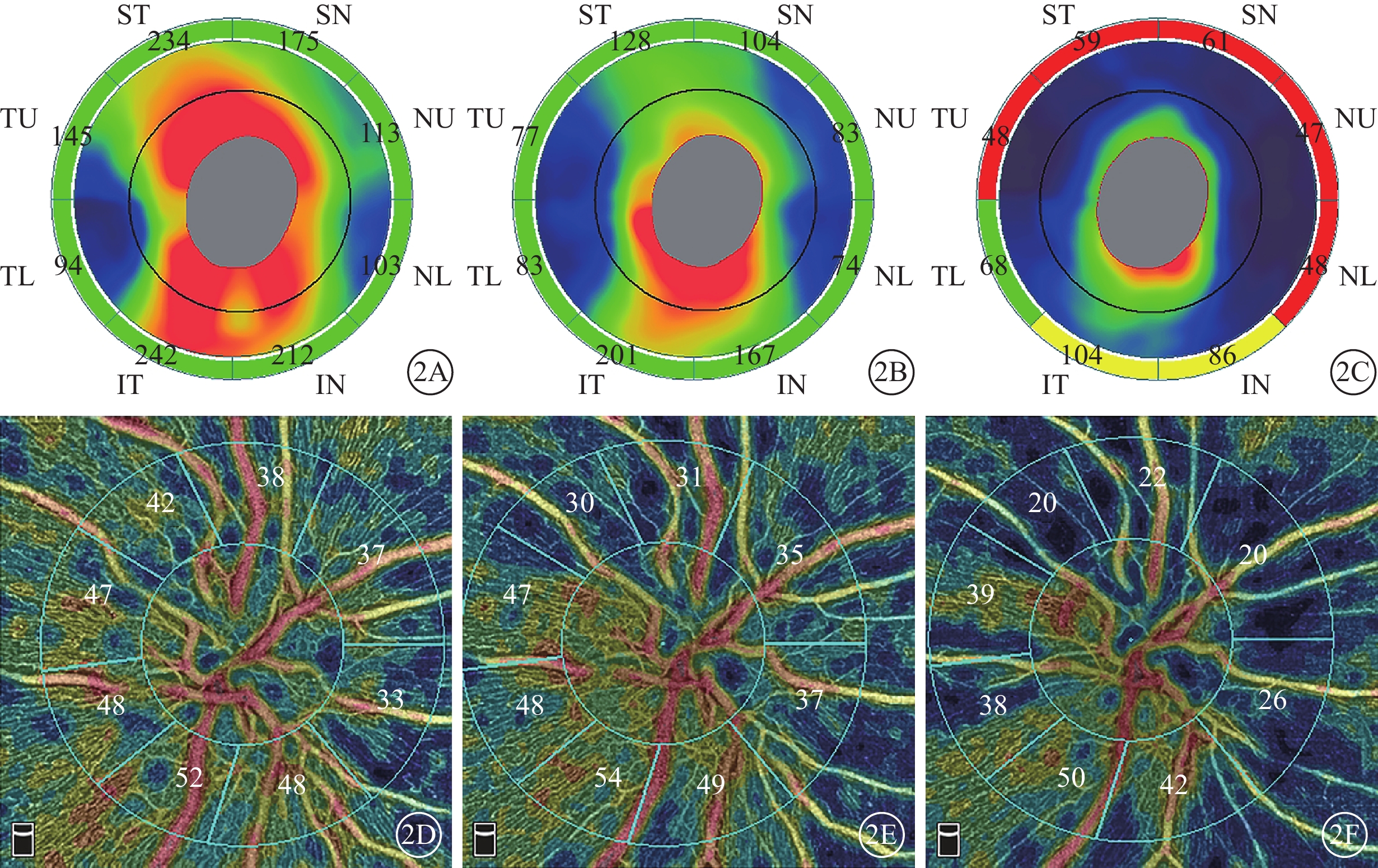 圖2
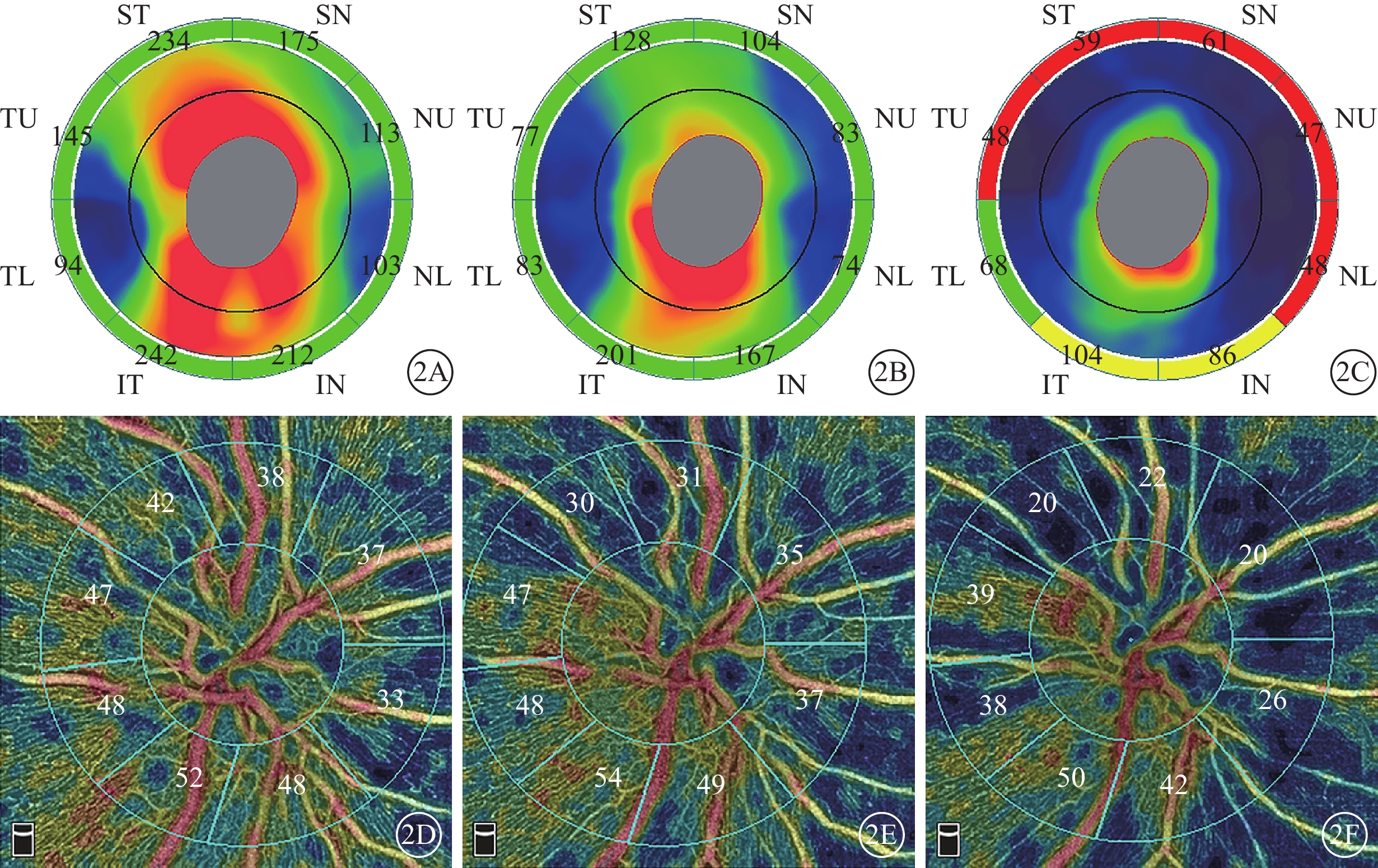
圖1同眼治療后視盤OCT、OCTA像。2A~2C示視盤OCT像,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;治療后1~2周和1~2、3~5個月視盤平均RNFL厚度逐漸下降,分別為165、115、65 μm。2D~2F示視盤OCTA像,治療后1~2周和1~2、3~5個月時視盤平均RPC下降,分別為43.00%、40.00%、34.00%。圖中數據為測量值
圖2
圖1同眼治療后視盤OCT、OCTA像。2A~2C示視盤OCT像,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;治療后1~2周和1~2、3~5個月視盤平均RNFL厚度逐漸下降,分別為165、115、65 μm。2D~2F示視盤OCTA像,治療后1~2周和1~2、3~5個月時視盤平均RPC下降,分別為43.00%、40.00%、34.00%。圖中數據為測量值
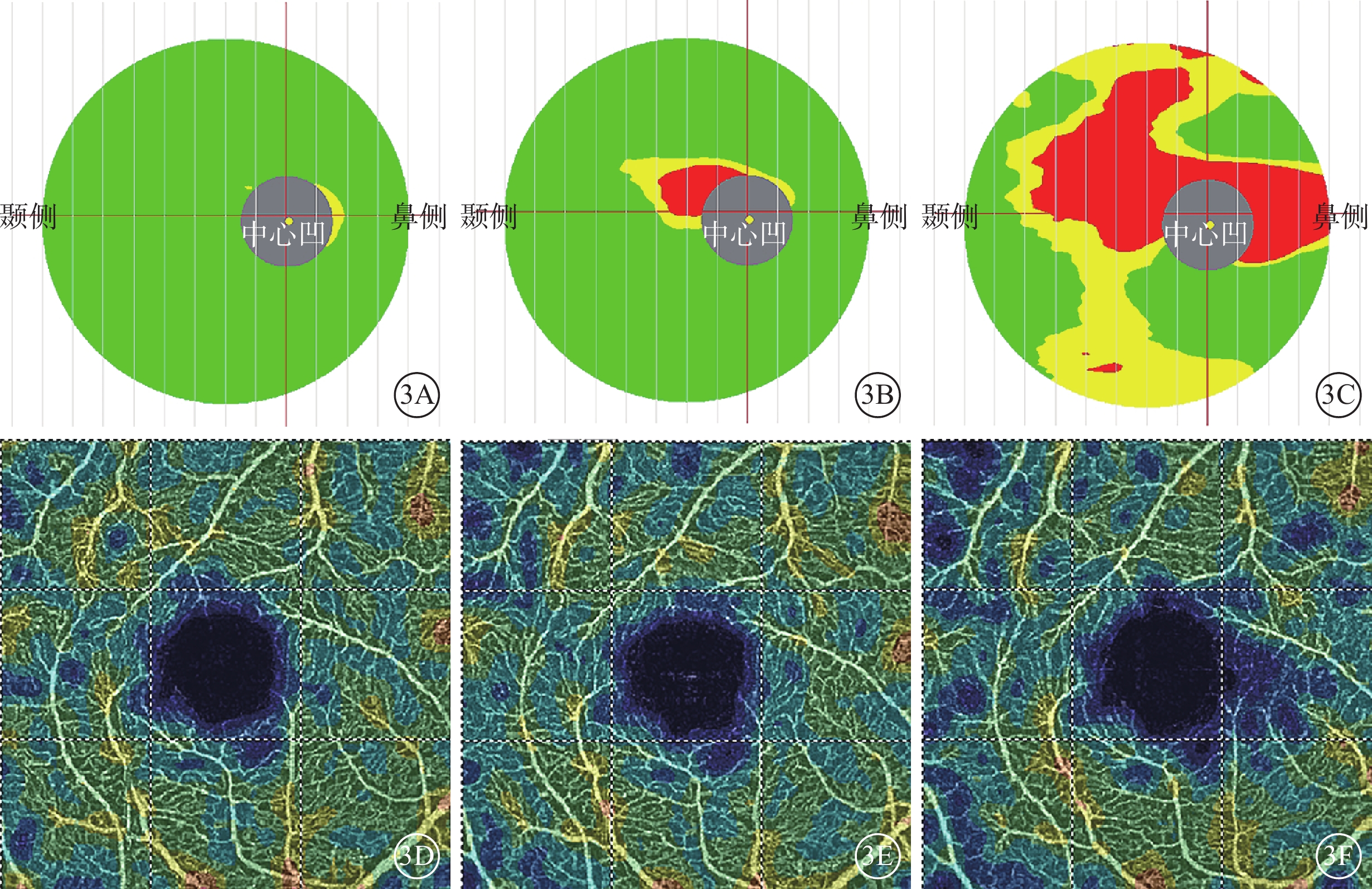 圖3
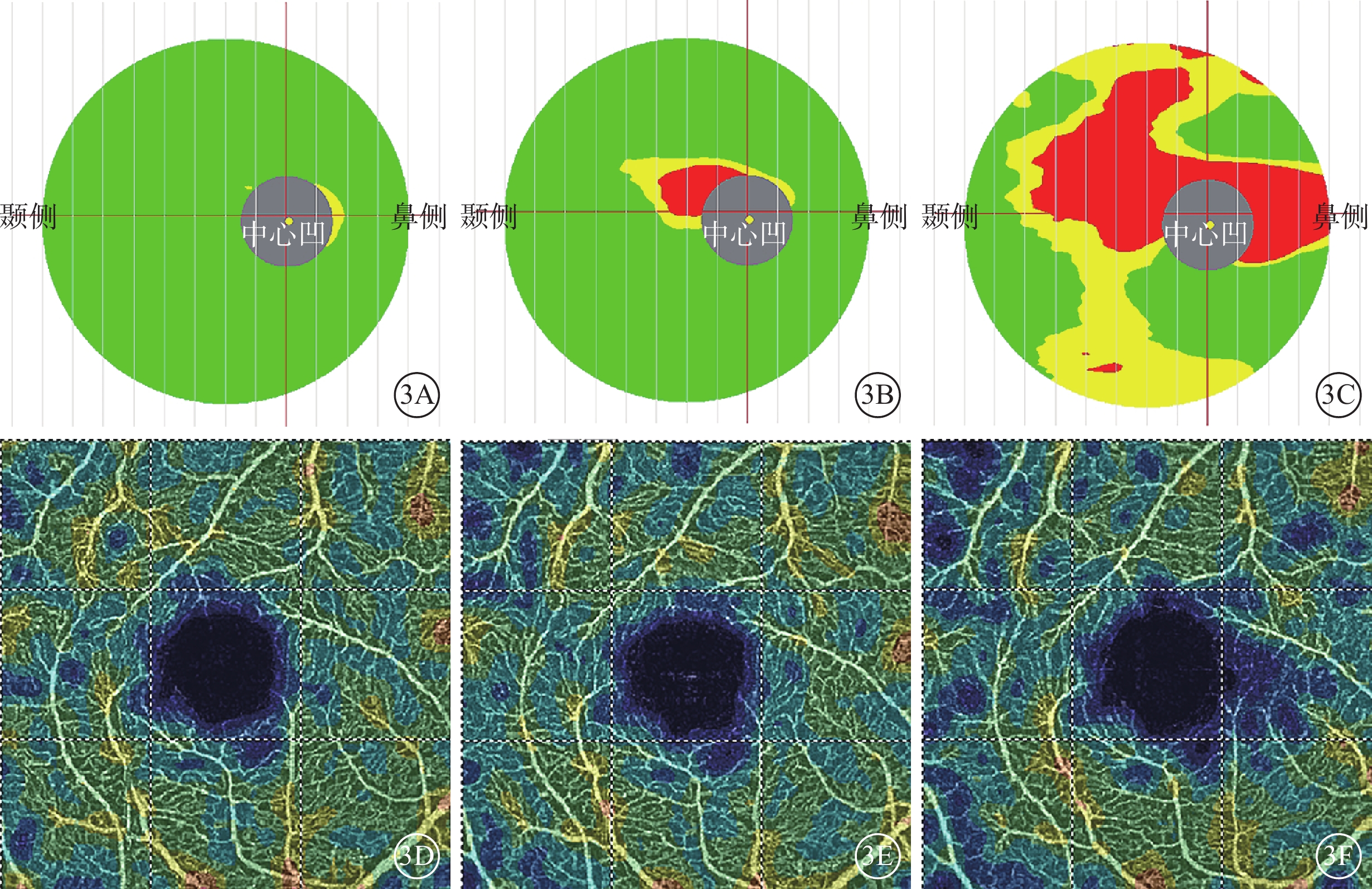
圖1同眼治療后黃斑OCT、OCTA像。3A~3C示黃斑OCT像,治療后1~2周和1~2、3~5個月黃斑平均GCC厚度逐漸下降,分別為99、94、77 μm;3D~3F示黃斑OCTA像,治療后1~2周和1~2、3~5個月時黃斑平均SVD下降,分別為44.10%、42.70%、39.80%
圖3
圖1同眼治療后黃斑OCT、OCTA像。3A~3C示黃斑OCT像,治療后1~2周和1~2、3~5個月黃斑平均GCC厚度逐漸下降,分別為99、94、77 μm;3D~3F示黃斑OCTA像,治療后1~2周和1~2、3~5個月時黃斑平均SVD下降,分別為44.10%、42.70%、39.80%
 ±s)
±s)
患眼組治療后1~2周,平均sGCC較iGCC顯著減低,差異有統計學意義(P<0.05);1~2個月,平均sRNFL較iRNFL、sRPC較iRPC、sGCC較iGCC、sSVD較iSVD顯著減低,差異有統計學意義(P<0.05);3~5個月,平均sRNFL較iRNFL、sRPC較iRPC、sGCC較iGCC顯著減低,差異有統計學意義(P<0.005)(表3,4)。
 ±s)
±s)
 ±s)
±s)
相關性分析結果顯示,治療后1~2周,平均GCC厚度與平均RNFL厚度顯著相關(r=0.715,P=0.001);1~2個月,平均GCC厚度與平均RNFL厚度、SVD顯著相關(r=0.743、0.482,P=0.000、0.037);3~5個月,平均RNFL厚度與平均RPC顯著相關(r=0.631,P=0.037)。
3 討論
OCTA能高敏感檢測微血管分布情況,可為評估缺血性疾病的發生發展提供一定的依據[3, 7],目前在青光眼及視神經炎、Leber遺傳性視神經病變、缺血性視神經病變等神經眼科的臨床研究中日益受到關注[7]。
由于視盤水腫時患眼OCTA成像難以獲取以及潛在的偽跡影響,既往NAION的OCTA觀察主要以視盤水腫消退期(<3個月)或視神經萎縮期(>3個月)為主[4-6]。2017年Sharma等[11]首次應用OCTA觀察急性期NAION患眼,發現視盤血管及視盤周圍放射狀毛細血管均減少。本研究結果顯示,患眼組在基線及病程1~2周時平均RPC較對側眼組及正常對照組均顯著降低,與其他研究結果一致[11-13]。提示急性期RPC減少可能較RNFL變薄更早反應病情進展。NAION視盤RPC減少可能與視盤水腫的機械壓迫對血流的阻力有關,也可能與原發的睫狀動脈缺血機制有關[13-14]。Fard等[13]應用OCTA觀察視盤周圍平均RPC減少的特點,以鑒別NAION與視神經炎的視盤水腫,其靈敏度及特異性分別為82%、89%。提示OCTA可能有助于鑒別視神經節段性缺血性損傷和視神經軸索脫髓鞘損傷。
楊沫等[4]研究發現,平均病程39 d的NAION患眼RPC呈彌漫性減少。本研究結果顯示,患眼組平均RPC在治療后1~2個月時較基線水平顯著下降,且sRPC顯著低于iRPC,差異持續至治療后3~5個月,與RNFL減少特征大致對應。由此推測,NAION患眼隨視盤水腫消退,RPC呈象限性減少。分析其差異的原因可能與本研究視盤RPC計算范圍更大、糖皮質激素治療加快視盤水腫消退、病例納入一致性更高有關。本研究中患眼組治療后3~5個月時平均RPC減少與平均RNFL變薄呈強相關性,與既往研究結果一致[5-6]。此外,有研究結果顯示,正常人、高血壓及青光眼患者RPC均與RNFL厚度呈正相關[7, 15-16]。提示在NAION發生發展過程中視神經結構損傷與其血流灌注降低可能相互影響。
既往研究顯示,NAION患眼黃斑區GCC改變可獨立于視盤RNFL水腫反應RGC早期損傷,后期GCC萎縮與視野缺損的相關性也較視盤RNFL萎縮更強[17-18]。但GCC變薄的發生機制尚不清楚,推測可能與其血流灌注降低有關[16, 19-20]。本研究結果顯示,基線時患眼組平均SVD與對側眼及正常對照組差異均無統計學意義,而在治療后1~2、3~5個月患眼組平均SVD較基線水平均顯著降低,提示平均SVD隨病程進展而降低。Augstburger等[6]、Wang等[21]發現NAION患眼病程>3個月時,黃斑旁中心凹以外的血流密度較旁中心凹下降更顯著。由此,我們推測NAION患眼黃斑區視網膜血流密度降低由外周向中心凹發展,可能與視盤缺血有關。
本研究結果顯示,患眼組治療后1~2個月時sRPC、sSVD均顯著低于iRPC、iSVD,與RNFL及GCC結構損傷特點、NAION下方視野更高喪失率表現一致[22]。相關性分析發現,其aSVD與aGCC具有顯著相關性,與Yu等[19]、Lim等[16]觀察到的正常人及高血壓患者結果相似。提示SVD降低可能與視網膜神經纖維損傷有關,sSVD減少可能繼發于萎縮的GCC血氧消耗降低[6, 17, 23]。而血流改變是否先于結構變化之前,尚需更大樣本及視網膜各分區的早期血流變化數據進一步研究探討[12]。此外,本研究基線時患眼組及對側眼組平均DVD均較正常對照組顯著降低,與Wang等[21]研究結果相似。分析其原因可能與NAION患者多伴有高血壓、夜間低血壓、糖尿病等其他血管性危險因素有關[24-25],可能存在臨床前期的黃斑區微循環異常或RGC損傷[16-17, 20, 26]。而患眼組末次隨訪時平均DVD無顯著變化,分析可能與GCC變薄時增強了深層視網膜成像清晰度及OCTA成像范圍較小等有關,需更大樣本量數據進一步驗證。
本研究尚存在以下不足:(1)本研究為回顧性病例分析,納入觀察的病例數少,部分患者3~5個月隨訪數據缺失;(2)發病初期視盤OCTA定位及RPC值受視盤水腫影響;(3)視盤及黃斑區OCTA成像范圍較小,但成像范圍增加將伴隨圖像分辨率降低及分層誤差增加;(4)OCT及OCTA觀察指標未行顳側、鼻側等亞組分析;未對脈絡膜層面、篩板水平的血流灌注狀態進行分析;(5)視功能評價指標單一,未能完全反應其預后情況。未來還需進行更大樣本的前瞻性隨訪研究,細化隨訪時間間隔,繼續深入探討OCTA在NAION病理機制探索、預測病情轉歸等方面的應用價值。
非動脈炎性缺血性視神經病變(NAION)是因供應視盤的睫狀后短動脈發生急性低灌注而導致的視神經損傷性疾病[1]。既往FFA、ICGA、彩色多普勒血流成像等檢查均證實NAION視盤血流灌注降低[1-2]。然而,這些檢查方法難以實現在長期隨訪過程中動態觀察血流灌注隨病程進展的變化。視神經損傷及血流灌注之間的相互影響、演變關系尚無定論,缺乏有效監測手段。OCT血管成像(OCTA)為無創血管成像技術,較傳統眼底血管造影能高分辨率地顯示視盤及黃斑區微血管分布情況并量化其血流灌注,在疾病隨訪應用中具有獨特優勢[3]。目前OCTA應用于NAION的觀察以視盤水腫消退后的橫斷面研究為主[4-7]。本研究利用OCTA動態觀察了一組NAION患眼視盤及黃斑區血流灌注在病程發展中的變化,為探索NAION血流灌注與視神經損傷的變化特點提供參考。現將結果報道如下。
1 對象和方法
回顧性隊列研究。2017年11月至2019年1月于武漢大學人民醫院眼科中心確診的NAION患者19例(NAION組)納入研究。參照文獻[8]標準確立本組患者的納入標準:(1)突發單眼無痛性視力下降或視物遮擋;(2)發病時視盤水腫;(3)與生理盲點相連的象限性視野缺損;(4)圖形VEP(P-VEP)以振幅下降為主;(5)FFA早期視盤局限性弱熒光或強熒光;(5)隨訪過程中視盤水腫消退;(6)實驗室紅細胞沉降率及C反應蛋白等檢查排除動脈炎性前部缺血性視神經病變可能,頭顱CT和(或)MRI檢查排除其他影響視功能或引起視盤水腫、視野缺損的眼部、全身或神經系統疾病。排除標準:青光眼、既往行眼內手術、激光光凝治療者;OCT及OCTA成像差影響數據分析者。
NAION組19例中,男性10例,女性9例;年齡45~70歲,平均年齡(55.05±7.11)歲;發病時間2~14 d,平均發病時間(5.84±3.84)d。均為單眼急性發病,其中對側眼既往有NAION發病史2例。將NION組的患眼、對側眼分別設為患眼組、對側眼組,分別為19、17只眼。選取年齡及性別匹配眼底檢查正常者20名40只眼作為正常對照組。其中,男性11名,女性9名;年齡46~66歲,平均年齡(56.10±5.51)歲。BCVA≥0.6。排除青光眼、高度近視、白內障等屈光間質差者以及既往有糖尿病病史或高血壓病史者。NAION組、正常對照組受檢者年齡(Z=-0.619)、性別構成比(χ2=0.022)比較,差異無統計學意義(P=0.550、0.882)。
患眼組、對側眼組均行BCVA、間接檢驗鏡、視野、P-VEP、眼底彩色照相(CFP)、FFA、頻域OCT(SD-OCT)及OCTA檢查;正常對照組受檢眼均行間接檢眼鏡、BCVA、SD-OCT、OCTA檢查。BCVA檢查采用國際標準視力表,以小數記錄并換算為logMAR視力。所有檢查由同一位經驗豐富的眼科醫師完成。
采用美國Optovue公司RTVue OCT(量化2.0)儀行SD-OCT、OCTA檢查。開啟眼球追蹤模式,按操作標準完成多次掃描[8]。圖像掃描質量≥7/10。SD-OCT光源波長840 nm,頻寬45 nm,軸向掃描頻率70 kHz。記錄視盤OCT-ONH模式的視盤周圍視網膜神經纖維層(RNFL)平均厚度及其上半側(s)、下半側(i)RNFL厚度(圖1A),黃斑OCT-GCC模式的平均神經節細胞復合體(GCC)厚度及其sGCC、iGCC厚度(圖1B)。OCTA利用分頻幅去相干血管成像算法。掃描范圍:視盤4.5 mm×4.5 mm,黃斑中心凹為中心3 mm×3 mm。單次OCTA圖像采集包含1次水平掃描疊加1次垂直掃描,包含304或400次B掃描、304×304或400×400次A掃描;耗時3.0~4.5 s[9]。在HD Angio Disc 4.5 mm×4.5 mm模式下,記錄九宮格分區法中全視盤平均血流密度(RPC)(圖1C),Garway-Heath分區法中sRPC、iRPC(圖1C)。Angio Retina 3 mm×3 mm模式下,記錄黃斑區淺層視網膜平均血流密度(SVD)及sSVD、iSVD(圖1D),深層視網膜平均血流密度(DVD)(圖1E),平均黃斑中心凹無血管區面積(FAZ)。采用軟件默認分層,淺層視網膜上邊界為內界膜,下邊界為內叢狀層(IPL)上10 μm;深層視網膜上邊界為IPL上10 μm,下邊界為外叢狀層下10 μm。
 圖1
基線時視盤、黃斑區OCT及OCTA像。1A示視盤RNFL測量示意圖,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;圖中數據為RNFL測量值,平均RNFL 152 μm。1B示黃斑GCC測量示意圖,平均GCC 102 μm;1C示視盤RPC測量示意圖,圖中數據為RPC測量值,平均RPC 49.4%;1D示SVD測量示意圖,平均SVD 44.4%;1E示DVD測量示意圖,平均DVD 46.1%
圖1
基線時視盤、黃斑區OCT及OCTA像。1A示視盤RNFL測量示意圖,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;圖中數據為RNFL測量值,平均RNFL 152 μm。1B示黃斑GCC測量示意圖,平均GCC 102 μm;1C示視盤RPC測量示意圖,圖中數據為RPC測量值,平均RPC 49.4%;1D示SVD測量示意圖,平均SVD 44.4%;1E示DVD測量示意圖,平均DVD 46.1%
參照我國NAION診斷和治療專家共識(2015年)[10],所有NAION患者均行口服醋酸潑尼松及改善循環營養神經藥物治療。19例患者中,治療后隨訪1~2、3~5個月分別為19、11例。治療后1~2周,1~2個月,3~5個月采用與治療前相同設備和方法行BCVA、CFP、SD-OCT、OCTA檢查。
采用SPSS 23.0軟件行統計學分析。計量資料以均數±標準差( ±s)表示,正態分布采用Kolmogorov Smirnov檢驗。患眼組、對側眼組、正常眼組之間比較行獨立樣本t檢驗、配對樣本t檢驗或兩獨立樣本非參數秩和檢驗。患眼組基線時、1~2周、1~2個月、3~5個之間比較,采用單因素重復方差分析或多個獨立樣本的非參數秩和檢驗后的兩兩分析。采用Pearson法或Spearman法行RNFL與RPC、GCC與SVD、RNFL與GCC、RPC與SVD的相關性分析。P<0.05為差異有統計學意義。
±s)表示,正態分布采用Kolmogorov Smirnov檢驗。患眼組、對側眼組、正常眼組之間比較行獨立樣本t檢驗、配對樣本t檢驗或兩獨立樣本非參數秩和檢驗。患眼組基線時、1~2周、1~2個月、3~5個之間比較,采用單因素重復方差分析或多個獨立樣本的非參數秩和檢驗后的兩兩分析。采用Pearson法或Spearman法行RNFL與RPC、GCC與SVD、RNFL與GCC、RPC與SVD的相關性分析。P<0.05為差異有統計學意義。
2 結果
基線時,患眼組、對側眼組、正常對照組平均logMAR BCVA分別為0.336±0.163、0.166±0.163、0.094±0.086。與正常對照組、對側眼組比較,患眼組平均RNFL增厚(Z=?6.168、?5.098,P=0.000、0.000),平均RPC(Z=?5.112、?4.152,P=0.000、0.000)、DVD(Z=?3.457、?1.316,P=0.001、0.196)顯著降低;對側眼組RNFL、RPC與正常對照組比較,差異均無統計學意義(P=0.479、0.972)。三組間GCC(Z=?1.440、?0.875、?1.621,P=0.150、0.381、0.107)、SVD(Z=?0.389、?1.475、?1.015,P=0.697、0.140、0.315)、FAZ(Z=?1.136、?0.323、?0.983,P=0.256、0.747、0.330)比較差異均無統計學意義;對側眼組與正常對照組比較,平均DVD顯著降低(Z=?2.382,P=0.017)(表1)。患眼組平均sRNFL、iRNFL分別(184.74±23.29)、(171.89±19.44)μm,差異有統計學意義(t=2.389,P=0.028);sRPC、iRPC分別為(46.66±3.55)、(48.14±5.78)%,差異有統計學意義(t=?1.067,P=0.030);sGCC、iGCC分別為(101.74±6.53)、(104.58±7.55)μm,sSVD、iSVD分別為(46.12±2.06)、(45.63±2.19)%,差異均無統計學意義(t=?2.317、1.736,P=0.032、0.100)。
 ±s)
±s)
治療后1~2周以及1~2、3~5個月,患眼組視盤平均DVD分別為(45.38±3.87)、(47.05±2.37)、(47.23±3.49)%,平均FAZ分別為(0.359±0.084)、(0.383±0.081)、(0.403±0.123)mm2。與基線時比較,治療后不同時間視盤平均DVD、FAZ差異均無統計學意義(H=5.140,2.381,P=0.162、0.497);平均RNFL、RPC、GCC、SVD差異均有統計學意義(P<0.05)(圖2,3;表2)。兩兩比較:平均RNFL,基線與1~2、3~5個月(P=0.000、0.000),1~2周與1~2、3~5個月(P=0.019、0.000)差異有統計學意義。平均RPC,基線與1~2、3~5個月(P=0.001、0.000),1~2周與3~5個月(P=0.001、0.000)差異有統計學意義。平均GCC厚度,基線與1~2、3~5個月(P=0.000、0.000),1~2周與1~2、3~5個月(P=0.000、0.000)差異有統計學意義。平均SVD,基線與1~2、3~5個月(P=0.000、0.000),1~2周與3~5個月(P=0.002)差異有統計學意義。
 圖2
圖1同眼治療后視盤OCT、OCTA像。2A~2C示視盤OCT像,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;治療后1~2周和1~2、3~5個月視盤平均RNFL厚度逐漸下降,分別為165、115、65 μm。2D~2F示視盤OCTA像,治療后1~2周和1~2、3~5個月時視盤平均RPC下降,分別為43.00%、40.00%、34.00%。圖中數據為測量值
圖2
圖1同眼治療后視盤OCT、OCTA像。2A~2C示視盤OCT像,ST:上方顳側,TU:顳上方,TL:顳下方,IT:下方顳側,IN:下方鼻側,NL:鼻下方,NU:鼻上方,SN:上方鼻側;治療后1~2周和1~2、3~5個月視盤平均RNFL厚度逐漸下降,分別為165、115、65 μm。2D~2F示視盤OCTA像,治療后1~2周和1~2、3~5個月時視盤平均RPC下降,分別為43.00%、40.00%、34.00%。圖中數據為測量值
 圖3
圖1同眼治療后黃斑OCT、OCTA像。3A~3C示黃斑OCT像,治療后1~2周和1~2、3~5個月黃斑平均GCC厚度逐漸下降,分別為99、94、77 μm;3D~3F示黃斑OCTA像,治療后1~2周和1~2、3~5個月時黃斑平均SVD下降,分別為44.10%、42.70%、39.80%
圖3
圖1同眼治療后黃斑OCT、OCTA像。3A~3C示黃斑OCT像,治療后1~2周和1~2、3~5個月黃斑平均GCC厚度逐漸下降,分別為99、94、77 μm;3D~3F示黃斑OCTA像,治療后1~2周和1~2、3~5個月時黃斑平均SVD下降,分別為44.10%、42.70%、39.80%
 ±s)
±s)
患眼組治療后1~2周,平均sGCC較iGCC顯著減低,差異有統計學意義(P<0.05);1~2個月,平均sRNFL較iRNFL、sRPC較iRPC、sGCC較iGCC、sSVD較iSVD顯著減低,差異有統計學意義(P<0.05);3~5個月,平均sRNFL較iRNFL、sRPC較iRPC、sGCC較iGCC顯著減低,差異有統計學意義(P<0.005)(表3,4)。
 ±s)
±s)
 ±s)
±s)
相關性分析結果顯示,治療后1~2周,平均GCC厚度與平均RNFL厚度顯著相關(r=0.715,P=0.001);1~2個月,平均GCC厚度與平均RNFL厚度、SVD顯著相關(r=0.743、0.482,P=0.000、0.037);3~5個月,平均RNFL厚度與平均RPC顯著相關(r=0.631,P=0.037)。
3 討論
OCTA能高敏感檢測微血管分布情況,可為評估缺血性疾病的發生發展提供一定的依據[3, 7],目前在青光眼及視神經炎、Leber遺傳性視神經病變、缺血性視神經病變等神經眼科的臨床研究中日益受到關注[7]。
由于視盤水腫時患眼OCTA成像難以獲取以及潛在的偽跡影響,既往NAION的OCTA觀察主要以視盤水腫消退期(<3個月)或視神經萎縮期(>3個月)為主[4-6]。2017年Sharma等[11]首次應用OCTA觀察急性期NAION患眼,發現視盤血管及視盤周圍放射狀毛細血管均減少。本研究結果顯示,患眼組在基線及病程1~2周時平均RPC較對側眼組及正常對照組均顯著降低,與其他研究結果一致[11-13]。提示急性期RPC減少可能較RNFL變薄更早反應病情進展。NAION視盤RPC減少可能與視盤水腫的機械壓迫對血流的阻力有關,也可能與原發的睫狀動脈缺血機制有關[13-14]。Fard等[13]應用OCTA觀察視盤周圍平均RPC減少的特點,以鑒別NAION與視神經炎的視盤水腫,其靈敏度及特異性分別為82%、89%。提示OCTA可能有助于鑒別視神經節段性缺血性損傷和視神經軸索脫髓鞘損傷。
楊沫等[4]研究發現,平均病程39 d的NAION患眼RPC呈彌漫性減少。本研究結果顯示,患眼組平均RPC在治療后1~2個月時較基線水平顯著下降,且sRPC顯著低于iRPC,差異持續至治療后3~5個月,與RNFL減少特征大致對應。由此推測,NAION患眼隨視盤水腫消退,RPC呈象限性減少。分析其差異的原因可能與本研究視盤RPC計算范圍更大、糖皮質激素治療加快視盤水腫消退、病例納入一致性更高有關。本研究中患眼組治療后3~5個月時平均RPC減少與平均RNFL變薄呈強相關性,與既往研究結果一致[5-6]。此外,有研究結果顯示,正常人、高血壓及青光眼患者RPC均與RNFL厚度呈正相關[7, 15-16]。提示在NAION發生發展過程中視神經結構損傷與其血流灌注降低可能相互影響。
既往研究顯示,NAION患眼黃斑區GCC改變可獨立于視盤RNFL水腫反應RGC早期損傷,后期GCC萎縮與視野缺損的相關性也較視盤RNFL萎縮更強[17-18]。但GCC變薄的發生機制尚不清楚,推測可能與其血流灌注降低有關[16, 19-20]。本研究結果顯示,基線時患眼組平均SVD與對側眼及正常對照組差異均無統計學意義,而在治療后1~2、3~5個月患眼組平均SVD較基線水平均顯著降低,提示平均SVD隨病程進展而降低。Augstburger等[6]、Wang等[21]發現NAION患眼病程>3個月時,黃斑旁中心凹以外的血流密度較旁中心凹下降更顯著。由此,我們推測NAION患眼黃斑區視網膜血流密度降低由外周向中心凹發展,可能與視盤缺血有關。
本研究結果顯示,患眼組治療后1~2個月時sRPC、sSVD均顯著低于iRPC、iSVD,與RNFL及GCC結構損傷特點、NAION下方視野更高喪失率表現一致[22]。相關性分析發現,其aSVD與aGCC具有顯著相關性,與Yu等[19]、Lim等[16]觀察到的正常人及高血壓患者結果相似。提示SVD降低可能與視網膜神經纖維損傷有關,sSVD減少可能繼發于萎縮的GCC血氧消耗降低[6, 17, 23]。而血流改變是否先于結構變化之前,尚需更大樣本及視網膜各分區的早期血流變化數據進一步研究探討[12]。此外,本研究基線時患眼組及對側眼組平均DVD均較正常對照組顯著降低,與Wang等[21]研究結果相似。分析其原因可能與NAION患者多伴有高血壓、夜間低血壓、糖尿病等其他血管性危險因素有關[24-25],可能存在臨床前期的黃斑區微循環異常或RGC損傷[16-17, 20, 26]。而患眼組末次隨訪時平均DVD無顯著變化,分析可能與GCC變薄時增強了深層視網膜成像清晰度及OCTA成像范圍較小等有關,需更大樣本量數據進一步驗證。
本研究尚存在以下不足:(1)本研究為回顧性病例分析,納入觀察的病例數少,部分患者3~5個月隨訪數據缺失;(2)發病初期視盤OCTA定位及RPC值受視盤水腫影響;(3)視盤及黃斑區OCTA成像范圍較小,但成像范圍增加將伴隨圖像分辨率降低及分層誤差增加;(4)OCT及OCTA觀察指標未行顳側、鼻側等亞組分析;未對脈絡膜層面、篩板水平的血流灌注狀態進行分析;(5)視功能評價指標單一,未能完全反應其預后情況。未來還需進行更大樣本的前瞻性隨訪研究,細化隨訪時間間隔,繼續深入探討OCTA在NAION病理機制探索、預測病情轉歸等方面的應用價值。