引用本文: 李陳香, 艾詩蓓, 陳忠平, 周旭霞. 普羅布考對高糖培養人視網膜Müller細胞特化蛋白1/細胞骨架相關蛋白/核因子E2相關因子2/半胱氨酸連接酶催化亞基表達的影響. 中華眼底病雜志, 2019, 35(2): 187-191. doi: 10.3760/cma.j.issn.1005-1015.2019.02.015 復制
糖尿病視網膜病變(DR)是糖尿病微血管病變最常見眼部并發癥[1]。既往研究表明,高糖誘導的神經元和神經膠質細胞損傷通常發生在微血管病變之前,其機制可能與氧化應激有關[2]。Müller細胞在DR的氧化應激、視網膜炎癥等中起重要作用。此外,作為氧化應激的關鍵因子核因子E2相關因子2(Nrf2)也主要表達于Müller細胞及星形膠質細胞[3-4]。氧化應激在DR發病中的作用一直是近年國內外研究的焦點[5-6]。Nrf2信號通路是最為重要的內源性抗氧化應激通路,主要受細胞骨架相關蛋白(Keap1)調控,而特化蛋白1(SP1)則可通過調控Keap1在氧化應激中發揮作用;Nrf2能進入細胞核內與抗氧化反應元件(ARE)相結合,啟動下游抗氧化基因轉錄,進行下游相關靶基因γ谷氨酰半胱氨酸連接酶(γ-GCL)等的轉錄,而半胱氨酸連接酶催化亞基(GCLC)正是γ-GCL的催化亞單位,調控谷胱甘肽(GSH)的合成發揮抗氧化作用[7-8]。普羅布考為臨床常用調脂藥物,并具有強大的抗氧化應激作用[9]。Duan等[10]發現普羅布考通過抗氧化作用延緩糖尿病腎病的發生、發展。但其對DR作用的研究較少。本研究觀察了普羅布考對高糖誘導人Müller細胞中SP1/Keap1/Nrf2/GCLC表達的影響,初步探討普羅布考通過上述通路發揮其抗氧化作用的可能機制。現將結果報道如下。
1 材料和方法
意外死亡正常人供體眼球,由長沙愛爾眼科醫院眼庫中心提供。鼠來源谷氨酰胺合成酶(GS)多克隆抗體、兔來源SP1單克隆抗體(美國Santa Cruz公司),DAPI(中國Solarbio公司),兔來源Nrf2單克隆抗體、鼠來源Keap1單克隆抗體、兔來源GCLC單克隆抗體(英國Abcam公司),羊抗鼠/羊抗兔CY3二抗(美國Molecular Probe公司),Dulbecco改良Eagle培養基、胎牛血清、雙抗(青霉素和鏈霉素)、0.25%胰蛋白酶-EDTA(美國Gibico公司),Trizol試劑、CO2培養箱(美國Thermo公司),SYBR GreenⅠ(中國Vazyme公司),普羅布考(中國食品藥品檢定研究院),DMSO(美國Sigma公司),倒置顯微鏡(德國Zeiss公司),正置熒光顯微鏡(日本Olympus公司),實時熒光定量PCR(qRT-PCR)儀(瑞士Roche公司)。
意外死亡正常人供體眼球,采用組織塊懸浮法原代培養視網膜Müller細胞,待80%細胞融合后以1∶2比例傳代培養,取第3~5代細胞用于實驗。
免疫熒光染色法鑒定Müller細胞及檢測細胞中SP1、Keap1、Nrf2、GCLC的蛋白表達。GS抗體、DAPI染色觀察Müller細胞形態。細胞接種于4孔板的蓋玻片上,細胞爬片至80%時,棄去培養液,洗滌3次。4%多聚甲醛固定15 min,PBS洗滌3次,加入1%Triton X-100室溫下孵育20 min,加入5%牛血清白蛋白37 ℃恒溫箱中封閉60 min。分別加入一抗(GS 1∶100,SP1 1∶50,Nrf2 1∶500,Keap1 1∶100,GCLC 1∶100,GS 1∶100),4 ℃冰箱中孵育過夜。PBS洗滌蓋玻片,加入對應熒光二抗(CY3 1∶100,異硫氰酸熒光素 1∶500)室溫下避光孵育1 h,PBS洗滌后,加入DAPI(1∶4 000)室溫下避光孵育5~10 min,PBS洗滌后封片,熒光正置顯微鏡觀察。
qRT-PCR檢測Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA的表達。Müller細胞均勻接種于6孔板上進行爬片,細胞覆蓋面積達到80%時吸去培養液,PBS洗滌3次,排除血清對結果的干擾。按照培養液中葡萄糖的濃度,采用單純隨機方法將細胞分正常糖組(5.5 mmol/L葡萄糖)、高糖組(25.0 mmol/L葡萄糖)、正常糖+普羅布考組、高糖+普羅布考組。干預組細胞培養液中分別加100 μmol/L普羅布考。干預24 h后,PBS洗滌3次,采用Trizol法提取細胞總RNA,逆轉錄成cDNA,以β-actin作為內參照。SYBR GreenⅠ嵌合熒光法擴增相應基因。SP1:正向引物5′-CAGAGGGTCAGTGGGCTACA-3′,反向引物5′-GAGGGTTTCCTGGGAGATGG-3′;Keap1:正向引物5′-TGGCCAAGCAAGAGGAGTTC-3′,反向游引物5′-GGCTGATGAGGGTCACCAGTT-3′;Nrf2:正向引物5′-TCAGCCAGCCCAGCACATCC-3′,反向引物5′-′TCTGCGCCAAAAGCTGCATGC-3′;GCLC:正向引物5′-GCAAGGCCCAGAACAGCACG-3′,反向引物5′-TCCCTCATCCATCTGGCAACTGT-3′;β-actine正向引物5′-CATGTACGTTGCTATCCAGGC-3′,反向引物5′-CTCCTTAATGTCACGCACGAT-3′。退火溫度50 ℃,40個循環后形成擴增曲線,嵌合熒光法基因擴增達到閾值時所經歷的循環閾值(Ct值)。Ct值采用Light Cycle R 96軟件進行分析,結果以2?△△Ct計算。
采用Graphpad Prism 5軟件進行統計學分析。兩組間數據比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
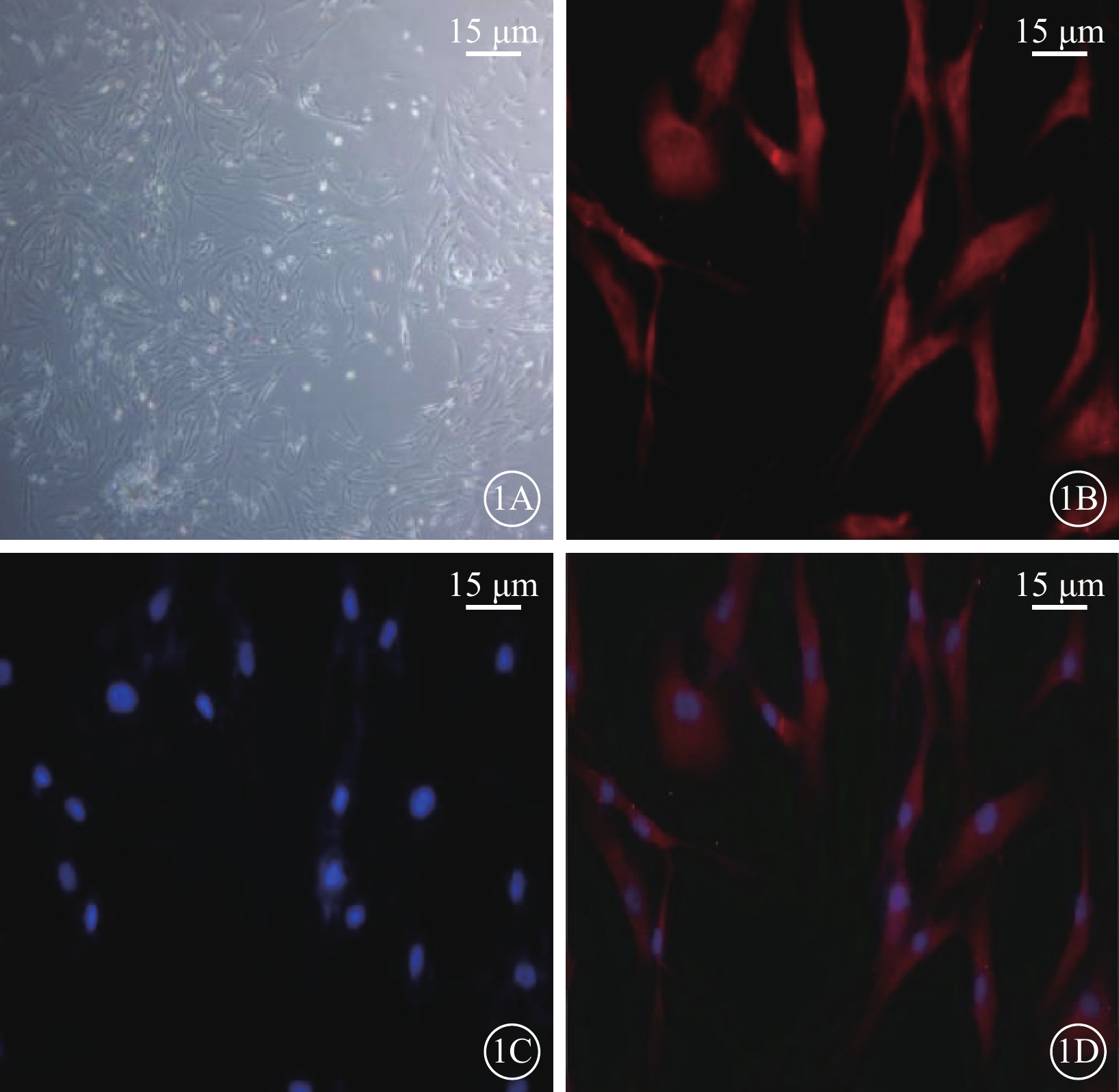
倒置相差顯微鏡觀察發現,培養的Müller細胞呈梭形生長,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁(圖1A)。正置熒光顯微鏡觀察發現,95%以上的細胞GS染色陽性,紅色熒光均勻一致;DAPI標記的細胞核呈圓形或卵圓形,邊界清晰,藍色熒光均勻一致(圖1B~1D)。
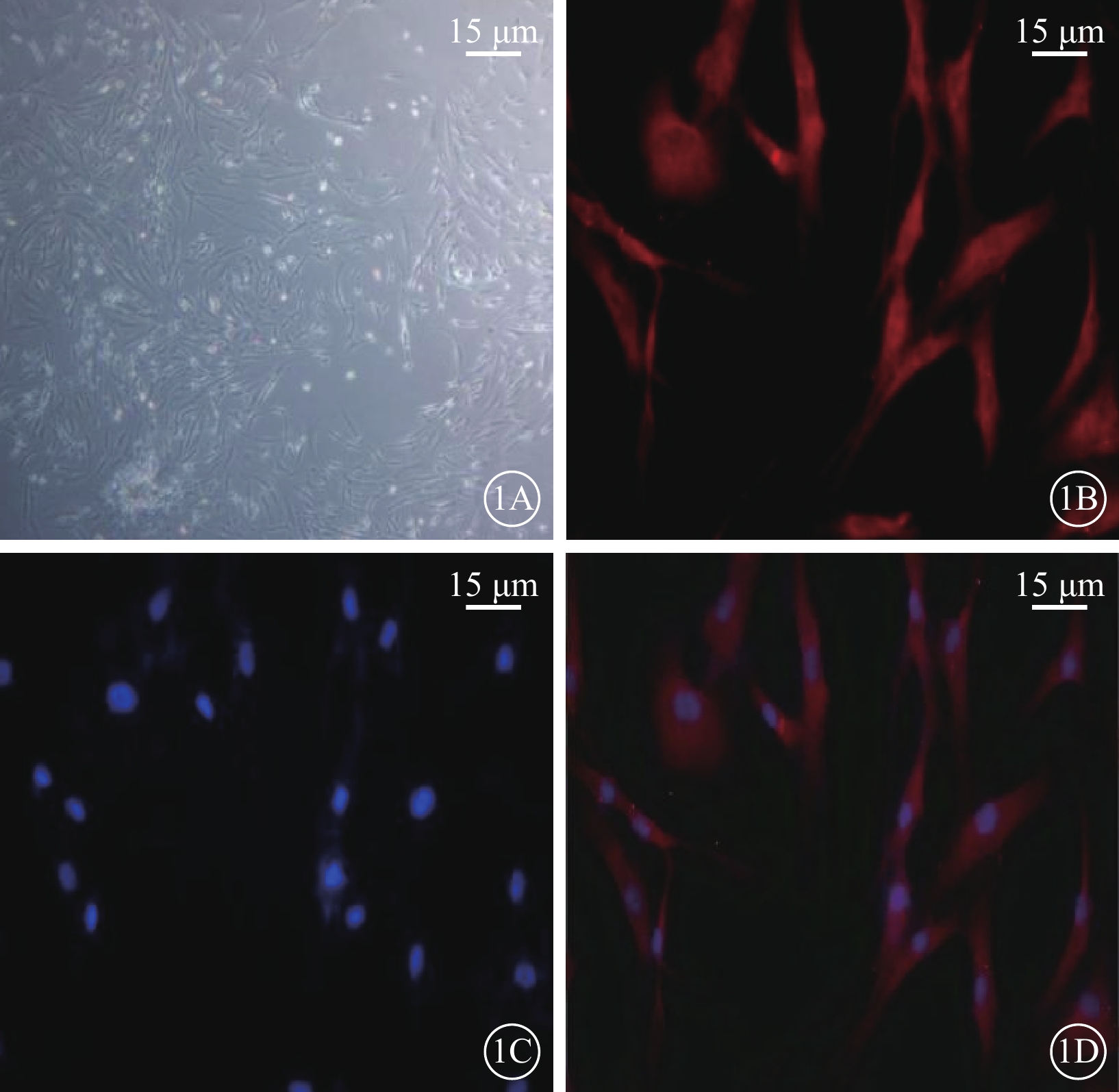 圖1
體外培養的人Müller細胞顯微鏡像。1A示倒置顯微鏡像。細胞基本融合,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁 標尺:15 μm。1B~1D示正置熒光顯微鏡像。1B示GS染色呈陽性,表現為細胞內紅色熒光;1C示DAPI標記的細胞核呈藍色熒光;1D示1B、1C共定位像,Müller細胞GS染色陽性率>95% 標尺:15 μm
圖1
體外培養的人Müller細胞顯微鏡像。1A示倒置顯微鏡像。細胞基本融合,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁 標尺:15 μm。1B~1D示正置熒光顯微鏡像。1B示GS染色呈陽性,表現為細胞內紅色熒光;1C示DAPI標記的細胞核呈藍色熒光;1D示1B、1C共定位像,Müller細胞GS染色陽性率>95% 標尺:15 μm
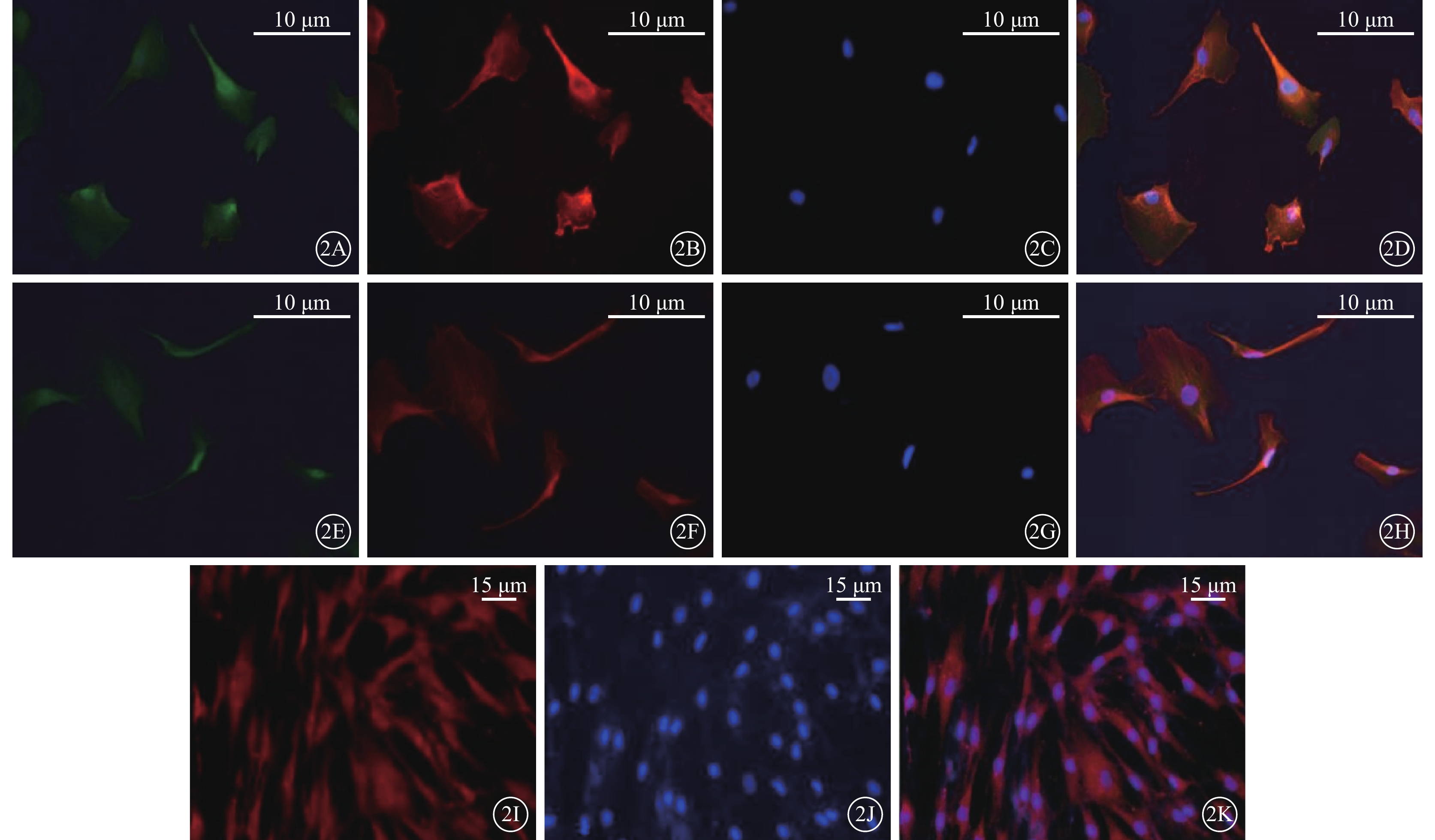
免疫熒光染色結果顯示,Müller細胞中SP1、Keap1、Nrf2、GCLC蛋白均呈陽性表達(圖2)。
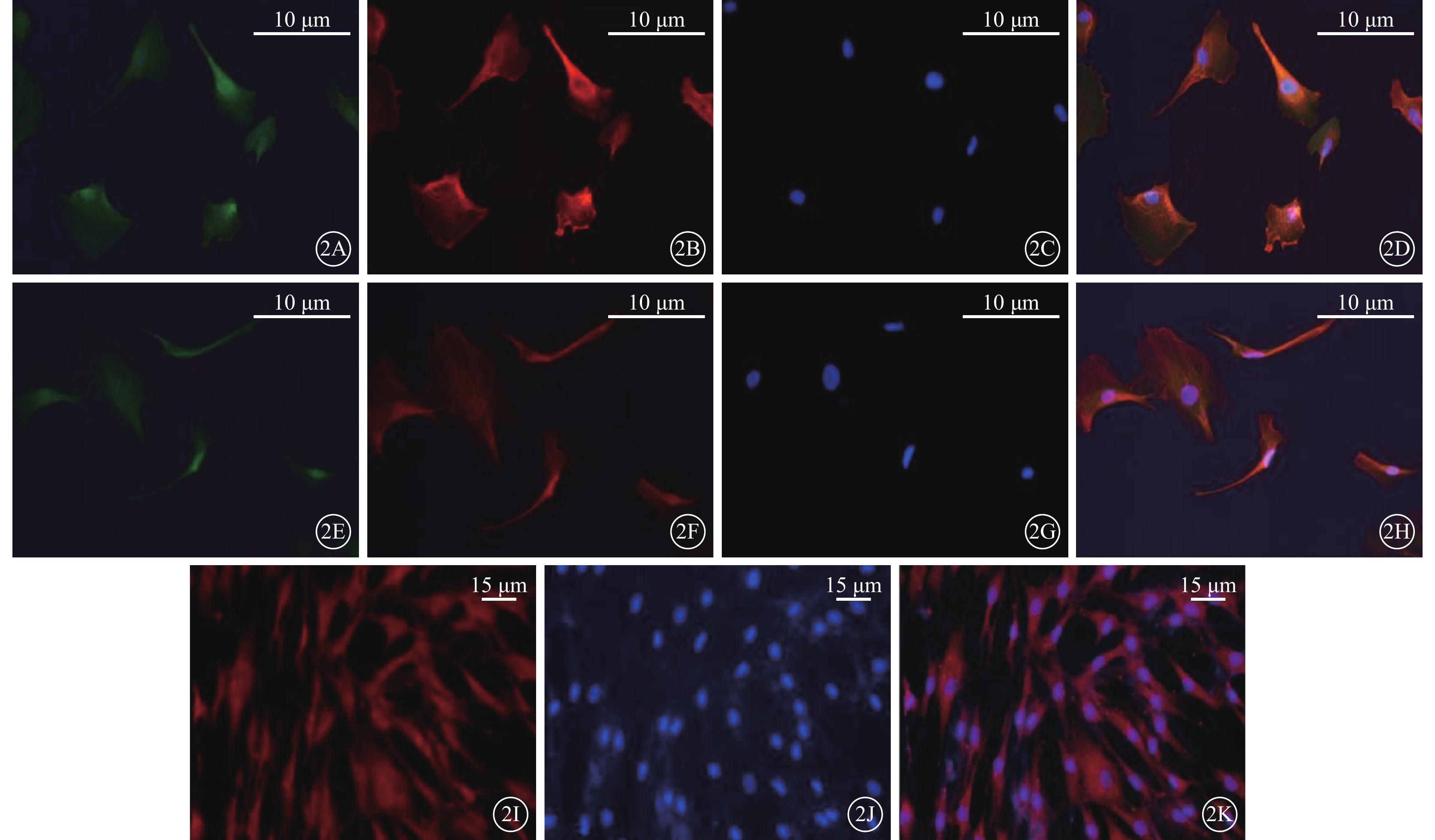 圖2
體外培養的人Müller細胞免疫熒光顯微鏡像。2A示GCLC免疫熒光染色陽性,呈綠色熒光;2B示GS免疫染色陽性,呈紅色熒光;2C示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2D示2A~2C共定位像 標尺:10 μm。2E示Nrf2免疫熒光染色陽性,呈綠色熒光;2F示Keap1免疫熒光染色陽性,呈紅色熒光;2G示DAPI免疫熒光染色陽性,呈藍色熒光;2H示2E~2G共定位像 標尺:10μm。2I示SP1免疫熒光染色陽性,呈紅色熒光;2J示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2K示2I~2J共定位像 標尺:15 μm
圖2
體外培養的人Müller細胞免疫熒光顯微鏡像。2A示GCLC免疫熒光染色陽性,呈綠色熒光;2B示GS免疫染色陽性,呈紅色熒光;2C示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2D示2A~2C共定位像 標尺:10 μm。2E示Nrf2免疫熒光染色陽性,呈綠色熒光;2F示Keap1免疫熒光染色陽性,呈紅色熒光;2G示DAPI免疫熒光染色陽性,呈藍色熒光;2H示2E~2G共定位像 標尺:10μm。2I示SP1免疫熒光染色陽性,呈紅色熒光;2J示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2K示2I~2J共定位像 標尺:15 μm
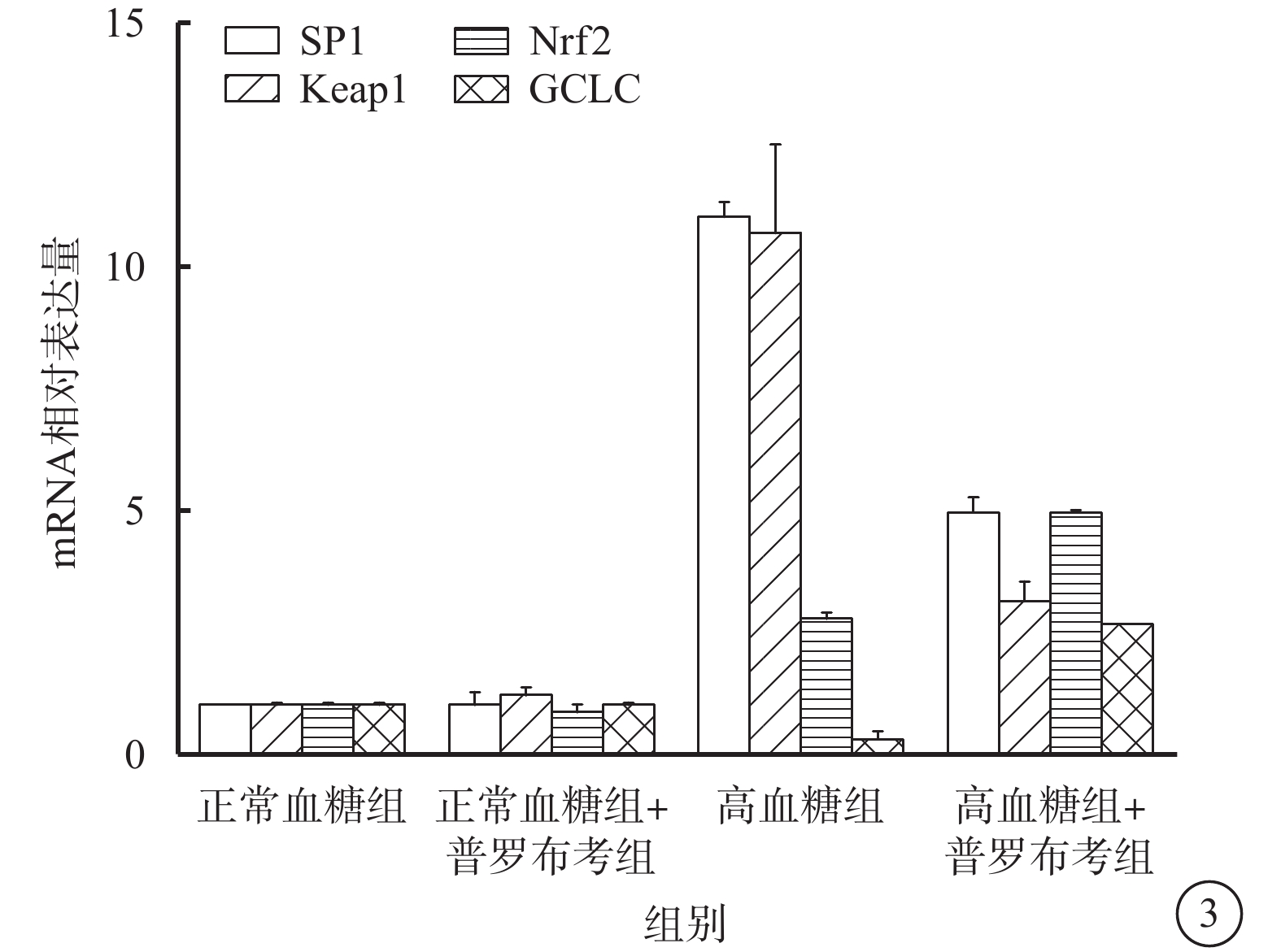
qRT-PCR檢測結果顯示,正常糖組、正常糖+普羅布考組Müller細胞中SP1(t=0.106 0)、Nrf2(t=0.663 8)、Keap1(t=1.487)、GCLC(t=1.786)mRNA表達比較,差異無統計學意義(P>0.05)。與正常糖組比較,高糖組Müller細胞中SP1(t=28.30,P<0.000)、Keap1(t=5.369,P=0.006)、Nrf2(t=10.59,P=0.001)mRNA表達顯著上調,GCLC顯著下調(t=4.633,P=0.010),差異均有統計學意義。與高糖組比較,高糖+普羅布考組Müller細胞中SP1(t=12.60,P=0.000)、Keap1(t=4.076,P=0.015)mRNA表達顯著下調,Nrf2(t=12.90,P=0.000)、GCLC(t=15.96,P<0.000)mRNA表達顯著上調,差異有統計學意義(圖3)。
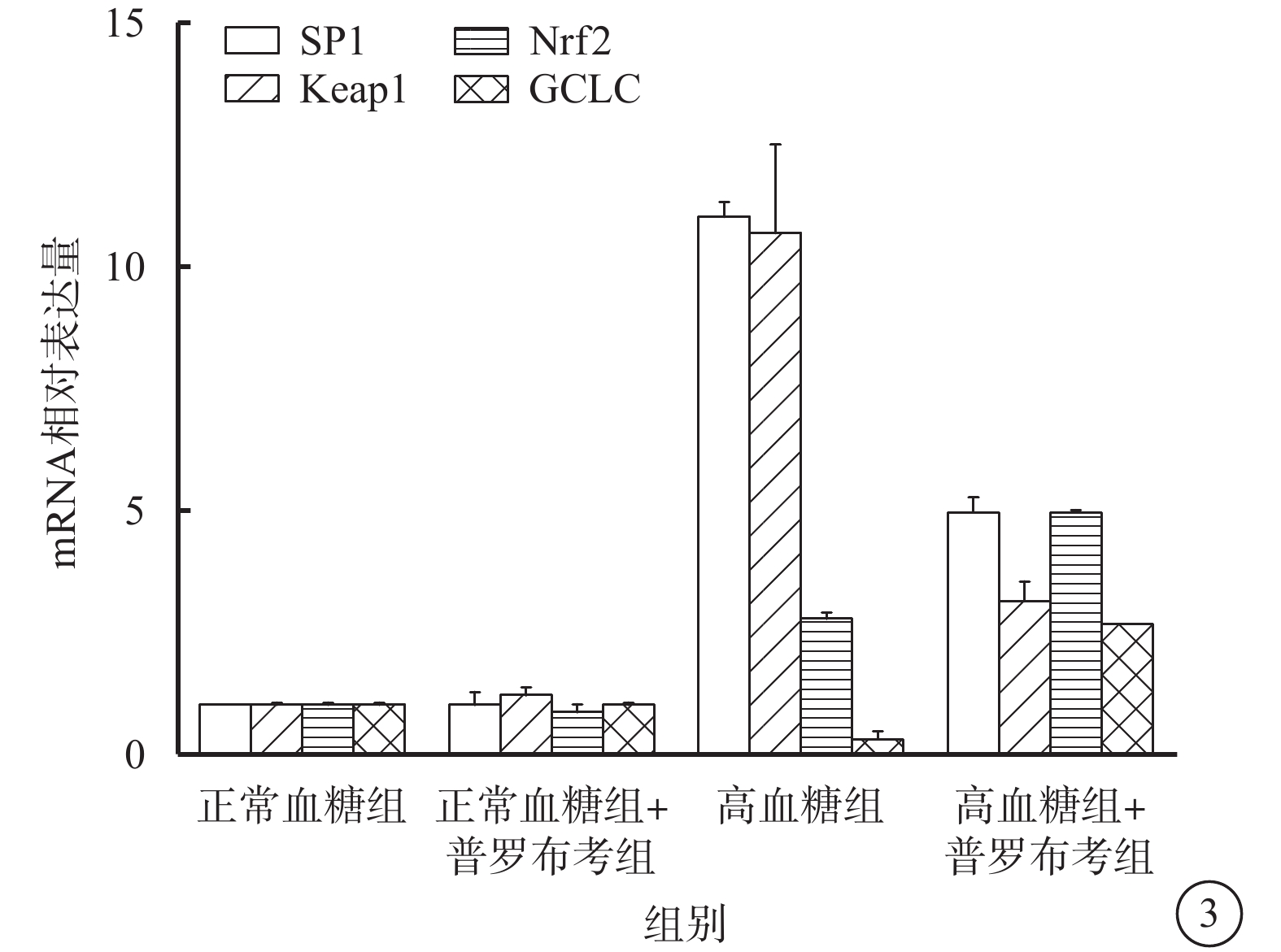 圖3
各組Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA表達情況。*高血糖組與高血糖+普羅布考組比較,P<0.05
圖3
各組Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA表達情況。*高血糖組與高血糖+普羅布考組比較,P<0.05
3 討論
GS是公認的Müller細胞分子標記[11]。本研究通過免疫熒光化學法,證實了通過組織塊懸浮法培養得到的細胞為視網膜Müller細胞。高血糖是DR發生、發展的始動因素,體外培養時25 mmol/L高糖水平,近似于糖尿病患者體內的高血糖狀態[12]。研究表明,高糖誘導的神經元和神經膠質細胞損傷通常發生在微血管病變之前,其機制可能與氧化應激有關[2]。Müller細胞在DR的氧化應激、視網膜炎癥、新生血管生成、血管滲漏及蛋白質缺失、修飾中起重要作用[3]。但Müller細胞具體的抗氧化應激機制仍是未知。
高血糖環境下ROS增加,導致氧化還原體系失衡,氧化應激發生。氧化應激在DR的發生和發展中起著重要作用。Nrf2信號通路是迄今為止發現的最為重要的內源性抗氧化應激通路,氧化應激損傷反應主要通過Nrf2/ARE通路實現,而Nrf2主要受Keap1調控[13-15]。SP1在細胞的生長、分化、新城代謝和凋亡中起著重要作用[16]。Guo等[17]發現在肺癌細胞中SP1是Keap1的轉錄激活因子,其對Keap1的表達發揮重要作用。Mishra等[18]研究發現在DR中轉錄因子SP1和Keap1表達顯著增加,轉錄因子SP1通過作用于Keap1的啟動子影響Keap1的表達。本研究結果顯示,Müller細胞中SP1、Nrf2、Keap1、GCLC蛋白均呈陽性表達;同時,高糖條件下Müller細胞中的Nrf2、Keap1、SP1 mRNA表達量均增高,而GCLC mRNA表達降低。結果與Zhong等[7]、Mishra等[19]的研究結果一致。在高糖刺激下Müller細胞中Nrf2表達量增加,SP1通過調控Keap1的表達,Keap1表達也上調。Nrf2可能主要被Keap1瞄定在細胞質中,進入細胞核內的Nrf2可能下降,所以導致GCLC的表達下調。而GCLC是GSH合成的關鍵酶,GCLC的減少會導致GSH合成減少,從而使細胞內抗氧化作用減弱[18]。Nrf2、Keap1之間的影響作用原因可能是高糖條件下Nrf2、Keap1之間的表觀遺傳學修飾作用或者是Nrf2、Keap1翻譯后修飾作用[20-22]。但其中具體調節機制仍未知。上述結果表明SP1/Keap1/Nrf2/GCLC信號通路在Müller細胞中可能發揮著重要作用。
普羅布考因其獨特的酚羥基分子結構,使其具有抗氧化作用;并且還可以抑制血細胞外ROS,有效減少氧化應激損傷導致的血管內皮細胞凋亡。Fu等[23]、Duan等[10]發現普羅布考通過抗氧化作用抑制糖尿病大鼠心室重建、延緩糖尿病腎病的發生和發展。糖尿病動物模型中,普羅布考通過調節抗氧化酶活性、抑制脂質過氧化、增加血漿胰島素水平、減少胰島素抵抗、降低血糖濃度及抑制免疫成熟相關的樹突狀細胞CD11c,以緩解DR的發病[24-25]。Agardh等[26]發現普羅布考能促進GSH的代謝作用,這可能與普羅布考的抗氧化作用相關。因此,普羅布考可能通過調節Nrf2/ARE通路,促進下游抗氧化基因GCL的表達,從而激活GSH生成系統。我們前期的研究表明,普羅布考可降低高血脂DR患者氧化應激水平,改善患者視功能、減輕黃斑水腫及硬性滲出[27-28]。本研究結果發現,在普羅布考作用下,SP1、Keap1 mRNA表達均下調,而Nrf2、GCLC mRNA表達均上調,并且正常血糖組與正常血糖+普羅布考組差異無統計學意義,表明普羅布考可能是通過Nrf2/GCLC通路保護Müller細胞,并抑制SP1和Keap1的表達。但普羅布考對高糖條件下人視網膜Müller細胞具體的保護作用機制仍有待進一步研究。
志謝 中南大學愛爾眼科學院陳建蘇教授和徐和平教授對課題及論文修改的精心指導和幫助;愛爾眼科研究所其他各位老師和長沙愛爾眼庫對實驗方案實施過程的指導和幫助。
糖尿病視網膜病變(DR)是糖尿病微血管病變最常見眼部并發癥[1]。既往研究表明,高糖誘導的神經元和神經膠質細胞損傷通常發生在微血管病變之前,其機制可能與氧化應激有關[2]。Müller細胞在DR的氧化應激、視網膜炎癥等中起重要作用。此外,作為氧化應激的關鍵因子核因子E2相關因子2(Nrf2)也主要表達于Müller細胞及星形膠質細胞[3-4]。氧化應激在DR發病中的作用一直是近年國內外研究的焦點[5-6]。Nrf2信號通路是最為重要的內源性抗氧化應激通路,主要受細胞骨架相關蛋白(Keap1)調控,而特化蛋白1(SP1)則可通過調控Keap1在氧化應激中發揮作用;Nrf2能進入細胞核內與抗氧化反應元件(ARE)相結合,啟動下游抗氧化基因轉錄,進行下游相關靶基因γ谷氨酰半胱氨酸連接酶(γ-GCL)等的轉錄,而半胱氨酸連接酶催化亞基(GCLC)正是γ-GCL的催化亞單位,調控谷胱甘肽(GSH)的合成發揮抗氧化作用[7-8]。普羅布考為臨床常用調脂藥物,并具有強大的抗氧化應激作用[9]。Duan等[10]發現普羅布考通過抗氧化作用延緩糖尿病腎病的發生、發展。但其對DR作用的研究較少。本研究觀察了普羅布考對高糖誘導人Müller細胞中SP1/Keap1/Nrf2/GCLC表達的影響,初步探討普羅布考通過上述通路發揮其抗氧化作用的可能機制。現將結果報道如下。
1 材料和方法
意外死亡正常人供體眼球,由長沙愛爾眼科醫院眼庫中心提供。鼠來源谷氨酰胺合成酶(GS)多克隆抗體、兔來源SP1單克隆抗體(美國Santa Cruz公司),DAPI(中國Solarbio公司),兔來源Nrf2單克隆抗體、鼠來源Keap1單克隆抗體、兔來源GCLC單克隆抗體(英國Abcam公司),羊抗鼠/羊抗兔CY3二抗(美國Molecular Probe公司),Dulbecco改良Eagle培養基、胎牛血清、雙抗(青霉素和鏈霉素)、0.25%胰蛋白酶-EDTA(美國Gibico公司),Trizol試劑、CO2培養箱(美國Thermo公司),SYBR GreenⅠ(中國Vazyme公司),普羅布考(中國食品藥品檢定研究院),DMSO(美國Sigma公司),倒置顯微鏡(德國Zeiss公司),正置熒光顯微鏡(日本Olympus公司),實時熒光定量PCR(qRT-PCR)儀(瑞士Roche公司)。
意外死亡正常人供體眼球,采用組織塊懸浮法原代培養視網膜Müller細胞,待80%細胞融合后以1∶2比例傳代培養,取第3~5代細胞用于實驗。
免疫熒光染色法鑒定Müller細胞及檢測細胞中SP1、Keap1、Nrf2、GCLC的蛋白表達。GS抗體、DAPI染色觀察Müller細胞形態。細胞接種于4孔板的蓋玻片上,細胞爬片至80%時,棄去培養液,洗滌3次。4%多聚甲醛固定15 min,PBS洗滌3次,加入1%Triton X-100室溫下孵育20 min,加入5%牛血清白蛋白37 ℃恒溫箱中封閉60 min。分別加入一抗(GS 1∶100,SP1 1∶50,Nrf2 1∶500,Keap1 1∶100,GCLC 1∶100,GS 1∶100),4 ℃冰箱中孵育過夜。PBS洗滌蓋玻片,加入對應熒光二抗(CY3 1∶100,異硫氰酸熒光素 1∶500)室溫下避光孵育1 h,PBS洗滌后,加入DAPI(1∶4 000)室溫下避光孵育5~10 min,PBS洗滌后封片,熒光正置顯微鏡觀察。
qRT-PCR檢測Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA的表達。Müller細胞均勻接種于6孔板上進行爬片,細胞覆蓋面積達到80%時吸去培養液,PBS洗滌3次,排除血清對結果的干擾。按照培養液中葡萄糖的濃度,采用單純隨機方法將細胞分正常糖組(5.5 mmol/L葡萄糖)、高糖組(25.0 mmol/L葡萄糖)、正常糖+普羅布考組、高糖+普羅布考組。干預組細胞培養液中分別加100 μmol/L普羅布考。干預24 h后,PBS洗滌3次,采用Trizol法提取細胞總RNA,逆轉錄成cDNA,以β-actin作為內參照。SYBR GreenⅠ嵌合熒光法擴增相應基因。SP1:正向引物5′-CAGAGGGTCAGTGGGCTACA-3′,反向引物5′-GAGGGTTTCCTGGGAGATGG-3′;Keap1:正向引物5′-TGGCCAAGCAAGAGGAGTTC-3′,反向游引物5′-GGCTGATGAGGGTCACCAGTT-3′;Nrf2:正向引物5′-TCAGCCAGCCCAGCACATCC-3′,反向引物5′-′TCTGCGCCAAAAGCTGCATGC-3′;GCLC:正向引物5′-GCAAGGCCCAGAACAGCACG-3′,反向引物5′-TCCCTCATCCATCTGGCAACTGT-3′;β-actine正向引物5′-CATGTACGTTGCTATCCAGGC-3′,反向引物5′-CTCCTTAATGTCACGCACGAT-3′。退火溫度50 ℃,40個循環后形成擴增曲線,嵌合熒光法基因擴增達到閾值時所經歷的循環閾值(Ct值)。Ct值采用Light Cycle R 96軟件進行分析,結果以2?△△Ct計算。
采用Graphpad Prism 5軟件進行統計學分析。兩組間數據比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
倒置相差顯微鏡觀察發現,培養的Müller細胞呈梭形生長,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁(圖1A)。正置熒光顯微鏡觀察發現,95%以上的細胞GS染色陽性,紅色熒光均勻一致;DAPI標記的細胞核呈圓形或卵圓形,邊界清晰,藍色熒光均勻一致(圖1B~1D)。
 圖1
體外培養的人Müller細胞顯微鏡像。1A示倒置顯微鏡像。細胞基本融合,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁 標尺:15 μm。1B~1D示正置熒光顯微鏡像。1B示GS染色呈陽性,表現為細胞內紅色熒光;1C示DAPI標記的細胞核呈藍色熒光;1D示1B、1C共定位像,Müller細胞GS染色陽性率>95% 標尺:15 μm
圖1
體外培養的人Müller細胞顯微鏡像。1A示倒置顯微鏡像。細胞基本融合,形態狹長,胞質豐富,胞核較大,其中可見1~2個核仁 標尺:15 μm。1B~1D示正置熒光顯微鏡像。1B示GS染色呈陽性,表現為細胞內紅色熒光;1C示DAPI標記的細胞核呈藍色熒光;1D示1B、1C共定位像,Müller細胞GS染色陽性率>95% 標尺:15 μm
免疫熒光染色結果顯示,Müller細胞中SP1、Keap1、Nrf2、GCLC蛋白均呈陽性表達(圖2)。
 圖2
體外培養的人Müller細胞免疫熒光顯微鏡像。2A示GCLC免疫熒光染色陽性,呈綠色熒光;2B示GS免疫染色陽性,呈紅色熒光;2C示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2D示2A~2C共定位像 標尺:10 μm。2E示Nrf2免疫熒光染色陽性,呈綠色熒光;2F示Keap1免疫熒光染色陽性,呈紅色熒光;2G示DAPI免疫熒光染色陽性,呈藍色熒光;2H示2E~2G共定位像 標尺:10μm。2I示SP1免疫熒光染色陽性,呈紅色熒光;2J示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2K示2I~2J共定位像 標尺:15 μm
圖2
體外培養的人Müller細胞免疫熒光顯微鏡像。2A示GCLC免疫熒光染色陽性,呈綠色熒光;2B示GS免疫染色陽性,呈紅色熒光;2C示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2D示2A~2C共定位像 標尺:10 μm。2E示Nrf2免疫熒光染色陽性,呈綠色熒光;2F示Keap1免疫熒光染色陽性,呈紅色熒光;2G示DAPI免疫熒光染色陽性,呈藍色熒光;2H示2E~2G共定位像 標尺:10μm。2I示SP1免疫熒光染色陽性,呈紅色熒光;2J示細胞內DAPI免疫熒光染色陽性,呈藍色熒光;2K示2I~2J共定位像 標尺:15 μm
qRT-PCR檢測結果顯示,正常糖組、正常糖+普羅布考組Müller細胞中SP1(t=0.106 0)、Nrf2(t=0.663 8)、Keap1(t=1.487)、GCLC(t=1.786)mRNA表達比較,差異無統計學意義(P>0.05)。與正常糖組比較,高糖組Müller細胞中SP1(t=28.30,P<0.000)、Keap1(t=5.369,P=0.006)、Nrf2(t=10.59,P=0.001)mRNA表達顯著上調,GCLC顯著下調(t=4.633,P=0.010),差異均有統計學意義。與高糖組比較,高糖+普羅布考組Müller細胞中SP1(t=12.60,P=0.000)、Keap1(t=4.076,P=0.015)mRNA表達顯著下調,Nrf2(t=12.90,P=0.000)、GCLC(t=15.96,P<0.000)mRNA表達顯著上調,差異有統計學意義(圖3)。
 圖3
各組Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA表達情況。*高血糖組與高血糖+普羅布考組比較,P<0.05
圖3
各組Müller細胞中SP1、Keap1、Nrf2、GCLC mRNA表達情況。*高血糖組與高血糖+普羅布考組比較,P<0.05
3 討論
GS是公認的Müller細胞分子標記[11]。本研究通過免疫熒光化學法,證實了通過組織塊懸浮法培養得到的細胞為視網膜Müller細胞。高血糖是DR發生、發展的始動因素,體外培養時25 mmol/L高糖水平,近似于糖尿病患者體內的高血糖狀態[12]。研究表明,高糖誘導的神經元和神經膠質細胞損傷通常發生在微血管病變之前,其機制可能與氧化應激有關[2]。Müller細胞在DR的氧化應激、視網膜炎癥、新生血管生成、血管滲漏及蛋白質缺失、修飾中起重要作用[3]。但Müller細胞具體的抗氧化應激機制仍是未知。
高血糖環境下ROS增加,導致氧化還原體系失衡,氧化應激發生。氧化應激在DR的發生和發展中起著重要作用。Nrf2信號通路是迄今為止發現的最為重要的內源性抗氧化應激通路,氧化應激損傷反應主要通過Nrf2/ARE通路實現,而Nrf2主要受Keap1調控[13-15]。SP1在細胞的生長、分化、新城代謝和凋亡中起著重要作用[16]。Guo等[17]發現在肺癌細胞中SP1是Keap1的轉錄激活因子,其對Keap1的表達發揮重要作用。Mishra等[18]研究發現在DR中轉錄因子SP1和Keap1表達顯著增加,轉錄因子SP1通過作用于Keap1的啟動子影響Keap1的表達。本研究結果顯示,Müller細胞中SP1、Nrf2、Keap1、GCLC蛋白均呈陽性表達;同時,高糖條件下Müller細胞中的Nrf2、Keap1、SP1 mRNA表達量均增高,而GCLC mRNA表達降低。結果與Zhong等[7]、Mishra等[19]的研究結果一致。在高糖刺激下Müller細胞中Nrf2表達量增加,SP1通過調控Keap1的表達,Keap1表達也上調。Nrf2可能主要被Keap1瞄定在細胞質中,進入細胞核內的Nrf2可能下降,所以導致GCLC的表達下調。而GCLC是GSH合成的關鍵酶,GCLC的減少會導致GSH合成減少,從而使細胞內抗氧化作用減弱[18]。Nrf2、Keap1之間的影響作用原因可能是高糖條件下Nrf2、Keap1之間的表觀遺傳學修飾作用或者是Nrf2、Keap1翻譯后修飾作用[20-22]。但其中具體調節機制仍未知。上述結果表明SP1/Keap1/Nrf2/GCLC信號通路在Müller細胞中可能發揮著重要作用。
普羅布考因其獨特的酚羥基分子結構,使其具有抗氧化作用;并且還可以抑制血細胞外ROS,有效減少氧化應激損傷導致的血管內皮細胞凋亡。Fu等[23]、Duan等[10]發現普羅布考通過抗氧化作用抑制糖尿病大鼠心室重建、延緩糖尿病腎病的發生和發展。糖尿病動物模型中,普羅布考通過調節抗氧化酶活性、抑制脂質過氧化、增加血漿胰島素水平、減少胰島素抵抗、降低血糖濃度及抑制免疫成熟相關的樹突狀細胞CD11c,以緩解DR的發病[24-25]。Agardh等[26]發現普羅布考能促進GSH的代謝作用,這可能與普羅布考的抗氧化作用相關。因此,普羅布考可能通過調節Nrf2/ARE通路,促進下游抗氧化基因GCL的表達,從而激活GSH生成系統。我們前期的研究表明,普羅布考可降低高血脂DR患者氧化應激水平,改善患者視功能、減輕黃斑水腫及硬性滲出[27-28]。本研究結果發現,在普羅布考作用下,SP1、Keap1 mRNA表達均下調,而Nrf2、GCLC mRNA表達均上調,并且正常血糖組與正常血糖+普羅布考組差異無統計學意義,表明普羅布考可能是通過Nrf2/GCLC通路保護Müller細胞,并抑制SP1和Keap1的表達。但普羅布考對高糖條件下人視網膜Müller細胞具體的保護作用機制仍有待進一步研究。
志謝 中南大學愛爾眼科學院陳建蘇教授和徐和平教授對課題及論文修改的精心指導和幫助;愛爾眼科研究所其他各位老師和長沙愛爾眼庫對實驗方案實施過程的指導和幫助。