引用本文: 陳建志, 冼文光, 符小林, 何福桃. 2型糖尿病患者血清中血管內皮生長因子、apelin及血紅素氧合酶-1水平變化及其與糖尿病視網膜病變的相關性研究. 中華眼底病雜志, 2019, 35(2): 145-149. doi: 10.3760/cma.j.issn.1005-1015.2019.02.008 復制
糖尿病視網膜病變(DR)主要病理改變為視網膜出血、滲出、微血管擴張及新生血管形成,但其具體發病機制目前尚未明確。近年研究發現,VEGF參與了視網膜的滲出、出血及視網膜新生血管形成,其水平變化與DR的發生發展具有一定相關性[1]。Apelin是一種新型脂肪細胞因子,屬于血管緊張素受體相關蛋白,參與視網膜內皮細胞增生及血管新生過程[2]。另有研究表明,血紅素氧合酶-1(HO-1)在高糖培養的視網膜細胞以及糖尿病(DM)動物模型的視網膜上存在異常表達[3]。VEGF、apelin及HO-1均與血管穩態、細胞增生及凋亡、機體炎癥、免疫反應等多種生理病理過程有關,但其與DR的關系尚未明確。本研究檢測了一組2型DM(T2DM)患者血清中VEGF、apelin、HO-1水平,分析其與DR發生的相關性。現將結果報道如下。
1 對象和方法
本研究是經海南西部中心醫院倫理委員會審核批準的回顧性病例研究(批準號:XBZXYY2014-JH0618);患者或監護人均獲知情并簽署書面同意書。
2014年1月至2017年12月在海南西部中心醫院內分泌科住院治療的T2DM患者208例納入研究。其中,男性116例,女性92例;年齡30~82歲,平均年齡(57.4±9.6)歲。納入標準:(1)均符合1999年WH0糖尿病專家委員會制定的DM診斷與分型標準[4];(2)未使用細胞毒制劑和免疫抑制劑,近4周內無服藥史,白細胞計數正常。排除標準:(1)1型DM和其他類型DM;(2)急慢性感染、肝腎疾病、風濕結締組織病、心腦血管病、惡性腫瘤者;(2)除DR外的其他眼部疾病以及眼底病變無法分級者。
患者均行視力、裂隙燈顯微鏡、間接檢眼鏡、FFA檢查。根據檢查結果并參照DR臨床診斷標準[5],將患者分為無DR(NDR)組、非生增生型DR(NPDR)組、增生型DR(PDR)組,分別為72、76、60例。選取同期我院體檢中心的健康體檢者50名作為對照組。其中,男性27名,女性23名;年齡34~78歲,平均年齡(56.8±9.3歲)。排除有全身及眼部疾病者;體重指數(BMI)≥25 kg/m2者。詳細記錄受檢者年齡、性別、DM病程、收縮壓(SBP)、舒張壓(DBP)、身高、體重、體重指數(BMI)。BMI=體重/身高2(kg/m2);空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-c)、低密度脂蛋白膽固醇(LDL-c)等實驗室指標。
PDR組患者DM病程明顯長于NDR組、NPDR組,差異均有統計學意義(P<0.05);對照組、NDR組、NPDR組、PDR組受檢者性別構成比、年齡、BMI、SBP、DBP比較,差異均無統計學意義(P>0.05)(表1)。PDR組患者FPG、HbAlc均明顯高于NPDR組、NDR組、對照組,差異均有統計學意義(P<0.05);4組患者間HDL-C、LDL-C、TG、TC比較,差異無均統計學意義(P>0.05)(表2)。
 )
)
所有受檢者均空腹抽取肘靜脈血5 ml,離心后留取血清,置入?70 ℃冰箱保存。采用ELISA法測定血清VEGF、apelin、HO-1;試劑盒購自美國RD公司,操作過程均嚴格按照試劑盒說明書進行。
采用SPSS20.0軟件行統計學分析。計量資料以均數±標準差( )表示。多組間比較采用單因素方差分析,組內兩兩比較采用SNK-q檢驗;兩組間比較采用成組t檢驗。計數資料比較采用χ2檢驗。根據受試者工作特征(ROC)曲線確定VEGF、apelin、HO-1預測PDR發生的臨界值,臨界值的確定以約登指數(靈敏度+特異性一1)最大為標準,并通過ROC曲線下面積(AUC)比較相關因素對PDR發生的預測價值,并確定其靈敏度和特異性、陽性和陰性預測值。AUC:0.5~0.7為預測價值較低;0.8~0.9為預測價值中等;>0.9為預測價值較高。靈敏度=真陽性/病例組,特異性=真陰性/對照組;陽性預測值=真陽性/(真陽性+假陽性),陰性預測值=真陰性/(真陰性+假陰性)。不同指標AUC比較采用Z檢驗。PDR患者血清VEGF、apelin、HO-1與臨床指標的相關性分析采用Pearson相關分析。P<0.05為差異有統計學意義。
)表示。多組間比較采用單因素方差分析,組內兩兩比較采用SNK-q檢驗;兩組間比較采用成組t檢驗。計數資料比較采用χ2檢驗。根據受試者工作特征(ROC)曲線確定VEGF、apelin、HO-1預測PDR發生的臨界值,臨界值的確定以約登指數(靈敏度+特異性一1)最大為標準,并通過ROC曲線下面積(AUC)比較相關因素對PDR發生的預測價值,并確定其靈敏度和特異性、陽性和陰性預測值。AUC:0.5~0.7為預測價值較低;0.8~0.9為預測價值中等;>0.9為預測價值較高。靈敏度=真陽性/病例組,特異性=真陰性/對照組;陽性預測值=真陽性/(真陽性+假陽性),陰性預測值=真陰性/(真陰性+假陰性)。不同指標AUC比較采用Z檢驗。PDR患者血清VEGF、apelin、HO-1與臨床指標的相關性分析采用Pearson相關分析。P<0.05為差異有統計學意義。
2 結果
PDR組患者血清VEGF、apelin明顯高于NPDR組、NDR組、對照組受檢者,且從對照組、NDR組、NPDR組依次遞增,差異均有統計學意義(P<0.05);HO-1明顯低于NPDR組、NDR組、對照組受檢者,且從對照組、NDR組、NPDR組依次遞減,差異均有統計學意義(P<0.05)(表3)。
 )
)
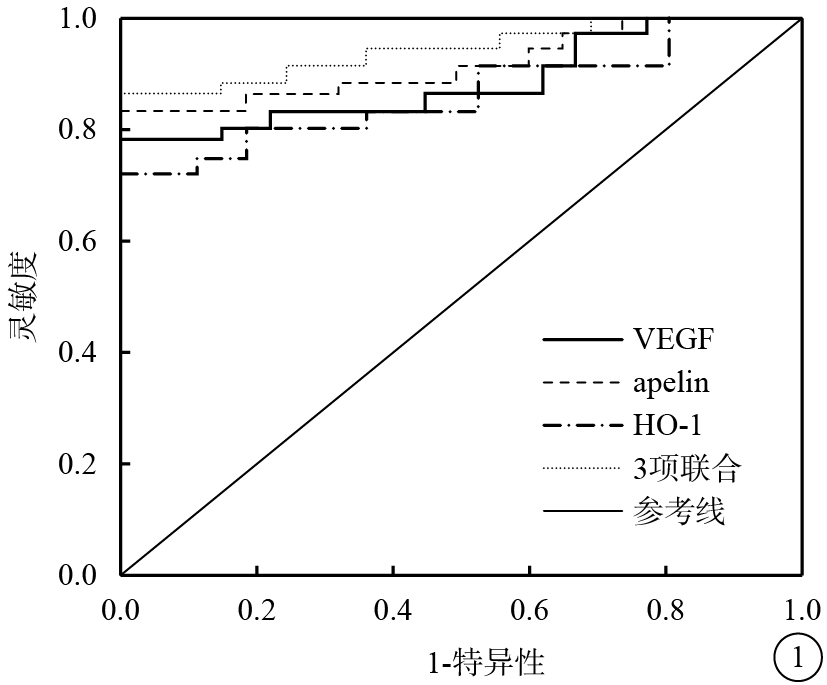
血清VEGF、apelin、HO-1水平聯合預測PDR的AUC為0.906(95%CI 0.849~0.962);VEGF、apelin、HO-1預測PDR的AUC分別為0.865(95%CI 0.775~0.898)、0.865(95%CI 0.806~0.926)、0.804(95%CI 0.746~0.866)。3項聯合預測PDR的AUC明顯高于單項預測,差異有統計學意義(Z=5.184、4.105、6.427,P<0.05)。血清VEGF、apelin、HO-1水平預測PDR的臨界值分別為162.50 pg/ml、8.30 ng/ml、27.13 mmol/L;3項聯合預測PDR的靈敏度和特異性分別為90.3%、83.0%(表4,圖1)。
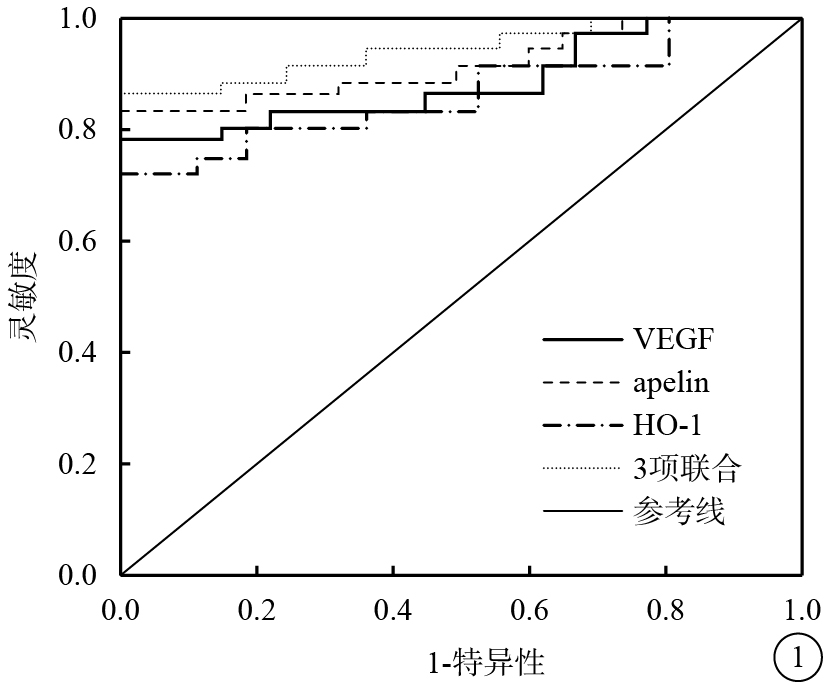 圖1
血清VEGF、apelin、HO-1水平預測PDR的ROC曲線圖
圖1
血清VEGF、apelin、HO-1水平預測PDR的ROC曲線圖
Pearson相關分析結果顯示,PDR患者血清VEGF、apelin、HO-1與DM病程、FPG、HbAlc均相關(P<0.05);與HDL-c、LDL-c、TG、TC無明顯相關(P>0.05)。PDR患者血清VEGF與apelin、HO-1均呈明顯相關(r=0.793、?0.594,P<0.01)(表5)。
3 討論
糖尿病患者長期處于高血糖狀態,過高的血糖可導致微血管結構及功能發生改變,DR是其較為常見的并發癥[6]。VEGF是一種常見的血管生成因子,具有肝素結合活性的二聚體糖蛋白,其主要作用是促進內皮細胞的增生和誘導新生血管的形成[7]。有研究表明,VEGF可影響正常眼血管和視網膜的血液供應,對維持和保護視網膜神經節細胞的功能有重要作用[8]。Apelin作為一種脂肪細胞因子,在機體炎癥反應、免疫應答及細胞生長發育、凋亡等多種病理生理過程中發揮著重要的作用[9]。近期有研究發現,apelin可刺激視網膜內皮細胞增生和視網膜新生血管形成[10]。HO-1是一種限速酶,也是一種應激蛋白,具有抗氧化、抗炎癥、抗凋亡及減少血管損傷等細胞保護作用[11]。有研究顯示,HO-1對DR的發展,尤其是對視網膜內皮細胞功能的失調及死亡具有一定作用[12]。
本研究結果顯示,PDR組患者DM病程、FPG、HbAlc明顯高于NPDR組、NDR組、對照組,數值呈遞減,差異有統計學意義,提示糖代謝異常在DR發病及病程進展中發揮著一定的作用,與既往研究結果相似[13]。分析其原因可能是糖代謝異常阻礙氧的擴散,血紅蛋白的非酶糖化,降低血紅蛋白攜帶氧的能力,而視網膜缺氧會導致DR病情加重。本研究結果顯示,與NPDR組、NDR組、對照組受試者比較,PDR組患者VEGF、apelin明顯升高,而HO-1明顯降低。其結果說明VEGF、apelin水平升高,HO-1水平降低可能參與DR發生及進展過程。Abu El-Asrar等[14]研究表明,VEGF參與DR的發生、發展,其水平異常與病情嚴重程度有密切關系。程金濤等[15]研究發現,DR患者血清apelin明顯升高,且病情越加重,apelin水平越高,提示apelin可能參與了DR發生及進展過程。亦有研究顯示,隨DR的進展,HO-1在視網膜組織中的表達降低,進而導致抗氧化應激作用降低,提示HO-1可能參與了DR的病情進展,其表達水平的降低可能加劇了DR的嚴重程度[16]。由此我們推測,高水平的HO-1可能是DR發生發展的保護因素。ROC曲線分析結果顯示,當血清VEGF、apelin分別超過162.50 pg/ml、8.30 ng/ml和HO-1低于27.13 mmol/L時,發生PDR的風險可能增加。3項聯合預測PDR的AUC為0.906,靈敏度(90.3%)和特異性(83.0%)較好,說明3項聯合檢測對預測PDR的發生價值較高。進一步相關分析發現,PDR患者血清VEGF、apelin、HO-1與DM病程、FPG、HbAlc均相關,血清VEGF與apelin、HO-1亦均呈相關。此結果進一步說明VEGF、apelin、HO-1與糖代謝異常之間可能存在密切聯系,共同參與PDR的發生過程。張小露[17]認為血清apelin水平在DR患者中顯著升高,且與患者DM病程、糖代謝異常有關,可作為評估DR病情進展的可靠指標。由此可見,DR患者血清VEGF、apelin高表達,而HO-1低表達,3者水平變化與DR病情嚴重程度有密切關系,同時VEGF、apelin及HO-1聯合檢測有助于預測PDR的發生。
本研究為回顧性病例分析,缺乏統一標準,DR分期也有所不同,為數據的比較帶來一定困難,眼內生長因子種類繁多,相互作用機制復雜,尚需要更多研究進一步探測其機制。
糖尿病視網膜病變(DR)主要病理改變為視網膜出血、滲出、微血管擴張及新生血管形成,但其具體發病機制目前尚未明確。近年研究發現,VEGF參與了視網膜的滲出、出血及視網膜新生血管形成,其水平變化與DR的發生發展具有一定相關性[1]。Apelin是一種新型脂肪細胞因子,屬于血管緊張素受體相關蛋白,參與視網膜內皮細胞增生及血管新生過程[2]。另有研究表明,血紅素氧合酶-1(HO-1)在高糖培養的視網膜細胞以及糖尿病(DM)動物模型的視網膜上存在異常表達[3]。VEGF、apelin及HO-1均與血管穩態、細胞增生及凋亡、機體炎癥、免疫反應等多種生理病理過程有關,但其與DR的關系尚未明確。本研究檢測了一組2型DM(T2DM)患者血清中VEGF、apelin、HO-1水平,分析其與DR發生的相關性。現將結果報道如下。
1 對象和方法
本研究是經海南西部中心醫院倫理委員會審核批準的回顧性病例研究(批準號:XBZXYY2014-JH0618);患者或監護人均獲知情并簽署書面同意書。
2014年1月至2017年12月在海南西部中心醫院內分泌科住院治療的T2DM患者208例納入研究。其中,男性116例,女性92例;年齡30~82歲,平均年齡(57.4±9.6)歲。納入標準:(1)均符合1999年WH0糖尿病專家委員會制定的DM診斷與分型標準[4];(2)未使用細胞毒制劑和免疫抑制劑,近4周內無服藥史,白細胞計數正常。排除標準:(1)1型DM和其他類型DM;(2)急慢性感染、肝腎疾病、風濕結締組織病、心腦血管病、惡性腫瘤者;(2)除DR外的其他眼部疾病以及眼底病變無法分級者。
患者均行視力、裂隙燈顯微鏡、間接檢眼鏡、FFA檢查。根據檢查結果并參照DR臨床診斷標準[5],將患者分為無DR(NDR)組、非生增生型DR(NPDR)組、增生型DR(PDR)組,分別為72、76、60例。選取同期我院體檢中心的健康體檢者50名作為對照組。其中,男性27名,女性23名;年齡34~78歲,平均年齡(56.8±9.3歲)。排除有全身及眼部疾病者;體重指數(BMI)≥25 kg/m2者。詳細記錄受檢者年齡、性別、DM病程、收縮壓(SBP)、舒張壓(DBP)、身高、體重、體重指數(BMI)。BMI=體重/身高2(kg/m2);空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-c)、低密度脂蛋白膽固醇(LDL-c)等實驗室指標。
PDR組患者DM病程明顯長于NDR組、NPDR組,差異均有統計學意義(P<0.05);對照組、NDR組、NPDR組、PDR組受檢者性別構成比、年齡、BMI、SBP、DBP比較,差異均無統計學意義(P>0.05)(表1)。PDR組患者FPG、HbAlc均明顯高于NPDR組、NDR組、對照組,差異均有統計學意義(P<0.05);4組患者間HDL-C、LDL-C、TG、TC比較,差異無均統計學意義(P>0.05)(表2)。
 )
)
所有受檢者均空腹抽取肘靜脈血5 ml,離心后留取血清,置入?70 ℃冰箱保存。采用ELISA法測定血清VEGF、apelin、HO-1;試劑盒購自美國RD公司,操作過程均嚴格按照試劑盒說明書進行。
采用SPSS20.0軟件行統計學分析。計量資料以均數±標準差( )表示。多組間比較采用單因素方差分析,組內兩兩比較采用SNK-q檢驗;兩組間比較采用成組t檢驗。計數資料比較采用χ2檢驗。根據受試者工作特征(ROC)曲線確定VEGF、apelin、HO-1預測PDR發生的臨界值,臨界值的確定以約登指數(靈敏度+特異性一1)最大為標準,并通過ROC曲線下面積(AUC)比較相關因素對PDR發生的預測價值,并確定其靈敏度和特異性、陽性和陰性預測值。AUC:0.5~0.7為預測價值較低;0.8~0.9為預測價值中等;>0.9為預測價值較高。靈敏度=真陽性/病例組,特異性=真陰性/對照組;陽性預測值=真陽性/(真陽性+假陽性),陰性預測值=真陰性/(真陰性+假陰性)。不同指標AUC比較采用Z檢驗。PDR患者血清VEGF、apelin、HO-1與臨床指標的相關性分析采用Pearson相關分析。P<0.05為差異有統計學意義。
)表示。多組間比較采用單因素方差分析,組內兩兩比較采用SNK-q檢驗;兩組間比較采用成組t檢驗。計數資料比較采用χ2檢驗。根據受試者工作特征(ROC)曲線確定VEGF、apelin、HO-1預測PDR發生的臨界值,臨界值的確定以約登指數(靈敏度+特異性一1)最大為標準,并通過ROC曲線下面積(AUC)比較相關因素對PDR發生的預測價值,并確定其靈敏度和特異性、陽性和陰性預測值。AUC:0.5~0.7為預測價值較低;0.8~0.9為預測價值中等;>0.9為預測價值較高。靈敏度=真陽性/病例組,特異性=真陰性/對照組;陽性預測值=真陽性/(真陽性+假陽性),陰性預測值=真陰性/(真陰性+假陰性)。不同指標AUC比較采用Z檢驗。PDR患者血清VEGF、apelin、HO-1與臨床指標的相關性分析采用Pearson相關分析。P<0.05為差異有統計學意義。
2 結果
PDR組患者血清VEGF、apelin明顯高于NPDR組、NDR組、對照組受檢者,且從對照組、NDR組、NPDR組依次遞增,差異均有統計學意義(P<0.05);HO-1明顯低于NPDR組、NDR組、對照組受檢者,且從對照組、NDR組、NPDR組依次遞減,差異均有統計學意義(P<0.05)(表3)。
 )
)
血清VEGF、apelin、HO-1水平聯合預測PDR的AUC為0.906(95%CI 0.849~0.962);VEGF、apelin、HO-1預測PDR的AUC分別為0.865(95%CI 0.775~0.898)、0.865(95%CI 0.806~0.926)、0.804(95%CI 0.746~0.866)。3項聯合預測PDR的AUC明顯高于單項預測,差異有統計學意義(Z=5.184、4.105、6.427,P<0.05)。血清VEGF、apelin、HO-1水平預測PDR的臨界值分別為162.50 pg/ml、8.30 ng/ml、27.13 mmol/L;3項聯合預測PDR的靈敏度和特異性分別為90.3%、83.0%(表4,圖1)。
 圖1
血清VEGF、apelin、HO-1水平預測PDR的ROC曲線圖
圖1
血清VEGF、apelin、HO-1水平預測PDR的ROC曲線圖
Pearson相關分析結果顯示,PDR患者血清VEGF、apelin、HO-1與DM病程、FPG、HbAlc均相關(P<0.05);與HDL-c、LDL-c、TG、TC無明顯相關(P>0.05)。PDR患者血清VEGF與apelin、HO-1均呈明顯相關(r=0.793、?0.594,P<0.01)(表5)。
3 討論
糖尿病患者長期處于高血糖狀態,過高的血糖可導致微血管結構及功能發生改變,DR是其較為常見的并發癥[6]。VEGF是一種常見的血管生成因子,具有肝素結合活性的二聚體糖蛋白,其主要作用是促進內皮細胞的增生和誘導新生血管的形成[7]。有研究表明,VEGF可影響正常眼血管和視網膜的血液供應,對維持和保護視網膜神經節細胞的功能有重要作用[8]。Apelin作為一種脂肪細胞因子,在機體炎癥反應、免疫應答及細胞生長發育、凋亡等多種病理生理過程中發揮著重要的作用[9]。近期有研究發現,apelin可刺激視網膜內皮細胞增生和視網膜新生血管形成[10]。HO-1是一種限速酶,也是一種應激蛋白,具有抗氧化、抗炎癥、抗凋亡及減少血管損傷等細胞保護作用[11]。有研究顯示,HO-1對DR的發展,尤其是對視網膜內皮細胞功能的失調及死亡具有一定作用[12]。
本研究結果顯示,PDR組患者DM病程、FPG、HbAlc明顯高于NPDR組、NDR組、對照組,數值呈遞減,差異有統計學意義,提示糖代謝異常在DR發病及病程進展中發揮著一定的作用,與既往研究結果相似[13]。分析其原因可能是糖代謝異常阻礙氧的擴散,血紅蛋白的非酶糖化,降低血紅蛋白攜帶氧的能力,而視網膜缺氧會導致DR病情加重。本研究結果顯示,與NPDR組、NDR組、對照組受試者比較,PDR組患者VEGF、apelin明顯升高,而HO-1明顯降低。其結果說明VEGF、apelin水平升高,HO-1水平降低可能參與DR發生及進展過程。Abu El-Asrar等[14]研究表明,VEGF參與DR的發生、發展,其水平異常與病情嚴重程度有密切關系。程金濤等[15]研究發現,DR患者血清apelin明顯升高,且病情越加重,apelin水平越高,提示apelin可能參與了DR發生及進展過程。亦有研究顯示,隨DR的進展,HO-1在視網膜組織中的表達降低,進而導致抗氧化應激作用降低,提示HO-1可能參與了DR的病情進展,其表達水平的降低可能加劇了DR的嚴重程度[16]。由此我們推測,高水平的HO-1可能是DR發生發展的保護因素。ROC曲線分析結果顯示,當血清VEGF、apelin分別超過162.50 pg/ml、8.30 ng/ml和HO-1低于27.13 mmol/L時,發生PDR的風險可能增加。3項聯合預測PDR的AUC為0.906,靈敏度(90.3%)和特異性(83.0%)較好,說明3項聯合檢測對預測PDR的發生價值較高。進一步相關分析發現,PDR患者血清VEGF、apelin、HO-1與DM病程、FPG、HbAlc均相關,血清VEGF與apelin、HO-1亦均呈相關。此結果進一步說明VEGF、apelin、HO-1與糖代謝異常之間可能存在密切聯系,共同參與PDR的發生過程。張小露[17]認為血清apelin水平在DR患者中顯著升高,且與患者DM病程、糖代謝異常有關,可作為評估DR病情進展的可靠指標。由此可見,DR患者血清VEGF、apelin高表達,而HO-1低表達,3者水平變化與DR病情嚴重程度有密切關系,同時VEGF、apelin及HO-1聯合檢測有助于預測PDR的發生。
本研究為回顧性病例分析,缺乏統一標準,DR分期也有所不同,為數據的比較帶來一定困難,眼內生長因子種類繁多,相互作用機制復雜,尚需要更多研究進一步探測其機制。