引用本文: 田芳, 胡博杰, 李文博, 黃亮瑜, 高美子, 蘇睿虹, 張曉敏, 李筱榮, 東莉潔. 高表達多聚嘧啶序列結合蛋白相關剪接因子對糖基化終產物誘導下視網膜Müller細胞凋亡的影響. 中華眼底病雜志, 2019, 35(1): 70-75. doi: 10.3760/cma.j.issn.1005-1015.2019.01.015 復制
近年來有研究表明,糖尿病視網膜病變(DR)視網膜神經系統病理改變先于視網膜微血管損害的出現,提示DR是一種神經血管性疾病[1-4]。視網膜Müller細胞是貫穿于視網膜全層的神經膠質細胞,主要參與調節視網膜神經元和血管的穩態平衡,對維持視網膜的正常生理功能起著重要作用[5-6]。糖基化終產物(AGEs)是一組在糖尿病患者體內高糖環境下由還原糖、蛋白質、脂類或核酸等有機大分子生成的不可逆非酶促反應終產物,可能在DR發生發展中發揮重要作用[7-14]。多聚嘧啶束結合蛋白相關剪接因子(PSF)是一種多功能蛋白,其可以通過下調VEGF表達而抑制氧誘導視網膜病變小鼠視網膜新生血管形成[15-17]。本研究選用AGEs誘導Müller細胞以期實現在一定程度上模擬糖尿病患者眼部的微環境特征,觀察分析了PSF高表達對AGEs誘導下Müller細胞凋亡的影響,以期為進一步探討DR的調控機制提供依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞鑒定及實驗分組
人Müller細胞株(MIO-M1)由天津醫科大學眼科醫院柯屹峰老師惠贈。真核細胞表達載體增強型綠色熒光蛋白(pEGFP)-PSF由本實驗室自行構建。糖基化修飾的牛血清白蛋白(美國BioVision公司),MTT(北京索萊寶科技有限公司),抗膠質纖維酸性蛋白(GFAP)抗體(ab7260)和抗谷氨酰胺合成酶(GS)抗體(ab64613,英國Abcam公司),DAPI(P36931)、Hoechst 33258染色劑(上海翊圣生物科技有限公司),ELISA細胞凋亡試劑盒(瑞士羅氏公司),2’,7’-二氯熒光素二乙酸酯(DCFH-DA,美國Sigma公司),轉染試劑脂質體2000(美國Invitrogen公司)。
以3×105個/ml的細胞密度將細胞接種于12孔板中,待細胞匯合至70%左右,棄去培養基,PBS洗細胞3次,3 min/次。依據所使用抗體的要求,100%甲醇 500 μl固定10 min,PBS洗細胞3次,5 min/次。用0.5% Triton X-100/PBS 500 μl室溫破膜10 min,PBS洗細胞3次,5 min/次。用10%山羊血清500 μl室溫作用1 h,分別加入一抗(抗GFAP、GS抗體),4℃過夜后,PBS清洗3次,3 min/次;加入二抗,室溫避光孵育2 h,PBS清洗3次,3 min/次;加入DAPI 1滴室溫作用10 min后封片,熒光倒置顯微鏡觀察。
將細胞密度為3.5×104個/ml的細胞爬片置于24、96孔細胞培養板中,待細胞融合度約70%時將其分為正常細胞組(N組)、空白對照組(N+AGEs組)、空載體對照組(Vec+AGEs組)及PSF高表達組(PSF+AGEs組)。N組為常規培養的Müller細胞;N+AGEs組僅做轉染處理但不導入任何外源性基因的Müller細胞,同時聯合AGEs誘導;Vec+AGEs組利用轉染試劑脂質體2000將pEGFP空載體導入Müller細胞聯合AGEs誘導;PSF+AGEs組利用轉染試劑脂質體2000將pEGFP-PSF真核表達質粒導入Müller細胞聯合AGEs誘導。N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞轉染24 h后再應用AGEs(150μg/ml)誘導細胞72 h,隨后進行后續實驗。采用免疫印跡法明確pEGFP-PSF質粒的轉染效率達到過表達。
1.2 PSF高表達對Müller細胞形態、生存力、凋亡及細胞中ROS水平的影響
采用HE染色觀察各組細胞形態。各實驗組細胞終止培養后取出蓋玻片,PBS清洗細胞3次,3 min/次;4%多聚甲醛固定10 min,PBS清洗2次,1 min/次;0.5% Triton X-100/PBS破膜室溫5 min,PBS清洗2次,1 min/次;浸入蘇木精染液中,染色30 s,自來水沖洗,浸入稀鹽酸酒精溶液進行分色(數秒鐘),自來水沖洗,浸入淡氨水中使胞核藍化(數秒鐘),自來水浸洗,浸入伊紅染液中1 min,自來水浸洗。經70%、80%、90%、95%酒精各1次進行逐級脫水,每次數秒鐘,通過二甲苯透明,30 s/次。在載玻片上滴加中性樹膠,將有細胞一面的蓋玻片向下封固于載玻片上,于光學顯微鏡下觀察細胞形態。
采用MTT比色法比較N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞生存力。各組細胞終止培養后棄培養液,細胞培養板中每孔加入110 μl MTT溶液,孵育4 h后每孔加入150 μl DMSO。采用酶聯免疫檢測儀測量波長490 nm處的吸光度[A,舊稱光密度(OD)]值。每組設3個副孔,實驗重復3次。
采用Hoechst 33258染色方法觀察各組細胞形態。各組細胞終止培養后棄培養液,PBS漂洗3次,1 min/次;4%多聚甲醛固定10 min,PBS漂洗3次,5 min/次;用終濃度5 mg/L的Hoechst 33258熒光染料避光孵育10 min,PBS清洗3次,5 min/次。熒光顯微鏡下觀察,拍照。
采用ELISA細胞凋亡試劑盒定量分析N+AGEs組、Vec+AGEs組及PSF+AGEs組的細胞凋亡值。實驗方法依據試劑盒說明書進行。采用酶聯免疫檢測儀測量波長450 nm處的A值。每組設3個副孔,實驗重復3次。
采用DCFH-DA法檢測N+AGEs組、Vec+AGEs組及PSF+AGEs組細胞內ROS水平。各組細胞終止培養后利用PBS洗1次,并換上終濃度為25 μmol/L DCFH-DA培養箱孵育30 min后PBS洗2次。酶標儀測量分析各組細胞內ROS水平。每組設3個副孔,實驗重復3次。
1.3 統計學方法
采用SPSS18.0軟件進行統計學分析。采用Graphprism軟件對所獲得數據進行圖表整理。首先對數據進行方差齊性檢驗,再利用Dunnett進行各實驗組與對照組之間的兩兩比較。P<0.05為差異有統計學意義。
2 結果
倒置相差顯微鏡觀察發現,Müller細胞胞質豐富,胞體狹長,兩端突起,呈梭形或不規則形狀單層生長。GFAP免疫細胞化學熒光染色鑒定結果顯示,95%以上細胞GFAP、GS染色陽性,均表現為胞漿內綠色熒光;DAPI細胞核染色顯示細胞核呈圓形,染色均一(圖1)。
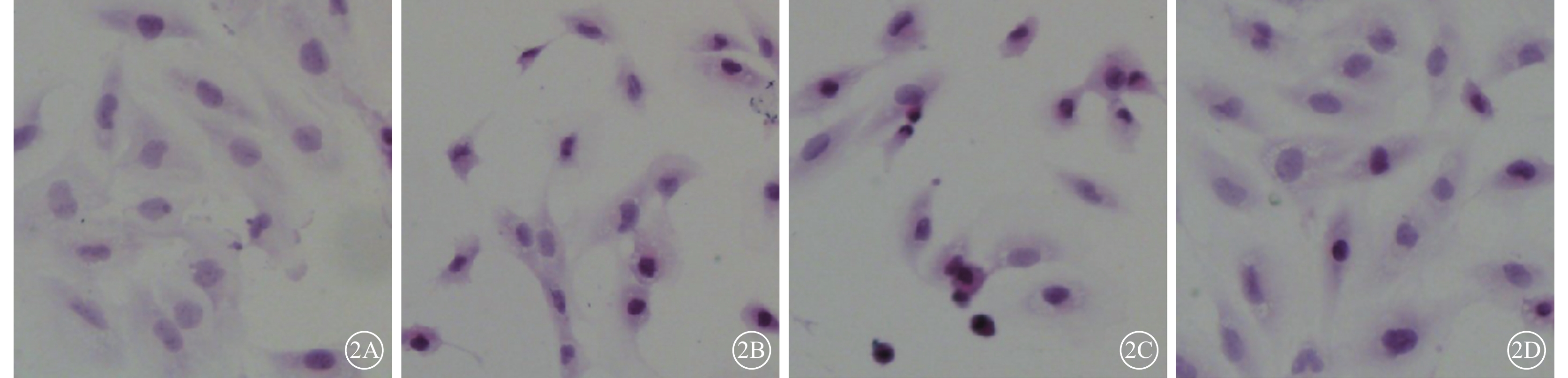
光學顯微鏡觀察發現,N組細胞形態飽滿,胞漿染色均一,細胞核呈圓形,胞質豐富,胞體狹長,兩端突起,呈梭形或不規則形狀單層生長;N+AGEs組及Vec+AGEs組細胞體積縮小,胞質致密濃縮,嗜酸性染色增強;PSF+AGEs組細胞形態尚飽滿,胞漿染色較均勻,偶見體積縮小(圖2)。
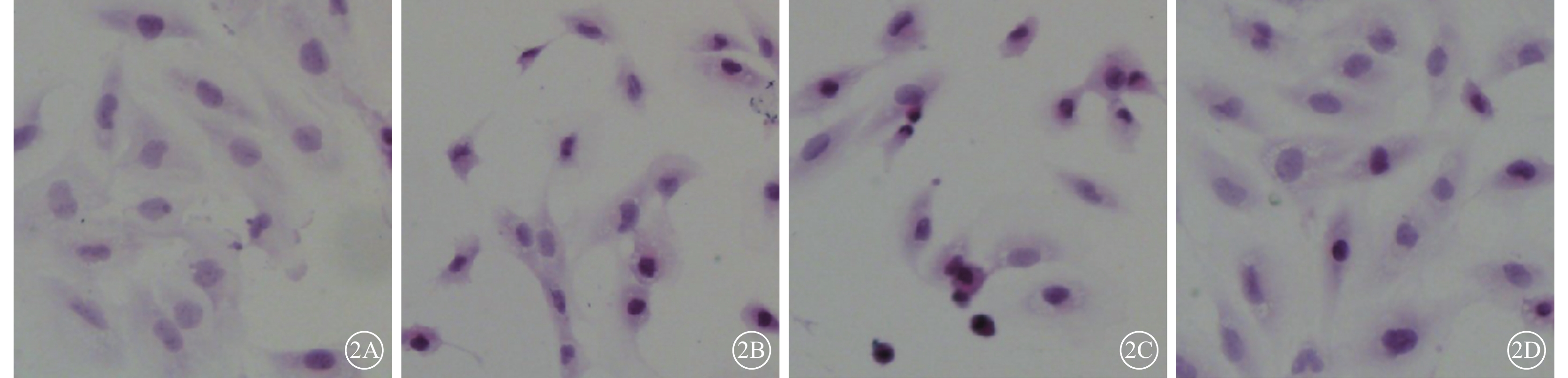 圖2
各組細胞光學顯微鏡像。2A~2D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞形態飽滿;N+AGEs組、Vec+AGEs組細胞形態皺縮;PSF+AGEs組細胞形態尚飽滿 HE ×80
圖2
各組細胞光學顯微鏡像。2A~2D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞形態飽滿;N+AGEs組、Vec+AGEs組細胞形態皺縮;PSF+AGEs組細胞形態尚飽滿 HE ×80
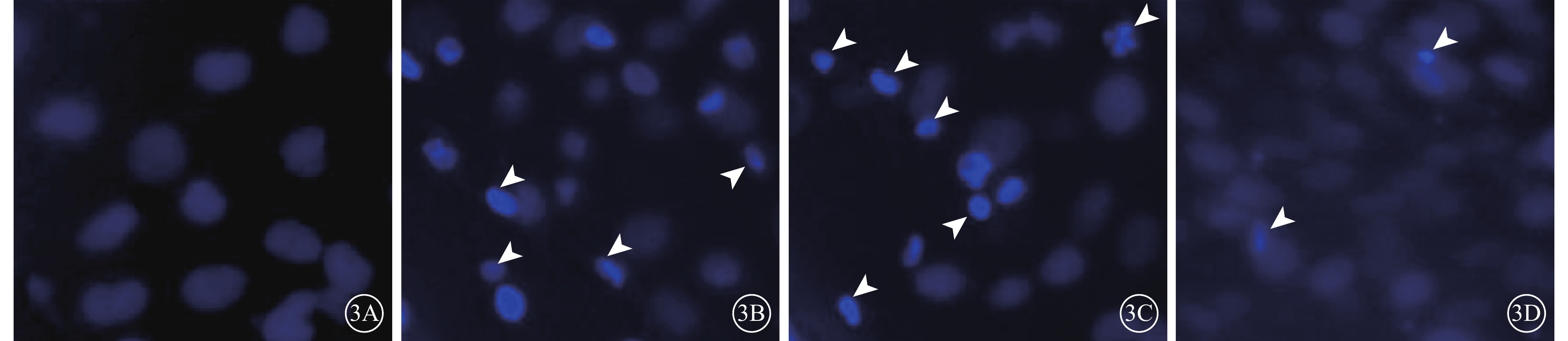
熒光顯微鏡觀察發現,N組細胞核呈圓形,染色均一;N+AGEs、Vec+AGEs組細胞核則表現為致密濃染,皺縮變小或呈碎塊狀;PSF+AGEs組細胞部分細胞核呈新月狀,并且細胞核碎裂減少(圖3)。
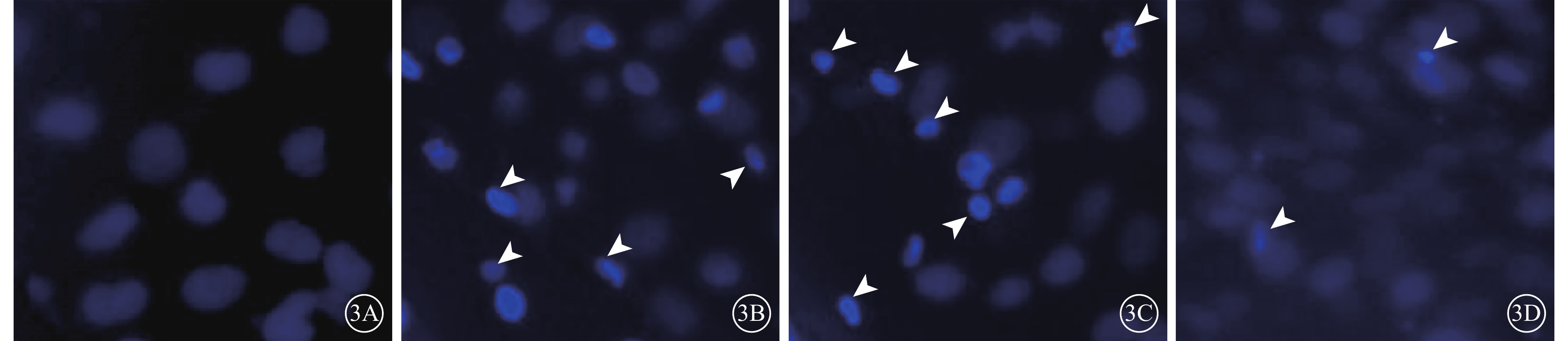 圖3
各組細胞熒光顯微鏡像。3A~3D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞核形態完整;N+AGEs組、Vec+AGEs組細胞核固縮碎裂(白箭頭);PSF+AGEs碎裂減少(白箭頭) ×80
圖3
各組細胞熒光顯微鏡像。3A~3D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞核形態完整;N+AGEs組、Vec+AGEs組細胞核固縮碎裂(白箭頭);PSF+AGEs碎裂減少(白箭頭) ×80
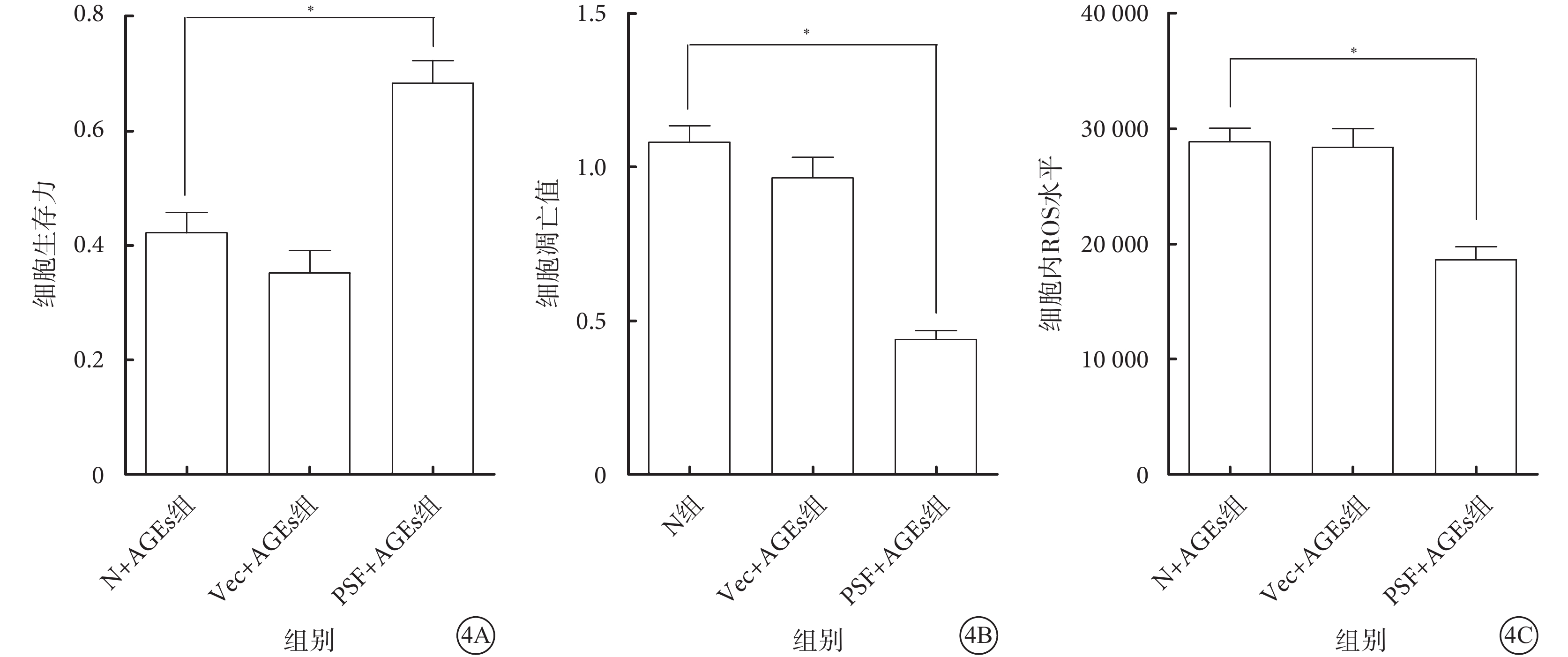
N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞生存力分別為0.42±0.11、0.35±0.12、0.68±0.12。PSF+AGEs組細胞生存力較N+AGEs組、Vec+AGEs組明顯提高,差異有統計學意義(F=20.65,P=0.000)(圖4A)。
ELISA檢測結果顯示,N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞凋亡值分別為1.08±0.16、0.96±0.20、0.44±0.08。PSF+AGEs組細胞凋亡值較N+AGEs組、Vec+AGEs組明顯降低,差異有統計學意義(F=43.43,P=0.000)(圖4B)。
DCFH-DA法檢測發現,N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞內ROS水平分別為28 833.67±3 550.06、28 356.67±4 854.81、18 616.00±3 382.54。PSF+AGEs組細胞內ROS水平較N+AGEs組、Vec+AGEs組明顯降低,差異有統計學意義(F=18.86,P=0.000)(圖4C)。
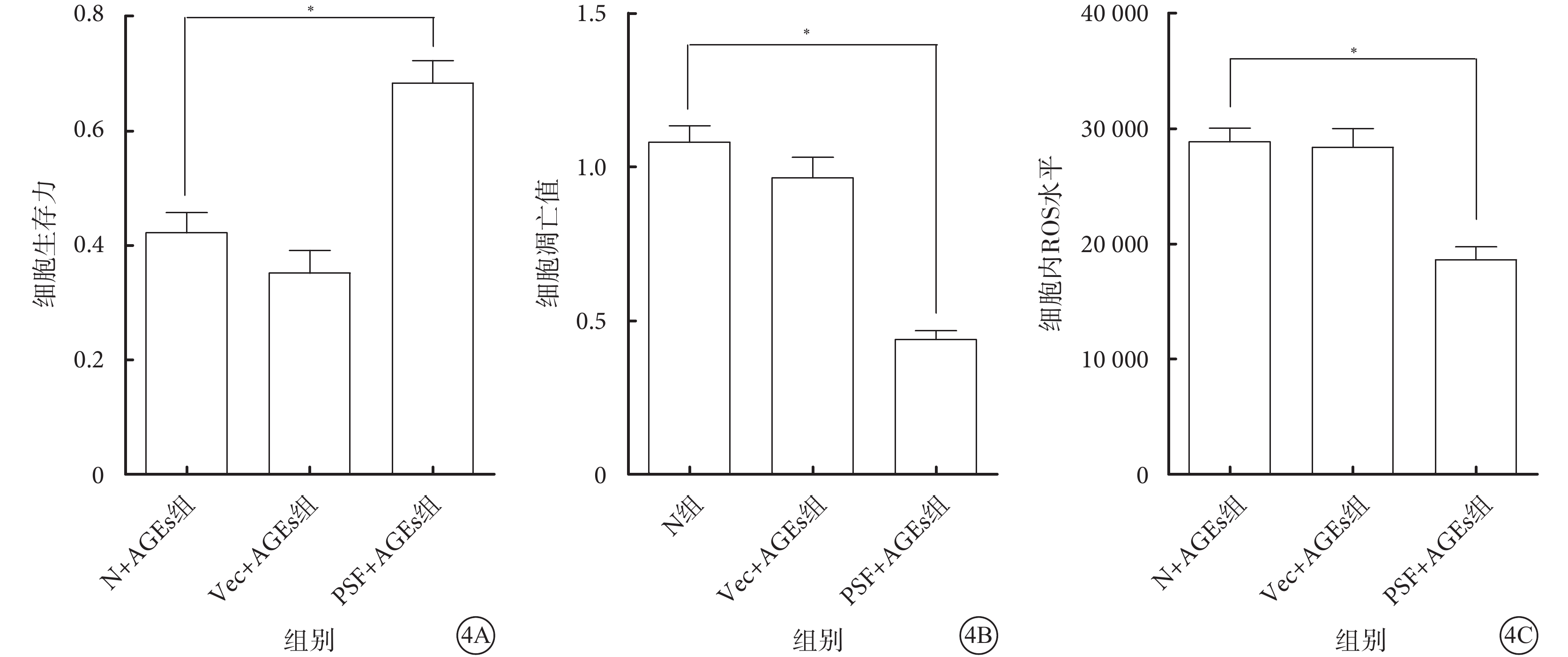 圖4
各組細胞生存力、凋亡率及細胞內ROS水平比較。4A示細胞生存力;4B示細胞凋亡率;4C示細胞內ROS水平。*P<0.05
圖4
各組細胞生存力、凋亡率及細胞內ROS水平比較。4A示細胞生存力;4B示細胞凋亡率;4C示細胞內ROS水平。*P<0.05
3 討論
AGEs與血糖控制狀況和病變的嚴重程度密切相關[8]。一系列研究結果顯示,AGEs可誘導視網膜移植體的神經膠質細胞反應以及神經元細胞變性[11]。AGEs受體參與調控高糖誘導的Müller細胞炎癥反應,AGEs刺激Müller細胞VEGF及堿性成纖維細胞因子的表達,且大鼠DR模型中AGEs的堆積可以導致Müller細胞功能障礙[12-14]。這提示AGEs在DR發生發展的過程中發揮重要作用。PSF是一種多功能蛋白,可抑制成年斑馬魚視神經的再生[1-3]。此外,PSF還通過調節細胞因子信號抑制物3的表達間接參與視神經再生的調控,這一發現對視神經損傷性疾病有重要的學術意義和潛在的應用價值[5-7]。本課題組的研究工作一直圍繞PSF對于眼科疾病的調控作用展開[15-17],本研究將PSF引入人視網膜Müller細胞模型中,并利用AGEs作為誘導劑刺激Müller細胞,探討PSF高表達對AGEs作用下Müller細胞的影響。
本研究結果顯示,正常培養的Müller細胞形態飽滿,胞漿染色均一,細胞核呈圓形;經AGEs刺激后細胞出現體積變小,細胞質濃縮,染色質高度凝聚、邊緣化等相關表現。同時我們應用MTT法發現,AGEs刺激可顯著下調Müller細胞的生存力。這些現象均提示AGEs刺激導致Müller細胞受損。
我們進一步通過Hoechst 33258染色示蹤細胞核的改變,結果顯示經AGEs刺激后細胞核皺縮變小,皺縮甚至碎裂。這些現象表征細胞凋亡程序的啟動。這提示PSF高表達可有效改善Müller細胞的形態學改變,顯著上調Müller細胞生存力,緩解AGEs誘導的Müller細胞的損傷,下調Müller細胞凋亡率。為明確AGEs是否可以誘導Müller細胞凋亡,我們進一步利用凋亡檢測試劑盒對各組Müller細胞進行定量分析。結果顯示,AGEs誘導可以導致Müller細胞凋亡,而PSF高表達可以抑制Müller細胞的凋亡。這提示PSF是Müller細胞凋亡的潛在保護因子。
氧化應激是指體內ROS的產生和抗氧化防御體系之間失衡,導致ROS聚集對組織造成損傷的病理狀態[18]。誘導ROS產生是AGEs導致組織損傷的一條重要途徑。有研究表明,ROS導致的氧化應激是細胞凋亡的一個重要觸發因素[19-23]。為初步了解PSF蛋白抑制AGEs誘導的Müller細胞凋亡的途徑,我們檢測PSF高表達對于AGEs誘導的Müller細胞ROS表達情況的影響。結果顯示,PSF高表達可以顯著下調AGEs誘導的Müller細胞ROS表達。綜合本研究實驗結果,我們推測PSF蛋白或可通過抑制AGEs誘導的氧化應激反應造成ROS堆積,從而維持Müller細胞的穩態平衡,緩解Müller細胞凋亡。這提示PSF蛋白有望成為臨床中預防和治療DR的潛在生物學靶點。但由于本研究僅在體外實驗中對相關假設進行了驗證,得到的只是初步結論;今后我們還將在動物實驗中驗證PSF蛋白保護Müller細胞免受AGEs誘導的氧化應激損害的具體機制,為PSF在臨床中的應用奠定理論基礎。
近年來有研究表明,糖尿病視網膜病變(DR)視網膜神經系統病理改變先于視網膜微血管損害的出現,提示DR是一種神經血管性疾病[1-4]。視網膜Müller細胞是貫穿于視網膜全層的神經膠質細胞,主要參與調節視網膜神經元和血管的穩態平衡,對維持視網膜的正常生理功能起著重要作用[5-6]。糖基化終產物(AGEs)是一組在糖尿病患者體內高糖環境下由還原糖、蛋白質、脂類或核酸等有機大分子生成的不可逆非酶促反應終產物,可能在DR發生發展中發揮重要作用[7-14]。多聚嘧啶束結合蛋白相關剪接因子(PSF)是一種多功能蛋白,其可以通過下調VEGF表達而抑制氧誘導視網膜病變小鼠視網膜新生血管形成[15-17]。本研究選用AGEs誘導Müller細胞以期實現在一定程度上模擬糖尿病患者眼部的微環境特征,觀察分析了PSF高表達對AGEs誘導下Müller細胞凋亡的影響,以期為進一步探討DR的調控機制提供依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料、細胞鑒定及實驗分組
人Müller細胞株(MIO-M1)由天津醫科大學眼科醫院柯屹峰老師惠贈。真核細胞表達載體增強型綠色熒光蛋白(pEGFP)-PSF由本實驗室自行構建。糖基化修飾的牛血清白蛋白(美國BioVision公司),MTT(北京索萊寶科技有限公司),抗膠質纖維酸性蛋白(GFAP)抗體(ab7260)和抗谷氨酰胺合成酶(GS)抗體(ab64613,英國Abcam公司),DAPI(P36931)、Hoechst 33258染色劑(上海翊圣生物科技有限公司),ELISA細胞凋亡試劑盒(瑞士羅氏公司),2’,7’-二氯熒光素二乙酸酯(DCFH-DA,美國Sigma公司),轉染試劑脂質體2000(美國Invitrogen公司)。
以3×105個/ml的細胞密度將細胞接種于12孔板中,待細胞匯合至70%左右,棄去培養基,PBS洗細胞3次,3 min/次。依據所使用抗體的要求,100%甲醇 500 μl固定10 min,PBS洗細胞3次,5 min/次。用0.5% Triton X-100/PBS 500 μl室溫破膜10 min,PBS洗細胞3次,5 min/次。用10%山羊血清500 μl室溫作用1 h,分別加入一抗(抗GFAP、GS抗體),4℃過夜后,PBS清洗3次,3 min/次;加入二抗,室溫避光孵育2 h,PBS清洗3次,3 min/次;加入DAPI 1滴室溫作用10 min后封片,熒光倒置顯微鏡觀察。
將細胞密度為3.5×104個/ml的細胞爬片置于24、96孔細胞培養板中,待細胞融合度約70%時將其分為正常細胞組(N組)、空白對照組(N+AGEs組)、空載體對照組(Vec+AGEs組)及PSF高表達組(PSF+AGEs組)。N組為常規培養的Müller細胞;N+AGEs組僅做轉染處理但不導入任何外源性基因的Müller細胞,同時聯合AGEs誘導;Vec+AGEs組利用轉染試劑脂質體2000將pEGFP空載體導入Müller細胞聯合AGEs誘導;PSF+AGEs組利用轉染試劑脂質體2000將pEGFP-PSF真核表達質粒導入Müller細胞聯合AGEs誘導。N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞轉染24 h后再應用AGEs(150μg/ml)誘導細胞72 h,隨后進行后續實驗。采用免疫印跡法明確pEGFP-PSF質粒的轉染效率達到過表達。
1.2 PSF高表達對Müller細胞形態、生存力、凋亡及細胞中ROS水平的影響
采用HE染色觀察各組細胞形態。各實驗組細胞終止培養后取出蓋玻片,PBS清洗細胞3次,3 min/次;4%多聚甲醛固定10 min,PBS清洗2次,1 min/次;0.5% Triton X-100/PBS破膜室溫5 min,PBS清洗2次,1 min/次;浸入蘇木精染液中,染色30 s,自來水沖洗,浸入稀鹽酸酒精溶液進行分色(數秒鐘),自來水沖洗,浸入淡氨水中使胞核藍化(數秒鐘),自來水浸洗,浸入伊紅染液中1 min,自來水浸洗。經70%、80%、90%、95%酒精各1次進行逐級脫水,每次數秒鐘,通過二甲苯透明,30 s/次。在載玻片上滴加中性樹膠,將有細胞一面的蓋玻片向下封固于載玻片上,于光學顯微鏡下觀察細胞形態。
采用MTT比色法比較N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞生存力。各組細胞終止培養后棄培養液,細胞培養板中每孔加入110 μl MTT溶液,孵育4 h后每孔加入150 μl DMSO。采用酶聯免疫檢測儀測量波長490 nm處的吸光度[A,舊稱光密度(OD)]值。每組設3個副孔,實驗重復3次。
采用Hoechst 33258染色方法觀察各組細胞形態。各組細胞終止培養后棄培養液,PBS漂洗3次,1 min/次;4%多聚甲醛固定10 min,PBS漂洗3次,5 min/次;用終濃度5 mg/L的Hoechst 33258熒光染料避光孵育10 min,PBS清洗3次,5 min/次。熒光顯微鏡下觀察,拍照。
采用ELISA細胞凋亡試劑盒定量分析N+AGEs組、Vec+AGEs組及PSF+AGEs組的細胞凋亡值。實驗方法依據試劑盒說明書進行。采用酶聯免疫檢測儀測量波長450 nm處的A值。每組設3個副孔,實驗重復3次。
采用DCFH-DA法檢測N+AGEs組、Vec+AGEs組及PSF+AGEs組細胞內ROS水平。各組細胞終止培養后利用PBS洗1次,并換上終濃度為25 μmol/L DCFH-DA培養箱孵育30 min后PBS洗2次。酶標儀測量分析各組細胞內ROS水平。每組設3個副孔,實驗重復3次。
1.3 統計學方法
采用SPSS18.0軟件進行統計學分析。采用Graphprism軟件對所獲得數據進行圖表整理。首先對數據進行方差齊性檢驗,再利用Dunnett進行各實驗組與對照組之間的兩兩比較。P<0.05為差異有統計學意義。
2 結果
倒置相差顯微鏡觀察發現,Müller細胞胞質豐富,胞體狹長,兩端突起,呈梭形或不規則形狀單層生長。GFAP免疫細胞化學熒光染色鑒定結果顯示,95%以上細胞GFAP、GS染色陽性,均表現為胞漿內綠色熒光;DAPI細胞核染色顯示細胞核呈圓形,染色均一(圖1)。
光學顯微鏡觀察發現,N組細胞形態飽滿,胞漿染色均一,細胞核呈圓形,胞質豐富,胞體狹長,兩端突起,呈梭形或不規則形狀單層生長;N+AGEs組及Vec+AGEs組細胞體積縮小,胞質致密濃縮,嗜酸性染色增強;PSF+AGEs組細胞形態尚飽滿,胞漿染色較均勻,偶見體積縮小(圖2)。
 圖2
各組細胞光學顯微鏡像。2A~2D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞形態飽滿;N+AGEs組、Vec+AGEs組細胞形態皺縮;PSF+AGEs組細胞形態尚飽滿 HE ×80
圖2
各組細胞光學顯微鏡像。2A~2D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞形態飽滿;N+AGEs組、Vec+AGEs組細胞形態皺縮;PSF+AGEs組細胞形態尚飽滿 HE ×80
熒光顯微鏡觀察發現,N組細胞核呈圓形,染色均一;N+AGEs、Vec+AGEs組細胞核則表現為致密濃染,皺縮變小或呈碎塊狀;PSF+AGEs組細胞部分細胞核呈新月狀,并且細胞核碎裂減少(圖3)。
 圖3
各組細胞熒光顯微鏡像。3A~3D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞核形態完整;N+AGEs組、Vec+AGEs組細胞核固縮碎裂(白箭頭);PSF+AGEs碎裂減少(白箭頭) ×80
圖3
各組細胞熒光顯微鏡像。3A~3D分別示N組、N+AGEs組、Vec+AGEs組、PSF+AGEs組。N組細胞核形態完整;N+AGEs組、Vec+AGEs組細胞核固縮碎裂(白箭頭);PSF+AGEs碎裂減少(白箭頭) ×80
N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞生存力分別為0.42±0.11、0.35±0.12、0.68±0.12。PSF+AGEs組細胞生存力較N+AGEs組、Vec+AGEs組明顯提高,差異有統計學意義(F=20.65,P=0.000)(圖4A)。
ELISA檢測結果顯示,N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞凋亡值分別為1.08±0.16、0.96±0.20、0.44±0.08。PSF+AGEs組細胞凋亡值較N+AGEs組、Vec+AGEs組明顯降低,差異有統計學意義(F=43.43,P=0.000)(圖4B)。
DCFH-DA法檢測發現,N+AGEs組、Vec+AGEs組、PSF+AGEs組細胞內ROS水平分別為28 833.67±3 550.06、28 356.67±4 854.81、18 616.00±3 382.54。PSF+AGEs組細胞內ROS水平較N+AGEs組、Vec+AGEs組明顯降低,差異有統計學意義(F=18.86,P=0.000)(圖4C)。
 圖4
各組細胞生存力、凋亡率及細胞內ROS水平比較。4A示細胞生存力;4B示細胞凋亡率;4C示細胞內ROS水平。*P<0.05
圖4
各組細胞生存力、凋亡率及細胞內ROS水平比較。4A示細胞生存力;4B示細胞凋亡率;4C示細胞內ROS水平。*P<0.05
3 討論
AGEs與血糖控制狀況和病變的嚴重程度密切相關[8]。一系列研究結果顯示,AGEs可誘導視網膜移植體的神經膠質細胞反應以及神經元細胞變性[11]。AGEs受體參與調控高糖誘導的Müller細胞炎癥反應,AGEs刺激Müller細胞VEGF及堿性成纖維細胞因子的表達,且大鼠DR模型中AGEs的堆積可以導致Müller細胞功能障礙[12-14]。這提示AGEs在DR發生發展的過程中發揮重要作用。PSF是一種多功能蛋白,可抑制成年斑馬魚視神經的再生[1-3]。此外,PSF還通過調節細胞因子信號抑制物3的表達間接參與視神經再生的調控,這一發現對視神經損傷性疾病有重要的學術意義和潛在的應用價值[5-7]。本課題組的研究工作一直圍繞PSF對于眼科疾病的調控作用展開[15-17],本研究將PSF引入人視網膜Müller細胞模型中,并利用AGEs作為誘導劑刺激Müller細胞,探討PSF高表達對AGEs作用下Müller細胞的影響。
本研究結果顯示,正常培養的Müller細胞形態飽滿,胞漿染色均一,細胞核呈圓形;經AGEs刺激后細胞出現體積變小,細胞質濃縮,染色質高度凝聚、邊緣化等相關表現。同時我們應用MTT法發現,AGEs刺激可顯著下調Müller細胞的生存力。這些現象均提示AGEs刺激導致Müller細胞受損。
我們進一步通過Hoechst 33258染色示蹤細胞核的改變,結果顯示經AGEs刺激后細胞核皺縮變小,皺縮甚至碎裂。這些現象表征細胞凋亡程序的啟動。這提示PSF高表達可有效改善Müller細胞的形態學改變,顯著上調Müller細胞生存力,緩解AGEs誘導的Müller細胞的損傷,下調Müller細胞凋亡率。為明確AGEs是否可以誘導Müller細胞凋亡,我們進一步利用凋亡檢測試劑盒對各組Müller細胞進行定量分析。結果顯示,AGEs誘導可以導致Müller細胞凋亡,而PSF高表達可以抑制Müller細胞的凋亡。這提示PSF是Müller細胞凋亡的潛在保護因子。
氧化應激是指體內ROS的產生和抗氧化防御體系之間失衡,導致ROS聚集對組織造成損傷的病理狀態[18]。誘導ROS產生是AGEs導致組織損傷的一條重要途徑。有研究表明,ROS導致的氧化應激是細胞凋亡的一個重要觸發因素[19-23]。為初步了解PSF蛋白抑制AGEs誘導的Müller細胞凋亡的途徑,我們檢測PSF高表達對于AGEs誘導的Müller細胞ROS表達情況的影響。結果顯示,PSF高表達可以顯著下調AGEs誘導的Müller細胞ROS表達。綜合本研究實驗結果,我們推測PSF蛋白或可通過抑制AGEs誘導的氧化應激反應造成ROS堆積,從而維持Müller細胞的穩態平衡,緩解Müller細胞凋亡。這提示PSF蛋白有望成為臨床中預防和治療DR的潛在生物學靶點。但由于本研究僅在體外實驗中對相關假設進行了驗證,得到的只是初步結論;今后我們還將在動物實驗中驗證PSF蛋白保護Müller細胞免受AGEs誘導的氧化應激損害的具體機制,為PSF在臨床中的應用奠定理論基礎。