引用本文: 余川, 胡迭, 孟旭霞, 周賢慧, 曹博雯, 李曉慶, 陳雅楠. Delta樣配體4對早期糖尿病大鼠視網膜病理結構的影響及其與血管內皮生長因子受體-2的關系研究. 中華眼底病雜志, 2018, 34(6): 586-591. doi: 10.3760/cma.j.issn.1005-1015.2018.06.012 復制
Delta樣配體4(Dll-4)是哺乳動物中發現的Notch信號通路的重要配體,在視網膜血管新生中發揮重要調節作用[1]。我們前期的動物和臨床研究證實,Notch-1/Dll-4信號通路參與了糖尿病(DM)視網膜病變(DR)的發生發展過程,且與血管內皮生長因子(VEGF)信號通路相關[2-3]。VEGF與其受體(VEGFR)-2是重要的促新生血管因子,在DR發生發展中表達顯著升高,給予抗VEGF藥物治療可取得明顯療效[4-5];但抑制VEGF的表達并未完全抑制缺血導致的視網膜新生血管形成[6]。而DR中Dll-4所發揮的作用及其與VEGFR-2的關系目前尚不清楚。本研究旨在觀察Dll-4對早期DM大鼠視網膜病理結構的影響及其與VEGFR-2的關系,探討Dll-4在DR中所發揮的可能作用。現將結果報道如下。
1 材料和方法
雄性Sprague Dawley大鼠70只,2個月齡,體重約200 g,清潔級,青島派特福德白鼠養殖專業社提供。動物合格證號:SCXK(魯)20130001。實驗動物使用遵循國家科技委頒布的《實驗動物管理條例》。隨機數字表法將大鼠分為正常組和DM組,分別10、60只大鼠。DM組大鼠禁食、不禁飲12 h后,左下腹腔注射60 mg/kg劑量鏈脲佐菌素制作DM模型;72 h后經尾靜脈采血檢測空腹血糖≥16.7 mmol/L者視為造模成功。其后每個月測定1次血糖,剔除血糖恢復和死亡大鼠,最終50只大鼠納入統計。正常組大鼠腹腔注射等體積檸檬酸-檸檬酸鈉緩沖液。DM組隨機數字表法分為DM 1m組、DM 2m組、DM 3m組、DM 3m+Anti組、DM 3m+磷酸鹽緩液(PBS)組,各組均為10只大鼠。成模后3個月,DM3m+Anti組大鼠玻璃體腔注射抗Dll-4多克隆抗體4 μl,抗體濃度0.25 mg/ml[7-8];DM 3m+PBS組大鼠玻璃體腔注射等體積PBS。注射后兩組大鼠均無玻璃體積血、白內障、高眼壓等并發癥發生;注射后5 d,處死大鼠。其余各組大鼠不做任何處理,分別于成模后1、2、3個月處死,進行后續實驗。
蘇木精-伊紅(HE)染色觀察視網膜各層結構和微血管變化,并測量各組視網膜總厚度。400倍物鏡下,采集各組HE染色圖像,隨機數字表法從每組HE圖像中抽取6張,利用Image pro plus 6.0軟件進行視網膜厚度測定,測量每張HE圖像中視網膜總厚度的平均值。
免疫組織化學染色檢測視網膜血管內皮細胞內Dll-4的表達及視網膜中Dll-4、VEGFR-2的表達。大鼠腹腔過度麻醉處死,摘除眼球,4%多聚甲醛液固定24 h,常規脫水,石蠟包埋,平行于視神經矢狀軸,連續切片,厚度4 μm。石蠟切片后,常規脫蠟復水,行抗原修復,5%山羊血清封閉,按照試劑盒說明進行Dll-4、VEGFR-2免疫組織化學染色,二氨基苯聯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡觀察。PBS代替一抗作為陰性對照。細胞及組織內出現棕黃色顆粒為陽性表達。Image pro plus 6.0軟件計算免疫組織化學染色相應蛋白陽性部分的平均吸光度值[A,舊稱光密度(OD)](IA)值,代表相應蛋白的相對表達量。
熒光定量聚合酶鏈反應(PCR)檢測視網膜中Dll-4、VEGFR-2 mRNA的表達。處死大鼠后,取視網膜組織,每50~100 mg視網膜組織加入1 ml RNAiso plus進行裂解;提取總RNA,紫外分光光度計檢測其濃度和純度。A260/A280在1.6~2.1的樣本用于實驗。逆轉錄成cDNA后,加入PCR反應體系,SYBR Green Ⅰ嵌合熒光法擴增相應基因。退火溫度60 ℃,40個循環后形成擴增曲線,記錄Ct值。結果采用2?ΔΔCt公式(ΔΔCt=ΔCt待測樣品?ΔCt對照樣品,ΔCt=目的基因Ct值?內參基因Ct值)進行分析。以β-肌動蛋白(actin)作為內參照基因。引物序列:β-actin:正向引物:5′-CCCATCTATGAGGGTTACGC-3′,反向引物:5′-TTTAATGTCACGCACGATTTC-3′,引物長度150堿基對(bp)。Dll-4:正向引物:5′-AAGAATAGCGGCAGTGGTCGTAA-3′,反向引物:5′-CCTTGGATGATGATTTGGCTGA-3′,引物長度161 bp。VEGFR-2引物序列:正向引物:5′-GCGACCCCAAATTCCATTATG-3′,反向引物:5′-CTTCTGAGGCAAGGACCATCC-3′,引物長度180 bp。
采用SPSS19.0軟件進行統計分析。正態分布的數據采用均數±標準差(
 )表示。采用單因素方差分析比較各組表達差異;組間比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
)表示。采用單因素方差分析比較各組表達差異;組間比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
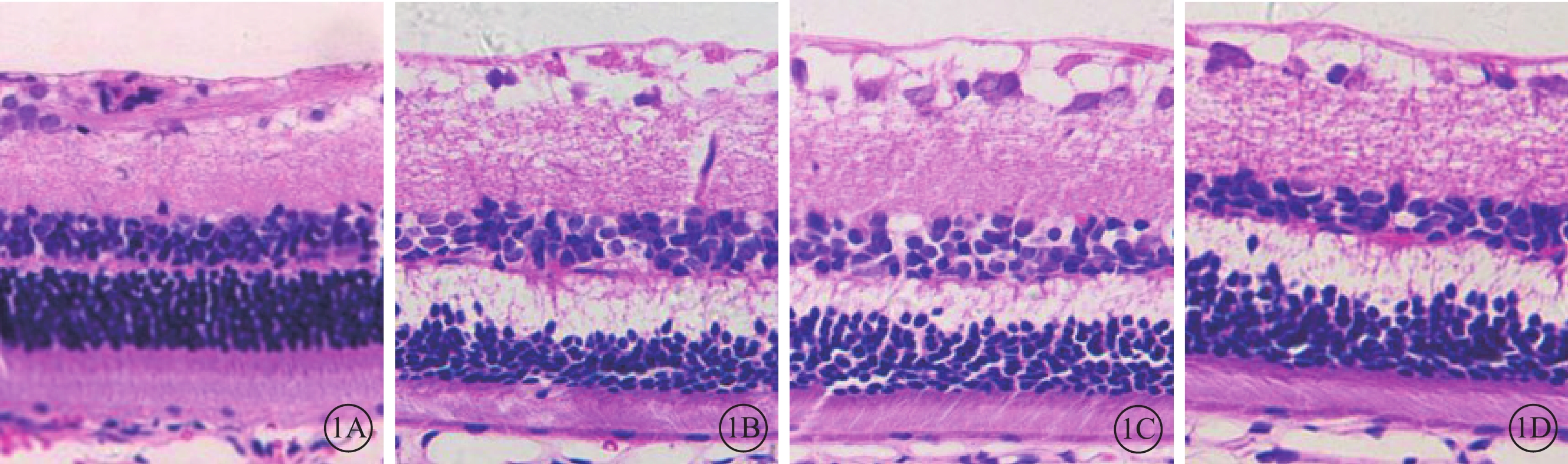
光學顯微鏡觀察發現,正常組大鼠視網膜各層結構清晰,細胞排列整齊(圖1A);DM 3m組大鼠視網膜神經節細胞層明顯水腫,內、外核層細胞數量減少,排列紊亂,外叢狀層(OPL)水腫明顯,微血管異常擴張,未見新生血管形成(圖1B);DM 3m+Anti組大鼠視網膜OPL水腫較DM 3m組減輕(圖1C);DM 3m+PBS組大鼠視網膜各層形態學表現與DM 3m組無明顯差異(圖1D)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度分別為(126.93±5.50)、(148.52±7.68)、(139.45±7.53)、(143.90±7.98)μm;與正常組比較,DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度增加,差異均有統計學意義(t=5.596、3.290、4.286,P=0.000、0.008、0.002);與DM 3m組比較,DM 3m+Anti組大鼠視網膜總厚度降低,但差異無統計學意義(t=2.065,P=0.066);DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度比較,差異無統計學意義(t=1.022,P=0.331)。
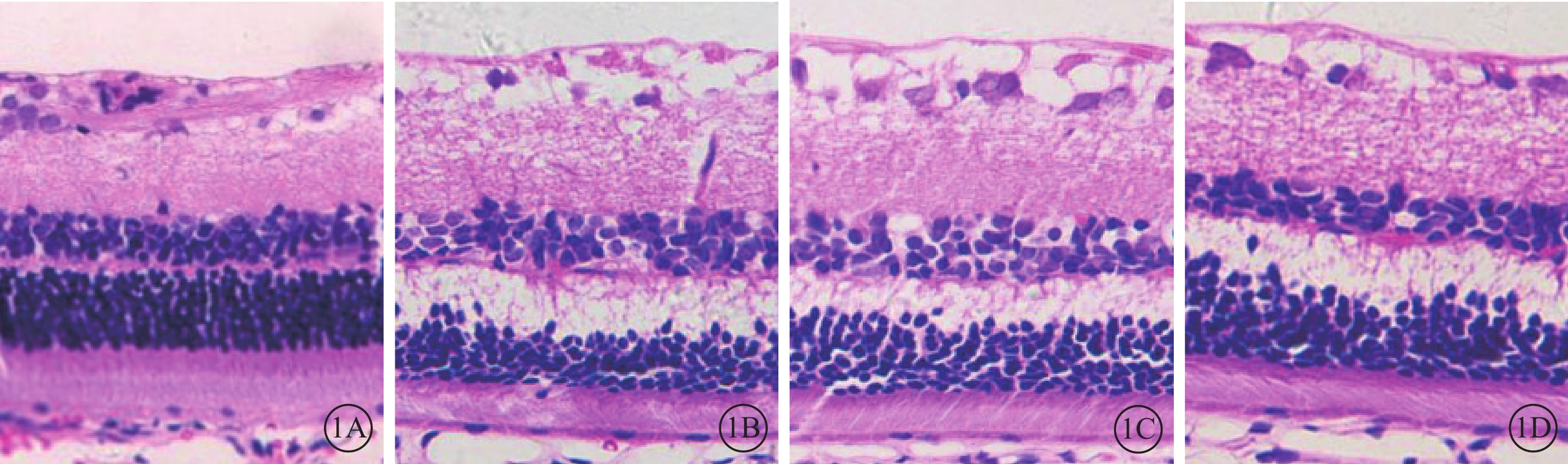 圖1
各組大鼠視網膜光學顯微鏡像。1A. 正常組,視網膜各層結構清晰,細胞排列規則。1B~1D. 分別為DM 3m組、DM 3m+Anti組、DM 3m+PBS組,視網膜神經節細胞層明顯水腫,OPL水腫顯著,微血管異常擴張;DM 3m+Anti組視網膜OPL水腫較DM 3m組減輕 HE ×400
圖1
各組大鼠視網膜光學顯微鏡像。1A. 正常組,視網膜各層結構清晰,細胞排列規則。1B~1D. 分別為DM 3m組、DM 3m+Anti組、DM 3m+PBS組,視網膜神經節細胞層明顯水腫,OPL水腫顯著,微血管異常擴張;DM 3m+Anti組視網膜OPL水腫較DM 3m組減輕 HE ×400
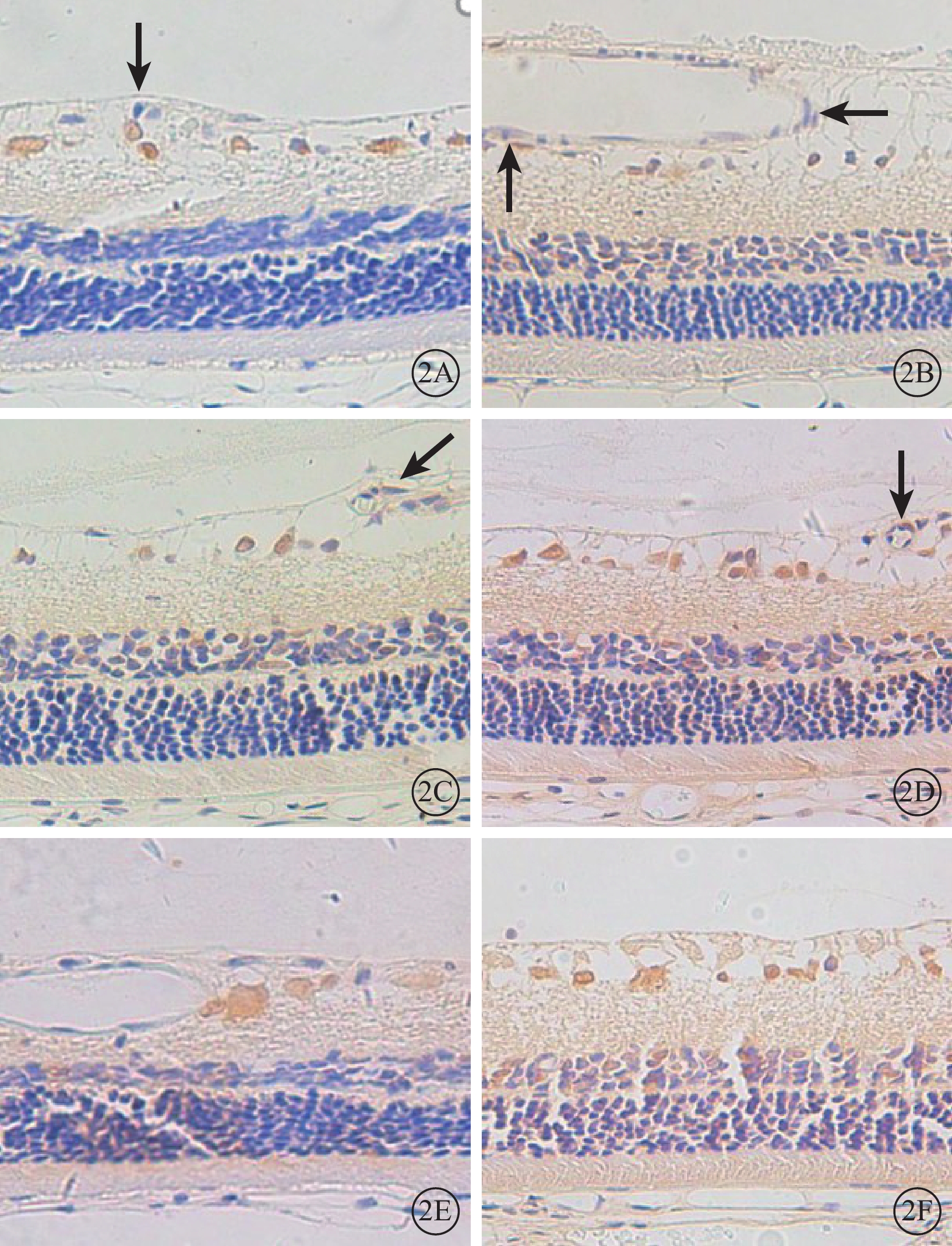
免疫組織化學染色結果顯示,正常組大鼠視網膜神經節細胞層可見少量棕黃色顆粒(圖2A)。DM 1m組、DM 2m組、DM 3m組大鼠視網膜血管內皮細胞中Dll-4陽性表達逐漸增加(圖2B~2D)。DM 3m組大鼠視網膜神經節細胞層及內、外核層Dll-4陽性著色較正常組加深;血管內皮細胞中可見明顯陽性著色顆粒(圖2D)。DM 3m+Anti組大鼠視網膜中Dll-4表達范圍較DM 3m組小,顏色變淡(圖2E)。DM 3m+PBS組與DM 3m組大鼠視網膜中Dll-4表達范圍無明顯差異(圖2F)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜IA值分別為1.17±0.79、4.17±1.04、2.75±0.63、3.86±0.60;與正常組大鼠視網膜IA值比較,差異均有統計學意義(t=6.477、4.412、7.641,P<0.05);DM 3m組、DM 3m+Anti組大鼠視網膜IA值比較,差異有統計學意義(t=3.291,P<0.05);DM 3m組、DM 3m+PBS組大鼠視網膜IA值比較,差異無統計學意義(t=0.740,P>0.05)。
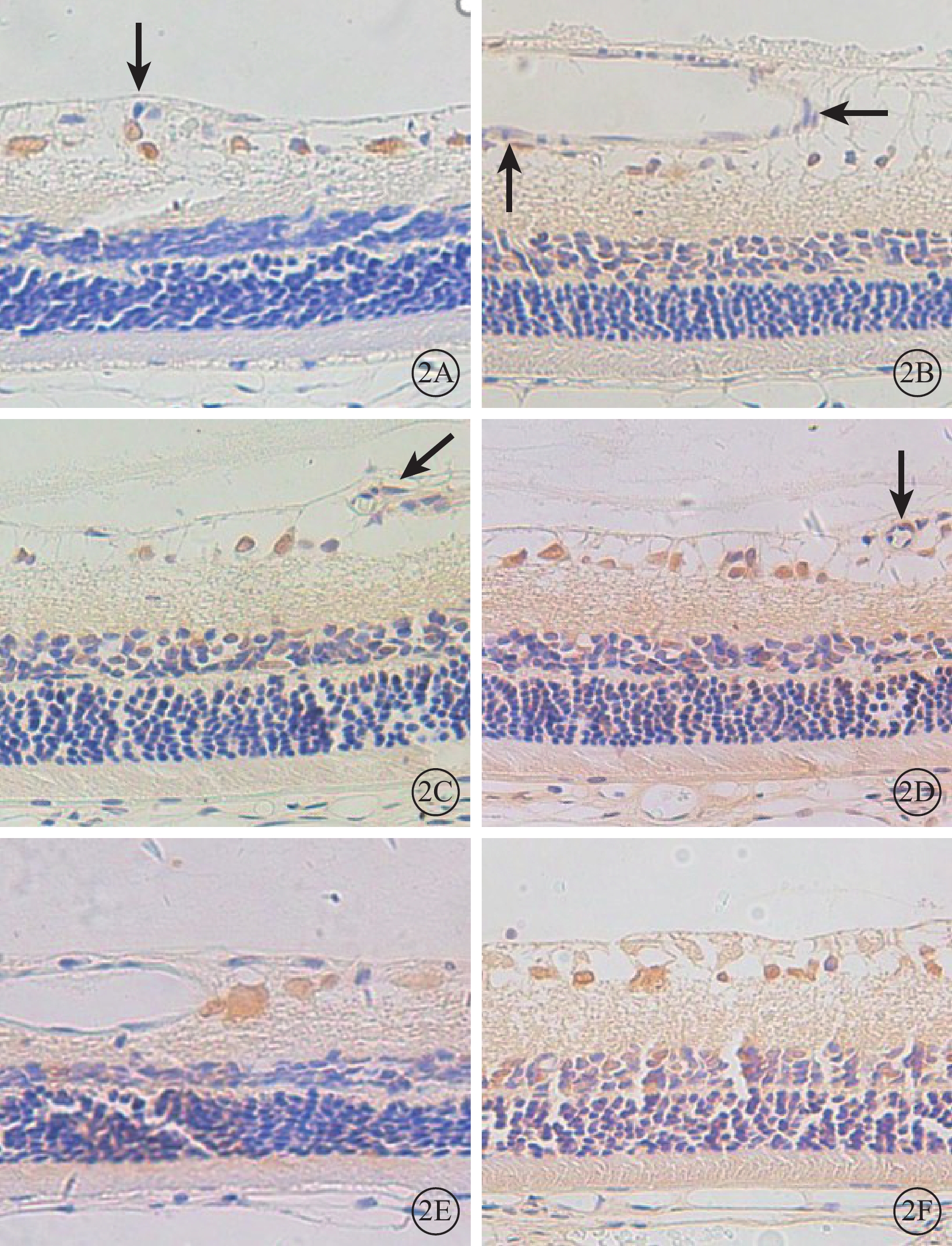 圖2
各組大鼠視網膜免疫組織化學染色像。2A. 正常組,視網膜神經節細胞層可見少量陽性著色的棕黃色顆粒(黑箭)。2B~2D.分別為DM 1m組、DM 2m組、DM 3m組,視網膜血管內皮細胞中Dll-4陽性表達逐漸增加;DM 3m組視網膜神經節細胞層及內、外核層陽性著色較正常組加深;血管內皮細胞可見明顯Dll-4陽性著色顆粒(黑箭)。2E.DM 3m+Anti組,視網膜中Dll-4陽性表達范圍較DM 3m組小,顏色變淡。2F. DM 3m+PBS組,與DM 3m組比較,陽性著色無明顯差異 DAB ×400
圖2
各組大鼠視網膜免疫組織化學染色像。2A. 正常組,視網膜神經節細胞層可見少量陽性著色的棕黃色顆粒(黑箭)。2B~2D.分別為DM 1m組、DM 2m組、DM 3m組,視網膜血管內皮細胞中Dll-4陽性表達逐漸增加;DM 3m組視網膜神經節細胞層及內、外核層陽性著色較正常組加深;血管內皮細胞可見明顯Dll-4陽性著色顆粒(黑箭)。2E.DM 3m+Anti組,視網膜中Dll-4陽性表達范圍較DM 3m組小,顏色變淡。2F. DM 3m+PBS組,與DM 3m組比較,陽性著色無明顯差異 DAB ×400
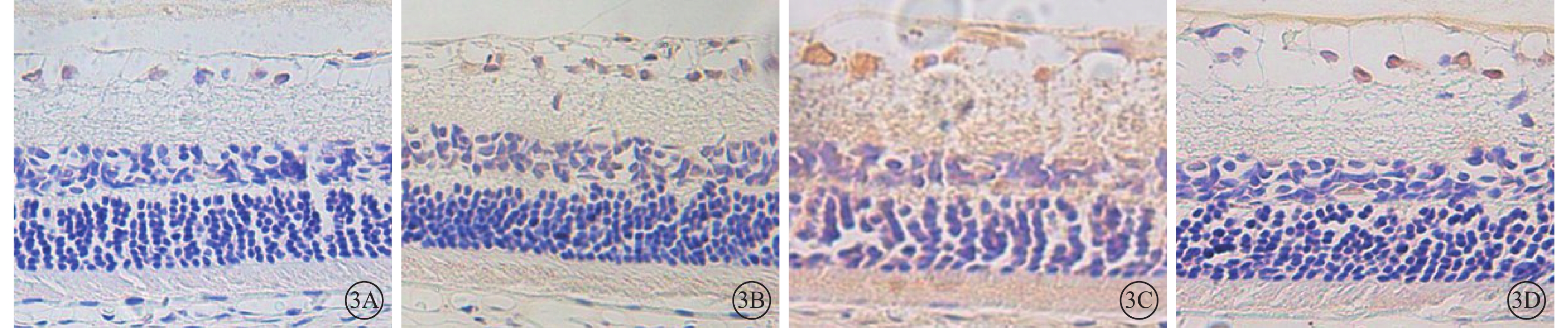
正常組大鼠視網膜神經節細胞層及內、外核層均可見少量棕黃色顆粒,著色淡(圖3A);DM 3m組大鼠視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深(圖3B);DM 3m+Anti組大鼠視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深(圖3C)。DM 3m+PBS組大鼠視網膜中VEGFR-2表達與DM 3m組無明顯差異(圖3D)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜IA值分別為2.06±1.10、4.48±1.19、9.43±1.74、3.69±0.79;與正常組大鼠視網膜IA值比較,差異均有統計學意義(t=4.224、10.118、3.397,P<0.05);DM 3m組、DM 3m+Anti組大鼠視網膜IA值比較,差異有統計學意義(t=6.645,P<0.05);DM 3m組、DM 3m+PBS組大鼠視網膜IA值比較,差異無統計學意義(t=1.562,P>0.05)。
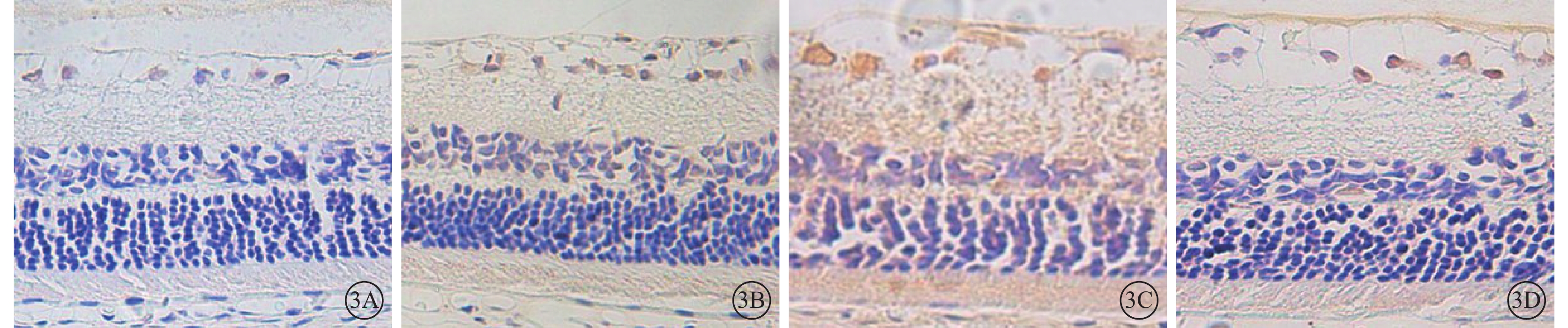 圖3
各組大鼠視網膜免疫組織化學染色像。3A. 正常組,視網膜神經節細胞層及內、外核層均可見少量VEGFR-2棕黃色顆粒,著色淡;3B. DM 3m組,視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深;3C. DM 3m+Anti組,視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深;3D.DM 3m+PBS組,VEGFR-2表達與DM 3m組無明顯差異 DAB ×400
圖3
各組大鼠視網膜免疫組織化學染色像。3A. 正常組,視網膜神經節細胞層及內、外核層均可見少量VEGFR-2棕黃色顆粒,著色淡;3B. DM 3m組,視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深;3C. DM 3m+Anti組,視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深;3D.DM 3m+PBS組,VEGFR-2表達與DM 3m組無明顯差異 DAB ×400
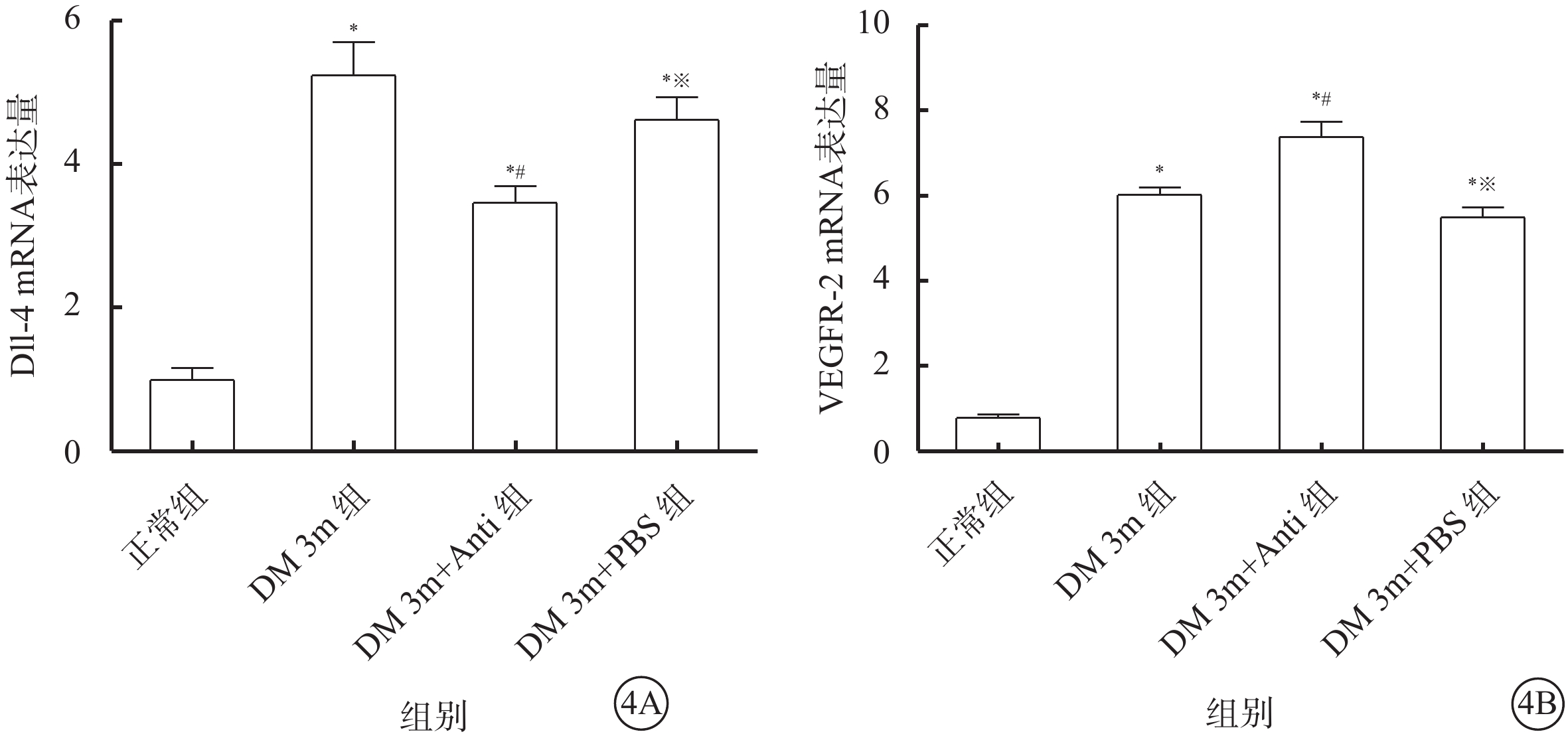
熒光定量PCR檢測結果顯示,與正常組大鼠比較,DM 3m組大鼠視網膜中Dll-4、VEGFR-2 mRNA表達量明顯升高,差異有統計學意義(t=6.705、20.871,P<0.05)。與DM 3m組大鼠比較,DM 3m+Anti組大鼠視網膜中Dll-4 mRNA表達量降低(t=2.681),VEGFR-2 mRNA表達量升高(t=3.639),差異均有統計學意義(P<0.05)。DM 3m+PBS組、DM 3m組大鼠視網膜中Dll-4、VEGFR-2 mRNA表達量比較,差異無統計學意義(t=0.513、0.657,P>0.05)(圖4)。
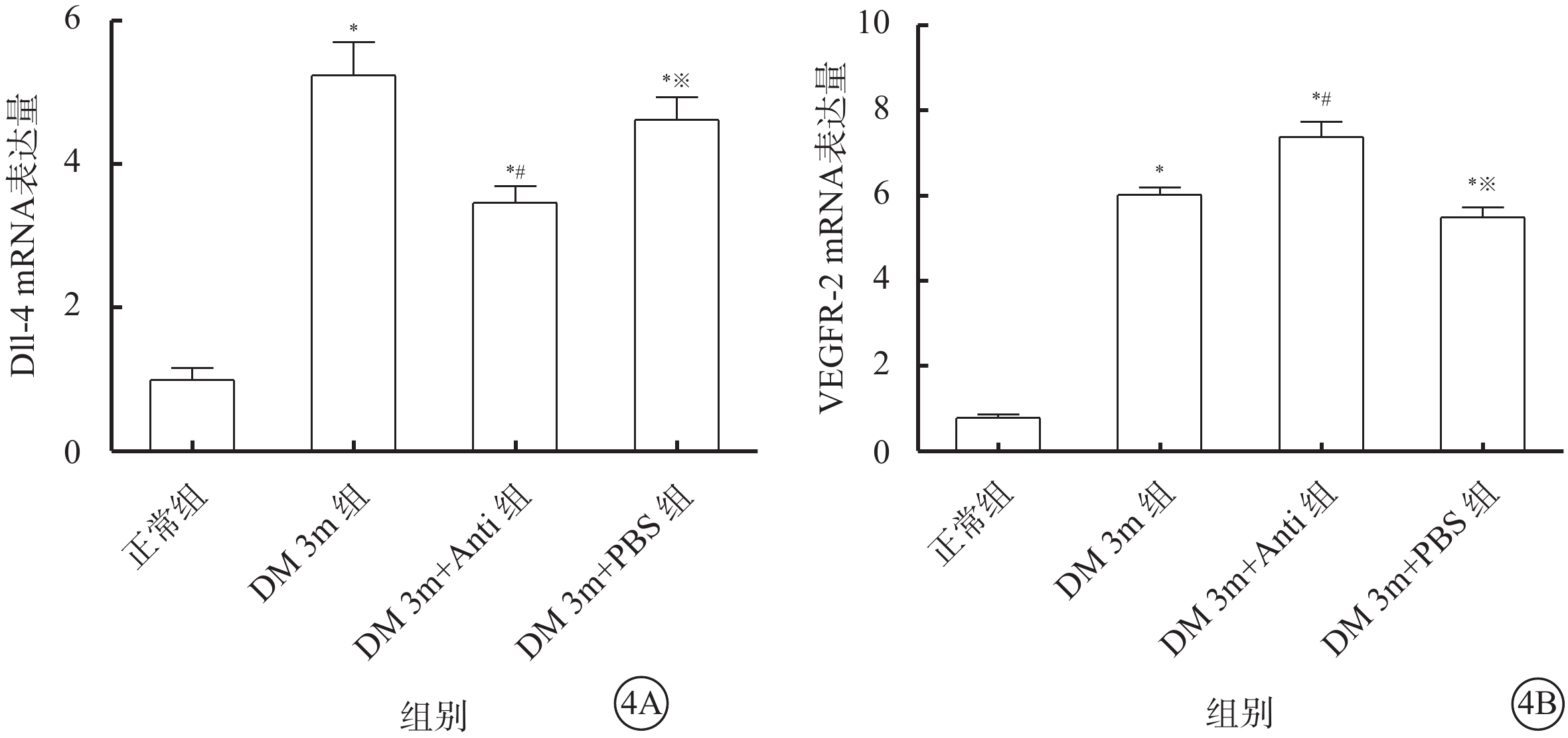 圖4
各組大鼠視網膜中Dll-4 、VEGFR-2 mRNA相對表達量比較。4A. Dll-4;4B. VEGFR-2。*與正常組比較,P<0.05;#與DM 3m組比較,※P<0.05;與DM 3m組比較,P>0.05
圖4
各組大鼠視網膜中Dll-4 、VEGFR-2 mRNA相對表達量比較。4A. Dll-4;4B. VEGFR-2。*與正常組比較,P<0.05;#與DM 3m組比較,※P<0.05;與DM 3m組比較,P>0.05
3 討論
Dll-4基因作為Notch配體中的Detal家族成員,其編碼一種胞外區域包含8個表皮生長因子樣結構域和Delta/Serrate/Lag-2結構域的膜結合蛋白;并高選擇地表達于鼠胚胎和成體的血管內皮細胞,對血管生物學調控發揮重要作用[1]。小鼠視網膜血管發育中,Dll-4顯著表達于生長活躍的血管內皮細胞;在成熟或完全分化的毛細血管內皮細胞則呈現明顯低水平表達;而氧誘導缺血性視網膜病變小鼠模型實驗中,Dll-4在血管生長最活躍區域表達尤為顯著[9]。此外,Lobov等[9]證實在視網膜缺血性病變及正常發育情況下,Dll-4均可作為一種血管出芽的負調節因子參與血管形成,且能被VEGF調節,并共同促進血管網的及時形成和分化。
VEGF在DR新生血管形成調節中起重要作用,相關配體VEGF-A是其家族中最重要的血管生長因子[10]。不同類型VEGFR表達于血管內皮細胞,VEGFR-1與VEGF-A有高親和力,但二者結合引起的生物活性很弱;而VEGFR-2的酪氨酸激酶活性調控著大部分血管內皮細胞對VEGF-A的反應,誘導頂端細胞發出絲狀偽足,內皮細胞遷移、增生以及增加血管通透性[11-13]。說明VEGF-A與VEGFR-2的結合在血管形成中發揮主導作用。研究表明,在血管新生中Dll-4和VEGFR-2存在復雜關系。我們前期臨床研究發現,增生型DR新生血管發生中,抑制VEGF表達,Dll-4的表達減少;此外,Dll-4的表達與VEGFR-2的表達部位大體一致且呈正相關[3]。而藥物抑制Dll-4表達后,野生型小鼠視網膜血管出芽及內皮細胞增生與視網膜中總的VEGFR-2 mRNA水平或VEGFR-2的分布不相關,且VEGFR-2呈輕度減少趨勢[9]。Liu等[14]研究發現VEGF信號通路激活后,可通過磷脂酰肌醇3激酶/蛋白激酶B通路誘導動脈內皮細胞中的Notch-1/Dll-4基因表達促進血管形成;此過程需要VEGFR-1和VEGFR-2的共同參與。而DR中Dll-4與VEGFR-2間的相互關系尚不明確。
我們前期動物實驗研究表明,DM大鼠早期視網膜病變過程中,Dll-4的表達逐漸增加,且與VEGFR-2變化呈正相關[2]。本研究在此研究基礎上,進一步觀察了玻璃體腔注射Dll-4抑制劑后Dll-4與VEGFR-2在視網膜中的表達情況。發現正常組、DM 1m組、DM 2m組、DM 3m組視網膜血管內皮細胞中Dll-4表達逐漸增加。DM 3個月時,大鼠玻璃體腔注射抗Dll-4抗體,注射后5 d,與DM 3m組比較,DM 3m+Anti組Dll-4在視網膜中的表達顯減少,而VEGFR-2在視網膜中的表達顯著增加。說明抑制Dll-4表達,VEGFR-2的表達增加。同樣,Suchting等[15]也證實,視網膜血管發育過程中,Dll-4基因敲除小鼠視網膜血管出現VEGFR-2表達增加和VEGFR-1表達減少。而Trindade等[16]研究發現,小鼠皮膚乳頭狀瘤的血管形成過程中,Dll-4過表達可減少VEGFR-2的表達和增加VEGFR-1的表達。Williams等[17]觀察到Dll-4在人臍靜脈內皮細胞中過表達可明顯降低VEGFR-2的表達。以上研究表明,Dll-4過表達可減少VEGFR-2的表達;而抑制Dll-4表達時,VEGFR-2的表達增加。因此,我們推測Dll-4表達變化對VEGFR-2的表達具有調節作用,且兩者可能共存于同一反應通路。
在視網膜缺血性病變和正常發育情況下,Dll-4可作為血管出芽的一種內源性抑制劑[9]。Harrington等[18]研究證實Dll-4、VEGF間存在有效負反饋回路,其中VEGF誘導Dll-4的表達,隨后Dll-4可通過調節VEGF信號途徑的多個成分降低血管內皮細胞對VEGF的反應能力。而VEGF信號被阻斷時,Dll-4的表達降低[2, 15]。說明Dll-4可作為VEGF的下游基因參與VEGF誘導的血管出芽過程[15]。然而本研究未檢測VEGF信號途徑中VEGF、VEGFR-1的表達情況,無法判定Dll-4與VEGF、VEGFR-1可能存在的關系,而且模型動物處于DM早期,尚無視網膜新生血管表型出現,因此Dll-4與VEGFR-2間的調節關系及其在DR新生血管形成的作用有待后續研究加以證實。
此外,本研究結果發現,玻璃體腔注射抗Dll-4抗體5 d后,DM 3m+Anti組大鼠視網膜OPL水腫較DM 3m組減輕。Aboualizadeh等[19]在對DR機制的研究中,發現DM病程3個月的小鼠視網膜OPL的糖基化產物的分子修飾和脂類中不飽和鍵的修飾作用明顯增加,具體表現為蛋白質中的酰胺Ⅱ與C-O、C-C和C-O-C連接的區域比例增加以及甲基和亞甲基組與C=H雙鍵間區域的比例降低。然而目前Dll-4的研究主要在DR或腫瘤血管新生中的作用[3, 9, 14-16],Dll-4對組織的生物化學改變的研究鮮有報道。玻璃體腔注射抗Dll-4抗體,抑制Dll-4表達,發現OPL水腫減輕,其余各層改變不明顯;推測Dll-4水平的降低可能對生化改變中的分子修飾過程具有調節作用,進而影響OPL病理結構。本研究中抗體作用后,觀察時間短,未選擇更長時間點觀察視網膜病理結構變化,抗體的半衰期尚不清楚,因此其具體機制仍需進一步研究加以探究。
Delta樣配體4(Dll-4)是哺乳動物中發現的Notch信號通路的重要配體,在視網膜血管新生中發揮重要調節作用[1]。我們前期的動物和臨床研究證實,Notch-1/Dll-4信號通路參與了糖尿病(DM)視網膜病變(DR)的發生發展過程,且與血管內皮生長因子(VEGF)信號通路相關[2-3]。VEGF與其受體(VEGFR)-2是重要的促新生血管因子,在DR發生發展中表達顯著升高,給予抗VEGF藥物治療可取得明顯療效[4-5];但抑制VEGF的表達并未完全抑制缺血導致的視網膜新生血管形成[6]。而DR中Dll-4所發揮的作用及其與VEGFR-2的關系目前尚不清楚。本研究旨在觀察Dll-4對早期DM大鼠視網膜病理結構的影響及其與VEGFR-2的關系,探討Dll-4在DR中所發揮的可能作用。現將結果報道如下。
1 材料和方法
雄性Sprague Dawley大鼠70只,2個月齡,體重約200 g,清潔級,青島派特福德白鼠養殖專業社提供。動物合格證號:SCXK(魯)20130001。實驗動物使用遵循國家科技委頒布的《實驗動物管理條例》。隨機數字表法將大鼠分為正常組和DM組,分別10、60只大鼠。DM組大鼠禁食、不禁飲12 h后,左下腹腔注射60 mg/kg劑量鏈脲佐菌素制作DM模型;72 h后經尾靜脈采血檢測空腹血糖≥16.7 mmol/L者視為造模成功。其后每個月測定1次血糖,剔除血糖恢復和死亡大鼠,最終50只大鼠納入統計。正常組大鼠腹腔注射等體積檸檬酸-檸檬酸鈉緩沖液。DM組隨機數字表法分為DM 1m組、DM 2m組、DM 3m組、DM 3m+Anti組、DM 3m+磷酸鹽緩液(PBS)組,各組均為10只大鼠。成模后3個月,DM3m+Anti組大鼠玻璃體腔注射抗Dll-4多克隆抗體4 μl,抗體濃度0.25 mg/ml[7-8];DM 3m+PBS組大鼠玻璃體腔注射等體積PBS。注射后兩組大鼠均無玻璃體積血、白內障、高眼壓等并發癥發生;注射后5 d,處死大鼠。其余各組大鼠不做任何處理,分別于成模后1、2、3個月處死,進行后續實驗。
蘇木精-伊紅(HE)染色觀察視網膜各層結構和微血管變化,并測量各組視網膜總厚度。400倍物鏡下,采集各組HE染色圖像,隨機數字表法從每組HE圖像中抽取6張,利用Image pro plus 6.0軟件進行視網膜厚度測定,測量每張HE圖像中視網膜總厚度的平均值。
免疫組織化學染色檢測視網膜血管內皮細胞內Dll-4的表達及視網膜中Dll-4、VEGFR-2的表達。大鼠腹腔過度麻醉處死,摘除眼球,4%多聚甲醛液固定24 h,常規脫水,石蠟包埋,平行于視神經矢狀軸,連續切片,厚度4 μm。石蠟切片后,常規脫蠟復水,行抗原修復,5%山羊血清封閉,按照試劑盒說明進行Dll-4、VEGFR-2免疫組織化學染色,二氨基苯聯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡觀察。PBS代替一抗作為陰性對照。細胞及組織內出現棕黃色顆粒為陽性表達。Image pro plus 6.0軟件計算免疫組織化學染色相應蛋白陽性部分的平均吸光度值[A,舊稱光密度(OD)](IA)值,代表相應蛋白的相對表達量。
熒光定量聚合酶鏈反應(PCR)檢測視網膜中Dll-4、VEGFR-2 mRNA的表達。處死大鼠后,取視網膜組織,每50~100 mg視網膜組織加入1 ml RNAiso plus進行裂解;提取總RNA,紫外分光光度計檢測其濃度和純度。A260/A280在1.6~2.1的樣本用于實驗。逆轉錄成cDNA后,加入PCR反應體系,SYBR Green Ⅰ嵌合熒光法擴增相應基因。退火溫度60 ℃,40個循環后形成擴增曲線,記錄Ct值。結果采用2?ΔΔCt公式(ΔΔCt=ΔCt待測樣品?ΔCt對照樣品,ΔCt=目的基因Ct值?內參基因Ct值)進行分析。以β-肌動蛋白(actin)作為內參照基因。引物序列:β-actin:正向引物:5′-CCCATCTATGAGGGTTACGC-3′,反向引物:5′-TTTAATGTCACGCACGATTTC-3′,引物長度150堿基對(bp)。Dll-4:正向引物:5′-AAGAATAGCGGCAGTGGTCGTAA-3′,反向引物:5′-CCTTGGATGATGATTTGGCTGA-3′,引物長度161 bp。VEGFR-2引物序列:正向引物:5′-GCGACCCCAAATTCCATTATG-3′,反向引物:5′-CTTCTGAGGCAAGGACCATCC-3′,引物長度180 bp。
采用SPSS19.0軟件進行統計分析。正態分布的數據采用均數±標準差(
 )表示。采用單因素方差分析比較各組表達差異;組間比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
)表示。采用單因素方差分析比較各組表達差異;組間比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
光學顯微鏡觀察發現,正常組大鼠視網膜各層結構清晰,細胞排列整齊(圖1A);DM 3m組大鼠視網膜神經節細胞層明顯水腫,內、外核層細胞數量減少,排列紊亂,外叢狀層(OPL)水腫明顯,微血管異常擴張,未見新生血管形成(圖1B);DM 3m+Anti組大鼠視網膜OPL水腫較DM 3m組減輕(圖1C);DM 3m+PBS組大鼠視網膜各層形態學表現與DM 3m組無明顯差異(圖1D)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度分別為(126.93±5.50)、(148.52±7.68)、(139.45±7.53)、(143.90±7.98)μm;與正常組比較,DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度增加,差異均有統計學意義(t=5.596、3.290、4.286,P=0.000、0.008、0.002);與DM 3m組比較,DM 3m+Anti組大鼠視網膜總厚度降低,但差異無統計學意義(t=2.065,P=0.066);DM 3m+Anti組、DM 3m+PBS組大鼠視網膜總厚度比較,差異無統計學意義(t=1.022,P=0.331)。
 圖1
各組大鼠視網膜光學顯微鏡像。1A. 正常組,視網膜各層結構清晰,細胞排列規則。1B~1D. 分別為DM 3m組、DM 3m+Anti組、DM 3m+PBS組,視網膜神經節細胞層明顯水腫,OPL水腫顯著,微血管異常擴張;DM 3m+Anti組視網膜OPL水腫較DM 3m組減輕 HE ×400
圖1
各組大鼠視網膜光學顯微鏡像。1A. 正常組,視網膜各層結構清晰,細胞排列規則。1B~1D. 分別為DM 3m組、DM 3m+Anti組、DM 3m+PBS組,視網膜神經節細胞層明顯水腫,OPL水腫顯著,微血管異常擴張;DM 3m+Anti組視網膜OPL水腫較DM 3m組減輕 HE ×400
免疫組織化學染色結果顯示,正常組大鼠視網膜神經節細胞層可見少量棕黃色顆粒(圖2A)。DM 1m組、DM 2m組、DM 3m組大鼠視網膜血管內皮細胞中Dll-4陽性表達逐漸增加(圖2B~2D)。DM 3m組大鼠視網膜神經節細胞層及內、外核層Dll-4陽性著色較正常組加深;血管內皮細胞中可見明顯陽性著色顆粒(圖2D)。DM 3m+Anti組大鼠視網膜中Dll-4表達范圍較DM 3m組小,顏色變淡(圖2E)。DM 3m+PBS組與DM 3m組大鼠視網膜中Dll-4表達范圍無明顯差異(圖2F)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜IA值分別為1.17±0.79、4.17±1.04、2.75±0.63、3.86±0.60;與正常組大鼠視網膜IA值比較,差異均有統計學意義(t=6.477、4.412、7.641,P<0.05);DM 3m組、DM 3m+Anti組大鼠視網膜IA值比較,差異有統計學意義(t=3.291,P<0.05);DM 3m組、DM 3m+PBS組大鼠視網膜IA值比較,差異無統計學意義(t=0.740,P>0.05)。
 圖2
各組大鼠視網膜免疫組織化學染色像。2A. 正常組,視網膜神經節細胞層可見少量陽性著色的棕黃色顆粒(黑箭)。2B~2D.分別為DM 1m組、DM 2m組、DM 3m組,視網膜血管內皮細胞中Dll-4陽性表達逐漸增加;DM 3m組視網膜神經節細胞層及內、外核層陽性著色較正常組加深;血管內皮細胞可見明顯Dll-4陽性著色顆粒(黑箭)。2E.DM 3m+Anti組,視網膜中Dll-4陽性表達范圍較DM 3m組小,顏色變淡。2F. DM 3m+PBS組,與DM 3m組比較,陽性著色無明顯差異 DAB ×400
圖2
各組大鼠視網膜免疫組織化學染色像。2A. 正常組,視網膜神經節細胞層可見少量陽性著色的棕黃色顆粒(黑箭)。2B~2D.分別為DM 1m組、DM 2m組、DM 3m組,視網膜血管內皮細胞中Dll-4陽性表達逐漸增加;DM 3m組視網膜神經節細胞層及內、外核層陽性著色較正常組加深;血管內皮細胞可見明顯Dll-4陽性著色顆粒(黑箭)。2E.DM 3m+Anti組,視網膜中Dll-4陽性表達范圍較DM 3m組小,顏色變淡。2F. DM 3m+PBS組,與DM 3m組比較,陽性著色無明顯差異 DAB ×400
正常組大鼠視網膜神經節細胞層及內、外核層均可見少量棕黃色顆粒,著色淡(圖3A);DM 3m組大鼠視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深(圖3B);DM 3m+Anti組大鼠視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深(圖3C)。DM 3m+PBS組大鼠視網膜中VEGFR-2表達與DM 3m組無明顯差異(圖3D)。正常組、DM 3m組、DM 3m+Anti組、DM 3m+PBS組大鼠視網膜IA值分別為2.06±1.10、4.48±1.19、9.43±1.74、3.69±0.79;與正常組大鼠視網膜IA值比較,差異均有統計學意義(t=4.224、10.118、3.397,P<0.05);DM 3m組、DM 3m+Anti組大鼠視網膜IA值比較,差異有統計學意義(t=6.645,P<0.05);DM 3m組、DM 3m+PBS組大鼠視網膜IA值比較,差異無統計學意義(t=1.562,P>0.05)。
 圖3
各組大鼠視網膜免疫組織化學染色像。3A. 正常組,視網膜神經節細胞層及內、外核層均可見少量VEGFR-2棕黃色顆粒,著色淡;3B. DM 3m組,視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深;3C. DM 3m+Anti組,視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深;3D.DM 3m+PBS組,VEGFR-2表達與DM 3m組無明顯差異 DAB ×400
圖3
各組大鼠視網膜免疫組織化學染色像。3A. 正常組,視網膜神經節細胞層及內、外核層均可見少量VEGFR-2棕黃色顆粒,著色淡;3B. DM 3m組,視網膜神經節細胞層及內、外核層中VEGFR-2陽性表達較正常組棕黃色顆粒著染加深;3C. DM 3m+Anti組,視網膜中VEGFR-2表達范圍較DM 3m組顯著增加,著色明顯加深;3D.DM 3m+PBS組,VEGFR-2表達與DM 3m組無明顯差異 DAB ×400
熒光定量PCR檢測結果顯示,與正常組大鼠比較,DM 3m組大鼠視網膜中Dll-4、VEGFR-2 mRNA表達量明顯升高,差異有統計學意義(t=6.705、20.871,P<0.05)。與DM 3m組大鼠比較,DM 3m+Anti組大鼠視網膜中Dll-4 mRNA表達量降低(t=2.681),VEGFR-2 mRNA表達量升高(t=3.639),差異均有統計學意義(P<0.05)。DM 3m+PBS組、DM 3m組大鼠視網膜中Dll-4、VEGFR-2 mRNA表達量比較,差異無統計學意義(t=0.513、0.657,P>0.05)(圖4)。
 圖4
各組大鼠視網膜中Dll-4 、VEGFR-2 mRNA相對表達量比較。4A. Dll-4;4B. VEGFR-2。*與正常組比較,P<0.05;#與DM 3m組比較,※P<0.05;與DM 3m組比較,P>0.05
圖4
各組大鼠視網膜中Dll-4 、VEGFR-2 mRNA相對表達量比較。4A. Dll-4;4B. VEGFR-2。*與正常組比較,P<0.05;#與DM 3m組比較,※P<0.05;與DM 3m組比較,P>0.05
3 討論
Dll-4基因作為Notch配體中的Detal家族成員,其編碼一種胞外區域包含8個表皮生長因子樣結構域和Delta/Serrate/Lag-2結構域的膜結合蛋白;并高選擇地表達于鼠胚胎和成體的血管內皮細胞,對血管生物學調控發揮重要作用[1]。小鼠視網膜血管發育中,Dll-4顯著表達于生長活躍的血管內皮細胞;在成熟或完全分化的毛細血管內皮細胞則呈現明顯低水平表達;而氧誘導缺血性視網膜病變小鼠模型實驗中,Dll-4在血管生長最活躍區域表達尤為顯著[9]。此外,Lobov等[9]證實在視網膜缺血性病變及正常發育情況下,Dll-4均可作為一種血管出芽的負調節因子參與血管形成,且能被VEGF調節,并共同促進血管網的及時形成和分化。
VEGF在DR新生血管形成調節中起重要作用,相關配體VEGF-A是其家族中最重要的血管生長因子[10]。不同類型VEGFR表達于血管內皮細胞,VEGFR-1與VEGF-A有高親和力,但二者結合引起的生物活性很弱;而VEGFR-2的酪氨酸激酶活性調控著大部分血管內皮細胞對VEGF-A的反應,誘導頂端細胞發出絲狀偽足,內皮細胞遷移、增生以及增加血管通透性[11-13]。說明VEGF-A與VEGFR-2的結合在血管形成中發揮主導作用。研究表明,在血管新生中Dll-4和VEGFR-2存在復雜關系。我們前期臨床研究發現,增生型DR新生血管發生中,抑制VEGF表達,Dll-4的表達減少;此外,Dll-4的表達與VEGFR-2的表達部位大體一致且呈正相關[3]。而藥物抑制Dll-4表達后,野生型小鼠視網膜血管出芽及內皮細胞增生與視網膜中總的VEGFR-2 mRNA水平或VEGFR-2的分布不相關,且VEGFR-2呈輕度減少趨勢[9]。Liu等[14]研究發現VEGF信號通路激活后,可通過磷脂酰肌醇3激酶/蛋白激酶B通路誘導動脈內皮細胞中的Notch-1/Dll-4基因表達促進血管形成;此過程需要VEGFR-1和VEGFR-2的共同參與。而DR中Dll-4與VEGFR-2間的相互關系尚不明確。
我們前期動物實驗研究表明,DM大鼠早期視網膜病變過程中,Dll-4的表達逐漸增加,且與VEGFR-2變化呈正相關[2]。本研究在此研究基礎上,進一步觀察了玻璃體腔注射Dll-4抑制劑后Dll-4與VEGFR-2在視網膜中的表達情況。發現正常組、DM 1m組、DM 2m組、DM 3m組視網膜血管內皮細胞中Dll-4表達逐漸增加。DM 3個月時,大鼠玻璃體腔注射抗Dll-4抗體,注射后5 d,與DM 3m組比較,DM 3m+Anti組Dll-4在視網膜中的表達顯減少,而VEGFR-2在視網膜中的表達顯著增加。說明抑制Dll-4表達,VEGFR-2的表達增加。同樣,Suchting等[15]也證實,視網膜血管發育過程中,Dll-4基因敲除小鼠視網膜血管出現VEGFR-2表達增加和VEGFR-1表達減少。而Trindade等[16]研究發現,小鼠皮膚乳頭狀瘤的血管形成過程中,Dll-4過表達可減少VEGFR-2的表達和增加VEGFR-1的表達。Williams等[17]觀察到Dll-4在人臍靜脈內皮細胞中過表達可明顯降低VEGFR-2的表達。以上研究表明,Dll-4過表達可減少VEGFR-2的表達;而抑制Dll-4表達時,VEGFR-2的表達增加。因此,我們推測Dll-4表達變化對VEGFR-2的表達具有調節作用,且兩者可能共存于同一反應通路。
在視網膜缺血性病變和正常發育情況下,Dll-4可作為血管出芽的一種內源性抑制劑[9]。Harrington等[18]研究證實Dll-4、VEGF間存在有效負反饋回路,其中VEGF誘導Dll-4的表達,隨后Dll-4可通過調節VEGF信號途徑的多個成分降低血管內皮細胞對VEGF的反應能力。而VEGF信號被阻斷時,Dll-4的表達降低[2, 15]。說明Dll-4可作為VEGF的下游基因參與VEGF誘導的血管出芽過程[15]。然而本研究未檢測VEGF信號途徑中VEGF、VEGFR-1的表達情況,無法判定Dll-4與VEGF、VEGFR-1可能存在的關系,而且模型動物處于DM早期,尚無視網膜新生血管表型出現,因此Dll-4與VEGFR-2間的調節關系及其在DR新生血管形成的作用有待后續研究加以證實。
此外,本研究結果發現,玻璃體腔注射抗Dll-4抗體5 d后,DM 3m+Anti組大鼠視網膜OPL水腫較DM 3m組減輕。Aboualizadeh等[19]在對DR機制的研究中,發現DM病程3個月的小鼠視網膜OPL的糖基化產物的分子修飾和脂類中不飽和鍵的修飾作用明顯增加,具體表現為蛋白質中的酰胺Ⅱ與C-O、C-C和C-O-C連接的區域比例增加以及甲基和亞甲基組與C=H雙鍵間區域的比例降低。然而目前Dll-4的研究主要在DR或腫瘤血管新生中的作用[3, 9, 14-16],Dll-4對組織的生物化學改變的研究鮮有報道。玻璃體腔注射抗Dll-4抗體,抑制Dll-4表達,發現OPL水腫減輕,其余各層改變不明顯;推測Dll-4水平的降低可能對生化改變中的分子修飾過程具有調節作用,進而影響OPL病理結構。本研究中抗體作用后,觀察時間短,未選擇更長時間點觀察視網膜病理結構變化,抗體的半衰期尚不清楚,因此其具體機制仍需進一步研究加以探究。