引用本文: 牛瑞, 東莉潔, 馬騰, 杜雪利, 何燕華, 崔偉娜, 胡博杰. 結締組織生長因子重組干擾載體慢病毒顆粒的構建及其對視網膜血管內皮細胞內源性結締組織生長因子表達的抑制作用. 中華眼底病雜志, 2018, 34(6): 580-585. doi: 10.3760/cma.j.issn.1005-1015.2018.06.011 復制
視網膜新生血管與纖維血管膜是增生型糖尿病視網膜病變(PDR)的標志性特征[1]。抗血管內皮生長因子(VEGF)藥物因其在新生血管性及滲出性病變中的顯著療效而逐漸成為輔助治療PDR的有效方式[2-3];但大量研究發現,抗VEGF藥物治療可導致結締組織生長因子(CTGF)表達升高而加劇纖維化進展[4]。我們前期研究發現,經抗VEGF藥物治療的PDR患者增生膜中VEGF表達明顯降低,但CTGF表達顯著上調[5]。提示血管新生和纖維化增生之間存在此消彼長的蹺板關系及轉換機制,而CTGF干預可能成為抗VEGF藥物治療PDR后緩解纖維化加劇的新型有效方式[6]。為探尋在拮抗VEGF表達的治療中針對性下調CTGF表達、抑制纖維化進程的方法,我們通過制備CTGF重組干擾載體(shRNA)慢病毒顆粒并篩選最佳感染復數(MOI)及感染時間來明確CTGF shRNA慢病毒顆粒的較優工作條件,綜合分析了CTGF shRNA慢病毒顆粒感染血管內皮細胞后產生的一系列生物學效應,以期為日后臨床治療中特異性下調內源性CTGF表達進而平衡抗VEGF與纖維化之間關系提供有效的分子工具。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料及實驗分組
恒河猴視網膜血管內皮細胞(RF/6A),由天津醫科大學眼科醫院研究所自行保存。胰蛋白酶、胎牛血清、青鏈霉素(美國Gibco公司);T75細胞培養瓶及6孔板(美國Corning公司);抗CTGF抗體(ab135812)、抗纖連蛋白抗體(ab2413)、抗膠原蛋白Ⅰ抗體(ab34710)、抗α-平滑肌肌動蛋白(α-SMA)抗體(ab5694)、聚偏二氟乙烯膜、化學發光液(美國Millipore公司);慢病毒載體pHB-U6-MCS-zsgreen-puro、pHB-U6-MCS-zsgre en-puro-Scramble質粒(上海漢恒公司);Transwell小室(美國Coming公司);HEK293FT細胞、psPAX2 質粒、pMD2G質粒、聚凝胺、Trizol試劑盒(美國Ambion公司); 磷酸鹽緩沖液(PBS)、RPMI-1640培養基(上海立菲生物技術有限公司)。
用含10%胎牛血清的RPMI-1640完全培養基培養細胞(100 U/ml青霉素及100 μg/ml鏈霉素),置于37℃、5%CO2的培養箱中培養。取第3代細胞用于實驗,并將其分為空白對照組(正常培養)、感染對照組(Scramble shRNA病毒感染)及CTGF敲低組(CTGFshRNA病毒感染)。
1.2 CTGF shRNA質粒構建及病毒包裝
構建CTGF shRNA。根據siRNA干擾序列GCGAGGTCATGAAGAAGAACATGAT安排引物合成。將生物公司合成的PAGE膠純化的Oligo序列分別稀釋至 100 μmol/L作為引物,應用退火程序95 ℃ 10 min,75 ℃10 min,55 ℃ 10 min,35 ℃ 10 min,15 ℃ 10 min形成帶粘性末端的雙鏈片段。用限制性內切酶BamHI/EcoRI對表達載體進行酶切,制備線性化表達載體。將干擾片段連接入表達載體,通過CaCl2法進行轉化試驗,轉化后人源CTGF shRNA平板挑菌,37 ℃ 250 r/min搖菌14 h,將菌液送測序公司測序。經測序驗證正確的陽性克隆,安排質粒小提。因載體質粒帶有紅色熒光標記,在熒光顯微鏡下呈現紅色熒光。
使用三質粒包裝系統獲得高滴度的慢病毒顆粒。鋪板293T細胞用于轉染。操作完畢后置于37 ℃、5%CO2和95%相對濕度的培養箱中。待細胞密度達到70%~80%的匯合率進行轉染。在37 ℃水浴中預熱OptiMEM,將LipofiterTM轉染試劑恢復至室溫做脂轉復合體,轉染后更換含10%胎牛血清的新鮮完全培養基,轉染后48、72 h時分別收集病毒上清。在48 h收毒時,將100 mm培養皿中的培養基倒入50 ml離心管中,隨后補入10 ml含10%胎牛血清的新鮮完全培養基,平穩置于37 ℃、5%CO2的恒溫培養箱中繼續培養。在72 h收毒時,直接將100 mm培養皿中的培養基倒入50 ml離心管中,將50 ml離心管中的病毒上清于4 ℃、2000×g離心10 min,去除細胞碎片;然后收集病毒原液上清置于超速離心管中,4 ℃、82 700×g離心120 min,最后將慢病毒超離分裝到滅菌處理的病毒管中于?80 ℃冰箱保存備用。得到對照組病毒滴度為1×108 TU/ml,CTGF shRNA滴度為2×108 TU/ml。
1.3 慢病毒感染RF/6A細胞,明確最佳MOI及感染時間
不同MOI條件下CTGF shRNA慢病毒感染RF/6A細胞。將狀態良好的RF/6A細胞以密度6×105個/孔隨機接種至3份24孔板中,以24 h后密度達到50%~60%為宜,每孔給予0.5 ml聚凝胺培養基混合物以提高細胞感染效率,使其終濃度為6 ng/ml·孔,室溫靜置30 min后吸除培養基,分別向不同24板孔中加入8.3、16.7、25 μl CTGF shRNA慢病毒顆粒,分別標記為MOI 10、20、30,4 h后補齊培養液至正常體積500 μl/孔,24 h后換液,繼續37℃培養,48 h后換液,繼續37℃培養,72 h后換液通過熒光顯微鏡下觀測慢病毒感染效率。應用ImageJ軟件對感染結果進行量化分析。選取待量化分析圖片,分別隨機圈選5個區域,測量得出平均熒光強度數據,記錄后取均值進行統計學分析。
MOI 20 CTGF shRNA慢病毒顆粒感染RF/6A細胞24、48、72 h。每孔加入16.7 μl CTGF shRNA慢病毒顆粒在24、48、72 h進行觀察,余方法同上。
1.4 Transwell細胞遷移實驗、實時定量聚合酶鏈反應(PCR)及蛋白免疫印跡(Western blot)檢測
Transwell小室的上室中預先加入100 μl完全培養基后,置于細胞培養箱進行濕潤及預熱30 min,利用這段時間準備細胞混懸液。細胞取自MOI 20 CTGF shRNA慢病毒顆粒感染72 h的RF/6A細胞,并調整其細胞密度為1×105個/ml。30 min后從細胞培養箱取出Transwell小室,向下室加600 μl完全培養基,向上室加100 μl配置的細胞混懸液,再次放入細胞培養箱培養繼續培養24 h后行常規蘇木精伊紅染色以示蹤細胞。染色完成后用棉簽輕輕擦拭以去除小室上表面細胞,晾干后用無菌尖刀片將小室底面切下,進行中性樹膠封片,每組設置3個復孔,本實驗重復3次。具體量化方法為首先利用顯微鏡拍照,隨后每個分組隨機選4~5個視野用以計數小室底膜下室側附著的細胞,即為發生遷移的細胞數,記錄并保存數據進行后續的統計學分析。
采用實時定量PCR檢測CTGF及細胞外基質(ECM)相關蛋白CTGF、纖連蛋白(FN)、α-SMA、Ⅰ型膠原蛋白(ColⅠ)的mRNA表達。按Trizol提取液說明書抽提細胞總RNA,經分光光度計檢測其濃度,以吸光度[A,舊稱光密度(OD)]260/A280比值介于1.8~2.0之間視為RNA提取質量良好。根據測得的RNA濃度,來計算1 μg RNA所對應的體積,加入到提前置于冰上的無菌無核酸酶的0.2 ml PCR管中,并按照順序依次加入逆轉錄反應所需組分,建立一個總量為20 μl的體系,依次歷經65 ℃孵育5 min,42 ℃孵育60 min,70 ℃加熱5 min,得到cDNA的產物直接用于后續PCR反應。根據NCBI數據庫中的CTGF、FN、ColⅠ、α-SMA設計引物序列,由金唯智生物科技有限公司合成(表1)。擴增反應中將2 μl模板cDNA、2 μl上下游引物的等比混合物、4 μl SYBR熒光染料依次加入384孔板(避光冰上操作),最終體積8 μl。每組3個復孔,實驗重復3次。放入實時定量PCR儀內反應進行相應的擴增反應并輸出循環閾值(Ct值),依照公式2-ΔΔCt法進行數據分析。
采用Western blot檢測CTGF及ECM相關蛋白CTGF、FN、ColⅠ、α-SMA的蛋白表達。病毒感染后72 h收集細胞進行總蛋白提取,調整蛋白濃度,以十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離蛋白復合物。經半干轉膜后,用5%脫脂奶粉室溫封閉1 h,進行一抗雜交;室溫孵育2 h后,以1倍洗膜緩沖液(TBST)洗膜3次,10 min/次;用辣根過氧化物酶標記的二抗繼續孵育1 h后,再以1倍TBST洗膜3次,10 min/次;最后加入增強化學發光法曝光底物,進行曝光并拍照。本實驗共重復3次。采用ImageJ 1.49v軟件進行灰度分析,以磷酸甘油醛脫氫酶為內參。
1.5 統計學分析
采用SPSS 19.0軟件進行統計分析。數據結果均符合正態分布,以均數±標準差(
 )表示。3組數據比較采用方差分析,組間兩兩比較采用Tukey檢驗。P<0.05為差異有統計學意義。
)表示。3組數據比較采用方差分析,組間兩兩比較采用Tukey檢驗。P<0.05為差異有統計學意義。
2 結果
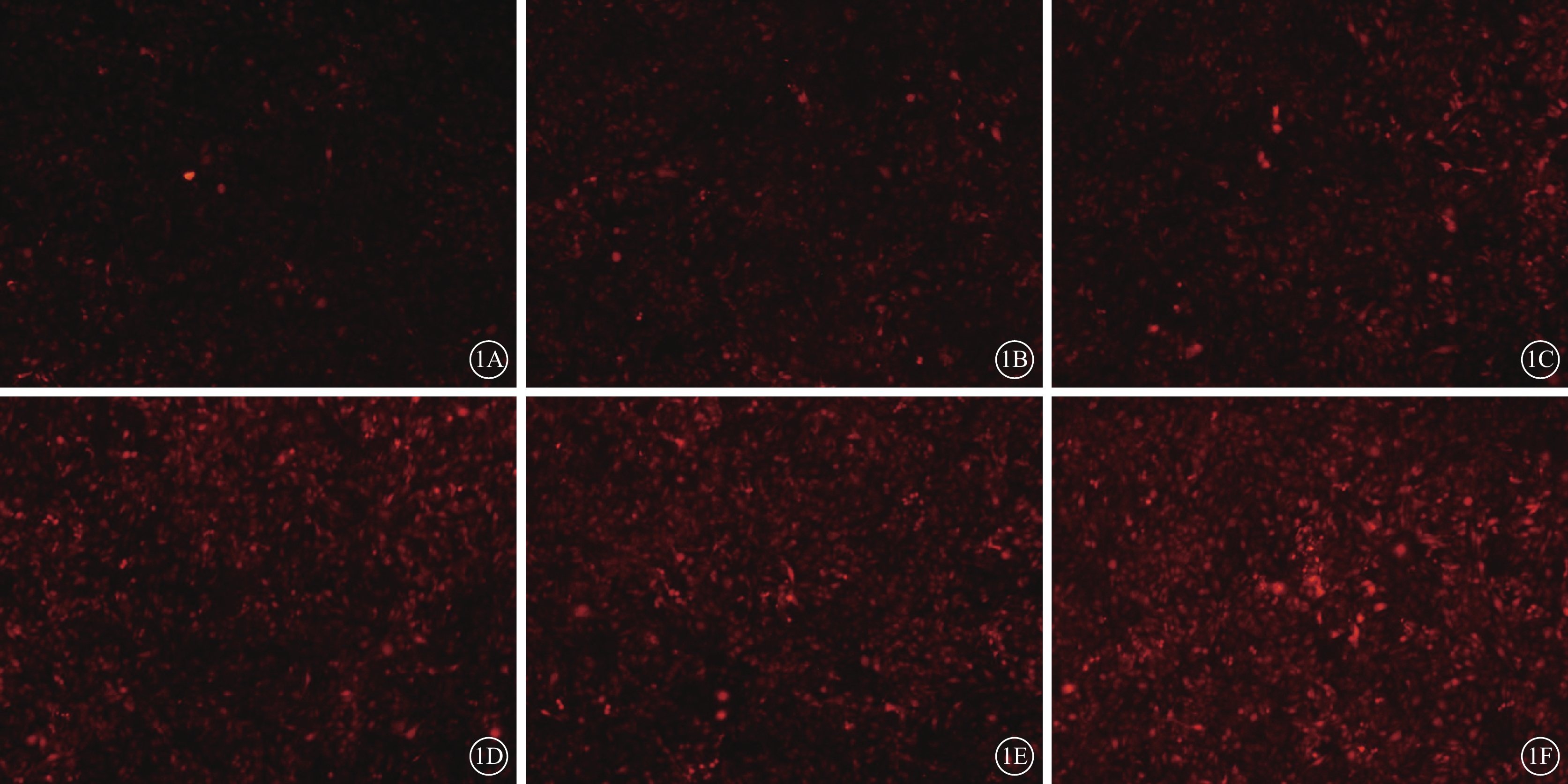
MOI 10、20、30的平均熒光強度分別為19.32±1.33、29.53±2.11、31.65±3.58;3組比較,差異有統計學意義(F=34.21,P=0.000)。兩兩比較結果顯示,MOI 10與MOI 20、30之間的差異均有統計學意義(P=0.000、0.000);MOI 20與MOI 30之間的差異無統計學意義(P=0.410);MOI 10與MOI 20之間的差異有統計學意義(P=0.000)(圖1A~1C)。MOI 20條件下感染時間24、48、72 h的平均熒光強度分別為39.61±1.69、42.00±2.50、55.21±2.70;3個時間點比較,差異有統計學意義(F=64.51,P=0.000)。兩兩比較結果顯示,72 h與24、48 h之間的差異均有統計學意義(P=0.000、0.000)(圖1D~1F)。
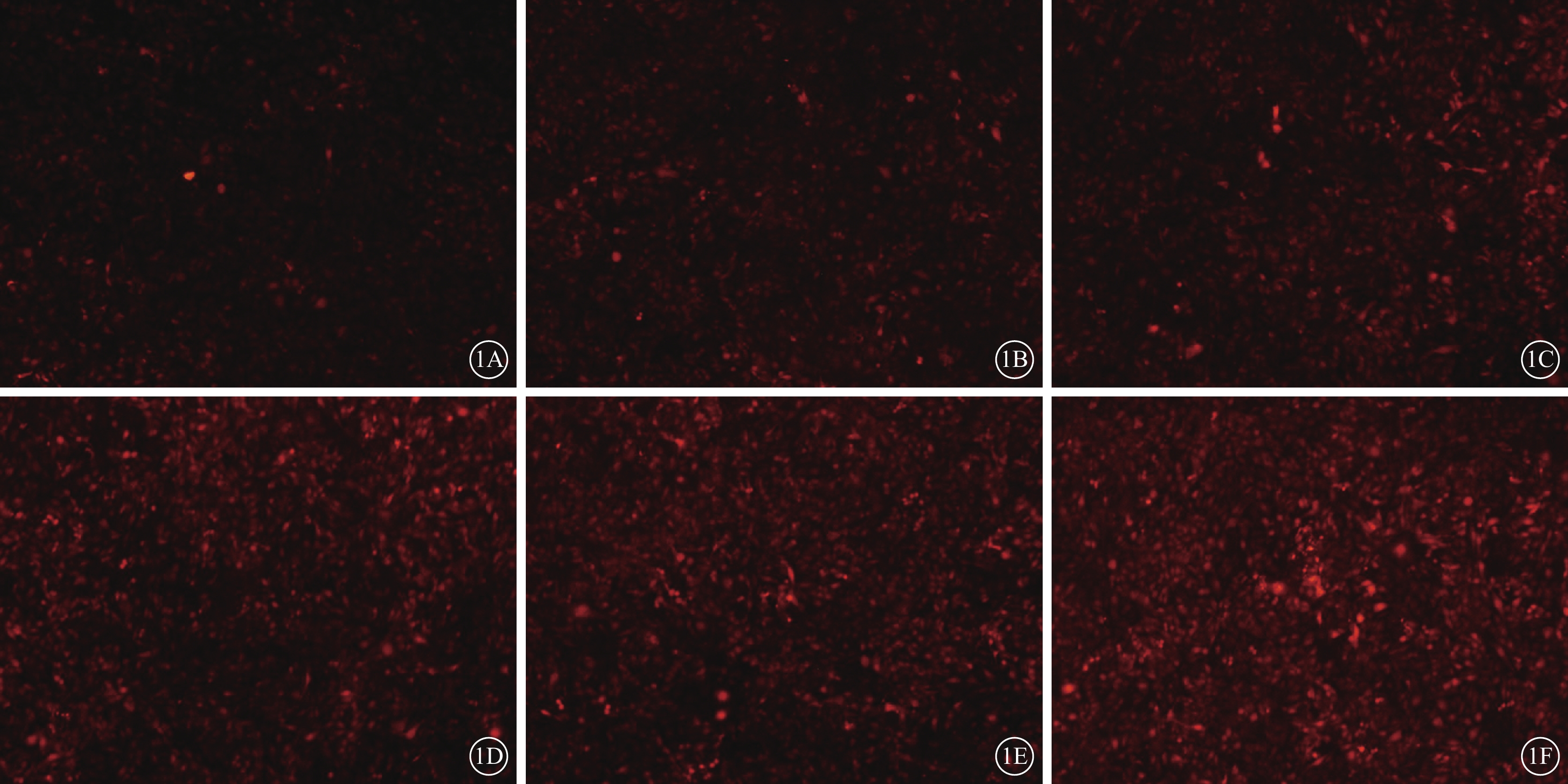 圖1
CTGF shRNA慢病毒顆粒感染RF/6A細胞熒光顯微鏡像。1A~1C.MOI 10、20、30;1D~1F.MOI 20條件下感染時間24、48、72 h。MOI 20、30較MOI 10熒光強度明顯增強;在MOI 20條件下,72 h熒光強度明顯高于24、48 h×40
圖1
CTGF shRNA慢病毒顆粒感染RF/6A細胞熒光顯微鏡像。1A~1C.MOI 10、20、30;1D~1F.MOI 20條件下感染時間24、48、72 h。MOI 20、30較MOI 10熒光強度明顯增強;在MOI 20條件下,72 h熒光強度明顯高于24、48 h×40
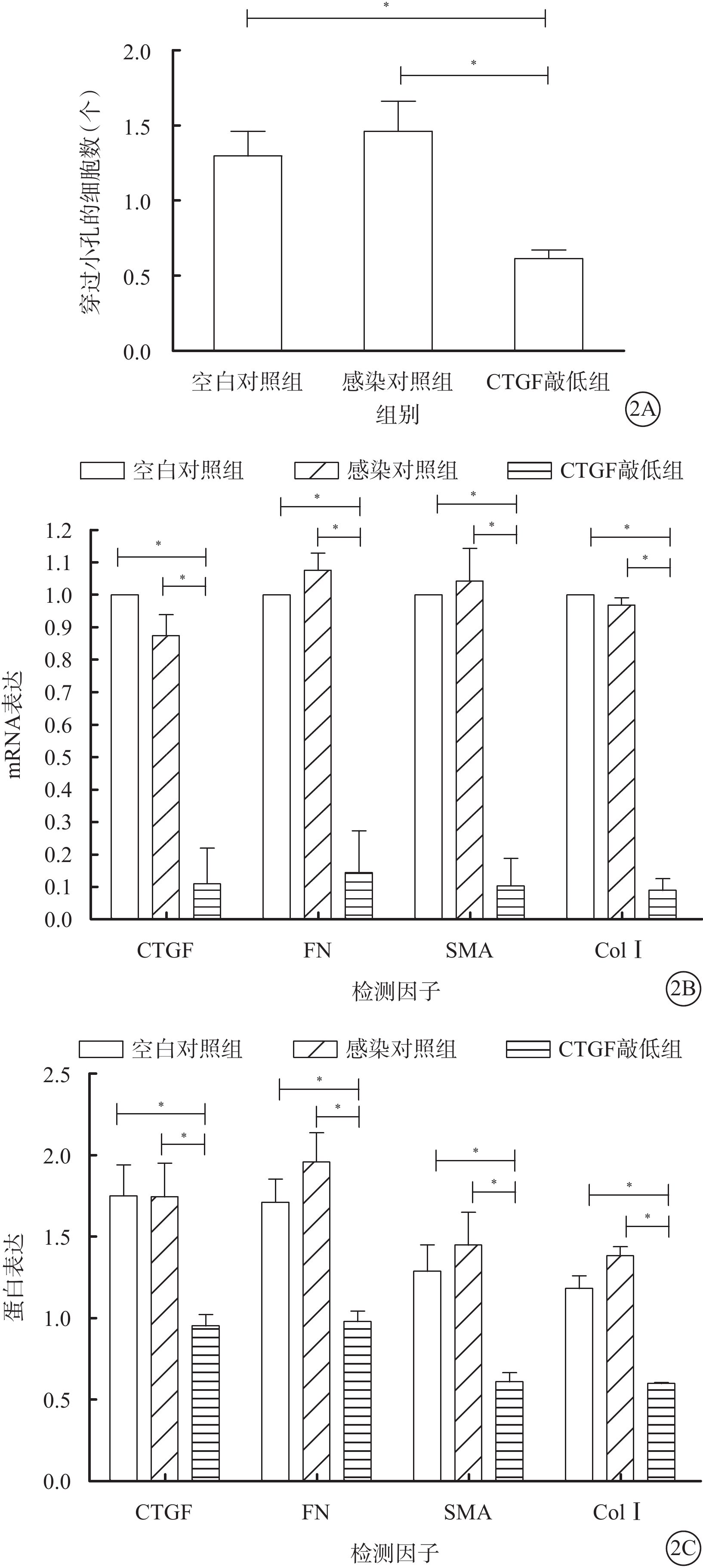
Transwell細胞遷移實驗結果顯示,空白對照組、感染對照組及CTGF敲低組穿過小孔的細胞數分別為(268.00±30.05)、(241.67±39.12)、(117.33±19.76)個。CTGF敲低組穿過小孔細胞數較空白對照組及感染對照組明顯降低,差異均有統計學意義(F=20.64,P=0.002)(圖2A)。
實時定量PCR檢測結果顯示,CTGF敲低組CTGF、FN、α-SMA、ColⅠ mRNA表達較空白對照組、感染對照組明顯降低,差異均有統計學意義(F=128.83、124.44、144.76、1 374.44,P=0.000、0.000、0.000、0.000)。感染對照組與空白對照組CTGF、FN、α-SMA、ColⅠ mRNA表達比較,差異無統計學意義(P=0.170、0.520、0.780、0.330)(圖2B)。
Western blot檢測結果顯示,CTGF敲低組CTGF、FN、α-SMA、ColⅠ蛋白表達較空白對照組、感染對照組明顯降低,差異均有統計學意義(F=22.55、41.60、25.73、161.68,P=0.002、0.000、0.001、0.000)。感染對照組與空白對照組CTGF、FN、α-SMA蛋白表達比較,差異無統計學意義(P=1.000、0.150、0.440);ColⅠ蛋白表達比較,差異有統計學意義(P=0.010)(圖2C)。
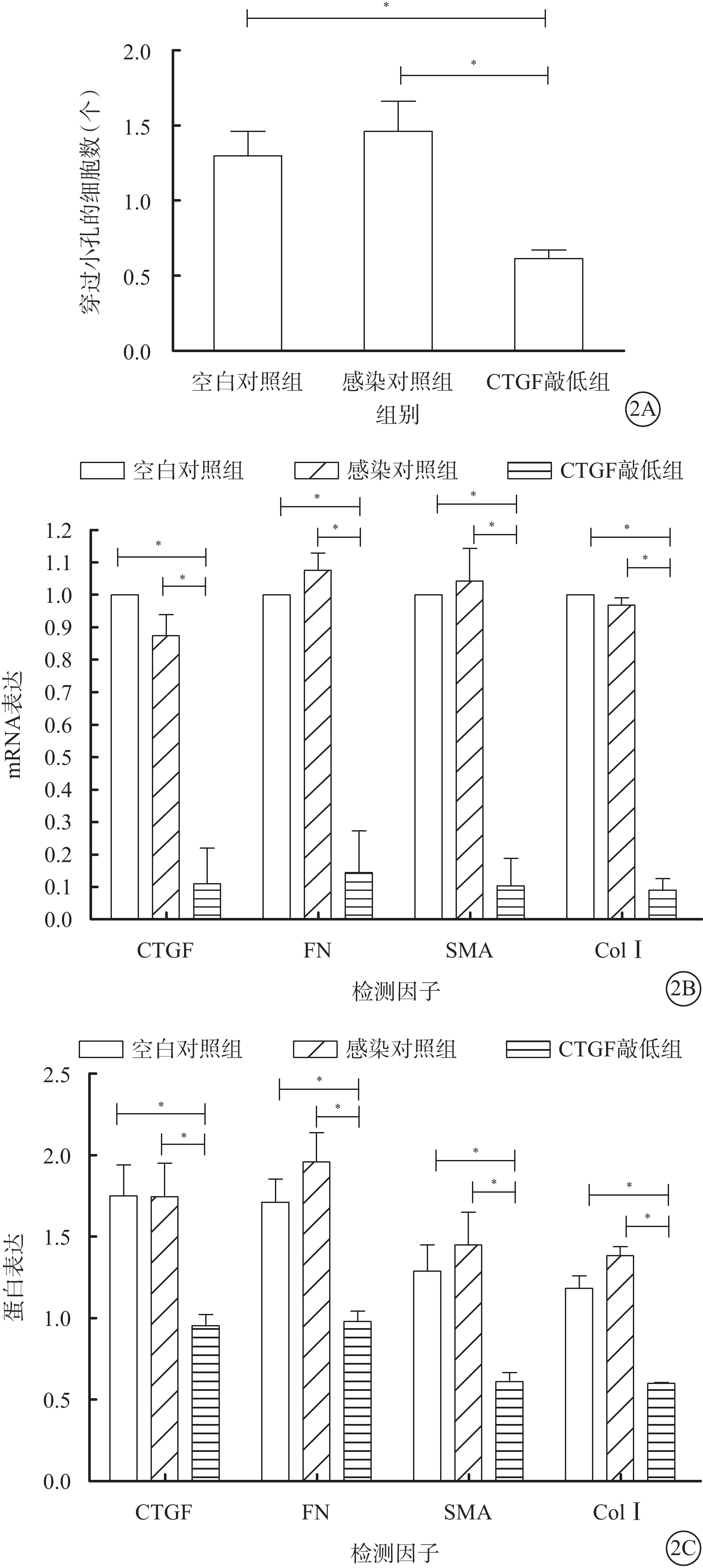 圖2
3組穿過小孔的細胞數及ECM相關蛋白mRNA、蛋白表達比較。2A.穿過小孔的細胞數;2B.ECM相關蛋白mRNA表達;2C.ECM相關蛋白表達。*P<0.05
圖2
3組穿過小孔的細胞數及ECM相關蛋白mRNA、蛋白表達比較。2A.穿過小孔的細胞數;2B.ECM相關蛋白mRNA表達;2C.ECM相關蛋白表達。*P<0.05
3 討論
Kuiper等[7]通過檢測患者玻璃體內VEGF和CTGF的表達水平,推測CTGF是PDR患者抗VEGF藥物治療后引起眼部纖維化的主要因素,并在此基礎上提出VEGF驅動玻璃體中的血管生成,CTGF調控纖維化的進展,CTGF和VEGF之間的平衡轉換達到一定的閾值比率時,血管生成減弱,纖維化狀態增強,導致瘢痕形成。CTGF和VEGF之間這種實時動態的轉化關系被稱為“血管纖維化開關”[7-9]。近年來包括我們在內的多個研究團隊持續關注于此并不斷開展相關的深入研究。
鑒于CTGF的表達水平是平衡抗VEGF藥物治療療效與纖維化穩態的關鍵點及突破口之一,可作為調控血管纖維化天平的重要砝碼,因此本研究選擇CTGF shRNA慢病毒工具,目的在于特異性下調細胞中內源性CTGF表達。CTGF shRNA慢病毒載體構建shRNA載體的優勢在于:(1)慢病毒可以感染難轉染的細胞,并且可感染的細胞種類多,針對視網膜組織中存在多種不同類型細胞的解剖特點,慢病毒載體可實現血管內皮細胞、色素上皮細胞、神經節細胞等多種細胞的同時感染,從而大大提高視網膜中CTGF的敲低效率[10-11]。(2)慢病毒載體所攜帶的目的基因可以整合入細胞基因組,從而獲得其穩定長期表達,實現shRNA可以長時間下調目的基因CTGF的表達;臨床意義在于延長藥物的半衰期,減少注藥次數,從而避免反復玻璃體腔注射引發的眼內炎等并發癥[12]。(3)目前所用的慢病毒包裝技術已經較為成熟,其制備成本可為大眾接受,具有良好的經濟適用性,為不斷擴大受眾人群范圍提供有力的前提條件[12]。并且,慢病毒載體的安全性已達到較高水平,可為逐步走向臨床治療提供有力的保障[13]。
實驗中我們制備CTGF shRNA慢病毒顆粒,通過篩選最佳MOI及感染時間來明確其較優工作條件。結果顯示,以MOI 20、時點72 h的CTGF病毒轉染率效果最佳,可以有效下調CTGF表達水平。在此基礎上,我們通過Transwell細胞遷移實驗以及對比分析CTGF shRNA慢病毒感染前后FN、α-SAM、ColⅠ等ECM相關蛋白的表達情況進一步分析CTGF shRNA慢病毒顆粒感染RF/6A細胞后產生的一系列生物學效應。結果顯示,CTGF受抑制后,RF/6A細胞的遷移能力明顯下降;CTGF shRNA慢病毒感染可顯著下調FN、α-SAM、ColⅠmRNA及蛋白表達。CTGF作為纖維化的效應分子,不僅可以直接參與纖維化的調控,亦可調控與ECM相關蛋白因子的表達[14]。說明上述因子均可作為衡量CTGF shRNA發揮作用與否的輔助參數。生理狀態下CTGF誘導ECM在正常結締組織功能和傷口愈合中發揮作用[15]。FN促進傷口愈合甚至角膜上皮愈合[16]。α-SMA產生ECM并促使其收縮促進傷口愈合[17]。ColⅠ在組織修復中發揮積極作用[18]。病理狀態下,CTGF對Col、FN、層粘連蛋白以及副纖維連接蛋白等ECM的產生均有調節作用,如FN增加Col產生和基質積聚,α-SMA通過轉化生長因子(TGF)-β1介導的Smad通路加劇腎間質纖維化,TGF-β1通過Smad信號通路亦可誘導Col過量表達加劇纖維化[19-22]。后三者均是ECM的蛋白因子,在纖維化調控中發揮相應的作用。如若抗CTGF藥物劑量過大,引起三者缺失時,則會對機體的組織修復、傷口愈合產生一定的影響。因此不斷通過細胞實驗完善對CTGF shRNA用量的探索,實現既抑制病理性纖維化又不影響其生理作用的發揮,為抗VEGF藥物聯合抗CTGF雙靶點治療PDR中CTGF shRNA最佳劑量的探索提供分子生物學依據。
本實驗研究以兩方面平衡理論為基礎。一方面維持抗VEGF與纖維化開關平衡,通過抗VEGF藥物減少血管新生,但同時減輕其帶來的纖維化加劇;另一方面維持正常生理功能與病理性纖維化之間的平衡,即抗CTGF既不影響組織正常生長發育,又最大限度減輕纖維化。兩方面的平衡是對CTGF shRNA進行定量分析探索的關鍵,是雙靶點治療PDR的重要基礎,也是本研究團隊今后研究及探索的方向。
視網膜新生血管與纖維血管膜是增生型糖尿病視網膜病變(PDR)的標志性特征[1]。抗血管內皮生長因子(VEGF)藥物因其在新生血管性及滲出性病變中的顯著療效而逐漸成為輔助治療PDR的有效方式[2-3];但大量研究發現,抗VEGF藥物治療可導致結締組織生長因子(CTGF)表達升高而加劇纖維化進展[4]。我們前期研究發現,經抗VEGF藥物治療的PDR患者增生膜中VEGF表達明顯降低,但CTGF表達顯著上調[5]。提示血管新生和纖維化增生之間存在此消彼長的蹺板關系及轉換機制,而CTGF干預可能成為抗VEGF藥物治療PDR后緩解纖維化加劇的新型有效方式[6]。為探尋在拮抗VEGF表達的治療中針對性下調CTGF表達、抑制纖維化進程的方法,我們通過制備CTGF重組干擾載體(shRNA)慢病毒顆粒并篩選最佳感染復數(MOI)及感染時間來明確CTGF shRNA慢病毒顆粒的較優工作條件,綜合分析了CTGF shRNA慢病毒顆粒感染血管內皮細胞后產生的一系列生物學效應,以期為日后臨床治療中特異性下調內源性CTGF表達進而平衡抗VEGF與纖維化之間關系提供有效的分子工具。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料及實驗分組
恒河猴視網膜血管內皮細胞(RF/6A),由天津醫科大學眼科醫院研究所自行保存。胰蛋白酶、胎牛血清、青鏈霉素(美國Gibco公司);T75細胞培養瓶及6孔板(美國Corning公司);抗CTGF抗體(ab135812)、抗纖連蛋白抗體(ab2413)、抗膠原蛋白Ⅰ抗體(ab34710)、抗α-平滑肌肌動蛋白(α-SMA)抗體(ab5694)、聚偏二氟乙烯膜、化學發光液(美國Millipore公司);慢病毒載體pHB-U6-MCS-zsgreen-puro、pHB-U6-MCS-zsgre en-puro-Scramble質粒(上海漢恒公司);Transwell小室(美國Coming公司);HEK293FT細胞、psPAX2 質粒、pMD2G質粒、聚凝胺、Trizol試劑盒(美國Ambion公司); 磷酸鹽緩沖液(PBS)、RPMI-1640培養基(上海立菲生物技術有限公司)。
用含10%胎牛血清的RPMI-1640完全培養基培養細胞(100 U/ml青霉素及100 μg/ml鏈霉素),置于37℃、5%CO2的培養箱中培養。取第3代細胞用于實驗,并將其分為空白對照組(正常培養)、感染對照組(Scramble shRNA病毒感染)及CTGF敲低組(CTGFshRNA病毒感染)。
1.2 CTGF shRNA質粒構建及病毒包裝
構建CTGF shRNA。根據siRNA干擾序列GCGAGGTCATGAAGAAGAACATGAT安排引物合成。將生物公司合成的PAGE膠純化的Oligo序列分別稀釋至 100 μmol/L作為引物,應用退火程序95 ℃ 10 min,75 ℃10 min,55 ℃ 10 min,35 ℃ 10 min,15 ℃ 10 min形成帶粘性末端的雙鏈片段。用限制性內切酶BamHI/EcoRI對表達載體進行酶切,制備線性化表達載體。將干擾片段連接入表達載體,通過CaCl2法進行轉化試驗,轉化后人源CTGF shRNA平板挑菌,37 ℃ 250 r/min搖菌14 h,將菌液送測序公司測序。經測序驗證正確的陽性克隆,安排質粒小提。因載體質粒帶有紅色熒光標記,在熒光顯微鏡下呈現紅色熒光。
使用三質粒包裝系統獲得高滴度的慢病毒顆粒。鋪板293T細胞用于轉染。操作完畢后置于37 ℃、5%CO2和95%相對濕度的培養箱中。待細胞密度達到70%~80%的匯合率進行轉染。在37 ℃水浴中預熱OptiMEM,將LipofiterTM轉染試劑恢復至室溫做脂轉復合體,轉染后更換含10%胎牛血清的新鮮完全培養基,轉染后48、72 h時分別收集病毒上清。在48 h收毒時,將100 mm培養皿中的培養基倒入50 ml離心管中,隨后補入10 ml含10%胎牛血清的新鮮完全培養基,平穩置于37 ℃、5%CO2的恒溫培養箱中繼續培養。在72 h收毒時,直接將100 mm培養皿中的培養基倒入50 ml離心管中,將50 ml離心管中的病毒上清于4 ℃、2000×g離心10 min,去除細胞碎片;然后收集病毒原液上清置于超速離心管中,4 ℃、82 700×g離心120 min,最后將慢病毒超離分裝到滅菌處理的病毒管中于?80 ℃冰箱保存備用。得到對照組病毒滴度為1×108 TU/ml,CTGF shRNA滴度為2×108 TU/ml。
1.3 慢病毒感染RF/6A細胞,明確最佳MOI及感染時間
不同MOI條件下CTGF shRNA慢病毒感染RF/6A細胞。將狀態良好的RF/6A細胞以密度6×105個/孔隨機接種至3份24孔板中,以24 h后密度達到50%~60%為宜,每孔給予0.5 ml聚凝胺培養基混合物以提高細胞感染效率,使其終濃度為6 ng/ml·孔,室溫靜置30 min后吸除培養基,分別向不同24板孔中加入8.3、16.7、25 μl CTGF shRNA慢病毒顆粒,分別標記為MOI 10、20、30,4 h后補齊培養液至正常體積500 μl/孔,24 h后換液,繼續37℃培養,48 h后換液,繼續37℃培養,72 h后換液通過熒光顯微鏡下觀測慢病毒感染效率。應用ImageJ軟件對感染結果進行量化分析。選取待量化分析圖片,分別隨機圈選5個區域,測量得出平均熒光強度數據,記錄后取均值進行統計學分析。
MOI 20 CTGF shRNA慢病毒顆粒感染RF/6A細胞24、48、72 h。每孔加入16.7 μl CTGF shRNA慢病毒顆粒在24、48、72 h進行觀察,余方法同上。
1.4 Transwell細胞遷移實驗、實時定量聚合酶鏈反應(PCR)及蛋白免疫印跡(Western blot)檢測
Transwell小室的上室中預先加入100 μl完全培養基后,置于細胞培養箱進行濕潤及預熱30 min,利用這段時間準備細胞混懸液。細胞取自MOI 20 CTGF shRNA慢病毒顆粒感染72 h的RF/6A細胞,并調整其細胞密度為1×105個/ml。30 min后從細胞培養箱取出Transwell小室,向下室加600 μl完全培養基,向上室加100 μl配置的細胞混懸液,再次放入細胞培養箱培養繼續培養24 h后行常規蘇木精伊紅染色以示蹤細胞。染色完成后用棉簽輕輕擦拭以去除小室上表面細胞,晾干后用無菌尖刀片將小室底面切下,進行中性樹膠封片,每組設置3個復孔,本實驗重復3次。具體量化方法為首先利用顯微鏡拍照,隨后每個分組隨機選4~5個視野用以計數小室底膜下室側附著的細胞,即為發生遷移的細胞數,記錄并保存數據進行后續的統計學分析。
采用實時定量PCR檢測CTGF及細胞外基質(ECM)相關蛋白CTGF、纖連蛋白(FN)、α-SMA、Ⅰ型膠原蛋白(ColⅠ)的mRNA表達。按Trizol提取液說明書抽提細胞總RNA,經分光光度計檢測其濃度,以吸光度[A,舊稱光密度(OD)]260/A280比值介于1.8~2.0之間視為RNA提取質量良好。根據測得的RNA濃度,來計算1 μg RNA所對應的體積,加入到提前置于冰上的無菌無核酸酶的0.2 ml PCR管中,并按照順序依次加入逆轉錄反應所需組分,建立一個總量為20 μl的體系,依次歷經65 ℃孵育5 min,42 ℃孵育60 min,70 ℃加熱5 min,得到cDNA的產物直接用于后續PCR反應。根據NCBI數據庫中的CTGF、FN、ColⅠ、α-SMA設計引物序列,由金唯智生物科技有限公司合成(表1)。擴增反應中將2 μl模板cDNA、2 μl上下游引物的等比混合物、4 μl SYBR熒光染料依次加入384孔板(避光冰上操作),最終體積8 μl。每組3個復孔,實驗重復3次。放入實時定量PCR儀內反應進行相應的擴增反應并輸出循環閾值(Ct值),依照公式2-ΔΔCt法進行數據分析。
采用Western blot檢測CTGF及ECM相關蛋白CTGF、FN、ColⅠ、α-SMA的蛋白表達。病毒感染后72 h收集細胞進行總蛋白提取,調整蛋白濃度,以十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離蛋白復合物。經半干轉膜后,用5%脫脂奶粉室溫封閉1 h,進行一抗雜交;室溫孵育2 h后,以1倍洗膜緩沖液(TBST)洗膜3次,10 min/次;用辣根過氧化物酶標記的二抗繼續孵育1 h后,再以1倍TBST洗膜3次,10 min/次;最后加入增強化學發光法曝光底物,進行曝光并拍照。本實驗共重復3次。采用ImageJ 1.49v軟件進行灰度分析,以磷酸甘油醛脫氫酶為內參。
1.5 統計學分析
采用SPSS 19.0軟件進行統計分析。數據結果均符合正態分布,以均數±標準差(
 )表示。3組數據比較采用方差分析,組間兩兩比較采用Tukey檢驗。P<0.05為差異有統計學意義。
)表示。3組數據比較采用方差分析,組間兩兩比較采用Tukey檢驗。P<0.05為差異有統計學意義。
2 結果
MOI 10、20、30的平均熒光強度分別為19.32±1.33、29.53±2.11、31.65±3.58;3組比較,差異有統計學意義(F=34.21,P=0.000)。兩兩比較結果顯示,MOI 10與MOI 20、30之間的差異均有統計學意義(P=0.000、0.000);MOI 20與MOI 30之間的差異無統計學意義(P=0.410);MOI 10與MOI 20之間的差異有統計學意義(P=0.000)(圖1A~1C)。MOI 20條件下感染時間24、48、72 h的平均熒光強度分別為39.61±1.69、42.00±2.50、55.21±2.70;3個時間點比較,差異有統計學意義(F=64.51,P=0.000)。兩兩比較結果顯示,72 h與24、48 h之間的差異均有統計學意義(P=0.000、0.000)(圖1D~1F)。
 圖1
CTGF shRNA慢病毒顆粒感染RF/6A細胞熒光顯微鏡像。1A~1C.MOI 10、20、30;1D~1F.MOI 20條件下感染時間24、48、72 h。MOI 20、30較MOI 10熒光強度明顯增強;在MOI 20條件下,72 h熒光強度明顯高于24、48 h×40
圖1
CTGF shRNA慢病毒顆粒感染RF/6A細胞熒光顯微鏡像。1A~1C.MOI 10、20、30;1D~1F.MOI 20條件下感染時間24、48、72 h。MOI 20、30較MOI 10熒光強度明顯增強;在MOI 20條件下,72 h熒光強度明顯高于24、48 h×40
Transwell細胞遷移實驗結果顯示,空白對照組、感染對照組及CTGF敲低組穿過小孔的細胞數分別為(268.00±30.05)、(241.67±39.12)、(117.33±19.76)個。CTGF敲低組穿過小孔細胞數較空白對照組及感染對照組明顯降低,差異均有統計學意義(F=20.64,P=0.002)(圖2A)。
實時定量PCR檢測結果顯示,CTGF敲低組CTGF、FN、α-SMA、ColⅠ mRNA表達較空白對照組、感染對照組明顯降低,差異均有統計學意義(F=128.83、124.44、144.76、1 374.44,P=0.000、0.000、0.000、0.000)。感染對照組與空白對照組CTGF、FN、α-SMA、ColⅠ mRNA表達比較,差異無統計學意義(P=0.170、0.520、0.780、0.330)(圖2B)。
Western blot檢測結果顯示,CTGF敲低組CTGF、FN、α-SMA、ColⅠ蛋白表達較空白對照組、感染對照組明顯降低,差異均有統計學意義(F=22.55、41.60、25.73、161.68,P=0.002、0.000、0.001、0.000)。感染對照組與空白對照組CTGF、FN、α-SMA蛋白表達比較,差異無統計學意義(P=1.000、0.150、0.440);ColⅠ蛋白表達比較,差異有統計學意義(P=0.010)(圖2C)。
 圖2
3組穿過小孔的細胞數及ECM相關蛋白mRNA、蛋白表達比較。2A.穿過小孔的細胞數;2B.ECM相關蛋白mRNA表達;2C.ECM相關蛋白表達。*P<0.05
圖2
3組穿過小孔的細胞數及ECM相關蛋白mRNA、蛋白表達比較。2A.穿過小孔的細胞數;2B.ECM相關蛋白mRNA表達;2C.ECM相關蛋白表達。*P<0.05
3 討論
Kuiper等[7]通過檢測患者玻璃體內VEGF和CTGF的表達水平,推測CTGF是PDR患者抗VEGF藥物治療后引起眼部纖維化的主要因素,并在此基礎上提出VEGF驅動玻璃體中的血管生成,CTGF調控纖維化的進展,CTGF和VEGF之間的平衡轉換達到一定的閾值比率時,血管生成減弱,纖維化狀態增強,導致瘢痕形成。CTGF和VEGF之間這種實時動態的轉化關系被稱為“血管纖維化開關”[7-9]。近年來包括我們在內的多個研究團隊持續關注于此并不斷開展相關的深入研究。
鑒于CTGF的表達水平是平衡抗VEGF藥物治療療效與纖維化穩態的關鍵點及突破口之一,可作為調控血管纖維化天平的重要砝碼,因此本研究選擇CTGF shRNA慢病毒工具,目的在于特異性下調細胞中內源性CTGF表達。CTGF shRNA慢病毒載體構建shRNA載體的優勢在于:(1)慢病毒可以感染難轉染的細胞,并且可感染的細胞種類多,針對視網膜組織中存在多種不同類型細胞的解剖特點,慢病毒載體可實現血管內皮細胞、色素上皮細胞、神經節細胞等多種細胞的同時感染,從而大大提高視網膜中CTGF的敲低效率[10-11]。(2)慢病毒載體所攜帶的目的基因可以整合入細胞基因組,從而獲得其穩定長期表達,實現shRNA可以長時間下調目的基因CTGF的表達;臨床意義在于延長藥物的半衰期,減少注藥次數,從而避免反復玻璃體腔注射引發的眼內炎等并發癥[12]。(3)目前所用的慢病毒包裝技術已經較為成熟,其制備成本可為大眾接受,具有良好的經濟適用性,為不斷擴大受眾人群范圍提供有力的前提條件[12]。并且,慢病毒載體的安全性已達到較高水平,可為逐步走向臨床治療提供有力的保障[13]。
實驗中我們制備CTGF shRNA慢病毒顆粒,通過篩選最佳MOI及感染時間來明確其較優工作條件。結果顯示,以MOI 20、時點72 h的CTGF病毒轉染率效果最佳,可以有效下調CTGF表達水平。在此基礎上,我們通過Transwell細胞遷移實驗以及對比分析CTGF shRNA慢病毒感染前后FN、α-SAM、ColⅠ等ECM相關蛋白的表達情況進一步分析CTGF shRNA慢病毒顆粒感染RF/6A細胞后產生的一系列生物學效應。結果顯示,CTGF受抑制后,RF/6A細胞的遷移能力明顯下降;CTGF shRNA慢病毒感染可顯著下調FN、α-SAM、ColⅠmRNA及蛋白表達。CTGF作為纖維化的效應分子,不僅可以直接參與纖維化的調控,亦可調控與ECM相關蛋白因子的表達[14]。說明上述因子均可作為衡量CTGF shRNA發揮作用與否的輔助參數。生理狀態下CTGF誘導ECM在正常結締組織功能和傷口愈合中發揮作用[15]。FN促進傷口愈合甚至角膜上皮愈合[16]。α-SMA產生ECM并促使其收縮促進傷口愈合[17]。ColⅠ在組織修復中發揮積極作用[18]。病理狀態下,CTGF對Col、FN、層粘連蛋白以及副纖維連接蛋白等ECM的產生均有調節作用,如FN增加Col產生和基質積聚,α-SMA通過轉化生長因子(TGF)-β1介導的Smad通路加劇腎間質纖維化,TGF-β1通過Smad信號通路亦可誘導Col過量表達加劇纖維化[19-22]。后三者均是ECM的蛋白因子,在纖維化調控中發揮相應的作用。如若抗CTGF藥物劑量過大,引起三者缺失時,則會對機體的組織修復、傷口愈合產生一定的影響。因此不斷通過細胞實驗完善對CTGF shRNA用量的探索,實現既抑制病理性纖維化又不影響其生理作用的發揮,為抗VEGF藥物聯合抗CTGF雙靶點治療PDR中CTGF shRNA最佳劑量的探索提供分子生物學依據。
本實驗研究以兩方面平衡理論為基礎。一方面維持抗VEGF與纖維化開關平衡,通過抗VEGF藥物減少血管新生,但同時減輕其帶來的纖維化加劇;另一方面維持正常生理功能與病理性纖維化之間的平衡,即抗CTGF既不影響組織正常生長發育,又最大限度減輕纖維化。兩方面的平衡是對CTGF shRNA進行定量分析探索的關鍵,是雙靶點治療PDR的重要基礎,也是本研究團隊今后研究及探索的方向。