引用本文: 謝若天, 白伶伶, 楊靜, 栗勇濤, 東莉潔, 馬菲菲, 李筱榮, 張曉敏. 大鼠來源的間充質干細胞外泌體對實驗性自身免疫性葡萄膜炎大鼠模型的治療作用. 中華眼底病雜志, 2018, 34(6): 562-567. doi: 10.3760/cma.j.issn.1005-1015.2018.06.008 復制
自身免疫性葡萄膜炎是常見致盲性疾病。目前臨床主要采用皮質類固醇、免疫抑制劑和生物制劑進行治療,但這些藥物長期應用可出現嚴重的全身副作用;并且,部分患者療效欠佳,尋求更加安全有效的治療藥物仍是葡萄膜炎研究的核心問題[1-2]。間充質干細胞(MSC)是一種中胚層來源的多能干細胞,在體內外均顯現出對多種免疫細胞的抑制作用,可有效治療多種類型自身免疫性葡萄膜炎動物模型[3-9]。外泌體是一種有著脂質雙分子層結構的納米級小囊泡,直徑在40~100 nm之間,可以介導細胞與細胞之間的信號傳導。已有研究表明,MSC外泌體表現出與MSC相似的功能,在旁分泌介導的免疫抑制機制中可能發揮作用[10]。本研究通過建立實驗性自身免疫性葡萄膜炎(EAU)大鼠模型,觀察MSC外泌體對EAU的局部治療效果,探究其是否能影響疾病進程及其作用機制,以期為臨床自身免疫性疾病新的無細胞療法提供思路。現將結果報道如下。
1 材料和方法
1.1 MSC外泌體分離和鑒定
取5周齡Wistar大鼠1只[SCXK(京)2016-0006],取出股骨和脛骨,在骨骺端打孔,用無血清的Dulbecco改良Eagle培養基(DMEM)/F12沖洗髓腔,將沖洗液以161 g離心8 min,棄上清液,用含10%胎牛血清的DMEM/F12重懸至T75培養瓶,在37 ℃、5%CO2飽和濕度下孵育,每3天換一次液。細胞培養至融合達80%以上時用胰酶消化傳代。取3~5代MSC用于后續實驗。采用流式細胞儀檢測MSC表面標記表達情況(CD29、CD90陽性,CD34、CD45陰性);在特定體外環境下進行MSC成骨分化、成內皮分化和成脂肪分化,檢測MSC的干細胞特性。
用完全培養基培養MSC 2 d后,換為含10%無外泌體血清的培養基,培養24 h后收取培養基。4 ℃條件下200×g離心10 min,2000×g離心20 min,10 000×g離心30 min,110 000×g離心7 h,隨后用0.22 μm濾膜過濾,從而得到無外泌體的血清。MSC外泌體提取與上述梯度離心法相似,僅將最后一步改為離心2 h。沉淀用磷酸鹽緩沖液(PBS)重懸,0.22 μm濾膜過濾,?80℃儲存。采用透射電子顯微鏡鑒定外泌體。
1.2 EAU建模及MSC外泌體治療
將12只Lewis大鼠[SCXK(京)2016-0006]采用隨機數字表法隨機分為實驗組和對照組,每組6只大鼠。將人光感受器相關結合蛋白1177-1191和結核菌素濃度為2.5 g/L的弗氏佐劑混合成乳劑,在實驗組大鼠尾根部和背部皮下注射至少6個點,每只大鼠注射乳劑200 μl建立EAU模型。建模后第9天,采用10%水合氯醛腹腔注射麻醉大鼠,奧布卡因滴眼液行眼球表面麻醉,鑷子輔助固定眼球,胰島素注射器于結膜面平行眼球進針,進針深度3.5 mm,單次注射外泌體100 μl(含量50 μg),退出針頭,氧氟沙星眼膏涂抹結膜囊。對照組大鼠注射相同體積的PBS。參照Caspi臨床分級[11]在建模6 d后開始給大鼠進行臨床評分。分別在第15、20天處死大鼠,摘除眼球于4%多聚甲醛浸泡1 h后用10%多聚甲醛浸泡24 h以上;隨后石蠟固定切片行視網膜組織病理蘇木精伊紅(HE)染色,光學顯微鏡下觀察大鼠視網膜組織結構,并對其病理進行評分[11]。
1.3 免疫組織化學染色、T細胞增生實驗、流式細胞技術及視網膜電圖(ERG)檢測
建模后第15、20天,采用視網膜免疫組織化學染色觀察巨噬細胞表面標志物CD68的表達。石蠟切片脫蠟脫水以后,微波處理5 min,用含有3%H2O2的PBS浸泡15 min。隨后將切片用5%牛血清白蛋白封閉30 min,4 ℃條件下一抗孵育過夜。PBS洗滌后滴加生物素標記二抗孵育30 min,二氨基聯苯胺(DAB)顯色2~5 min。以黃色或棕黃色染色為CD68陽性表達。
建模后第12天,取實驗組大鼠脾臟T淋巴細胞,不同濃度梯度(1、10、30 μg/ml)R16特異性抗原與不同濃度梯度(0.1、0.5、1.0、10.0 μg/ml)外泌體體外培養48 h,5-溴脫氧尿嘧啶核苷(Brdu)標記后繼續培養8 h,加入Brdu抗體及顯色液,酶標儀檢測450 nm處吸光度[A,舊稱光密度(OD)]值。
建模后第15天,取大鼠眼球和引流淋巴結制備細胞懸液。取2×105個細胞在含有50 ng/ml佛波酯、1 μg/ml離子霉素和1 μg/ml布雷菲德菌素A的培養基中刺激4~6 h后,用CD4的流式抗體標記。固定、過夜破膜后,用干擾素(IFN)-γ和白細胞介素-17的抗體標記從而檢測Th1和Th17細胞。Foxp3+的T細胞通過標記CD4、CD25抗體,過夜固定破膜后標記Foxp3的抗體檢測。
建模后第12、15、21天,采用ERG評估大鼠視網膜功能,檢測前1 d將大鼠做暗適應處理。腹膜下注射10%水合氯醛全身麻醉大鼠,丙美卡因滴眼液行眼部麻醉,復方托吡卡胺滴眼液散瞳。將角膜接觸環狀電極放置在角膜上,參考電極和接地電極分別放置在耳后和尾部皮下,分別記錄大鼠對10次0.01、3.0 cd/m2白色閃光的反應平均值。從a波的波谷到b波的波峰為b波振幅,從基線到第1次波谷為a波振幅。a、b波峰時值為閃光刺激開始到波峰的時間。
1.4 統計學方法
采用SAS 9.2軟件進行統計學處理,數據以均數±標準差(
 ±s)表示。EAU臨床評分通過方差分析檢驗,組間數據比較采用 t 檢驗,T細胞增生實驗中各組對比采用單因素方差分析。P<0.05 為差異有統計學意義。
±s)表示。EAU臨床評分通過方差分析檢驗,組間數據比較采用 t 檢驗,T細胞增生實驗中各組對比采用單因素方差分析。P<0.05 為差異有統計學意義。
2 結果
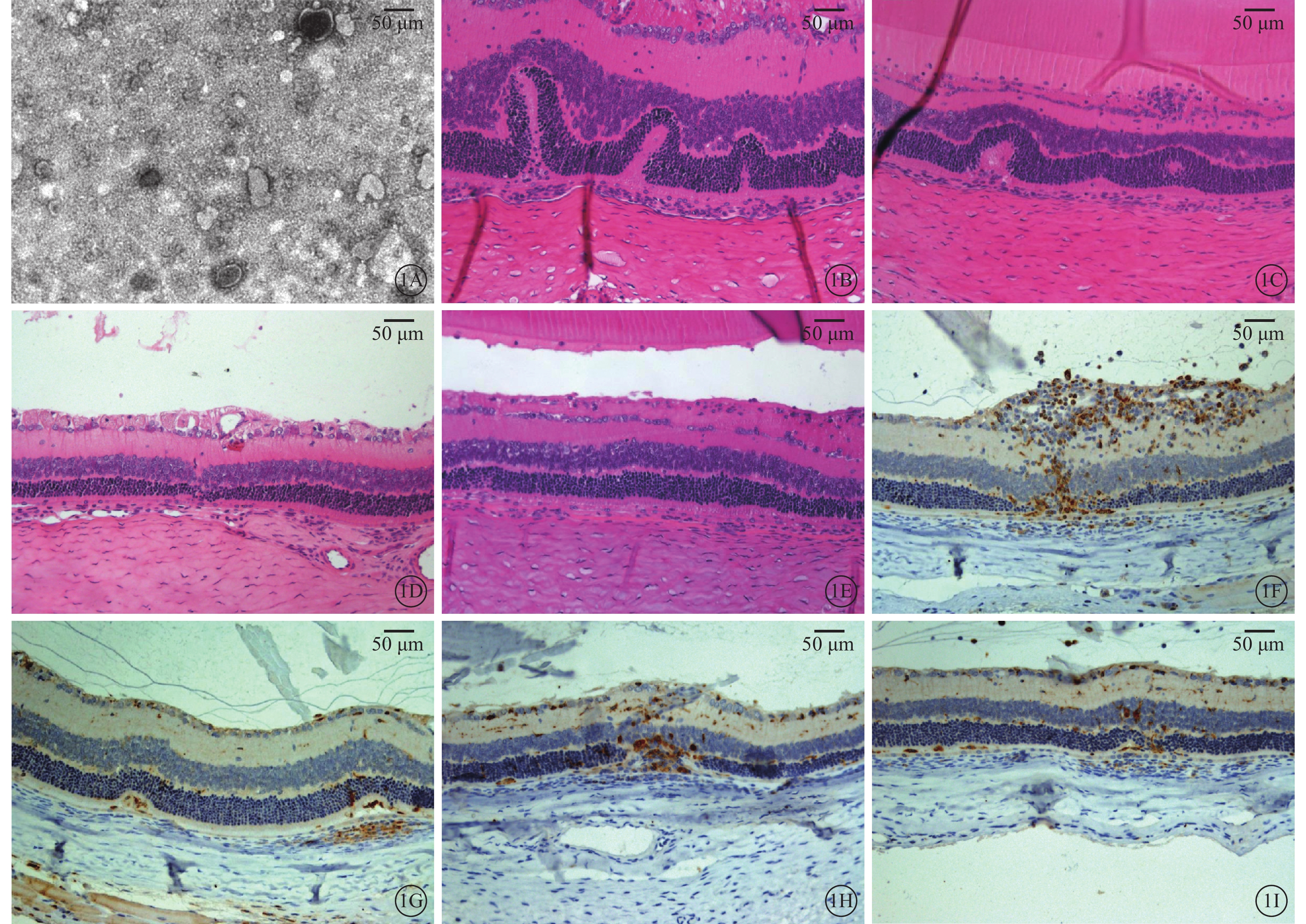
透射電子顯微鏡觀察發現,從大鼠骨髓MSC培養上清液中提取的外泌體為40~100 nm的小囊泡結構(圖1A)。
建模后第15、20天,HE染色觀察發現,實驗組眼球后極部視網膜各層結構較對照組完整,炎性細胞浸潤少(圖1B~1E);免疫組織化學染色觀察發現,實驗組大鼠視網膜CD68陽性表達明顯少于對照組(圖1F~1I)。
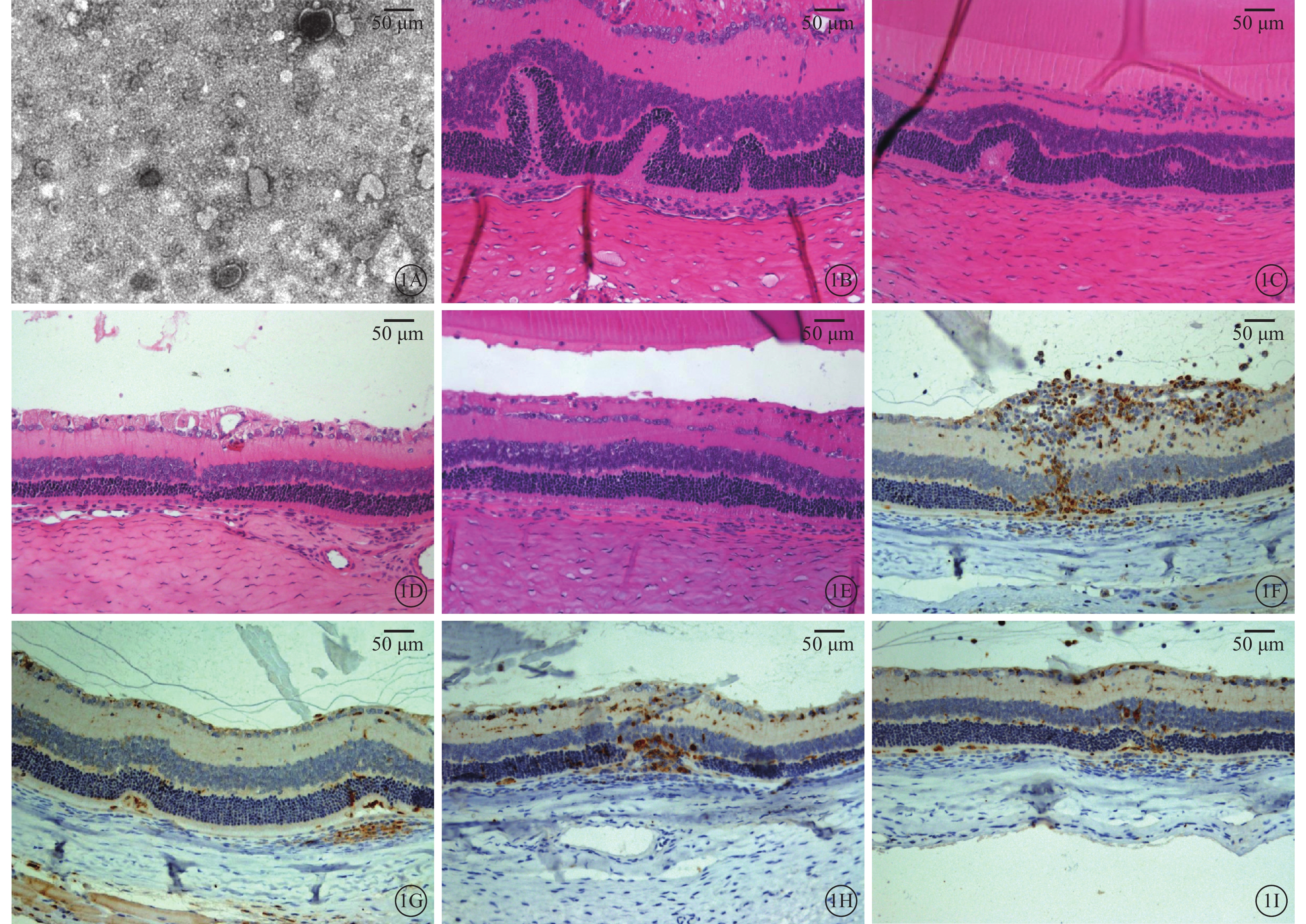 圖1
MSC外泌體透射電子顯微鏡像及大鼠視網膜光學顯微鏡像。1A.MSC外泌體透射電子顯微鏡像,可見外泌體為40~100 μm的囊泡結構。1B、1C.對照組建模后第15、20天光學顯微鏡像,可見對照組后極部視網膜結構紊亂,有大量炎性細胞浸潤。1D、1E.實驗組建模后第15、20天光學顯微鏡像,可見視網膜結構輕度紊亂,有少量炎性細胞浸潤。1F、1G.對照組建模后第15、20天光學顯微鏡像,可見第15天時視網膜結構紊亂,各層CD68高表達,玻璃體腔中可見CD68表達;第20天時CD68表達降低。1H、1I.實驗組建模后第15、20天光學顯微鏡像,可見第15天時CD68在各層視網膜中高表達,視網膜結構輕度紊亂;第20天時視網膜中少量CD68陽性表達細胞,視網膜結構較完整。1A染色方法為磷鎢酸,標尺100 μm;1B~1E染色方法為HE,標尺50 μm;1F~1I染色方法為DAB,標尺50 μm
圖1
MSC外泌體透射電子顯微鏡像及大鼠視網膜光學顯微鏡像。1A.MSC外泌體透射電子顯微鏡像,可見外泌體為40~100 μm的囊泡結構。1B、1C.對照組建模后第15、20天光學顯微鏡像,可見對照組后極部視網膜結構紊亂,有大量炎性細胞浸潤。1D、1E.實驗組建模后第15、20天光學顯微鏡像,可見視網膜結構輕度紊亂,有少量炎性細胞浸潤。1F、1G.對照組建模后第15、20天光學顯微鏡像,可見第15天時視網膜結構紊亂,各層CD68高表達,玻璃體腔中可見CD68表達;第20天時CD68表達降低。1H、1I.實驗組建模后第15、20天光學顯微鏡像,可見第15天時CD68在各層視網膜中高表達,視網膜結構輕度紊亂;第20天時視網膜中少量CD68陽性表達細胞,視網膜結構較完整。1A染色方法為磷鎢酸,標尺100 μm;1B~1E染色方法為HE,標尺50 μm;1F~1I染色方法為DAB,標尺50 μm
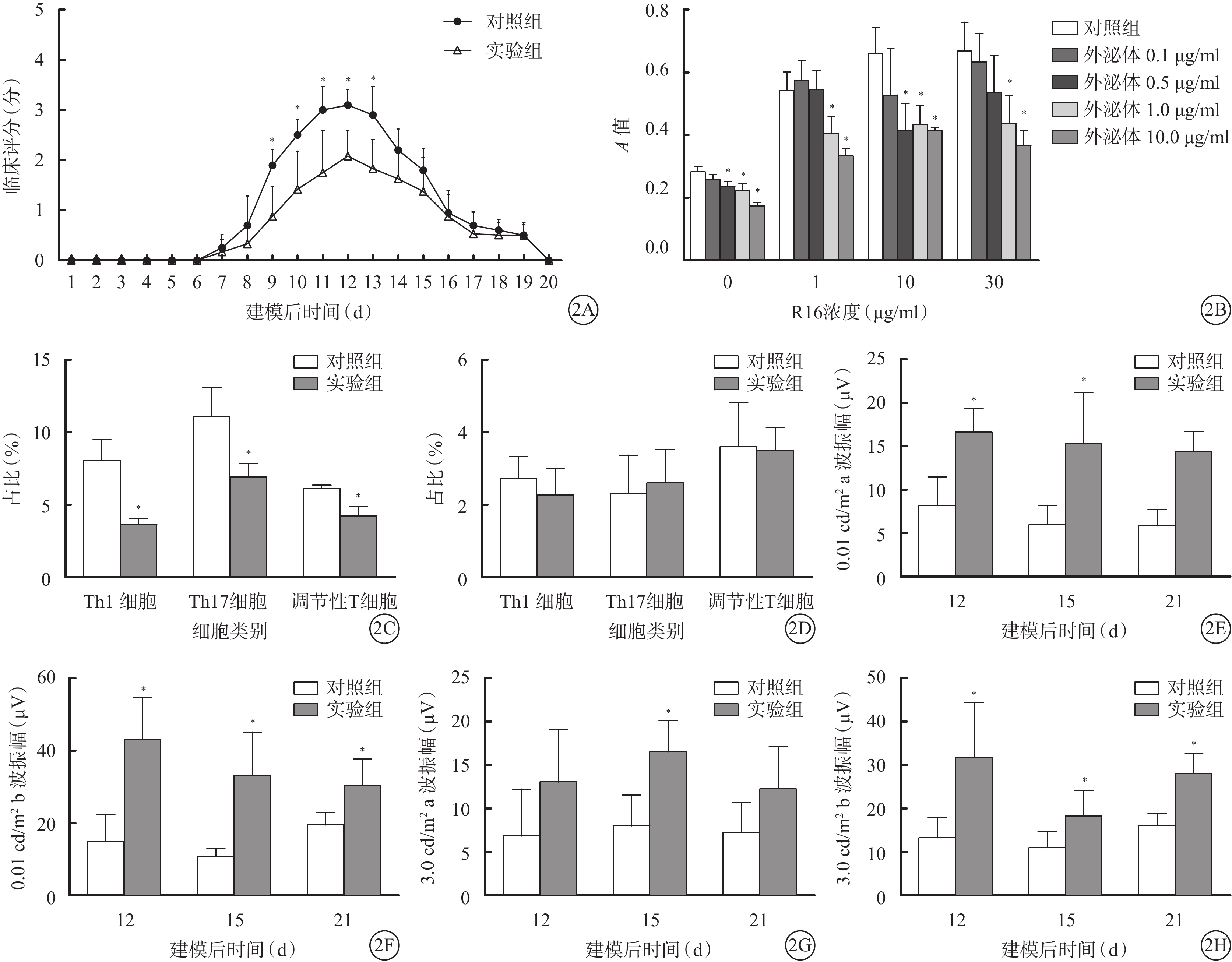
建模后第15天,實驗組大鼠視網膜病理評分較對照組更低,差異有統計學意義(P<0.05);建模后第20天,兩組大鼠視網膜病理評分比較,差異無統計學意義(P>0.05)。建模后第8~18天,實驗組大鼠視網膜臨床評分均低于對照組,其中建模后第9~13天的差異有統計學意義(t=3.665、3.210、3.181、4.121、3.227,P=0.004、0.009、0.010、0.002、0.009);其余時間點的差異無統計學意義(t=0.566、1.338、1.989、1.303、0.298、0.795、0.675、0.000,P=0.584、0.211、0.075、0.223、0.772、0.445、0.515)(圖2A)。
T細胞增生實驗結果顯示,在0、1、10、30 μg/ml R16刺激下1.0、10.0 μg/ml外泌體對T細胞的增生有抑制作用,差異有統計學意義(F=18.530、11.630、4.188、6.011,P<0.05)。在1、30 μg/ml R16刺激下0.5 μg/ml外泌體對T細胞的增生有抑制作用(P<0.05)(圖2B)。
建模后第15天,流式細胞技術檢測結果顯示,實驗組大鼠眼部浸潤的Th1、Th17細胞和調節性T細胞亞群數量較對照組減少,差異有統計學意義(t=7.374、4.525、6.910,P=0.000、0.001、0.000);兩組之間淋巴結中的細胞比例無差異(t=1.126、0.493、0.178,P=0.286、0.632、0.862)(圖2C,2D)。
ERG檢測結果顯示,建模后第12、15、21天實驗組0.01 cd/m2a波(t=4.852、3.604、7.199,P=0.001、0.005、0.000)、0.01 cd/m2 b波(t=5.047、4.551、3.331,P=0.001、0.001、0.008)、3.0 cd/m2 b波(t=3.391、2.566、5.446,P=0.007、0.028、0.000)振幅均較對照組增高,差異有統計學意義;建模后第15天實驗組3.0 cd/m2 a波振幅(t=4.178,P=0.002)較對照組增高,差異有統計學意義;建模后第12、21天實驗組3.0 cd/m2 a波振幅與對照組比較,差異無統計學意義(t=1.885、2.078,P=0.089、0.064)(圖2E~2H)。
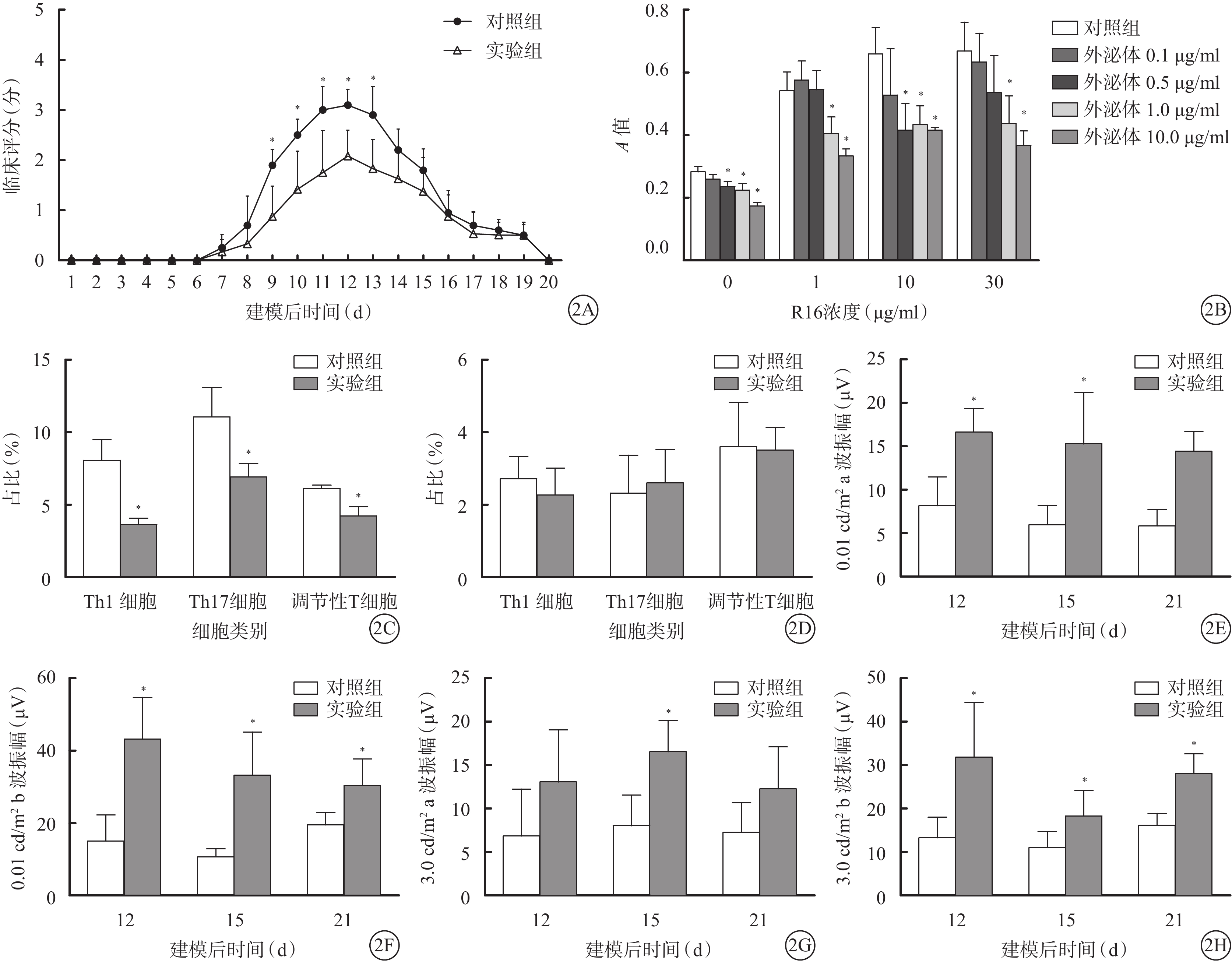 圖2
兩組大鼠視網膜臨床評分、T細胞增生實驗、流式細胞技術及ERG檢測結果比較。2A.臨床評分比較,*P<0.05;2B.T細胞增生實驗結果比較,*P<0.05;2C、2D.眼球及淋巴結流式細胞技術檢測結果比較,*P<0.05;2E~2H.ERG檢測結果比較,*P<0.05
圖2
兩組大鼠視網膜臨床評分、T細胞增生實驗、流式細胞技術及ERG檢測結果比較。2A.臨床評分比較,*P<0.05;2B.T細胞增生實驗結果比較,*P<0.05;2C、2D.眼球及淋巴結流式細胞技術檢測結果比較,*P<0.05;2E~2H.ERG檢測結果比較,*P<0.05
3 討論
我們既往研究發現,在大鼠EAU模型中靜脈輸注大鼠MSC可以抑制T細胞增生,下調Th1、Th17效應細胞,上調Th2、Treg細胞,能有效預防和治療抗原誘導的EAU發生發展[12]。在大鼠角膜移植模型中,應用MSC可以延長角膜植片存活時間,其機制與抑制T細胞增生,下調Th1和上調Treg細胞有關[13]。這些結果表明MSC可以通過對機體免疫的調節,抑制免疫疾病的發生發展。
MSC外泌體有促進組織創傷修復、調節免疫反應、抑制炎癥等作用,是治療免疫性疾病的有前景的無細胞治療方案。我們曾采用人來源的MSC外泌體治療大鼠EAU,發現球周注射可以顯著抑制病情,保護視網膜[14]。本研究通過觀察同種異體大鼠MSC外泌體對EAU的治療作用,發現外泌體與其來源的MSC有相似的治療效果。其可以減輕EAU的臨床和病理表現,保護視網膜功能,減少眼部巨噬細胞浸潤,下調眼部致炎性T細胞的比例,上調調節性T細胞的比例,抑制T細胞增生。然而,在人來源的MSC外泌體治療大鼠EAU的研究中,我們發現人來源MSC外泌體并不能抑制大鼠T細胞增生[14]。此結果差異可能與不同物種來源的MSC外泌體中所含內容物成分不同有關,具體原因有待進一步研究加以探索。外泌體可能通過其包裹的miRNA發揮生物學功能;當外泌體與RNA酶共孵育后,其治療效果減弱或消失[15-16]。有研究表明,來自人脂肪組織的MSC外泌體能抑制人CD4+、CD8+T細胞增生,抑制CD4+、CD8+T細胞向終末分化表型和效應子記憶表型分化,降低CD4+、CD8+T細胞產生的IFN-γ,從而治療免疫介導的炎癥性疾病[17]。骨髓來源的MSC外泌體可以誘導T細胞凋亡,誘導大量調節性T細胞生成,增大調節性T細胞/效應T細胞的比例[18]。本研究中雖然外泌體可以下調眼部致炎T細胞,上調調節性T細胞的比例,但是淋巴結中致炎性T細胞和調節性T細胞與對照組并無顯著差異。這一差異可能是由于MSC有向受損部位定向遷移的能力,其分泌的外泌體也可能優先在受損部位發揮效果,具體機制尚需進一步分析研究。
本研究結果再次證明了MSC外泌體的免疫調控作用,為外泌體的應用提供了新的方向。然而,MSC外泌體中具體有效成分的深層作用機制仍不甚明朗,如何在不影響其作用效果的前提下提高MSC外泌體的產量也是亟待解決的問題。與MSC相比,外泌體更加穩定,易于保存,而且沒有成瘤風險,安全性更高。未來還需進一步研究以充分利用外泌體的治療潛力。
自身免疫性葡萄膜炎是常見致盲性疾病。目前臨床主要采用皮質類固醇、免疫抑制劑和生物制劑進行治療,但這些藥物長期應用可出現嚴重的全身副作用;并且,部分患者療效欠佳,尋求更加安全有效的治療藥物仍是葡萄膜炎研究的核心問題[1-2]。間充質干細胞(MSC)是一種中胚層來源的多能干細胞,在體內外均顯現出對多種免疫細胞的抑制作用,可有效治療多種類型自身免疫性葡萄膜炎動物模型[3-9]。外泌體是一種有著脂質雙分子層結構的納米級小囊泡,直徑在40~100 nm之間,可以介導細胞與細胞之間的信號傳導。已有研究表明,MSC外泌體表現出與MSC相似的功能,在旁分泌介導的免疫抑制機制中可能發揮作用[10]。本研究通過建立實驗性自身免疫性葡萄膜炎(EAU)大鼠模型,觀察MSC外泌體對EAU的局部治療效果,探究其是否能影響疾病進程及其作用機制,以期為臨床自身免疫性疾病新的無細胞療法提供思路。現將結果報道如下。
1 材料和方法
1.1 MSC外泌體分離和鑒定
取5周齡Wistar大鼠1只[SCXK(京)2016-0006],取出股骨和脛骨,在骨骺端打孔,用無血清的Dulbecco改良Eagle培養基(DMEM)/F12沖洗髓腔,將沖洗液以161 g離心8 min,棄上清液,用含10%胎牛血清的DMEM/F12重懸至T75培養瓶,在37 ℃、5%CO2飽和濕度下孵育,每3天換一次液。細胞培養至融合達80%以上時用胰酶消化傳代。取3~5代MSC用于后續實驗。采用流式細胞儀檢測MSC表面標記表達情況(CD29、CD90陽性,CD34、CD45陰性);在特定體外環境下進行MSC成骨分化、成內皮分化和成脂肪分化,檢測MSC的干細胞特性。
用完全培養基培養MSC 2 d后,換為含10%無外泌體血清的培養基,培養24 h后收取培養基。4 ℃條件下200×g離心10 min,2000×g離心20 min,10 000×g離心30 min,110 000×g離心7 h,隨后用0.22 μm濾膜過濾,從而得到無外泌體的血清。MSC外泌體提取與上述梯度離心法相似,僅將最后一步改為離心2 h。沉淀用磷酸鹽緩沖液(PBS)重懸,0.22 μm濾膜過濾,?80℃儲存。采用透射電子顯微鏡鑒定外泌體。
1.2 EAU建模及MSC外泌體治療
將12只Lewis大鼠[SCXK(京)2016-0006]采用隨機數字表法隨機分為實驗組和對照組,每組6只大鼠。將人光感受器相關結合蛋白1177-1191和結核菌素濃度為2.5 g/L的弗氏佐劑混合成乳劑,在實驗組大鼠尾根部和背部皮下注射至少6個點,每只大鼠注射乳劑200 μl建立EAU模型。建模后第9天,采用10%水合氯醛腹腔注射麻醉大鼠,奧布卡因滴眼液行眼球表面麻醉,鑷子輔助固定眼球,胰島素注射器于結膜面平行眼球進針,進針深度3.5 mm,單次注射外泌體100 μl(含量50 μg),退出針頭,氧氟沙星眼膏涂抹結膜囊。對照組大鼠注射相同體積的PBS。參照Caspi臨床分級[11]在建模6 d后開始給大鼠進行臨床評分。分別在第15、20天處死大鼠,摘除眼球于4%多聚甲醛浸泡1 h后用10%多聚甲醛浸泡24 h以上;隨后石蠟固定切片行視網膜組織病理蘇木精伊紅(HE)染色,光學顯微鏡下觀察大鼠視網膜組織結構,并對其病理進行評分[11]。
1.3 免疫組織化學染色、T細胞增生實驗、流式細胞技術及視網膜電圖(ERG)檢測
建模后第15、20天,采用視網膜免疫組織化學染色觀察巨噬細胞表面標志物CD68的表達。石蠟切片脫蠟脫水以后,微波處理5 min,用含有3%H2O2的PBS浸泡15 min。隨后將切片用5%牛血清白蛋白封閉30 min,4 ℃條件下一抗孵育過夜。PBS洗滌后滴加生物素標記二抗孵育30 min,二氨基聯苯胺(DAB)顯色2~5 min。以黃色或棕黃色染色為CD68陽性表達。
建模后第12天,取實驗組大鼠脾臟T淋巴細胞,不同濃度梯度(1、10、30 μg/ml)R16特異性抗原與不同濃度梯度(0.1、0.5、1.0、10.0 μg/ml)外泌體體外培養48 h,5-溴脫氧尿嘧啶核苷(Brdu)標記后繼續培養8 h,加入Brdu抗體及顯色液,酶標儀檢測450 nm處吸光度[A,舊稱光密度(OD)]值。
建模后第15天,取大鼠眼球和引流淋巴結制備細胞懸液。取2×105個細胞在含有50 ng/ml佛波酯、1 μg/ml離子霉素和1 μg/ml布雷菲德菌素A的培養基中刺激4~6 h后,用CD4的流式抗體標記。固定、過夜破膜后,用干擾素(IFN)-γ和白細胞介素-17的抗體標記從而檢測Th1和Th17細胞。Foxp3+的T細胞通過標記CD4、CD25抗體,過夜固定破膜后標記Foxp3的抗體檢測。
建模后第12、15、21天,采用ERG評估大鼠視網膜功能,檢測前1 d將大鼠做暗適應處理。腹膜下注射10%水合氯醛全身麻醉大鼠,丙美卡因滴眼液行眼部麻醉,復方托吡卡胺滴眼液散瞳。將角膜接觸環狀電極放置在角膜上,參考電極和接地電極分別放置在耳后和尾部皮下,分別記錄大鼠對10次0.01、3.0 cd/m2白色閃光的反應平均值。從a波的波谷到b波的波峰為b波振幅,從基線到第1次波谷為a波振幅。a、b波峰時值為閃光刺激開始到波峰的時間。
1.4 統計學方法
采用SAS 9.2軟件進行統計學處理,數據以均數±標準差(
 ±s)表示。EAU臨床評分通過方差分析檢驗,組間數據比較采用 t 檢驗,T細胞增生實驗中各組對比采用單因素方差分析。P<0.05 為差異有統計學意義。
±s)表示。EAU臨床評分通過方差分析檢驗,組間數據比較采用 t 檢驗,T細胞增生實驗中各組對比采用單因素方差分析。P<0.05 為差異有統計學意義。
2 結果
透射電子顯微鏡觀察發現,從大鼠骨髓MSC培養上清液中提取的外泌體為40~100 nm的小囊泡結構(圖1A)。
建模后第15、20天,HE染色觀察發現,實驗組眼球后極部視網膜各層結構較對照組完整,炎性細胞浸潤少(圖1B~1E);免疫組織化學染色觀察發現,實驗組大鼠視網膜CD68陽性表達明顯少于對照組(圖1F~1I)。
 圖1
MSC外泌體透射電子顯微鏡像及大鼠視網膜光學顯微鏡像。1A.MSC外泌體透射電子顯微鏡像,可見外泌體為40~100 μm的囊泡結構。1B、1C.對照組建模后第15、20天光學顯微鏡像,可見對照組后極部視網膜結構紊亂,有大量炎性細胞浸潤。1D、1E.實驗組建模后第15、20天光學顯微鏡像,可見視網膜結構輕度紊亂,有少量炎性細胞浸潤。1F、1G.對照組建模后第15、20天光學顯微鏡像,可見第15天時視網膜結構紊亂,各層CD68高表達,玻璃體腔中可見CD68表達;第20天時CD68表達降低。1H、1I.實驗組建模后第15、20天光學顯微鏡像,可見第15天時CD68在各層視網膜中高表達,視網膜結構輕度紊亂;第20天時視網膜中少量CD68陽性表達細胞,視網膜結構較完整。1A染色方法為磷鎢酸,標尺100 μm;1B~1E染色方法為HE,標尺50 μm;1F~1I染色方法為DAB,標尺50 μm
圖1
MSC外泌體透射電子顯微鏡像及大鼠視網膜光學顯微鏡像。1A.MSC外泌體透射電子顯微鏡像,可見外泌體為40~100 μm的囊泡結構。1B、1C.對照組建模后第15、20天光學顯微鏡像,可見對照組后極部視網膜結構紊亂,有大量炎性細胞浸潤。1D、1E.實驗組建模后第15、20天光學顯微鏡像,可見視網膜結構輕度紊亂,有少量炎性細胞浸潤。1F、1G.對照組建模后第15、20天光學顯微鏡像,可見第15天時視網膜結構紊亂,各層CD68高表達,玻璃體腔中可見CD68表達;第20天時CD68表達降低。1H、1I.實驗組建模后第15、20天光學顯微鏡像,可見第15天時CD68在各層視網膜中高表達,視網膜結構輕度紊亂;第20天時視網膜中少量CD68陽性表達細胞,視網膜結構較完整。1A染色方法為磷鎢酸,標尺100 μm;1B~1E染色方法為HE,標尺50 μm;1F~1I染色方法為DAB,標尺50 μm
建模后第15天,實驗組大鼠視網膜病理評分較對照組更低,差異有統計學意義(P<0.05);建模后第20天,兩組大鼠視網膜病理評分比較,差異無統計學意義(P>0.05)。建模后第8~18天,實驗組大鼠視網膜臨床評分均低于對照組,其中建模后第9~13天的差異有統計學意義(t=3.665、3.210、3.181、4.121、3.227,P=0.004、0.009、0.010、0.002、0.009);其余時間點的差異無統計學意義(t=0.566、1.338、1.989、1.303、0.298、0.795、0.675、0.000,P=0.584、0.211、0.075、0.223、0.772、0.445、0.515)(圖2A)。
T細胞增生實驗結果顯示,在0、1、10、30 μg/ml R16刺激下1.0、10.0 μg/ml外泌體對T細胞的增生有抑制作用,差異有統計學意義(F=18.530、11.630、4.188、6.011,P<0.05)。在1、30 μg/ml R16刺激下0.5 μg/ml外泌體對T細胞的增生有抑制作用(P<0.05)(圖2B)。
建模后第15天,流式細胞技術檢測結果顯示,實驗組大鼠眼部浸潤的Th1、Th17細胞和調節性T細胞亞群數量較對照組減少,差異有統計學意義(t=7.374、4.525、6.910,P=0.000、0.001、0.000);兩組之間淋巴結中的細胞比例無差異(t=1.126、0.493、0.178,P=0.286、0.632、0.862)(圖2C,2D)。
ERG檢測結果顯示,建模后第12、15、21天實驗組0.01 cd/m2a波(t=4.852、3.604、7.199,P=0.001、0.005、0.000)、0.01 cd/m2 b波(t=5.047、4.551、3.331,P=0.001、0.001、0.008)、3.0 cd/m2 b波(t=3.391、2.566、5.446,P=0.007、0.028、0.000)振幅均較對照組增高,差異有統計學意義;建模后第15天實驗組3.0 cd/m2 a波振幅(t=4.178,P=0.002)較對照組增高,差異有統計學意義;建模后第12、21天實驗組3.0 cd/m2 a波振幅與對照組比較,差異無統計學意義(t=1.885、2.078,P=0.089、0.064)(圖2E~2H)。
 圖2
兩組大鼠視網膜臨床評分、T細胞增生實驗、流式細胞技術及ERG檢測結果比較。2A.臨床評分比較,*P<0.05;2B.T細胞增生實驗結果比較,*P<0.05;2C、2D.眼球及淋巴結流式細胞技術檢測結果比較,*P<0.05;2E~2H.ERG檢測結果比較,*P<0.05
圖2
兩組大鼠視網膜臨床評分、T細胞增生實驗、流式細胞技術及ERG檢測結果比較。2A.臨床評分比較,*P<0.05;2B.T細胞增生實驗結果比較,*P<0.05;2C、2D.眼球及淋巴結流式細胞技術檢測結果比較,*P<0.05;2E~2H.ERG檢測結果比較,*P<0.05
3 討論
我們既往研究發現,在大鼠EAU模型中靜脈輸注大鼠MSC可以抑制T細胞增生,下調Th1、Th17效應細胞,上調Th2、Treg細胞,能有效預防和治療抗原誘導的EAU發生發展[12]。在大鼠角膜移植模型中,應用MSC可以延長角膜植片存活時間,其機制與抑制T細胞增生,下調Th1和上調Treg細胞有關[13]。這些結果表明MSC可以通過對機體免疫的調節,抑制免疫疾病的發生發展。
MSC外泌體有促進組織創傷修復、調節免疫反應、抑制炎癥等作用,是治療免疫性疾病的有前景的無細胞治療方案。我們曾采用人來源的MSC外泌體治療大鼠EAU,發現球周注射可以顯著抑制病情,保護視網膜[14]。本研究通過觀察同種異體大鼠MSC外泌體對EAU的治療作用,發現外泌體與其來源的MSC有相似的治療效果。其可以減輕EAU的臨床和病理表現,保護視網膜功能,減少眼部巨噬細胞浸潤,下調眼部致炎性T細胞的比例,上調調節性T細胞的比例,抑制T細胞增生。然而,在人來源的MSC外泌體治療大鼠EAU的研究中,我們發現人來源MSC外泌體并不能抑制大鼠T細胞增生[14]。此結果差異可能與不同物種來源的MSC外泌體中所含內容物成分不同有關,具體原因有待進一步研究加以探索。外泌體可能通過其包裹的miRNA發揮生物學功能;當外泌體與RNA酶共孵育后,其治療效果減弱或消失[15-16]。有研究表明,來自人脂肪組織的MSC外泌體能抑制人CD4+、CD8+T細胞增生,抑制CD4+、CD8+T細胞向終末分化表型和效應子記憶表型分化,降低CD4+、CD8+T細胞產生的IFN-γ,從而治療免疫介導的炎癥性疾病[17]。骨髓來源的MSC外泌體可以誘導T細胞凋亡,誘導大量調節性T細胞生成,增大調節性T細胞/效應T細胞的比例[18]。本研究中雖然外泌體可以下調眼部致炎T細胞,上調調節性T細胞的比例,但是淋巴結中致炎性T細胞和調節性T細胞與對照組并無顯著差異。這一差異可能是由于MSC有向受損部位定向遷移的能力,其分泌的外泌體也可能優先在受損部位發揮效果,具體機制尚需進一步分析研究。
本研究結果再次證明了MSC外泌體的免疫調控作用,為外泌體的應用提供了新的方向。然而,MSC外泌體中具體有效成分的深層作用機制仍不甚明朗,如何在不影響其作用效果的前提下提高MSC外泌體的產量也是亟待解決的問題。與MSC相比,外泌體更加穩定,易于保存,而且沒有成瘤風險,安全性更高。未來還需進一步研究以充分利用外泌體的治療潛力。