引用本文: 王霄娜, 彭曉燕, 游啟生, 張乘瑞, 莫賓, 焦璇, 嚴偉. 蜂巢狀視網膜營養不良一例. 中華眼底病雜志, 2018, 34(5): 489-491. doi: 10.3760/cma.j.issn.1005-1015.2018.05.016 復制
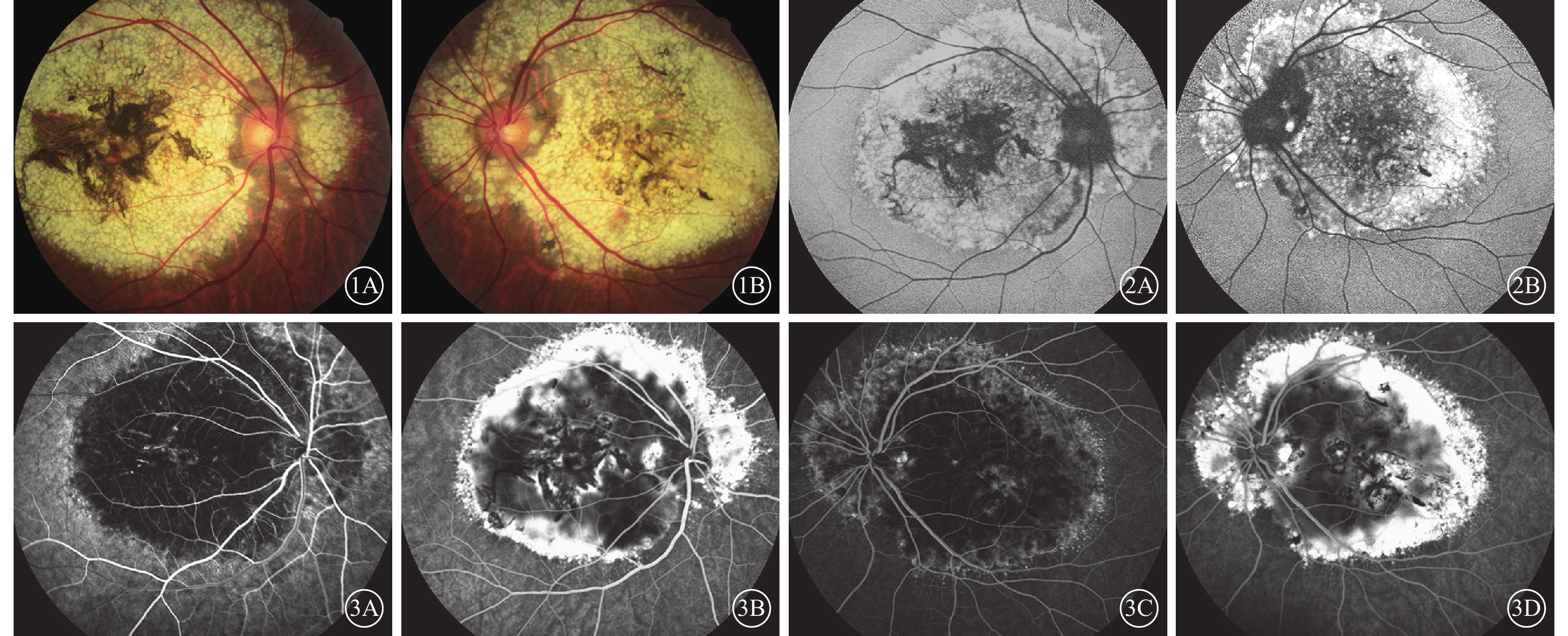
患者男,52歲。因雙眼視力下降來我院眼科就診。10余年前患者出現視物模糊未予重視(既往雙眼最佳視力可達0.8),近期視力下降嚴重。發病期間患者否認視物變形變色;否認發熱、外傷等情況;否認高血壓、糖尿病等全身病。其有一兄長,2年前開始出現視物模糊不清,具體原因未查;有一雙子女,均未訴明顯視物異常情況。眼科檢查:雙眼視力0.3。雙眼眼前節未見明顯異常。雙眼后極部大量黃白色顆粒狀沉積物,大小約20個視盤面積,累及范圍達顳側上下血管弓,鼻側包繞視盤全周;病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,視網膜色素上皮(RPE)和脈絡膜毛細血管萎縮,暴露脈絡膜大中血管;病灶上方對應視網膜血管走形正常(圖1)。眼底自身熒光(FAF)檢查,雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光(圖2)。熒光素眼底血管造影(FFA)檢查,雙眼后極部可見4個視盤直徑(DD)×3 DD大小弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光灶逐漸變為強熒光,其內不規則片狀弱熒光遮蔽,其外強熒光環增強著染,未見熒光素滲漏(圖3)。光相干斷層掃描(OCT)檢查,雙眼后極部視網膜外層結構紊亂,可見RPE及Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變(圖4)。多焦視網膜電圖檢查,雙眼后極部視網膜功能局限降低,黃斑區功能重度受損。基因檢測,EFEMP1基因R345W突變(圖5)。診斷:蜂巢狀視網膜營養不良(DHRD)。
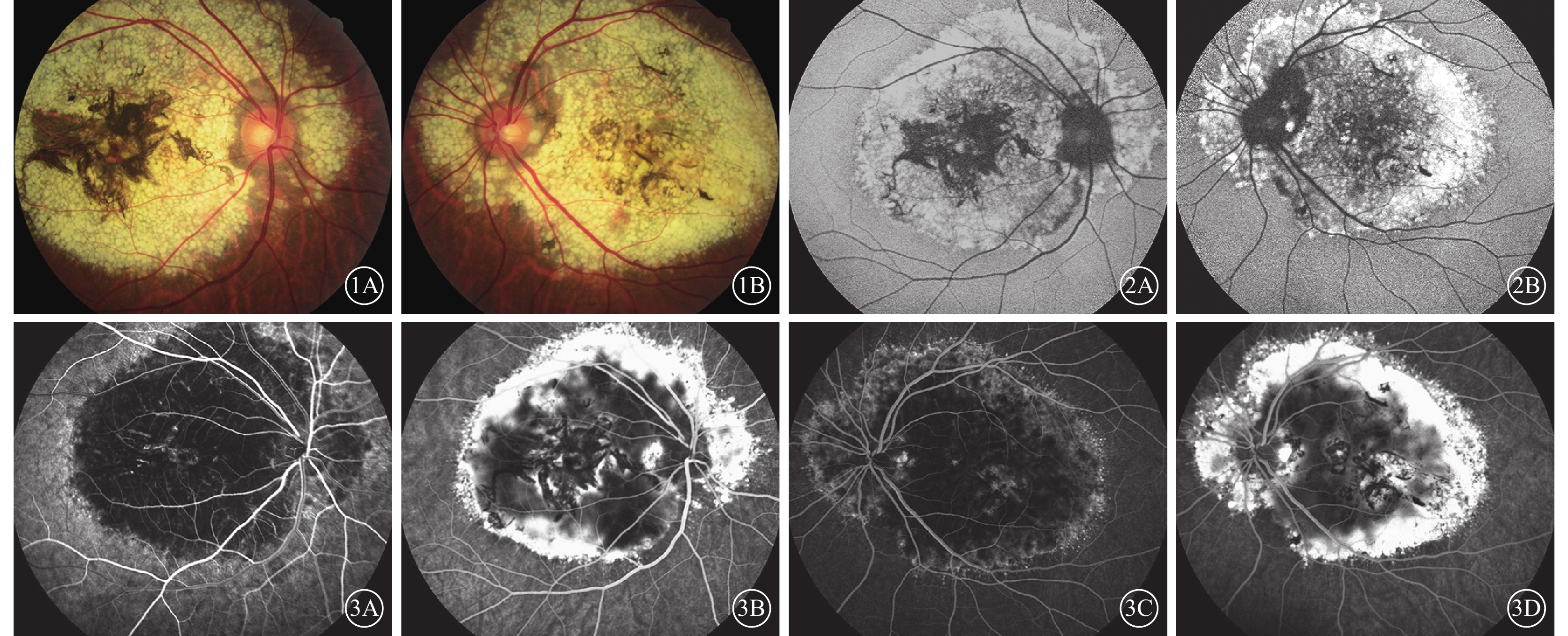 圖1
患者雙眼彩色眼底像。1A. 右眼;1B. 左眼。雙眼后極部大量黃白色顆粒狀沉積物,病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,病灶上方對應視物膜血管走形如常 圖 2 患者雙眼FAF像。2A. 右眼;2B. 左眼。雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光 圖 3 患者雙眼FFA像。3A. 右眼早期;3B. 右眼晚期;3C. 左眼早期;3D. 左眼晚期。雙眼后極部可見弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光病灶逐漸變為強熒光,其外強熒光環增強著染,未見熒光素滲漏
圖1
患者雙眼彩色眼底像。1A. 右眼;1B. 左眼。雙眼后極部大量黃白色顆粒狀沉積物,病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,病灶上方對應視物膜血管走形如常 圖 2 患者雙眼FAF像。2A. 右眼;2B. 左眼。雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光 圖 3 患者雙眼FFA像。3A. 右眼早期;3B. 右眼晚期;3C. 左眼早期;3D. 左眼晚期。雙眼后極部可見弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光病灶逐漸變為強熒光,其外強熒光環增強著染,未見熒光素滲漏
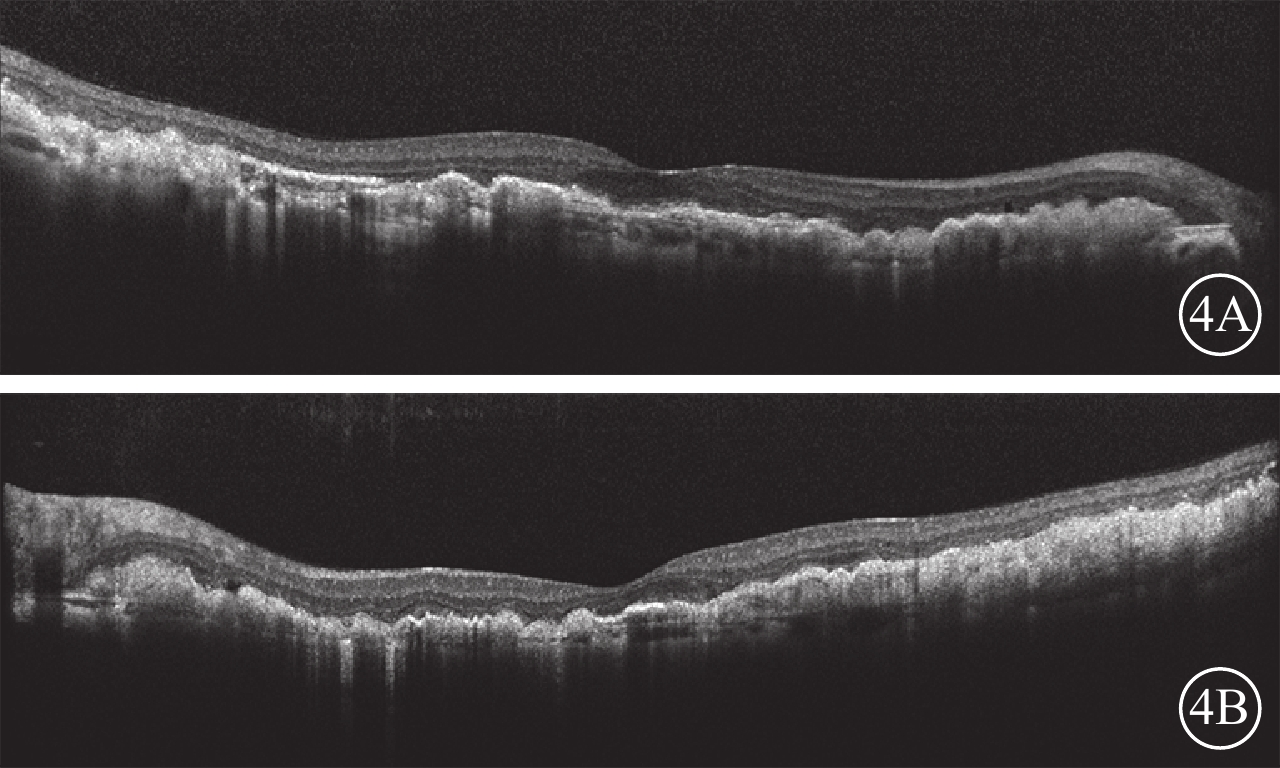 圖4
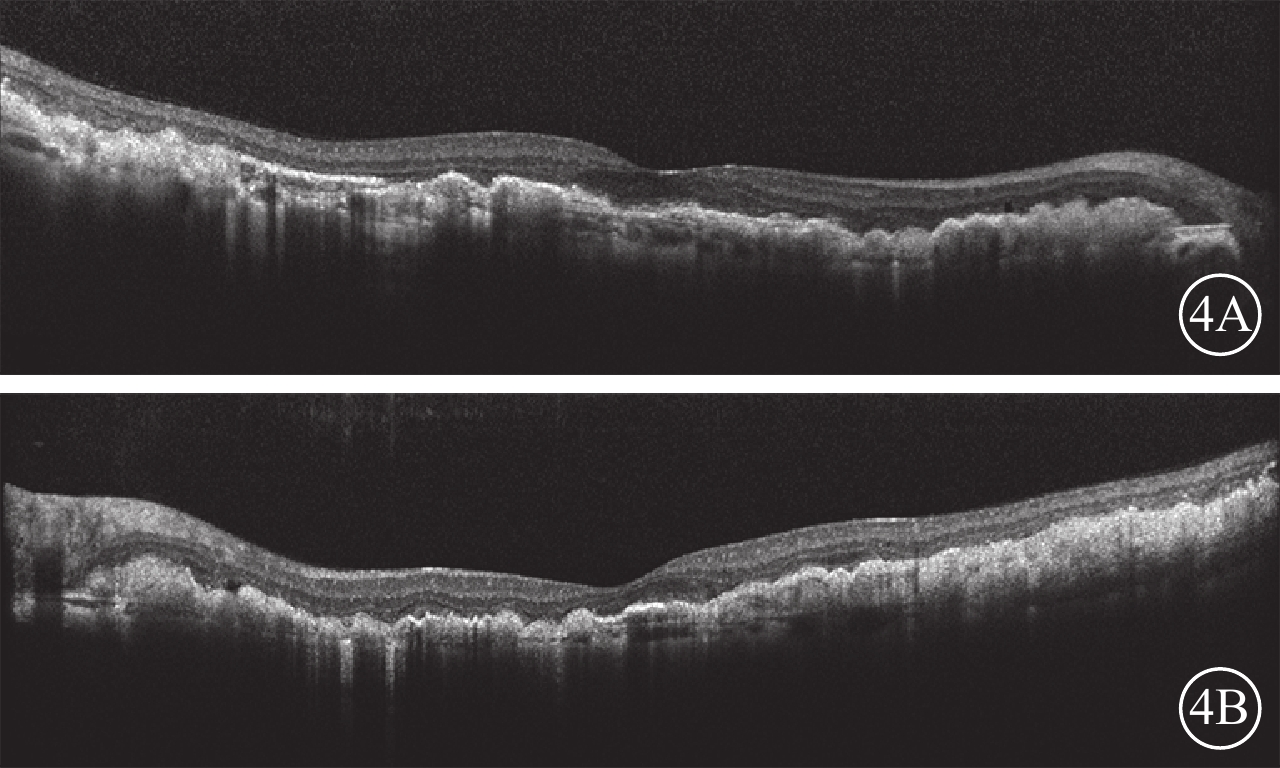
患者雙眼OCT像。4A. 右眼;4B. 左眼。雙眼后極部視網膜外層結構紊亂,可見RPE與Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變
圖4
患者雙眼OCT像。4A. 右眼;4B. 左眼。雙眼后極部視網膜外層結構紊亂,可見RPE與Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變
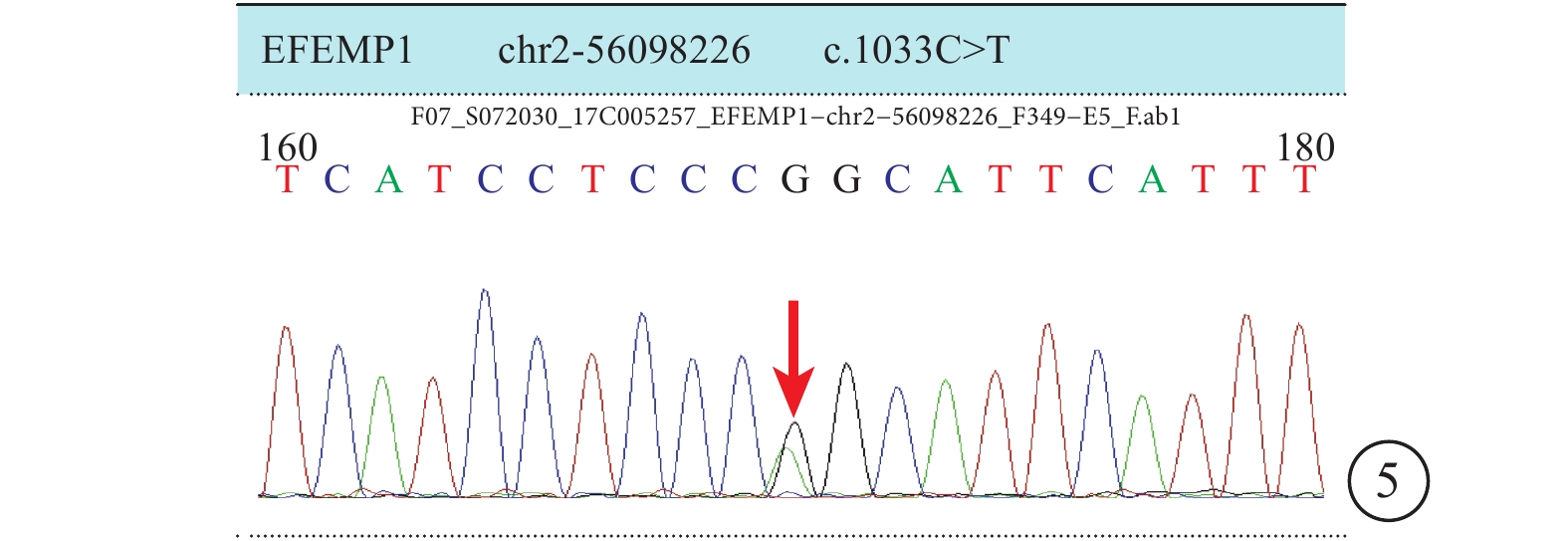 圖5
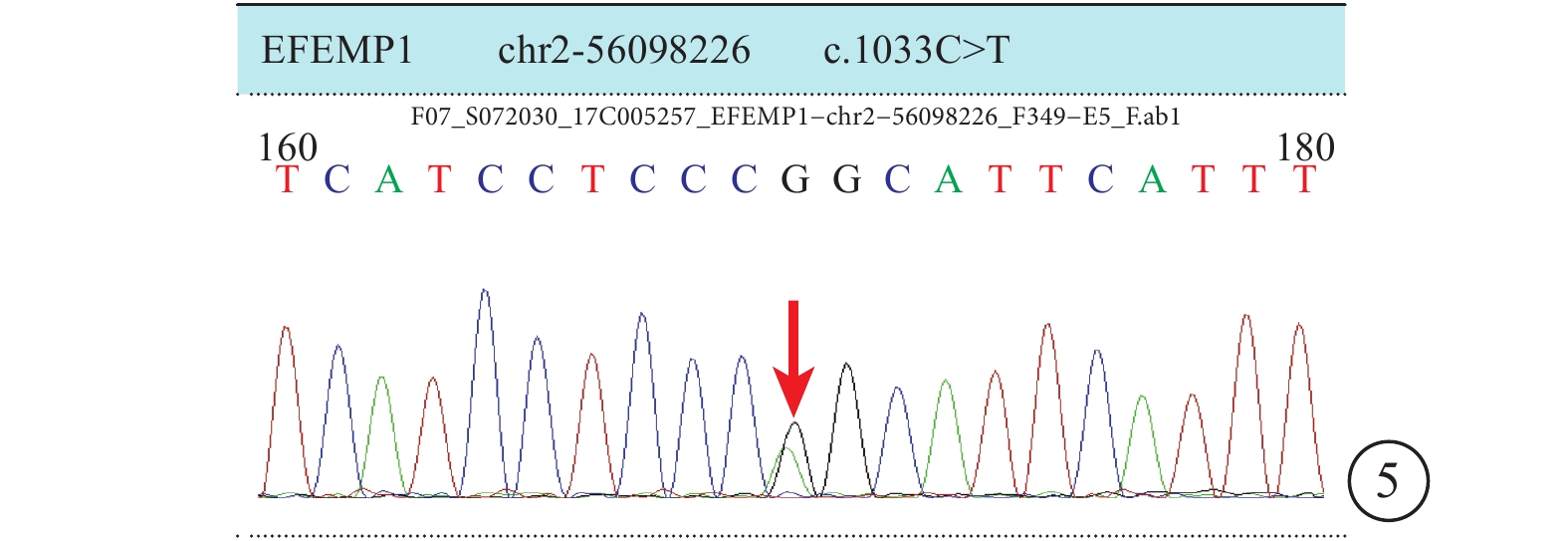
基因檢測結果峰圖。EFEMP1基因編碼區第1033號核苷酸由胞嘧啶變異為胸腺嘧啶(c.1033C>T)(紅箭),導致第345號氨基酸由精氨酸變異為色氨酸(p.R345W),為錯義雜合突變
圖5
基因檢測結果峰圖。EFEMP1基因編碼區第1033號核苷酸由胞嘧啶變異為胸腺嘧啶(c.1033C>T)(紅箭),導致第345號氨基酸由精氨酸變異為色氨酸(p.R345W),為錯義雜合突變
討論 DHRD多于30~40歲出現癥狀[1, 2]。患者常主訴視力下降、視物變形變色、黑影遮擋、畏光。眼底改變主要為黃斑區或視盤旁疣狀沉積,因其顏色和形態很像“蜂巢”而得名。隨著病情進展,眼底沉積物的數量和大小都會增加,晚期還會形成大量萎縮灶。其眼底萎縮病灶的擴大、色素增生或是并發脈絡膜新生血管均是造成視力進一步下降的原因[3-6]。本例患者40歲左右開始出現視物模糊癥狀,眼底表現為雙眼后極部大量黃白色疣狀沉積物伴黃斑區色素增生,與DHRD臨床表現相符。
1999年Stone等[4]首次發現DHRD患者EFEMP1基因非保守區345位密碼子由精氨酸變為色氨酸,最終確定了該疾病的致病基因。本例患者基因檢測結果顯示,EFEMP1基因R345W突變,確認DHRD診斷。人EFEMP1基因全長60 kb,包括12個外顯子,其編碼一種細胞外基質蛋白,由493位氨基酸組成,相對分子質量為55×103[7]。EFEMP蛋白是衰老關鍵蛋白fibulin蛋白家族中的一員,包括6型,主要分布在腦部、肺、心臟、胎盤、視網膜等組織內[8]。EFEMP1基因則是編碼fibulin蛋白3型,其存在于正常視網膜的神經纖維層和光感受器細胞的內外節周圍,在RPE、Bruch膜和脈絡膜層并不出現[9, 10]。R345W突變導致其構型出現折疊錯誤,使得蛋白喪失原有功能并在細胞內大量沉積,并且與年齡和EFEMP1基因拷貝數相關[11]。
DHRD眼底大量黃白色疣狀沉積物主要可以歸為兩種。一種是靠近病灶中心的形狀較大的圓形疣狀沉積,平均直徑0.13 μm;另一種是靠近病灶周邊的放射狀分布的小疣狀沉積,直徑僅有0.05 μm[12]。FAF中顯示的密集強熒光病灶主要對應大的疣狀沉積物,而周邊放射排列的疣狀沉積物不能明顯看到[13]。這種放射狀的疣狀沉積在年輕患者中更為明顯,且分布及自身熒光特點與老年性黃斑變性(AMD)的疣狀病變有一定區別[12, 14]。在FFA中,大的圓形疣狀沉積物早期為弱熒光,晚期逐漸成為強熒光斑點;而放射狀疣狀沉積物主要表現為病灶周圍毛刺狀強熒光邊[15]。常見的AMD疣狀病灶周圍通常是以膽固醇等輸水成分,而本病疣狀沉積物的外圍液體成分豐富,最終形成了這種弱熒光環[16, 17]。OCT可以觀察到兩種疣狀沉積物均分布在RPE下方,但隆起高度有明顯差異。大的圓形疣狀沉積物上方橢圓體帶也可見破壞,而放射狀疣狀沉積物上方橢圓體帶則相對完整。該病變累及范圍內內層視網膜結構相對完整[18]。隨著病情進展,沉積物可見逐漸堆積、融合的過程[12]。應用微視野對該病患者進行隨訪發現其視力損傷區域與RPE下沉積物隆起范圍呈現較好的一致性,且沉積物隆起越高,對應區域視功能損傷越重[12]。
由于DHRD與AMD具有相似的黃斑區黃白色病灶、RPE與Bruch膜層間沉積物,臨床中應注意鑒別。并且,AMD患者也可見Fibulin蛋白家族5、6型變異[19]。但AMD較DHRD發病晚,發病規律也并不遵循孟德爾遺傳定律,不能用生殖細胞突變的遺傳方式來解釋。已有研究發現,AMD患者可能由于某種微環境失衡,或者內質網修飾異常,導致了局部EFEMP1蛋白的性狀改變,最終發生了與EFEMP1基因突變相似的臨床表現[20]。因此,如何利用物理或者化學方法在活體中重建蛋白質內穩態,恢復EFEMP1蛋白的正常功能成為治療DHRD與AMD的新方向。目前,DHRD尚無有效的治療方法。臨床應注意隨訪患者是否并發脈絡膜新生血管或視網膜下新生血管膜[21]。如發現新生血管所致的視網膜下液體不能吸收,應積極行抗血管內皮生長因子藥物治療。
患者男,52歲。因雙眼視力下降來我院眼科就診。10余年前患者出現視物模糊未予重視(既往雙眼最佳視力可達0.8),近期視力下降嚴重。發病期間患者否認視物變形變色;否認發熱、外傷等情況;否認高血壓、糖尿病等全身病。其有一兄長,2年前開始出現視物模糊不清,具體原因未查;有一雙子女,均未訴明顯視物異常情況。眼科檢查:雙眼視力0.3。雙眼眼前節未見明顯異常。雙眼后極部大量黃白色顆粒狀沉積物,大小約20個視盤面積,累及范圍達顳側上下血管弓,鼻側包繞視盤全周;病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,視網膜色素上皮(RPE)和脈絡膜毛細血管萎縮,暴露脈絡膜大中血管;病灶上方對應視網膜血管走形正常(圖1)。眼底自身熒光(FAF)檢查,雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光(圖2)。熒光素眼底血管造影(FFA)檢查,雙眼后極部可見4個視盤直徑(DD)×3 DD大小弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光灶逐漸變為強熒光,其內不規則片狀弱熒光遮蔽,其外強熒光環增強著染,未見熒光素滲漏(圖3)。光相干斷層掃描(OCT)檢查,雙眼后極部視網膜外層結構紊亂,可見RPE及Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變(圖4)。多焦視網膜電圖檢查,雙眼后極部視網膜功能局限降低,黃斑區功能重度受損。基因檢測,EFEMP1基因R345W突變(圖5)。診斷:蜂巢狀視網膜營養不良(DHRD)。
 圖1
患者雙眼彩色眼底像。1A. 右眼;1B. 左眼。雙眼后極部大量黃白色顆粒狀沉積物,病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,病灶上方對應視物膜血管走形如常 圖 2 患者雙眼FAF像。2A. 右眼;2B. 左眼。雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光 圖 3 患者雙眼FFA像。3A. 右眼早期;3B. 右眼晚期;3C. 左眼早期;3D. 左眼晚期。雙眼后極部可見弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光病灶逐漸變為強熒光,其外強熒光環增強著染,未見熒光素滲漏
圖1
患者雙眼彩色眼底像。1A. 右眼;1B. 左眼。雙眼后極部大量黃白色顆粒狀沉積物,病灶周邊可見細小黃白色沉積物呈放射狀分布;黃斑區可見大量色素增生,病灶上方對應視物膜血管走形如常 圖 2 患者雙眼FAF像。2A. 右眼;2B. 左眼。雙眼后極部強熒光病灶,與眼底像中黃白色病灶相對應,黃斑區熒光略弱,伴有不規則弱熒光 圖 3 患者雙眼FFA像。3A. 右眼早期;3B. 右眼晚期;3C. 左眼早期;3D. 左眼晚期。雙眼后極部可見弱熒光病灶,其間夾雜點片狀強熒光,伴周圍毛刺狀強熒光環;晚期弱熒光病灶逐漸變為強熒光,其外強熒光環增強著染,未見熒光素滲漏
 圖4
患者雙眼OCT像。4A. 右眼;4B. 左眼。雙眼后極部視網膜外層結構紊亂,可見RPE與Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變
圖4
患者雙眼OCT像。4A. 右眼;4B. 左眼。雙眼后極部視網膜外層結構紊亂,可見RPE與Bruch膜層間大量均值強反射疣狀沉積物,疣狀沉積物彼此相連呈波浪狀改變,下方脈絡膜薄變
 圖5
基因檢測結果峰圖。EFEMP1基因編碼區第1033號核苷酸由胞嘧啶變異為胸腺嘧啶(c.1033C>T)(紅箭),導致第345號氨基酸由精氨酸變異為色氨酸(p.R345W),為錯義雜合突變
圖5
基因檢測結果峰圖。EFEMP1基因編碼區第1033號核苷酸由胞嘧啶變異為胸腺嘧啶(c.1033C>T)(紅箭),導致第345號氨基酸由精氨酸變異為色氨酸(p.R345W),為錯義雜合突變
討論 DHRD多于30~40歲出現癥狀[1, 2]。患者常主訴視力下降、視物變形變色、黑影遮擋、畏光。眼底改變主要為黃斑區或視盤旁疣狀沉積,因其顏色和形態很像“蜂巢”而得名。隨著病情進展,眼底沉積物的數量和大小都會增加,晚期還會形成大量萎縮灶。其眼底萎縮病灶的擴大、色素增生或是并發脈絡膜新生血管均是造成視力進一步下降的原因[3-6]。本例患者40歲左右開始出現視物模糊癥狀,眼底表現為雙眼后極部大量黃白色疣狀沉積物伴黃斑區色素增生,與DHRD臨床表現相符。
1999年Stone等[4]首次發現DHRD患者EFEMP1基因非保守區345位密碼子由精氨酸變為色氨酸,最終確定了該疾病的致病基因。本例患者基因檢測結果顯示,EFEMP1基因R345W突變,確認DHRD診斷。人EFEMP1基因全長60 kb,包括12個外顯子,其編碼一種細胞外基質蛋白,由493位氨基酸組成,相對分子質量為55×103[7]。EFEMP蛋白是衰老關鍵蛋白fibulin蛋白家族中的一員,包括6型,主要分布在腦部、肺、心臟、胎盤、視網膜等組織內[8]。EFEMP1基因則是編碼fibulin蛋白3型,其存在于正常視網膜的神經纖維層和光感受器細胞的內外節周圍,在RPE、Bruch膜和脈絡膜層并不出現[9, 10]。R345W突變導致其構型出現折疊錯誤,使得蛋白喪失原有功能并在細胞內大量沉積,并且與年齡和EFEMP1基因拷貝數相關[11]。
DHRD眼底大量黃白色疣狀沉積物主要可以歸為兩種。一種是靠近病灶中心的形狀較大的圓形疣狀沉積,平均直徑0.13 μm;另一種是靠近病灶周邊的放射狀分布的小疣狀沉積,直徑僅有0.05 μm[12]。FAF中顯示的密集強熒光病灶主要對應大的疣狀沉積物,而周邊放射排列的疣狀沉積物不能明顯看到[13]。這種放射狀的疣狀沉積在年輕患者中更為明顯,且分布及自身熒光特點與老年性黃斑變性(AMD)的疣狀病變有一定區別[12, 14]。在FFA中,大的圓形疣狀沉積物早期為弱熒光,晚期逐漸成為強熒光斑點;而放射狀疣狀沉積物主要表現為病灶周圍毛刺狀強熒光邊[15]。常見的AMD疣狀病灶周圍通常是以膽固醇等輸水成分,而本病疣狀沉積物的外圍液體成分豐富,最終形成了這種弱熒光環[16, 17]。OCT可以觀察到兩種疣狀沉積物均分布在RPE下方,但隆起高度有明顯差異。大的圓形疣狀沉積物上方橢圓體帶也可見破壞,而放射狀疣狀沉積物上方橢圓體帶則相對完整。該病變累及范圍內內層視網膜結構相對完整[18]。隨著病情進展,沉積物可見逐漸堆積、融合的過程[12]。應用微視野對該病患者進行隨訪發現其視力損傷區域與RPE下沉積物隆起范圍呈現較好的一致性,且沉積物隆起越高,對應區域視功能損傷越重[12]。
由于DHRD與AMD具有相似的黃斑區黃白色病灶、RPE與Bruch膜層間沉積物,臨床中應注意鑒別。并且,AMD患者也可見Fibulin蛋白家族5、6型變異[19]。但AMD較DHRD發病晚,發病規律也并不遵循孟德爾遺傳定律,不能用生殖細胞突變的遺傳方式來解釋。已有研究發現,AMD患者可能由于某種微環境失衡,或者內質網修飾異常,導致了局部EFEMP1蛋白的性狀改變,最終發生了與EFEMP1基因突變相似的臨床表現[20]。因此,如何利用物理或者化學方法在活體中重建蛋白質內穩態,恢復EFEMP1蛋白的正常功能成為治療DHRD與AMD的新方向。目前,DHRD尚無有效的治療方法。臨床應注意隨訪患者是否并發脈絡膜新生血管或視網膜下新生血管膜[21]。如發現新生血管所致的視網膜下液體不能吸收,應積極行抗血管內皮生長因子藥物治療。