引用本文: 邢小麗, 黃亮瑜, 蘇睿虹, 劉勛, 趙今稚, 高美子, 張曉敏, 李筱榮, 東莉潔. 丁基苯酞對過氧化氫誘導下視網膜Müller細胞凋亡的影響. 中華眼底病雜志, 2018, 34(5): 481-486. doi: 10.3760/cma.j.issn.1005-1015.2018.05.014 復制
氧化應激可破壞視網膜Müller細胞膜屏障,嚴重時甚至引起細胞死亡。Müller細胞損傷可導致谷氨酸積累,阻礙血管調節,以致血視網膜屏障損傷[1, 2]。丁基苯酞(NBP)是我國具有自主知識產權的藥物,可作用于缺血性腦卒中所致腦損傷、脊髓損傷的多個病理環節,減輕神經功能損傷程度[3-5]。研究表明,NBP在抑制缺血缺氧、細胞凋亡及氧自由基產生等方面保護神經細胞免受氧化應激損傷[6, 7]。但目前用于神經膠質細胞保護作用研究鮮見報道。為此,我們將NBP引入Müller細胞氧化應激模型,以觀察NBP對氧化應激損傷的Müller細胞的保護作用,旨在為尋找Müller細胞保護藥物提供實驗基礎。現將結果報道如下。
1 材料和方法
1.1 材料
人Müller細胞系(MIO-M1)由天津醫科大學眼科醫院柯屹峰老師惠贈。NBP(石藥集團有限公司);LIVE/DEAD?細胞活性/細胞毒性檢測試劑盒[賽默飛世爾科技(中國)有限公司],Hoechst 33258染色劑(上海翊圣生物科技有限公司),噻唑藍(MTT)(北京索萊寶科技有限公司),2’, 7’-二氯熒光素二乙酸酯(DCFH-DA,美國Sigma公司),內質網(ER)紅色熒光探針(ER-Tracker Red,上海碧云天生物技術有限公司)。兔抗鼠谷氨酰胺合成酶(GS)單克隆抗體(美國Abcam公司),4’, 6-二脒基-2-苯基吲哚(DAPI,美國英杰生命技術有限公司),山羊抗兔IgG H&L (Alexa Fluor? 488,ab150077,美國Abcam公司) ,Olymplus熒光顯微鏡(BX51,日本Olympus公司)。
1.2 方法
參照文獻[8]的方法培養Müller細胞,取對數生長期細胞用于實驗。
免疫熒光染色法鑒定Müller細胞,GS抗體、GFAP抗體和DAPI染色觀察Müller細胞形態。Müller細胞以磷酸鹽緩沖液(PBS)洗滌后,4%多聚甲醛固定在蓋玻片上10 min,加入含0.1%Triton X-100的PBS通透10 min,牛血清白蛋白室溫下封閉30 min。細胞與GS抗體、GFAP抗體在4 ℃濕盒中孵育過夜。PBS洗滌蓋玻片,加入山羊抗兔二抗在室溫下孵育2 h。PBS洗滌后,DAPI染色,滴加適量的抗熒光淬滅劑于細胞上,熒光顯微鏡下觀察。
純化的Müller細胞分為正常對照組、模型組(H2O2組)、實驗組(H2O2+NBP組)。H2O2組、H2O2+NBP組細胞培養液中加入200 μmol/L H2O2刺激2 h后,H2O2組更換為完全培養基,H2O2+NBP組更換為含1 μmol/L NBP的完全培養基。正常對照組為常規培養細胞。
蘇木精-伊紅(HE)染色觀察正常對照組、H2O2組、H2O2+NBP組Müller細胞形態改變。各組細胞以3.0×104個/孔的細胞密度接種于24孔板,常規HE染色后光學顯微鏡觀察拍照。
MTT比色法檢測正常對照組、H2O2組、H2O2+NBP組細胞活性。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,細胞融合至70%~80%時,H2O2+NBP組更換為含1 μmol/L NBP的完全培養基作用24、48 h。各組細胞加入MTT孵育4 h后吸除原液,加入150 μl二甲基亞砜,室溫靜置10 min,酶聯免疫檢測儀490 nm波長處讀取吸光度[A,舊稱光密度(OD)]值。每組設定3個副孔,實驗重復進行3次,取平均值。
Hoechst33258染色觀察正常對照組、H2O2組、H2O2+NBP組細胞凋亡情況。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,加入1 μg/ml Hoechst33258,2 h后中止,熒光顯微鏡下觀察各組細胞形態。每組設定3個副孔,實驗重復3次。
LIVE/DEAD?細胞活性/細胞毒性試劑盒檢測正常對照組、H2O2組、H2O2+NBP組細胞生存力。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,繼續培養24 h,每孔加入30 μl配制的Live/Dead染色劑溶液,室溫靜置30 min,終止染色,PBS清洗。每組設3個副孔,實驗重復3次。細胞熒光顯微鏡觀察拍照,活細胞呈綠色熒光,死亡細胞呈紅色熒光。
DCFH-DA+ER-Tracker Red雙染色觀察正常對照組、H2O2組、H2O2+NBP組細胞ER中活性氧(ROS)的表達水平。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,每孔加入30 μl配制的ER-Tracker RED和DCFH-DA染色劑溶液,避光孵育20 min,PBS清洗。每組設3個副孔,實驗重復進行3次。細胞熒光顯微鏡觀察拍照,ER-Tracker Red染色呈紅色熒光示蹤ER;DCFH-DA染色ROS呈綠色熒光。
1.3 統計學方法
采用SPSS18.0軟件行統計分析。數據分析選擇單因素方差分析聯合Dunnett統計學方法,即首先對數據進行方差齊性檢驗,再利用Dunnett進行各組之間的兩兩比較。P<0.05為差異有統計學意義。經Graphprism軟件對所獲得數據進行圖表整理。
2 結果
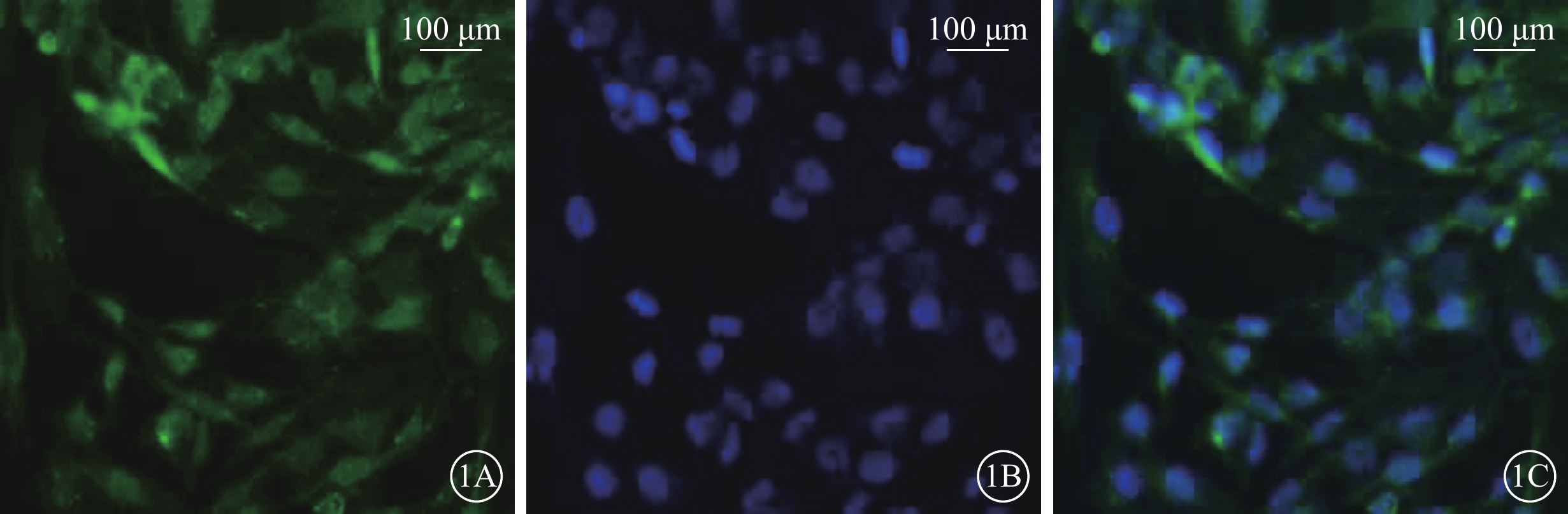
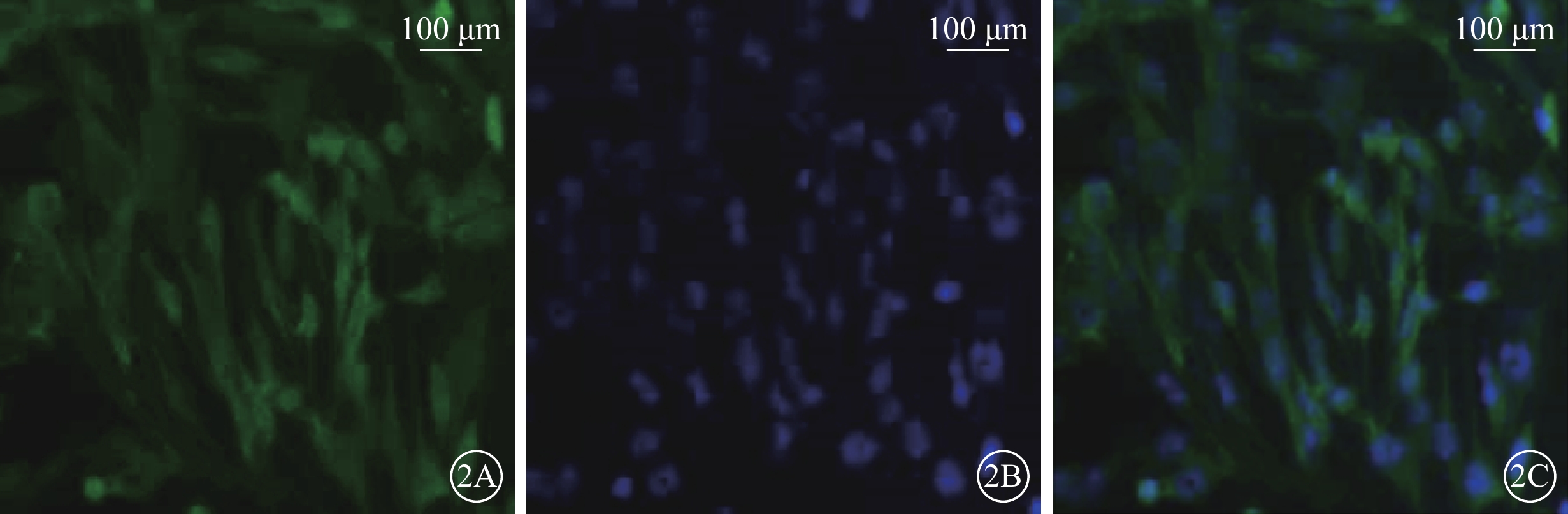
倒置相差顯微鏡觀察發現,培養的Müller細胞呈長梭形交織生長。熒光顯微鏡觀察發現,95%以上Müller細胞GFAP(圖1)、GS(圖2)染色陽性;細胞體大,細胞漿豐富,綠色熒光均勻一致;DAPI標記的細胞核呈圓形或卵圓形,邊界清晰,藍色熒光均勻一致。
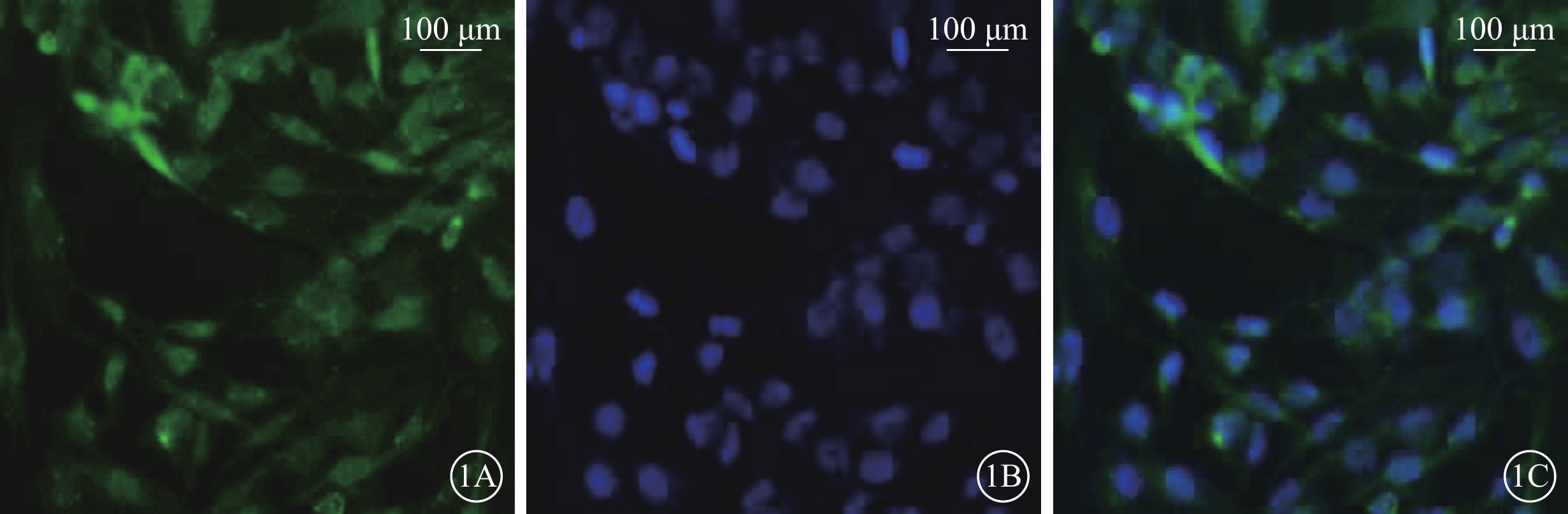 圖1
Müller細胞熒光顯微鏡像。1A. GFAP標記的細胞質及細胞核呈綠色熒光。1B. DAPI標記的細胞核呈藍色熒光。1C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
圖1
Müller細胞熒光顯微鏡像。1A. GFAP標記的細胞質及細胞核呈綠色熒光。1B. DAPI標記的細胞核呈藍色熒光。1C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
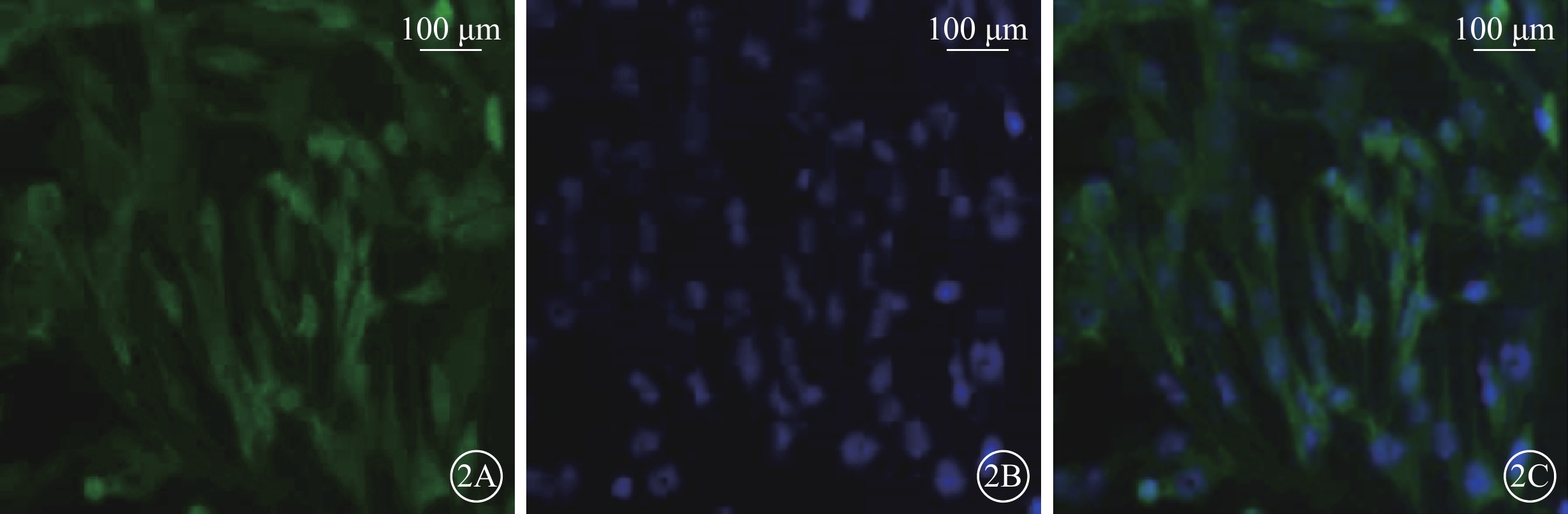 圖2
Müller細胞熒光顯微鏡像。2A. GS標記的細胞質及細胞核呈綠色熒光。2B. DAPI標記的細胞核呈藍色熒光。2C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
圖2
Müller細胞熒光顯微鏡像。2A. GS標記的細胞質及細胞核呈綠色熒光。2B. DAPI標記的細胞核呈藍色熒光。2C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
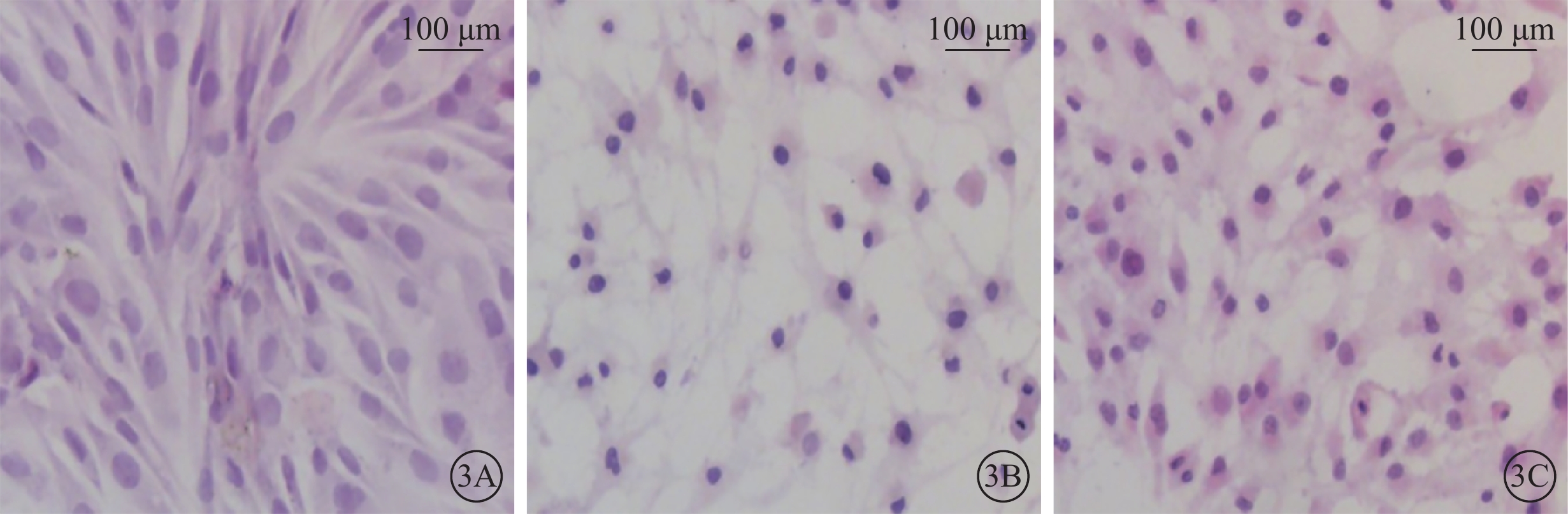
光學顯微鏡觀察發現,正常對照組細胞呈長梭形,胞質邊界清晰、形態均一;H2O2組細胞數量減少,細胞形態狹長,細胞核濃縮,細胞質減少; H2O2+NBP組細胞數量較H2O2組增加,較正常對照組減少,細胞質邊界清晰,部分細胞呈長梭形(圖3)。
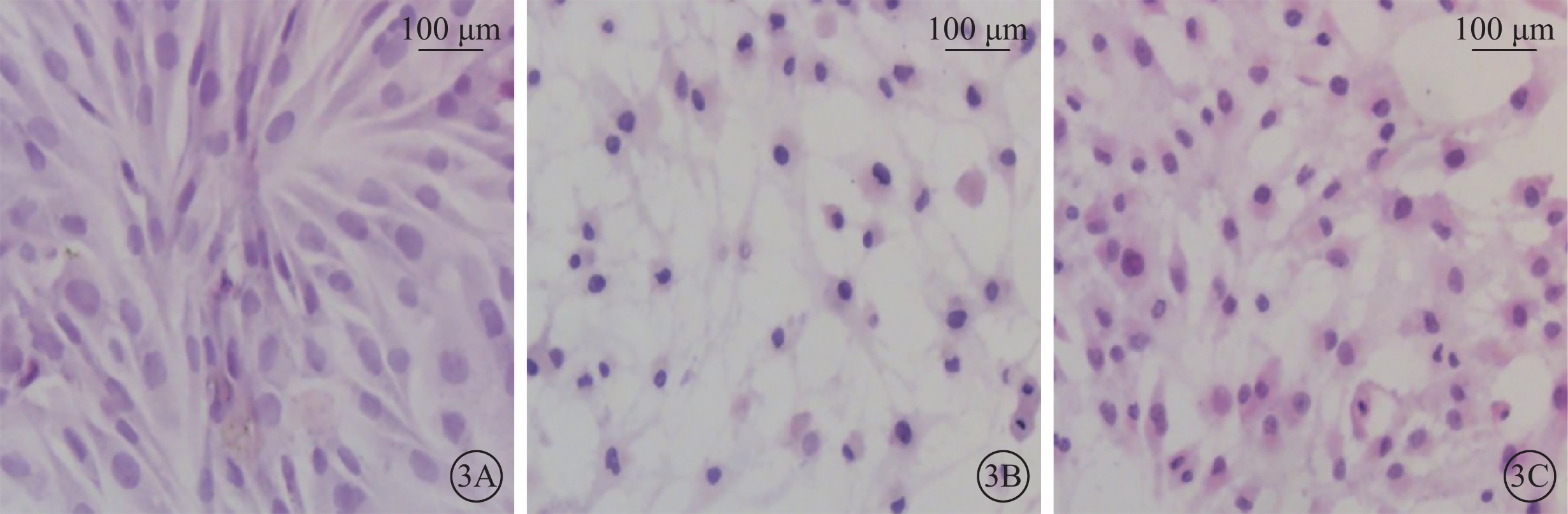 圖3
各組細胞光學顯微鏡像。3A~3C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈長梭形,細胞質邊界清晰;H2O2組細胞數量較正常對照組少,細胞核濃縮,細胞質減少;H2O2+NBP組細胞數量較正常對照組減少,但比H2O2組增多,細胞核較正常對照組略減小,較H2O2組細胞核大,細胞質多 HE 標尺: 100 μm
圖3
各組細胞光學顯微鏡像。3A~3C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈長梭形,細胞質邊界清晰;H2O2組細胞數量較正常對照組少,細胞核濃縮,細胞質減少;H2O2+NBP組細胞數量較正常對照組減少,但比H2O2組增多,細胞核較正常對照組略減小,較H2O2組細胞核大,細胞質多 HE 標尺: 100 μm
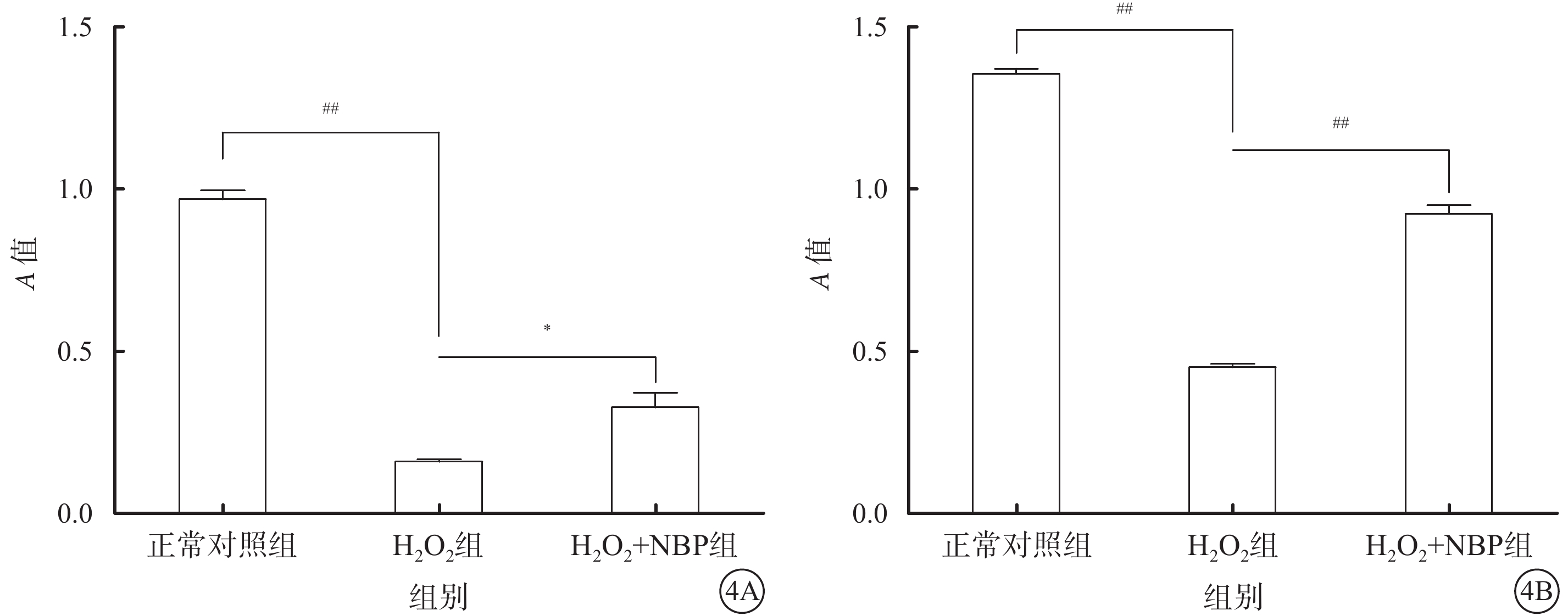
MTT比色法檢測結果顯示,NBP作用24 h后,正常對照組、H2O2組、H2O2+NBP組細胞生存力分別為0.97±0.05、0.16±0.01、0.33±0.08;正常對照組與H2O2組、H2O2組與H2O2+NBP組細胞生存力比較,差異均有統計學意義(t=28.96、3.658,P<0.001、0.022)。48 h后,正常對照組、H2O2組、H2O2+NBP組細胞生存力分別為1.35±0.03、0.45±0.03、0.92±0.05;正常對照組與H2O2組、H2O2組與H2O2+NBP組Müller細胞生存力比較,差異均有統計學意義(t=47.58、20.33,P<0.001、<0.001)(圖4)。
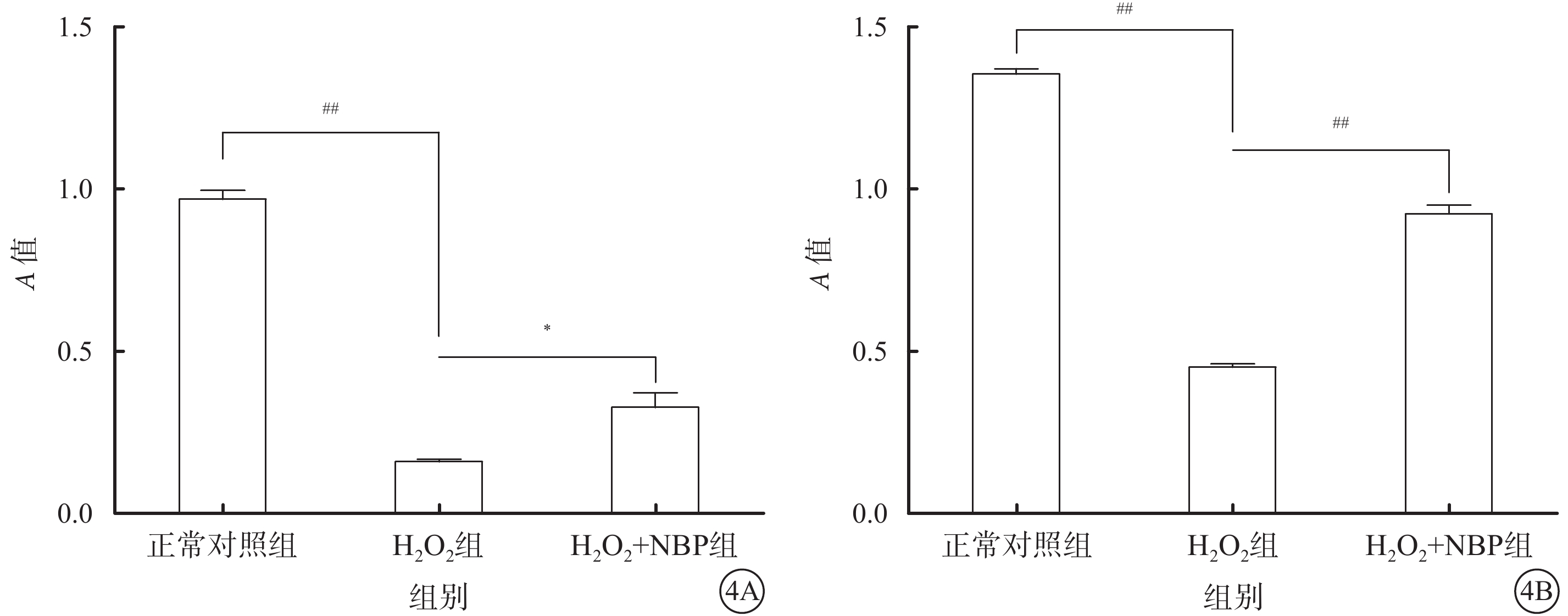 圖4
正常對照組、H2O2組、H2O2+NBP組細胞生存力比較。4A. 24 h;4B. 48 h。*P<0.05;##P<0.001
圖4
正常對照組、H2O2組、H2O2+NBP組細胞生存力比較。4A. 24 h;4B. 48 h。*P<0.05;##P<0.001
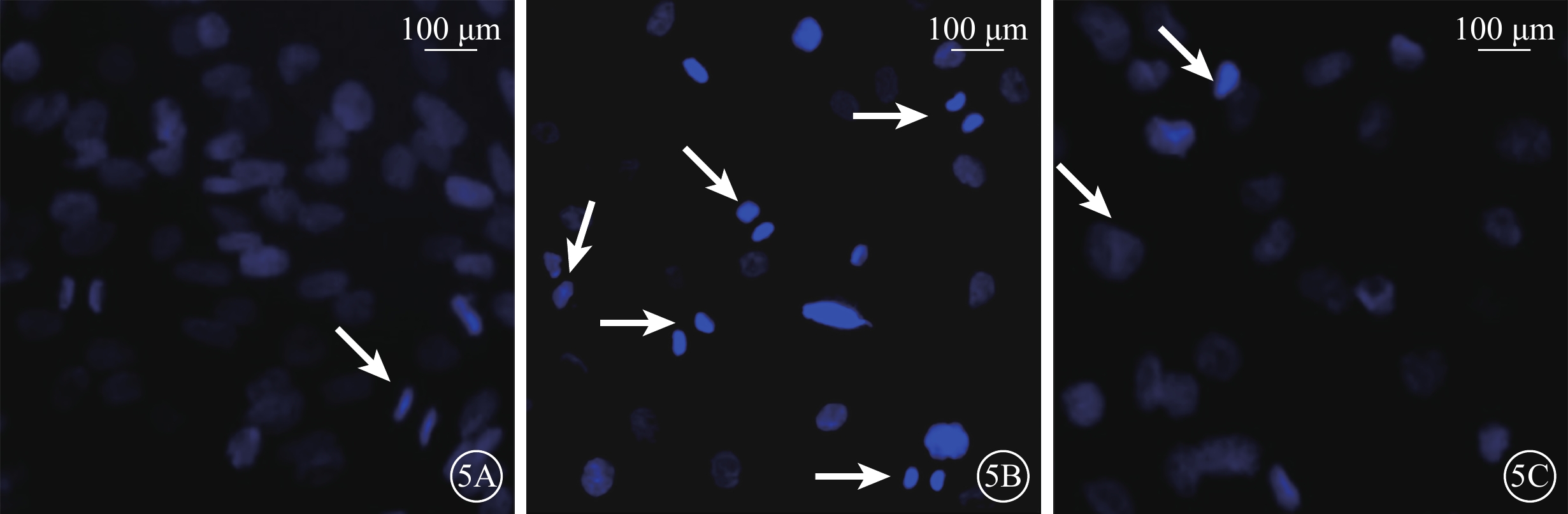
熒光顯微鏡觀察結果顯示,正常對照組細胞核藍色熒光均勻一致,形態完整;H2O2組細胞的細胞核固縮、碎裂,藍色熒光增強;H2O2+NBP組細胞少數細胞核邊集呈新月狀且細胞核碎裂減少,其余細胞藍色熒光均勻(圖5)。
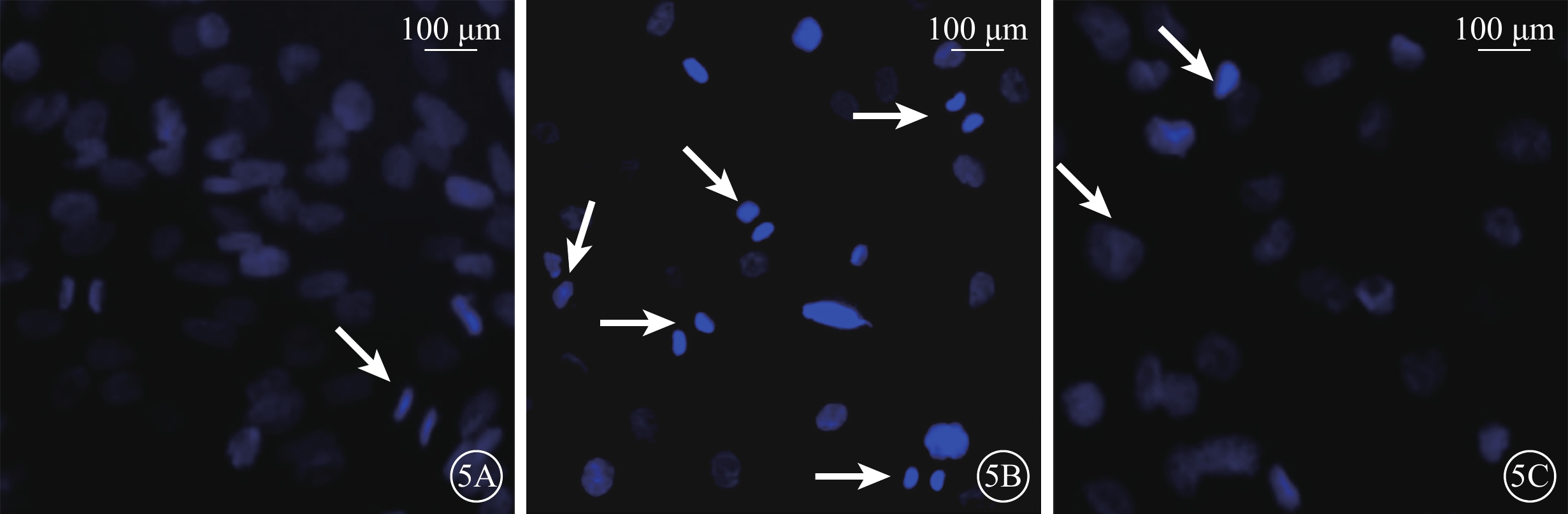 圖5
各組細胞熒光顯微鏡像。5A~5C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞染色呈圓形,藍色熒光均勻一致;H2O2組細胞濃集呈亮藍色,部分為碎片狀(白箭);H2O2+NBP組僅少數細胞呈亮藍色(白箭),其余細胞藍色熒光均勻 Hoechst33258標尺:100 μm
圖5
各組細胞熒光顯微鏡像。5A~5C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞染色呈圓形,藍色熒光均勻一致;H2O2組細胞濃集呈亮藍色,部分為碎片狀(白箭);H2O2+NBP組僅少數細胞呈亮藍色(白箭),其余細胞藍色熒光均勻 Hoechst33258標尺:100 μm
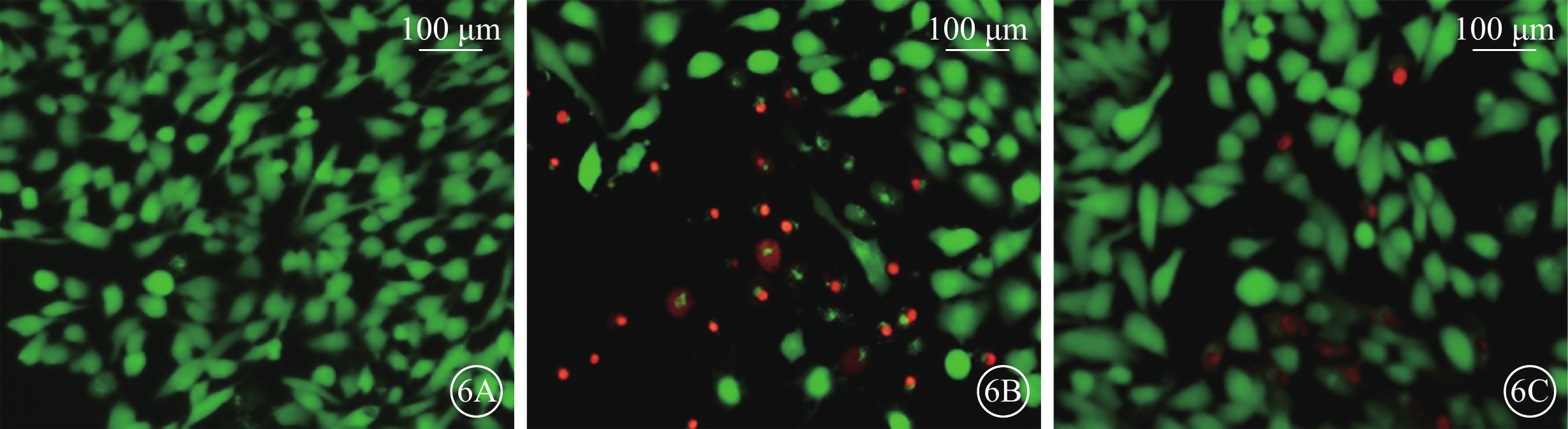
細胞熒光顯微鏡觀察發現,正常對照組細胞呈綠色熒光;H2O2組中可見較多呈紅色熒光的死亡細胞,呈綠色熒光的活細胞數量顯著減少;H2O2+NBP組呈綠色熒光的活細胞數量增多,紅色熒光的死亡細胞減少(圖6)。
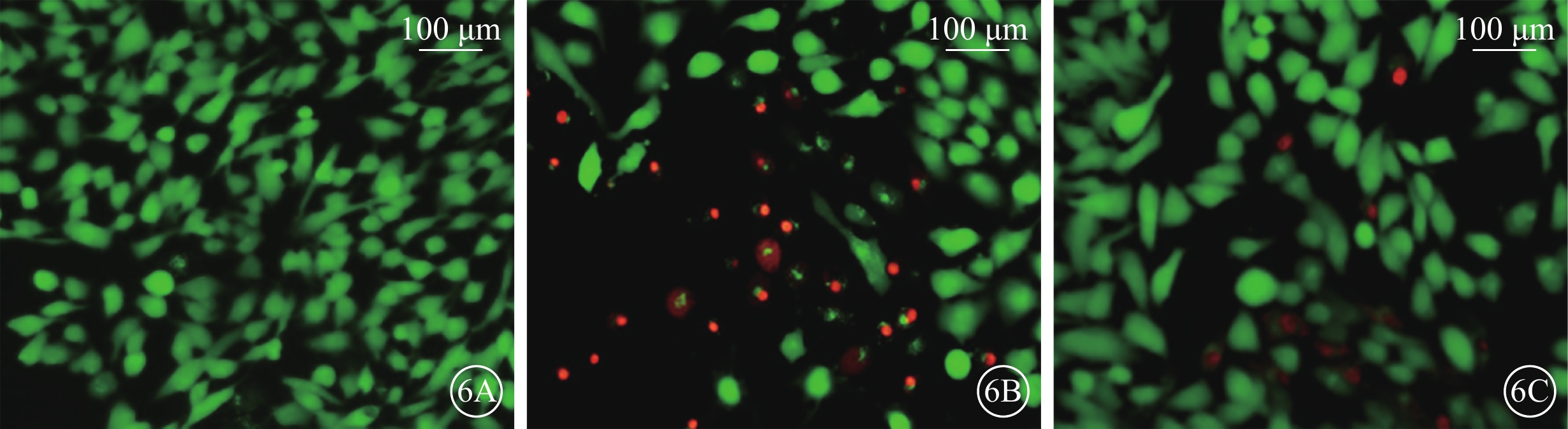 圖6
各組細胞熒光顯微鏡像。6A~6C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈綠色熒光;H2O2組細胞中紅色熒光增多;H2O2+NBP組細胞中紅色熒光顯著減少 標尺:100 μm
圖6
各組細胞熒光顯微鏡像。6A~6C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈綠色熒光;H2O2組細胞中紅色熒光增多;H2O2+NBP組細胞中紅色熒光顯著減少 標尺:100 μm
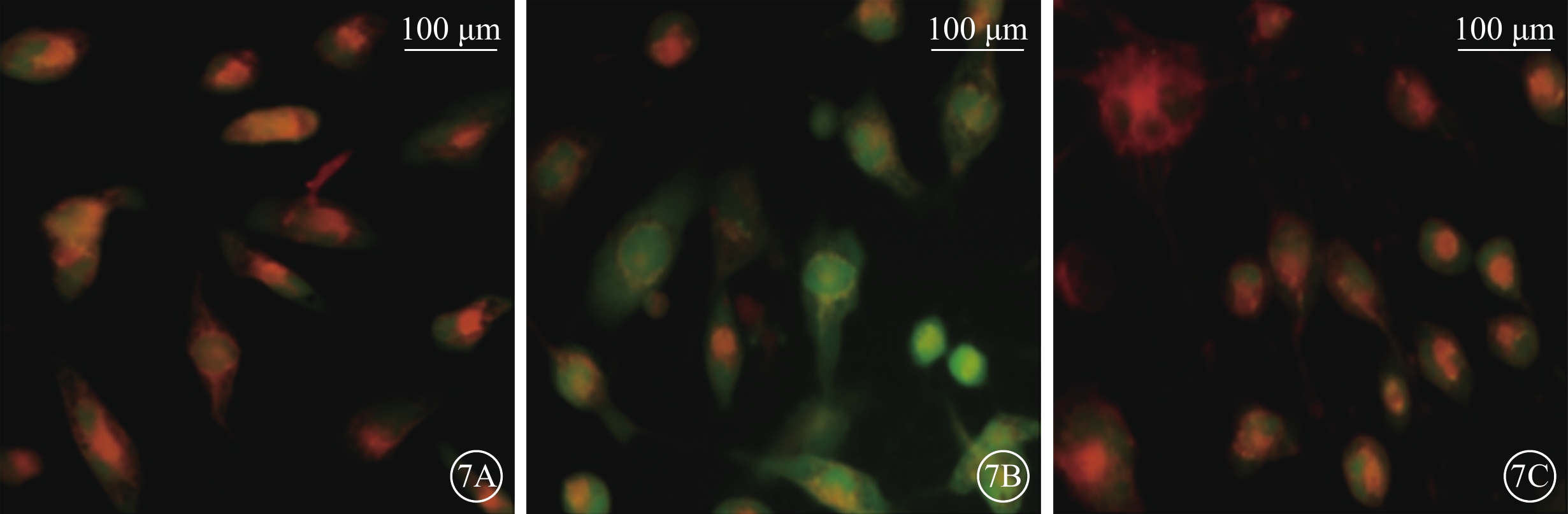
細胞熒光顯微鏡觀察發現,正常對照組細胞ER中隱約可見綠色熒光;H2O2組細胞ER中綠色熒光強度明顯增強;H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低(圖7)。
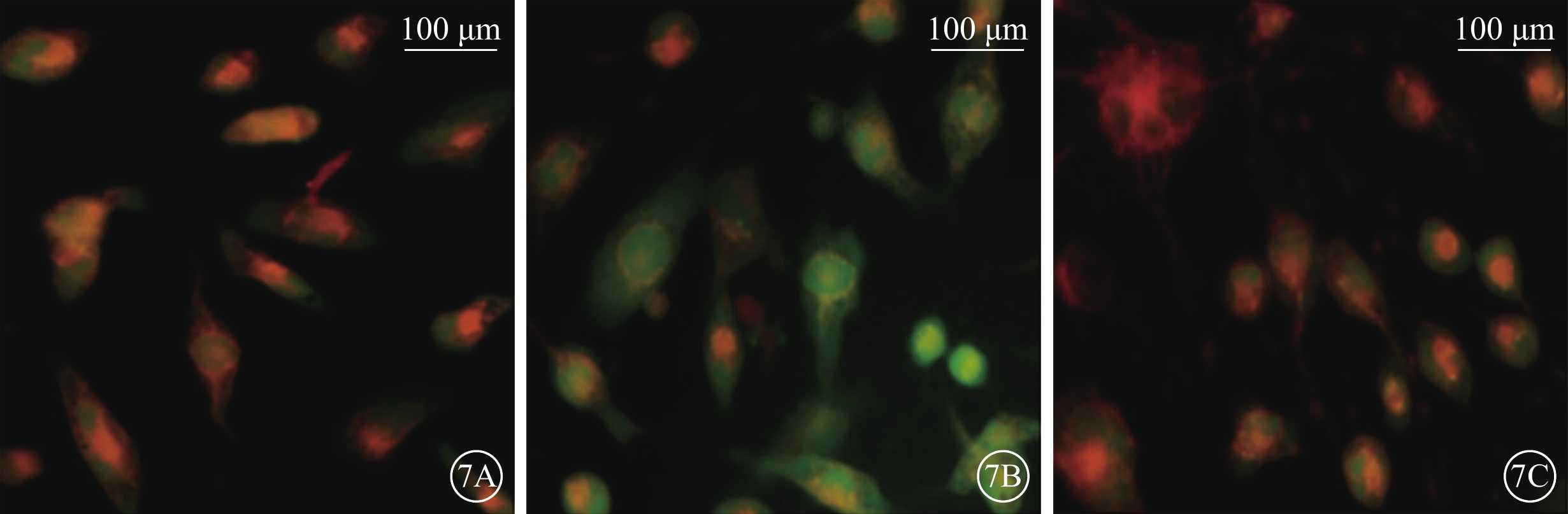 圖7
各組細胞ROS+ER熒光共定位像。7A. 正常對照組細胞ER中隱約可見綠色熒光;7B. H2O2組細胞ER中綠色熒光強度明顯增強;7C. H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低。綠色熒光為DCFH-DA標記的ROS,紅色熒光為ER-Tracker Red示蹤的ER標尺:100 μm
圖7
各組細胞ROS+ER熒光共定位像。7A. 正常對照組細胞ER中隱約可見綠色熒光;7B. H2O2組細胞ER中綠色熒光強度明顯增強;7C. H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低。綠色熒光為DCFH-DA標記的ROS,紅色熒光為ER-Tracker Red示蹤的ER標尺:100 μm
3 討論
Müller細胞是貫穿于全層視網膜的大神經膠質細胞,主要負責視網膜保護、營養及代謝、調節神經遞質等。有研究表明,Müller細胞在很多眼缺血性疾病早期就出現形態及功能的變化。本研究結果顯示,Müller細胞在H2O2的刺激下,產生凋亡的一系列病理生理改變,模擬眼缺血性疾病早期出現的缺血缺氧狀態,在此基礎之上研究其可能的機制,為今后疾病的治療開拓新的思路。
NBP國內主要用于缺血性腦卒中的治療。大量研究表明,NBP可在抑制缺血缺氧、細胞凋亡、氧自由基產生等多個環節起到保護神經細胞免受氧化應激損傷的作用[9, 10]。
本研究結果顯示,經H2O2刺激后Müller細胞數量減少,形態呈長梭形,細胞質濃縮;細胞生存力下降。提示H2O2刺激導致細胞受損以及細胞凋亡程序的啟動。加入NBP作用后,細胞數量較H2O2組明顯增加,細胞質邊界清晰,部分細胞呈長梭形,細胞生存力提高;緩解了H2O2誘導的細胞氧化損傷。提示NBP是Müller細胞凋亡的潛在保護因子。
ROS包括超氧自由基、過氧化氫及其下游產物過氧化物和羥化物等,可參與細胞生長增生、發育分化、衰老和凋亡等生理及病理過程。為初步了解抑制H2O2誘導的Müller細胞凋亡的途徑,本研究應用DCFH-DA檢測NBP高表達對H2O2誘導的Müller細胞ER中ROS的表達影響。結果發現,H2O2刺激后Müller細胞的ROS水平明顯增高,而給予NBP作用后,細胞中ROS水平顯著下降。提示NBP可抑制氧化應激水平。
ER是真核細胞中分泌和折疊合成蛋白及膜結合蛋白的的重要亞細胞器,在許多神經疾病中起著至關重要的作用,如神經退行性疾病、硬化癥和腦缺血等[11]。研究顯示,ER應激在糖尿病視網膜病變中有重要作用[12, 13]。為明確H2O2誘導的氧化應激是否與ER應激存在潛在聯系,本研究采用ER-Tracker染色,觀察細胞ER中ROS表達情況。ER-Tracker Red是一種ER紅色熒光探針,可以用于活細胞ER特異性熒光染色。DCFH-DA本身沒有熒光,可以穿過細胞膜,進入細胞內后被細胞內的酯酶水解生成DCFH。在ROS存在的條件下,DCFH被氧化生成熒光物質DCF,檢測熒光DCF可了解細胞內ROS水平。綠色熒光的強度與細胞內ROS水平成正比。結果顯示,NBP作用后可有效緩解ER中ROS的堆積,進而下調ER應激水平。Zheng等[5]發現NBP可以在脊髓損傷后,抑制ER應激。本研究結果與此一致。
既往對NBP的研究主要集中于神經系統,如腦缺血、脊髓損傷等[7-9]。NBP是一種多靶點的神經保護劑,可以顯著降低氧化損傷,改善線粒體功能,減少神經元的凋亡,并可抑制炎癥反應。最近研究表明,NBP在鏈脲佐菌素誘導的糖尿病大鼠模型中可抑制白內障形成,降低血糖[14]。其機制是減少ROS、丙二醛等氧化應激指標。
本研究僅對NBP在體外培養的Müller細胞氧化應激條件下作用進行初步探討,今后尚需對NBP作用下Müller抗氧化應激機制,Müller與視網膜神經節細胞之間的相互作用以及分子機制等進行深入研究。
氧化應激可破壞視網膜Müller細胞膜屏障,嚴重時甚至引起細胞死亡。Müller細胞損傷可導致谷氨酸積累,阻礙血管調節,以致血視網膜屏障損傷[1, 2]。丁基苯酞(NBP)是我國具有自主知識產權的藥物,可作用于缺血性腦卒中所致腦損傷、脊髓損傷的多個病理環節,減輕神經功能損傷程度[3-5]。研究表明,NBP在抑制缺血缺氧、細胞凋亡及氧自由基產生等方面保護神經細胞免受氧化應激損傷[6, 7]。但目前用于神經膠質細胞保護作用研究鮮見報道。為此,我們將NBP引入Müller細胞氧化應激模型,以觀察NBP對氧化應激損傷的Müller細胞的保護作用,旨在為尋找Müller細胞保護藥物提供實驗基礎。現將結果報道如下。
1 材料和方法
1.1 材料
人Müller細胞系(MIO-M1)由天津醫科大學眼科醫院柯屹峰老師惠贈。NBP(石藥集團有限公司);LIVE/DEAD?細胞活性/細胞毒性檢測試劑盒[賽默飛世爾科技(中國)有限公司],Hoechst 33258染色劑(上海翊圣生物科技有限公司),噻唑藍(MTT)(北京索萊寶科技有限公司),2’, 7’-二氯熒光素二乙酸酯(DCFH-DA,美國Sigma公司),內質網(ER)紅色熒光探針(ER-Tracker Red,上海碧云天生物技術有限公司)。兔抗鼠谷氨酰胺合成酶(GS)單克隆抗體(美國Abcam公司),4’, 6-二脒基-2-苯基吲哚(DAPI,美國英杰生命技術有限公司),山羊抗兔IgG H&L (Alexa Fluor? 488,ab150077,美國Abcam公司) ,Olymplus熒光顯微鏡(BX51,日本Olympus公司)。
1.2 方法
參照文獻[8]的方法培養Müller細胞,取對數生長期細胞用于實驗。
免疫熒光染色法鑒定Müller細胞,GS抗體、GFAP抗體和DAPI染色觀察Müller細胞形態。Müller細胞以磷酸鹽緩沖液(PBS)洗滌后,4%多聚甲醛固定在蓋玻片上10 min,加入含0.1%Triton X-100的PBS通透10 min,牛血清白蛋白室溫下封閉30 min。細胞與GS抗體、GFAP抗體在4 ℃濕盒中孵育過夜。PBS洗滌蓋玻片,加入山羊抗兔二抗在室溫下孵育2 h。PBS洗滌后,DAPI染色,滴加適量的抗熒光淬滅劑于細胞上,熒光顯微鏡下觀察。
純化的Müller細胞分為正常對照組、模型組(H2O2組)、實驗組(H2O2+NBP組)。H2O2組、H2O2+NBP組細胞培養液中加入200 μmol/L H2O2刺激2 h后,H2O2組更換為完全培養基,H2O2+NBP組更換為含1 μmol/L NBP的完全培養基。正常對照組為常規培養細胞。
蘇木精-伊紅(HE)染色觀察正常對照組、H2O2組、H2O2+NBP組Müller細胞形態改變。各組細胞以3.0×104個/孔的細胞密度接種于24孔板,常規HE染色后光學顯微鏡觀察拍照。
MTT比色法檢測正常對照組、H2O2組、H2O2+NBP組細胞活性。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,細胞融合至70%~80%時,H2O2+NBP組更換為含1 μmol/L NBP的完全培養基作用24、48 h。各組細胞加入MTT孵育4 h后吸除原液,加入150 μl二甲基亞砜,室溫靜置10 min,酶聯免疫檢測儀490 nm波長處讀取吸光度[A,舊稱光密度(OD)]值。每組設定3個副孔,實驗重復進行3次,取平均值。
Hoechst33258染色觀察正常對照組、H2O2組、H2O2+NBP組細胞凋亡情況。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,加入1 μg/ml Hoechst33258,2 h后中止,熒光顯微鏡下觀察各組細胞形態。每組設定3個副孔,實驗重復3次。
LIVE/DEAD?細胞活性/細胞毒性試劑盒檢測正常對照組、H2O2組、H2O2+NBP組細胞生存力。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,繼續培養24 h,每孔加入30 μl配制的Live/Dead染色劑溶液,室溫靜置30 min,終止染色,PBS清洗。每組設3個副孔,實驗重復3次。細胞熒光顯微鏡觀察拍照,活細胞呈綠色熒光,死亡細胞呈紅色熒光。
DCFH-DA+ER-Tracker Red雙染色觀察正常對照組、H2O2組、H2O2+NBP組細胞ER中活性氧(ROS)的表達水平。各組細胞以3.5×104個/孔的細胞密度接種于96孔板,每孔加入30 μl配制的ER-Tracker RED和DCFH-DA染色劑溶液,避光孵育20 min,PBS清洗。每組設3個副孔,實驗重復進行3次。細胞熒光顯微鏡觀察拍照,ER-Tracker Red染色呈紅色熒光示蹤ER;DCFH-DA染色ROS呈綠色熒光。
1.3 統計學方法
采用SPSS18.0軟件行統計分析。數據分析選擇單因素方差分析聯合Dunnett統計學方法,即首先對數據進行方差齊性檢驗,再利用Dunnett進行各組之間的兩兩比較。P<0.05為差異有統計學意義。經Graphprism軟件對所獲得數據進行圖表整理。
2 結果
倒置相差顯微鏡觀察發現,培養的Müller細胞呈長梭形交織生長。熒光顯微鏡觀察發現,95%以上Müller細胞GFAP(圖1)、GS(圖2)染色陽性;細胞體大,細胞漿豐富,綠色熒光均勻一致;DAPI標記的細胞核呈圓形或卵圓形,邊界清晰,藍色熒光均勻一致。
 圖1
Müller細胞熒光顯微鏡像。1A. GFAP標記的細胞質及細胞核呈綠色熒光。1B. DAPI標記的細胞核呈藍色熒光。1C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
圖1
Müller細胞熒光顯微鏡像。1A. GFAP標記的細胞質及細胞核呈綠色熒光。1B. DAPI標記的細胞核呈藍色熒光。1C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
 圖2
Müller細胞熒光顯微鏡像。2A. GS標記的細胞質及細胞核呈綠色熒光。2B. DAPI標記的細胞核呈藍色熒光。2C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
圖2
Müller細胞熒光顯微鏡像。2A. GS標記的細胞質及細胞核呈綠色熒光。2B. DAPI標記的細胞核呈藍色熒光。2C. 共定位,培養的Müller細胞,形態規則,呈長梭形交織生長;染色陽性率>95% 標尺:100 μm
光學顯微鏡觀察發現,正常對照組細胞呈長梭形,胞質邊界清晰、形態均一;H2O2組細胞數量減少,細胞形態狹長,細胞核濃縮,細胞質減少; H2O2+NBP組細胞數量較H2O2組增加,較正常對照組減少,細胞質邊界清晰,部分細胞呈長梭形(圖3)。
 圖3
各組細胞光學顯微鏡像。3A~3C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈長梭形,細胞質邊界清晰;H2O2組細胞數量較正常對照組少,細胞核濃縮,細胞質減少;H2O2+NBP組細胞數量較正常對照組減少,但比H2O2組增多,細胞核較正常對照組略減小,較H2O2組細胞核大,細胞質多 HE 標尺: 100 μm
圖3
各組細胞光學顯微鏡像。3A~3C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈長梭形,細胞質邊界清晰;H2O2組細胞數量較正常對照組少,細胞核濃縮,細胞質減少;H2O2+NBP組細胞數量較正常對照組減少,但比H2O2組增多,細胞核較正常對照組略減小,較H2O2組細胞核大,細胞質多 HE 標尺: 100 μm
MTT比色法檢測結果顯示,NBP作用24 h后,正常對照組、H2O2組、H2O2+NBP組細胞生存力分別為0.97±0.05、0.16±0.01、0.33±0.08;正常對照組與H2O2組、H2O2組與H2O2+NBP組細胞生存力比較,差異均有統計學意義(t=28.96、3.658,P<0.001、0.022)。48 h后,正常對照組、H2O2組、H2O2+NBP組細胞生存力分別為1.35±0.03、0.45±0.03、0.92±0.05;正常對照組與H2O2組、H2O2組與H2O2+NBP組Müller細胞生存力比較,差異均有統計學意義(t=47.58、20.33,P<0.001、<0.001)(圖4)。
 圖4
正常對照組、H2O2組、H2O2+NBP組細胞生存力比較。4A. 24 h;4B. 48 h。*P<0.05;##P<0.001
圖4
正常對照組、H2O2組、H2O2+NBP組細胞生存力比較。4A. 24 h;4B. 48 h。*P<0.05;##P<0.001
熒光顯微鏡觀察結果顯示,正常對照組細胞核藍色熒光均勻一致,形態完整;H2O2組細胞的細胞核固縮、碎裂,藍色熒光增強;H2O2+NBP組細胞少數細胞核邊集呈新月狀且細胞核碎裂減少,其余細胞藍色熒光均勻(圖5)。
 圖5
各組細胞熒光顯微鏡像。5A~5C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞染色呈圓形,藍色熒光均勻一致;H2O2組細胞濃集呈亮藍色,部分為碎片狀(白箭);H2O2+NBP組僅少數細胞呈亮藍色(白箭),其余細胞藍色熒光均勻 Hoechst33258標尺:100 μm
圖5
各組細胞熒光顯微鏡像。5A~5C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞染色呈圓形,藍色熒光均勻一致;H2O2組細胞濃集呈亮藍色,部分為碎片狀(白箭);H2O2+NBP組僅少數細胞呈亮藍色(白箭),其余細胞藍色熒光均勻 Hoechst33258標尺:100 μm
細胞熒光顯微鏡觀察發現,正常對照組細胞呈綠色熒光;H2O2組中可見較多呈紅色熒光的死亡細胞,呈綠色熒光的活細胞數量顯著減少;H2O2+NBP組呈綠色熒光的活細胞數量增多,紅色熒光的死亡細胞減少(圖6)。
 圖6
各組細胞熒光顯微鏡像。6A~6C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈綠色熒光;H2O2組細胞中紅色熒光增多;H2O2+NBP組細胞中紅色熒光顯著減少 標尺:100 μm
圖6
各組細胞熒光顯微鏡像。6A~6C. 分別為正常對照組、H2O2組、H2O2+NBP組。正常對照組細胞呈綠色熒光;H2O2組細胞中紅色熒光增多;H2O2+NBP組細胞中紅色熒光顯著減少 標尺:100 μm
細胞熒光顯微鏡觀察發現,正常對照組細胞ER中隱約可見綠色熒光;H2O2組細胞ER中綠色熒光強度明顯增強;H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低(圖7)。
 圖7
各組細胞ROS+ER熒光共定位像。7A. 正常對照組細胞ER中隱約可見綠色熒光;7B. H2O2組細胞ER中綠色熒光強度明顯增強;7C. H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低。綠色熒光為DCFH-DA標記的ROS,紅色熒光為ER-Tracker Red示蹤的ER標尺:100 μm
圖7
各組細胞ROS+ER熒光共定位像。7A. 正常對照組細胞ER中隱約可見綠色熒光;7B. H2O2組細胞ER中綠色熒光強度明顯增強;7C. H2O2+NBP組細胞ER中綠色熒光強度較H2O2組明顯降低。綠色熒光為DCFH-DA標記的ROS,紅色熒光為ER-Tracker Red示蹤的ER標尺:100 μm
3 討論
Müller細胞是貫穿于全層視網膜的大神經膠質細胞,主要負責視網膜保護、營養及代謝、調節神經遞質等。有研究表明,Müller細胞在很多眼缺血性疾病早期就出現形態及功能的變化。本研究結果顯示,Müller細胞在H2O2的刺激下,產生凋亡的一系列病理生理改變,模擬眼缺血性疾病早期出現的缺血缺氧狀態,在此基礎之上研究其可能的機制,為今后疾病的治療開拓新的思路。
NBP國內主要用于缺血性腦卒中的治療。大量研究表明,NBP可在抑制缺血缺氧、細胞凋亡、氧自由基產生等多個環節起到保護神經細胞免受氧化應激損傷的作用[9, 10]。
本研究結果顯示,經H2O2刺激后Müller細胞數量減少,形態呈長梭形,細胞質濃縮;細胞生存力下降。提示H2O2刺激導致細胞受損以及細胞凋亡程序的啟動。加入NBP作用后,細胞數量較H2O2組明顯增加,細胞質邊界清晰,部分細胞呈長梭形,細胞生存力提高;緩解了H2O2誘導的細胞氧化損傷。提示NBP是Müller細胞凋亡的潛在保護因子。
ROS包括超氧自由基、過氧化氫及其下游產物過氧化物和羥化物等,可參與細胞生長增生、發育分化、衰老和凋亡等生理及病理過程。為初步了解抑制H2O2誘導的Müller細胞凋亡的途徑,本研究應用DCFH-DA檢測NBP高表達對H2O2誘導的Müller細胞ER中ROS的表達影響。結果發現,H2O2刺激后Müller細胞的ROS水平明顯增高,而給予NBP作用后,細胞中ROS水平顯著下降。提示NBP可抑制氧化應激水平。
ER是真核細胞中分泌和折疊合成蛋白及膜結合蛋白的的重要亞細胞器,在許多神經疾病中起著至關重要的作用,如神經退行性疾病、硬化癥和腦缺血等[11]。研究顯示,ER應激在糖尿病視網膜病變中有重要作用[12, 13]。為明確H2O2誘導的氧化應激是否與ER應激存在潛在聯系,本研究采用ER-Tracker染色,觀察細胞ER中ROS表達情況。ER-Tracker Red是一種ER紅色熒光探針,可以用于活細胞ER特異性熒光染色。DCFH-DA本身沒有熒光,可以穿過細胞膜,進入細胞內后被細胞內的酯酶水解生成DCFH。在ROS存在的條件下,DCFH被氧化生成熒光物質DCF,檢測熒光DCF可了解細胞內ROS水平。綠色熒光的強度與細胞內ROS水平成正比。結果顯示,NBP作用后可有效緩解ER中ROS的堆積,進而下調ER應激水平。Zheng等[5]發現NBP可以在脊髓損傷后,抑制ER應激。本研究結果與此一致。
既往對NBP的研究主要集中于神經系統,如腦缺血、脊髓損傷等[7-9]。NBP是一種多靶點的神經保護劑,可以顯著降低氧化損傷,改善線粒體功能,減少神經元的凋亡,并可抑制炎癥反應。最近研究表明,NBP在鏈脲佐菌素誘導的糖尿病大鼠模型中可抑制白內障形成,降低血糖[14]。其機制是減少ROS、丙二醛等氧化應激指標。
本研究僅對NBP在體外培養的Müller細胞氧化應激條件下作用進行初步探討,今后尚需對NBP作用下Müller抗氧化應激機制,Müller與視網膜神經節細胞之間的相互作用以及分子機制等進行深入研究。