引用本文: 王鑫, 尚慶麗, 馬景學, 郝玉華, 姚惠娟, 李佳佳. 實驗性脈絡膜新生血管中Rap1、鳥苷三磷酸-Rap1、血管內皮生長因子及β-連環蛋白的表達研究. 中華眼底病雜志, 2018, 34(5): 475-480. doi: 10.3760/cma.j.issn.1005-1015.2018.05.013 復制
脈絡膜新生血管(CNV)的形成離不開脈絡膜毛細血管內皮細胞(CEC)的活化、Bruch膜的破壞與視網膜色素上皮(RPE)層的遷移。因此,RPE-Bruch膜-脈絡膜毛細血管復合體(RBCC)的完整性在CNV的形成發展中起至關重要的作用。研究發現,Ras超家族的小分子G蛋白Rap1,不僅可調節整合素介導的細胞基質黏附及細胞遷移,還對細胞間連接的完整性具有重要作用,Rap1可參與調節上皮細胞和內皮細胞間緊密連接與粘附連接的形成,一定程度上影響屏障功能的完整性[1]。因此,我們推斷Rap1對屏障功能的維持可能具有協調作用。本研究通過觀察激光誘導的CNV中Rap1及相關因子的表達情況,探討Rap1及相關因子與CNV發生發展的相關性。
1 材料和方法
健康雄性棕色挪威大鼠42只,8~10周齡,體重200~220 g,購自北京維通利華試驗動物技術有限公司,于河北醫科大學第二醫院動物實驗中心正常飼養。實驗動物的管理和使用符合國家科學技術委員會頒布的《實驗動物管理條例》,并取得河北醫科大學第二醫院科研倫理委員會許可。大鼠眼部經裂隙燈顯微鏡和檢眼鏡檢查屈光間質清晰,眼底無病變。
隨機數字表法將大鼠分為空白對照組和模型組,分別7、35只大鼠;均雙眼入組。模型組大鼠激光光凝誘導CNV形成,建立動物模型。按體重0.35 ml/100 g的劑量腹腔注射10%水合氯醛麻醉大鼠,鹽酸丙美卡因滴眼液眼表麻醉,1.5 cm×3.0 cm載玻片作為角膜接觸鏡,采用Coherent Novus-Omni氪離子激光機(美國Coherent公司)進行激光光凝。激光參數:波長647 nm,光斑直徑50 μm,功率260 mW,曝光時間0.05 s,距視盤2~3個視盤直徑均勻光凝9~10個點,以氣泡產生或伴有輕度出血為擊破Bruch膜的標志[2],記為有效光凝斑。空白對照組以及模型組大鼠光凝后3、7、14、21、28 d,隨機數字表法隨機選取2只大鼠行熒光素眼底血管造影(FFA)檢查。5%水合氯醛充分麻醉,復方托吡卡胺滴眼液散瞳,按體重0.5 ml/kg的劑量腹腔注射10%熒光素鈉,注射后立即行FFA檢查,同步動態觀察大鼠模型CNV的形成情況。以出現CNV光凝斑數量與光凝斑總數的比值(百分率)作為該時間段CNV發生率。
光凝后3、7、14、21、28 d,模型組大鼠隨機數字表法隨機選取2只大鼠行脈絡膜鋪片,測量CNV面積。麻醉同前并固定大鼠,經雙側頸總動脈注射異硫氰酸熒光素-右旋糖酐(相對分子質量2×106,美國Sigma公司)磷酸鹽緩沖液(PBS)1 ml。摘除眼球,置于固定液中固定1 h,沖洗后放入PBS,解剖顯微鏡下去除眼前節,仔細剝除視網膜神經層,以視盤為中心,行4~5條放射狀切口,將獲得的RPE-脈絡膜-鞏膜復合體平鋪于蓋玻片上,滴少量甘油封片。激光共聚焦顯微鏡對CNV進行觀察和測量。
蛋白免疫印跡法(Western blot)檢測CNV中Rap1、鳥苷三磷酸(GTP)-Rap1、VEGF、β-連環蛋白(catenin)蛋白表達。光凝后3、7、14、21、28 d,隨機數字表法隨機選取空白對照組和模型組大鼠2只,摘除眼球,分離RPE-脈絡膜-鞏膜復合體。取CNV病變區域20 mg組織加入200~400 μl裂解液,提取總蛋白,Bradford法測定樣本蛋白含量。制備十二烷基硫酸鈉聚丙烯酰胺凝膠電泳膠分離蛋白,隨后將蛋白質轉移至甲醇激活的聚偏氟乙烯膜,室溫封閉 1 h,一抗4 ℃反應過夜,1倍洗膜緩沖液(TBST)洗滌3次,10 min/次,將洗滌后的一抗反應膜放入二抗工作液(1:3000)中,室溫避光緩慢搖動作用60 min,1倍TBST洗膜,進行化學發光反應、顯影及定影。以等量β-肌動蛋白(actin)作為對照,將膠片進行掃描。重復4次,Image J軟件分析灰度值。
實時熒光定量聚合酶鏈反應(RT- PCR) 檢測CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA的表達。處死空白對照組、模型組各剩余大鼠3只,超純RNA提取試劑盒(CWbio.Co.Ltd,Cat#CW0581)提取視網膜、脈絡膜總RNA,5 μl RNA 1%瓊脂糖凝膠進行電泳,檢測RNA完整性。HiFi-MMLVcDNA第一鏈合成試劑盒(Cat#CW0744)進行逆轉錄,65 ℃孵育5 min,冰浴2 min,離心。加入5倍逆轉錄緩沖液4 μl、0.1 mol/L二硫蘇糖醇2 μl、10.0 mmol/L脫氧核糖核苷三磷酸1 μl、HiFi-MMLV酶混合物1 μl,混勻,37 ℃孵育50 min,70 ℃保溫10 min,?20 ℃冰箱保存。應用Primer5.0軟件設計引物(表1)。反應條件:95 ℃預變性10 min;95 ℃變性15 s;60 ℃退火60 s。重復40個循環后形成擴增曲線,記錄循環閾值(Ct值),以磷酸甘油醛脫氫酶(GAPDH)為內參基因,采用2?ΔΔCt法計算目的基因mRNA相對表達量。
采用SPSS19.0軟件進行統計分析。數據進行正態性和方差齊性檢驗,符合正態分布和方差齊性時采用單因素方差分析,兩兩比較采用最小顯著差法檢驗;方差不齊時,采用非參數軼和檢驗。P<0.05為差異有統計學意義。
2 結果
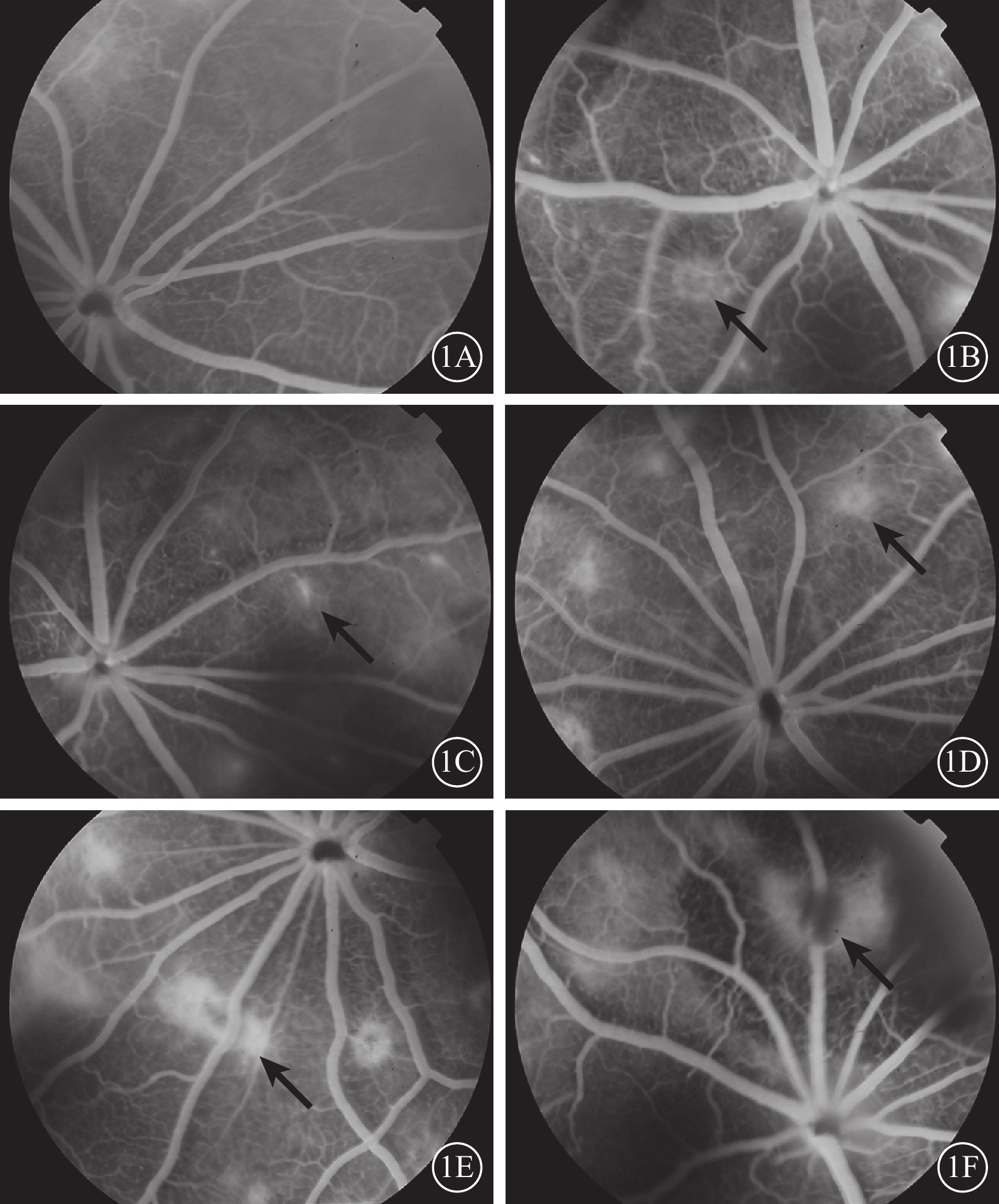
FFA檢查結果顯示,空白對照組大鼠視網膜血管熒光充盈良好,血管結構清晰(圖1A)。模型組大鼠光凝后3 d,13%(14/109)的光凝斑早期為弱熒光,晚期呈云霧狀強熒光,無明顯熒光素滲漏(圖1B);7 d,58%(63/109)的光凝斑出現輕度熒光素滲漏(圖1C);14 d,72%(78/108)的光凝斑出現大片圓盤狀熒光素滲漏(圖1D);21 d,79%(85/107)的光凝斑熒光素滲漏達最高峰(圖1E);28 d,75 %(81/108)的光凝斑熒光素滲漏無明顯增加(圖1F)。
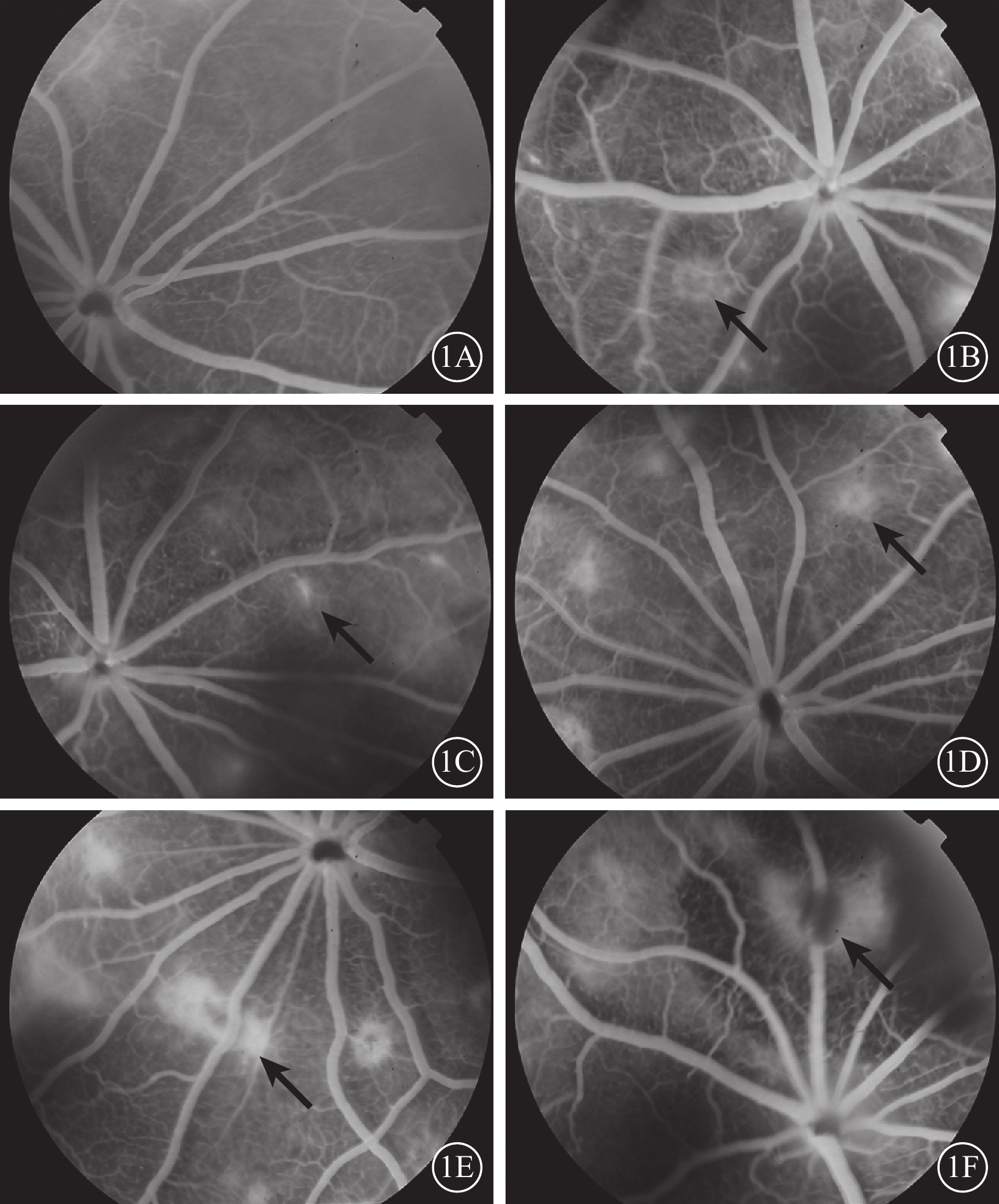 圖1
空白對照組和模型組大鼠光凝后不同時間點FFA像。1A. 空白對照組,視網膜血管熒光充盈良好,血管結構清晰;1B. 光凝后3 d,隱約可見光凝部位類圓形熒光素滲漏(黑箭);1C. 光凝后7 d,可見圓盤狀熒光素滲漏(黑箭),較光凝后3 d強度增加;1D. 光凝后14 d,出現多處圓盤狀熒光素滲漏(黑箭);1E. 光凝后21 d,有熒光素滲漏的光凝斑(黑箭)較前增多;1F. 光凝后28 d,熒光素滲漏較前穩定,無明顯變化(黑箭)
圖1
空白對照組和模型組大鼠光凝后不同時間點FFA像。1A. 空白對照組,視網膜血管熒光充盈良好,血管結構清晰;1B. 光凝后3 d,隱約可見光凝部位類圓形熒光素滲漏(黑箭);1C. 光凝后7 d,可見圓盤狀熒光素滲漏(黑箭),較光凝后3 d強度增加;1D. 光凝后14 d,出現多處圓盤狀熒光素滲漏(黑箭);1E. 光凝后21 d,有熒光素滲漏的光凝斑(黑箭)較前增多;1F. 光凝后28 d,熒光素滲漏較前穩定,無明顯變化(黑箭)
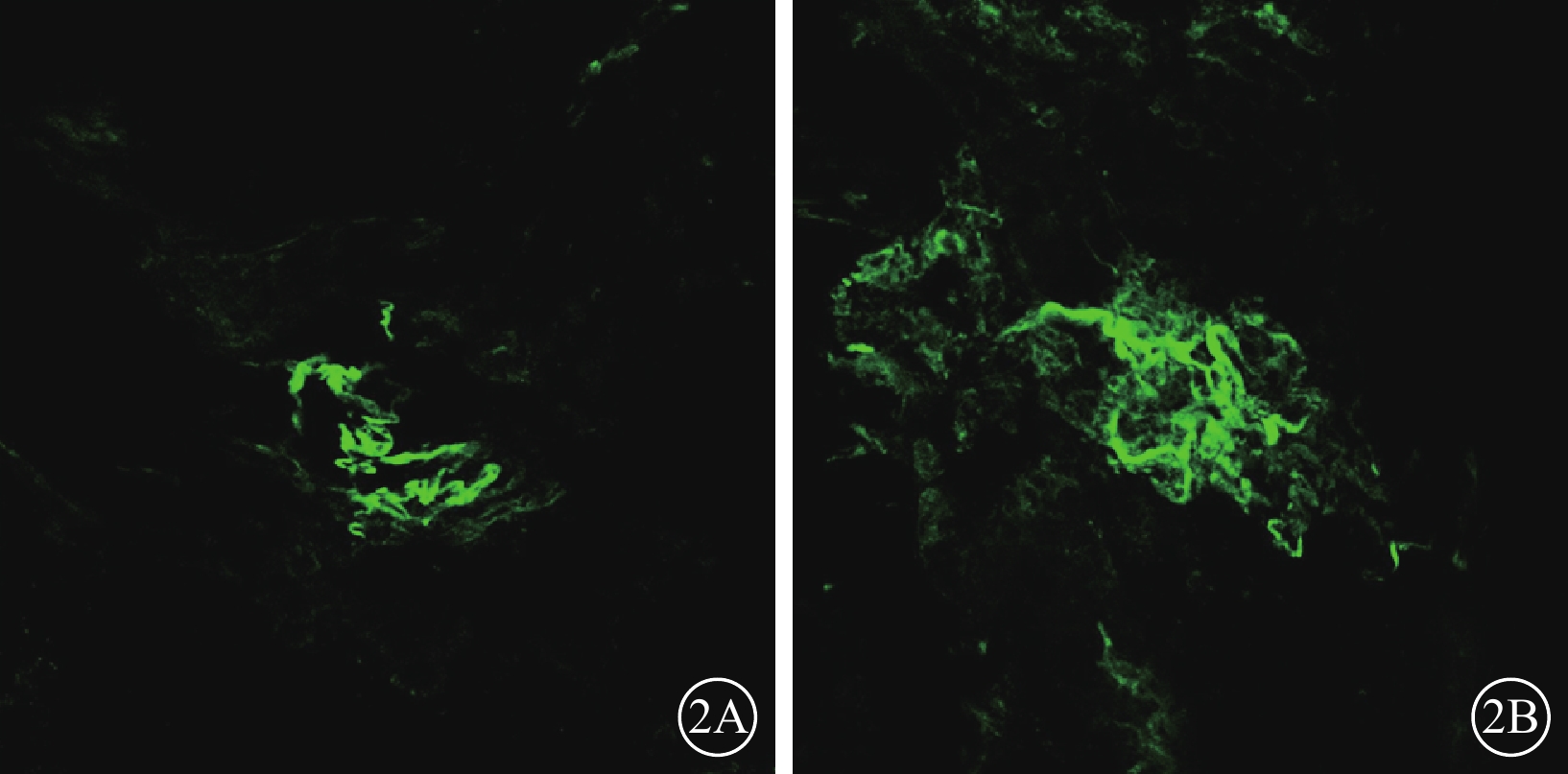
激光共聚焦顯微鏡觀察發現,光凝后7 d,光凝斑周圍可見CNV生長;14 d時,CNV明顯增加(圖2A);21 d,可見CNV面積延伸并擴大,如花朵樣從底部向上擴張,呈寬闊的扁平血管網(圖2B);28 d,形成較穩定的新生血管網。光凝后3、7、14、21、28 d,CNV面積分別為(11.54±4.12)、(26.57±1.82)、(35.47±2.77)、(36.03±4.02)×103 μm2。與光凝后7 d時CNV面積比較,光凝后14、21、28 d時CNV面積增加,差異均有統計學意義(t=3.725、5.532、3.605,P<0.05);光凝后14、21、28 d之間CNV面積比較,差異均無統計學意義(P>0.05)。
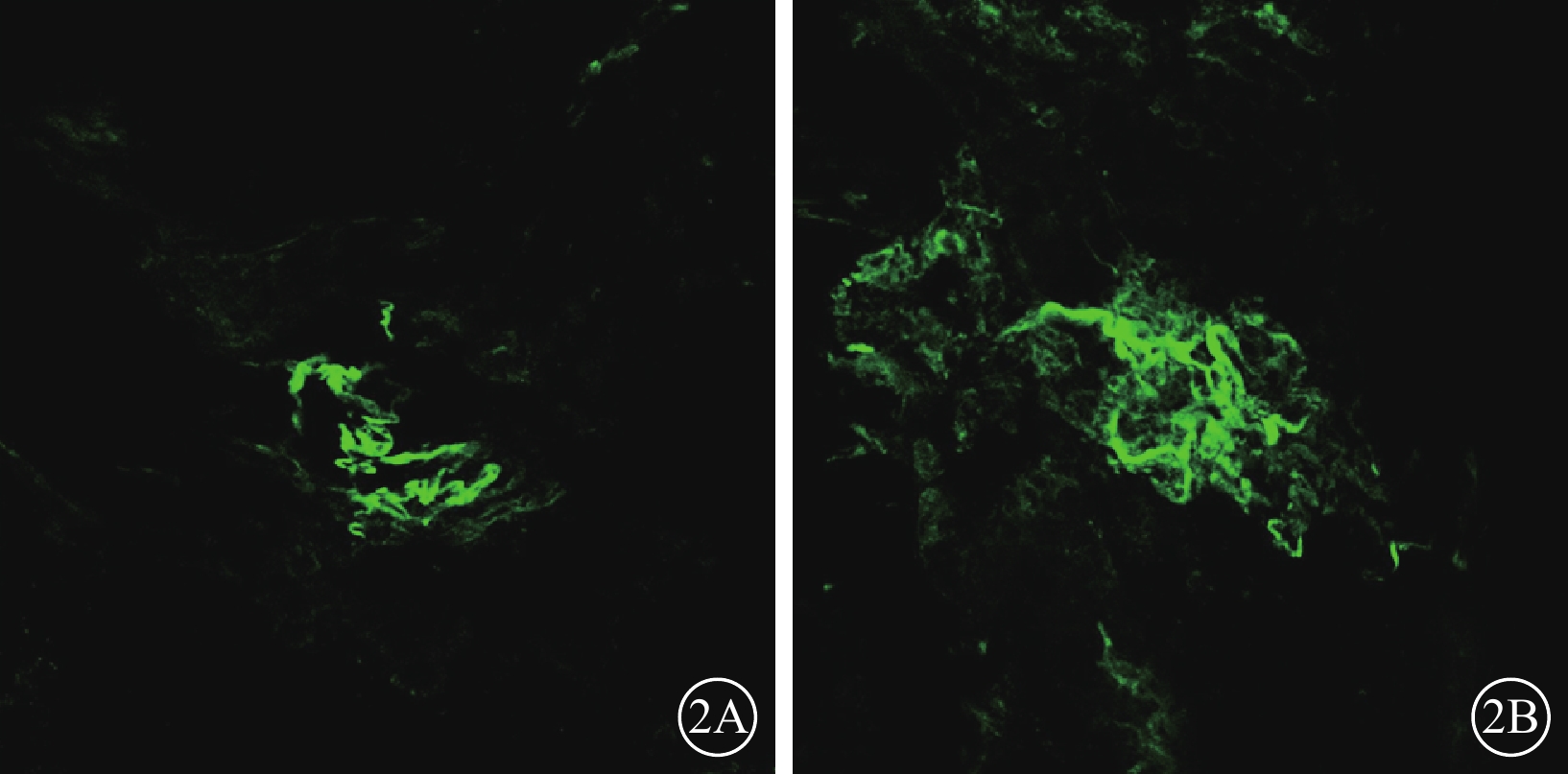 圖2
模型組大鼠光凝后14、21 d CNV激光共聚集顯微鏡像。2A:光凝后14 d,CNV表現為不規則形態的強熒光微血管網;2B. 光凝后21 d,CNV面積較光凝后14 d顯著增大 ×100
圖2
模型組大鼠光凝后14、21 d CNV激光共聚集顯微鏡像。2A:光凝后14 d,CNV表現為不規則形態的強熒光微血管網;2B. 光凝后21 d,CNV面積較光凝后14 d顯著增大 ×100
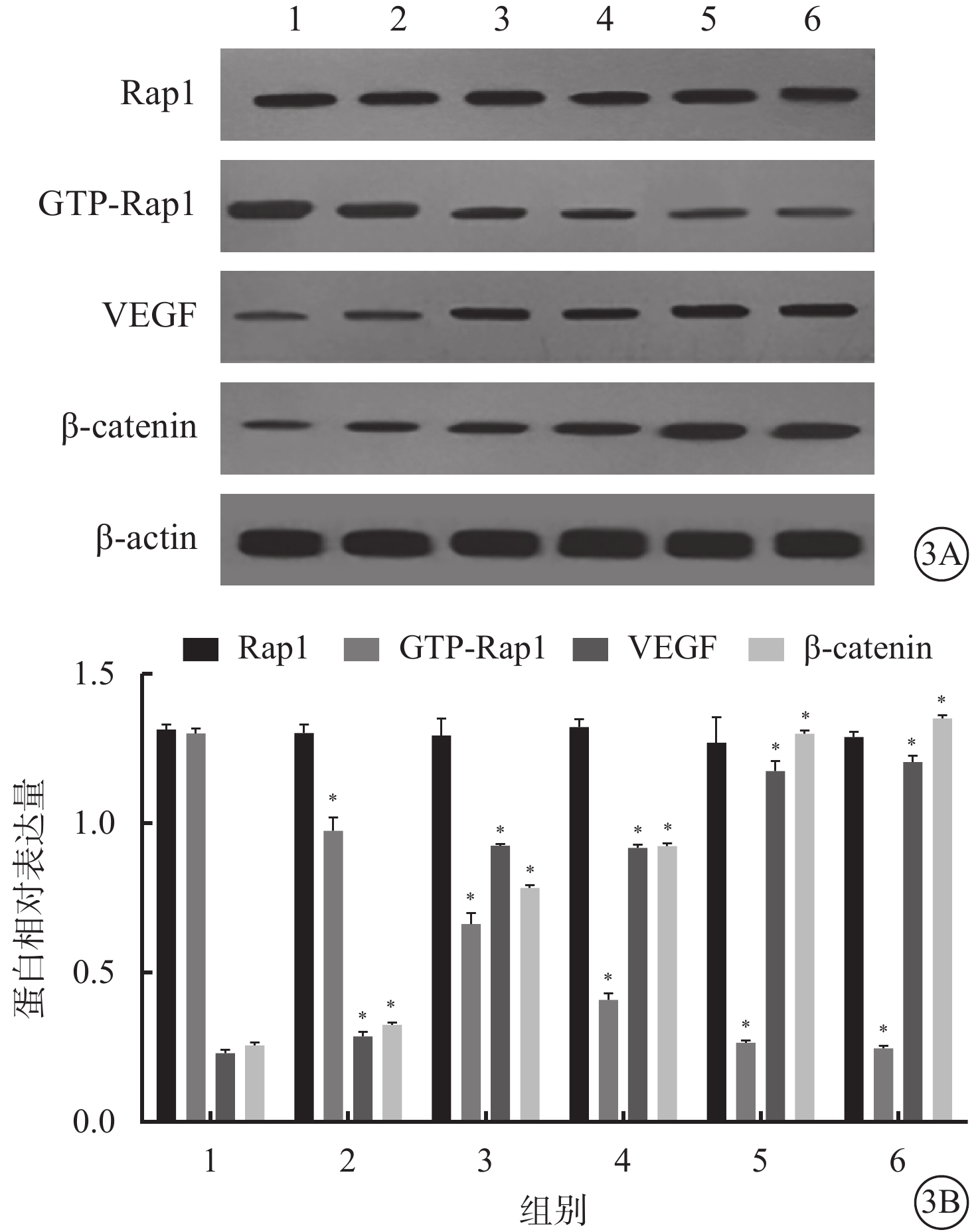
Western blot檢測結果顯示,與空白對照組比較,光凝后3、7、14、21、28 d,CNV中Rap1蛋白相對表達量差異均無統計學意義(P=0.645);GTP-Rap1蛋白相對表達量顯著降低,差異有統計學意義(P=0.000),且不同時間點呈下降趨勢;VEGF蛋白相對表達量顯著升高,差異有統計學意義(P=0.000),且于光凝后7、14 d明顯升高,21 d達到峰值,28 d無顯著變化;β-catenin蛋白相對表達量明顯增高,差異有統計學意義(P=0.000)(圖3)。
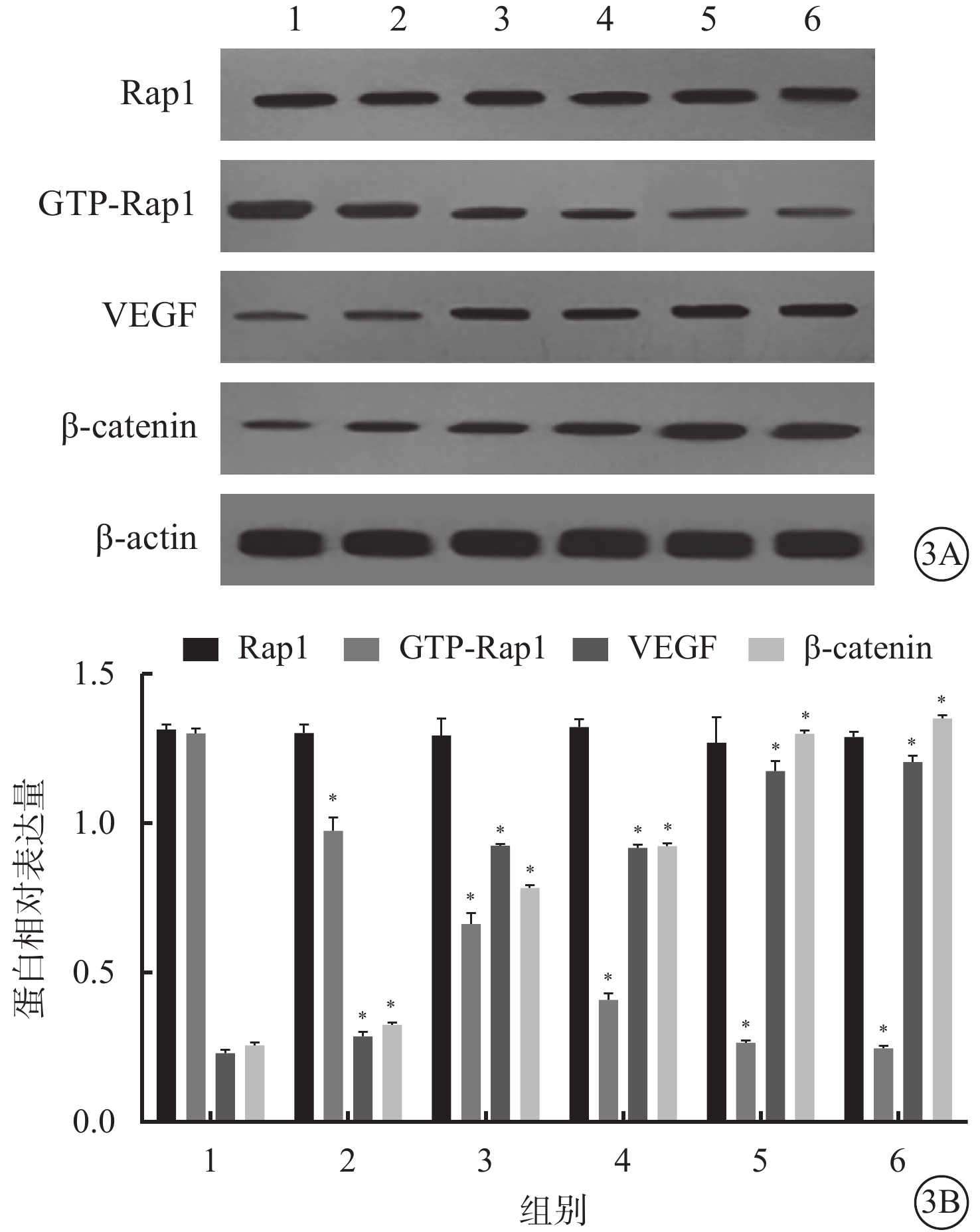 圖3
空白對照組和模型組大鼠光凝后不同時間CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達情況。3A.電泳圖;3B.分別為CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達結果。1.空白對照組;2~6. 分別為模型組大鼠光凝后3、7、14、21、28 d。*P<0.05
圖3
空白對照組和模型組大鼠光凝后不同時間CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達情況。3A.電泳圖;3B.分別為CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達結果。1.空白對照組;2~6. 分別為模型組大鼠光凝后3、7、14、21、28 d。*P<0.05
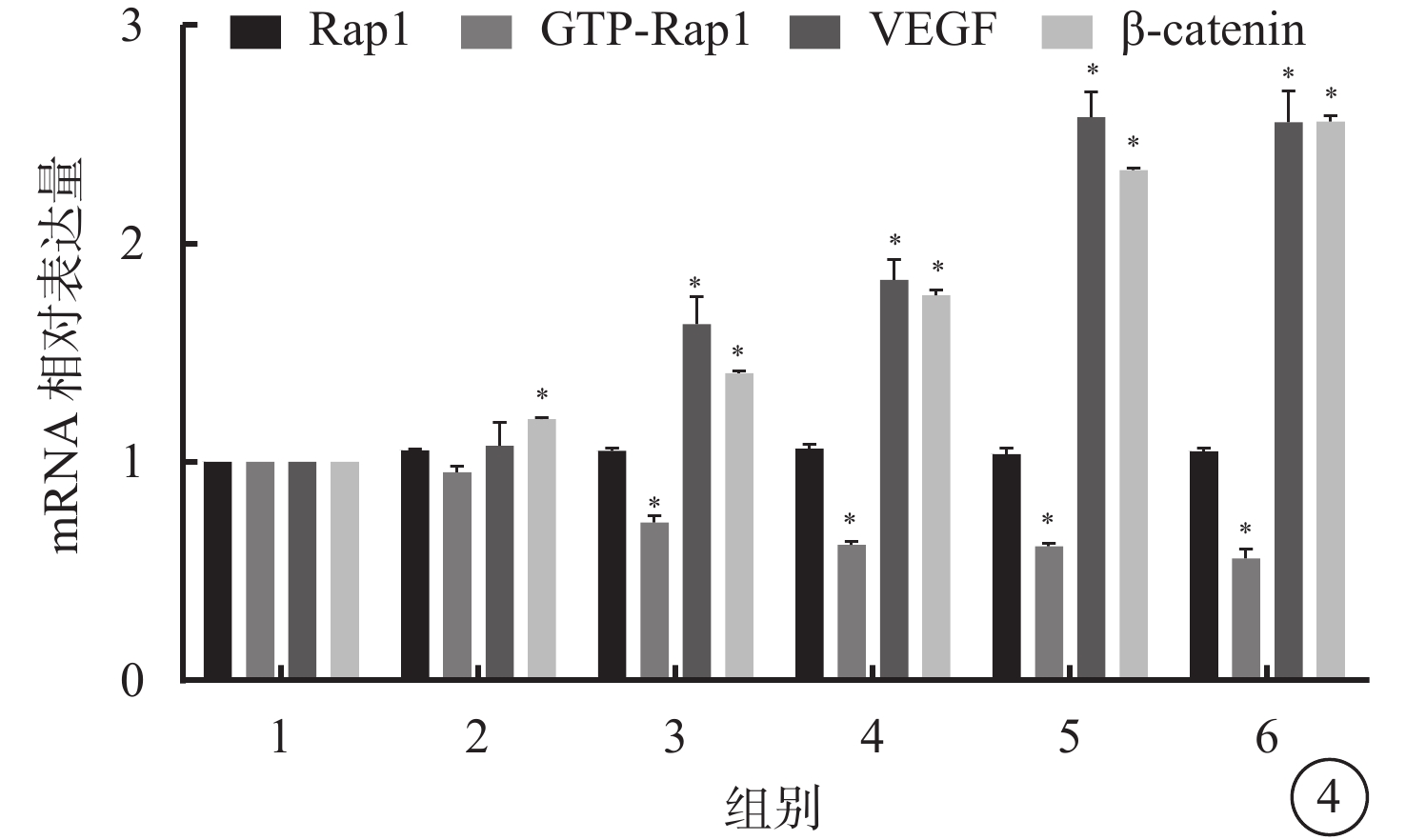
RT-PCR檢測結果顯示,與空白對照組比較,光凝后3、7、14、21、28 d,CNV中Rap1 mRNA相對表達量差異無統計學意義(P=0.156);β-catenin mRNA相對表達量差異均有統計學意義(P=0.000)。7、14、21、28 d,GTP-Rap1、VEGF mRNA相對表達量差異均有統計學意義(P=0.000);3 d,差異無統計學意義(P=0.000)(圖4)。
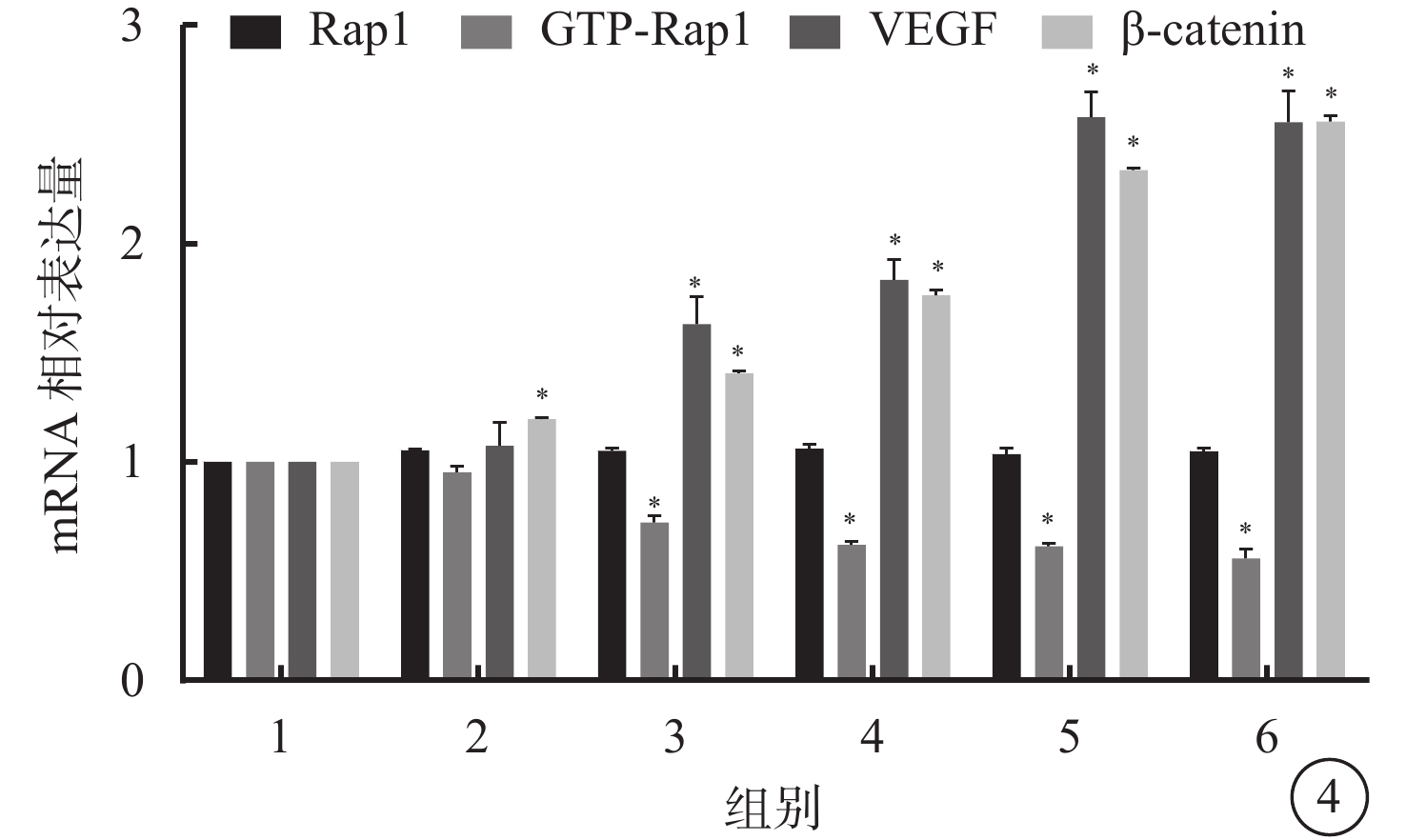 圖4
空白對照組和模型組大鼠光凝后不同時間點CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA表達結果。1.空白對照組;2~6.分別為模型組光凝后3、7、14、21、28 d。*P<0.05
圖4
空白對照組和模型組大鼠光凝后不同時間點CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA表達結果。1.空白對照組;2~6.分別為模型組光凝后3、7、14、21、28 d。*P<0.05
3 討論
CNV是因新生血管管壁結構異常,導致血管滲漏、出血而引起的繼發性病理改變[3, 4]。CNV形成是老年性黃斑變性(AMD)的主要病理特征。研究發現,AMD、糖尿病視網膜病變等均可導致RPE損傷及失代償[5]。RPE細胞間的緊密連接與粘附連接,使RPE有效阻止了視網膜與脈絡膜之間某些物質的自由轉換,起到分子“開關”的作用。增強RPE屏障完整性,可降低血管通透性,抑制脈絡膜內皮細胞遷移[6]。但在CNV發病機制研究中,如何增強RPE屏障完整性的報道甚少。
研究發現,屬于Ras超家族的小分子G蛋白Rap1,對細胞運動和連接形成具有重要調節作用,可參與調節上皮細胞間和內皮細胞間緊密連接與粘附連接形成,從而影響屏障功能的完整性[1]。小分子G蛋白能在與GTP結合的活化形式和與鳥苷二磷酸結合的非活化形式之間快速轉變,影響Actin細胞骨架重塑,參與調節細胞連接,進而對屏障功能的完整性起到快速微調作用[7, 8],即Rap1參與調節上皮細胞和內皮細胞緊密連接與粘附連接的形成,并對屏障功能的維持具有一定作用。
RBCC的完整性在CNV的形成發展中起到重要作用,并且Rap1對屏障功能的完整性具有干預作用,Rap1與CNV的發生發展的相關性研究尚少。本研究結果顯示,光凝后不同時間點模型組大鼠CNV中Rap1表達與空白對照組比較,差異均無統計學意義;而GTP-Rap1表達較空白對照組減少,VEGF表達增多。結果說明,Rap1的活性與RPE屏障完整性、VEGF表達以及CNV形成之間密切相關。同時,Rap1在CNV發生發展過程中具體的作用機制仍需進一步深入研究。
RPE細胞間的粘附連接決定RPE屏障的變化,屬于上皮細胞的粘附連接[9-12]。RPE屏障完整性發生破壞時,粘附連接受損,相應的抑制束縛瓦解,使得β-catenin成為游離分子后被其他的復合體磷酸化,最終在細胞核表達[13]。因此,隨著CNV的發生發展,β-catenin的表達量呈上升趨勢。
β-catenin作為Wnt/β-catenin信號通路的關鍵分子,其核轉位必然影響Wnt信號通路。β-catenin信號通路在細胞的增生、分化、凋亡、遷移中發揮重要調控作用,參與炎癥、血管新生、纖維化及癌癥等多種生理及病理過程[14-18]。本研究結果顯示,光凝后不同時間,模型組大鼠CNV中β-catenin的表達水平均較空白對照組明顯升高。激光誘導的CNV使Bruch破裂進而RPE屏障功能破壞,細胞間粘附連接隨之受損,繼而引起E-cadherin的表達缺失,β-catenin被釋放,表達含量增多。同時,實驗性CNV中RPE細胞的Wnt/β-catenin信號通路呈現出異常激活的狀態,β-catenin的表達必然增多,上調炎癥、氧化應激因子以及促血管因子的表達,誘導CNV的發生[19]。
Rap1具有兩種亞型Rap1A和Rap1B,兩者具有90%的同源性,雖然分別位于不同的染色體上,卻只有9個氨基酸組成不同[20]。本研究觀察到活化的Rap1與CNV形成密切相關,但是Rap1兩種亞型的具體作用并不清楚。體外研究利用短發夾RNA分別使RPE細胞的Rap1A和Rap1B基因沉默,發現與Rap1B沉默相比,抑制Rap1A更能使RPE單層細胞間隙增寬,說明Rap1A亞型對于保持穩定狀態下細胞間連接及屏障功能的完整性更為重要[4]。Adijanto等[21]運用鈣開關實驗誘導屏障的動態變化,發現Rap1B主要負責動態應答,對細胞連接的瓦解后重組具有更重要的作用,可以推測在RPE屏障受損時,Rap1B在CEC穿過RPE層入侵到視網膜神經感覺層中發揮關鍵的調控作用。另外,Wang等[22]發現在體外培養RPE細胞中,通過不同機制激活各個亞型有助于維持RPE屏障完整性。Rap1A限制了RPE細胞連接的分解,而Rap1B促進了RPE細胞連接的重組。Rap1A可破壞RPE細胞附著的連接復合體,并與還原型輔酶Ⅱ(NADPH)氧化酶亞基P22phox相互作用阻止NADPH氧化酶的活化,從而減少活性氧的產生。總之,在激光誘導的CNV模型中RPE屏障受到損害,靶向恢復RPE屏障的完整性治療CNV需要促進RPE細胞間連接重組。而活化的Rap1抑制實驗性CNV形成過程中是否主要依賴于Rap1B起主要作用,并且RAP1A跟Rap1B的效應機制如何,仍需后續研究進一步深入探究。
血管生成抑制劑包括阻斷VEGF活性是治療CNV的有效方法。但VEGF同時也是神經保護劑和內皮細胞的存活因子,在抑制CNV形成的同時,也會影響其有利作用的發揮。本研究觀察了Rap1、GTP-Rap1、VEGF和β-catenin在實驗性CNV中的表達,發現GTP-Rap1與CNV發生發展密切相關。為今后以Rap1為靶向鞏固RPE屏障的完整性提供研究基礎,為CNV臨床治療提供新思路。但GTP-Rap1抑制CNV發生發展的作用機制以及聯合VEGF抑制劑作用于實驗性CNV,是否可以起到事半功倍的效果,需要在后續的工作中研究闡述。
脈絡膜新生血管(CNV)的形成離不開脈絡膜毛細血管內皮細胞(CEC)的活化、Bruch膜的破壞與視網膜色素上皮(RPE)層的遷移。因此,RPE-Bruch膜-脈絡膜毛細血管復合體(RBCC)的完整性在CNV的形成發展中起至關重要的作用。研究發現,Ras超家族的小分子G蛋白Rap1,不僅可調節整合素介導的細胞基質黏附及細胞遷移,還對細胞間連接的完整性具有重要作用,Rap1可參與調節上皮細胞和內皮細胞間緊密連接與粘附連接的形成,一定程度上影響屏障功能的完整性[1]。因此,我們推斷Rap1對屏障功能的維持可能具有協調作用。本研究通過觀察激光誘導的CNV中Rap1及相關因子的表達情況,探討Rap1及相關因子與CNV發生發展的相關性。
1 材料和方法
健康雄性棕色挪威大鼠42只,8~10周齡,體重200~220 g,購自北京維通利華試驗動物技術有限公司,于河北醫科大學第二醫院動物實驗中心正常飼養。實驗動物的管理和使用符合國家科學技術委員會頒布的《實驗動物管理條例》,并取得河北醫科大學第二醫院科研倫理委員會許可。大鼠眼部經裂隙燈顯微鏡和檢眼鏡檢查屈光間質清晰,眼底無病變。
隨機數字表法將大鼠分為空白對照組和模型組,分別7、35只大鼠;均雙眼入組。模型組大鼠激光光凝誘導CNV形成,建立動物模型。按體重0.35 ml/100 g的劑量腹腔注射10%水合氯醛麻醉大鼠,鹽酸丙美卡因滴眼液眼表麻醉,1.5 cm×3.0 cm載玻片作為角膜接觸鏡,采用Coherent Novus-Omni氪離子激光機(美國Coherent公司)進行激光光凝。激光參數:波長647 nm,光斑直徑50 μm,功率260 mW,曝光時間0.05 s,距視盤2~3個視盤直徑均勻光凝9~10個點,以氣泡產生或伴有輕度出血為擊破Bruch膜的標志[2],記為有效光凝斑。空白對照組以及模型組大鼠光凝后3、7、14、21、28 d,隨機數字表法隨機選取2只大鼠行熒光素眼底血管造影(FFA)檢查。5%水合氯醛充分麻醉,復方托吡卡胺滴眼液散瞳,按體重0.5 ml/kg的劑量腹腔注射10%熒光素鈉,注射后立即行FFA檢查,同步動態觀察大鼠模型CNV的形成情況。以出現CNV光凝斑數量與光凝斑總數的比值(百分率)作為該時間段CNV發生率。
光凝后3、7、14、21、28 d,模型組大鼠隨機數字表法隨機選取2只大鼠行脈絡膜鋪片,測量CNV面積。麻醉同前并固定大鼠,經雙側頸總動脈注射異硫氰酸熒光素-右旋糖酐(相對分子質量2×106,美國Sigma公司)磷酸鹽緩沖液(PBS)1 ml。摘除眼球,置于固定液中固定1 h,沖洗后放入PBS,解剖顯微鏡下去除眼前節,仔細剝除視網膜神經層,以視盤為中心,行4~5條放射狀切口,將獲得的RPE-脈絡膜-鞏膜復合體平鋪于蓋玻片上,滴少量甘油封片。激光共聚焦顯微鏡對CNV進行觀察和測量。
蛋白免疫印跡法(Western blot)檢測CNV中Rap1、鳥苷三磷酸(GTP)-Rap1、VEGF、β-連環蛋白(catenin)蛋白表達。光凝后3、7、14、21、28 d,隨機數字表法隨機選取空白對照組和模型組大鼠2只,摘除眼球,分離RPE-脈絡膜-鞏膜復合體。取CNV病變區域20 mg組織加入200~400 μl裂解液,提取總蛋白,Bradford法測定樣本蛋白含量。制備十二烷基硫酸鈉聚丙烯酰胺凝膠電泳膠分離蛋白,隨后將蛋白質轉移至甲醇激活的聚偏氟乙烯膜,室溫封閉 1 h,一抗4 ℃反應過夜,1倍洗膜緩沖液(TBST)洗滌3次,10 min/次,將洗滌后的一抗反應膜放入二抗工作液(1:3000)中,室溫避光緩慢搖動作用60 min,1倍TBST洗膜,進行化學發光反應、顯影及定影。以等量β-肌動蛋白(actin)作為對照,將膠片進行掃描。重復4次,Image J軟件分析灰度值。
實時熒光定量聚合酶鏈反應(RT- PCR) 檢測CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA的表達。處死空白對照組、模型組各剩余大鼠3只,超純RNA提取試劑盒(CWbio.Co.Ltd,Cat#CW0581)提取視網膜、脈絡膜總RNA,5 μl RNA 1%瓊脂糖凝膠進行電泳,檢測RNA完整性。HiFi-MMLVcDNA第一鏈合成試劑盒(Cat#CW0744)進行逆轉錄,65 ℃孵育5 min,冰浴2 min,離心。加入5倍逆轉錄緩沖液4 μl、0.1 mol/L二硫蘇糖醇2 μl、10.0 mmol/L脫氧核糖核苷三磷酸1 μl、HiFi-MMLV酶混合物1 μl,混勻,37 ℃孵育50 min,70 ℃保溫10 min,?20 ℃冰箱保存。應用Primer5.0軟件設計引物(表1)。反應條件:95 ℃預變性10 min;95 ℃變性15 s;60 ℃退火60 s。重復40個循環后形成擴增曲線,記錄循環閾值(Ct值),以磷酸甘油醛脫氫酶(GAPDH)為內參基因,采用2?ΔΔCt法計算目的基因mRNA相對表達量。
采用SPSS19.0軟件進行統計分析。數據進行正態性和方差齊性檢驗,符合正態分布和方差齊性時采用單因素方差分析,兩兩比較采用最小顯著差法檢驗;方差不齊時,采用非參數軼和檢驗。P<0.05為差異有統計學意義。
2 結果
FFA檢查結果顯示,空白對照組大鼠視網膜血管熒光充盈良好,血管結構清晰(圖1A)。模型組大鼠光凝后3 d,13%(14/109)的光凝斑早期為弱熒光,晚期呈云霧狀強熒光,無明顯熒光素滲漏(圖1B);7 d,58%(63/109)的光凝斑出現輕度熒光素滲漏(圖1C);14 d,72%(78/108)的光凝斑出現大片圓盤狀熒光素滲漏(圖1D);21 d,79%(85/107)的光凝斑熒光素滲漏達最高峰(圖1E);28 d,75 %(81/108)的光凝斑熒光素滲漏無明顯增加(圖1F)。
 圖1
空白對照組和模型組大鼠光凝后不同時間點FFA像。1A. 空白對照組,視網膜血管熒光充盈良好,血管結構清晰;1B. 光凝后3 d,隱約可見光凝部位類圓形熒光素滲漏(黑箭);1C. 光凝后7 d,可見圓盤狀熒光素滲漏(黑箭),較光凝后3 d強度增加;1D. 光凝后14 d,出現多處圓盤狀熒光素滲漏(黑箭);1E. 光凝后21 d,有熒光素滲漏的光凝斑(黑箭)較前增多;1F. 光凝后28 d,熒光素滲漏較前穩定,無明顯變化(黑箭)
圖1
空白對照組和模型組大鼠光凝后不同時間點FFA像。1A. 空白對照組,視網膜血管熒光充盈良好,血管結構清晰;1B. 光凝后3 d,隱約可見光凝部位類圓形熒光素滲漏(黑箭);1C. 光凝后7 d,可見圓盤狀熒光素滲漏(黑箭),較光凝后3 d強度增加;1D. 光凝后14 d,出現多處圓盤狀熒光素滲漏(黑箭);1E. 光凝后21 d,有熒光素滲漏的光凝斑(黑箭)較前增多;1F. 光凝后28 d,熒光素滲漏較前穩定,無明顯變化(黑箭)
激光共聚焦顯微鏡觀察發現,光凝后7 d,光凝斑周圍可見CNV生長;14 d時,CNV明顯增加(圖2A);21 d,可見CNV面積延伸并擴大,如花朵樣從底部向上擴張,呈寬闊的扁平血管網(圖2B);28 d,形成較穩定的新生血管網。光凝后3、7、14、21、28 d,CNV面積分別為(11.54±4.12)、(26.57±1.82)、(35.47±2.77)、(36.03±4.02)×103 μm2。與光凝后7 d時CNV面積比較,光凝后14、21、28 d時CNV面積增加,差異均有統計學意義(t=3.725、5.532、3.605,P<0.05);光凝后14、21、28 d之間CNV面積比較,差異均無統計學意義(P>0.05)。
 圖2
模型組大鼠光凝后14、21 d CNV激光共聚集顯微鏡像。2A:光凝后14 d,CNV表現為不規則形態的強熒光微血管網;2B. 光凝后21 d,CNV面積較光凝后14 d顯著增大 ×100
圖2
模型組大鼠光凝后14、21 d CNV激光共聚集顯微鏡像。2A:光凝后14 d,CNV表現為不規則形態的強熒光微血管網;2B. 光凝后21 d,CNV面積較光凝后14 d顯著增大 ×100
Western blot檢測結果顯示,與空白對照組比較,光凝后3、7、14、21、28 d,CNV中Rap1蛋白相對表達量差異均無統計學意義(P=0.645);GTP-Rap1蛋白相對表達量顯著降低,差異有統計學意義(P=0.000),且不同時間點呈下降趨勢;VEGF蛋白相對表達量顯著升高,差異有統計學意義(P=0.000),且于光凝后7、14 d明顯升高,21 d達到峰值,28 d無顯著變化;β-catenin蛋白相對表達量明顯增高,差異有統計學意義(P=0.000)(圖3)。
 圖3
空白對照組和模型組大鼠光凝后不同時間CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達情況。3A.電泳圖;3B.分別為CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達結果。1.空白對照組;2~6. 分別為模型組大鼠光凝后3、7、14、21、28 d。*P<0.05
圖3
空白對照組和模型組大鼠光凝后不同時間CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達情況。3A.電泳圖;3B.分別為CNV中Rap1、GTP-Rap1、VEGF、β-catenin蛋白表達結果。1.空白對照組;2~6. 分別為模型組大鼠光凝后3、7、14、21、28 d。*P<0.05
RT-PCR檢測結果顯示,與空白對照組比較,光凝后3、7、14、21、28 d,CNV中Rap1 mRNA相對表達量差異無統計學意義(P=0.156);β-catenin mRNA相對表達量差異均有統計學意義(P=0.000)。7、14、21、28 d,GTP-Rap1、VEGF mRNA相對表達量差異均有統計學意義(P=0.000);3 d,差異無統計學意義(P=0.000)(圖4)。
 圖4
空白對照組和模型組大鼠光凝后不同時間點CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA表達結果。1.空白對照組;2~6.分別為模型組光凝后3、7、14、21、28 d。*P<0.05
圖4
空白對照組和模型組大鼠光凝后不同時間點CNV中Rap1、GTP-Rap1、VEGF、β-catenin mRNA表達結果。1.空白對照組;2~6.分別為模型組光凝后3、7、14、21、28 d。*P<0.05
3 討論
CNV是因新生血管管壁結構異常,導致血管滲漏、出血而引起的繼發性病理改變[3, 4]。CNV形成是老年性黃斑變性(AMD)的主要病理特征。研究發現,AMD、糖尿病視網膜病變等均可導致RPE損傷及失代償[5]。RPE細胞間的緊密連接與粘附連接,使RPE有效阻止了視網膜與脈絡膜之間某些物質的自由轉換,起到分子“開關”的作用。增強RPE屏障完整性,可降低血管通透性,抑制脈絡膜內皮細胞遷移[6]。但在CNV發病機制研究中,如何增強RPE屏障完整性的報道甚少。
研究發現,屬于Ras超家族的小分子G蛋白Rap1,對細胞運動和連接形成具有重要調節作用,可參與調節上皮細胞間和內皮細胞間緊密連接與粘附連接形成,從而影響屏障功能的完整性[1]。小分子G蛋白能在與GTP結合的活化形式和與鳥苷二磷酸結合的非活化形式之間快速轉變,影響Actin細胞骨架重塑,參與調節細胞連接,進而對屏障功能的完整性起到快速微調作用[7, 8],即Rap1參與調節上皮細胞和內皮細胞緊密連接與粘附連接的形成,并對屏障功能的維持具有一定作用。
RBCC的完整性在CNV的形成發展中起到重要作用,并且Rap1對屏障功能的完整性具有干預作用,Rap1與CNV的發生發展的相關性研究尚少。本研究結果顯示,光凝后不同時間點模型組大鼠CNV中Rap1表達與空白對照組比較,差異均無統計學意義;而GTP-Rap1表達較空白對照組減少,VEGF表達增多。結果說明,Rap1的活性與RPE屏障完整性、VEGF表達以及CNV形成之間密切相關。同時,Rap1在CNV發生發展過程中具體的作用機制仍需進一步深入研究。
RPE細胞間的粘附連接決定RPE屏障的變化,屬于上皮細胞的粘附連接[9-12]。RPE屏障完整性發生破壞時,粘附連接受損,相應的抑制束縛瓦解,使得β-catenin成為游離分子后被其他的復合體磷酸化,最終在細胞核表達[13]。因此,隨著CNV的發生發展,β-catenin的表達量呈上升趨勢。
β-catenin作為Wnt/β-catenin信號通路的關鍵分子,其核轉位必然影響Wnt信號通路。β-catenin信號通路在細胞的增生、分化、凋亡、遷移中發揮重要調控作用,參與炎癥、血管新生、纖維化及癌癥等多種生理及病理過程[14-18]。本研究結果顯示,光凝后不同時間,模型組大鼠CNV中β-catenin的表達水平均較空白對照組明顯升高。激光誘導的CNV使Bruch破裂進而RPE屏障功能破壞,細胞間粘附連接隨之受損,繼而引起E-cadherin的表達缺失,β-catenin被釋放,表達含量增多。同時,實驗性CNV中RPE細胞的Wnt/β-catenin信號通路呈現出異常激活的狀態,β-catenin的表達必然增多,上調炎癥、氧化應激因子以及促血管因子的表達,誘導CNV的發生[19]。
Rap1具有兩種亞型Rap1A和Rap1B,兩者具有90%的同源性,雖然分別位于不同的染色體上,卻只有9個氨基酸組成不同[20]。本研究觀察到活化的Rap1與CNV形成密切相關,但是Rap1兩種亞型的具體作用并不清楚。體外研究利用短發夾RNA分別使RPE細胞的Rap1A和Rap1B基因沉默,發現與Rap1B沉默相比,抑制Rap1A更能使RPE單層細胞間隙增寬,說明Rap1A亞型對于保持穩定狀態下細胞間連接及屏障功能的完整性更為重要[4]。Adijanto等[21]運用鈣開關實驗誘導屏障的動態變化,發現Rap1B主要負責動態應答,對細胞連接的瓦解后重組具有更重要的作用,可以推測在RPE屏障受損時,Rap1B在CEC穿過RPE層入侵到視網膜神經感覺層中發揮關鍵的調控作用。另外,Wang等[22]發現在體外培養RPE細胞中,通過不同機制激活各個亞型有助于維持RPE屏障完整性。Rap1A限制了RPE細胞連接的分解,而Rap1B促進了RPE細胞連接的重組。Rap1A可破壞RPE細胞附著的連接復合體,并與還原型輔酶Ⅱ(NADPH)氧化酶亞基P22phox相互作用阻止NADPH氧化酶的活化,從而減少活性氧的產生。總之,在激光誘導的CNV模型中RPE屏障受到損害,靶向恢復RPE屏障的完整性治療CNV需要促進RPE細胞間連接重組。而活化的Rap1抑制實驗性CNV形成過程中是否主要依賴于Rap1B起主要作用,并且RAP1A跟Rap1B的效應機制如何,仍需后續研究進一步深入探究。
血管生成抑制劑包括阻斷VEGF活性是治療CNV的有效方法。但VEGF同時也是神經保護劑和內皮細胞的存活因子,在抑制CNV形成的同時,也會影響其有利作用的發揮。本研究觀察了Rap1、GTP-Rap1、VEGF和β-catenin在實驗性CNV中的表達,發現GTP-Rap1與CNV發生發展密切相關。為今后以Rap1為靶向鞏固RPE屏障的完整性提供研究基礎,為CNV臨床治療提供新思路。但GTP-Rap1抑制CNV發生發展的作用機制以及聯合VEGF抑制劑作用于實驗性CNV,是否可以起到事半功倍的效果,需要在后續的工作中研究闡述。