引用本文: 孟凡超, 孫世龍, 蘇建, 石佩玉, 周偉民, 王書香, 楚金亭. 髓樣細胞表達觸發受體在缺血性視神經病變中的表達. 中華眼底病雜志, 2018, 34(5): 471-474. doi: 10.3760/cma.j.issn.1005-1015.2018.05.012 復制
髓樣細胞表達觸發受體(TREM)是免疫球蛋白超家族成員中的一個受體家族,包括TREM-1、TREM-2、TREM-3等;已在急性炎癥、非腫瘤性炎性疾病、神經退行性疾病中得到廣泛研究[1]。TREM-1主要在單核細胞和中性粒細胞表面表達,是免疫球蛋白超家族的一類細胞表面受體。TREM-2不表達于外周血單核細胞,而主要表達于新近分化的巨噬細胞、小膠質細胞、樹突狀細胞等[2]。研究證實小膠質細胞TREM-2在缺血中具有神經保護作用。關于小膠質細胞的炎癥反應,在小鼠中編碼促炎細胞因子如白細胞介素(IL)-1b和腫瘤壞死因子(TNF)-α的基因被下調[3],表明TREM-2刺激小膠質細胞的促炎反應。既往文獻報道,神經系統中僅在小膠質細胞發現TREM-2,少突膠質細胞或其他類型的腦細胞未發現其存在[4, 5]。目前已知TREM/ DNAX激活蛋白12(DAP12)受體復合物可激活細胞外磷脂酰肌醇-3激酶、細胞外調節蛋白激酶(ERK)1/ERK2和鳥嘌呤核苷酸交換因子Vav蛋白3,以及誘導細胞內Ca2+動員、肌動蛋白(actin)細胞骨架的重排,同時也調節神經系統的凋亡[6]。為了解TREM在缺血性視神經病變中的表達及其作用,我們觀察了大鼠雙側頸內動脈結扎后視神經組織中TREM-1、TREM-2、半胱氨酸蛋白酶(Caspase-3)、IL-6的表達。現將結果報道如下。
1 材料和方法
健康Sprague Dawley大鼠20只,雌雄各半,2月齡,體重280~320 g,清潔級,河南省實驗動物中心提供。動物生產許可證:SCXK(豫)2010-0001;使用許可證:SYXK(豫)2010-0001。實驗動物的管理和使用符合國家科學技術委員會頒布的《實驗動物管理條例》。
采用數字表法隨機將大鼠分為模型組、對照組,各為10只大鼠。兩組大鼠均按40 mg/kg的劑量腹腔注射水合氯醛進行麻醉,無菌條件下頸正中切口分離肌肉和筋膜后充分暴露雙側頸內動脈,實驗組大鼠5-0的絲線結扎雙側頸內動脈,保留頸外動脈建立亞急性缺血性視神經病變動物模型。對照組大鼠只分離雙側頸總動脈,不進行結扎。建模后14 d,大鼠水合氯醛麻醉后,仰臥位固定于手術臺,剪開右心耳,以0.9%生理鹽水200 ml快速滴入,4%多聚甲醛-磷酸鹽緩沖液(PBS)灌注固定;快速斷頭取視神經于冰盤上,置于凍存管內,進行后續實驗。
實時定量熒光聚合酶鏈反應(RT-PCR)檢測模型組、對照組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達量。視神經組織勻漿,按照酚-異硫氰酸胍一步法提取各組總RNA。微量紫外分光光度計測定總RNA濃度和純度。每個標本取200 ng總RNA,按逆轉錄試劑盒說明在20 μl體系中合成cDNA。根據NCBI數據庫中的TREM-1、TREM-2、Caspase-3、IL-6以及β-actin基因序列,以Premier 5.0軟件設計引物,由上海生工生物工程公司合成(表1)。熒光定量聚合酶鏈反應(PCR)儀進行RT-PCR反應,擴增條件94 ℃預變性 3 min,94 ℃變性3 min,60 ℃退火45 s,72 ℃延伸1 min,共35個循環,最后72 ℃延伸3 min。每個樣本取10 μl產物進行瓊脂糖凝膠電泳,應用Alpha Imager圖像分析系統測定吸光度[A,舊稱光密度(OD)]值,以β-actin為內參照基因,樣本相對表達含量=樣本A值/樣本β-actin A值。
蛋白質免疫印跡法(Western blot)檢測模型組、對照組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6蛋白相對表達量。PBS沖洗視神經組織后加入RIPA裂解液冰上裂解,提取總蛋白。提取的蛋白經8%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離后,將蛋白轉移至聚偏二氟乙烯膜上,洗膜緩沖液(TBST)漂洗3次,5%脫脂奶粉封閉1 h,加入兔抗大鼠TREM-1單克隆抗體(1:1000)、兔抗大鼠TREM-2單克隆抗體(1:1000)、兔抗大鼠Caspase-3單克隆抗體(1:2000)、兔抗大鼠IL-6單克隆抗體(1:1000)和兔抗大鼠β-actin單克隆抗體(1:1000),4 ℃孵育過夜,TBST漂洗3次后加入1:2000稀釋的HRP標記羊抗兔IgG二抗,常溫孵育2 h,TBST充分洗滌后電化學發光法顯影,暗室曝光,二氨基聯苯胺(DAB)顯色并拍照。采用Image J圖像分析系統進行灰度分析,以β-actin作為內參照。
采用SPSS17.0軟件進行統計學分析。正態分布的數據以均數±標準差(
 )表示。兩組間mRNA和蛋白比較采用t檢驗。檢驗水準α=0.05,P<0.05為差異有統計學意義。
)表示。兩組間mRNA和蛋白比較采用t檢驗。檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結果
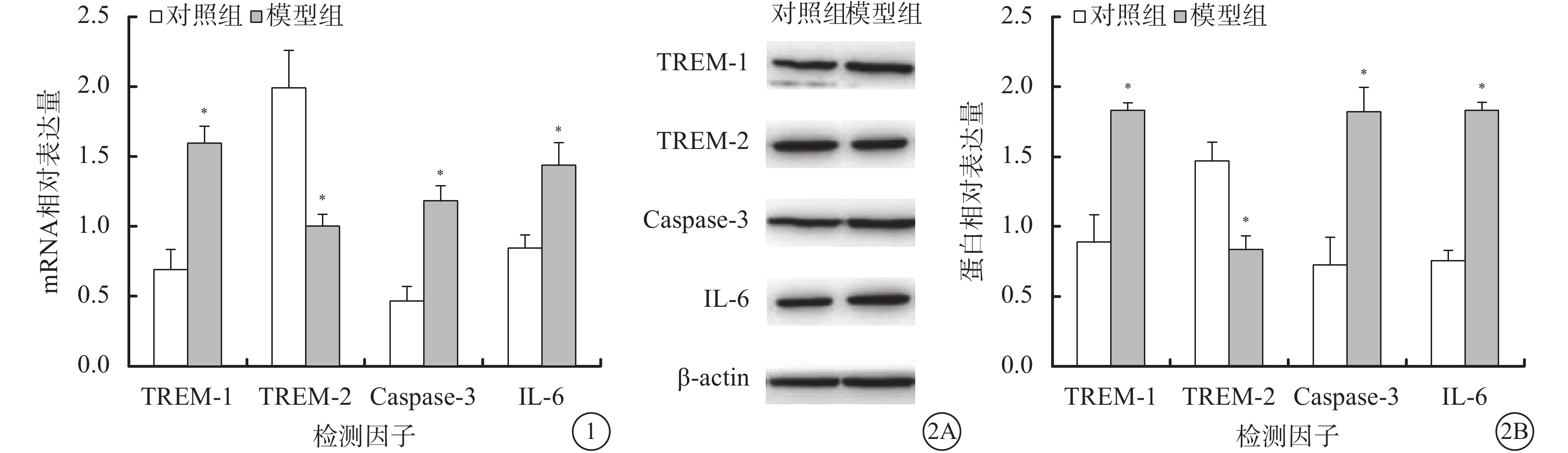
RT-PCR檢測結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1(t=6.058,P=0.037)、Caspase-3(t=7.860,P=0.001)、IL-6(t=6.055,P=0.004) mRNA表達升高,TREM-2 mRNA(t=6.992,P=0.002)表達降低,差異均有統計學意義(圖1)。
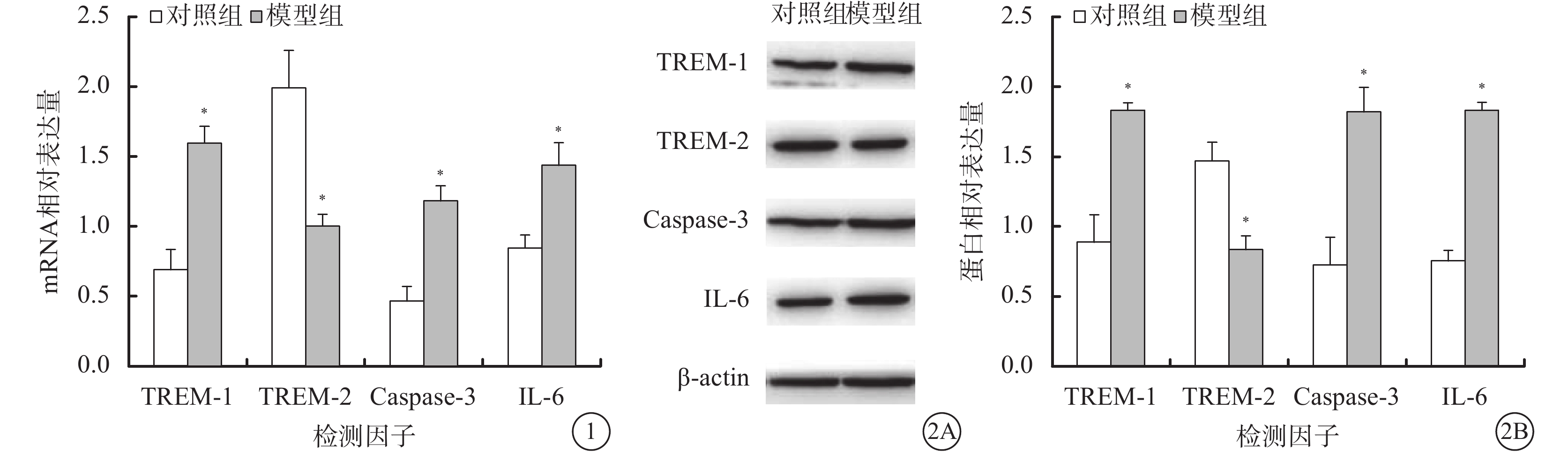 圖1
對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達含量。*與對照組比較,P<0.05 圖 2 對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 蛋白相對表達含量。2A.電泳圖;2B.兩組大鼠視神經組織中TREM-1、TRE-2、Caspase-3、IL-6蛋白表達結果。*與對照組相比,P<0.05
圖1
對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達含量。*與對照組比較,P<0.05 圖 2 對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 蛋白相對表達含量。2A.電泳圖;2B.兩組大鼠視神經組織中TREM-1、TRE-2、Caspase-3、IL-6蛋白表達結果。*與對照組相比,P<0.05
Western blot檢測結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1(t=9.671,P=0.001)、Caspase-3(t=9.524,P=0.001)、IL-6(t=14.501,P=0.000)蛋白表達升高,TREM-2(t=9.283,P=0.001)蛋白表達降低,差異均有統計學意義(圖2)。
3 討論
TREM是免疫球蛋白家族中的一個受體家族,其基因位于人染色體6p21[5, 6],是一種與激活自然殺傷細胞受體同源的IgG樣受體。有研究表明,TREM-1高度表達于嗜中性粒細胞和部分單核細胞和(或)巨噬細胞亞群[7],特別是肺泡巨噬細胞[8];TREM-2表達于不成熟的樹突狀細胞、破骨細胞和小膠質細胞表面[9]。兩者是具有相似結構[相對分子質量(25~30)×103]的跨膜糖蛋白。目前已知TREM-2基因敲除與Nasu-Hakola病即多囊脂性骨發育不良與硬化性腦白質病、神經退行性疾病、缺血性腦卒中的發病具有直接相關性。
本研究結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1、Caspase-3、IL-6 mRNA和蛋白相對表達升高,TREM-2 mRNA和蛋白相對表達降低,差異均有統計學意義。有研究結果表明,TREM-1的觸發可導致TNF-α、IL-8和單核細胞趨化蛋白1分泌增加并引發嗜中性粒細胞脫顆粒和以及髓過氧化物酶和一氧化氮的釋放[10]。TREM-1與單克隆抗體的結合刺激多種促炎細胞因子和趨化因子的產生[11, 12]。在Toll樣受體-2或Toll樣受體-4配體存在下TREM-1激活可增強促炎細胞因子(TNF、IL-1、粒細胞-巨噬細胞集落刺激因子)的產生,同時抑制IL-10的釋放[13]。TREM-2總體上具有促抗炎和促吞噬作用[3]:(1)TREM-2與配體結合后通過TREM-2/DAP12介導的信號轉導通路,激活ERK和酪氨酸蛋白激酶等,從而參與活化T細胞應答,影響小膠質細胞的自噬,是體內中樞神經系統炎癥調節的重要通路,同時EPK信號通路參與抑制脂多糖刺激后樹突狀細胞的凋亡[14];(2)巨噬細胞中TREM-2缺乏可誘導促炎癥細胞因子的產生,包括IL-6和TNF-α[15];(3)高表達TREM-2可以促進吞噬作用及減輕炎癥反應。由于TREM-1的促進炎癥反應作用以及TREM-2的抗炎作用,目前國內外研究發現TREM受體家族與風濕性疾病、膿毒血癥、多發性硬化、心肌梗死等多種疾病有關,但目前關于TREM受體家族與缺血性視神經病的關系研究較少。
本研究結果顯示,與對照組比較,模型組大鼠視神經中TREM-1、Caspase-3、IL-6 mRNA和蛋白相對表達升高,TREM-2 mRNA和蛋白相對表達降低,差異均有統計學意義。這一結果表明TREM-1及TREM-2的表達與缺血性視神經病有一定關系。在一定程度上提示TREM-1的表達及其相關炎癥因子可能會通過加重炎癥反應從而加重缺血性視神經疾病模型中視神經的損傷,TREM-2的表達可能會通過抗炎、抗凋亡作用而發揮保護作用,這為臨床治療缺血性視神經疾病提供了通過調控缺血性視神經病患者TREM受體家族的表達水平從而減輕視神經的損傷這一治療新思路。
髓樣細胞表達觸發受體(TREM)是免疫球蛋白超家族成員中的一個受體家族,包括TREM-1、TREM-2、TREM-3等;已在急性炎癥、非腫瘤性炎性疾病、神經退行性疾病中得到廣泛研究[1]。TREM-1主要在單核細胞和中性粒細胞表面表達,是免疫球蛋白超家族的一類細胞表面受體。TREM-2不表達于外周血單核細胞,而主要表達于新近分化的巨噬細胞、小膠質細胞、樹突狀細胞等[2]。研究證實小膠質細胞TREM-2在缺血中具有神經保護作用。關于小膠質細胞的炎癥反應,在小鼠中編碼促炎細胞因子如白細胞介素(IL)-1b和腫瘤壞死因子(TNF)-α的基因被下調[3],表明TREM-2刺激小膠質細胞的促炎反應。既往文獻報道,神經系統中僅在小膠質細胞發現TREM-2,少突膠質細胞或其他類型的腦細胞未發現其存在[4, 5]。目前已知TREM/ DNAX激活蛋白12(DAP12)受體復合物可激活細胞外磷脂酰肌醇-3激酶、細胞外調節蛋白激酶(ERK)1/ERK2和鳥嘌呤核苷酸交換因子Vav蛋白3,以及誘導細胞內Ca2+動員、肌動蛋白(actin)細胞骨架的重排,同時也調節神經系統的凋亡[6]。為了解TREM在缺血性視神經病變中的表達及其作用,我們觀察了大鼠雙側頸內動脈結扎后視神經組織中TREM-1、TREM-2、半胱氨酸蛋白酶(Caspase-3)、IL-6的表達。現將結果報道如下。
1 材料和方法
健康Sprague Dawley大鼠20只,雌雄各半,2月齡,體重280~320 g,清潔級,河南省實驗動物中心提供。動物生產許可證:SCXK(豫)2010-0001;使用許可證:SYXK(豫)2010-0001。實驗動物的管理和使用符合國家科學技術委員會頒布的《實驗動物管理條例》。
采用數字表法隨機將大鼠分為模型組、對照組,各為10只大鼠。兩組大鼠均按40 mg/kg的劑量腹腔注射水合氯醛進行麻醉,無菌條件下頸正中切口分離肌肉和筋膜后充分暴露雙側頸內動脈,實驗組大鼠5-0的絲線結扎雙側頸內動脈,保留頸外動脈建立亞急性缺血性視神經病變動物模型。對照組大鼠只分離雙側頸總動脈,不進行結扎。建模后14 d,大鼠水合氯醛麻醉后,仰臥位固定于手術臺,剪開右心耳,以0.9%生理鹽水200 ml快速滴入,4%多聚甲醛-磷酸鹽緩沖液(PBS)灌注固定;快速斷頭取視神經于冰盤上,置于凍存管內,進行后續實驗。
實時定量熒光聚合酶鏈反應(RT-PCR)檢測模型組、對照組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達量。視神經組織勻漿,按照酚-異硫氰酸胍一步法提取各組總RNA。微量紫外分光光度計測定總RNA濃度和純度。每個標本取200 ng總RNA,按逆轉錄試劑盒說明在20 μl體系中合成cDNA。根據NCBI數據庫中的TREM-1、TREM-2、Caspase-3、IL-6以及β-actin基因序列,以Premier 5.0軟件設計引物,由上海生工生物工程公司合成(表1)。熒光定量聚合酶鏈反應(PCR)儀進行RT-PCR反應,擴增條件94 ℃預變性 3 min,94 ℃變性3 min,60 ℃退火45 s,72 ℃延伸1 min,共35個循環,最后72 ℃延伸3 min。每個樣本取10 μl產物進行瓊脂糖凝膠電泳,應用Alpha Imager圖像分析系統測定吸光度[A,舊稱光密度(OD)]值,以β-actin為內參照基因,樣本相對表達含量=樣本A值/樣本β-actin A值。
蛋白質免疫印跡法(Western blot)檢測模型組、對照組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6蛋白相對表達量。PBS沖洗視神經組織后加入RIPA裂解液冰上裂解,提取總蛋白。提取的蛋白經8%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離后,將蛋白轉移至聚偏二氟乙烯膜上,洗膜緩沖液(TBST)漂洗3次,5%脫脂奶粉封閉1 h,加入兔抗大鼠TREM-1單克隆抗體(1:1000)、兔抗大鼠TREM-2單克隆抗體(1:1000)、兔抗大鼠Caspase-3單克隆抗體(1:2000)、兔抗大鼠IL-6單克隆抗體(1:1000)和兔抗大鼠β-actin單克隆抗體(1:1000),4 ℃孵育過夜,TBST漂洗3次后加入1:2000稀釋的HRP標記羊抗兔IgG二抗,常溫孵育2 h,TBST充分洗滌后電化學發光法顯影,暗室曝光,二氨基聯苯胺(DAB)顯色并拍照。采用Image J圖像分析系統進行灰度分析,以β-actin作為內參照。
采用SPSS17.0軟件進行統計學分析。正態分布的數據以均數±標準差(
 )表示。兩組間mRNA和蛋白比較采用t檢驗。檢驗水準α=0.05,P<0.05為差異有統計學意義。
)表示。兩組間mRNA和蛋白比較采用t檢驗。檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結果
RT-PCR檢測結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1(t=6.058,P=0.037)、Caspase-3(t=7.860,P=0.001)、IL-6(t=6.055,P=0.004) mRNA表達升高,TREM-2 mRNA(t=6.992,P=0.002)表達降低,差異均有統計學意義(圖1)。
 圖1
對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達含量。*與對照組比較,P<0.05 圖 2 對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 蛋白相對表達含量。2A.電泳圖;2B.兩組大鼠視神經組織中TREM-1、TRE-2、Caspase-3、IL-6蛋白表達結果。*與對照組相比,P<0.05
圖1
對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 mRNA相對表達含量。*與對照組比較,P<0.05 圖 2 對照組、模型組大鼠視神經組織中TREM-1、TREM-2、Caspase-3、IL-6 蛋白相對表達含量。2A.電泳圖;2B.兩組大鼠視神經組織中TREM-1、TRE-2、Caspase-3、IL-6蛋白表達結果。*與對照組相比,P<0.05
Western blot檢測結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1(t=9.671,P=0.001)、Caspase-3(t=9.524,P=0.001)、IL-6(t=14.501,P=0.000)蛋白表達升高,TREM-2(t=9.283,P=0.001)蛋白表達降低,差異均有統計學意義(圖2)。
3 討論
TREM是免疫球蛋白家族中的一個受體家族,其基因位于人染色體6p21[5, 6],是一種與激活自然殺傷細胞受體同源的IgG樣受體。有研究表明,TREM-1高度表達于嗜中性粒細胞和部分單核細胞和(或)巨噬細胞亞群[7],特別是肺泡巨噬細胞[8];TREM-2表達于不成熟的樹突狀細胞、破骨細胞和小膠質細胞表面[9]。兩者是具有相似結構[相對分子質量(25~30)×103]的跨膜糖蛋白。目前已知TREM-2基因敲除與Nasu-Hakola病即多囊脂性骨發育不良與硬化性腦白質病、神經退行性疾病、缺血性腦卒中的發病具有直接相關性。
本研究結果顯示,與對照組比較,模型組大鼠視神經組織中TREM-1、Caspase-3、IL-6 mRNA和蛋白相對表達升高,TREM-2 mRNA和蛋白相對表達降低,差異均有統計學意義。有研究結果表明,TREM-1的觸發可導致TNF-α、IL-8和單核細胞趨化蛋白1分泌增加并引發嗜中性粒細胞脫顆粒和以及髓過氧化物酶和一氧化氮的釋放[10]。TREM-1與單克隆抗體的結合刺激多種促炎細胞因子和趨化因子的產生[11, 12]。在Toll樣受體-2或Toll樣受體-4配體存在下TREM-1激活可增強促炎細胞因子(TNF、IL-1、粒細胞-巨噬細胞集落刺激因子)的產生,同時抑制IL-10的釋放[13]。TREM-2總體上具有促抗炎和促吞噬作用[3]:(1)TREM-2與配體結合后通過TREM-2/DAP12介導的信號轉導通路,激活ERK和酪氨酸蛋白激酶等,從而參與活化T細胞應答,影響小膠質細胞的自噬,是體內中樞神經系統炎癥調節的重要通路,同時EPK信號通路參與抑制脂多糖刺激后樹突狀細胞的凋亡[14];(2)巨噬細胞中TREM-2缺乏可誘導促炎癥細胞因子的產生,包括IL-6和TNF-α[15];(3)高表達TREM-2可以促進吞噬作用及減輕炎癥反應。由于TREM-1的促進炎癥反應作用以及TREM-2的抗炎作用,目前國內外研究發現TREM受體家族與風濕性疾病、膿毒血癥、多發性硬化、心肌梗死等多種疾病有關,但目前關于TREM受體家族與缺血性視神經病的關系研究較少。
本研究結果顯示,與對照組比較,模型組大鼠視神經中TREM-1、Caspase-3、IL-6 mRNA和蛋白相對表達升高,TREM-2 mRNA和蛋白相對表達降低,差異均有統計學意義。這一結果表明TREM-1及TREM-2的表達與缺血性視神經病有一定關系。在一定程度上提示TREM-1的表達及其相關炎癥因子可能會通過加重炎癥反應從而加重缺血性視神經疾病模型中視神經的損傷,TREM-2的表達可能會通過抗炎、抗凋亡作用而發揮保護作用,這為臨床治療缺血性視神經疾病提供了通過調控缺血性視神經病患者TREM受體家族的表達水平從而減輕視神經的損傷這一治療新思路。