引用本文: 牛瑞, 東莉潔, 馬騰, 杜雪利, 何燕華, 崔偉娜, 胡博杰. 抗血管內皮生長因子藥物治療后視網膜血管內皮細胞基因表達譜的RNA-Seq分析. 中華眼底病雜志, 2018, 34(3): 275-280. doi: 10.3760/cma.j.issn.1005-1015.2018.03.016 復制
抗血管內皮生長因子(VEGF)藥物治療新生血管性、滲出性病變療效顯著,但其在減少新生血管的同時,視網膜增生膜有增加趨勢[1, 2]。我們前期研究發現,增生型糖尿病視網膜病變(DR)患眼增生膜中VEGF表達明顯降低,而與血管生成及組織纖維化密切相關的結締組織生長因子(CTGF)表達顯著上調[3]。提示血管新生和纖維化增生之間存在此消彼長的蹺板關系及轉換機制。為深入探究該現象的分子機制,我們選擇體外細胞模型,通過不同干預手段模擬DR患眼抗VEGF藥物應用與否條件下視網膜血管內皮細胞生存的微環境,并聯合RNA-seq技術收集轉錄組學信息,以初步探討血管新生和纖維化增生之間的關鍵調控基因及相關調控通路。現將結果報道如下。
1 材料和方法
恒河猴視網膜血管內皮細胞(RF-6A),由天津醫科大學眼科醫院研究所自行保存。胰蛋白酶、胎牛血清、青鏈霉素(美國Gibco公司);T75細胞培養瓶及6孔板(美國Corning公司);Trizol試劑盒(美國Ambion公司);重組VEGF(美國PeproTech公司);雷珠單抗(諾華制藥有限公司);RPMI-1640培養基、磷酸鹽緩沖液(PBS,上海立菲生物技術有限公司)。
用含10%胎牛血清的RPMI-1640完全培養基培養細胞(100 U/ml青霉素及100 g/ml鏈霉素),置于37℃、5%CO2的培養箱中培養。取對數生長期細胞用于實驗,吸棄每孔中完全培養基,以無血清的1640基礎培養基饑餓過夜,以去除血清的生長因子對于后續試驗的影響。將細胞分為VEGF組、VEGF聯合抗VEGF藥物組,分別采用50 ng/ml VEGF、50 ng/ml VEGF+2.5 μg/ml抗VEGF藥物持續作用72 h。通過有機提取和吸附到離心柱的硅膠膜上制備總RNA。在總RNA樣品的濃度、純度、完整性、DNA是否污染等方面質量檢控測序數據,以確保后續處理的數據質量合格。濃度采用Qubit? 2.0熒光計精確定量;純度通過NanoPhotometer?分光光度計檢測吸光度A[舊稱光密度(OD)值]260/280及A260/230比值確定;完整性通過安捷倫2100生物分析儀精確檢測;DNA是否污染通過瓊脂糖凝膠電泳分析。
選擇poly(A)RNA富集來處理總RNA樣品。根據多聚T后加有A的簡并反轉錄引物即單堿基錨定,將mRNA進行分類。應用Oligo(dT)磁珠將有poly A尾的mRNA進行富集,在NEB Fragmentation Buffer中應用二價陽離子隨機打斷富集到的mRNA。隨后依據NEB普通建庫方式及鏈特異性建庫方式進行建庫。NEB普通建庫是以片段化的mRNA為模板,隨機寡核苷酸為引物,在莫洛尼鼠白血病病毒逆轉錄酶體系中合成cDNA第一條鏈,然后用核糖核酸酶H降解RNA鏈,并在DNA聚合酶Ⅰ體系下,以高質量的脫氧核糖核苷酸為原料合成cDNA第二條鏈。純化后的雙鏈cDNA經過末端修復、加A尾并連接測序接頭。應用AMPure XP beads將200堿基對(bp)左右的cDNA篩選出來,進行聚合酶鏈反應(PCR)擴增并再次使用AMPure XP beads純化PCR產物,最終獲得文庫。
文庫構建完成后,應用Qubit? 2.0 熒光計進行初步定量,將文庫稀釋至1.5 ng/μl。隨后應用安捷倫2100生物分析儀檢測文庫的插入片段,當插入片段達到預期后,應用熒光定量逆轉錄(qRT)-PCR來準確定量文庫有效濃度(文庫有效濃度高于2 nmol/L),以保證文庫質量。
根據制造商的說明,使用TruSeq PE Cluster Kit v4-cBot-HS(Illumia)在cBot簇生成系統上進行索引編碼樣品的聚類。簇生成后,將文庫制備物在Illumina Hiseq 4000平臺上進行測序,并產生配對末端讀數。
應用Bioconductor軟件將低質量序列、過度表示序列及適配序列濾除。應用edgeR函數進行差異表達分析,提取P≤0.001的差異顯著基因相應蛋白質序列進行Pathway、GO功能顯著性富集分析。該函數基于每個基因表達服從負二項分布的假定,即應用條件最大似然法對單個基因的離散度進行估計,隨后應用經驗性貝葉斯法把離散度逼近一個共同值,最后觀察兩組均值的差值與0的差異是否具有統計學意義。
應用Blast軟件比對基因序列到NR庫和KEGG數據庫,隨后提取所有基因的Pathway、GO注釋信息。根據差異表達基因列表,應用軟件Bioconductor中的topGO函數和超幾何檢驗對差異表達基因進行Pathway、GO功能顯著性富集分析。對得到的差異基因大數據進行篩查,篩除Log-2到Log2區間內無意義的數據,將該數據按P值大小逐一從數據庫中找出對應基因,查閱相關文獻,了解該基因在不同組織中發揮的作用及作用機制。根據基因作用途徑,完善顯著差異基因間的關系。
2 結果
樣品SRA編號為SRP144687。所有樣品在illumina測序平臺的轉錄組測序后,分別得到VEGF聯合抗VEGF藥物組、VEGF組總reads數46 047 754、46 241 632條;過濾質量較低的數據,得到clean reads數所占比例分別為93.74%、94.13%(表1)。
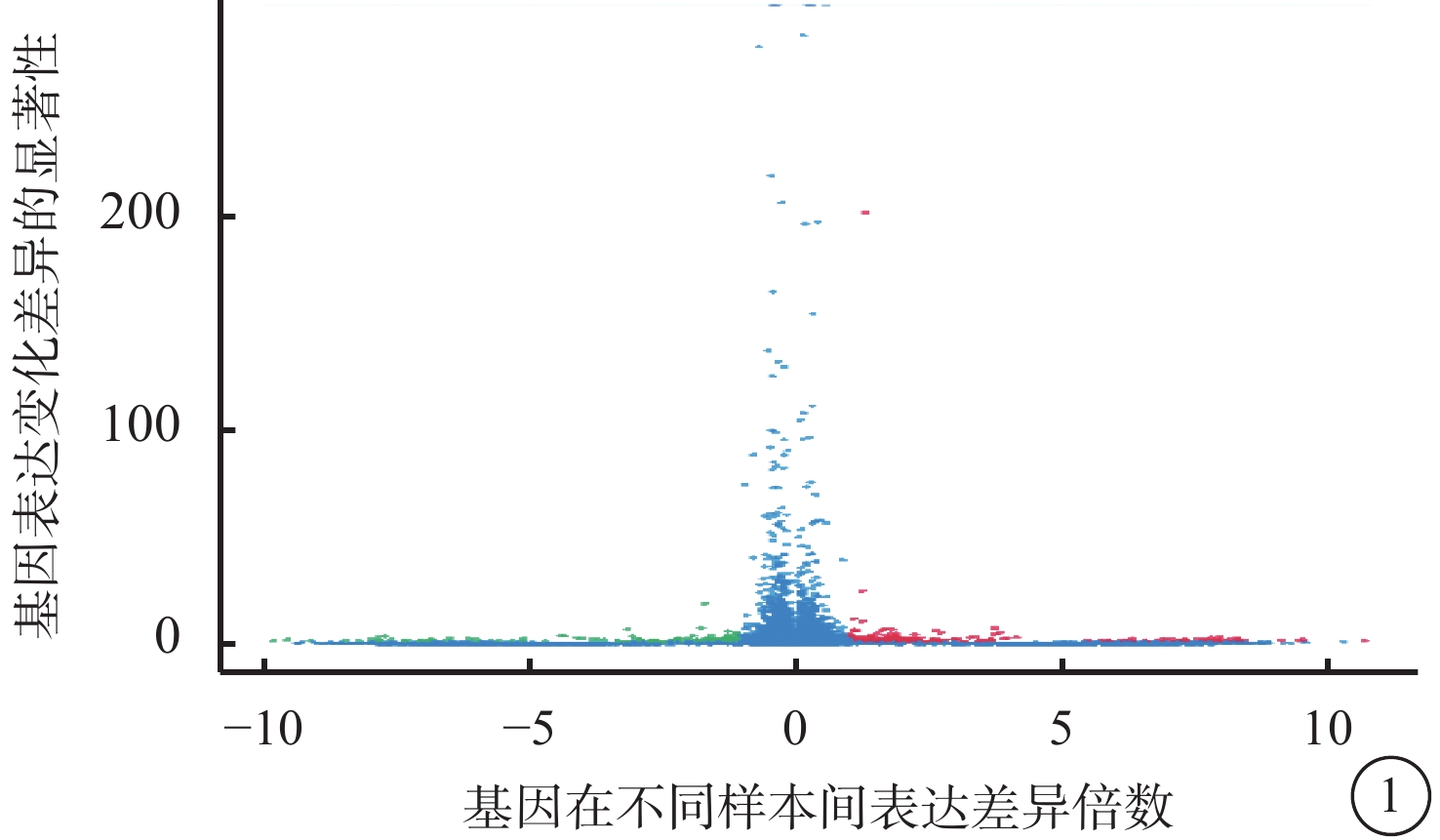
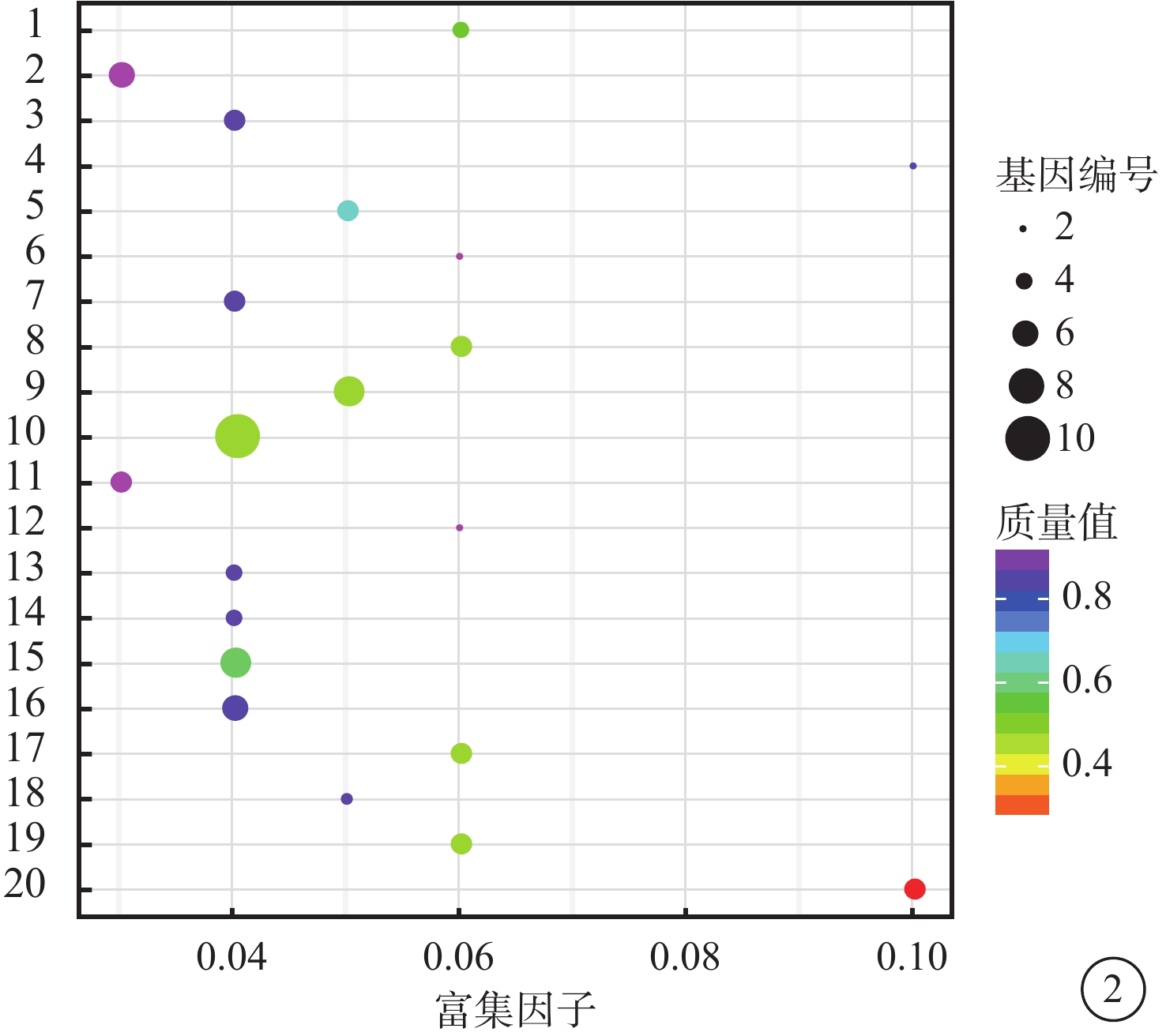
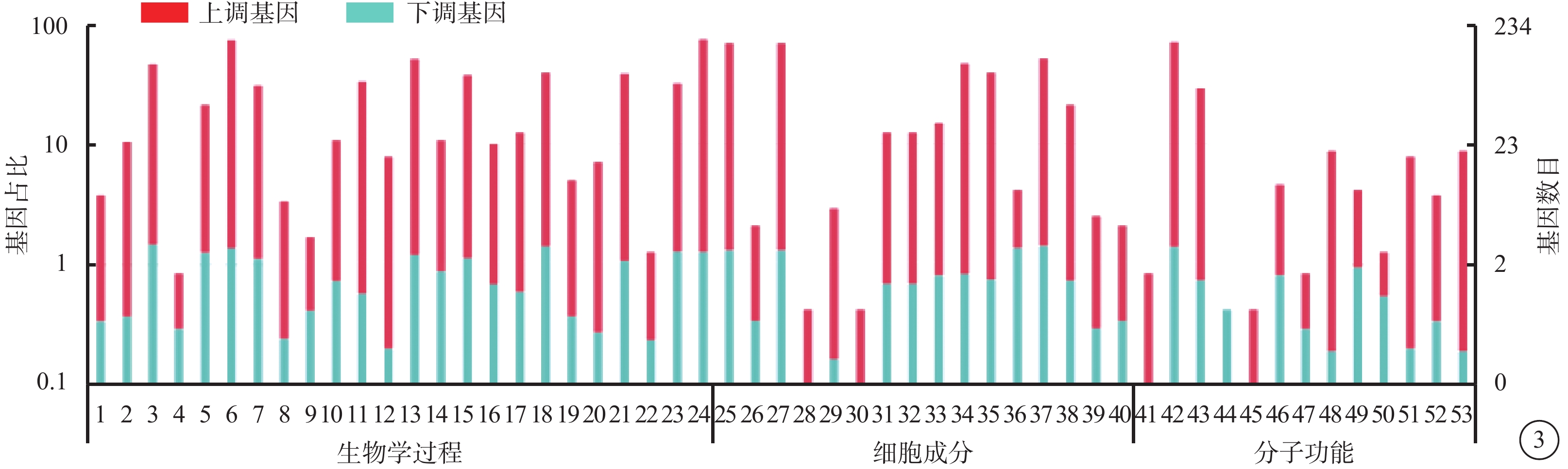
VEGF聯合抗VEGF藥物組與VEGF組之間共有328個差異表達基因。其中,上調基因194個,下調基因133個(圖1)。Pathway顯著性富集分析前20條具有明顯差異的通路,發現Notch信號通路、細胞外基質(ECM)受體通路、絲裂原活化蛋白激酶(MAPK)信號通路、轉化生長因子-β(TGF-β)信號通路、Wnt信號通路表達在兩組細胞間存在差異,而其中又以與纖維化進程調控密切相關的TGF-β信號通路中鈣/鈣調蛋白依賴性蛋白激酶Ⅱβ(CAMK2B)、膠原蛋白Ⅲ型α1鏈(COL3A1)、細胞球蛋白(CYGB)、前列腺素E(PGE)受體2(PTGER2)、硫酸乙酰肝素6-O-磺基轉移酶2(HS6ST2)等基因的差異表達最為引人關注(圖2)。GO功能顯著性富集分析結果顯示,差異基因的功能主要劃分為生物學行為調控、細胞組分形成以及分子功能三大板塊,集中表現在生物學過程部分的系統形成和調節多細胞有機體的形成等(圖3)。
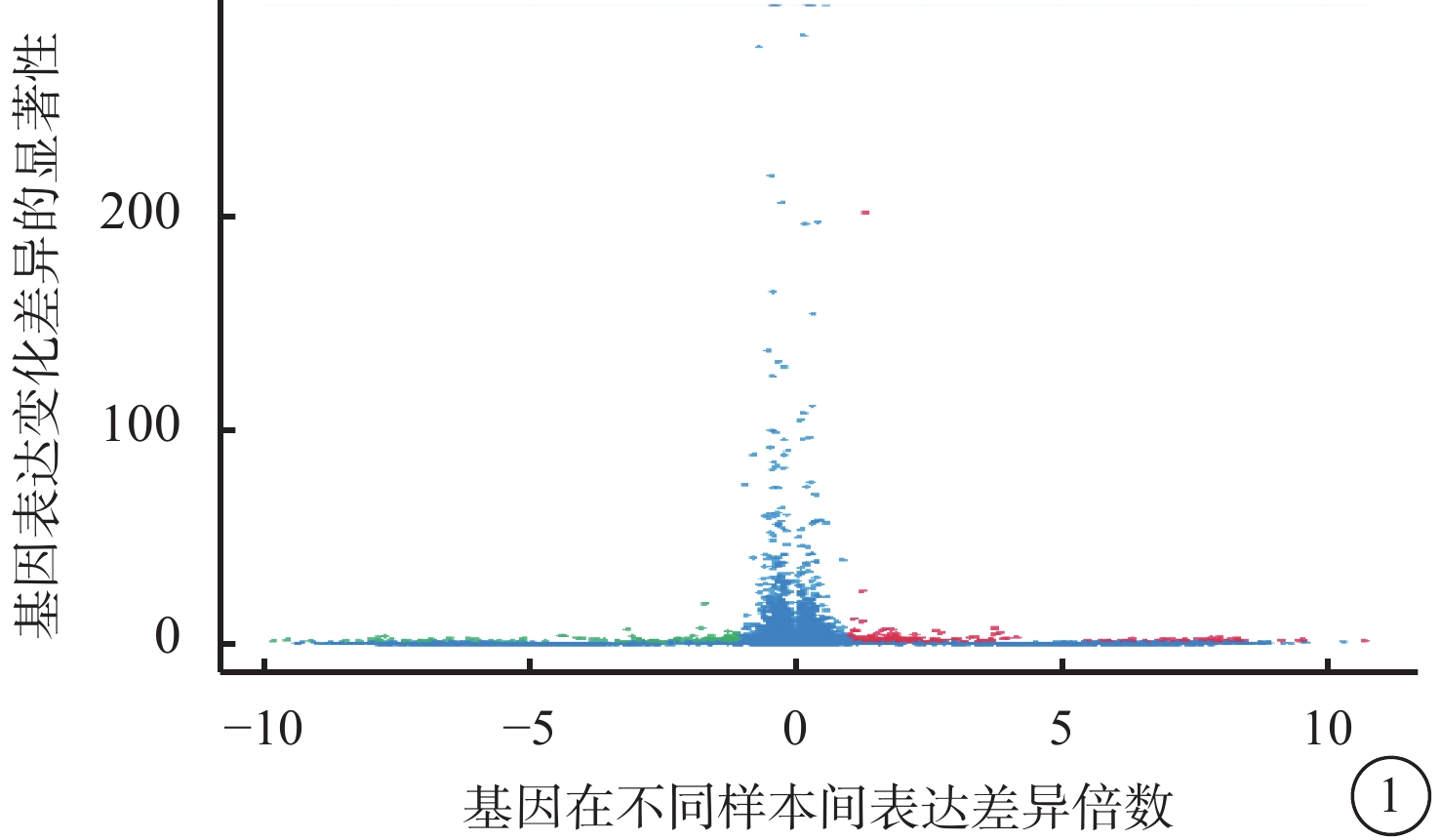 圖1
VEGF聯合抗VEGF藥物組與VEGF組差異表達基因火山圖
圖1
VEGF聯合抗VEGF藥物組與VEGF組差異表達基因火山圖
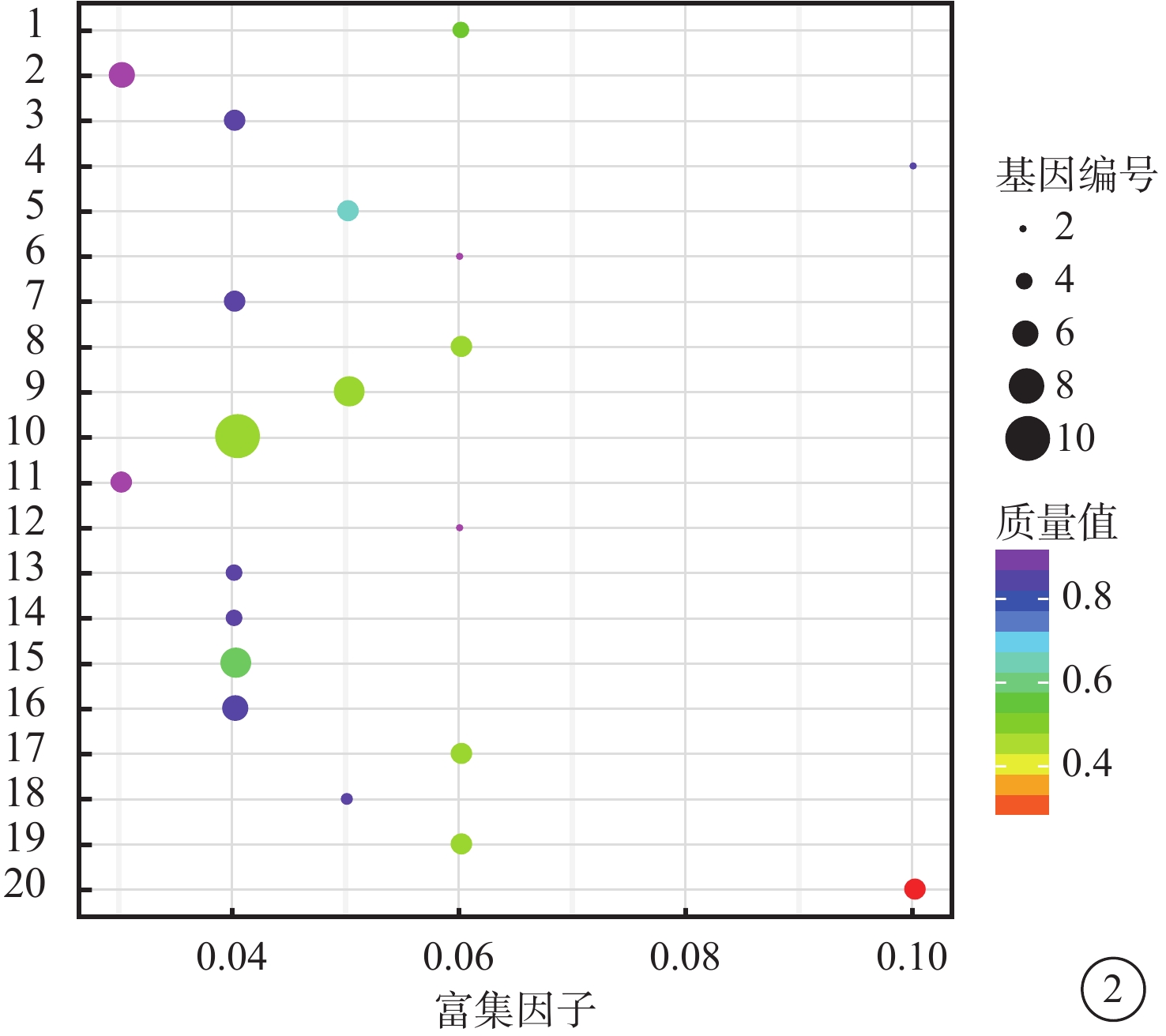 圖2
富集程度排名前20的Pathway條目統計散點圖。1. 酪氨酸代謝;2. 弓形體病;3. Toll樣受體信號通路;4. 腎素血管緊張素系統;5. 朊病毒疾病;6. 苯丙氨酸代謝;7. 百日咳;8. Notch信號通路;9. NOD樣受體信號通路;10. 神經營養因子信號通路;11. 利什曼病;12. 組氨酸代謝;13. 甘油酯代謝;14. 內分泌和其他因子調節的鈣重吸收;15. ECM受體相互作用;16. 心肌收縮;17. 碳水化合物的消化及吸收;18. β丙氨酸代謝;19. 氨酰tRNA的生物合成;20. ABC轉運蛋白
圖2
富集程度排名前20的Pathway條目統計散點圖。1. 酪氨酸代謝;2. 弓形體病;3. Toll樣受體信號通路;4. 腎素血管緊張素系統;5. 朊病毒疾病;6. 苯丙氨酸代謝;7. 百日咳;8. Notch信號通路;9. NOD樣受體信號通路;10. 神經營養因子信號通路;11. 利什曼病;12. 組氨酸代謝;13. 甘油酯代謝;14. 內分泌和其他因子調節的鈣重吸收;15. ECM受體相互作用;16. 心肌收縮;17. 碳水化合物的消化及吸收;18. β丙氨酸代謝;19. 氨酰tRNA的生物合成;20. ABC轉運蛋白
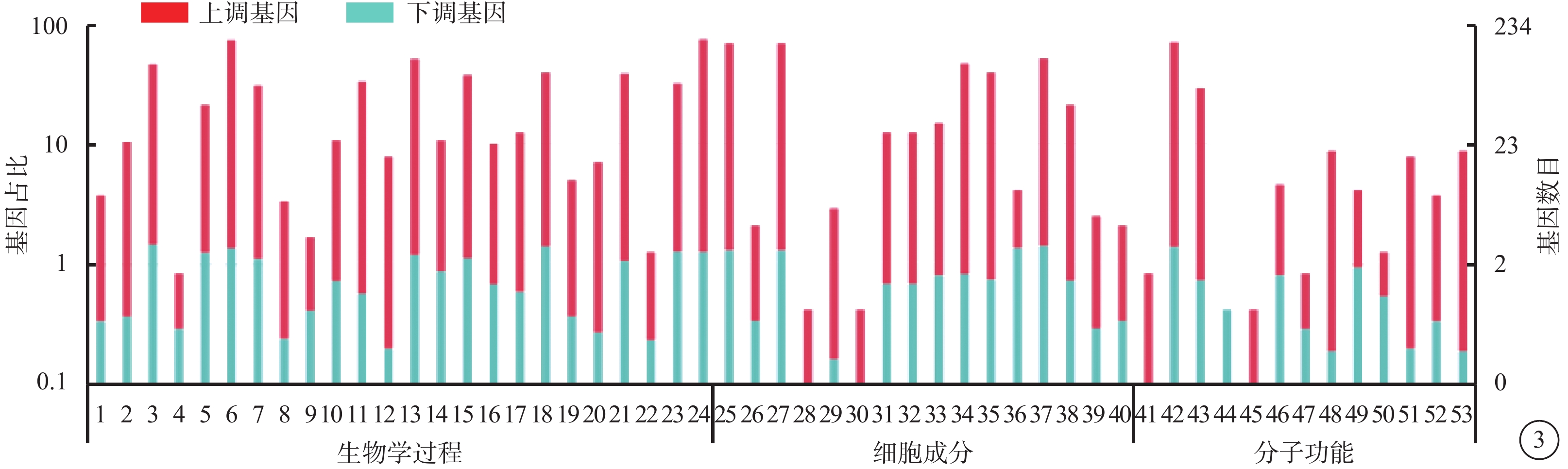 圖3
差異基因GO功能注釋分類統計圖。1. 特性;2. 生物粘附;3. 生物調節;4. 細胞殺傷;5. 細胞組織成分或合成原料;6. 細胞過程;7. 發展過程;8. 發育;9. 激素分泌;10. 免疫系統過程;11. 局限;12. 運動;13. 代謝過程;14. 多生物過程;15. 多細胞生物過程;16. 負向調節生物過程;17. 正向調節生物過程;18. 生物過程的調節;19. 生殖;20. 生殖過程;21. 刺激后反應;22. 規律的過程;23. 發信號;24. 單一生物過程 25. 細胞;26. 細胞連接處;27. 細胞部分;28. 膠原三聚體;29. 細胞外基質;30. 細胞外基質部分;31. 細胞外區域;32. 細胞外區域部分;33. 大分子復合物;34. 膜;35. 膜部分;36. 封閉膜內腔;37. 細胞器;38. 細胞器部分;39. 突觸;40. 突觸部分;41. 抗氧化活性;42. 粘合物;43. 催化活性;44. 通道調節器活動;45. 電子載體活性;46. 酶調節劑活性;47. 鳥苷酸 - 核苷酸交換因子活性;48. 分子轉導活性;49. 核酸結合轉錄因子活性;50. 蛋白質結合轉錄因子活性;51. 受體活性;52. 結構分子活性;53. 轉運蛋白活性
圖3
差異基因GO功能注釋分類統計圖。1. 特性;2. 生物粘附;3. 生物調節;4. 細胞殺傷;5. 細胞組織成分或合成原料;6. 細胞過程;7. 發展過程;8. 發育;9. 激素分泌;10. 免疫系統過程;11. 局限;12. 運動;13. 代謝過程;14. 多生物過程;15. 多細胞生物過程;16. 負向調節生物過程;17. 正向調節生物過程;18. 生物過程的調節;19. 生殖;20. 生殖過程;21. 刺激后反應;22. 規律的過程;23. 發信號;24. 單一生物過程 25. 細胞;26. 細胞連接處;27. 細胞部分;28. 膠原三聚體;29. 細胞外基質;30. 細胞外基質部分;31. 細胞外區域;32. 細胞外區域部分;33. 大分子復合物;34. 膜;35. 膜部分;36. 封閉膜內腔;37. 細胞器;38. 細胞器部分;39. 突觸;40. 突觸部分;41. 抗氧化活性;42. 粘合物;43. 催化活性;44. 通道調節器活動;45. 電子載體活性;46. 酶調節劑活性;47. 鳥苷酸 - 核苷酸交換因子活性;48. 分子轉導活性;49. 核酸結合轉錄因子活性;50. 蛋白質結合轉錄因子活性;51. 受體活性;52. 結構分子活性;53. 轉運蛋白活性
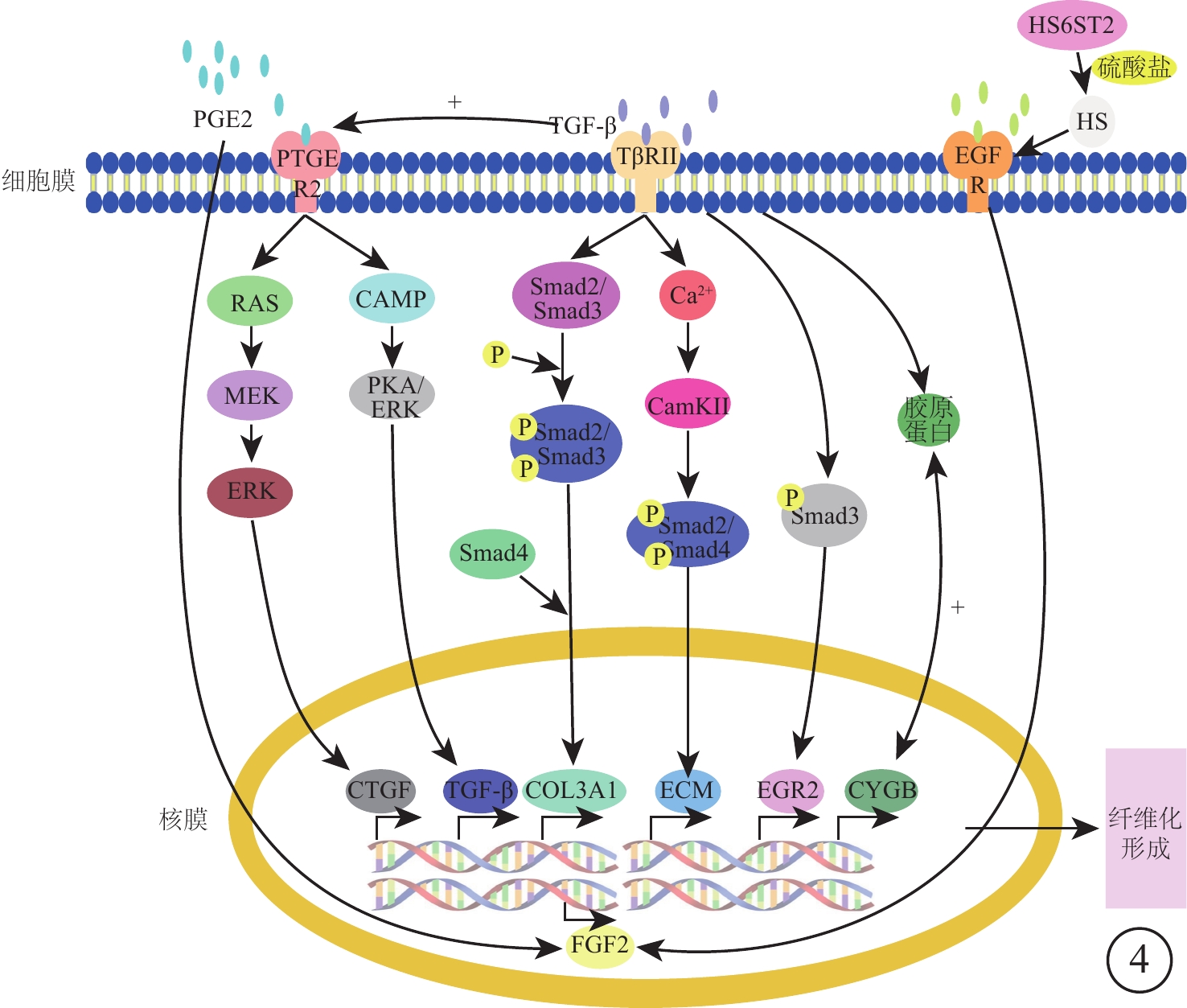
從328個差異表達基因中,選出差異基因表達較為顯著的14個基因,分析其各自特征及其在VEGF聯合抗VEGF藥物組與VEGF組間的表達情況。結果顯示,這些差異表達基因參與分子生物學過程,影響細胞能量代謝、蛋白合成等(表2,圖4)。其中,SI、PRX、HPGD與蛋白合成相關,BIRC7與細胞凋亡相關,而ABLIM1、CRB2與視網膜發育相關,ABCG1、ABCA9、ABCA12與巨噬細胞膽固醇和磷脂轉運相關。
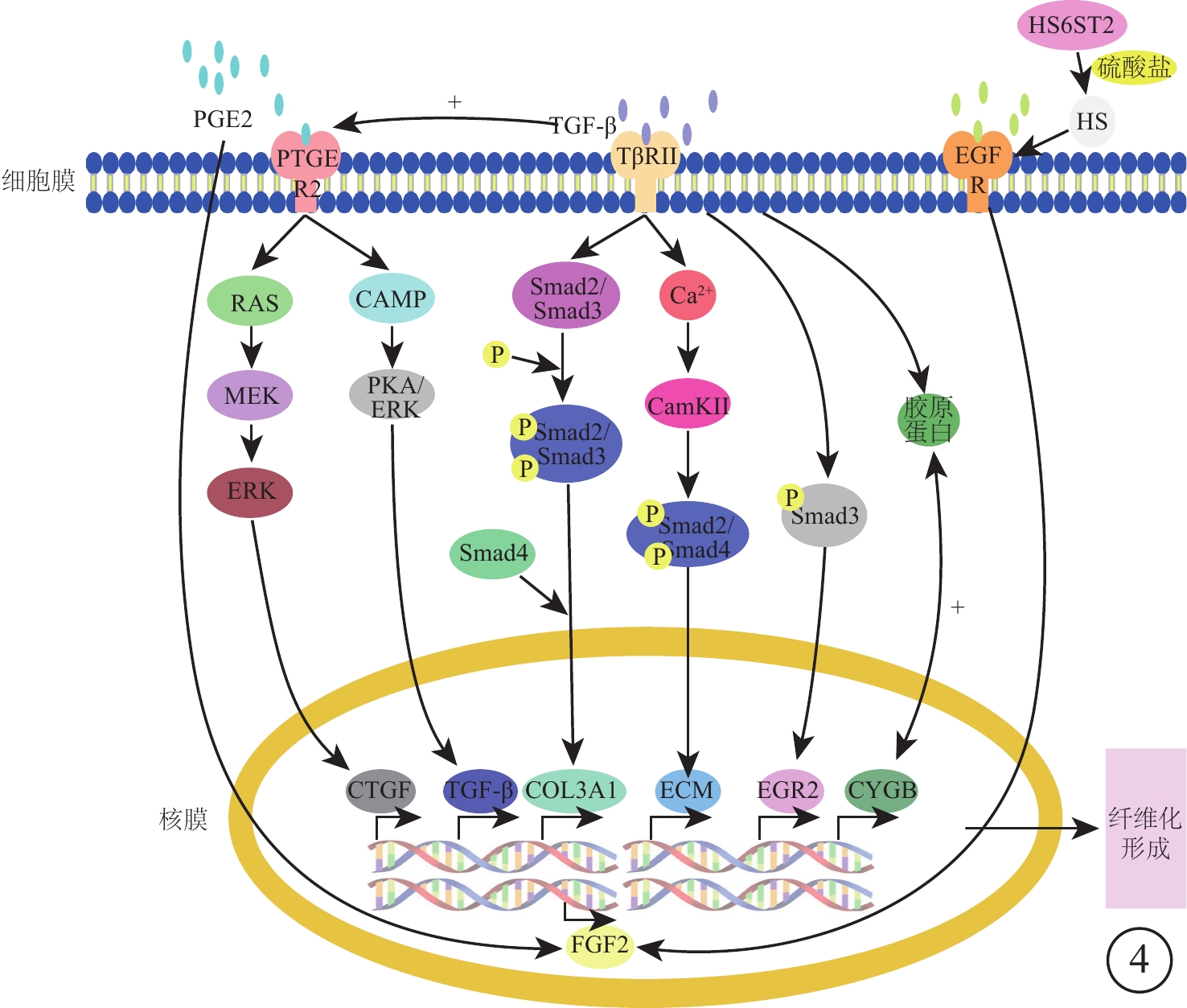 圖4
差異基因作用途徑及相互關系模式圖。TβRⅡ. Ⅱ型TGF-β受體;EGR2. 早期生長反應蛋白2;CAMP. 環磷酸腺苷;EGFR. 表皮生長因子受體;HS. 硫酸乙酰肝素;FGF2. 堿性成纖維細胞生長因子2
圖4
差異基因作用途徑及相互關系模式圖。TβRⅡ. Ⅱ型TGF-β受體;EGR2. 早期生長反應蛋白2;CAMP. 環磷酸腺苷;EGFR. 表皮生長因子受體;HS. 硫酸乙酰肝素;FGF2. 堿性成纖維細胞生長因子2
3 討論
玻璃體腔注射抗VEGF藥物可能加劇增生性玻璃體視網膜病變或滲出型老年性黃斑變性患者纖維化的嚴重程度[2];致密玻璃體積血或既往存在牽拉性視網膜脫離(TRD)者注射后TRD程度更為嚴重[4-8]。增生型DR患者經玻璃體腔注射貝伐單抗后視網膜纖維化增加,其纖維血管增生膜中也觀察到纖維化轉變[2, 6]。因此,探索抗VEGF藥物與纖維化蹺板式關系有其必要性。
RNA-seq是利用新一代高通量測序技術對轉錄組進行分析,其在鑒定差異表達基因方面較傳統技術更具優勢[9-10]。本研究體外培養視網膜血管內皮細胞,以重組VEGF刺激細胞來模擬增生型DR中血管內皮細胞的高VEGF生存環境,以VEGF聯合抗VEGF藥物干預細胞來仿效抗VEGF藥物治療后細胞所處的微環境,之后應用RNA-Seq技術對細胞進行全轉錄組測序,獲得生物學大數據。分析發現,兩者之間差異基因的功能涉及分子生物學過程調控及細胞能量代謝、蛋白合成等方面。其中SI與蛋白合成相關,BIRCT、GP1BA與細胞增生凋亡相關,ABLIM1、CRB2與視網膜發育相關。差異基因的功能主要劃分為生物學行為調控、細胞成分及分子功能三大板塊;Notch信號通路、ECM受體通路、MAPK信號通路、TGF-β信號通路、Wnt信號通路表達在兩組細胞間存在差異。
TGF-β在ECM生成過程中發揮關鍵調節作用,是刺激膠原蛋白合成、發生纖維化的基礎[11-13]。不僅如此,TGF-β還可誘導CTGF、血小板衍生生長因子、EGF和FGF發揮作用進一步促進纖維化[14]。TGF-β信號傳導途徑為TGF-β通過結合活性TβRⅡ,導致Smad2和Smad3的絲氨酸磷酸化和TβRⅠ活化,激活的TβRⅠ反過來促進Smad2和Smad3的絲氨酸磷酸化及其與Smad4的結合,促進磷酸化后Smad2和Smad3易位到細胞核以及促纖維化基因的轉錄[15-17]。我們發現的差異基因中CaMK2B、COL3A1、CYGB、PTGER2因與TGF-β信號通路的密切聯系最為引人關注。
CaMK2B及COL3A1是Smad途徑介導的TGF-β下游因子。鈣調蛋白依賴性蛋白激酶Ⅱ是一個普遍存在的Ser/Thr定向蛋白激酶,該基因的產物是一個β鏈[18]。TGF通過誘發有節律的Ca2+振蕩,使細胞內Ca2+增加進而激活CaMKⅡ,隨后活化的CaMKⅡ磷酸化多種靶標,包括Smad2和Smad4,導致ECM基因表達和促纖維化應答[19]。Ⅲ型膠原蛋白被認為具有促纖維化作用,其表達受局部成纖維細胞活性的調節[20]。除此之外,TGF-β1通過Smad信號通路誘導成纖維細胞中Ⅰ型和Ⅲ型膠原蛋白的表達,在誘導膠原蛋白合成的同時,誘導其合成CYGB[12, 21] 。CYGB是最近發現的一種功能尚未確定的六配位球蛋白,在大多數組織中普遍表達[21]。CYGB表達與膠原蛋白合成之間呈正相關,當其表達上調時,膠原蛋白Ⅰ型α1鏈轉錄物和膠原蛋白的表達同時增加,并參與膠原蛋白合成促進纖維化反應[21]。
PTGER2在成纖維細胞中具有自分泌和旁分泌介質的功能,激活上皮細胞中VEGF、CTGF、TGF-β1和白細胞介素(IL)-8等因子表達,影響趨化性募集、增生、基質產生和基質重塑等過程[22-25]。PGE2與不同的轉導機制如細胞內CAMP減少和細胞內鈣增加有關,通過與這些受體的相互作用,PGE2介導各種生理反應[25]。一方面PTGER2激活通過RAS/MEK/細胞外信號調節激酶(ERK)信號通路誘導CTGF基因。CTGF是涉及多種細胞過程的分泌蛋白,包括血管生成、骨骼發生和傷口愈合,并且該纖維蛋白的基因在纖維化組織中的傷口愈合期間被表達[26]。另一方面,PTGER2與腺苷酸環化酶偶聯,在激活時產生CAMP,隨后通過蛋白激酶A和ERK途徑誘導TGF-β1基因表達,TGF-β1刺激PGE2釋放,PGE2顯著誘導FGF2的表達[26-29]。FGF2促進成纖維細胞和多種其他細胞類型的增生、分化和遷移,并影響包括血管生成、組織重塑、傷口愈合和腫瘤生長在內的一系列過程[30-33]。FGF2在創傷修復和再生階段具有突出作用。在急性傷口愈合中,FGF2通過刺激成纖維細胞運動和膠原酶產生以促進細胞外基質重塑,促進肉芽組織形成,并在再上皮化期間增加角質形成細胞運動性而促進組織修復。同樣調控FGF2表達的有HS6ST2。HS6ST2是HS磺基轉移酶基因家族的成員,其催化硫酸鹽轉移至HS,HS硫酸化有助于通過HS依賴性HB-EGF/EGFR誘導細胞中FGF2、IL-6和IL-8的表達,從而影響體內外的內皮細胞功能[34]。HS涉及各種細胞過程,如器官發生或腫瘤發生也涉及胚胎干細胞分化和特發性肺纖維化[25, 35, 36]。
綜上所述,抗VEGF藥物對視網膜纖維化的影響是多層次、多方面、多靶點的復雜過程,其通過調節多個作用途徑及相關基因的表達影響視網膜纖維化,因此設定具有時間依賴和濃度依賴的實驗分組,易于模擬動態梯度漸變過程,完整詮釋翹板關系。本研究通過RNA轉錄組測序分析,為進一步完善蹺板式關鍵調控基因及相關調控通路提供了數據支持,為減輕抗VEGF藥物治療后視網膜纖維化提供相應切入點;后續應再完善相關實驗,以期進一步探尋血管新生和纖維化之間漸變過程的調控作用機制。
抗血管內皮生長因子(VEGF)藥物治療新生血管性、滲出性病變療效顯著,但其在減少新生血管的同時,視網膜增生膜有增加趨勢[1, 2]。我們前期研究發現,增生型糖尿病視網膜病變(DR)患眼增生膜中VEGF表達明顯降低,而與血管生成及組織纖維化密切相關的結締組織生長因子(CTGF)表達顯著上調[3]。提示血管新生和纖維化增生之間存在此消彼長的蹺板關系及轉換機制。為深入探究該現象的分子機制,我們選擇體外細胞模型,通過不同干預手段模擬DR患眼抗VEGF藥物應用與否條件下視網膜血管內皮細胞生存的微環境,并聯合RNA-seq技術收集轉錄組學信息,以初步探討血管新生和纖維化增生之間的關鍵調控基因及相關調控通路。現將結果報道如下。
1 材料和方法
恒河猴視網膜血管內皮細胞(RF-6A),由天津醫科大學眼科醫院研究所自行保存。胰蛋白酶、胎牛血清、青鏈霉素(美國Gibco公司);T75細胞培養瓶及6孔板(美國Corning公司);Trizol試劑盒(美國Ambion公司);重組VEGF(美國PeproTech公司);雷珠單抗(諾華制藥有限公司);RPMI-1640培養基、磷酸鹽緩沖液(PBS,上海立菲生物技術有限公司)。
用含10%胎牛血清的RPMI-1640完全培養基培養細胞(100 U/ml青霉素及100 g/ml鏈霉素),置于37℃、5%CO2的培養箱中培養。取對數生長期細胞用于實驗,吸棄每孔中完全培養基,以無血清的1640基礎培養基饑餓過夜,以去除血清的生長因子對于后續試驗的影響。將細胞分為VEGF組、VEGF聯合抗VEGF藥物組,分別采用50 ng/ml VEGF、50 ng/ml VEGF+2.5 μg/ml抗VEGF藥物持續作用72 h。通過有機提取和吸附到離心柱的硅膠膜上制備總RNA。在總RNA樣品的濃度、純度、完整性、DNA是否污染等方面質量檢控測序數據,以確保后續處理的數據質量合格。濃度采用Qubit? 2.0熒光計精確定量;純度通過NanoPhotometer?分光光度計檢測吸光度A[舊稱光密度(OD)值]260/280及A260/230比值確定;完整性通過安捷倫2100生物分析儀精確檢測;DNA是否污染通過瓊脂糖凝膠電泳分析。
選擇poly(A)RNA富集來處理總RNA樣品。根據多聚T后加有A的簡并反轉錄引物即單堿基錨定,將mRNA進行分類。應用Oligo(dT)磁珠將有poly A尾的mRNA進行富集,在NEB Fragmentation Buffer中應用二價陽離子隨機打斷富集到的mRNA。隨后依據NEB普通建庫方式及鏈特異性建庫方式進行建庫。NEB普通建庫是以片段化的mRNA為模板,隨機寡核苷酸為引物,在莫洛尼鼠白血病病毒逆轉錄酶體系中合成cDNA第一條鏈,然后用核糖核酸酶H降解RNA鏈,并在DNA聚合酶Ⅰ體系下,以高質量的脫氧核糖核苷酸為原料合成cDNA第二條鏈。純化后的雙鏈cDNA經過末端修復、加A尾并連接測序接頭。應用AMPure XP beads將200堿基對(bp)左右的cDNA篩選出來,進行聚合酶鏈反應(PCR)擴增并再次使用AMPure XP beads純化PCR產物,最終獲得文庫。
文庫構建完成后,應用Qubit? 2.0 熒光計進行初步定量,將文庫稀釋至1.5 ng/μl。隨后應用安捷倫2100生物分析儀檢測文庫的插入片段,當插入片段達到預期后,應用熒光定量逆轉錄(qRT)-PCR來準確定量文庫有效濃度(文庫有效濃度高于2 nmol/L),以保證文庫質量。
根據制造商的說明,使用TruSeq PE Cluster Kit v4-cBot-HS(Illumia)在cBot簇生成系統上進行索引編碼樣品的聚類。簇生成后,將文庫制備物在Illumina Hiseq 4000平臺上進行測序,并產生配對末端讀數。
應用Bioconductor軟件將低質量序列、過度表示序列及適配序列濾除。應用edgeR函數進行差異表達分析,提取P≤0.001的差異顯著基因相應蛋白質序列進行Pathway、GO功能顯著性富集分析。該函數基于每個基因表達服從負二項分布的假定,即應用條件最大似然法對單個基因的離散度進行估計,隨后應用經驗性貝葉斯法把離散度逼近一個共同值,最后觀察兩組均值的差值與0的差異是否具有統計學意義。
應用Blast軟件比對基因序列到NR庫和KEGG數據庫,隨后提取所有基因的Pathway、GO注釋信息。根據差異表達基因列表,應用軟件Bioconductor中的topGO函數和超幾何檢驗對差異表達基因進行Pathway、GO功能顯著性富集分析。對得到的差異基因大數據進行篩查,篩除Log-2到Log2區間內無意義的數據,將該數據按P值大小逐一從數據庫中找出對應基因,查閱相關文獻,了解該基因在不同組織中發揮的作用及作用機制。根據基因作用途徑,完善顯著差異基因間的關系。
2 結果
樣品SRA編號為SRP144687。所有樣品在illumina測序平臺的轉錄組測序后,分別得到VEGF聯合抗VEGF藥物組、VEGF組總reads數46 047 754、46 241 632條;過濾質量較低的數據,得到clean reads數所占比例分別為93.74%、94.13%(表1)。
VEGF聯合抗VEGF藥物組與VEGF組之間共有328個差異表達基因。其中,上調基因194個,下調基因133個(圖1)。Pathway顯著性富集分析前20條具有明顯差異的通路,發現Notch信號通路、細胞外基質(ECM)受體通路、絲裂原活化蛋白激酶(MAPK)信號通路、轉化生長因子-β(TGF-β)信號通路、Wnt信號通路表達在兩組細胞間存在差異,而其中又以與纖維化進程調控密切相關的TGF-β信號通路中鈣/鈣調蛋白依賴性蛋白激酶Ⅱβ(CAMK2B)、膠原蛋白Ⅲ型α1鏈(COL3A1)、細胞球蛋白(CYGB)、前列腺素E(PGE)受體2(PTGER2)、硫酸乙酰肝素6-O-磺基轉移酶2(HS6ST2)等基因的差異表達最為引人關注(圖2)。GO功能顯著性富集分析結果顯示,差異基因的功能主要劃分為生物學行為調控、細胞組分形成以及分子功能三大板塊,集中表現在生物學過程部分的系統形成和調節多細胞有機體的形成等(圖3)。
 圖1
VEGF聯合抗VEGF藥物組與VEGF組差異表達基因火山圖
圖1
VEGF聯合抗VEGF藥物組與VEGF組差異表達基因火山圖
 圖2
富集程度排名前20的Pathway條目統計散點圖。1. 酪氨酸代謝;2. 弓形體病;3. Toll樣受體信號通路;4. 腎素血管緊張素系統;5. 朊病毒疾病;6. 苯丙氨酸代謝;7. 百日咳;8. Notch信號通路;9. NOD樣受體信號通路;10. 神經營養因子信號通路;11. 利什曼病;12. 組氨酸代謝;13. 甘油酯代謝;14. 內分泌和其他因子調節的鈣重吸收;15. ECM受體相互作用;16. 心肌收縮;17. 碳水化合物的消化及吸收;18. β丙氨酸代謝;19. 氨酰tRNA的生物合成;20. ABC轉運蛋白
圖2
富集程度排名前20的Pathway條目統計散點圖。1. 酪氨酸代謝;2. 弓形體病;3. Toll樣受體信號通路;4. 腎素血管緊張素系統;5. 朊病毒疾病;6. 苯丙氨酸代謝;7. 百日咳;8. Notch信號通路;9. NOD樣受體信號通路;10. 神經營養因子信號通路;11. 利什曼病;12. 組氨酸代謝;13. 甘油酯代謝;14. 內分泌和其他因子調節的鈣重吸收;15. ECM受體相互作用;16. 心肌收縮;17. 碳水化合物的消化及吸收;18. β丙氨酸代謝;19. 氨酰tRNA的生物合成;20. ABC轉運蛋白
 圖3
差異基因GO功能注釋分類統計圖。1. 特性;2. 生物粘附;3. 生物調節;4. 細胞殺傷;5. 細胞組織成分或合成原料;6. 細胞過程;7. 發展過程;8. 發育;9. 激素分泌;10. 免疫系統過程;11. 局限;12. 運動;13. 代謝過程;14. 多生物過程;15. 多細胞生物過程;16. 負向調節生物過程;17. 正向調節生物過程;18. 生物過程的調節;19. 生殖;20. 生殖過程;21. 刺激后反應;22. 規律的過程;23. 發信號;24. 單一生物過程 25. 細胞;26. 細胞連接處;27. 細胞部分;28. 膠原三聚體;29. 細胞外基質;30. 細胞外基質部分;31. 細胞外區域;32. 細胞外區域部分;33. 大分子復合物;34. 膜;35. 膜部分;36. 封閉膜內腔;37. 細胞器;38. 細胞器部分;39. 突觸;40. 突觸部分;41. 抗氧化活性;42. 粘合物;43. 催化活性;44. 通道調節器活動;45. 電子載體活性;46. 酶調節劑活性;47. 鳥苷酸 - 核苷酸交換因子活性;48. 分子轉導活性;49. 核酸結合轉錄因子活性;50. 蛋白質結合轉錄因子活性;51. 受體活性;52. 結構分子活性;53. 轉運蛋白活性
圖3
差異基因GO功能注釋分類統計圖。1. 特性;2. 生物粘附;3. 生物調節;4. 細胞殺傷;5. 細胞組織成分或合成原料;6. 細胞過程;7. 發展過程;8. 發育;9. 激素分泌;10. 免疫系統過程;11. 局限;12. 運動;13. 代謝過程;14. 多生物過程;15. 多細胞生物過程;16. 負向調節生物過程;17. 正向調節生物過程;18. 生物過程的調節;19. 生殖;20. 生殖過程;21. 刺激后反應;22. 規律的過程;23. 發信號;24. 單一生物過程 25. 細胞;26. 細胞連接處;27. 細胞部分;28. 膠原三聚體;29. 細胞外基質;30. 細胞外基質部分;31. 細胞外區域;32. 細胞外區域部分;33. 大分子復合物;34. 膜;35. 膜部分;36. 封閉膜內腔;37. 細胞器;38. 細胞器部分;39. 突觸;40. 突觸部分;41. 抗氧化活性;42. 粘合物;43. 催化活性;44. 通道調節器活動;45. 電子載體活性;46. 酶調節劑活性;47. 鳥苷酸 - 核苷酸交換因子活性;48. 分子轉導活性;49. 核酸結合轉錄因子活性;50. 蛋白質結合轉錄因子活性;51. 受體活性;52. 結構分子活性;53. 轉運蛋白活性
從328個差異表達基因中,選出差異基因表達較為顯著的14個基因,分析其各自特征及其在VEGF聯合抗VEGF藥物組與VEGF組間的表達情況。結果顯示,這些差異表達基因參與分子生物學過程,影響細胞能量代謝、蛋白合成等(表2,圖4)。其中,SI、PRX、HPGD與蛋白合成相關,BIRC7與細胞凋亡相關,而ABLIM1、CRB2與視網膜發育相關,ABCG1、ABCA9、ABCA12與巨噬細胞膽固醇和磷脂轉運相關。
 圖4
差異基因作用途徑及相互關系模式圖。TβRⅡ. Ⅱ型TGF-β受體;EGR2. 早期生長反應蛋白2;CAMP. 環磷酸腺苷;EGFR. 表皮生長因子受體;HS. 硫酸乙酰肝素;FGF2. 堿性成纖維細胞生長因子2
圖4
差異基因作用途徑及相互關系模式圖。TβRⅡ. Ⅱ型TGF-β受體;EGR2. 早期生長反應蛋白2;CAMP. 環磷酸腺苷;EGFR. 表皮生長因子受體;HS. 硫酸乙酰肝素;FGF2. 堿性成纖維細胞生長因子2
3 討論
玻璃體腔注射抗VEGF藥物可能加劇增生性玻璃體視網膜病變或滲出型老年性黃斑變性患者纖維化的嚴重程度[2];致密玻璃體積血或既往存在牽拉性視網膜脫離(TRD)者注射后TRD程度更為嚴重[4-8]。增生型DR患者經玻璃體腔注射貝伐單抗后視網膜纖維化增加,其纖維血管增生膜中也觀察到纖維化轉變[2, 6]。因此,探索抗VEGF藥物與纖維化蹺板式關系有其必要性。
RNA-seq是利用新一代高通量測序技術對轉錄組進行分析,其在鑒定差異表達基因方面較傳統技術更具優勢[9-10]。本研究體外培養視網膜血管內皮細胞,以重組VEGF刺激細胞來模擬增生型DR中血管內皮細胞的高VEGF生存環境,以VEGF聯合抗VEGF藥物干預細胞來仿效抗VEGF藥物治療后細胞所處的微環境,之后應用RNA-Seq技術對細胞進行全轉錄組測序,獲得生物學大數據。分析發現,兩者之間差異基因的功能涉及分子生物學過程調控及細胞能量代謝、蛋白合成等方面。其中SI與蛋白合成相關,BIRCT、GP1BA與細胞增生凋亡相關,ABLIM1、CRB2與視網膜發育相關。差異基因的功能主要劃分為生物學行為調控、細胞成分及分子功能三大板塊;Notch信號通路、ECM受體通路、MAPK信號通路、TGF-β信號通路、Wnt信號通路表達在兩組細胞間存在差異。
TGF-β在ECM生成過程中發揮關鍵調節作用,是刺激膠原蛋白合成、發生纖維化的基礎[11-13]。不僅如此,TGF-β還可誘導CTGF、血小板衍生生長因子、EGF和FGF發揮作用進一步促進纖維化[14]。TGF-β信號傳導途徑為TGF-β通過結合活性TβRⅡ,導致Smad2和Smad3的絲氨酸磷酸化和TβRⅠ活化,激活的TβRⅠ反過來促進Smad2和Smad3的絲氨酸磷酸化及其與Smad4的結合,促進磷酸化后Smad2和Smad3易位到細胞核以及促纖維化基因的轉錄[15-17]。我們發現的差異基因中CaMK2B、COL3A1、CYGB、PTGER2因與TGF-β信號通路的密切聯系最為引人關注。
CaMK2B及COL3A1是Smad途徑介導的TGF-β下游因子。鈣調蛋白依賴性蛋白激酶Ⅱ是一個普遍存在的Ser/Thr定向蛋白激酶,該基因的產物是一個β鏈[18]。TGF通過誘發有節律的Ca2+振蕩,使細胞內Ca2+增加進而激活CaMKⅡ,隨后活化的CaMKⅡ磷酸化多種靶標,包括Smad2和Smad4,導致ECM基因表達和促纖維化應答[19]。Ⅲ型膠原蛋白被認為具有促纖維化作用,其表達受局部成纖維細胞活性的調節[20]。除此之外,TGF-β1通過Smad信號通路誘導成纖維細胞中Ⅰ型和Ⅲ型膠原蛋白的表達,在誘導膠原蛋白合成的同時,誘導其合成CYGB[12, 21] 。CYGB是最近發現的一種功能尚未確定的六配位球蛋白,在大多數組織中普遍表達[21]。CYGB表達與膠原蛋白合成之間呈正相關,當其表達上調時,膠原蛋白Ⅰ型α1鏈轉錄物和膠原蛋白的表達同時增加,并參與膠原蛋白合成促進纖維化反應[21]。
PTGER2在成纖維細胞中具有自分泌和旁分泌介質的功能,激活上皮細胞中VEGF、CTGF、TGF-β1和白細胞介素(IL)-8等因子表達,影響趨化性募集、增生、基質產生和基質重塑等過程[22-25]。PGE2與不同的轉導機制如細胞內CAMP減少和細胞內鈣增加有關,通過與這些受體的相互作用,PGE2介導各種生理反應[25]。一方面PTGER2激活通過RAS/MEK/細胞外信號調節激酶(ERK)信號通路誘導CTGF基因。CTGF是涉及多種細胞過程的分泌蛋白,包括血管生成、骨骼發生和傷口愈合,并且該纖維蛋白的基因在纖維化組織中的傷口愈合期間被表達[26]。另一方面,PTGER2與腺苷酸環化酶偶聯,在激活時產生CAMP,隨后通過蛋白激酶A和ERK途徑誘導TGF-β1基因表達,TGF-β1刺激PGE2釋放,PGE2顯著誘導FGF2的表達[26-29]。FGF2促進成纖維細胞和多種其他細胞類型的增生、分化和遷移,并影響包括血管生成、組織重塑、傷口愈合和腫瘤生長在內的一系列過程[30-33]。FGF2在創傷修復和再生階段具有突出作用。在急性傷口愈合中,FGF2通過刺激成纖維細胞運動和膠原酶產生以促進細胞外基質重塑,促進肉芽組織形成,并在再上皮化期間增加角質形成細胞運動性而促進組織修復。同樣調控FGF2表達的有HS6ST2。HS6ST2是HS磺基轉移酶基因家族的成員,其催化硫酸鹽轉移至HS,HS硫酸化有助于通過HS依賴性HB-EGF/EGFR誘導細胞中FGF2、IL-6和IL-8的表達,從而影響體內外的內皮細胞功能[34]。HS涉及各種細胞過程,如器官發生或腫瘤發生也涉及胚胎干細胞分化和特發性肺纖維化[25, 35, 36]。
綜上所述,抗VEGF藥物對視網膜纖維化的影響是多層次、多方面、多靶點的復雜過程,其通過調節多個作用途徑及相關基因的表達影響視網膜纖維化,因此設定具有時間依賴和濃度依賴的實驗分組,易于模擬動態梯度漸變過程,完整詮釋翹板關系。本研究通過RNA轉錄組測序分析,為進一步完善蹺板式關鍵調控基因及相關調控通路提供了數據支持,為減輕抗VEGF藥物治療后視網膜纖維化提供相應切入點;后續應再完善相關實驗,以期進一步探尋血管新生和纖維化之間漸變過程的調控作用機制。