引用本文: 宋天玲, 孟旭霞, 曹博雯, 郭慶敏, 周賢慧, 胡迭. 尾靜脈注射人臍帶間充質干細胞對早期糖尿病大鼠視網膜神經細胞凋亡及膠質纖維酸性蛋白表達的影響. 中華眼底病雜志, 2018, 34(2): 164-167. doi: 10.3760/cma.j.issn.1005-1015.2018.02.013 復制
近年研究發現,視網膜神經細胞凋亡與膠質細胞反應性活化早于微血管病變的發生[1]。在未出現視網膜微血管病變的糖尿病(DM)患者已出現視網膜電圖異常改變、暗適應能力下降、視野缺損等視功能的下降[2],提示DM早期即有視網膜神經細胞的損傷。神經細胞凋亡與活化的程度可以反應視網膜損傷的程度,膠質纖維酸性蛋白(GFAP)作為膠質細胞的特異性蛋白,其表達及分布可直接說明膠質細胞的活化狀態。間充質干細胞(MSC)作為一類具有自我更新及分化等功能的基質細胞,是目前多學科研究的焦點。已有研究結果證實MSC可以增加DM視網膜病變(DR)動物模型血視網膜屏障的完整性[3]。但關于MSC在DR神經損傷方面的研究較少。人臍帶MSC (hUCMSC)作為一種重要的MSC,因其取材方便、易于擴增、不存在倫理學問題而廣泛應用于研究中。因此,本研究通過建立DM大鼠模型,應用hUCMSC進行干預,觀察hUCMSC對DM大鼠視網膜神經細胞凋亡及GFAP表達變化的影響,初步探討其對早期DR神經細胞損傷及膠質細胞活化的影響。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠70只,體重約200 g,清潔級;由青島市動物中心提供。實驗遵循國家科學技術委員會發布的《實驗動物管理條例》。標準顆粒飼料喂養,不限食水,室內通風良好,室溫18~22 ℃,12 h光照交替,保持墊料干燥。hUCMSC由干細胞與生物診療國家地方聯合工程研究中心提供。
隨機數字表法將大鼠分為正常對照組(A組)、DM組,分別為12、58只。DM組大鼠禁食12 h后,按60 mg/kg劑量單次腹腔注射2%鏈脲佐菌素(溶解于0.1 mol/L的枸櫞酸鈉溶液)誘導DM動物模型。72 h后測空腹血糖≥16.7 mmol/L為DM造模成功。繼續高糖、高脂飼養5個月,再采用隨機數字表法將DM組大鼠隨機分為DM空白對照組(B組)、磷酸鹽緩沖液(PBS)組(C組)、hUCMSC干預組(D組)。C、D組大鼠尾靜脈分別注射PBS、1×106 hUCMSC 1 ml。繼續飼養1個月,剔除死亡或血糖恢復大鼠,最終每組12只大鼠納入研究。A組大鼠腹腔注射等體積枸櫞酸鈉溶液。B組大鼠不做任何處理。實驗期間定期監測大鼠血糖變化,使血糖維持在成模要求的范圍。6個月后處死全部大鼠,取眼球組織進行后續實驗。
采用dUTP缺口末端標記(TUNEL)法觀察大鼠視網膜細胞凋亡情況。石蠟切片常規脫蠟、水化,Proteinase K室溫處理組織15~30 min,PBS漂洗2次后加入TUNEL反應混合溶液,37 ℃孵育60 min。光學顯微鏡觀察、拍照。凋亡細胞的細胞核呈棕色或棕褐色,非凋亡細胞的細胞核呈藍色。
采用免疫組織化學法檢測大鼠視網膜中GFAP蛋白的表達。石蠟切片常規脫蠟、水化后,正常山羊血清封閉,一抗兔抗GFAP,二抗生物素化羊抗兔IgG,二氨基聯苯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡下觀察。以血管內皮細胞膜呈棕黃色為陽性表達。
采用蛋白免疫印跡法(Western blot)檢測大鼠視網膜中GFAP蛋白的表達。大鼠視網膜組織裂解、勻漿,離心后取上清,二喹啉甲酸蛋白定量試劑盒檢測蛋白濃度。蛋白變性,上樣,十二烷基硫酸鈉聚丙烯酰氨凝膠電泳,4 ℃恒流電轉至聚偏二氟乙烯膜上,5%脫脂牛奶室溫封閉1.5 h,GFAP(兔抗大鼠)一抗1:100,4 ℃孵育過夜,洗膜,加入辣根過氧化物酶(HRP)標記的羊抗兔IgG(1:5000),搖床室溫孵育1 h,洗膜,顯色,Image Lab凝膠成像系統成像。以β-肌動蛋白作為內參照,進行灰度分析。
采用SPSS 22.0統計軟件進行統計學分析處理。所有實驗數據以均數±標準差(
 )表示。多組間比較采用單因素方差分析,組間兩兩比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
)表示。多組間比較采用單因素方差分析,組間兩兩比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
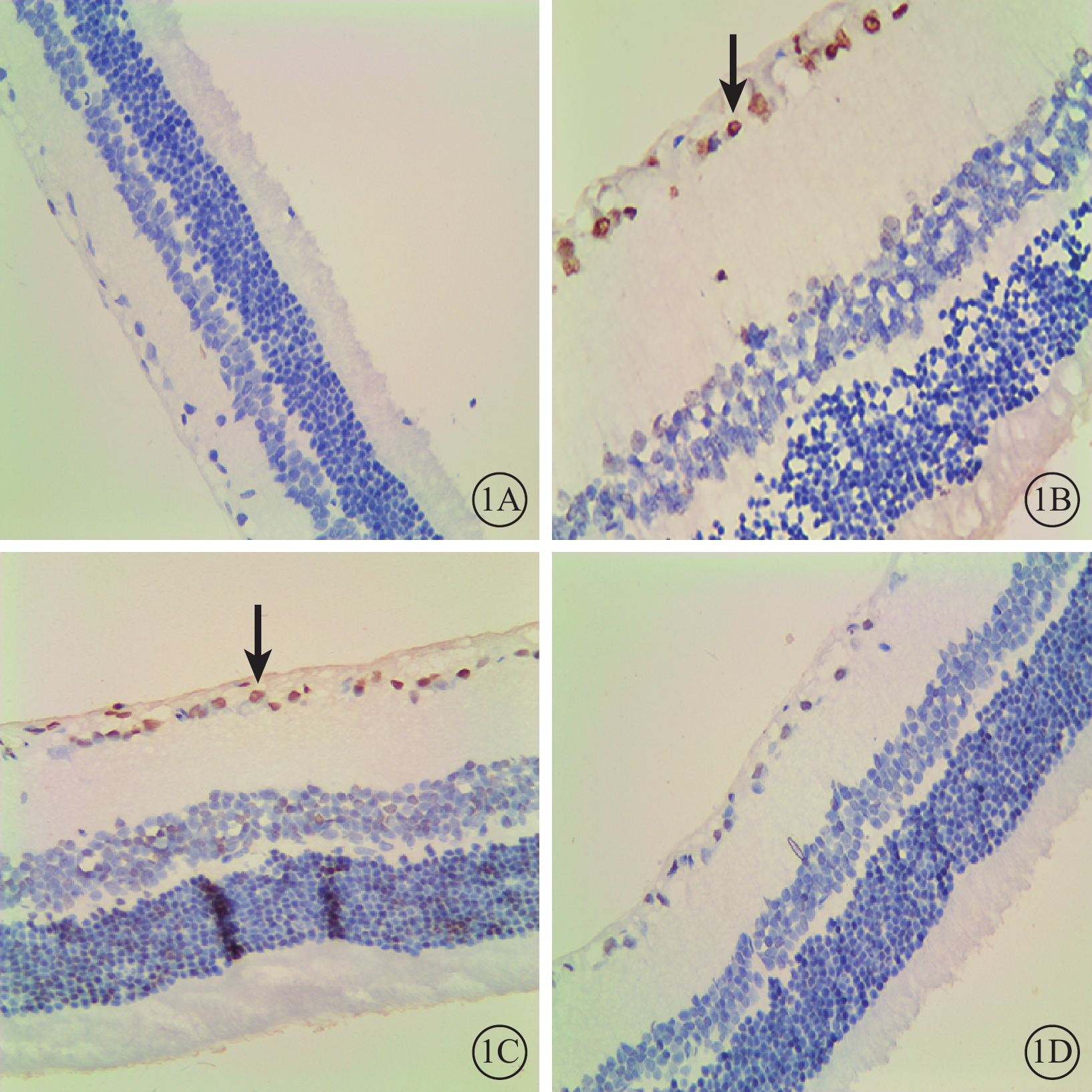
光學顯微鏡觀察結果顯示,A組大鼠視網膜各層細胞排列整齊,未見凋亡細胞(圖1A);B、C組大鼠視網膜神經節細胞層(GCL)、內核層(INL)均可見較多凋亡細胞,GCL水腫,各層細胞排列紊亂(圖1B,1C);D組大鼠視網膜GCL偶見凋亡細胞、水腫明顯減輕,各層細胞排列較整齊(圖1D)。
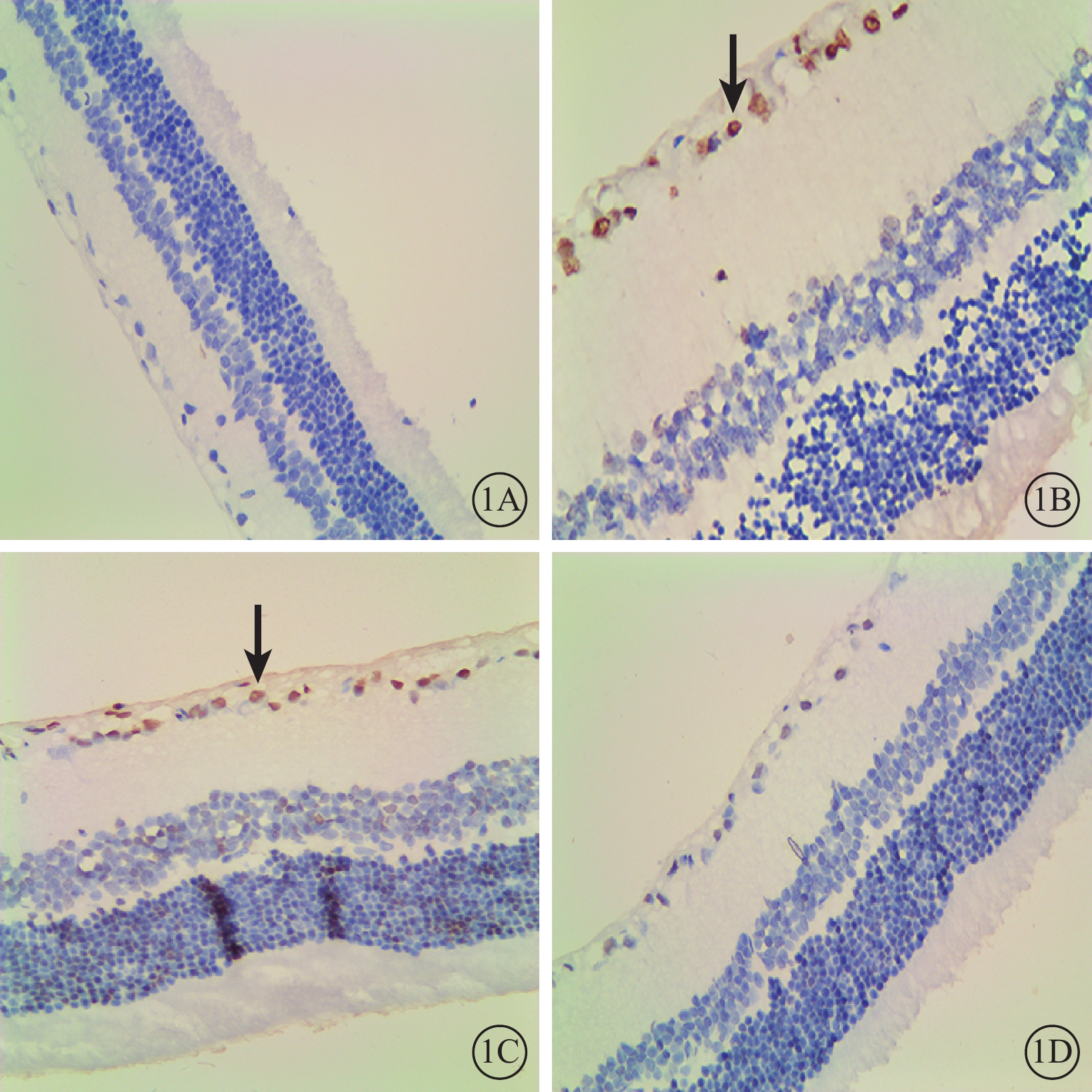 圖1
各組大鼠視網膜組織光學顯微鏡像。1A~1D.分別為A、B、C、D組。A組大鼠視網膜未見凋亡細胞;B、C組大鼠內層視網膜可見多量凋亡細胞(黑箭);D組大鼠視網膜凋亡細胞較B、C組明顯減少 DAB ×40
圖1
各組大鼠視網膜組織光學顯微鏡像。1A~1D.分別為A、B、C、D組。A組大鼠視網膜未見凋亡細胞;B、C組大鼠內層視網膜可見多量凋亡細胞(黑箭);D組大鼠視網膜凋亡細胞較B、C組明顯減少 DAB ×40
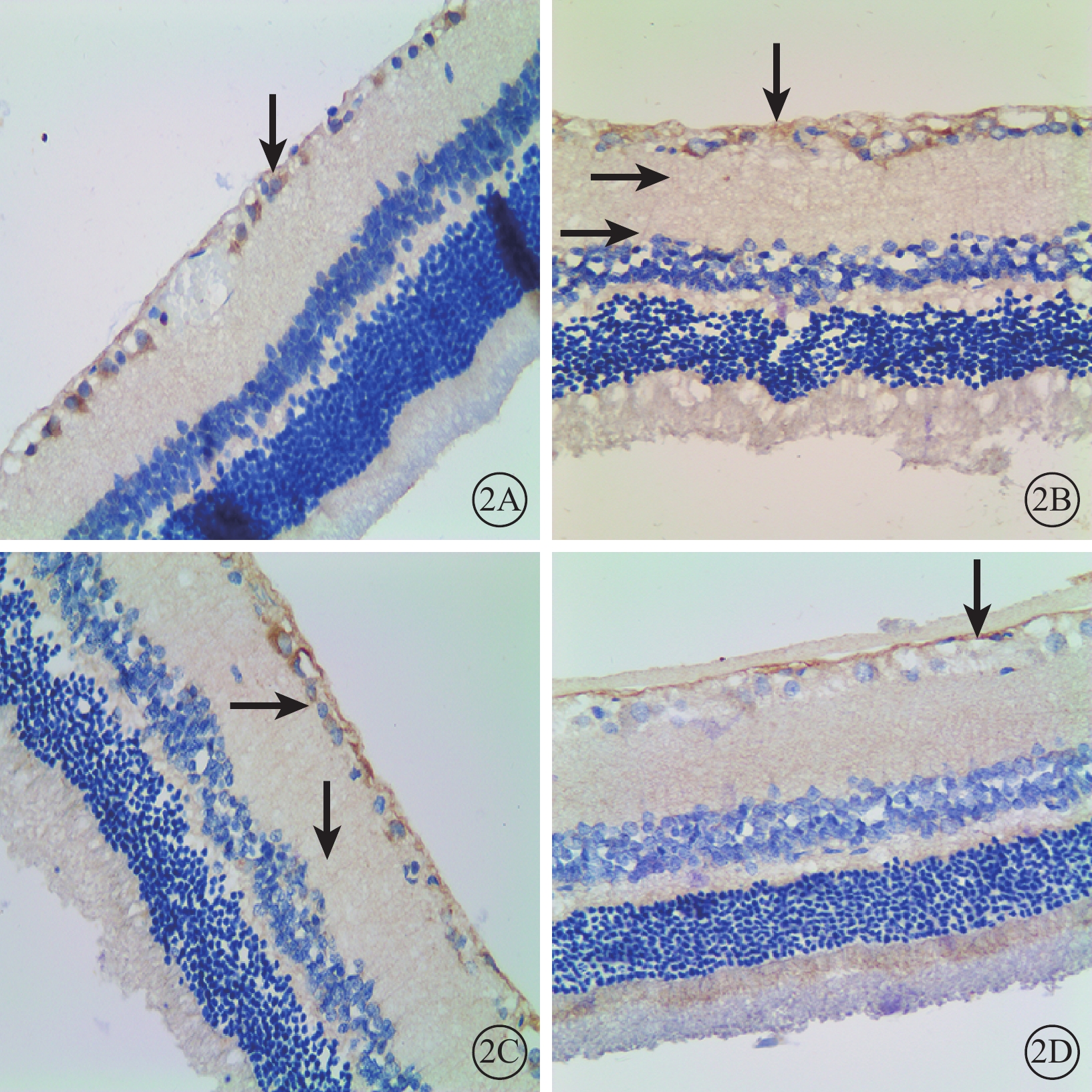
免疫組織化學染色結果顯示,A組大鼠視網膜中GFAP陽性表達主要見于GCL和神經纖維層(RNFL),呈棕黃色顆粒著染,色淡(圖2A);B、C組大鼠視網膜GFAP陽性表達貫穿于內叢狀層(IPL)、INL,RNFL、GCL棕黃色顆粒著染加深(圖2B,2C);D組大鼠視網膜中GFAP陽性表達范圍僅見于RNFL、GCL,IPL未見陽性細胞突起(圖2D)。
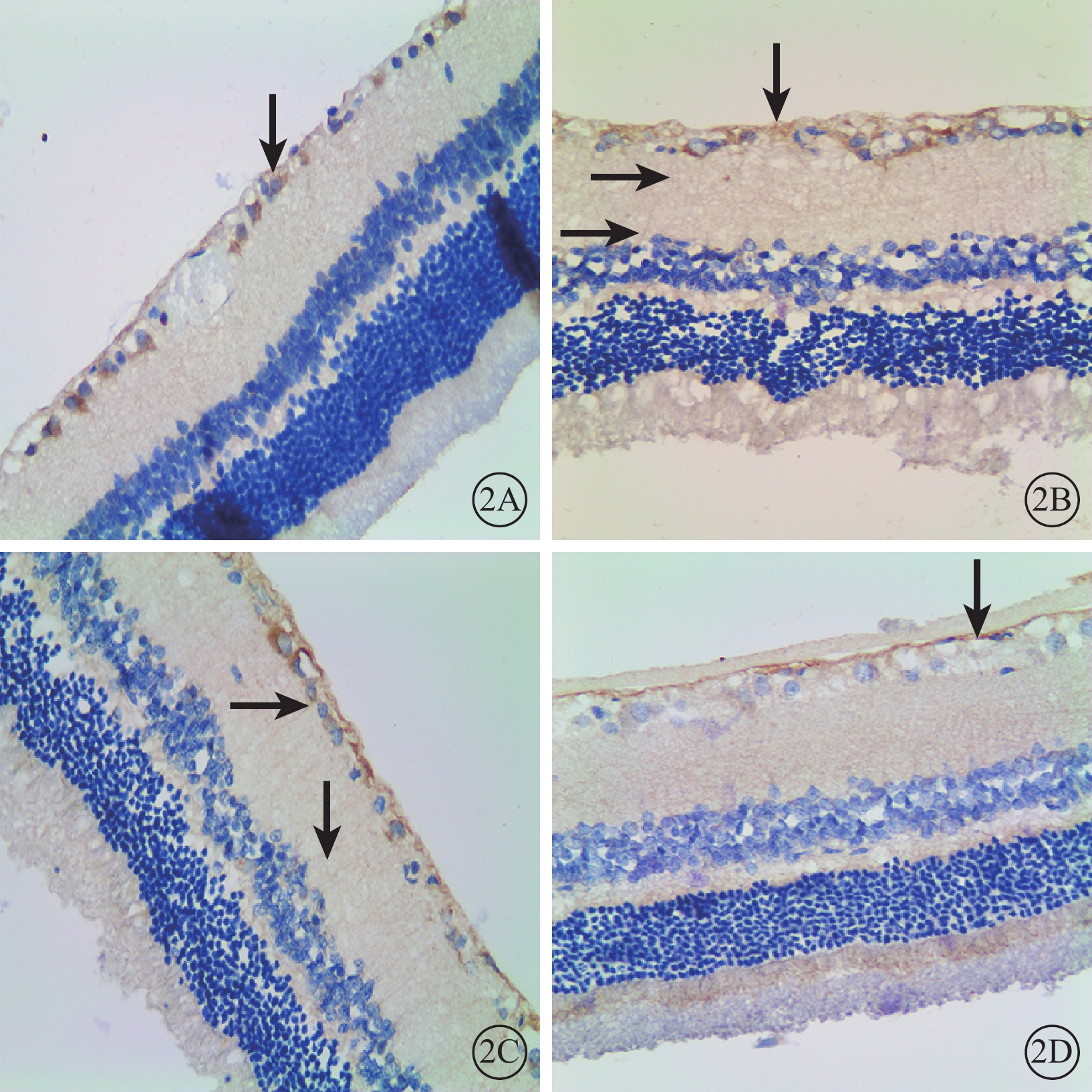 圖2
各組大鼠視網膜免疫組織化學染色像。2A~2D.分別為A、B、C、D組。A組大鼠視網膜中GFAP蛋白陽性細胞僅見于RNFL、GCL(黑箭);B、C組大鼠視網膜中GFAP蛋白棕黃色顆粒著染加深,且成絲狀突起貫穿于IPL、INL(黑箭);D組大鼠視網膜中GFAP蛋白陽性細胞(黑箭)表達同A組基本一致 DAB ×40
圖2
各組大鼠視網膜免疫組織化學染色像。2A~2D.分別為A、B、C、D組。A組大鼠視網膜中GFAP蛋白陽性細胞僅見于RNFL、GCL(黑箭);B、C組大鼠視網膜中GFAP蛋白棕黃色顆粒著染加深,且成絲狀突起貫穿于IPL、INL(黑箭);D組大鼠視網膜中GFAP蛋白陽性細胞(黑箭)表達同A組基本一致 DAB ×40
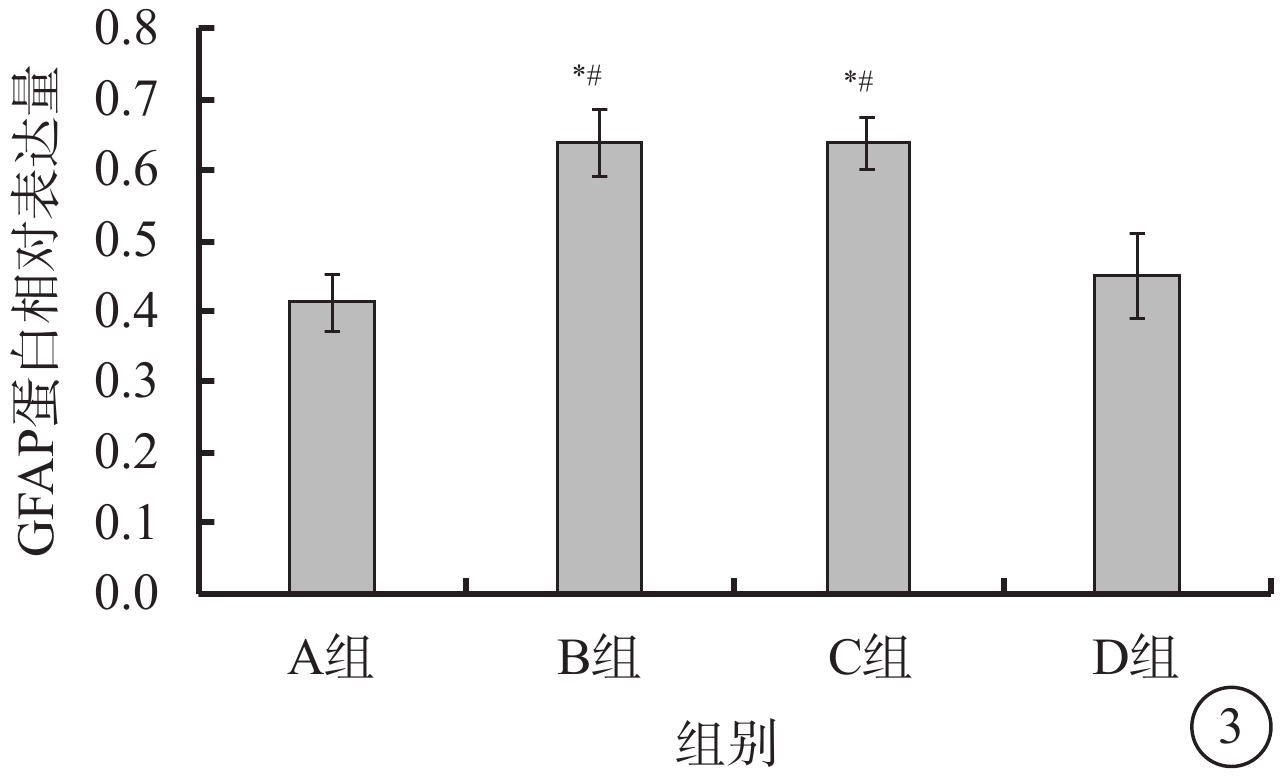
Western blot檢測結果顯示,A組大鼠視網膜中GFAP蛋白呈低表達;B、C組大鼠視網膜中GFAP蛋白表達明顯增加;D組大鼠視網膜中GFAP蛋白表達較B、C組明顯降低,差異有統計學意義(F=79.635,P<0.05)(圖3)。
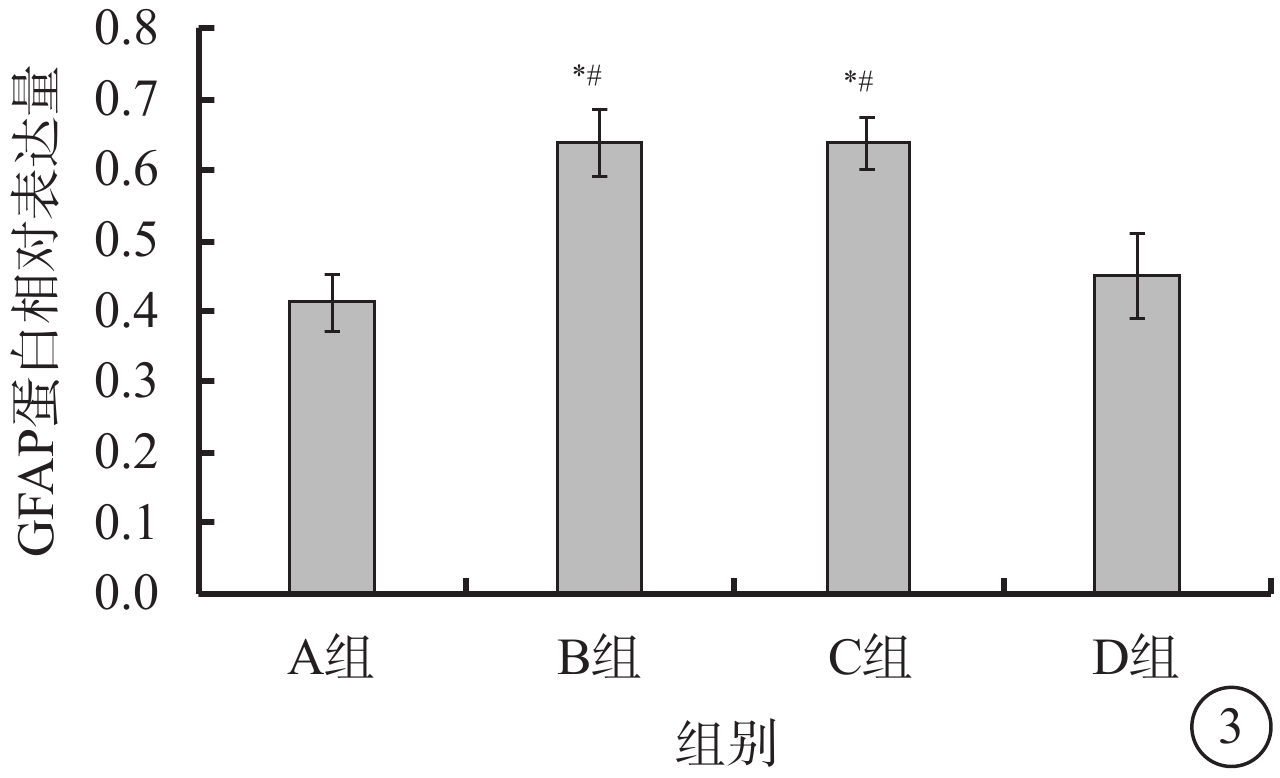 圖3
各組大鼠視網膜GFAP蛋白表達。*與A組比較,P<0.05;#與D組比較,P<0.05
圖3
各組大鼠視網膜GFAP蛋白表達。*與A組比較,P<0.05;#與D組比較,P<0.05
3 討論
既往研究發現,DR患者早期即已出現視網膜神經節細胞凋亡和INL的變薄[4]。另有研究發現,7.5個月齡DM大鼠視網膜變薄,IPL和INL厚度均有不同程度減少,且神經節細胞數量也出現降低;由此推斷INL變薄可能與神經元及膠質細胞的凋亡有關[5]。本研究也觀察到類似現象,5個月齡DM大鼠視網膜神經上皮層內可見細胞凋亡,尤其在GCL內可見大量凋亡細胞,而正常對照組大鼠視網膜神經上皮層幾乎未見凋亡細胞,由此可見早期DM大鼠已經出現視網膜神經細胞的凋亡。而視網膜神經細胞的凋亡可以導致視功能下降。
膠質細胞是神經視網膜的重要組成部分,具有支持、營養、保護視網膜神經元的作用,并直接與神經元進行信號傳遞,參與視覺信息加工過程[6]。GFAP作為一種中間絲纖維蛋白,正常大鼠視網膜中僅星形膠質細胞表達GFAP;炎癥刺激等損傷因素存在時Müller細胞反應性膠質化,表現為終板開始表達GFAP[6],并且隨著損傷刺激的持續作用,GFAP在Müller細胞中的表達量逐漸增加。可見GFAP表達增加可作為膠質細胞活化的直接指標。膠質細胞反應性活化是一把“雙刃劍”。一方面,早期活化的膠質細胞通過多種機制保護神經細胞;另一方面,長時間膠質細胞活化會導致特定功能蛋白下調,造成細胞水腫、神經元過度興奮和谷氨酸中毒等,而后者是導致神經元變性的主要原因[7]。本研究結果發現,早期DM大鼠視網膜膠質細胞明顯活化,表現為貫穿于視網膜神經上皮層的膠質細胞突起強表達GFAP。表明早期DM大鼠的視網膜組織中已經出現膠質細胞功能的改變。
hUCMSC是取自臍帶華通膠中分離培養的成體干細胞,具有干細胞的一般特點,如向多胚層細胞分化及向組織損傷部位定向遷移并促進損傷修復、抗炎以及神經營養等功能[8]。具有取材方便、免疫原性低、易擴增等優點[9]。本研究結果顯示,隨著DM病程進展,視網膜神經細胞凋亡明顯,膠質細胞著染增強,D組大鼠尾靜脈注射hUCMSC 1個月后,神經細胞凋亡較B組明顯減少,GFAP陽性細胞著染明顯減輕,Western blot結果同樣顯示GFAP表達減少,證明hUCMSC對DM大鼠視網膜神經細胞具有保護作用,具體表現為抑制神經細胞凋亡與膠質細胞活化。目前關于干細胞治療DR的具體作用機制尚不清楚,有研究發現經尾靜脈注射MSC,可在胰島、視網膜等組織器官中檢測到干細胞標志物[3, 10]。我們推測hUCMSC可能在體內微環境誘導下歸巢到受損的視網膜、胰島等組織中,參與干細胞歸巢過程的因子可能包括趨化因子、黏附分子等[11]。 國內外多項研究結果證實,在特定條件下MSC可以轉化為神經元樣細胞[12, 13]。也有研究結果證實hUCMSC及其體外誘導分化得到的神經干細胞(NSC)能夠分泌神經營養因子[14, 15]。因此,我們推測hUCMSC還可能通過歸巢到受損的視網膜后,在體內環境誘導下,分化為神經干細胞,并分泌神經營養因子,營養及修復視網膜神經細胞及膠質細胞,從而抑制甚至逆轉DR進展。此外,MSC還有改善受損組織微環境,協助受損組織釋放抗炎、抗凋亡分子的作用[16]。
Zhang等[15]觀察到通過玻璃體腔注射hUCMSC可以對早期DM大鼠視網膜神經退行性病變起到治療作用,而本研究采用尾靜脈注射hUCMSC也得到類似結果。盡管目前已有針對蛋白激酶C活化、氧化應激等的靶向生化治療機制,但均不能消除致病因素高血糖。高血糖環境中,細胞內氧自由基增多,導致氧化應激級聯反應增強,通過內源性途徑誘發細胞發生凋亡,尾靜脈干預可以降低DM大鼠血糖[17],從病因上發揮治療作用。
近年干細胞已應用于部分疾病的臨床治療[18, 19]。而對于DR的治療仍處于實驗研究階段,本研究通過觀察hUCMSC對早期DM大鼠視網膜神經細胞凋亡與膠質細胞活化的影響,初步探討其對早期DR的干預作用,但具體作用機制還有待進一步研究。
近年研究發現,視網膜神經細胞凋亡與膠質細胞反應性活化早于微血管病變的發生[1]。在未出現視網膜微血管病變的糖尿病(DM)患者已出現視網膜電圖異常改變、暗適應能力下降、視野缺損等視功能的下降[2],提示DM早期即有視網膜神經細胞的損傷。神經細胞凋亡與活化的程度可以反應視網膜損傷的程度,膠質纖維酸性蛋白(GFAP)作為膠質細胞的特異性蛋白,其表達及分布可直接說明膠質細胞的活化狀態。間充質干細胞(MSC)作為一類具有自我更新及分化等功能的基質細胞,是目前多學科研究的焦點。已有研究結果證實MSC可以增加DM視網膜病變(DR)動物模型血視網膜屏障的完整性[3]。但關于MSC在DR神經損傷方面的研究較少。人臍帶MSC (hUCMSC)作為一種重要的MSC,因其取材方便、易于擴增、不存在倫理學問題而廣泛應用于研究中。因此,本研究通過建立DM大鼠模型,應用hUCMSC進行干預,觀察hUCMSC對DM大鼠視網膜神經細胞凋亡及GFAP表達變化的影響,初步探討其對早期DR神經細胞損傷及膠質細胞活化的影響。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠70只,體重約200 g,清潔級;由青島市動物中心提供。實驗遵循國家科學技術委員會發布的《實驗動物管理條例》。標準顆粒飼料喂養,不限食水,室內通風良好,室溫18~22 ℃,12 h光照交替,保持墊料干燥。hUCMSC由干細胞與生物診療國家地方聯合工程研究中心提供。
隨機數字表法將大鼠分為正常對照組(A組)、DM組,分別為12、58只。DM組大鼠禁食12 h后,按60 mg/kg劑量單次腹腔注射2%鏈脲佐菌素(溶解于0.1 mol/L的枸櫞酸鈉溶液)誘導DM動物模型。72 h后測空腹血糖≥16.7 mmol/L為DM造模成功。繼續高糖、高脂飼養5個月,再采用隨機數字表法將DM組大鼠隨機分為DM空白對照組(B組)、磷酸鹽緩沖液(PBS)組(C組)、hUCMSC干預組(D組)。C、D組大鼠尾靜脈分別注射PBS、1×106 hUCMSC 1 ml。繼續飼養1個月,剔除死亡或血糖恢復大鼠,最終每組12只大鼠納入研究。A組大鼠腹腔注射等體積枸櫞酸鈉溶液。B組大鼠不做任何處理。實驗期間定期監測大鼠血糖變化,使血糖維持在成模要求的范圍。6個月后處死全部大鼠,取眼球組織進行后續實驗。
采用dUTP缺口末端標記(TUNEL)法觀察大鼠視網膜細胞凋亡情況。石蠟切片常規脫蠟、水化,Proteinase K室溫處理組織15~30 min,PBS漂洗2次后加入TUNEL反應混合溶液,37 ℃孵育60 min。光學顯微鏡觀察、拍照。凋亡細胞的細胞核呈棕色或棕褐色,非凋亡細胞的細胞核呈藍色。
采用免疫組織化學法檢測大鼠視網膜中GFAP蛋白的表達。石蠟切片常規脫蠟、水化后,正常山羊血清封閉,一抗兔抗GFAP,二抗生物素化羊抗兔IgG,二氨基聯苯胺(DAB)顯色,蘇木精復染,封片,光學顯微鏡下觀察。以血管內皮細胞膜呈棕黃色為陽性表達。
采用蛋白免疫印跡法(Western blot)檢測大鼠視網膜中GFAP蛋白的表達。大鼠視網膜組織裂解、勻漿,離心后取上清,二喹啉甲酸蛋白定量試劑盒檢測蛋白濃度。蛋白變性,上樣,十二烷基硫酸鈉聚丙烯酰氨凝膠電泳,4 ℃恒流電轉至聚偏二氟乙烯膜上,5%脫脂牛奶室溫封閉1.5 h,GFAP(兔抗大鼠)一抗1:100,4 ℃孵育過夜,洗膜,加入辣根過氧化物酶(HRP)標記的羊抗兔IgG(1:5000),搖床室溫孵育1 h,洗膜,顯色,Image Lab凝膠成像系統成像。以β-肌動蛋白作為內參照,進行灰度分析。
采用SPSS 22.0統計軟件進行統計學分析處理。所有實驗數據以均數±標準差(
 )表示。多組間比較采用單因素方差分析,組間兩兩比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
)表示。多組間比較采用單因素方差分析,組間兩兩比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
光學顯微鏡觀察結果顯示,A組大鼠視網膜各層細胞排列整齊,未見凋亡細胞(圖1A);B、C組大鼠視網膜神經節細胞層(GCL)、內核層(INL)均可見較多凋亡細胞,GCL水腫,各層細胞排列紊亂(圖1B,1C);D組大鼠視網膜GCL偶見凋亡細胞、水腫明顯減輕,各層細胞排列較整齊(圖1D)。
 圖1
各組大鼠視網膜組織光學顯微鏡像。1A~1D.分別為A、B、C、D組。A組大鼠視網膜未見凋亡細胞;B、C組大鼠內層視網膜可見多量凋亡細胞(黑箭);D組大鼠視網膜凋亡細胞較B、C組明顯減少 DAB ×40
圖1
各組大鼠視網膜組織光學顯微鏡像。1A~1D.分別為A、B、C、D組。A組大鼠視網膜未見凋亡細胞;B、C組大鼠內層視網膜可見多量凋亡細胞(黑箭);D組大鼠視網膜凋亡細胞較B、C組明顯減少 DAB ×40
免疫組織化學染色結果顯示,A組大鼠視網膜中GFAP陽性表達主要見于GCL和神經纖維層(RNFL),呈棕黃色顆粒著染,色淡(圖2A);B、C組大鼠視網膜GFAP陽性表達貫穿于內叢狀層(IPL)、INL,RNFL、GCL棕黃色顆粒著染加深(圖2B,2C);D組大鼠視網膜中GFAP陽性表達范圍僅見于RNFL、GCL,IPL未見陽性細胞突起(圖2D)。
 圖2
各組大鼠視網膜免疫組織化學染色像。2A~2D.分別為A、B、C、D組。A組大鼠視網膜中GFAP蛋白陽性細胞僅見于RNFL、GCL(黑箭);B、C組大鼠視網膜中GFAP蛋白棕黃色顆粒著染加深,且成絲狀突起貫穿于IPL、INL(黑箭);D組大鼠視網膜中GFAP蛋白陽性細胞(黑箭)表達同A組基本一致 DAB ×40
圖2
各組大鼠視網膜免疫組織化學染色像。2A~2D.分別為A、B、C、D組。A組大鼠視網膜中GFAP蛋白陽性細胞僅見于RNFL、GCL(黑箭);B、C組大鼠視網膜中GFAP蛋白棕黃色顆粒著染加深,且成絲狀突起貫穿于IPL、INL(黑箭);D組大鼠視網膜中GFAP蛋白陽性細胞(黑箭)表達同A組基本一致 DAB ×40
Western blot檢測結果顯示,A組大鼠視網膜中GFAP蛋白呈低表達;B、C組大鼠視網膜中GFAP蛋白表達明顯增加;D組大鼠視網膜中GFAP蛋白表達較B、C組明顯降低,差異有統計學意義(F=79.635,P<0.05)(圖3)。
 圖3
各組大鼠視網膜GFAP蛋白表達。*與A組比較,P<0.05;#與D組比較,P<0.05
圖3
各組大鼠視網膜GFAP蛋白表達。*與A組比較,P<0.05;#與D組比較,P<0.05
3 討論
既往研究發現,DR患者早期即已出現視網膜神經節細胞凋亡和INL的變薄[4]。另有研究發現,7.5個月齡DM大鼠視網膜變薄,IPL和INL厚度均有不同程度減少,且神經節細胞數量也出現降低;由此推斷INL變薄可能與神經元及膠質細胞的凋亡有關[5]。本研究也觀察到類似現象,5個月齡DM大鼠視網膜神經上皮層內可見細胞凋亡,尤其在GCL內可見大量凋亡細胞,而正常對照組大鼠視網膜神經上皮層幾乎未見凋亡細胞,由此可見早期DM大鼠已經出現視網膜神經細胞的凋亡。而視網膜神經細胞的凋亡可以導致視功能下降。
膠質細胞是神經視網膜的重要組成部分,具有支持、營養、保護視網膜神經元的作用,并直接與神經元進行信號傳遞,參與視覺信息加工過程[6]。GFAP作為一種中間絲纖維蛋白,正常大鼠視網膜中僅星形膠質細胞表達GFAP;炎癥刺激等損傷因素存在時Müller細胞反應性膠質化,表現為終板開始表達GFAP[6],并且隨著損傷刺激的持續作用,GFAP在Müller細胞中的表達量逐漸增加。可見GFAP表達增加可作為膠質細胞活化的直接指標。膠質細胞反應性活化是一把“雙刃劍”。一方面,早期活化的膠質細胞通過多種機制保護神經細胞;另一方面,長時間膠質細胞活化會導致特定功能蛋白下調,造成細胞水腫、神經元過度興奮和谷氨酸中毒等,而后者是導致神經元變性的主要原因[7]。本研究結果發現,早期DM大鼠視網膜膠質細胞明顯活化,表現為貫穿于視網膜神經上皮層的膠質細胞突起強表達GFAP。表明早期DM大鼠的視網膜組織中已經出現膠質細胞功能的改變。
hUCMSC是取自臍帶華通膠中分離培養的成體干細胞,具有干細胞的一般特點,如向多胚層細胞分化及向組織損傷部位定向遷移并促進損傷修復、抗炎以及神經營養等功能[8]。具有取材方便、免疫原性低、易擴增等優點[9]。本研究結果顯示,隨著DM病程進展,視網膜神經細胞凋亡明顯,膠質細胞著染增強,D組大鼠尾靜脈注射hUCMSC 1個月后,神經細胞凋亡較B組明顯減少,GFAP陽性細胞著染明顯減輕,Western blot結果同樣顯示GFAP表達減少,證明hUCMSC對DM大鼠視網膜神經細胞具有保護作用,具體表現為抑制神經細胞凋亡與膠質細胞活化。目前關于干細胞治療DR的具體作用機制尚不清楚,有研究發現經尾靜脈注射MSC,可在胰島、視網膜等組織器官中檢測到干細胞標志物[3, 10]。我們推測hUCMSC可能在體內微環境誘導下歸巢到受損的視網膜、胰島等組織中,參與干細胞歸巢過程的因子可能包括趨化因子、黏附分子等[11]。 國內外多項研究結果證實,在特定條件下MSC可以轉化為神經元樣細胞[12, 13]。也有研究結果證實hUCMSC及其體外誘導分化得到的神經干細胞(NSC)能夠分泌神經營養因子[14, 15]。因此,我們推測hUCMSC還可能通過歸巢到受損的視網膜后,在體內環境誘導下,分化為神經干細胞,并分泌神經營養因子,營養及修復視網膜神經細胞及膠質細胞,從而抑制甚至逆轉DR進展。此外,MSC還有改善受損組織微環境,協助受損組織釋放抗炎、抗凋亡分子的作用[16]。
Zhang等[15]觀察到通過玻璃體腔注射hUCMSC可以對早期DM大鼠視網膜神經退行性病變起到治療作用,而本研究采用尾靜脈注射hUCMSC也得到類似結果。盡管目前已有針對蛋白激酶C活化、氧化應激等的靶向生化治療機制,但均不能消除致病因素高血糖。高血糖環境中,細胞內氧自由基增多,導致氧化應激級聯反應增強,通過內源性途徑誘發細胞發生凋亡,尾靜脈干預可以降低DM大鼠血糖[17],從病因上發揮治療作用。
近年干細胞已應用于部分疾病的臨床治療[18, 19]。而對于DR的治療仍處于實驗研究階段,本研究通過觀察hUCMSC對早期DM大鼠視網膜神經細胞凋亡與膠質細胞活化的影響,初步探討其對早期DR的干預作用,但具體作用機制還有待進一步研究。