引用本文: 田芳, 李文博, 黃亮瑜, 高美子, 趙今稚, 胡博杰, 張曉敏, 李筱榮, 東莉潔. 聚嘧啶束結合蛋白相關剪接因子對過氧化氫誘導下視網膜色素上皮細胞凋亡的影響. 中華眼底病雜志, 2018, 34(2): 159-163. doi: 10.3760/cma.j.issn.1005-1015.2018.02.012 復制
氧化應激是指機體在遭受各種有害刺激時,體內高活性分子如活性氧(ROS)產生過多引發的一系列細胞毒效應,主要表現為DNA氧化損傷及蛋白質的表達異常[1]。視網膜色素上皮( RPE)細胞具有吞噬降解光感受器細胞外節段、參與視循環、轉運和分泌營養物質、清除自由基等功能,因此RPE細胞對維持視網膜的穩態平衡發揮重要的作用[2]。隨著年齡增長RPE細胞因吸收眼內散射光及吞噬作用而產生大量ROS,極易誘發氧化應激反應的發生,導致RPE細胞遭受氧化損傷。聚嘧啶束結合蛋白相關剪接因子(PSF)是一種多功能蛋白[3, 4]。我們課題組前期研究發現PSF通過抑制RPE細胞磷脂酰肌醇3激酶(PI3K)/絲氨酸-蘇氨酸蛋白(Akt)激酶信號通路的活化,從而抑制血管內皮生長因子(VEGF)的表達[5]。過氧化氫(H2O2)誘導的RPE細胞缺氧是常用的一種體外氧化應激模型[6, 7],本研究將PSF蛋白引入RPE細胞氧化應激模型,觀察PSF蛋白對RPE氧化損傷的影響以及潛在機制。現將結果報道如下。
1 材料和方法
1.1 材料
人RPE細胞株(ARPE-19細胞,廣州吉妮歐生物科技有限公司);pEGFP-PSF真核表達質粒由本實驗室自行構建[8]。噻唑藍(MTT)(北京索萊寶科技有限公司);H2O2溶液、2’,7’-二氯熒光素二乙酸酯(DCFH-DA)、細胞凋亡檢測試劑盒(美國Sigma公司);轉染試劑脂質體2000(美國Invitrogen公司);LIVE/DEAD?細胞活性/細胞毒性檢測試劑盒(美國Thermo公司)。
1.2 方法
將ARPE-19細胞爬片于已預先放置蓋玻片的24孔細胞培養板中,共12孔;待細胞融合度約80%時,將細胞分為正常細胞組、損傷組(N+H2O2組)、空載體對照組(Vec+H2O2組)、PSF高表達組(PSF+H2O2組)。應用脂質體2000將pEGFP空載體、pEGFP-PSF真核表達質粒分別導入Vec+H2O2組、PSF+H2O2組,N+H2O2組僅作轉染處理,正常細胞組為常規培養細胞。細胞轉染24 h后,各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,磷酸鹽緩沖液(PBS)洗3次,3 min/次;4%多聚甲醛室溫固定10 min,PBS洗2次,1 min/次;0.5% TritonX-100/PBS破膜室溫5 min,PBS洗2次,1 min/次;蘇木精-伊紅(HE)染色;酒精逐級脫水,二甲苯透明,中性樹膠封片。光學顯微鏡下觀察各組細胞形態。
蛋白免疫印跡法(Western blot)檢測pEGFP-PSF真核表達質粒轉染效果。接種6×105個/孔ARPE-19細胞于1 ml培養體系的6孔細胞培養板中,待細胞匯合度達到70%左右,將細胞分為正常細胞組、Vec+H2O2組、PSF+H2O2組。收集各組全細胞提取物,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離蛋白復合物,將PSF蛋白轉至聚偏二氟乙烯膜。5%脫脂牛奶室溫封閉1 h,一抗4 ℃孵育過夜,1倍洗膜緩沖液(TBST)洗膜3次,10 min/次;辣根過氧化物酶標記的二抗繼續孵育1 h,1倍TBST洗膜3次,10 min/次;增強化學發光檢測試劑盒發光顯影。以甘油醛脫氫酶(GAPDH)為內參照,檢測各組細胞中PSF蛋白表達量。
MTT法定量測定細胞活性。將ARPE-19細胞接種于96孔細胞培養板中,共12孔。待細胞融合度約80%時,將細胞分為N+H2O2組、Vec+H2O2組、PSF+H2O2組。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,棄去培養液,每孔加入100 μl培養液與10 μl MTT溶液,繼續孵箱4 h,棄上清液,每孔加入二甲基亞砜溶液150 μl,常溫下放置10 min。選擇490 nm波長, 酶聯免疫檢測儀測定各孔細胞吸光度[A,舊稱光密度(OD)]值,每組設3個副孔,實驗重復3次,取平均值。
LIVE/DEAD?細胞活性/細胞毒性試劑盒檢測正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,每孔加入50 μl配制的Live/Dead染色劑溶液,室溫孵育30 min,終止染色,每孔加入50 μl PBS。每組設3個副孔,實驗重復3次。細胞熒光顯微鏡觀察拍照,活細胞呈綠色熒光,死亡細胞呈紅色熒光。
細胞凋亡檢測試劑盒檢測N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,參照說明書進行操作;每組設3個副孔,實驗重復3次。
DCFH-DA法檢測正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞內ROS水平。應用ROS檢測試劑盒,按照說明書流程操作,以酶聯免疫檢測儀測定N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞內ROS水平;每組設3個副孔,實驗重復3次。
1.3 統計方法
采用SPSS18.0軟件進行統計學分析。數據分析選擇單因素方差分析(ANOVA)聯合Dunnett統計學方法,即首先對數據進行方差齊性檢驗,再利用Dunnett進行各實驗組與對照組之間的兩兩比較。P<0.05為差異有統計學意義。經Graphprism軟件對所獲得數據進行圖表整理。
2 結果
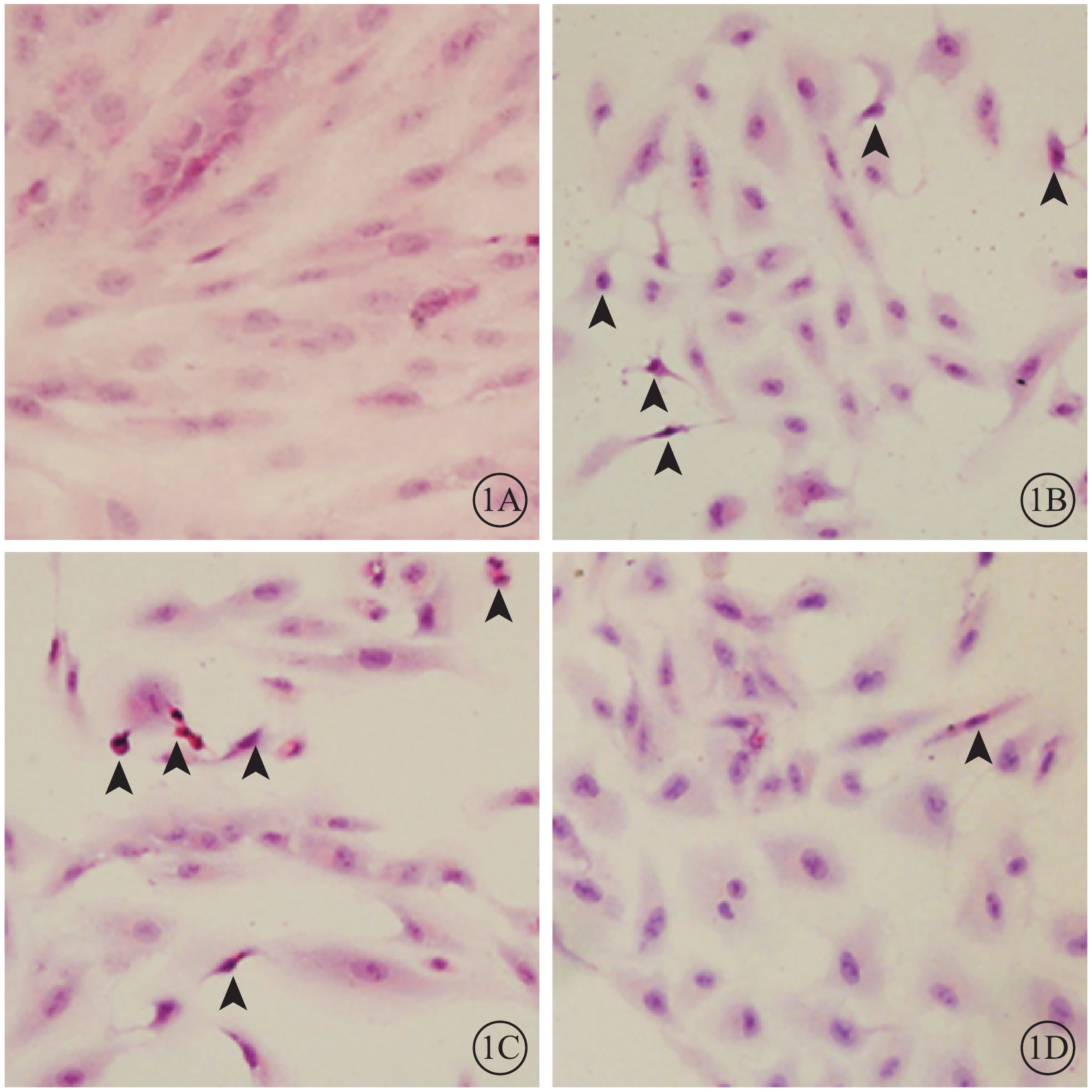
光學顯微鏡觀察發現,正常細胞組細胞形態飽滿,胞質染色均一,細胞核呈圓形,胞質豐富(圖1A);N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(圖1B,1C);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(圖1D)。
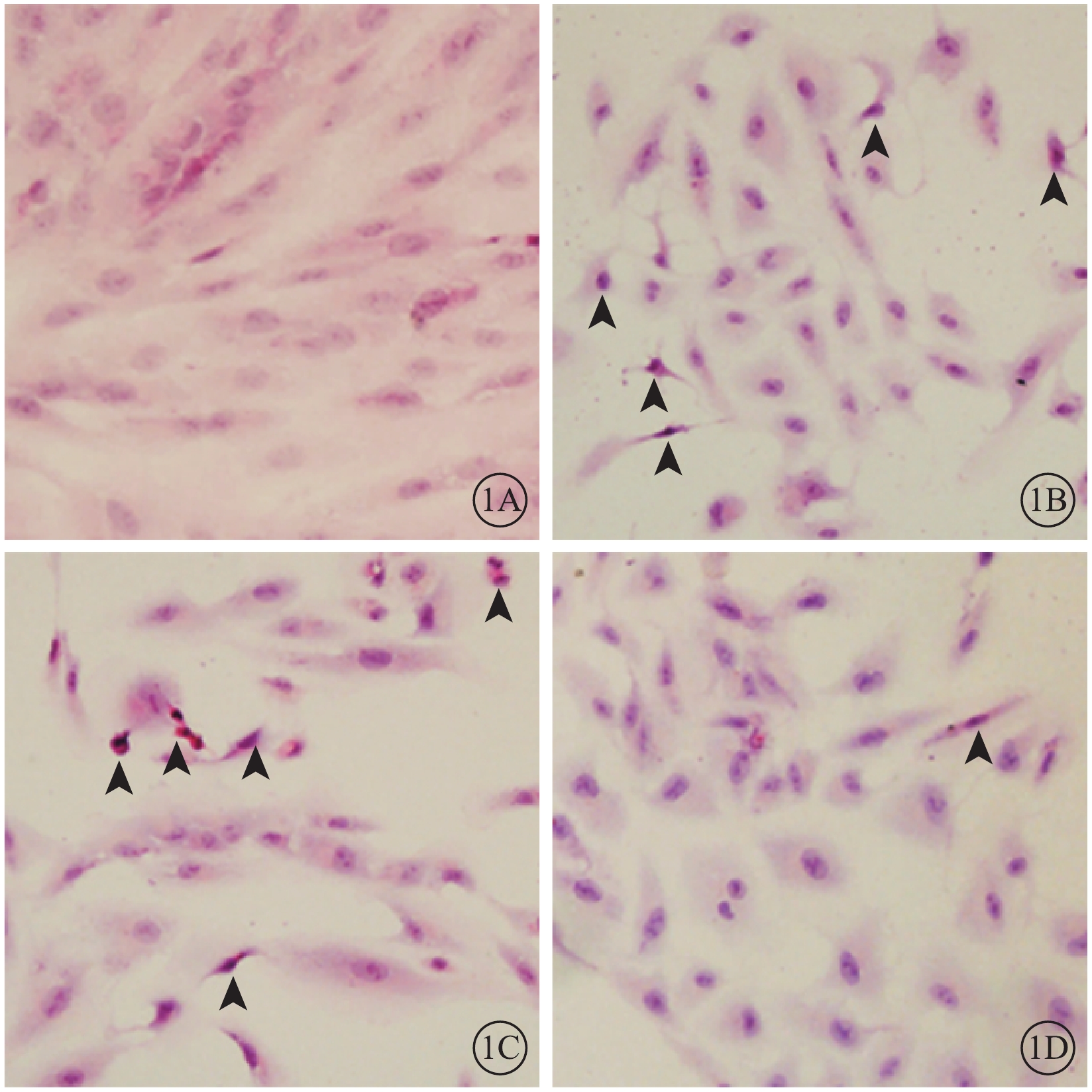 圖1
各組細胞光學顯微鏡像。1A~1D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞形態飽滿,細胞核呈圓形;N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(黑箭);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(黑箭)HE ×100
圖1
各組細胞光學顯微鏡像。1A~1D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞形態飽滿,細胞核呈圓形;N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(黑箭);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(黑箭)HE ×100
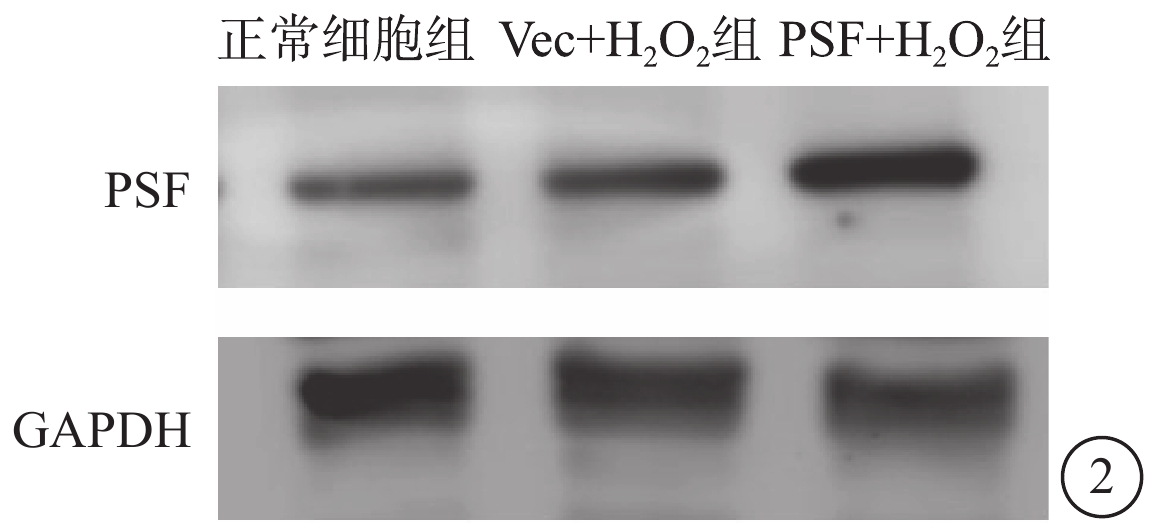
Western blot檢測結果顯示,與正常細胞組、Vec+H2O2組比較,PSF+H2O2組細胞PSF蛋白表達顯著上調(圖2)。
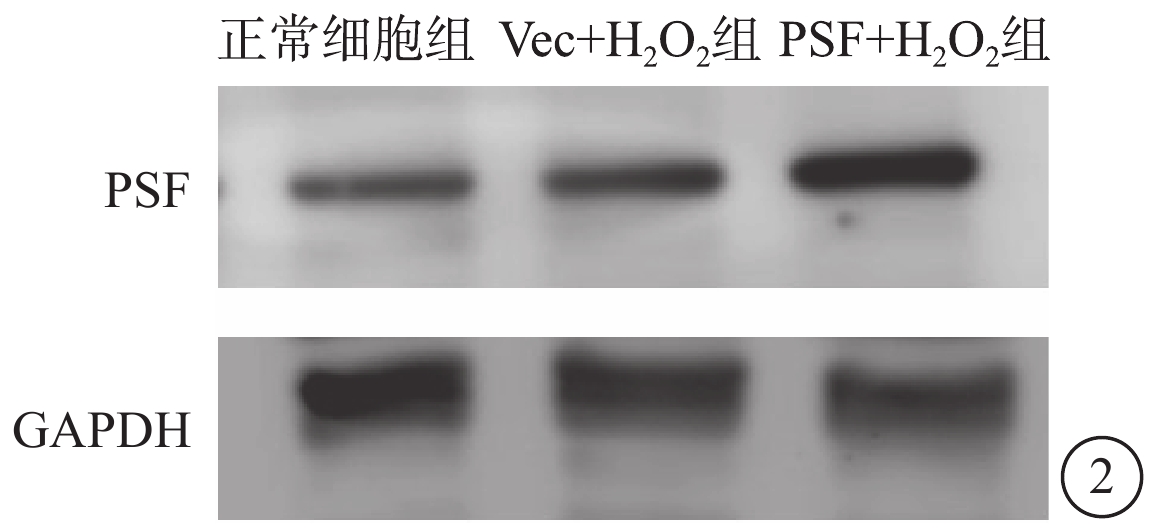 圖2
正常細胞組、Vec+H2O2組、PSF+H2O2組細胞PSF蛋白表達電泳圖
圖2
正常細胞組、Vec+H2O2組、PSF+H2O2組細胞PSF蛋白表達電泳圖
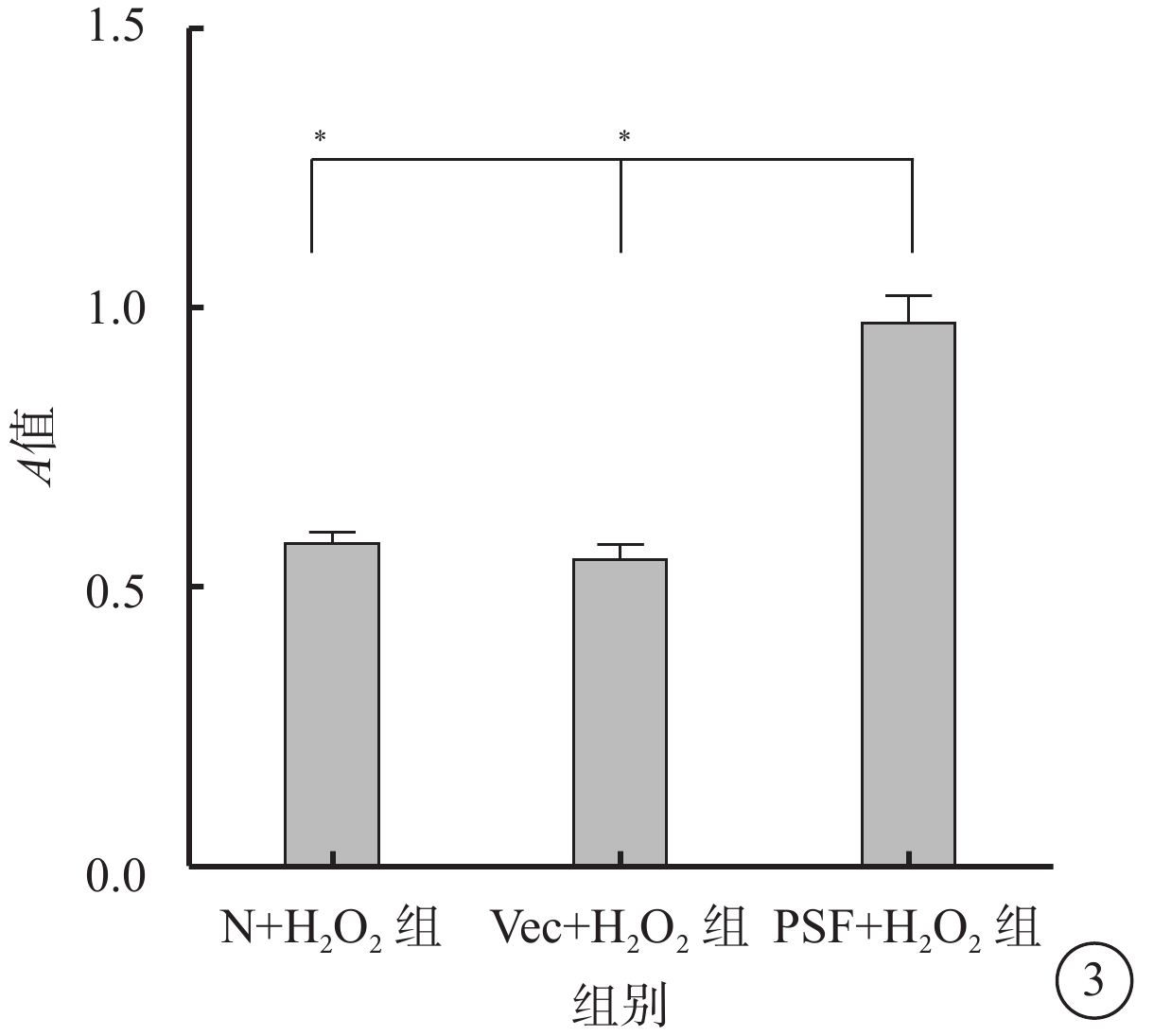
MTT比色法檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力分別為0.58±0.06、0.55±0.08、0.97±0.15。與PSF+H2O2組比較,N+H2O2組、Vec+H2O2組細胞活性下降,差異有統計學意義(F=46.98,P=0.000)(圖3)
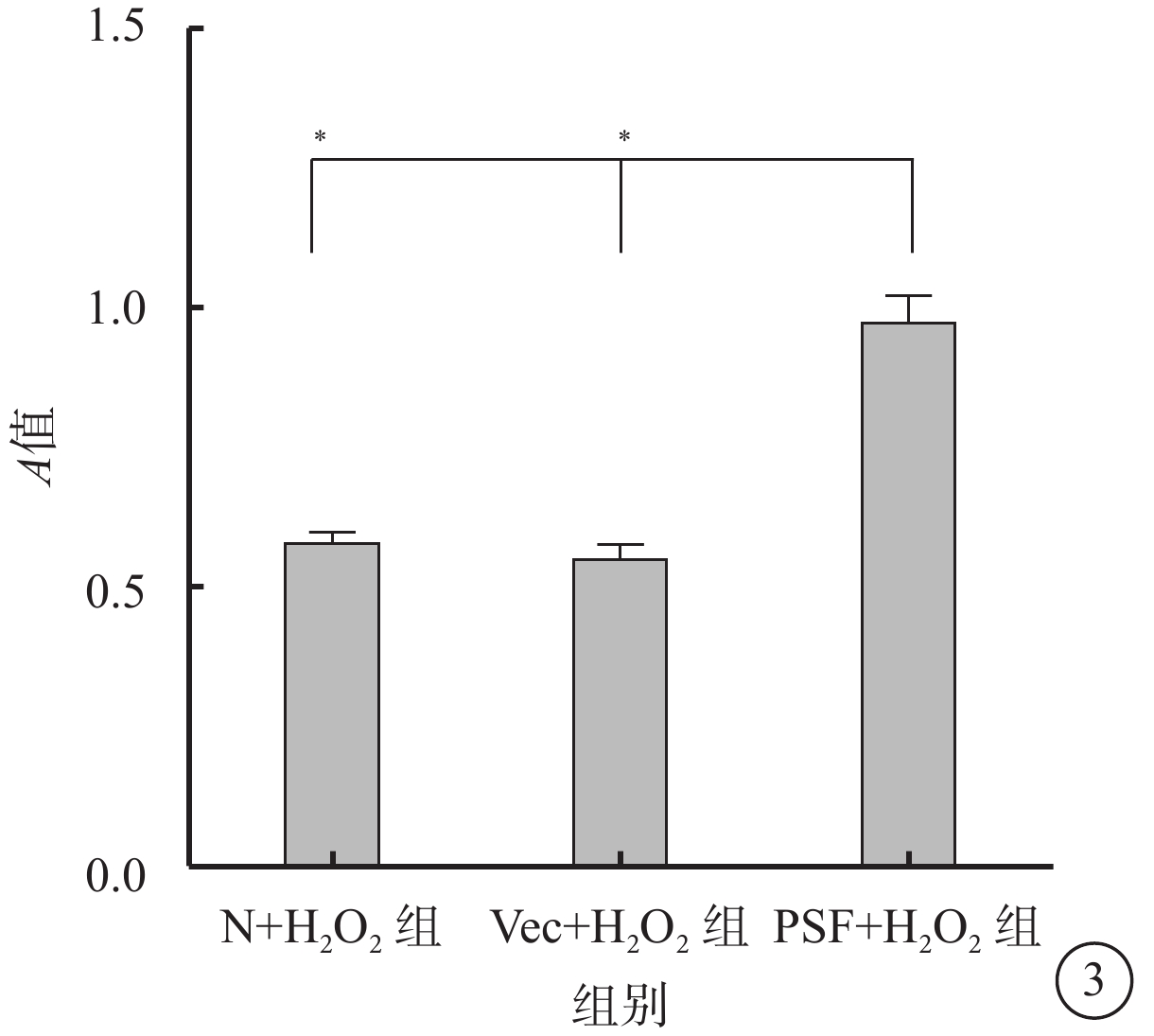 圖3
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力比較。*P<0.05
圖3
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力比較。*P<0.05
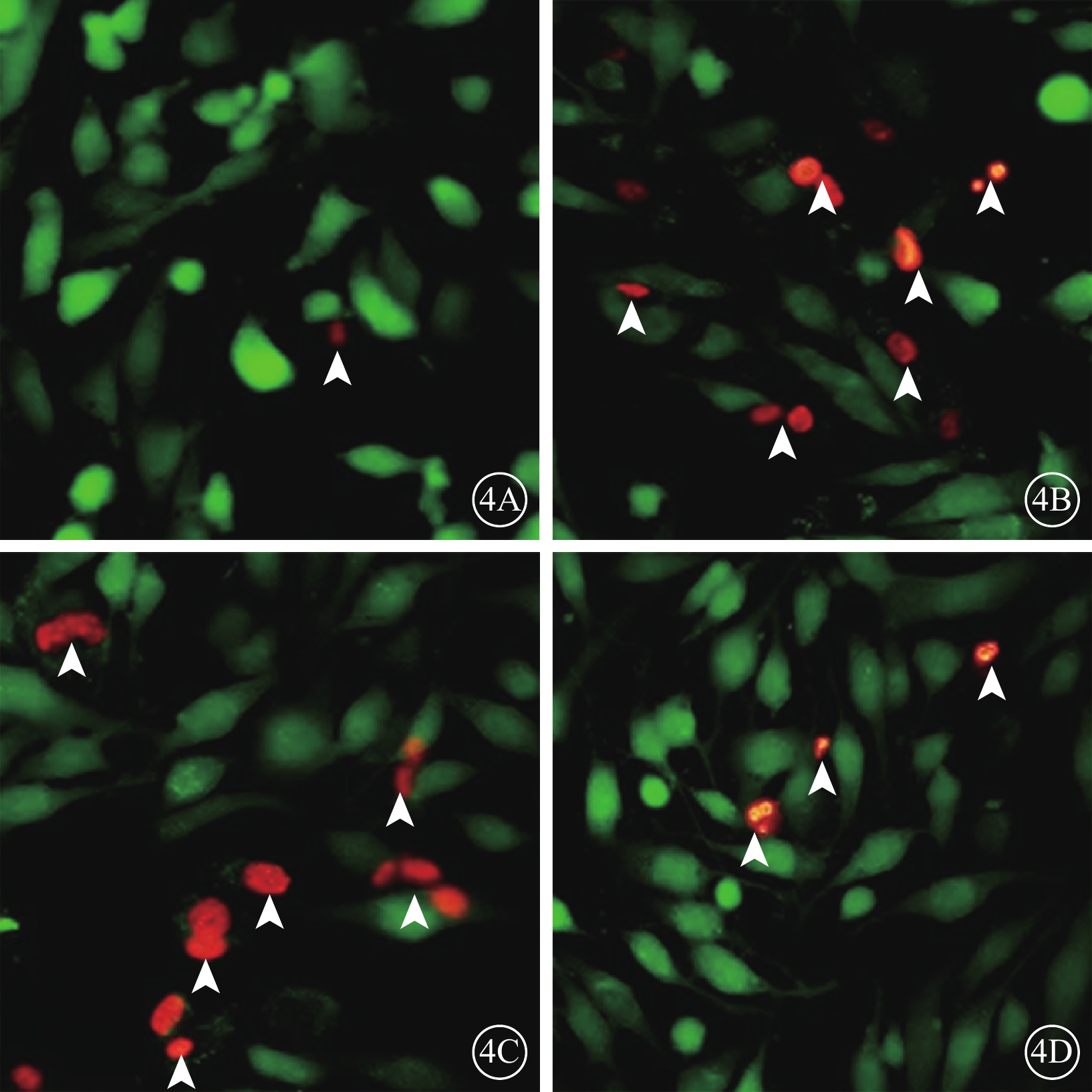
細胞熒光顯微鏡觀察發現,正常細胞組細胞呈綠色熒光,偶見紅色熒光(圖4A);N+H2O2組、Vec+H2O2組中呈紅色熒光的死亡細胞數量明顯增多,呈綠色熒光的活細胞數量顯著減少(圖4B,4C);PSF+H2O2組活細胞數量明顯增多,死亡細胞數量顯著減少(圖4D)。
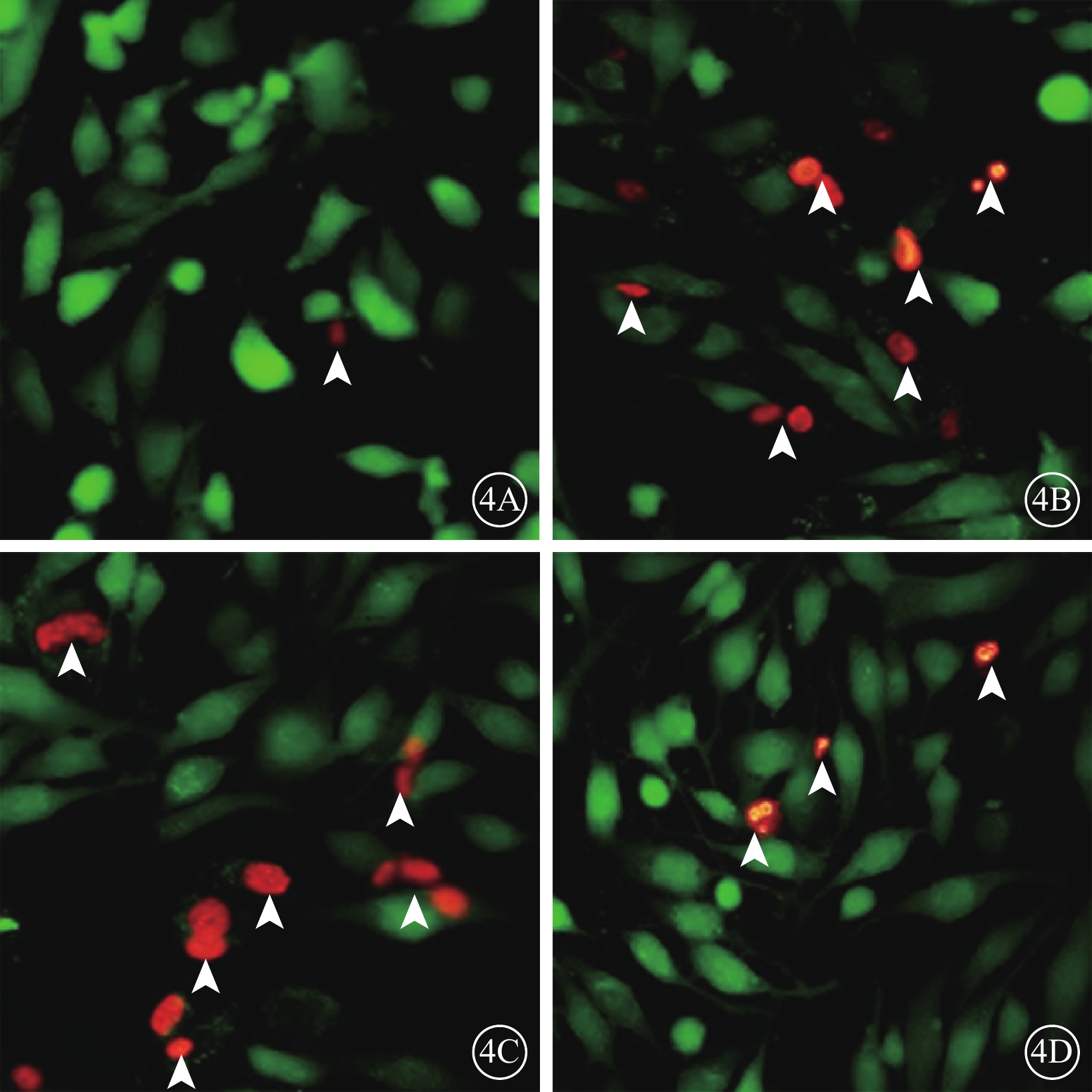 圖4
各組細胞熒光顯微鏡像。4A~4D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞偶見紅色熒光(白箭頭);N+H2O2組、Vec+H2O2組細胞中紅色熒光明顯增多(白箭頭);PSF+H2O2組細胞中紅色熒光顯著減少(白箭頭)×100
圖4
各組細胞熒光顯微鏡像。4A~4D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞偶見紅色熒光(白箭頭);N+H2O2組、Vec+H2O2組細胞中紅色熒光明顯增多(白箭頭);PSF+H2O2組細胞中紅色熒光顯著減少(白箭頭)×100
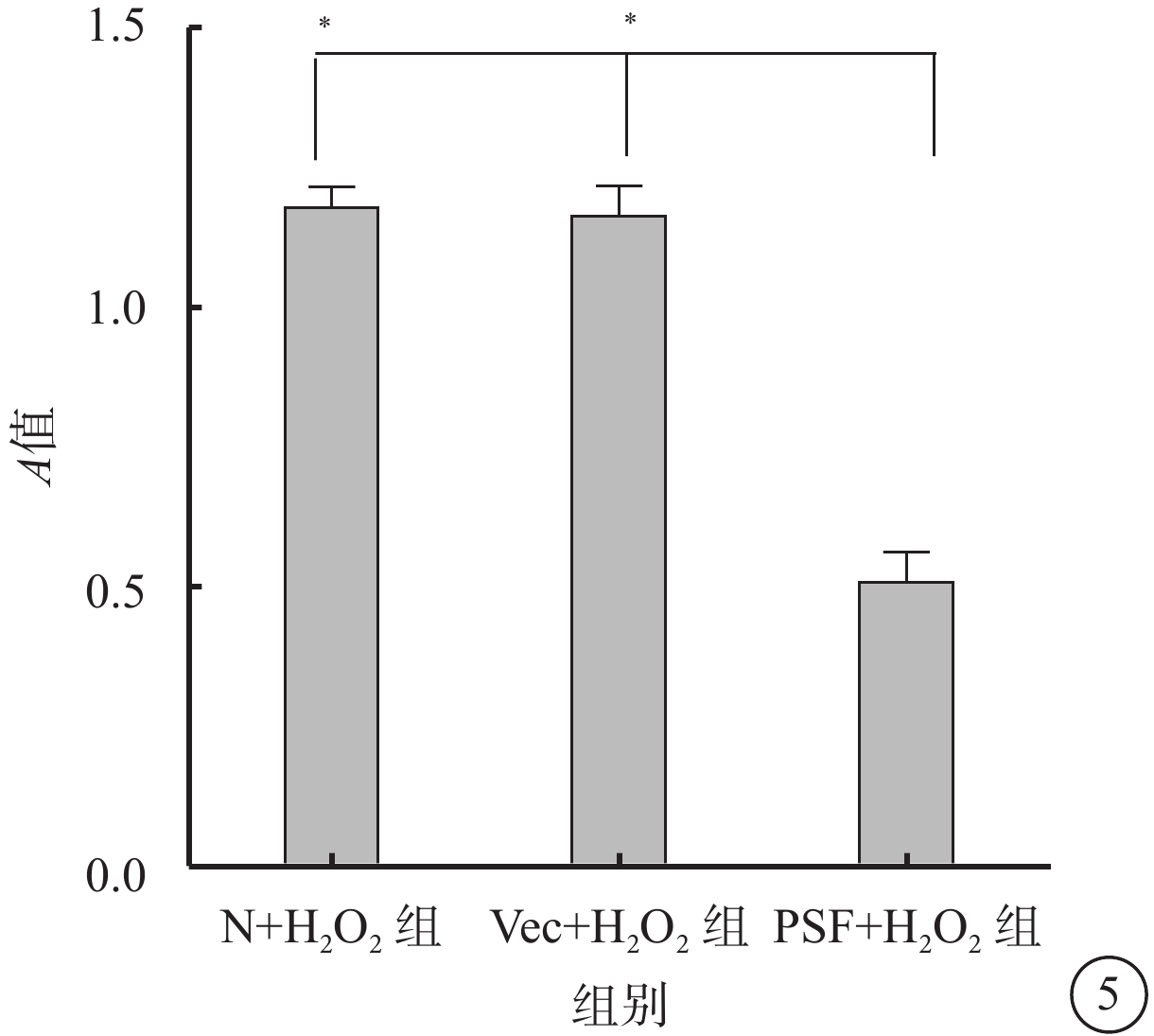
細胞凋亡檢測試劑盒檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞A值分別為1.18±0.11、1.16±0.16、0.51±0.16;與N+H2O2組、Vec+H2O2組細胞A值比較,PSF+H2O2組細胞A值顯著下降,差異有統計學意義(F=62.24,P=0.000)(圖5)。
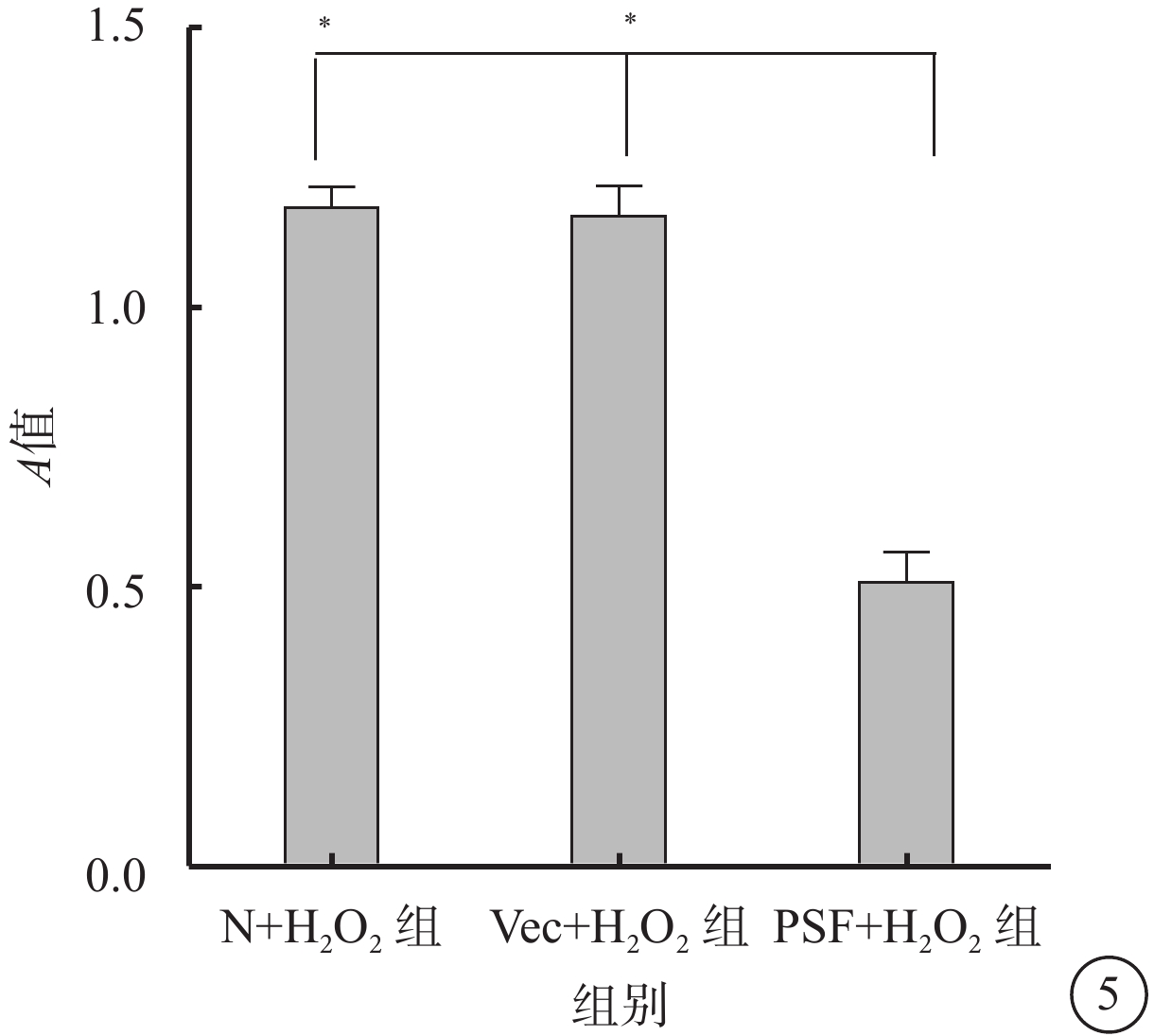 圖5
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡比較。*P<0.05
圖5
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡比較。*P<0.05
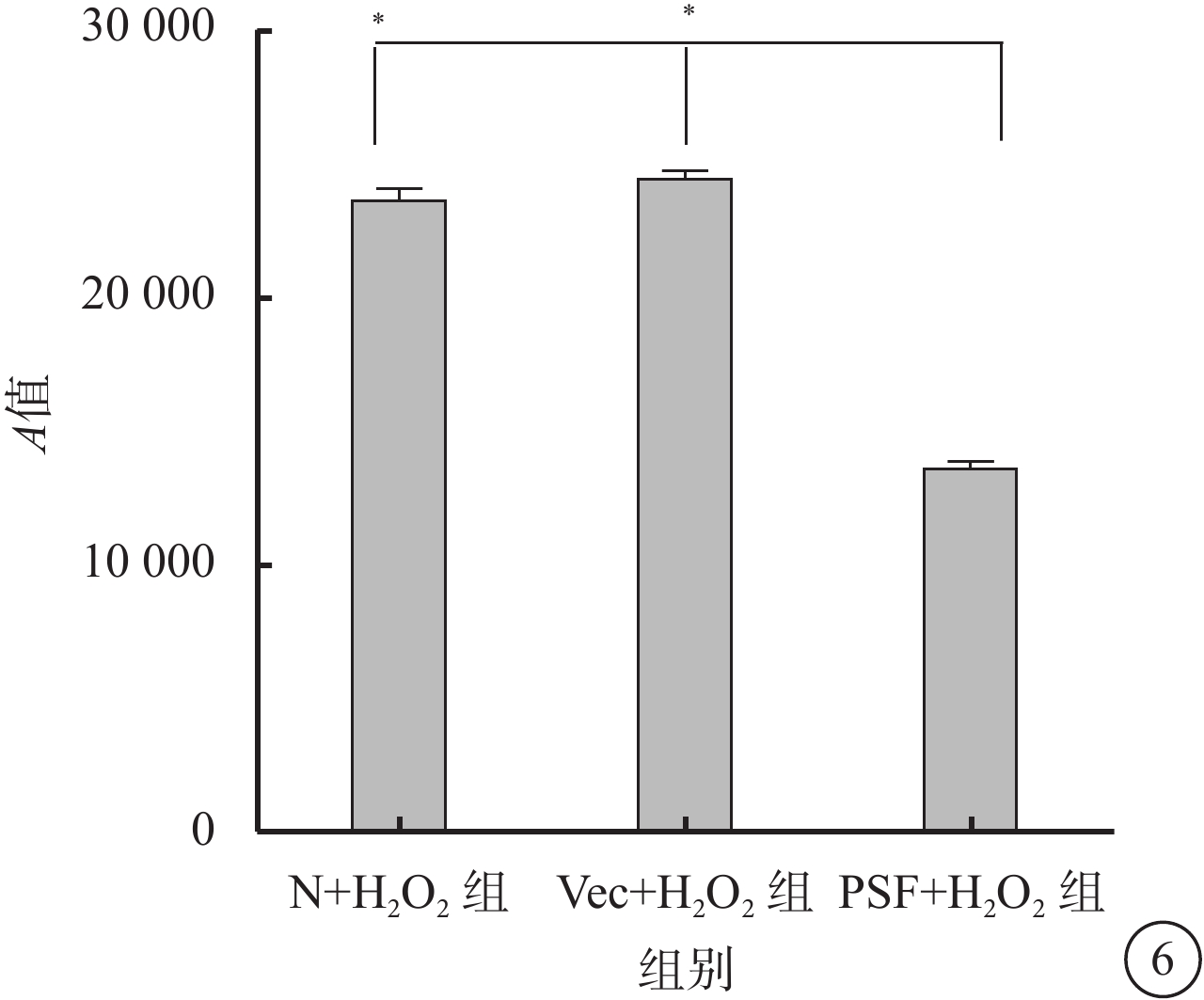
DCFH-DA法檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞中ROS表達的A值分別為23 602.56±1 386.3、24 424.67±877.59、13 570±805.19;與N+H2O2組、Vec+H2O2組比較,PSF+H2O2組細胞中ROS表達量下降,差異有統計學意義(F=295.235,P=0.000)(圖6)。
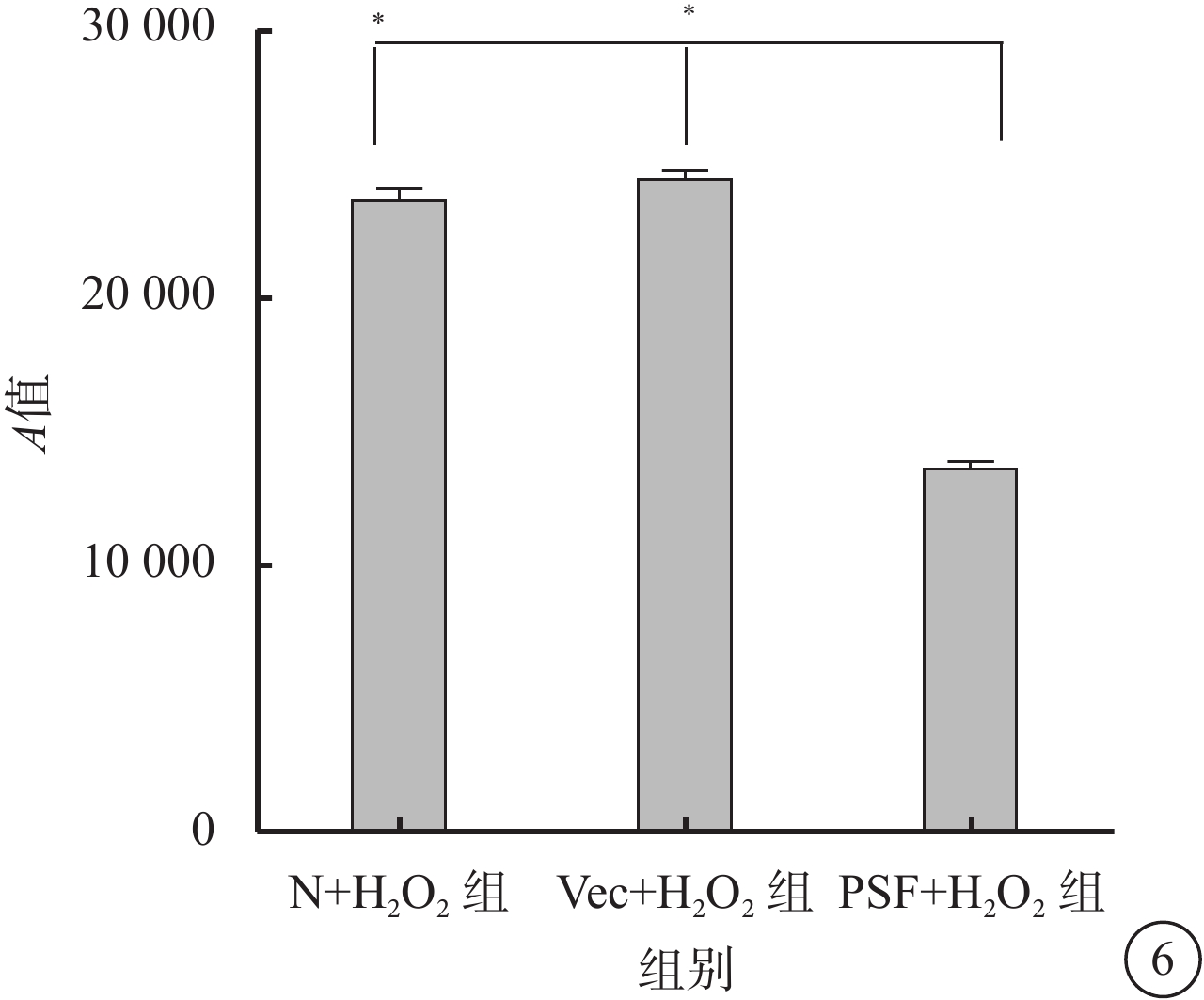 圖6
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞ROS含量比較。*P<0.05
圖6
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞ROS含量比較。*P<0.05
3 討論
RPE細胞作為血視網膜屏障的重要組成成分具有重要的生物學及解剖學功能。RPE細胞的異常病理變化在多種視網膜疾病的發生發展過程中占重要地位[9]。其中氧化損傷引起的RPE細胞變性和死亡是老年性黃斑變性(AMD)的顯著特征和主要誘因[10-13]。因此,保護RPE細胞免受氧化應激損傷成為延緩和治療AMD的一條重要策略[14]。
PSF由707個氨基酸殘基組成,相對分子質量為100×103的多功能蛋白,可參與基因轉錄調控、DNA損傷修復、premRNA的剪接加工[3, 4]。我們前期研究結果顯示,PSF蛋白可以抑制氧誘導視網膜病變小鼠視網膜新生血管的形成,下調VEGF表達,從而抑制新生血管的增生[5, 15, 16]。在此基礎之上進一步明確了胰島素生長因子-1刺激后PSF可通過調控體外培養的RPE細胞PI3K/Akt信號通路的活化程度來影響VEGF的表達[5]。研究發現,在氧化應激情況下,ROS調控VEGF表達,活化VEGF受體,活化下游信號,導致內皮細胞的增生和遷移以及新生血管的形成[17-19]。但PSF蛋白對ROS的表達調控以及效應發揮是否也存在潛在的調控作用尚不清楚。
在培養體系中添加H2O2是研究氧化應激的經典模型[20-23]。Kim等[24]研究發現H2O2可誘導RPE細胞凋亡;腫瘤壞死因子-α與H2O2聯合應用可導致半胱天冬酶激活進而誘導RPE凋亡。基于此,本研究將PSF引入人RPE細胞模型中,并利用H2O2作為誘導劑刺激RPE細胞,目的在于觀察PSF蛋白對RPE氧化損傷的影響以及潛在機制。結果顯示,經H2O2刺激后細胞體積變小,細胞質濃縮,細胞的嗜酸性染色增強,相比之下,PSF+H2O2組細胞形態尚飽滿,胞質相對豐富。與N+H2O2組比較,H2O2刺激后,PSF+H2O2組細胞生存力明顯提高。提示H2O2刺激導致RPE細胞受損。為明確RPE細胞的損傷程度,采用LIVE/DEAD?細胞活性/細胞毒性試劑盒標記細胞死亡率。結果顯示,H2O2刺激可以誘導RPE細胞的損傷,并導致死亡,PSF蛋白高表達可以顯著下調H2O2誘導的RPE細胞的死亡水平。H2O2可以誘導細胞凋亡,而PSF蛋白高表達可以拮抗H2O2處理導致的RPE細胞凋亡。由此可見PSF高表達可有效改善H2O2誘導的RPE細胞的形態學改變,顯著上調RPE細胞生存力,緩解H2O2誘導的RPE細胞損傷,下調RPE細胞凋亡率。
為明確H2O2是否可以誘導RPE細胞凋亡,本研究應用凋亡檢測試劑盒對不同分組的RPE細胞進行定量分析。結果顯示,誘導可以導致RPE細胞凋亡,而PSF+H2O2組細胞凋亡明顯低于N+H2O2組、Vec+H2O2組,即PSF高表達可以抑制RPE細胞凋亡。提示PSF是RPE細胞凋亡的潛在保護因子。
氧化應激是指體內ROS的產生和抗氧化防御體系之間失衡,導致ROS聚集對組織造成損傷的病理狀態。研究發現,大量ROS未能及時清除時可使機體發生氧化應激反應,誘導線粒體膜電位降低,線粒體通透性轉換孔開放,線粒體細胞色素C釋放入胞漿,由此觸發并激活細胞的凋亡系統引起細胞凋亡[25-27]。為初步了解PSF蛋白抑制H2O2誘導的RPE細胞凋亡的途徑,本研究檢測PSF高表達對于H2O2誘導的RPE細胞ROS的表達情況的影響。結果顯示,PSF+H2O2組可以顯著下調H2O2誘導的RPE細胞ROS表達。
氧化應激是指機體在遭受各種有害刺激時,體內高活性分子如活性氧(ROS)產生過多引發的一系列細胞毒效應,主要表現為DNA氧化損傷及蛋白質的表達異常[1]。視網膜色素上皮( RPE)細胞具有吞噬降解光感受器細胞外節段、參與視循環、轉運和分泌營養物質、清除自由基等功能,因此RPE細胞對維持視網膜的穩態平衡發揮重要的作用[2]。隨著年齡增長RPE細胞因吸收眼內散射光及吞噬作用而產生大量ROS,極易誘發氧化應激反應的發生,導致RPE細胞遭受氧化損傷。聚嘧啶束結合蛋白相關剪接因子(PSF)是一種多功能蛋白[3, 4]。我們課題組前期研究發現PSF通過抑制RPE細胞磷脂酰肌醇3激酶(PI3K)/絲氨酸-蘇氨酸蛋白(Akt)激酶信號通路的活化,從而抑制血管內皮生長因子(VEGF)的表達[5]。過氧化氫(H2O2)誘導的RPE細胞缺氧是常用的一種體外氧化應激模型[6, 7],本研究將PSF蛋白引入RPE細胞氧化應激模型,觀察PSF蛋白對RPE氧化損傷的影響以及潛在機制。現將結果報道如下。
1 材料和方法
1.1 材料
人RPE細胞株(ARPE-19細胞,廣州吉妮歐生物科技有限公司);pEGFP-PSF真核表達質粒由本實驗室自行構建[8]。噻唑藍(MTT)(北京索萊寶科技有限公司);H2O2溶液、2’,7’-二氯熒光素二乙酸酯(DCFH-DA)、細胞凋亡檢測試劑盒(美國Sigma公司);轉染試劑脂質體2000(美國Invitrogen公司);LIVE/DEAD?細胞活性/細胞毒性檢測試劑盒(美國Thermo公司)。
1.2 方法
將ARPE-19細胞爬片于已預先放置蓋玻片的24孔細胞培養板中,共12孔;待細胞融合度約80%時,將細胞分為正常細胞組、損傷組(N+H2O2組)、空載體對照組(Vec+H2O2組)、PSF高表達組(PSF+H2O2組)。應用脂質體2000將pEGFP空載體、pEGFP-PSF真核表達質粒分別導入Vec+H2O2組、PSF+H2O2組,N+H2O2組僅作轉染處理,正常細胞組為常規培養細胞。細胞轉染24 h后,各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,磷酸鹽緩沖液(PBS)洗3次,3 min/次;4%多聚甲醛室溫固定10 min,PBS洗2次,1 min/次;0.5% TritonX-100/PBS破膜室溫5 min,PBS洗2次,1 min/次;蘇木精-伊紅(HE)染色;酒精逐級脫水,二甲苯透明,中性樹膠封片。光學顯微鏡下觀察各組細胞形態。
蛋白免疫印跡法(Western blot)檢測pEGFP-PSF真核表達質粒轉染效果。接種6×105個/孔ARPE-19細胞于1 ml培養體系的6孔細胞培養板中,待細胞匯合度達到70%左右,將細胞分為正常細胞組、Vec+H2O2組、PSF+H2O2組。收集各組全細胞提取物,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離蛋白復合物,將PSF蛋白轉至聚偏二氟乙烯膜。5%脫脂牛奶室溫封閉1 h,一抗4 ℃孵育過夜,1倍洗膜緩沖液(TBST)洗膜3次,10 min/次;辣根過氧化物酶標記的二抗繼續孵育1 h,1倍TBST洗膜3次,10 min/次;增強化學發光檢測試劑盒發光顯影。以甘油醛脫氫酶(GAPDH)為內參照,檢測各組細胞中PSF蛋白表達量。
MTT法定量測定細胞活性。將ARPE-19細胞接種于96孔細胞培養板中,共12孔。待細胞融合度約80%時,將細胞分為N+H2O2組、Vec+H2O2組、PSF+H2O2組。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,棄去培養液,每孔加入100 μl培養液與10 μl MTT溶液,繼續孵箱4 h,棄上清液,每孔加入二甲基亞砜溶液150 μl,常溫下放置10 min。選擇490 nm波長, 酶聯免疫檢測儀測定各孔細胞吸光度[A,舊稱光密度(OD)]值,每組設3個副孔,實驗重復3次,取平均值。
LIVE/DEAD?細胞活性/細胞毒性試劑盒檢測正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,每孔加入50 μl配制的Live/Dead染色劑溶液,室溫孵育30 min,終止染色,每孔加入50 μl PBS。每組設3個副孔,實驗重復3次。細胞熒光顯微鏡觀察拍照,活細胞呈綠色熒光,死亡細胞呈紅色熒光。
細胞凋亡檢測試劑盒檢測N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡。各組細胞H2O2刺激2 h后更換為完全培養基繼續培養24 h,參照說明書進行操作;每組設3個副孔,實驗重復3次。
DCFH-DA法檢測正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞內ROS水平。應用ROS檢測試劑盒,按照說明書流程操作,以酶聯免疫檢測儀測定N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞內ROS水平;每組設3個副孔,實驗重復3次。
1.3 統計方法
采用SPSS18.0軟件進行統計學分析。數據分析選擇單因素方差分析(ANOVA)聯合Dunnett統計學方法,即首先對數據進行方差齊性檢驗,再利用Dunnett進行各實驗組與對照組之間的兩兩比較。P<0.05為差異有統計學意義。經Graphprism軟件對所獲得數據進行圖表整理。
2 結果
光學顯微鏡觀察發現,正常細胞組細胞形態飽滿,胞質染色均一,細胞核呈圓形,胞質豐富(圖1A);N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(圖1B,1C);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(圖1D)。
 圖1
各組細胞光學顯微鏡像。1A~1D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞形態飽滿,細胞核呈圓形;N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(黑箭);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(黑箭)HE ×100
圖1
各組細胞光學顯微鏡像。1A~1D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞形態飽滿,細胞核呈圓形;N+H2O2組、Vec+H2O2組細胞體積縮小,胞質致密濃縮、嗜酸性染色增強(黑箭);PSF+H2O2組細胞形態尚飽滿,胞質染色較均勻,偶見體積縮小(黑箭)HE ×100
Western blot檢測結果顯示,與正常細胞組、Vec+H2O2組比較,PSF+H2O2組細胞PSF蛋白表達顯著上調(圖2)。
 圖2
正常細胞組、Vec+H2O2組、PSF+H2O2組細胞PSF蛋白表達電泳圖
圖2
正常細胞組、Vec+H2O2組、PSF+H2O2組細胞PSF蛋白表達電泳圖
MTT比色法檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力分別為0.58±0.06、0.55±0.08、0.97±0.15。與PSF+H2O2組比較,N+H2O2組、Vec+H2O2組細胞活性下降,差異有統計學意義(F=46.98,P=0.000)(圖3)
 圖3
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力比較。*P<0.05
圖3
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞生存力比較。*P<0.05
細胞熒光顯微鏡觀察發現,正常細胞組細胞呈綠色熒光,偶見紅色熒光(圖4A);N+H2O2組、Vec+H2O2組中呈紅色熒光的死亡細胞數量明顯增多,呈綠色熒光的活細胞數量顯著減少(圖4B,4C);PSF+H2O2組活細胞數量明顯增多,死亡細胞數量顯著減少(圖4D)。
 圖4
各組細胞熒光顯微鏡像。4A~4D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞偶見紅色熒光(白箭頭);N+H2O2組、Vec+H2O2組細胞中紅色熒光明顯增多(白箭頭);PSF+H2O2組細胞中紅色熒光顯著減少(白箭頭)×100
圖4
各組細胞熒光顯微鏡像。4A~4D.分別為正常細胞組、N+H2O2組、Vec+H2O2組、PSF+H2O2組。正常細胞組細胞偶見紅色熒光(白箭頭);N+H2O2組、Vec+H2O2組細胞中紅色熒光明顯增多(白箭頭);PSF+H2O2組細胞中紅色熒光顯著減少(白箭頭)×100
細胞凋亡檢測試劑盒檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞A值分別為1.18±0.11、1.16±0.16、0.51±0.16;與N+H2O2組、Vec+H2O2組細胞A值比較,PSF+H2O2組細胞A值顯著下降,差異有統計學意義(F=62.24,P=0.000)(圖5)。
 圖5
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡比較。*P<0.05
圖5
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞凋亡比較。*P<0.05
DCFH-DA法檢測結果顯示,N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞中ROS表達的A值分別為23 602.56±1 386.3、24 424.67±877.59、13 570±805.19;與N+H2O2組、Vec+H2O2組比較,PSF+H2O2組細胞中ROS表達量下降,差異有統計學意義(F=295.235,P=0.000)(圖6)。
 圖6
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞ROS含量比較。*P<0.05
圖6
N+H2O2組、Vec+H2O2組、PSF+H2O2組細胞ROS含量比較。*P<0.05
3 討論
RPE細胞作為血視網膜屏障的重要組成成分具有重要的生物學及解剖學功能。RPE細胞的異常病理變化在多種視網膜疾病的發生發展過程中占重要地位[9]。其中氧化損傷引起的RPE細胞變性和死亡是老年性黃斑變性(AMD)的顯著特征和主要誘因[10-13]。因此,保護RPE細胞免受氧化應激損傷成為延緩和治療AMD的一條重要策略[14]。
PSF由707個氨基酸殘基組成,相對分子質量為100×103的多功能蛋白,可參與基因轉錄調控、DNA損傷修復、premRNA的剪接加工[3, 4]。我們前期研究結果顯示,PSF蛋白可以抑制氧誘導視網膜病變小鼠視網膜新生血管的形成,下調VEGF表達,從而抑制新生血管的增生[5, 15, 16]。在此基礎之上進一步明確了胰島素生長因子-1刺激后PSF可通過調控體外培養的RPE細胞PI3K/Akt信號通路的活化程度來影響VEGF的表達[5]。研究發現,在氧化應激情況下,ROS調控VEGF表達,活化VEGF受體,活化下游信號,導致內皮細胞的增生和遷移以及新生血管的形成[17-19]。但PSF蛋白對ROS的表達調控以及效應發揮是否也存在潛在的調控作用尚不清楚。
在培養體系中添加H2O2是研究氧化應激的經典模型[20-23]。Kim等[24]研究發現H2O2可誘導RPE細胞凋亡;腫瘤壞死因子-α與H2O2聯合應用可導致半胱天冬酶激活進而誘導RPE凋亡。基于此,本研究將PSF引入人RPE細胞模型中,并利用H2O2作為誘導劑刺激RPE細胞,目的在于觀察PSF蛋白對RPE氧化損傷的影響以及潛在機制。結果顯示,經H2O2刺激后細胞體積變小,細胞質濃縮,細胞的嗜酸性染色增強,相比之下,PSF+H2O2組細胞形態尚飽滿,胞質相對豐富。與N+H2O2組比較,H2O2刺激后,PSF+H2O2組細胞生存力明顯提高。提示H2O2刺激導致RPE細胞受損。為明確RPE細胞的損傷程度,采用LIVE/DEAD?細胞活性/細胞毒性試劑盒標記細胞死亡率。結果顯示,H2O2刺激可以誘導RPE細胞的損傷,并導致死亡,PSF蛋白高表達可以顯著下調H2O2誘導的RPE細胞的死亡水平。H2O2可以誘導細胞凋亡,而PSF蛋白高表達可以拮抗H2O2處理導致的RPE細胞凋亡。由此可見PSF高表達可有效改善H2O2誘導的RPE細胞的形態學改變,顯著上調RPE細胞生存力,緩解H2O2誘導的RPE細胞損傷,下調RPE細胞凋亡率。
為明確H2O2是否可以誘導RPE細胞凋亡,本研究應用凋亡檢測試劑盒對不同分組的RPE細胞進行定量分析。結果顯示,誘導可以導致RPE細胞凋亡,而PSF+H2O2組細胞凋亡明顯低于N+H2O2組、Vec+H2O2組,即PSF高表達可以抑制RPE細胞凋亡。提示PSF是RPE細胞凋亡的潛在保護因子。
氧化應激是指體內ROS的產生和抗氧化防御體系之間失衡,導致ROS聚集對組織造成損傷的病理狀態。研究發現,大量ROS未能及時清除時可使機體發生氧化應激反應,誘導線粒體膜電位降低,線粒體通透性轉換孔開放,線粒體細胞色素C釋放入胞漿,由此觸發并激活細胞的凋亡系統引起細胞凋亡[25-27]。為初步了解PSF蛋白抑制H2O2誘導的RPE細胞凋亡的途徑,本研究檢測PSF高表達對于H2O2誘導的RPE細胞ROS的表達情況的影響。結果顯示,PSF+H2O2組可以顯著下調H2O2誘導的RPE細胞ROS表達。