引用本文: 駱靜怡, 肖輝, 徐曉宇, 方蕾, 魏偉, 鐘毅敏, 劉杏. 多灶性卵黃樣視網膜病變BEST1基因篩查及臨床特征分析. 中華眼底病雜志, 2018, 34(2): 149-154. doi: 10.3760/cma.j.issn.1005-1015.2018.02.010 復制
多灶性卵黃樣視網膜病變(MVR)表現為視網膜后極部多灶性卵黃樣病變(MVL),伴有視網膜水腫、脫離及色素改變[1-3]。MVR可為散發病例或家族遺傳。既往研究發現,60%的MVR患者攜帶BEST1基因雜合突變,并有眼電圖(EOG)光峰值降低,因而認為該病為Best卵黃樣黃斑營養不良(BVMD)的一種非典型臨床表型[4, 5]。目前關于MVR的研究多為高加索人種,國內僅有零星病例報告[6]。本研究對5個MVR家系進行BEST1基因突變篩查,并對臨床表型進行了觀察。現將結果報道如下。
1 對象和方法
回顧性系列病例研究。本研究經中山眼科中心倫理委員會審核批準。研究遵循赫爾辛基宣言,所有受檢者和未成年患者監護人均簽署知情同意書。
2006年6月至2016年12月在中山大學中山眼科中心就診的MVR患者9例18只眼及家系正常成員10名納入研究。患者分別來自5個無血緣關系家系。患者中,男性4例8只眼,女性5例10只眼;均為雙眼。發病時年齡10~36歲;就診時年齡19~50歲,平均年齡(28.7±8.9)歲。家系正常成員10名中,男性6名,女性4名;年齡4~31歲。納入標準:(1)視網膜下MVL;(2)EOG光峰值降低,光峰/暗谷值(Arden比)<1.55。排除標準:(1)中心性漿液性脈絡膜視網膜病變、老年性黃斑病變、Stargardt病及先天性視網膜劈裂者;(2)患有糖尿病、重癥高血壓、肺心病、腦血栓、腫瘤等全身性疾病者;(3)長期應用系統性糖皮質激素、抗凝藥物以及腎臟透析者。
詳細收集患者及家系成員的基本信息及現病史,繪制家系圖。所有受檢者均行最佳矯正視力(BCVA)、眼壓、屈光度、裂隙燈顯微鏡、90 D前置鏡、前房角鏡、頻域光相干斷層掃描(OCT)、眼底自身熒光(AF)、眼底彩色照相、超聲生物顯微鏡(UBM)檢查,以及眼軸長度(AL)測量。BCVA>0.1且固視良好者行EOG及視野檢查。其中,行EOG檢查12只眼;視野檢查13只眼。眼壓測量采用Goldmann壓平眼壓計;頻域OCT檢查采用德國海德堡公司Spectralis OCT儀,HRA程序下行AF檢查;眼底照相采用日本興和株式會社Kowa眼底照相機;EOG檢查采用德國羅蘭公司RetiPort系統;UBM檢查采用天津索維電子公司Model SW-3200L;視野檢查采用美國Zeiss公司Humphrey全自動視野計HFA-Ⅱ;AL測量采用法國光太公司A/B型超聲儀。患者臨床表現符合MVR診斷標準[4, 5]。10名家系正常成員視力、眼壓及眼部檢查均正常。
抽取受試者外周靜脈血5 ml,乙二胺四乙酸抗凝,采用酚氯仿法抽提DNA提取全基因組DNA,?80 ℃冰箱保存。根據在Pubmed(https://www.ncbi.nlm.nih.gov/)與UCSC數據庫(http://genome.ucsc.edu/)查閱結果,選取轉錄本NM_004183.3的2~9、11號外顯子與轉錄本NM_001139443.1的10號外顯子,應用Primer 5.0軟件設計引物(表1)。聚合酶鏈反應(PCR)擴增BEST1基因外顯子及其側翼。PCR反應條件:96 ℃預變性5 min,96 ℃變性30 s,55~62 ℃退火20 s,72 ℃延伸1 min,共30個循環;延伸5 min。PCR擴增產物2%瓊脂糖凝膠電泳檢測并純化。采用ABI 3730XL型全自動序列儀電泳并記錄序列數據(美國ABI公司)。
采用Chromas 2.0軟件進行序列分析,依據峰圖波形判斷純合突變與雜合突變。根據美國醫學遺傳學和基因組學學會(ACMG)指南篩查致病性突變[7];千人基因組計劃(1000G)(http://browser.1000genomes.org/index.html)、美國國立心肺和血液研究所(EVS)(http://evs.gs.washington.edu/EVS/)、外顯子集成聯盟(ExAC)(http://exac.broadinstitute.org/)分析基因突變頻率; 在線工具PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)、Provean (http://provean.jcvi.org/genome_submit_2.php?species=human)、MutationTaster(MT)(http://www.mutationtaster.org/)、SIFT(http://sift.jcvi.org/www/SIFT_enst_submit.html)預測致病性。孟德爾遺傳規律判斷遺傳方式。
2 結果
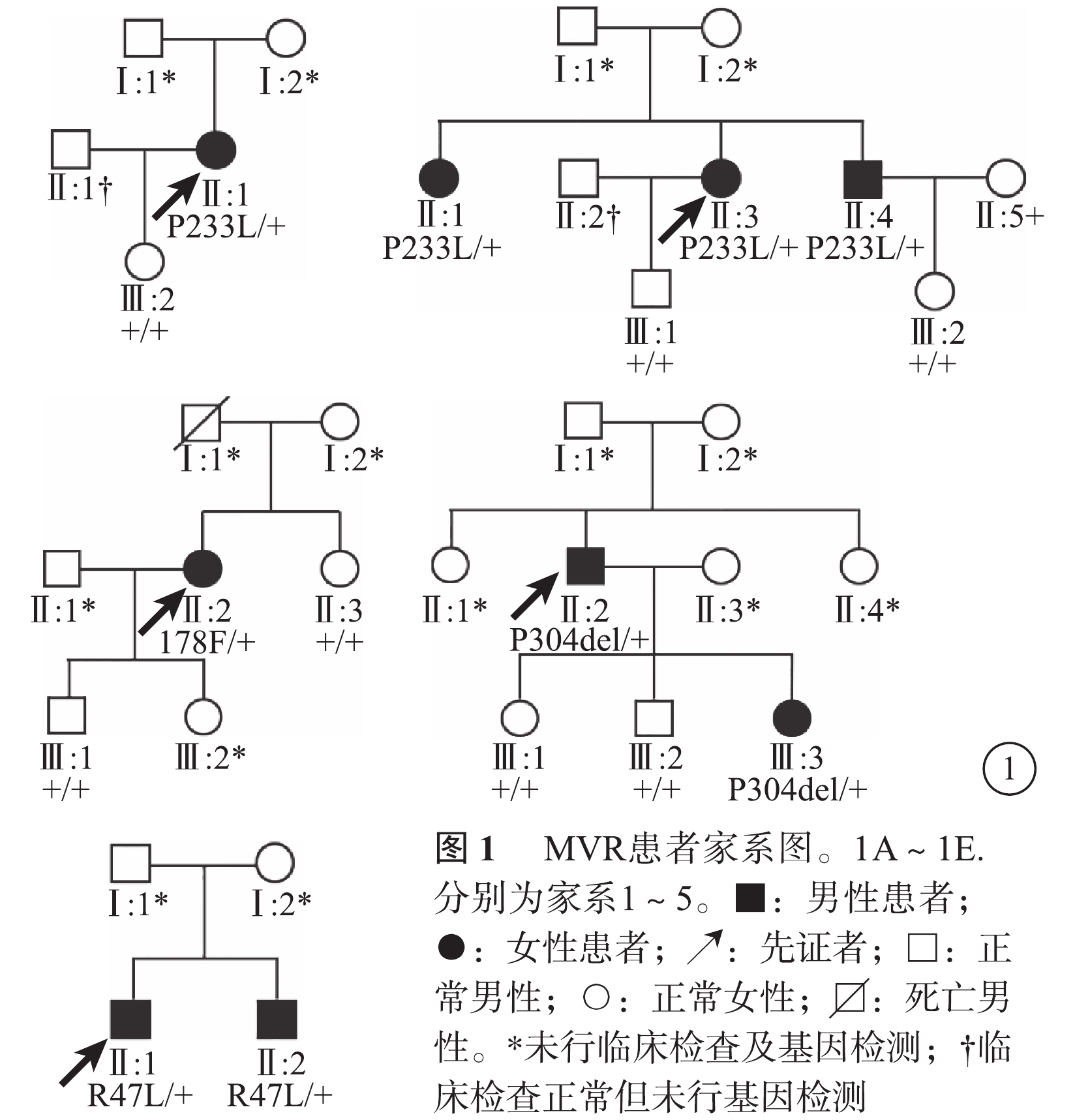
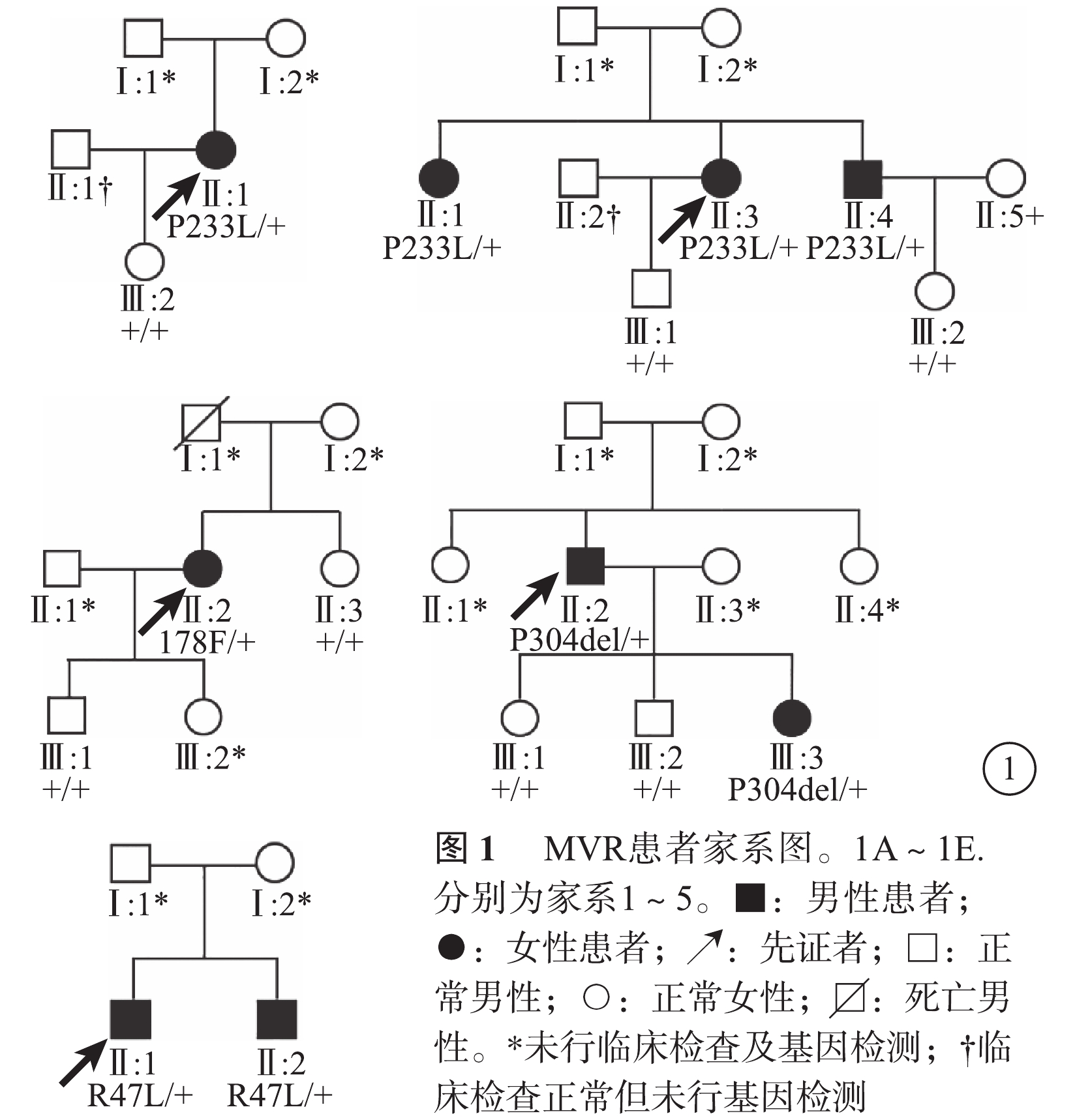
5個家系中,家系2、4、5先證者有明確家族史,其中家系5呈常染色體顯性遺傳(圖1)。
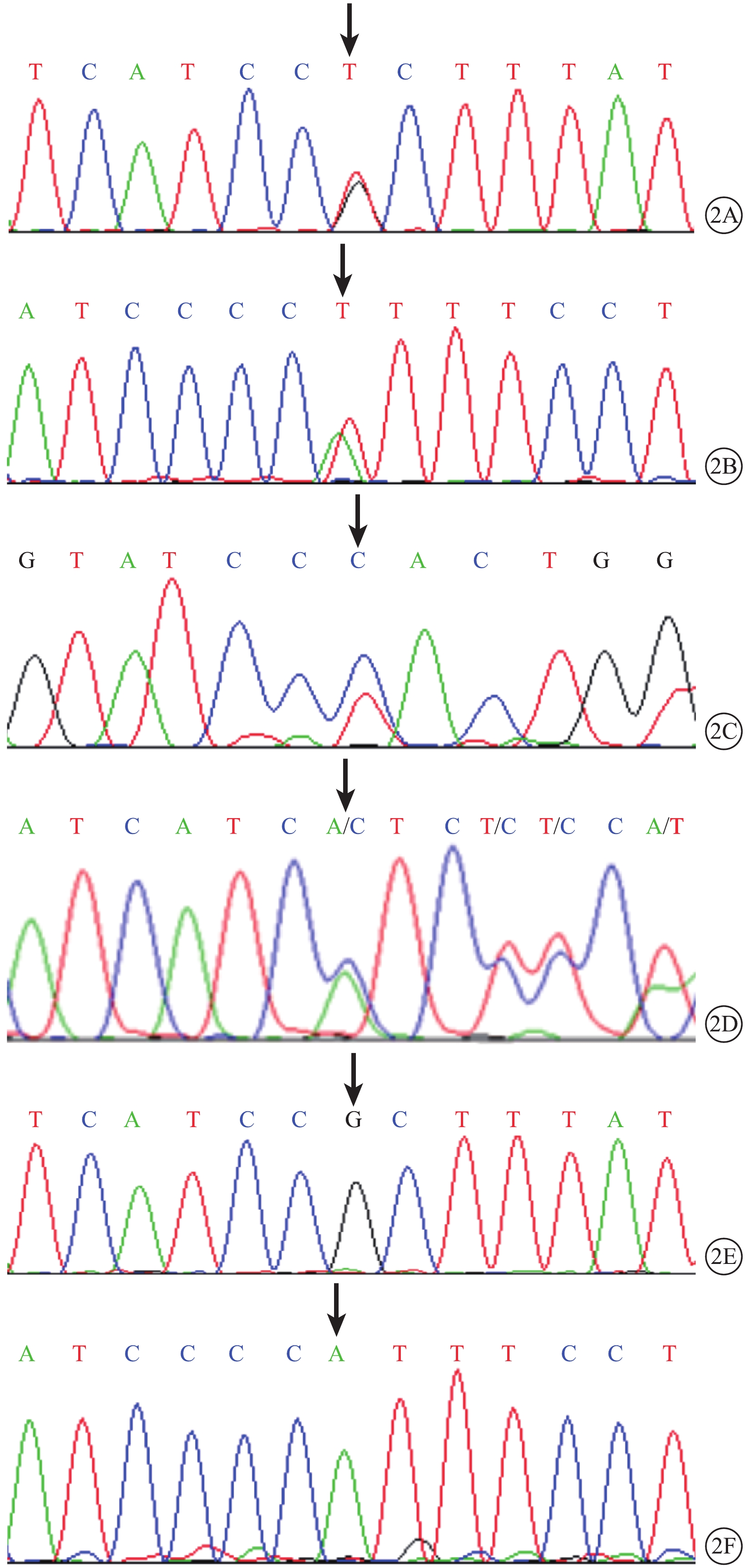
9例患者DNA測序結果發現BEST1基因突變位點4個,其中新發現突變位點2個。錯義突變3個(c.140G>T,p.R47L;c.232A>T,p.I78F;c.698C>T,p.P233L);缺失突變1個(c.910_912del,p.D304del)(圖2A~2D,表2)。p.R47L和p.I78F為新發現突變位點。家系正常成員未檢測到BEST1基因突變(圖2E, 2F)。
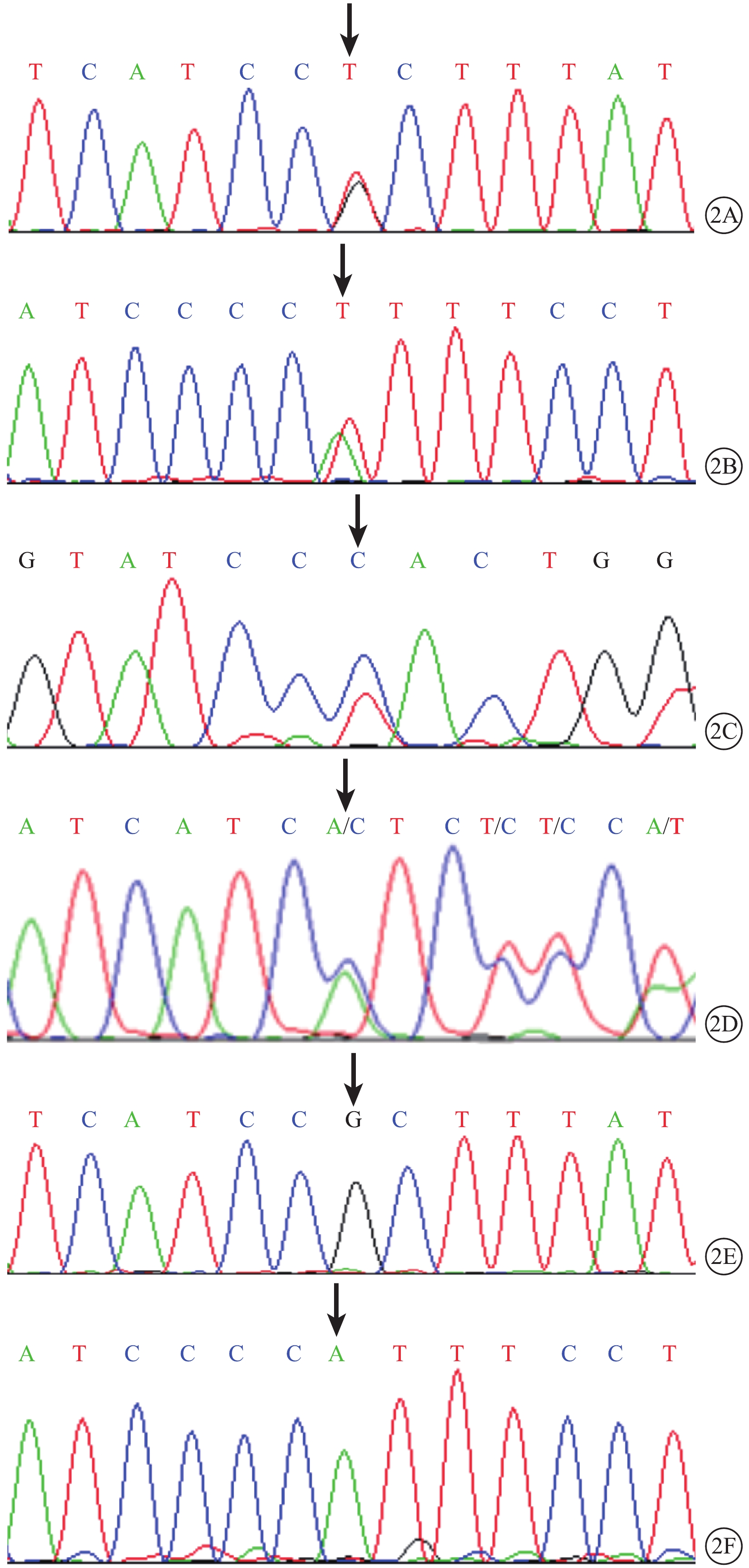 圖2
MVR患者BEST1基因測序圖。2A. BEST1基因第2外顯子的c.140G>T p.R47L錯義突變(黑箭);2B. BEST1基因第3外顯子的c.232A>T p.I78F錯義突變(黑箭);2C. BEST1基因第6外顯子的c.698C>T p.P233L錯義突變(黑箭);2D. BEST1基因第8外顯子的c.910_912del,p.D304del缺失突變(黑箭);2E, 2F. 家系正常成員,BEST1基因對應位點未見突變
圖2
MVR患者BEST1基因測序圖。2A. BEST1基因第2外顯子的c.140G>T p.R47L錯義突變(黑箭);2B. BEST1基因第3外顯子的c.232A>T p.I78F錯義突變(黑箭);2C. BEST1基因第6外顯子的c.698C>T p.P233L錯義突變(黑箭);2D. BEST1基因第8外顯子的c.910_912del,p.D304del缺失突變(黑箭);2E, 2F. 家系正常成員,BEST1基因對應位點未見突變
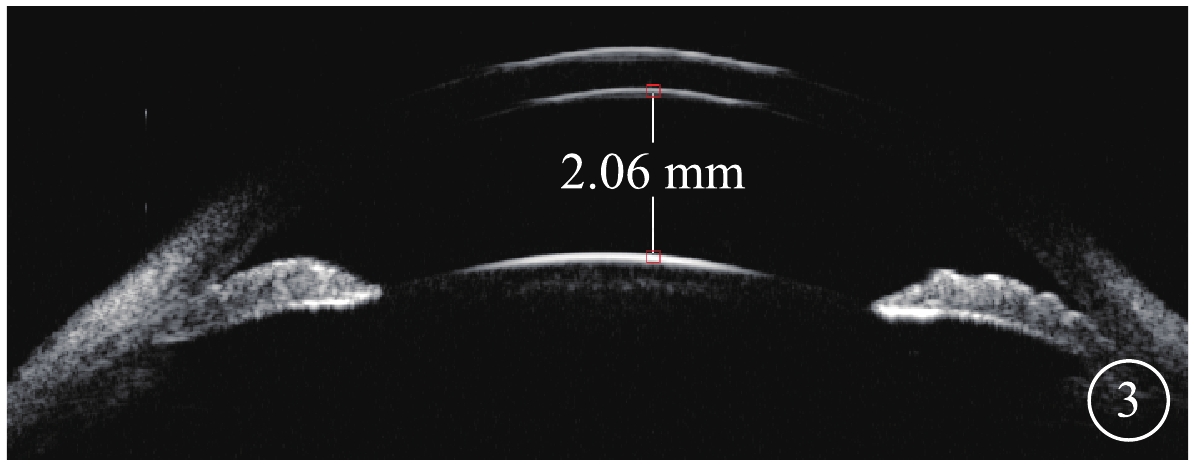
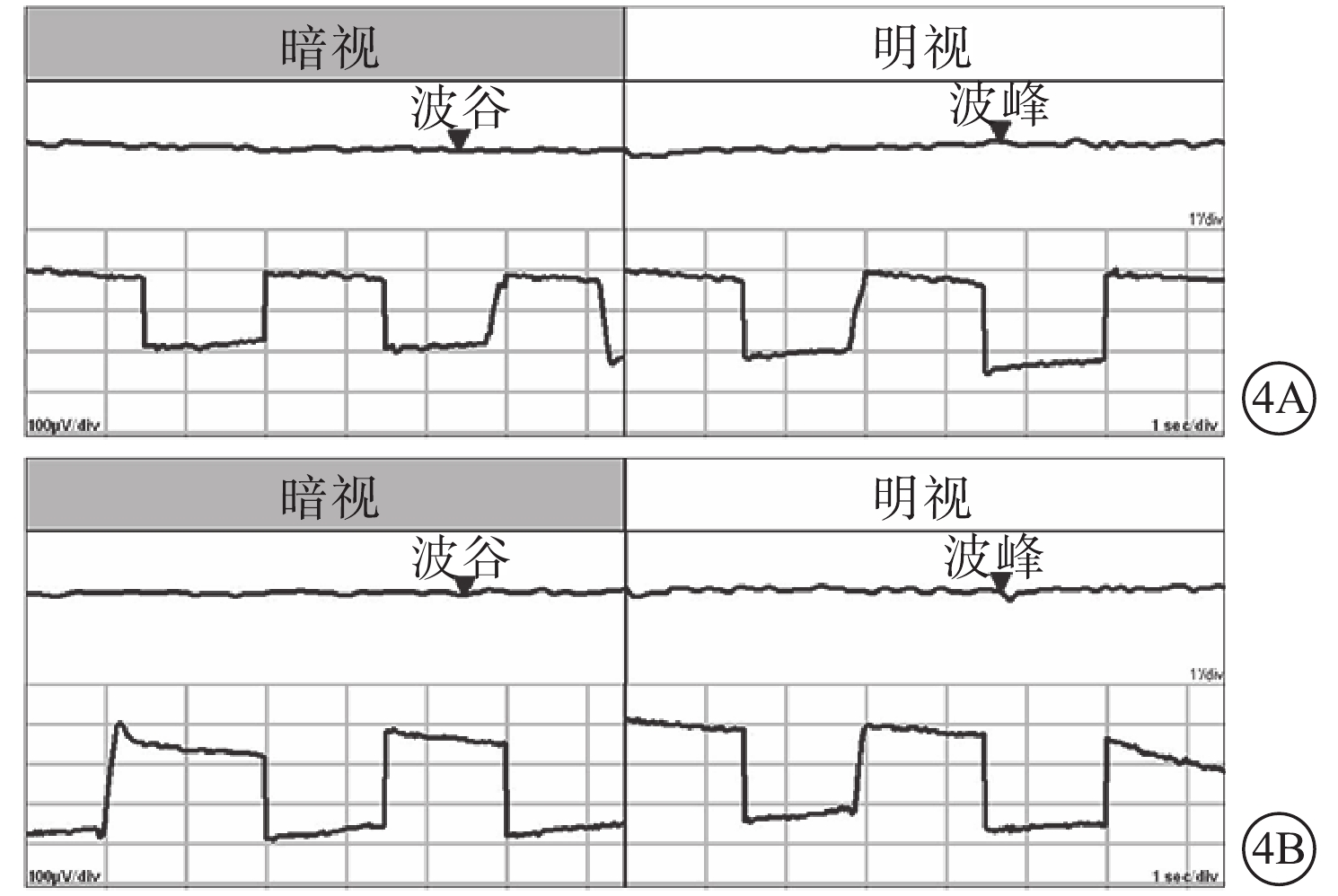
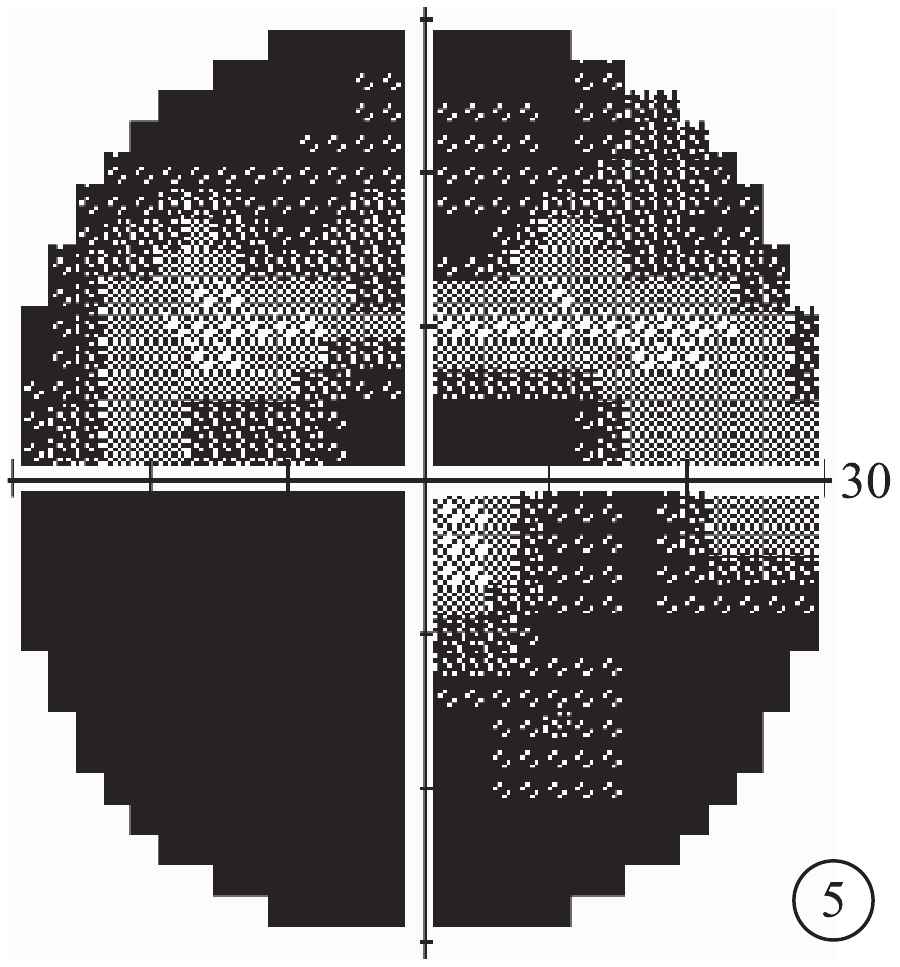
患者主述發病時視物模糊5例,眼前漂浮物2例,視物變形2例。患眼BCVA手動~1.0。首診時眼壓13~47 mm Hg(1 mmHg=0.133 kPa),平均眼壓為(30.39±11.86)mm Hg;眼壓升高12只眼。屈光度?2.25~+2.50 D,平均屈光度(?0.33±1.68)D。AL 20.55~22.97 mm,平均AL(21.87±0.63)mm。中央前房深度1.68~2.68 mm,平均前房深度(2.17±0.29)mm;閉角型青光眼(ACG)12只眼,房角關閉(AC)(圖3)4只眼。行EOG檢查的12只眼,Arden比均<1.55(圖4)。行視野檢查的13只眼,中心暗點、旁中心暗點、弓形暗點、中心30°視野彌漫性缺損(圖5)分別為5、4、1、7只眼。
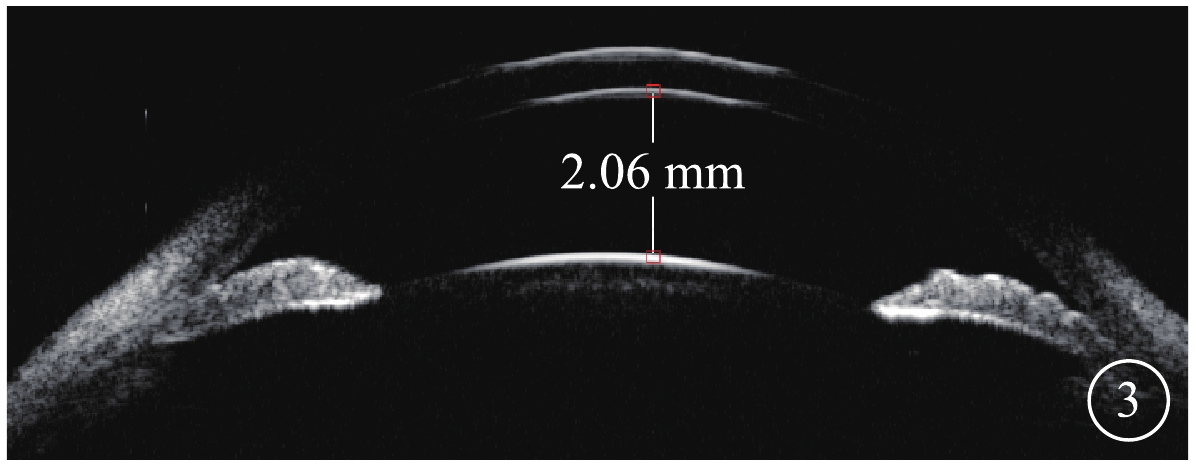 圖3
MVR患眼UBM像。中央前深度 2.06 mm,AC
圖3
MVR患眼UBM像。中央前深度 2.06 mm,AC
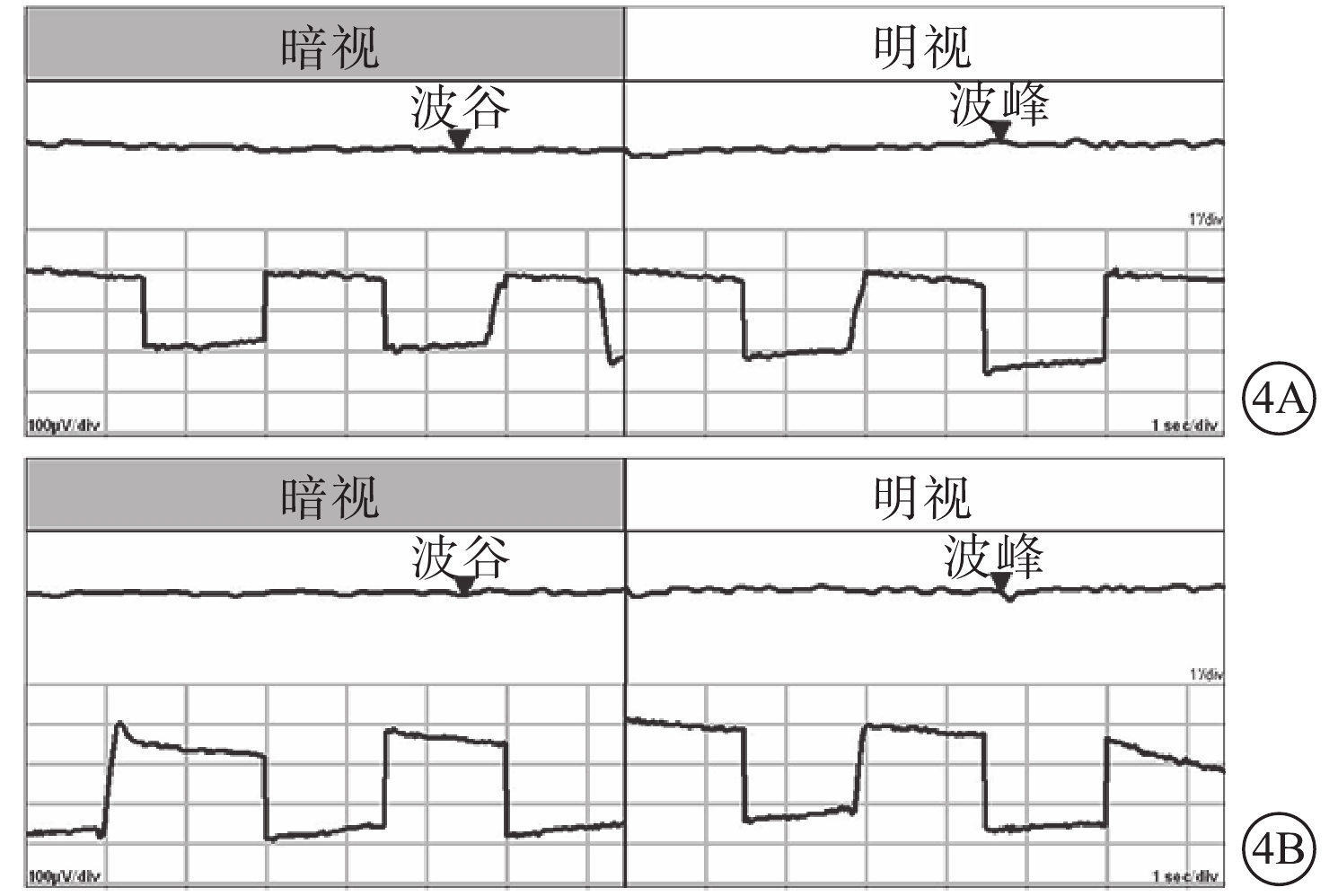 圖4
MVR患者雙眼EOG像。4A. 右眼;4B. 左眼。Arden比分別為1.2、1.0
圖4
MVR患者雙眼EOG像。4A. 右眼;4B. 左眼。Arden比分別為1.2、1.0
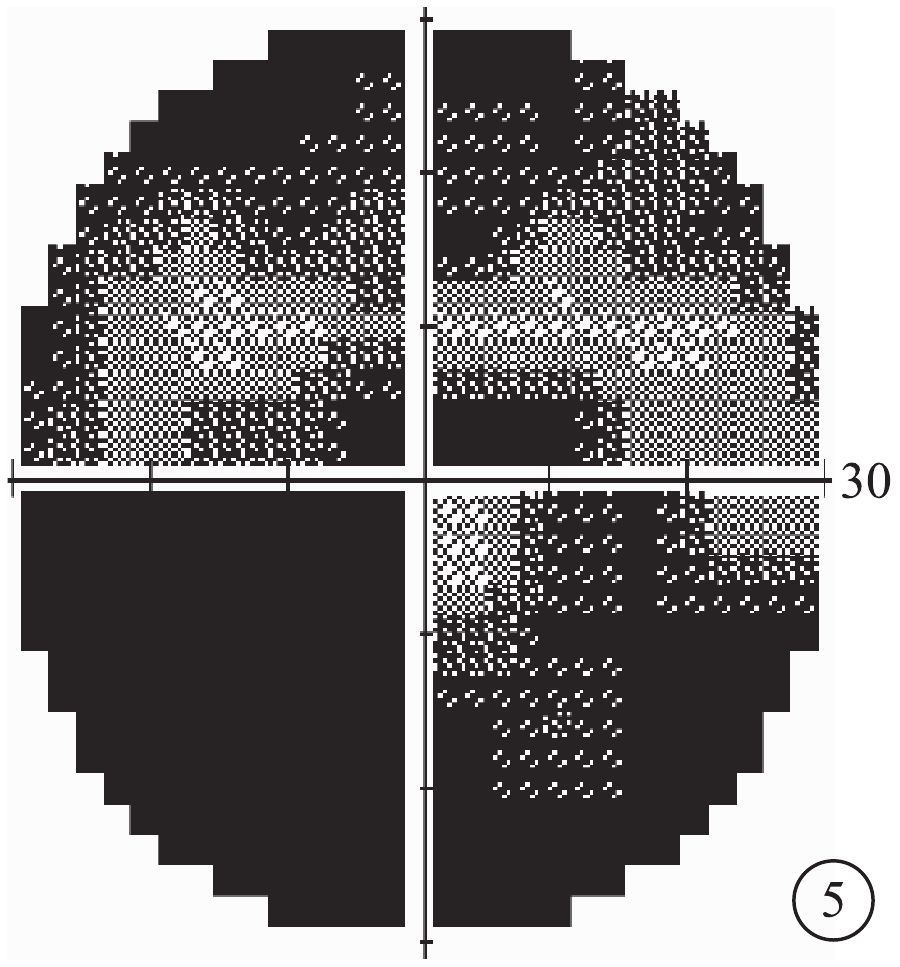 圖5
圖3同眼視野像。彌漫性光敏感度下降,視野平均缺損值?28.27 dB
圖5
圖3同眼視野像。彌漫性光敏感度下降,視野平均缺損值?28.27 dB
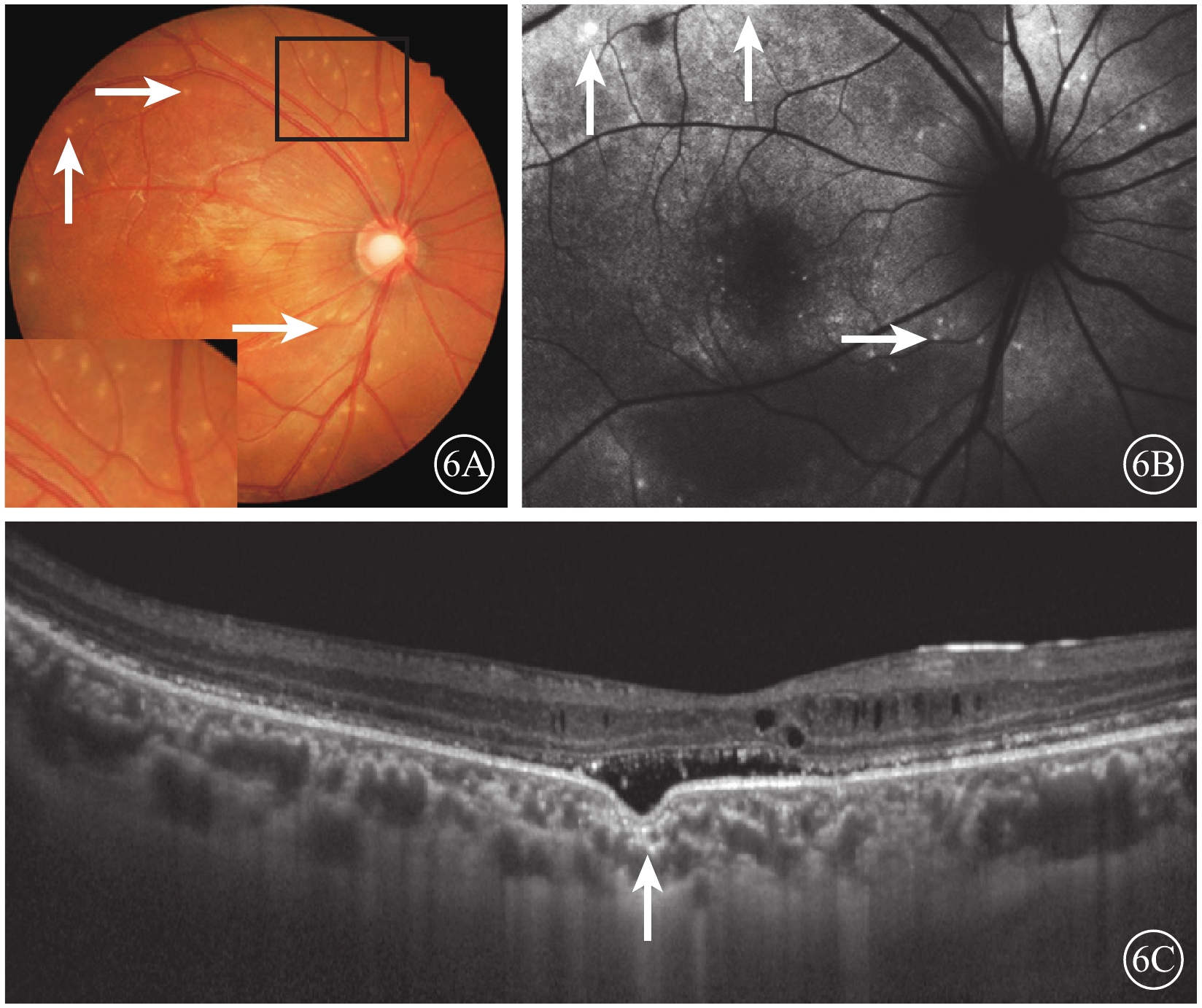
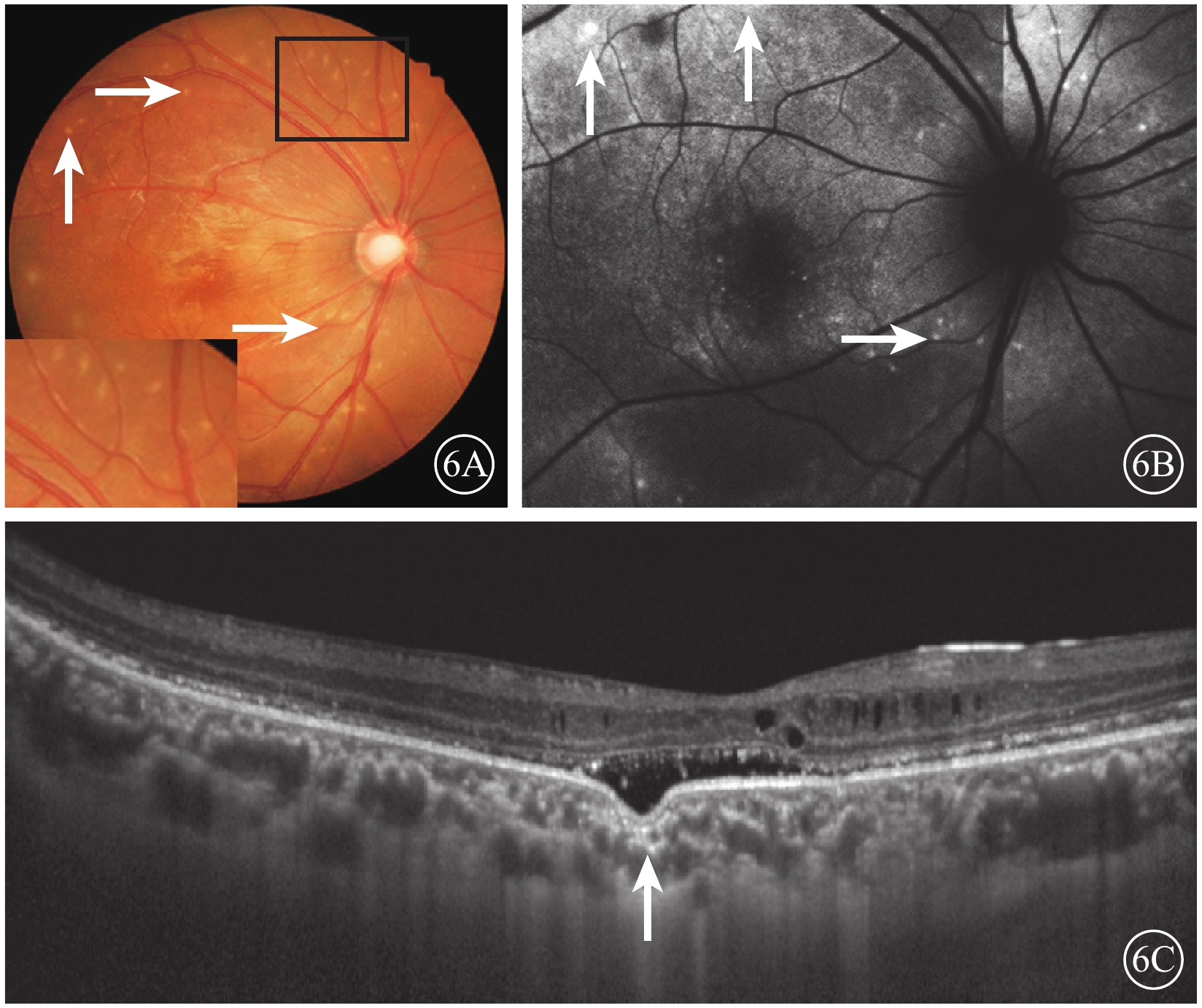
眼底彩色照相檢查顯示,所有患眼視網膜后極部均可見對稱的MVL;病灶分布于黃斑區、視網膜顳上及顳下血管弓及視盤周圍;病灶較小,數量不定,部分病灶融合成片(圖6A)。AF檢查結果顯示,后極部視網膜呈不規則強、弱熒光改變(圖6B)。頻域OCT檢查結果顯示,視網膜輕度水腫,神經上皮層廣泛淺脫離,光感受器外節延長,視網膜及色素上皮(RPE)層間強反射沉積物。黃斑區神經上皮層、RPE層分離,存在局灶性脈絡膜凹陷(FCE)(圖6C)1只眼;患者BEST1基因雜合突變(c.698C>T,p.P233I)。
ACG 12只眼及AC 4只眼不僅有上述視網膜病變,同時還伴有以下特征:(1)AL短,平均AL(21.87±0.63)mm。(2)房角狹窄及關閉,周邊前房深度<1/3 CT至消失,房角鏡下房角關閉鐘點數為8(5,11);UBM檢查發現房角狹窄及關閉(圖3)。(3)青光眼性視神經病變,伴ACG者,視盤蒼白、杯盤比擴大至0.5~0.9(圖6A),視盤周圍RNFL變薄。
ACG 12只眼中,行復合式小梁切除手術6只眼;另外6只眼及AC 4只眼行周邊虹膜切除手術聯合降眼壓藥物治療。行復合式小梁切除手術的6只眼,均在手術后1個月內出現頑固性淺前房;眼壓8~12 mm Hg,平均眼壓(10.00±1.41)mmHg。藥物保守治療后前房未能恢復,再次行白內障超聲乳化吸除聯合人工晶狀體植入、前段玻璃體切割手術;手術后隨訪時間(40.33±22.5)個月。末次隨訪時,平均眼壓(9.33±1.03)mmHg。行周邊虹膜切除手術聯合降眼壓藥物治療的10只眼,手術后平均隨訪時間(23.6±18.06)個月。末次隨訪時平均眼壓(14.9±4.04)mmHg。所有患眼均未出現前房變淺等并發癥。
3 討論
BEST1基因位于11q12.3,包括11個外顯子,其編碼產物Bestrophin-1蛋白主要表達于RPE層,為跨膜蛋白,具有多種功能[8]。當BEST1基因發生致病性突變,Bestrophin-1蛋白結構及功能發生改變,引起RPE細胞代謝異常,從而導致視網膜下脂褐質異常積聚,光感受器發生萎縮、凋亡,細胞外液增多等病理性改變。眼底表現為黃白色物質積聚、視網膜水腫、廣泛淺脫離。EOG光峰值反映RPE氯離子通道功能,在BEST1基因突變致病患者中普遍降低[9]。
BEST1基因相關遺傳性眼病包括BVMD、常染色體隱性遺傳Best病變、成人型卵黃樣黃斑營養不良(AOFVD)、視網膜色素變性、常染色體顯性遺傳玻璃體視網膜脈絡膜病變以及常染色體顯性遺傳小角膜-光感受器營養不良-早發型白內障-后鞏膜葡萄腫綜合征[9]。其中以BVMD最為常見。BVMD病程進展緩慢,典型臨床表現為黃斑部視網膜下卵黃樣物質沉積,EOG Arden比<1.55[10]。BVMD具有臨床表現異質性的特點,即使在同一家系內,不同患者之間也可存在較大的表型差異[5, 11-13]。Mullins等[13]研究發現,約有9.1%的BVMD患者具有不典型的臨床改變,表現為卵黃樣病灶呈多灶性沉積。本研究通過對5個MVR家系的研究,發現4個BEST1基因突變,其中2個為新突變。所有患者均攜帶BEST1基因的雜合突變,提示MVR與BEST1基因變異有關,而該病與BVMD的關系還需進一步研究。
目前文獻報道BVMD的基因突變超過100個,多數為高加索人,主要為錯義突變[9]。本研究結果顯示,p.R47L與p.I78F為新突變,p.P233L與p.D304del為已知突變。而與p.R47L同一位點的突變c.140G>A,p.R47H曾在AOFVD患者中發現[14]。p.P233L與p.D304del為已知突變,在具有典型的BVMD或MVR表型的顯性遺傳家系中發現[15-17]。以上位點均位于或接近RPE細胞基底膜,提示對Bestrophin-1蛋白功能有重要影響[9]。
本研究結果顯示,所有患眼均存在視網膜后極部散在卵黃樣病灶,病灶大小不一,于黃斑區及沿顳側血管弓分布;EOG Arden比<1.55。結果與Boon等[4]、Blodi和Stone[18]的研究發現一致。既往曾在MVR患眼中發現黃斑區視網膜萎縮灶。根據典型BVMD分期,萎縮可能為卵黃樣病灶的晚期改變;而本組患者均未見明顯視網膜萎縮灶,可能與病程有關。本組患眼中,黃斑區存在FCE者1只眼,為偏中心凹型及非粘附型,目前未有MVR患者合并FCE的報道。推測與病灶區視網膜下積液的壓力改變有關[19, 20]。
BEST1基因突變導致RPE的功能異常,不僅引起視網膜病變,還可影響眼球的正常發育[21],導致患者AL變短、眼前節結構擁擠的眼球生物學改變,部分患者可伴有ACG。而眼底廣泛視網膜神經上皮層脫離向前段延伸是否可造成睫狀體發生病理改變,從而引起AC,發生ACG有待進一步研究。本組患者中伴ACG和(或)AC者8例,占88.9%,高于既往研究;其原因可能與卵黃樣病變進展緩慢,部分患者未予以重視,當ACG進展后加劇視力損傷方到醫院就診,導致本組患者發生ACG比例較高。
本研究還發現MVR伴ACG者行小梁切除手術后均出現眼壓正常的頑固淺前房,保守治療無效,需行超聲乳化白內障吸除聯合人工晶狀體植入手術同時切除前段玻璃體切割才能恢復前房。與惡性青光眼不同,惡性青光眼手術后淺前房往往伴有眼壓升高,主要是睫狀環阻滯所致[22]。而MVR伴ACG者出現手術后淺前房時眼壓正常,推測其可能原因與RPE功能缺陷致患者長期存在視網膜神經上皮層廣泛漿液性脫離造成的前后房壓力不平衡有關[23]。而行周邊虹膜切除手術聯合藥物治療者,不僅降低小梁切除手術后的并發癥,還能較好控制眼壓,是此類繼發青光眼患者可考慮的首選治療方法。
多灶性卵黃樣視網膜病變(MVR)表現為視網膜后極部多灶性卵黃樣病變(MVL),伴有視網膜水腫、脫離及色素改變[1-3]。MVR可為散發病例或家族遺傳。既往研究發現,60%的MVR患者攜帶BEST1基因雜合突變,并有眼電圖(EOG)光峰值降低,因而認為該病為Best卵黃樣黃斑營養不良(BVMD)的一種非典型臨床表型[4, 5]。目前關于MVR的研究多為高加索人種,國內僅有零星病例報告[6]。本研究對5個MVR家系進行BEST1基因突變篩查,并對臨床表型進行了觀察。現將結果報道如下。
1 對象和方法
回顧性系列病例研究。本研究經中山眼科中心倫理委員會審核批準。研究遵循赫爾辛基宣言,所有受檢者和未成年患者監護人均簽署知情同意書。
2006年6月至2016年12月在中山大學中山眼科中心就診的MVR患者9例18只眼及家系正常成員10名納入研究。患者分別來自5個無血緣關系家系。患者中,男性4例8只眼,女性5例10只眼;均為雙眼。發病時年齡10~36歲;就診時年齡19~50歲,平均年齡(28.7±8.9)歲。家系正常成員10名中,男性6名,女性4名;年齡4~31歲。納入標準:(1)視網膜下MVL;(2)EOG光峰值降低,光峰/暗谷值(Arden比)<1.55。排除標準:(1)中心性漿液性脈絡膜視網膜病變、老年性黃斑病變、Stargardt病及先天性視網膜劈裂者;(2)患有糖尿病、重癥高血壓、肺心病、腦血栓、腫瘤等全身性疾病者;(3)長期應用系統性糖皮質激素、抗凝藥物以及腎臟透析者。
詳細收集患者及家系成員的基本信息及現病史,繪制家系圖。所有受檢者均行最佳矯正視力(BCVA)、眼壓、屈光度、裂隙燈顯微鏡、90 D前置鏡、前房角鏡、頻域光相干斷層掃描(OCT)、眼底自身熒光(AF)、眼底彩色照相、超聲生物顯微鏡(UBM)檢查,以及眼軸長度(AL)測量。BCVA>0.1且固視良好者行EOG及視野檢查。其中,行EOG檢查12只眼;視野檢查13只眼。眼壓測量采用Goldmann壓平眼壓計;頻域OCT檢查采用德國海德堡公司Spectralis OCT儀,HRA程序下行AF檢查;眼底照相采用日本興和株式會社Kowa眼底照相機;EOG檢查采用德國羅蘭公司RetiPort系統;UBM檢查采用天津索維電子公司Model SW-3200L;視野檢查采用美國Zeiss公司Humphrey全自動視野計HFA-Ⅱ;AL測量采用法國光太公司A/B型超聲儀。患者臨床表現符合MVR診斷標準[4, 5]。10名家系正常成員視力、眼壓及眼部檢查均正常。
抽取受試者外周靜脈血5 ml,乙二胺四乙酸抗凝,采用酚氯仿法抽提DNA提取全基因組DNA,?80 ℃冰箱保存。根據在Pubmed(https://www.ncbi.nlm.nih.gov/)與UCSC數據庫(http://genome.ucsc.edu/)查閱結果,選取轉錄本NM_004183.3的2~9、11號外顯子與轉錄本NM_001139443.1的10號外顯子,應用Primer 5.0軟件設計引物(表1)。聚合酶鏈反應(PCR)擴增BEST1基因外顯子及其側翼。PCR反應條件:96 ℃預變性5 min,96 ℃變性30 s,55~62 ℃退火20 s,72 ℃延伸1 min,共30個循環;延伸5 min。PCR擴增產物2%瓊脂糖凝膠電泳檢測并純化。采用ABI 3730XL型全自動序列儀電泳并記錄序列數據(美國ABI公司)。
采用Chromas 2.0軟件進行序列分析,依據峰圖波形判斷純合突變與雜合突變。根據美國醫學遺傳學和基因組學學會(ACMG)指南篩查致病性突變[7];千人基因組計劃(1000G)(http://browser.1000genomes.org/index.html)、美國國立心肺和血液研究所(EVS)(http://evs.gs.washington.edu/EVS/)、外顯子集成聯盟(ExAC)(http://exac.broadinstitute.org/)分析基因突變頻率; 在線工具PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)、Provean (http://provean.jcvi.org/genome_submit_2.php?species=human)、MutationTaster(MT)(http://www.mutationtaster.org/)、SIFT(http://sift.jcvi.org/www/SIFT_enst_submit.html)預測致病性。孟德爾遺傳規律判斷遺傳方式。
2 結果
5個家系中,家系2、4、5先證者有明確家族史,其中家系5呈常染色體顯性遺傳(圖1)。

9例患者DNA測序結果發現BEST1基因突變位點4個,其中新發現突變位點2個。錯義突變3個(c.140G>T,p.R47L;c.232A>T,p.I78F;c.698C>T,p.P233L);缺失突變1個(c.910_912del,p.D304del)(圖2A~2D,表2)。p.R47L和p.I78F為新發現突變位點。家系正常成員未檢測到BEST1基因突變(圖2E, 2F)。
 圖2
MVR患者BEST1基因測序圖。2A. BEST1基因第2外顯子的c.140G>T p.R47L錯義突變(黑箭);2B. BEST1基因第3外顯子的c.232A>T p.I78F錯義突變(黑箭);2C. BEST1基因第6外顯子的c.698C>T p.P233L錯義突變(黑箭);2D. BEST1基因第8外顯子的c.910_912del,p.D304del缺失突變(黑箭);2E, 2F. 家系正常成員,BEST1基因對應位點未見突變
圖2
MVR患者BEST1基因測序圖。2A. BEST1基因第2外顯子的c.140G>T p.R47L錯義突變(黑箭);2B. BEST1基因第3外顯子的c.232A>T p.I78F錯義突變(黑箭);2C. BEST1基因第6外顯子的c.698C>T p.P233L錯義突變(黑箭);2D. BEST1基因第8外顯子的c.910_912del,p.D304del缺失突變(黑箭);2E, 2F. 家系正常成員,BEST1基因對應位點未見突變
患者主述發病時視物模糊5例,眼前漂浮物2例,視物變形2例。患眼BCVA手動~1.0。首診時眼壓13~47 mm Hg(1 mmHg=0.133 kPa),平均眼壓為(30.39±11.86)mm Hg;眼壓升高12只眼。屈光度?2.25~+2.50 D,平均屈光度(?0.33±1.68)D。AL 20.55~22.97 mm,平均AL(21.87±0.63)mm。中央前房深度1.68~2.68 mm,平均前房深度(2.17±0.29)mm;閉角型青光眼(ACG)12只眼,房角關閉(AC)(圖3)4只眼。行EOG檢查的12只眼,Arden比均<1.55(圖4)。行視野檢查的13只眼,中心暗點、旁中心暗點、弓形暗點、中心30°視野彌漫性缺損(圖5)分別為5、4、1、7只眼。
 圖3
MVR患眼UBM像。中央前深度 2.06 mm,AC
圖3
MVR患眼UBM像。中央前深度 2.06 mm,AC
 圖4
MVR患者雙眼EOG像。4A. 右眼;4B. 左眼。Arden比分別為1.2、1.0
圖4
MVR患者雙眼EOG像。4A. 右眼;4B. 左眼。Arden比分別為1.2、1.0
 圖5
圖3同眼視野像。彌漫性光敏感度下降,視野平均缺損值?28.27 dB
圖5
圖3同眼視野像。彌漫性光敏感度下降,視野平均缺損值?28.27 dB
眼底彩色照相檢查顯示,所有患眼視網膜后極部均可見對稱的MVL;病灶分布于黃斑區、視網膜顳上及顳下血管弓及視盤周圍;病灶較小,數量不定,部分病灶融合成片(圖6A)。AF檢查結果顯示,后極部視網膜呈不規則強、弱熒光改變(圖6B)。頻域OCT檢查結果顯示,視網膜輕度水腫,神經上皮層廣泛淺脫離,光感受器外節延長,視網膜及色素上皮(RPE)層間強反射沉積物。黃斑區神經上皮層、RPE層分離,存在局灶性脈絡膜凹陷(FCE)(圖6C)1只眼;患者BEST1基因雜合突變(c.698C>T,p.P233I)。
ACG 12只眼及AC 4只眼不僅有上述視網膜病變,同時還伴有以下特征:(1)AL短,平均AL(21.87±0.63)mm。(2)房角狹窄及關閉,周邊前房深度<1/3 CT至消失,房角鏡下房角關閉鐘點數為8(5,11);UBM檢查發現房角狹窄及關閉(圖3)。(3)青光眼性視神經病變,伴ACG者,視盤蒼白、杯盤比擴大至0.5~0.9(圖6A),視盤周圍RNFL變薄。
ACG 12只眼中,行復合式小梁切除手術6只眼;另外6只眼及AC 4只眼行周邊虹膜切除手術聯合降眼壓藥物治療。行復合式小梁切除手術的6只眼,均在手術后1個月內出現頑固性淺前房;眼壓8~12 mm Hg,平均眼壓(10.00±1.41)mmHg。藥物保守治療后前房未能恢復,再次行白內障超聲乳化吸除聯合人工晶狀體植入、前段玻璃體切割手術;手術后隨訪時間(40.33±22.5)個月。末次隨訪時,平均眼壓(9.33±1.03)mmHg。行周邊虹膜切除手術聯合降眼壓藥物治療的10只眼,手術后平均隨訪時間(23.6±18.06)個月。末次隨訪時平均眼壓(14.9±4.04)mmHg。所有患眼均未出現前房變淺等并發癥。
3 討論
BEST1基因位于11q12.3,包括11個外顯子,其編碼產物Bestrophin-1蛋白主要表達于RPE層,為跨膜蛋白,具有多種功能[8]。當BEST1基因發生致病性突變,Bestrophin-1蛋白結構及功能發生改變,引起RPE細胞代謝異常,從而導致視網膜下脂褐質異常積聚,光感受器發生萎縮、凋亡,細胞外液增多等病理性改變。眼底表現為黃白色物質積聚、視網膜水腫、廣泛淺脫離。EOG光峰值反映RPE氯離子通道功能,在BEST1基因突變致病患者中普遍降低[9]。
BEST1基因相關遺傳性眼病包括BVMD、常染色體隱性遺傳Best病變、成人型卵黃樣黃斑營養不良(AOFVD)、視網膜色素變性、常染色體顯性遺傳玻璃體視網膜脈絡膜病變以及常染色體顯性遺傳小角膜-光感受器營養不良-早發型白內障-后鞏膜葡萄腫綜合征[9]。其中以BVMD最為常見。BVMD病程進展緩慢,典型臨床表現為黃斑部視網膜下卵黃樣物質沉積,EOG Arden比<1.55[10]。BVMD具有臨床表現異質性的特點,即使在同一家系內,不同患者之間也可存在較大的表型差異[5, 11-13]。Mullins等[13]研究發現,約有9.1%的BVMD患者具有不典型的臨床改變,表現為卵黃樣病灶呈多灶性沉積。本研究通過對5個MVR家系的研究,發現4個BEST1基因突變,其中2個為新突變。所有患者均攜帶BEST1基因的雜合突變,提示MVR與BEST1基因變異有關,而該病與BVMD的關系還需進一步研究。
目前文獻報道BVMD的基因突變超過100個,多數為高加索人,主要為錯義突變[9]。本研究結果顯示,p.R47L與p.I78F為新突變,p.P233L與p.D304del為已知突變。而與p.R47L同一位點的突變c.140G>A,p.R47H曾在AOFVD患者中發現[14]。p.P233L與p.D304del為已知突變,在具有典型的BVMD或MVR表型的顯性遺傳家系中發現[15-17]。以上位點均位于或接近RPE細胞基底膜,提示對Bestrophin-1蛋白功能有重要影響[9]。
本研究結果顯示,所有患眼均存在視網膜后極部散在卵黃樣病灶,病灶大小不一,于黃斑區及沿顳側血管弓分布;EOG Arden比<1.55。結果與Boon等[4]、Blodi和Stone[18]的研究發現一致。既往曾在MVR患眼中發現黃斑區視網膜萎縮灶。根據典型BVMD分期,萎縮可能為卵黃樣病灶的晚期改變;而本組患者均未見明顯視網膜萎縮灶,可能與病程有關。本組患眼中,黃斑區存在FCE者1只眼,為偏中心凹型及非粘附型,目前未有MVR患者合并FCE的報道。推測與病灶區視網膜下積液的壓力改變有關[19, 20]。
BEST1基因突變導致RPE的功能異常,不僅引起視網膜病變,還可影響眼球的正常發育[21],導致患者AL變短、眼前節結構擁擠的眼球生物學改變,部分患者可伴有ACG。而眼底廣泛視網膜神經上皮層脫離向前段延伸是否可造成睫狀體發生病理改變,從而引起AC,發生ACG有待進一步研究。本組患者中伴ACG和(或)AC者8例,占88.9%,高于既往研究;其原因可能與卵黃樣病變進展緩慢,部分患者未予以重視,當ACG進展后加劇視力損傷方到醫院就診,導致本組患者發生ACG比例較高。
本研究還發現MVR伴ACG者行小梁切除手術后均出現眼壓正常的頑固淺前房,保守治療無效,需行超聲乳化白內障吸除聯合人工晶狀體植入手術同時切除前段玻璃體切割才能恢復前房。與惡性青光眼不同,惡性青光眼手術后淺前房往往伴有眼壓升高,主要是睫狀環阻滯所致[22]。而MVR伴ACG者出現手術后淺前房時眼壓正常,推測其可能原因與RPE功能缺陷致患者長期存在視網膜神經上皮層廣泛漿液性脫離造成的前后房壓力不平衡有關[23]。而行周邊虹膜切除手術聯合藥物治療者,不僅降低小梁切除手術后的并發癥,還能較好控制眼壓,是此類繼發青光眼患者可考慮的首選治療方法。