引用本文: 王一瑋, 陳婷, 馬瑾, 鐘勇. 大鼠非動脈炎性前部缺血性視神經病變模型建立與評價. 中華眼底病雜志, 2018, 34(1): 60-64. doi: 10.3760/cma.j.issn.1005-1015.2018.01.015 復制
非動脈炎性前部缺血性視神經病變(NAION)多表現為突發無痛性視力下降、視盤水腫以及特征性視野缺損[1]。既往由于缺乏理想的實驗動物模型,一定程度上限制了NAION的基礎研究。建立合適的具有良好重復性的動物模型對進一步深入研究NAION的發病機制、早期病理變化或探索治療策略具有重要意義。目前NAION動物模型研究尚處于探索階段,各研究團隊的結果存在一定差異[2-4]。為進一步在動物水平上進行NAION發病機制與干預策略的研究,本研究參考光動力方法建立了NAION大鼠模型,對其視網膜、視神經損傷進行定性或定量評價。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠47只,體重180~200 g,北京維通利華實驗動物有限公司提供。復方托吡卡胺滴眼液散瞳排除眼疾。12 h光/暗循環環境飼養。采用隨機數字表法將大鼠隨機分為正常對照組、單純激光組、NAION模型組,各有13、11、23只。取右眼為實驗眼。NAION模型組采用孟加拉玫瑰紅聯合光動力方法建立模型[2]。腹腔注射10%水合氯醛麻醉大鼠后,復方托吡卡胺滴眼液充分散瞳,鹽酸奧布卡因點眼。將大鼠置于Lightlas 532眼底激光機(美國Coherent公司)前。激光參數為波長532 nm,能量50 mW,光斑直徑500 μm。按1 ml/kg的劑量經股靜脈注入2.5 mmol/L光敏劑孟加拉玫瑰紅溶液(美國Sigma公司),立即對準視盤照射12 s。單純激光組大鼠僅按上述激光參數照射視盤,不注射光敏劑。正常對照組大鼠不作任何干預。分別于建模后12 h及1、3、7、28 d應用直接檢眼鏡檢查大鼠視網膜及視盤情況。
建模后3、28 d,正常對照組、單純激光組、NAION模型組各取3、3、5只大鼠。摘出眼球,固定過夜,依次梯度酒精脫水,石蠟包埋,于角膜緣標記處做視神經矢狀切片。烤片,蘇木精伊紅(HE)染色,中性樹脂封片,光學顯微鏡觀察(日本尼康公司)并于距視盤一個視野窗的位置照相記錄。
建模后3、7、28 d,正常對照組、NAION模型組各取2、6只大鼠。摘除眼球,置入2.5%戊二醛溶液后固定過夜。去眼前節,1%鋨酸固定,磷酸鹽緩沖液沖洗,梯度酒精脫水,環氧樹脂包埋、切片,醋酸雙氧鈾和枸櫞酸鉛染色。透射電子顯微鏡(JEM-1010,日本電子株式會社)觀察并照相。
建模后21 d,正常對照組、單純激光組、NAION模型組各取8、8、12只大鼠。麻醉后將其頭部固定于900型腦立體定位儀(美國David Kopf公司)上,暴露Bregma點并參考其后移5.9、6.4 mm,旁開1.4 mm分別定位雙側上丘,微型顱鉆在相應定位點鉆開顱骨[5]。微量注射器將3%熒光金(美國Biotium公司)于每側上丘注射兩點,每針1.5 μl。熒光金標記7 d后角膜緣標記并取眼球標本置于4%多聚甲醛中固定2 h,去除眼前節,分離視網膜并定向鋪片,避光、自然風干。熒光顯微鏡(日本尼康公司)采集圖像,距視盤2 mm上下左右拍攝照片用于計數視網膜神經節細胞(RGC)。采用Photoshop 8.0.1軟件,盲法人工計數RGC密度,將右眼與左眼RGC密度比值定義為RGC存活率[6]。
采用SPSS 12.0統計學軟件進行統計分析,定量資料以均數±標準差(
 ±s)表示。3組間大鼠RGC密度及存活率比較采用單因素方差分析,組間兩兩比較采用最小顯著差法 t 檢驗。P<0.05為差異有統計學意義。
±s)表示。3組間大鼠RGC密度及存活率比較采用單因素方差分析,組間兩兩比較采用最小顯著差法 t 檢驗。P<0.05為差異有統計學意義。
2 結果
直接檢眼鏡檢查發現,NAION模型組大鼠于建模12 h后無明顯視盤水腫;建模1、3 d后可見視盤水腫,但無視網膜混濁水腫、出血;建模后7 d,視盤水腫基本消退;建模后28 d,視盤顏色變淡。正常對照組、單純激光組大鼠視網膜及視盤均未見異常。
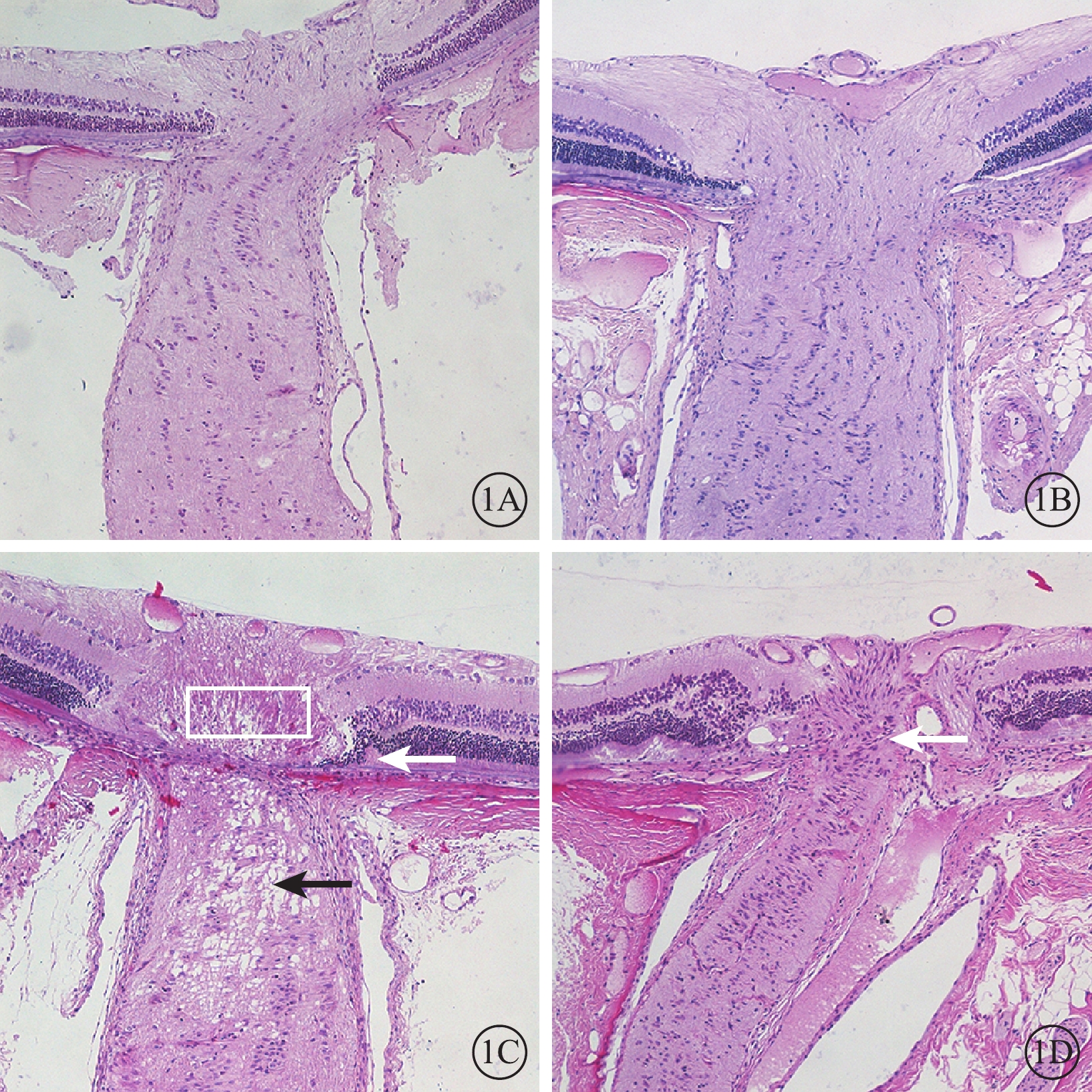
光學顯微鏡檢查發現,正常對照組與單純激光組大鼠神經纖維束縱行排列、規則有序(圖1A,1B)。NAION模型組大鼠于建模后3 d視盤明顯水腫,篩板附近視神經軸突空泡變性明顯,視盤周圍局部視網膜淺脫離(圖1C);建模后28 d視神經萎縮伴細胞浸潤,視盤周圍神經纖維層變薄(圖1D)。
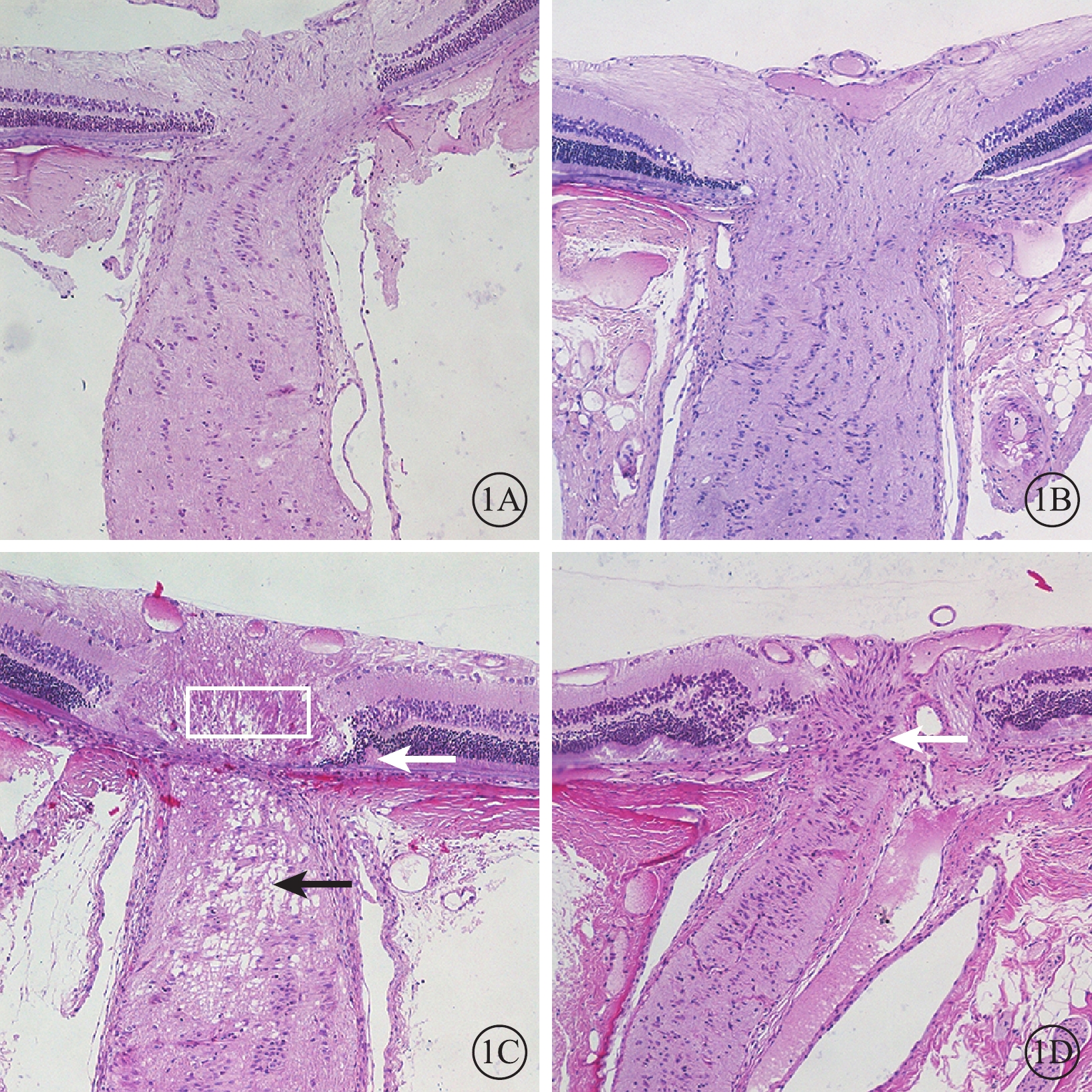 圖1
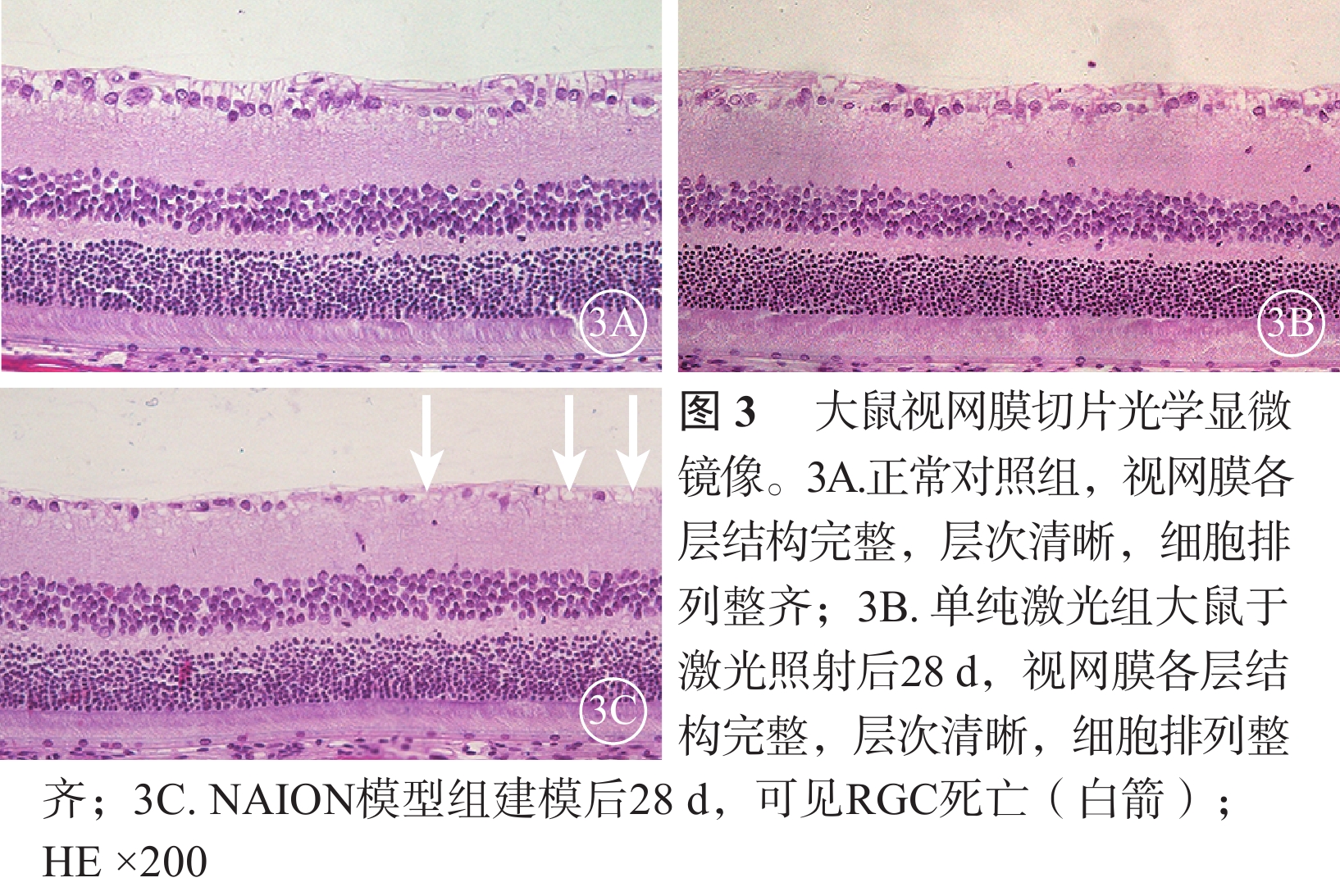
大鼠視神經矢狀切片光學顯微鏡像。1A. 正常對照組;1B. 單純激光組;1C. NAION模型組建模后3 d;1D. NAION模型組建模后28 d。正常對照組、單純激光組大鼠神經纖維束縱行排列、規則有序。NAION模型組建模后3 d視盤水腫(白框),視盤周圍局限性視網膜脫離(白箭)以及軸突空泡變性(黑箭);建模后28 d視神經萎縮、細胞浸潤(白箭) HE ×100
圖1
大鼠視神經矢狀切片光學顯微鏡像。1A. 正常對照組;1B. 單純激光組;1C. NAION模型組建模后3 d;1D. NAION模型組建模后28 d。正常對照組、單純激光組大鼠神經纖維束縱行排列、規則有序。NAION模型組建模后3 d視盤水腫(白框),視盤周圍局限性視網膜脫離(白箭)以及軸突空泡變性(黑箭);建模后28 d視神經萎縮、細胞浸潤(白箭) HE ×100
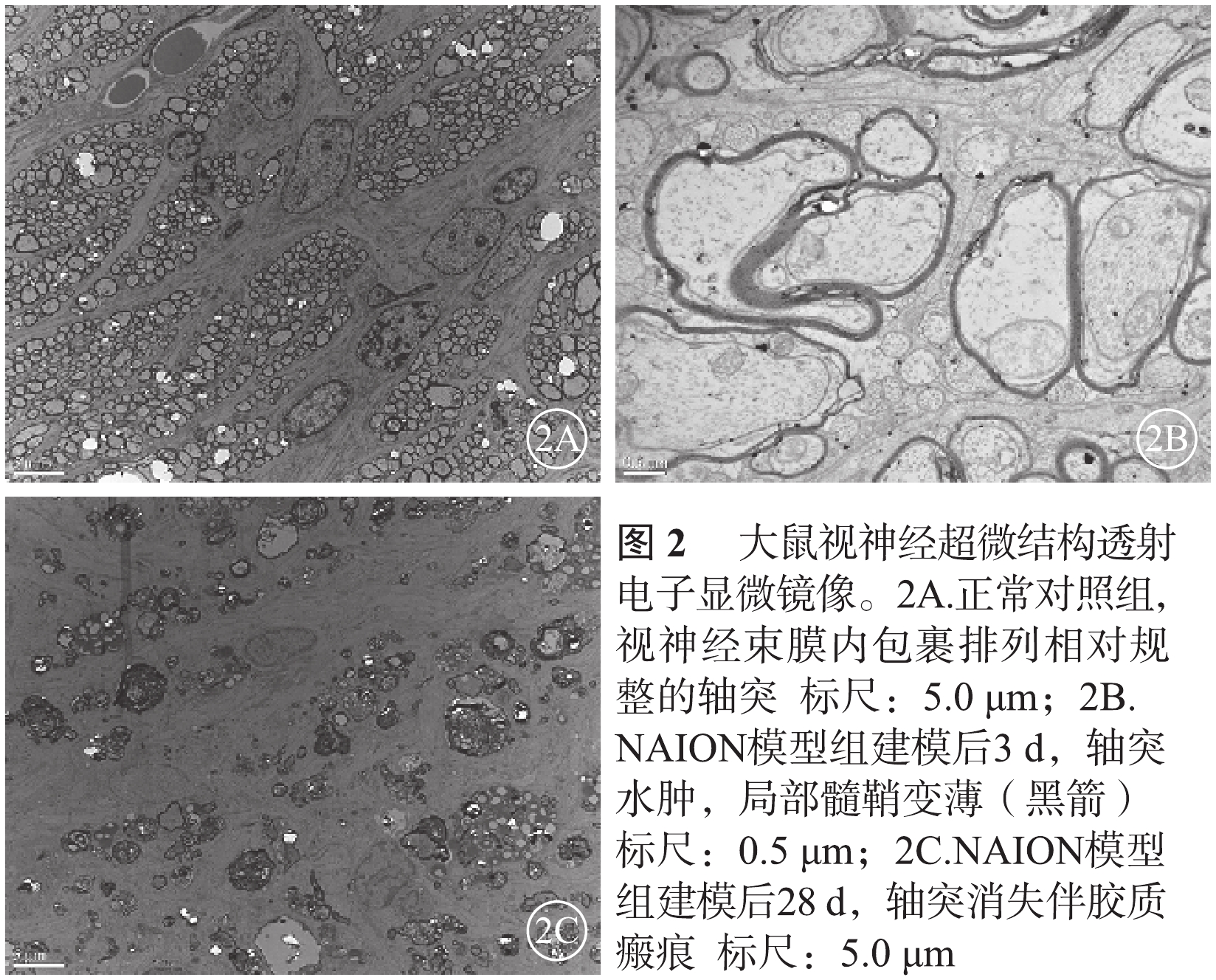
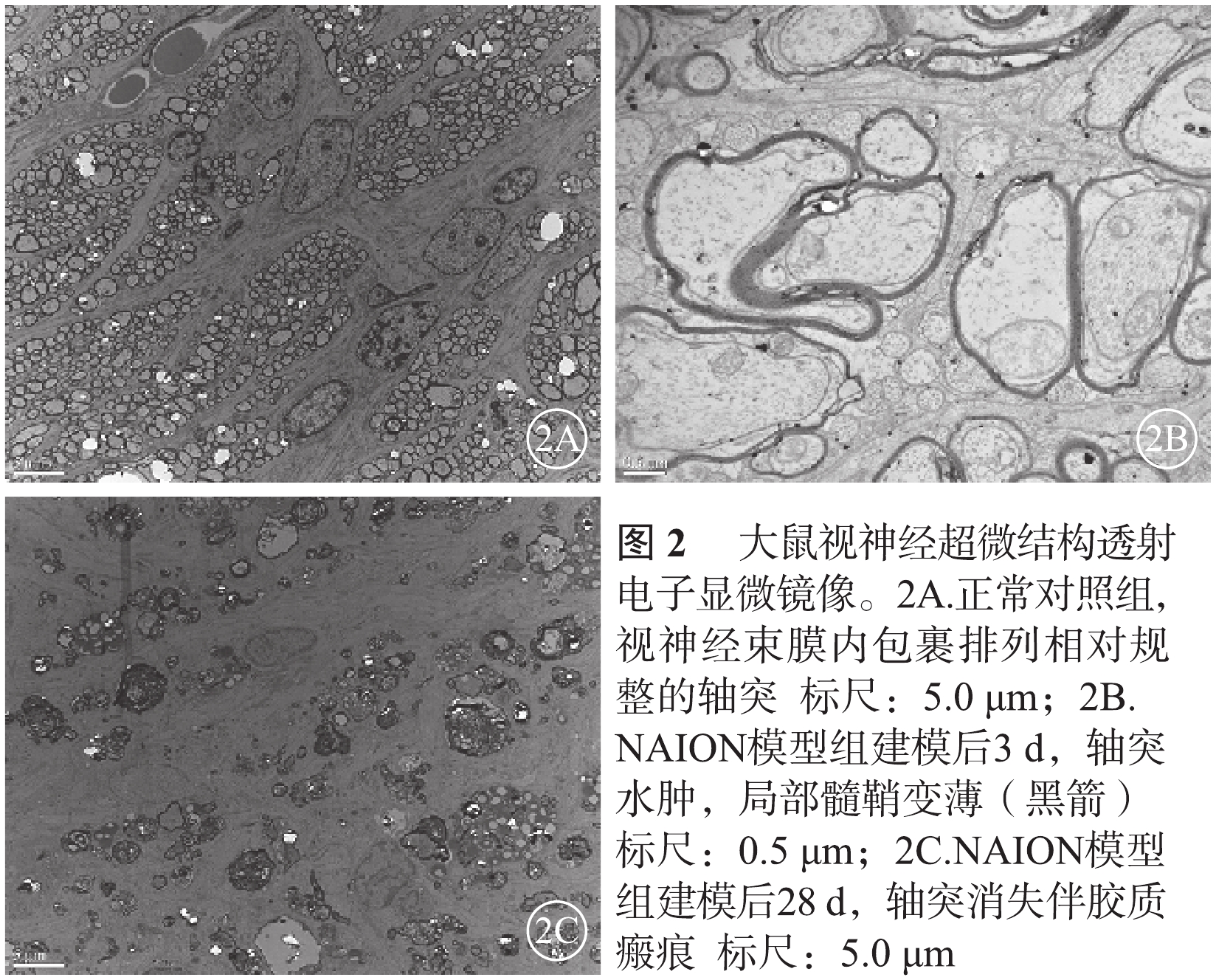
透射電子顯微鏡觀察發現,正常對照組大鼠視神經的神經纖維束排列相對規整,未見明顯軸突損傷(圖2A)。NAION模型組大鼠于建模后3 d視神經軸突水腫、局部髓鞘變薄(圖2B),建模后28 d視神經軸突大量消失,膠質瘢痕明顯(圖2C)。
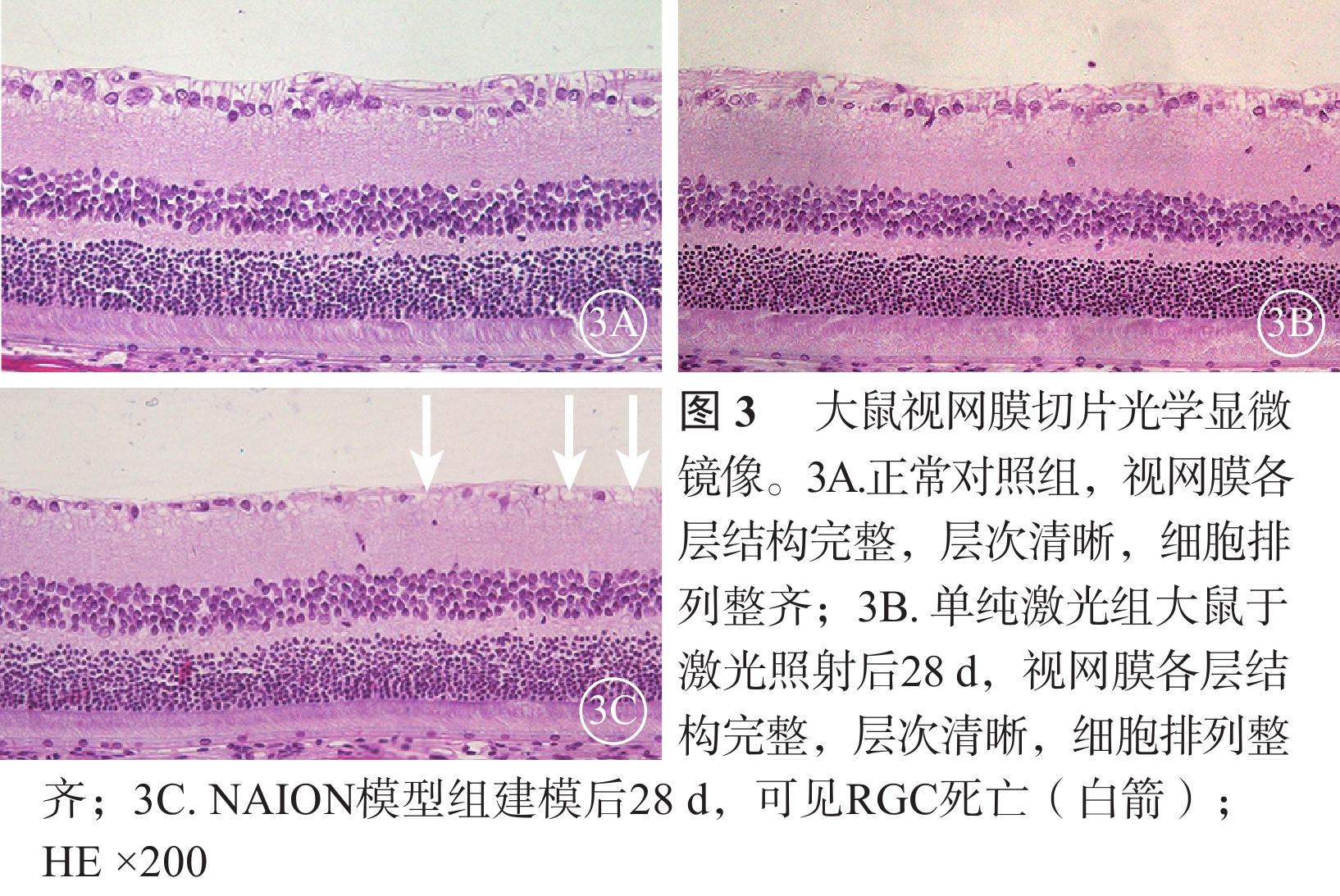
光學顯微鏡觀察發現,正常對照組大鼠及單純激光組大鼠于激光照射后28 d均可見視網膜各層結構完整,層次清晰,細胞排列整齊(圖3A,3B)。NAION模型組大鼠于建模后28 d可見RGC明顯減少、核染色致密,視網膜神經纖維層變薄,而內核層、外核層無明顯變化(圖3C)。
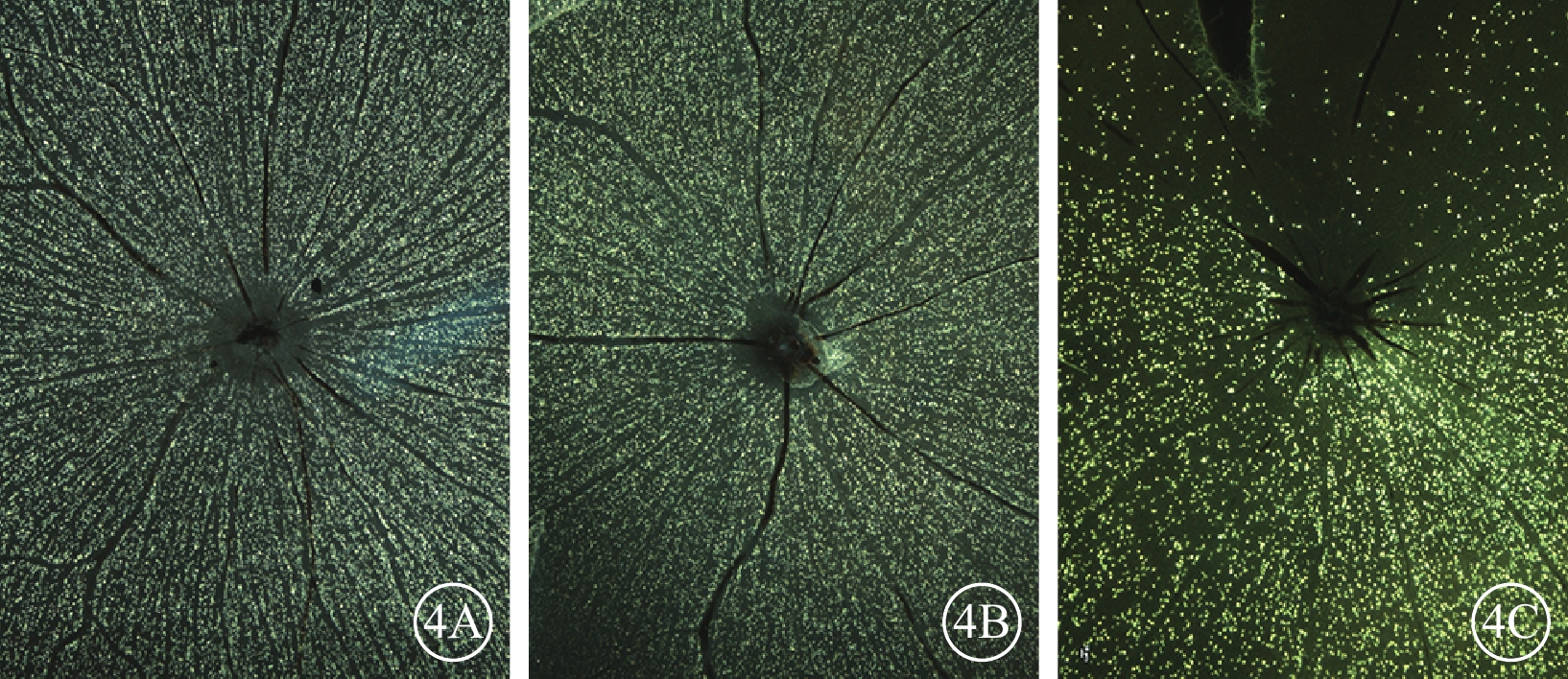
熒光顯微鏡觀察發現,正常對照組、單純激光組大鼠RGC無明顯RGC死亡(圖4A,4B),NAION模型組大鼠RGC明顯減少(圖4C)。
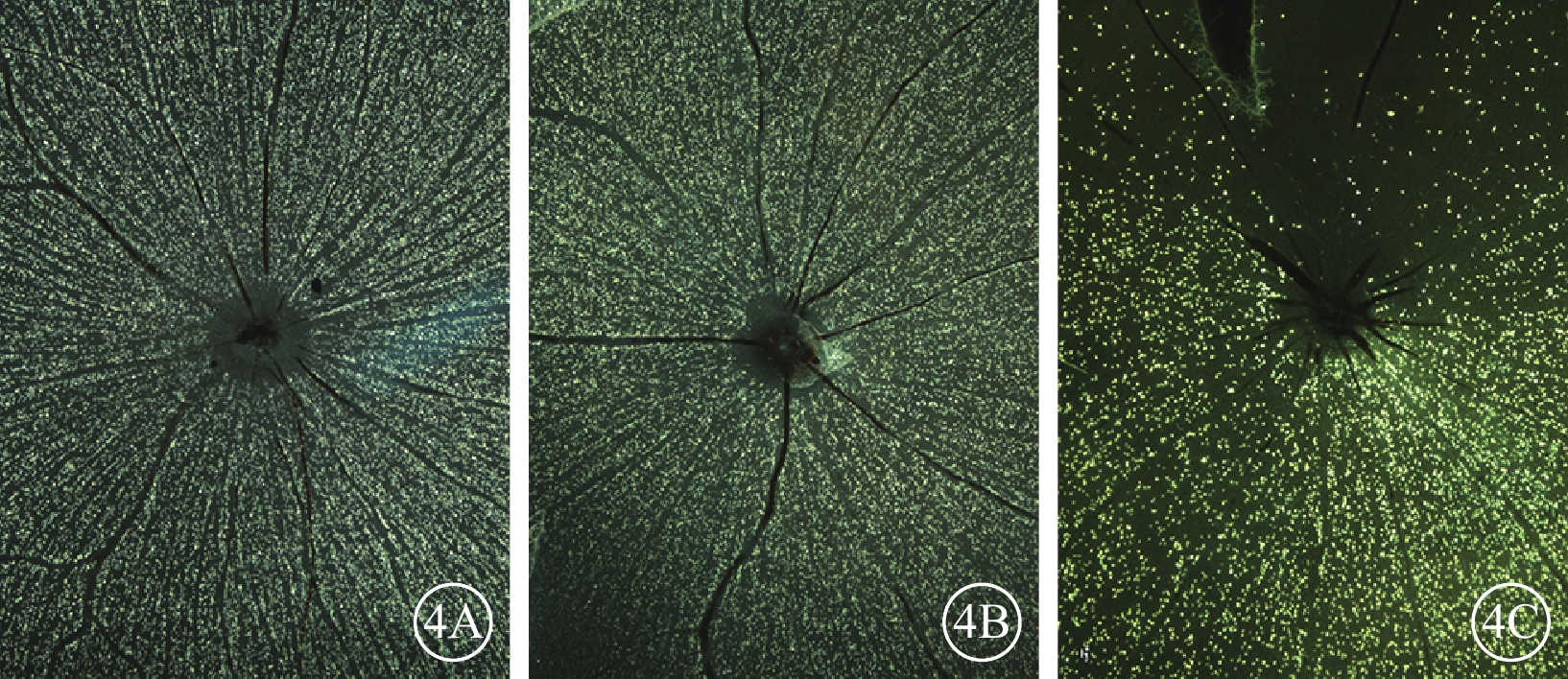 圖4
大鼠RGC熒光顯微鏡像。4A. 正常對照組;4B. 單純激光組;4C. NAION模型組建模后28 d。正常對照組、單純激光組大鼠RGC無明顯RGC死亡,而NAION模型組RGC明顯減少 ×40
圖4
大鼠RGC熒光顯微鏡像。4A. 正常對照組;4B. 單純激光組;4C. NAION模型組建模后28 d。正常對照組、單純激光組大鼠RGC無明顯RGC死亡,而NAION模型組RGC明顯減少 ×40
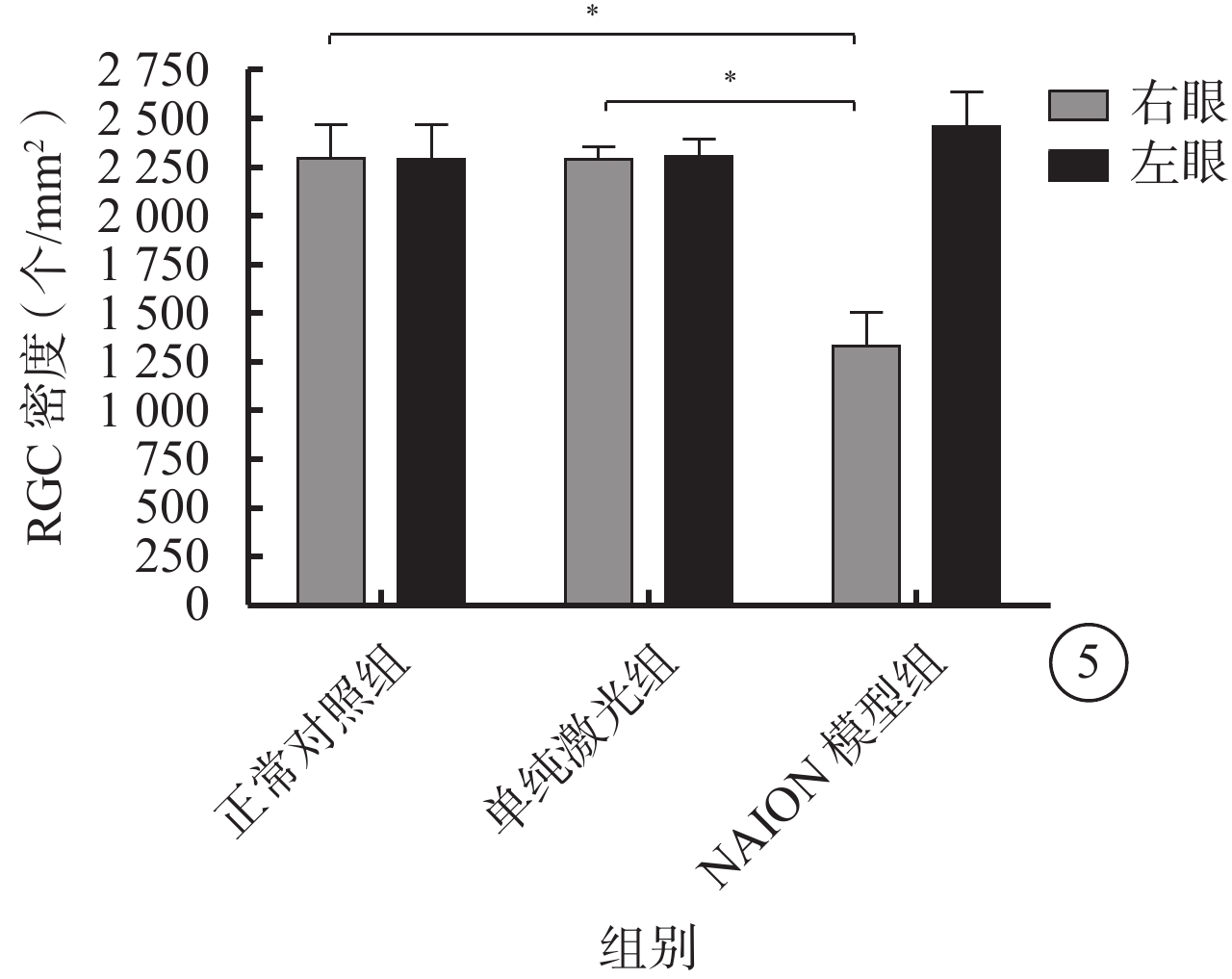
正常對照組、單純激光組及NAION模型組大鼠右眼RGC密度分別為(2293±175)、(2289±63)、(1330±169)個/mm2,左眼RGC密度分別為(2285±179)、(2305±84)、(2455±179)個/mm2。3組大鼠右眼RGC密度比較,差異有統計學意義(F=142.309,P=0.000)。3組間大鼠左眼RGC密度比較,差異無統計學意義(F=2.659,P>0.05)。與正常對照組、單純激光組比較,NAION模型組大鼠右眼RGC密度明顯降低,差異均有統計學意義(t=?14.142、?14.088,P=00.000、P=0.000);正常對照組與單純激光組大鼠右眼RGC密度比較,差異無統計學意義(t=0.050,P=0.961)(圖5)。
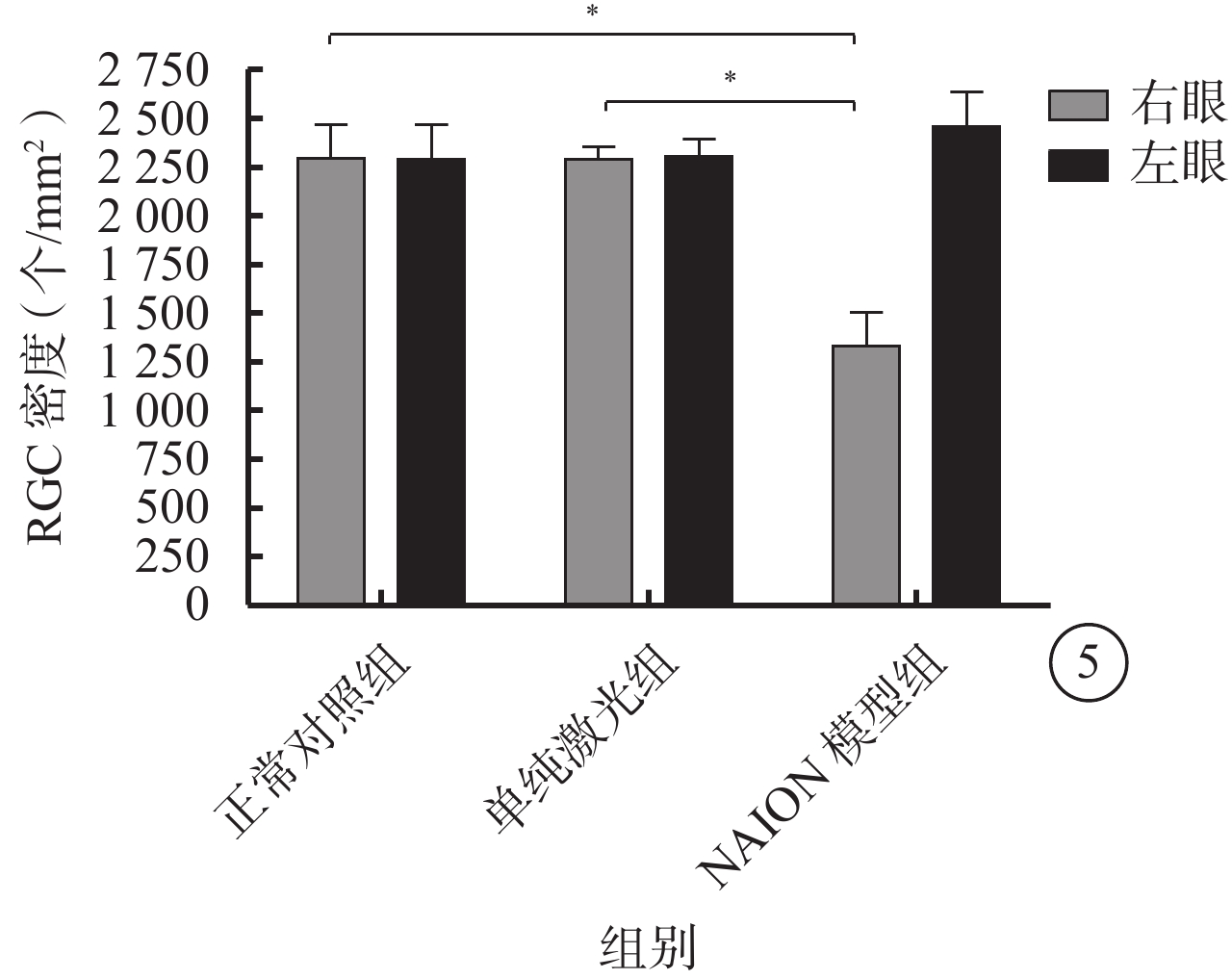 圖5
3組間大鼠雙眼RGC密度比較。*P<0.05
圖5
3組間大鼠雙眼RGC密度比較。*P<0.05
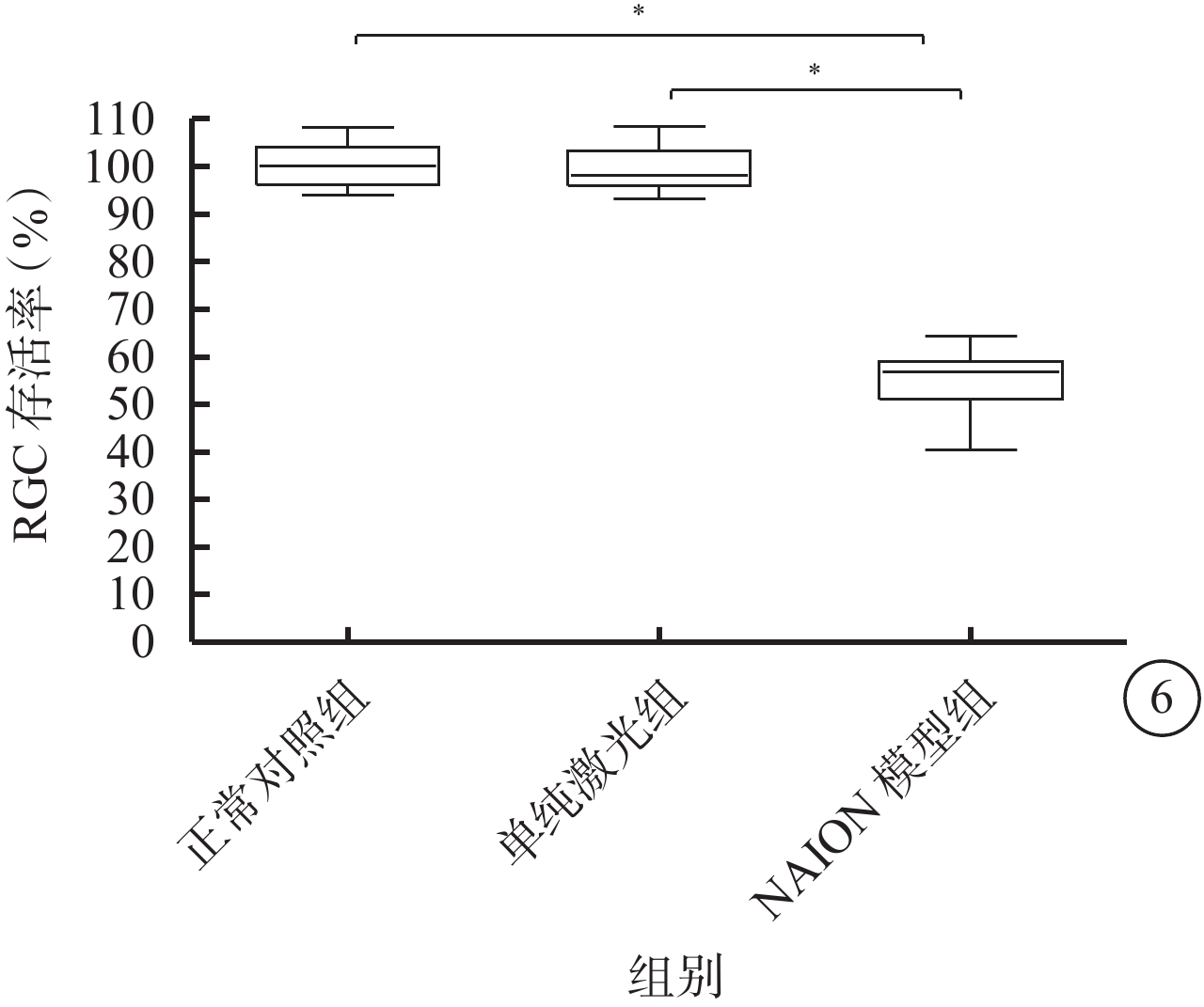
正常對照組、單純激光組及NAION模型組大鼠RGC存活率分別為(100.5±4.7)%、(99.4±5.0)%、(54.4±7.0)%。3組大鼠RGC存活率比較,差異有統計學意義(F=203.051,P=0.000)。與正常對照組、單純激光組比較,NAION模型組大鼠RGC存活率明顯降低,差異均有統計學意義(t=?17.048、?16.667,P=0.000、0.000);正常對照組與單純激光組大鼠RGC存活率比較,差異無統計學意義(t=0.348,P=0.731)(圖6)。
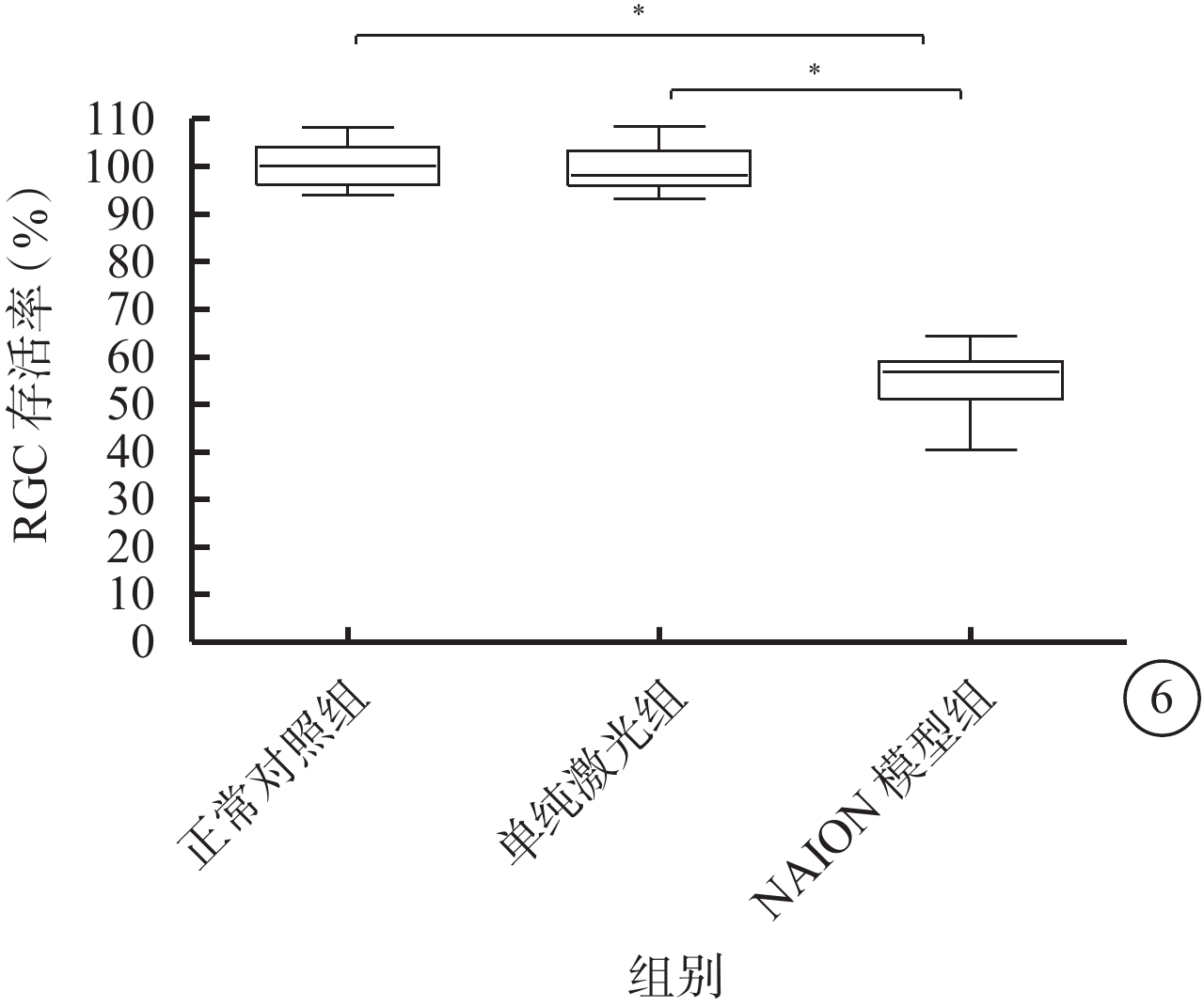 圖6
3組間大鼠RGC存活率比較。*P<0.05
圖6
3組間大鼠RGC存活率比較。*P<0.05
3 討論
NAION模型組大鼠于建模后1 d即可見視盤水腫,建模后3 d視盤水腫明顯,建模后7 d視盤水腫基本消退,建模后28 d視神經萎縮。這與臨床上NAION患眼視盤形態變化存在一定相似性,但二者的視盤水腫期持續時間不同。這可能與不同物種視神經篩板、鞘膜以及鞏膜壁結構的差異有關[7]。
NAION的發病機制為睫狀后動脈循環系統短暫性低灌注導致視盤缺血缺氧、水腫,進而出現視盤梗塞,軸突變性和RGC損傷是其重要病理改變[8]。多數研究認為供應視盤的睫狀后短動脈小分支閉塞是發生NAION的始動因素。尸眼組織病理學檢查發現,視神經缺血早期篩板后區的神經纖維束腫脹,篩板膠原纖維腫脹;后期巨噬細胞浸潤[9]。本研究中NAION模型組大鼠于建模后3 d視神經軸突水腫、部分髓鞘解體,建模后28 d大量軸突潰變、消失且伴明顯的反應性膠質化。
NAION的主要病理結局是軸突變性、RGC凋亡。RGC是典型的中樞神經系統長軸突神經元細胞。然而,與其他類型神經元不同,RGC軸突與胞體的血供卻不一致[8]。既往動物水平研究中對于RGC凋亡的報道差異較大。Zhang等[10]發現,NAION模型建立14 d后RGC層中原位末端標記法(TUNEL)染色陽性細胞占90%。Slater等[11]發現,NAION大鼠模型建立2~3周后尚有50% RGC存活。Bernstein等[12]發現,光動力損傷21 d后NAION大鼠RGC丟失率超過50%。本研究借助熒光金逆行標記、定量評價RGC密度及存活率,結果顯示,與正常對照組相比,NAION模型組大鼠RGC密度明顯降低,光動力損傷4周后近半數RGC死亡。我們分析不同研究結果的差異可能與研究方法與觀察時間點不同有關。但也提示今后研究中應注意模型的穩定性。
既往視神經損傷實驗研究常用的模型包括高眼壓模型、視神經橫斷傷或鉗夾傷、ET-1視神經損傷模型等。高眼壓模型中視網膜內核層、外核層受累[13, 14];視神經橫斷傷模型中視神經軸突全部受損[15, 16];ET-1視神經損傷模型則主要通過收縮大血管誘導視神經缺血[17]。本研究利用孟加拉玫瑰紅聯合激光光動力方法建立NAION大鼠模型。在大鼠體內注射孟加拉玫瑰紅后,利用一定波長的激光持續照射視盤,血管內孟加拉玫瑰紅發生光化學反應,產生大量氧自由基,造成血管血栓形成。其視盤微血管損傷進一步導致軸突及RGC死亡,但視網膜內核層與外核層的細胞形態及數目并無明顯變化,這有別于上述其他的視神經損傷模型。
本研究比較了單純激光組與正常對照組、NAION組大鼠視神經及RGC存活率的差異。單純激光組大鼠未表現NAION組大鼠所出現的視神經萎縮,其RGC密度與存活率與正常對照組無明顯差異。進一步證實了NAION模型組大鼠的視網膜及視盤病理損傷并非主要由激光熱損傷引起。理論上,氧自由基半衰期很短,只可能對血流緩慢的前部視神經毛細血管內皮的局部造成損傷,而視盤周圍較粗大的血管內血流速度快,控制合適的激光照射能量及照射時間的條件下,則不會造成大血管損傷。這可能部分解釋了單純激光組與NAION模型組的差異。
本研究結果表明,孟加拉玫瑰紅聯合激光光動力方法可引起大鼠視神經軸突損傷及RGC死亡,NAION大鼠模型與臨床NAION患眼在眼底及組織病理學改變方面具有一定的相似性,這為今后進行NAION大鼠模型的干預研究提供了一定的基礎。但本研究也存在一些局限性。第一,我們采用熒光金逆行標記的方法定量評價RGC的損傷。該方法的優勢在于既可定量計數RGC密度及存活率,亦可提供直觀的視網膜鋪片廣角照片;但缺陷是無法明確RGC死亡的方式。今后應聯合TUNEL等其他技術做進一步研究。第二,單純激光組大鼠雖未出現視神經萎縮及明顯RGC死亡,但尚需進一步明確單純激光照射是否對視盤超微結構等造成影響。
非動脈炎性前部缺血性視神經病變(NAION)多表現為突發無痛性視力下降、視盤水腫以及特征性視野缺損[1]。既往由于缺乏理想的實驗動物模型,一定程度上限制了NAION的基礎研究。建立合適的具有良好重復性的動物模型對進一步深入研究NAION的發病機制、早期病理變化或探索治療策略具有重要意義。目前NAION動物模型研究尚處于探索階段,各研究團隊的結果存在一定差異[2-4]。為進一步在動物水平上進行NAION發病機制與干預策略的研究,本研究參考光動力方法建立了NAION大鼠模型,對其視網膜、視神經損傷進行定性或定量評價。現將結果報道如下。
1 材料和方法
健康雄性Sprague-Dawley大鼠47只,體重180~200 g,北京維通利華實驗動物有限公司提供。復方托吡卡胺滴眼液散瞳排除眼疾。12 h光/暗循環環境飼養。采用隨機數字表法將大鼠隨機分為正常對照組、單純激光組、NAION模型組,各有13、11、23只。取右眼為實驗眼。NAION模型組采用孟加拉玫瑰紅聯合光動力方法建立模型[2]。腹腔注射10%水合氯醛麻醉大鼠后,復方托吡卡胺滴眼液充分散瞳,鹽酸奧布卡因點眼。將大鼠置于Lightlas 532眼底激光機(美國Coherent公司)前。激光參數為波長532 nm,能量50 mW,光斑直徑500 μm。按1 ml/kg的劑量經股靜脈注入2.5 mmol/L光敏劑孟加拉玫瑰紅溶液(美國Sigma公司),立即對準視盤照射12 s。單純激光組大鼠僅按上述激光參數照射視盤,不注射光敏劑。正常對照組大鼠不作任何干預。分別于建模后12 h及1、3、7、28 d應用直接檢眼鏡檢查大鼠視網膜及視盤情況。
建模后3、28 d,正常對照組、單純激光組、NAION模型組各取3、3、5只大鼠。摘出眼球,固定過夜,依次梯度酒精脫水,石蠟包埋,于角膜緣標記處做視神經矢狀切片。烤片,蘇木精伊紅(HE)染色,中性樹脂封片,光學顯微鏡觀察(日本尼康公司)并于距視盤一個視野窗的位置照相記錄。
建模后3、7、28 d,正常對照組、NAION模型組各取2、6只大鼠。摘除眼球,置入2.5%戊二醛溶液后固定過夜。去眼前節,1%鋨酸固定,磷酸鹽緩沖液沖洗,梯度酒精脫水,環氧樹脂包埋、切片,醋酸雙氧鈾和枸櫞酸鉛染色。透射電子顯微鏡(JEM-1010,日本電子株式會社)觀察并照相。
建模后21 d,正常對照組、單純激光組、NAION模型組各取8、8、12只大鼠。麻醉后將其頭部固定于900型腦立體定位儀(美國David Kopf公司)上,暴露Bregma點并參考其后移5.9、6.4 mm,旁開1.4 mm分別定位雙側上丘,微型顱鉆在相應定位點鉆開顱骨[5]。微量注射器將3%熒光金(美國Biotium公司)于每側上丘注射兩點,每針1.5 μl。熒光金標記7 d后角膜緣標記并取眼球標本置于4%多聚甲醛中固定2 h,去除眼前節,分離視網膜并定向鋪片,避光、自然風干。熒光顯微鏡(日本尼康公司)采集圖像,距視盤2 mm上下左右拍攝照片用于計數視網膜神經節細胞(RGC)。采用Photoshop 8.0.1軟件,盲法人工計數RGC密度,將右眼與左眼RGC密度比值定義為RGC存活率[6]。
采用SPSS 12.0統計學軟件進行統計分析,定量資料以均數±標準差(
 ±s)表示。3組間大鼠RGC密度及存活率比較采用單因素方差分析,組間兩兩比較采用最小顯著差法 t 檢驗。P<0.05為差異有統計學意義。
±s)表示。3組間大鼠RGC密度及存活率比較采用單因素方差分析,組間兩兩比較采用最小顯著差法 t 檢驗。P<0.05為差異有統計學意義。
2 結果
直接檢眼鏡檢查發現,NAION模型組大鼠于建模12 h后無明顯視盤水腫;建模1、3 d后可見視盤水腫,但無視網膜混濁水腫、出血;建模后7 d,視盤水腫基本消退;建模后28 d,視盤顏色變淡。正常對照組、單純激光組大鼠視網膜及視盤均未見異常。
光學顯微鏡檢查發現,正常對照組與單純激光組大鼠神經纖維束縱行排列、規則有序(圖1A,1B)。NAION模型組大鼠于建模后3 d視盤明顯水腫,篩板附近視神經軸突空泡變性明顯,視盤周圍局部視網膜淺脫離(圖1C);建模后28 d視神經萎縮伴細胞浸潤,視盤周圍神經纖維層變薄(圖1D)。
 圖1
大鼠視神經矢狀切片光學顯微鏡像。1A. 正常對照組;1B. 單純激光組;1C. NAION模型組建模后3 d;1D. NAION模型組建模后28 d。正常對照組、單純激光組大鼠神經纖維束縱行排列、規則有序。NAION模型組建模后3 d視盤水腫(白框),視盤周圍局限性視網膜脫離(白箭)以及軸突空泡變性(黑箭);建模后28 d視神經萎縮、細胞浸潤(白箭) HE ×100
圖1
大鼠視神經矢狀切片光學顯微鏡像。1A. 正常對照組;1B. 單純激光組;1C. NAION模型組建模后3 d;1D. NAION模型組建模后28 d。正常對照組、單純激光組大鼠神經纖維束縱行排列、規則有序。NAION模型組建模后3 d視盤水腫(白框),視盤周圍局限性視網膜脫離(白箭)以及軸突空泡變性(黑箭);建模后28 d視神經萎縮、細胞浸潤(白箭) HE ×100
透射電子顯微鏡觀察發現,正常對照組大鼠視神經的神經纖維束排列相對規整,未見明顯軸突損傷(圖2A)。NAION模型組大鼠于建模后3 d視神經軸突水腫、局部髓鞘變薄(圖2B),建模后28 d視神經軸突大量消失,膠質瘢痕明顯(圖2C)。

光學顯微鏡觀察發現,正常對照組大鼠及單純激光組大鼠于激光照射后28 d均可見視網膜各層結構完整,層次清晰,細胞排列整齊(圖3A,3B)。NAION模型組大鼠于建模后28 d可見RGC明顯減少、核染色致密,視網膜神經纖維層變薄,而內核層、外核層無明顯變化(圖3C)。

熒光顯微鏡觀察發現,正常對照組、單純激光組大鼠RGC無明顯RGC死亡(圖4A,4B),NAION模型組大鼠RGC明顯減少(圖4C)。
 圖4
大鼠RGC熒光顯微鏡像。4A. 正常對照組;4B. 單純激光組;4C. NAION模型組建模后28 d。正常對照組、單純激光組大鼠RGC無明顯RGC死亡,而NAION模型組RGC明顯減少 ×40
圖4
大鼠RGC熒光顯微鏡像。4A. 正常對照組;4B. 單純激光組;4C. NAION模型組建模后28 d。正常對照組、單純激光組大鼠RGC無明顯RGC死亡,而NAION模型組RGC明顯減少 ×40
正常對照組、單純激光組及NAION模型組大鼠右眼RGC密度分別為(2293±175)、(2289±63)、(1330±169)個/mm2,左眼RGC密度分別為(2285±179)、(2305±84)、(2455±179)個/mm2。3組大鼠右眼RGC密度比較,差異有統計學意義(F=142.309,P=0.000)。3組間大鼠左眼RGC密度比較,差異無統計學意義(F=2.659,P>0.05)。與正常對照組、單純激光組比較,NAION模型組大鼠右眼RGC密度明顯降低,差異均有統計學意義(t=?14.142、?14.088,P=00.000、P=0.000);正常對照組與單純激光組大鼠右眼RGC密度比較,差異無統計學意義(t=0.050,P=0.961)(圖5)。
 圖5
3組間大鼠雙眼RGC密度比較。*P<0.05
圖5
3組間大鼠雙眼RGC密度比較。*P<0.05
正常對照組、單純激光組及NAION模型組大鼠RGC存活率分別為(100.5±4.7)%、(99.4±5.0)%、(54.4±7.0)%。3組大鼠RGC存活率比較,差異有統計學意義(F=203.051,P=0.000)。與正常對照組、單純激光組比較,NAION模型組大鼠RGC存活率明顯降低,差異均有統計學意義(t=?17.048、?16.667,P=0.000、0.000);正常對照組與單純激光組大鼠RGC存活率比較,差異無統計學意義(t=0.348,P=0.731)(圖6)。
 圖6
3組間大鼠RGC存活率比較。*P<0.05
圖6
3組間大鼠RGC存活率比較。*P<0.05
3 討論
NAION模型組大鼠于建模后1 d即可見視盤水腫,建模后3 d視盤水腫明顯,建模后7 d視盤水腫基本消退,建模后28 d視神經萎縮。這與臨床上NAION患眼視盤形態變化存在一定相似性,但二者的視盤水腫期持續時間不同。這可能與不同物種視神經篩板、鞘膜以及鞏膜壁結構的差異有關[7]。
NAION的發病機制為睫狀后動脈循環系統短暫性低灌注導致視盤缺血缺氧、水腫,進而出現視盤梗塞,軸突變性和RGC損傷是其重要病理改變[8]。多數研究認為供應視盤的睫狀后短動脈小分支閉塞是發生NAION的始動因素。尸眼組織病理學檢查發現,視神經缺血早期篩板后區的神經纖維束腫脹,篩板膠原纖維腫脹;后期巨噬細胞浸潤[9]。本研究中NAION模型組大鼠于建模后3 d視神經軸突水腫、部分髓鞘解體,建模后28 d大量軸突潰變、消失且伴明顯的反應性膠質化。
NAION的主要病理結局是軸突變性、RGC凋亡。RGC是典型的中樞神經系統長軸突神經元細胞。然而,與其他類型神經元不同,RGC軸突與胞體的血供卻不一致[8]。既往動物水平研究中對于RGC凋亡的報道差異較大。Zhang等[10]發現,NAION模型建立14 d后RGC層中原位末端標記法(TUNEL)染色陽性細胞占90%。Slater等[11]發現,NAION大鼠模型建立2~3周后尚有50% RGC存活。Bernstein等[12]發現,光動力損傷21 d后NAION大鼠RGC丟失率超過50%。本研究借助熒光金逆行標記、定量評價RGC密度及存活率,結果顯示,與正常對照組相比,NAION模型組大鼠RGC密度明顯降低,光動力損傷4周后近半數RGC死亡。我們分析不同研究結果的差異可能與研究方法與觀察時間點不同有關。但也提示今后研究中應注意模型的穩定性。
既往視神經損傷實驗研究常用的模型包括高眼壓模型、視神經橫斷傷或鉗夾傷、ET-1視神經損傷模型等。高眼壓模型中視網膜內核層、外核層受累[13, 14];視神經橫斷傷模型中視神經軸突全部受損[15, 16];ET-1視神經損傷模型則主要通過收縮大血管誘導視神經缺血[17]。本研究利用孟加拉玫瑰紅聯合激光光動力方法建立NAION大鼠模型。在大鼠體內注射孟加拉玫瑰紅后,利用一定波長的激光持續照射視盤,血管內孟加拉玫瑰紅發生光化學反應,產生大量氧自由基,造成血管血栓形成。其視盤微血管損傷進一步導致軸突及RGC死亡,但視網膜內核層與外核層的細胞形態及數目并無明顯變化,這有別于上述其他的視神經損傷模型。
本研究比較了單純激光組與正常對照組、NAION組大鼠視神經及RGC存活率的差異。單純激光組大鼠未表現NAION組大鼠所出現的視神經萎縮,其RGC密度與存活率與正常對照組無明顯差異。進一步證實了NAION模型組大鼠的視網膜及視盤病理損傷并非主要由激光熱損傷引起。理論上,氧自由基半衰期很短,只可能對血流緩慢的前部視神經毛細血管內皮的局部造成損傷,而視盤周圍較粗大的血管內血流速度快,控制合適的激光照射能量及照射時間的條件下,則不會造成大血管損傷。這可能部分解釋了單純激光組與NAION模型組的差異。
本研究結果表明,孟加拉玫瑰紅聯合激光光動力方法可引起大鼠視神經軸突損傷及RGC死亡,NAION大鼠模型與臨床NAION患眼在眼底及組織病理學改變方面具有一定的相似性,這為今后進行NAION大鼠模型的干預研究提供了一定的基礎。但本研究也存在一些局限性。第一,我們采用熒光金逆行標記的方法定量評價RGC的損傷。該方法的優勢在于既可定量計數RGC密度及存活率,亦可提供直觀的視網膜鋪片廣角照片;但缺陷是無法明確RGC死亡的方式。今后應聯合TUNEL等其他技術做進一步研究。第二,單純激光組大鼠雖未出現視神經萎縮及明顯RGC死亡,但尚需進一步明確單純激光照射是否對視盤超微結構等造成影響。