引用本文: 張喜梅, 徐曉莉, 李潔, 謝娟, 鄭東萍. 息肉樣脈絡膜血管病變患眼玻璃體腔注射雷珠單抗治療前后眼底自身熒光影像特征觀察. 中華眼底病雜志, 2017, 33(6): 587-592. doi: 10.3760/cma.j.issn.1005-1015.2017.06.008 復制
息肉樣脈絡膜血管病變(PCV)臨床表現為視網膜色素上皮(RPE)下的橘紅色息肉樣病灶及出血性RPE脫離[1-3]。吲哚青綠血管造影(ICGA)檢查特征為后極部脈絡膜異常分支血管網(BVN)、終末息肉樣擴張[4, 5]。但ICGA為有創檢查,不適宜應用于治療后療效的隨訪觀察。近年,眼底自身熒光(FAF)技術因其無創、簡便、可重復性好已廣泛應用于黃斑疾病的臨床監測。眼底主要熒光物質脂褐素主要沉積于RPE細胞,通過FAF對脂褐素的檢測可反應RPE細胞和外層視網膜生理和病理過程[6]。Yamagishi等[7]、Suzuki等[8]認為PCV病灶的存在可能直接影響RPE細胞的代謝功能,應用FAF技術可評估PCV病灶情況。我們觀察了一組PCV患者玻璃體腔注射雷珠單抗治療前后息肉樣病灶FAF的變化特點。現將結果報道如下。
1 對象和方法
回顧性病例研究。患者均知情并簽署治療同意書。2014年5月至2016年5月在我院檢查確診并有連續隨訪記錄的PCV患者17例17只眼納入研究。其中,男性11例11只眼,女性6例6只眼;均為單眼。年齡55~81歲,平均年齡(68.24±7.17)歲。納入標準:(1)間接檢眼鏡檢查可見視網膜下橘紅色病灶、漿液性視網膜脫離、視網膜下出血、RPE脫離。(2)ICGA檢查可見BVN、末端有擴張的息肉樣病灶;病灶累及黃斑中心凹或位于旁中心凹。(3)未接受過玻璃體腔注射抗血管內皮生長因子(VEGF)藥物治療。排除新生血管性老年性黃斑變性、視網膜下出血累及中心凹并超過2個視盤直徑(DD)范圍、伴有>2 DD范圍的RPE脫離、繼發原有新生血管瘢痕病灶的出血、屈光間質明顯混濁、高度近視黃斑病變、糖尿病視網膜病變、視網膜靜脈阻塞等。
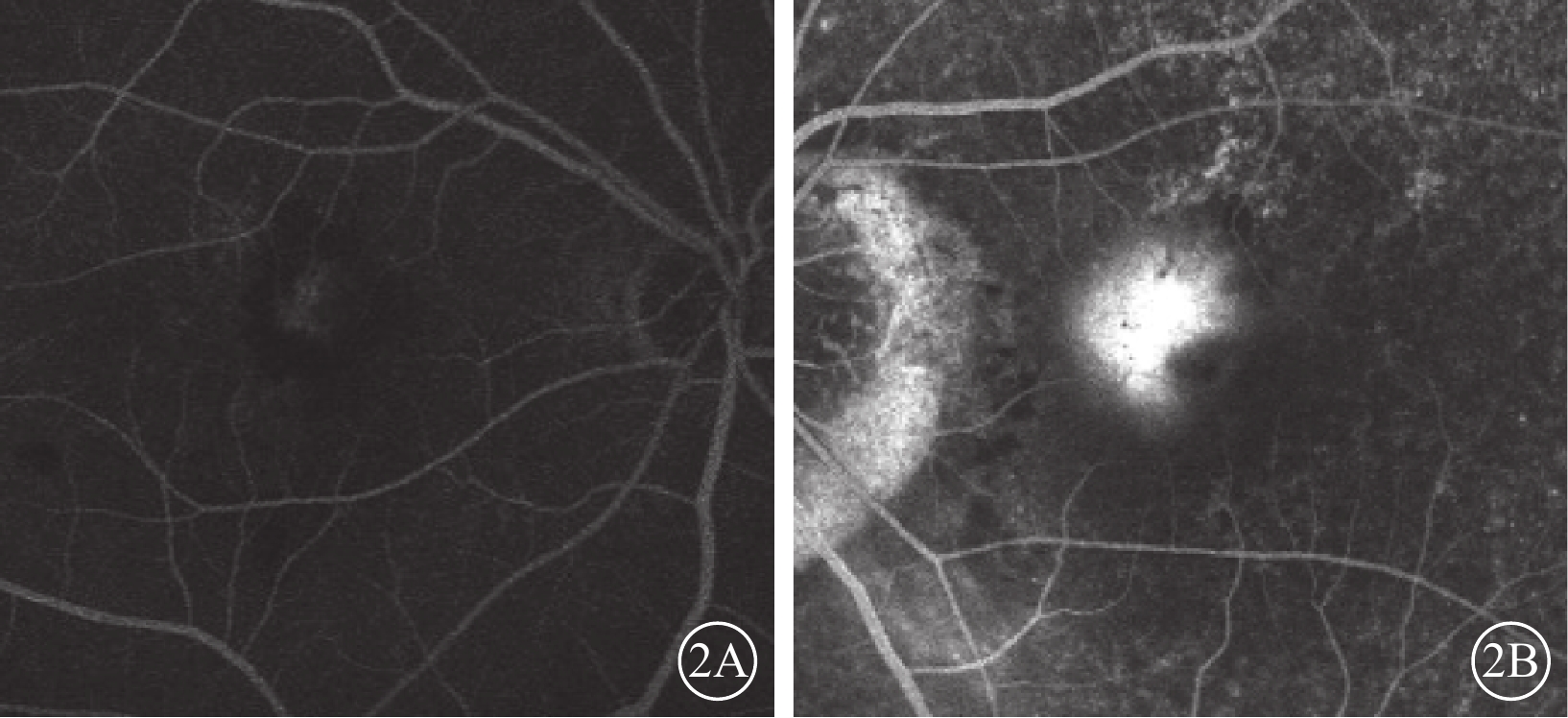
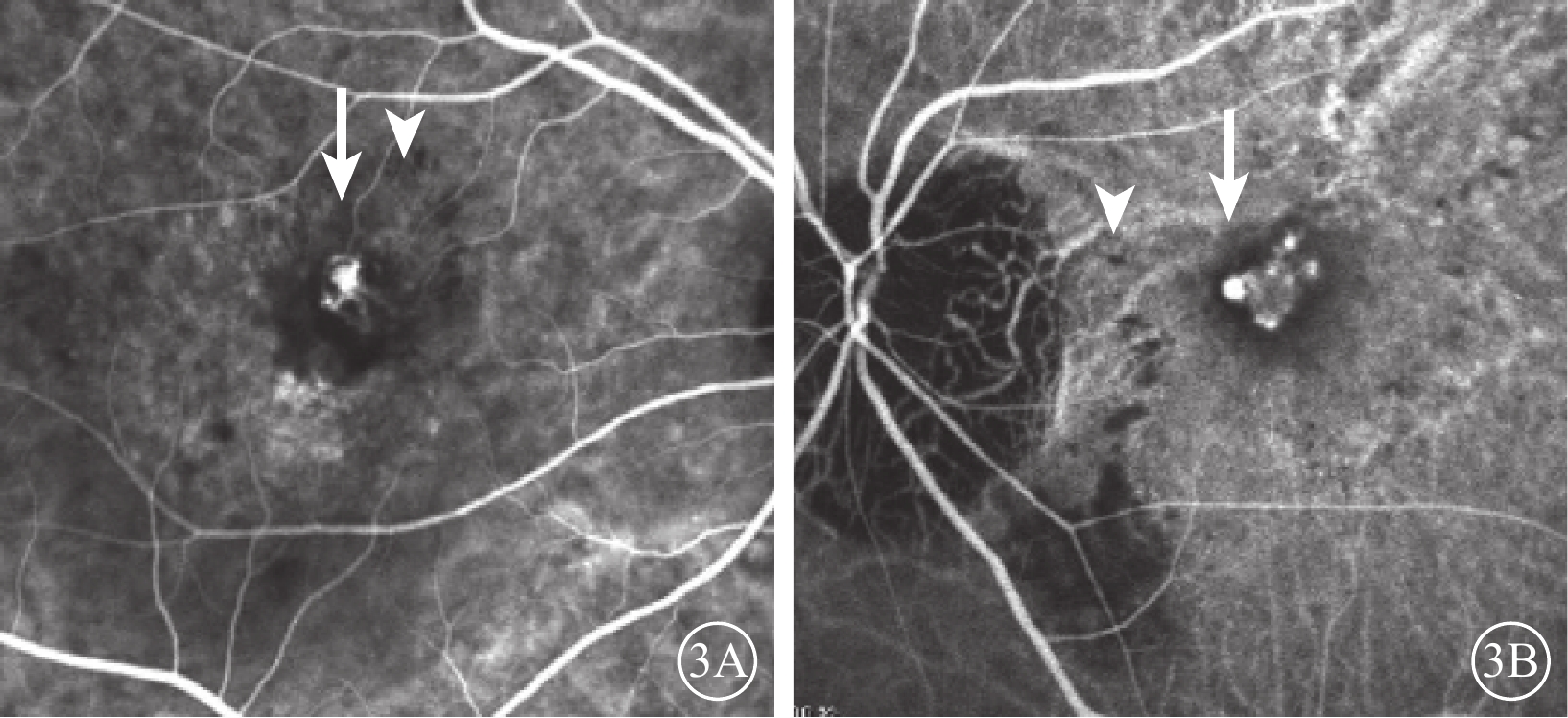
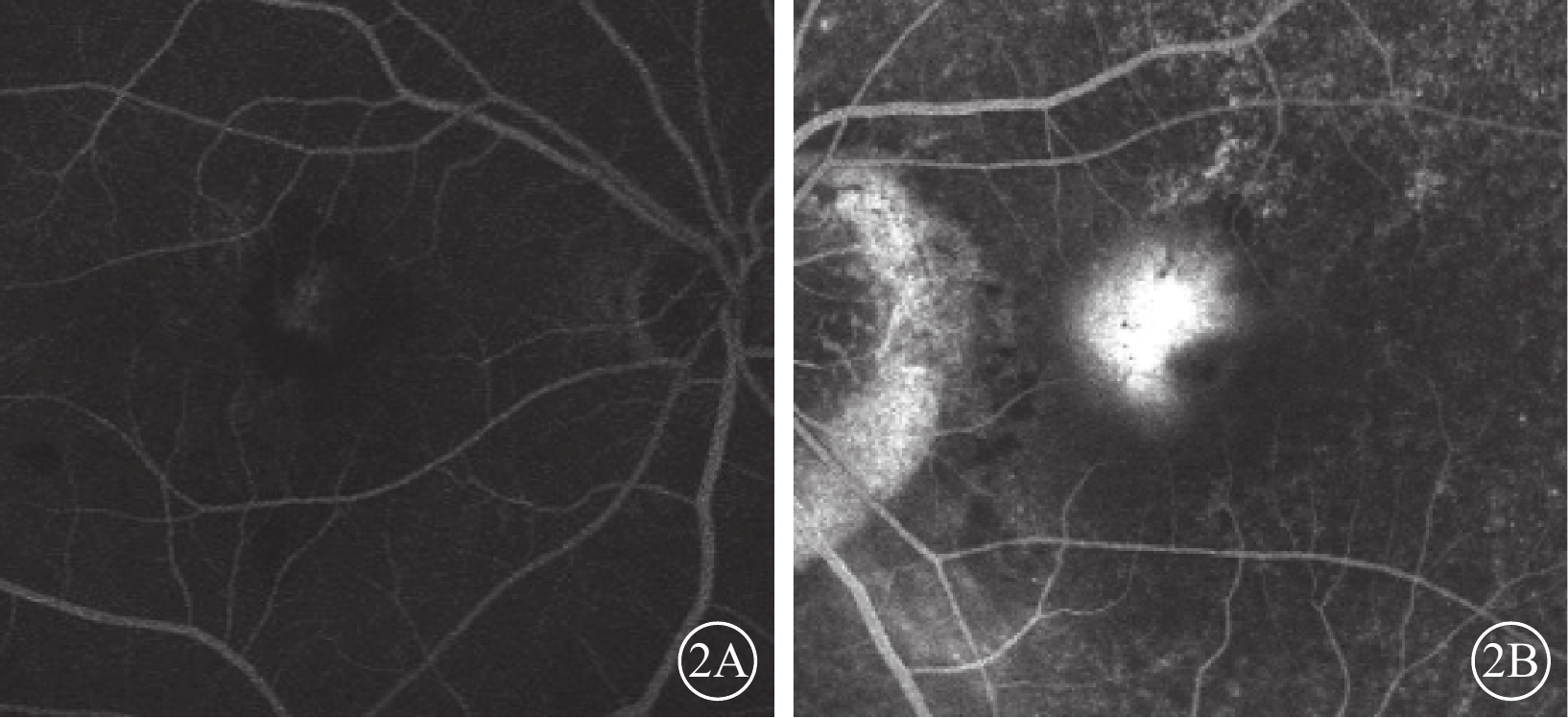
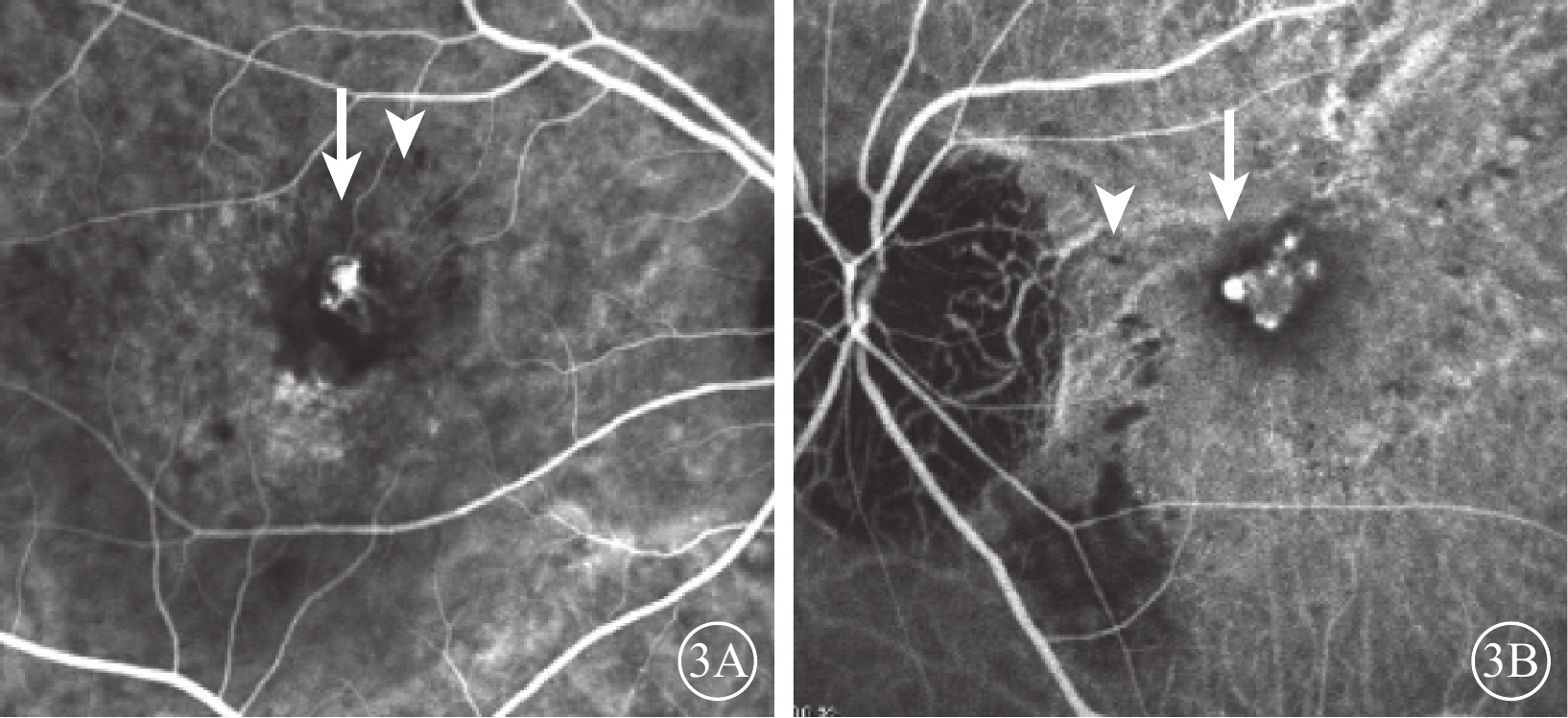
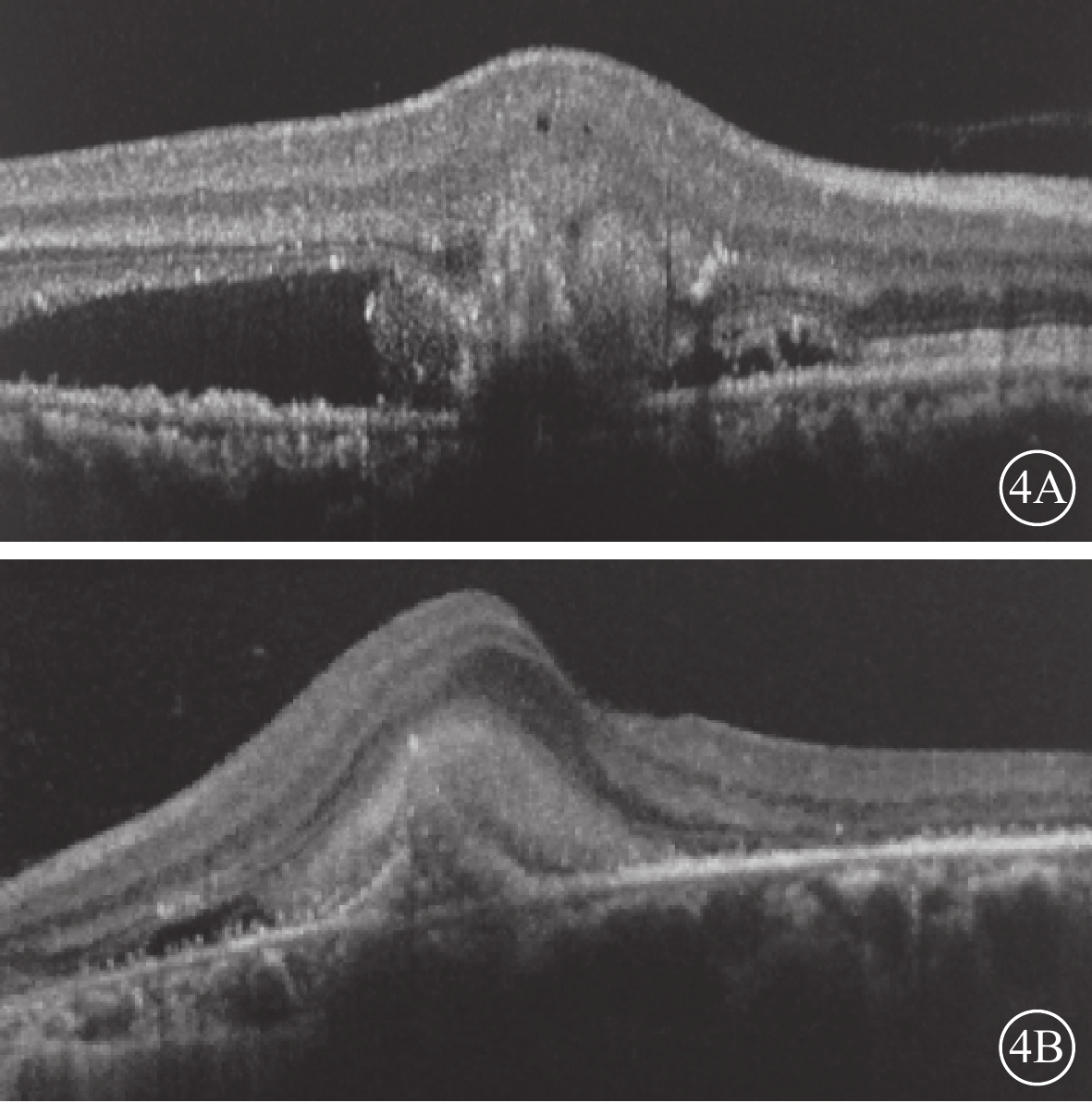
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、光相干斷層掃描(OCT)、FAF、熒光素眼底血管造影(FFA)、ICGA檢查。患眼均可見黃斑區病灶周圍有不同程度出血、水腫(圖1A,1B);FFA檢查可見出血部位呈熒光遮蔽,晚期熒光增強,病灶邊緣不清楚(圖2A,2B);ICGA檢查早期息肉樣病灶呈強熒光點,部分患眼可見BVN(圖3A,3B);OCT檢查可見黃斑區視網膜神經上皮層淺脫離,視網膜下可見強反射帶,部分患眼可見RPE層局限凸起(圖4A,4B)。
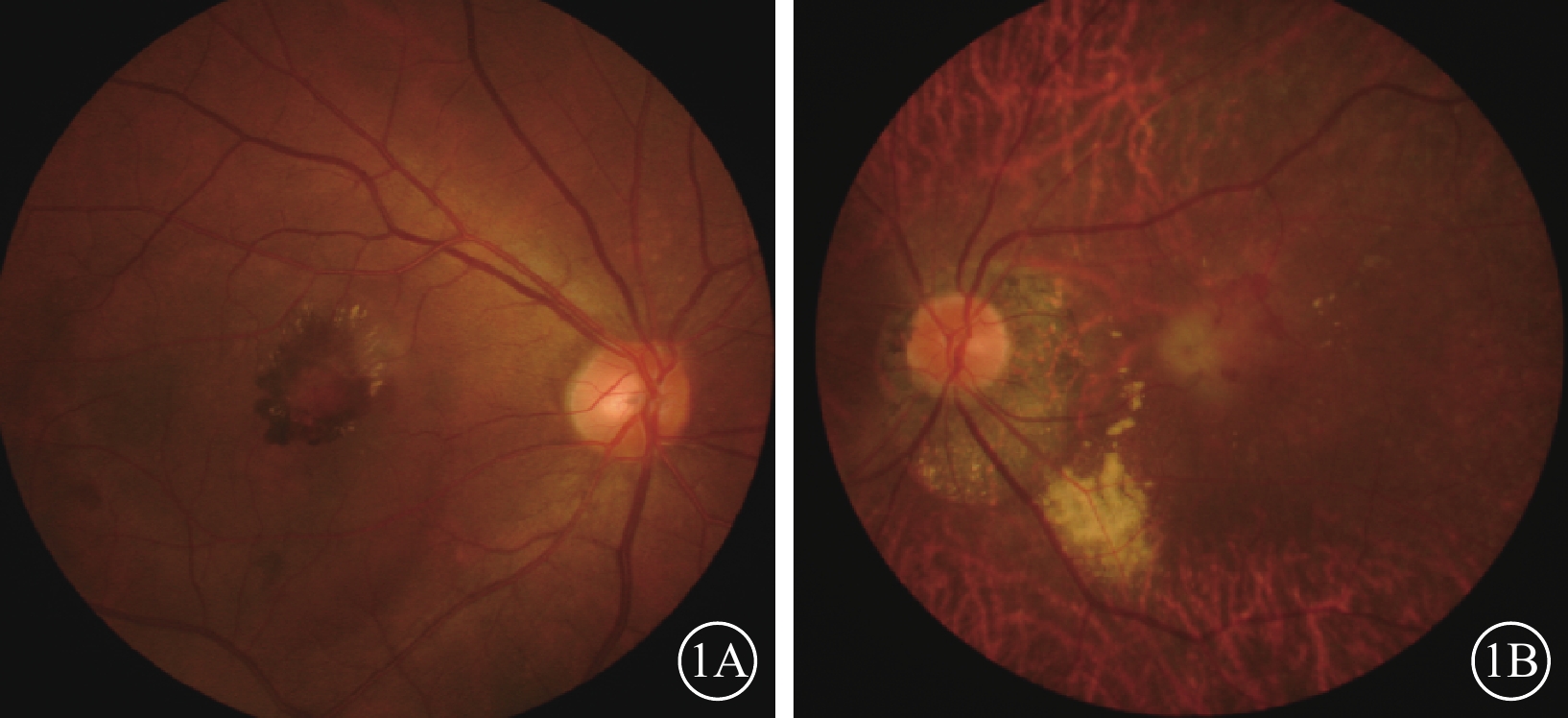 圖1
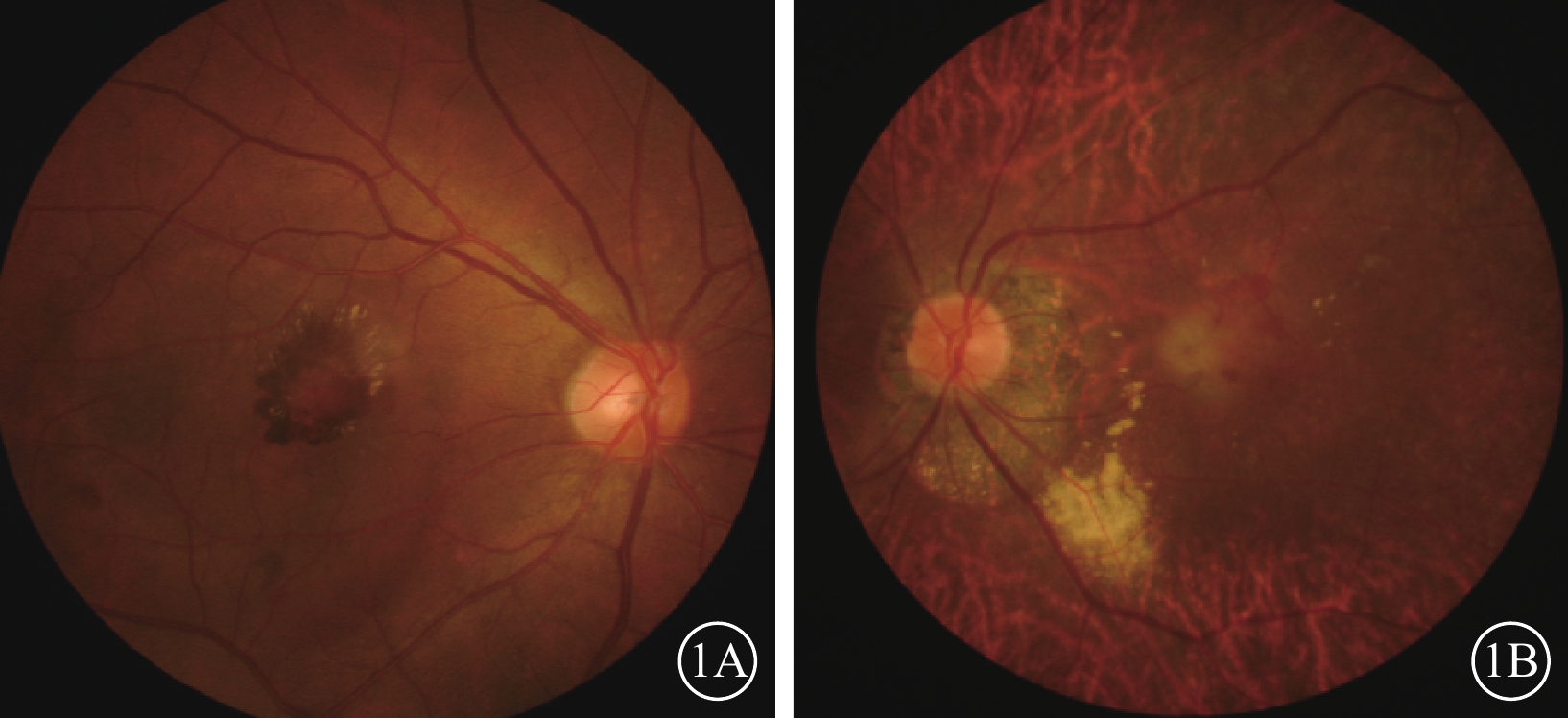
患眼彩色眼底像。1A. 右眼,黃斑區出血、水腫;1B. 左眼,黃斑區中央灰白色邊界模糊病灶伴顳側出血、水腫
圖1
患眼彩色眼底像。1A. 右眼,黃斑區出血、水腫;1B. 左眼,黃斑區中央灰白色邊界模糊病灶伴顳側出血、水腫
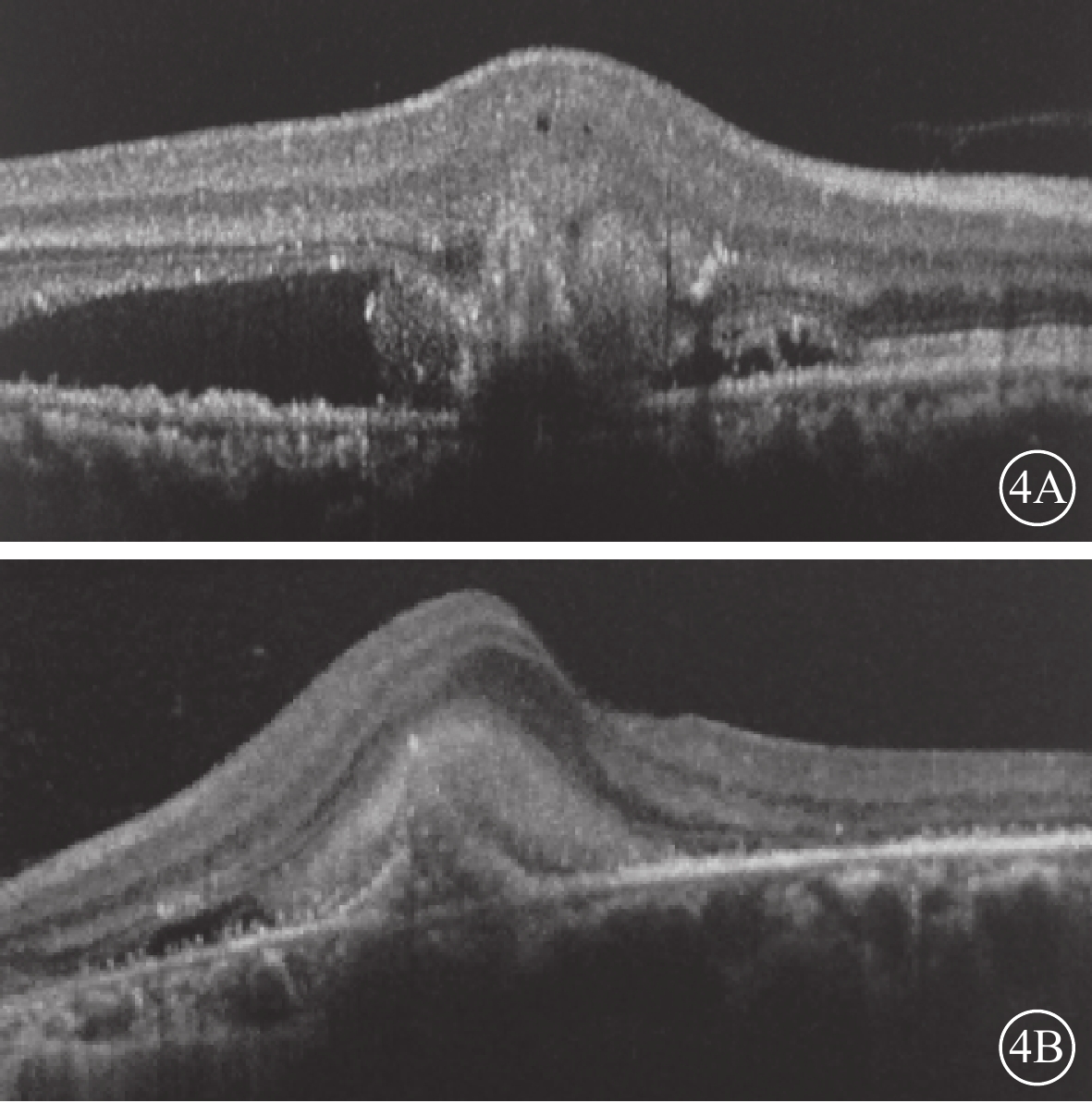 圖4
患眼OCT圖像。4A. 右眼,4B. 左眼。黃斑區視網膜神經上皮層淺脫離,神經上皮層下可見強反射帶,RPE連續性中斷,呈指狀凸起輪廓
圖4
患眼OCT圖像。4A. 右眼,4B. 左眼。黃斑區視網膜神經上皮層淺脫離,神經上皮層下可見強反射帶,RPE連續性中斷,呈指狀凸起輪廓
采用糖尿病視網膜病變早期治療研究組視力表行BCVA檢查。采用德國海德堡公司共焦激光眼底血管造影儀HRA2行FAF檢查。激發光波長488 nm,激發強度96%;屏障濾片濾過波長為500 nm。圖像采集由同一位技術員完成,記錄模式9張/s;最終輸出圖像由儀器自動合成。范圍:黃斑30°×30°,像素768×822。根據文獻[8, 9]標準將FAF異常熒光分為強熒光或弱熒光。強熒光定義為相對于正常背景熒光增強的FAF;弱熒光定義為相對于正常背景熒光降低的FAF。混合熒光為強弱熒光灶的不均勻混雜。弱熒光又分為融合弱熒光和顆粒狀弱熒光。融合弱熒光為均勻的可與周圍區域明顯區分的熒光缺損;顆粒狀弱熒光為不同程度的弱熒光灶的不均勻混雜。排除由視網膜下出血引起的遮蔽熒光。
根據FAF強度將患眼分為弱熒光組和混合熒光組,分別為8例8只眼、9例9只眼。兩組患者性別構成比、平均年齡比較,差異無統計學意義(P>0.05)(表1);兩組患眼BCVA分別為(58.88±11.66)、(46.56±9.15)個字母,差異無統計學意義(t=2.403,P=0.072)。
所有患者均為首次治療。玻璃體腔注射均在無菌手術室內按內眼手術常規操作完成。患眼玻璃體腔注射10.0 mg/ml的雷珠單抗(瑞士諾華制藥有限公司)0.05 ml(含雷珠單抗0.5 mg);每一個月注射1次,連續注射3個月。其后根據隨訪時OCT檢查結果評估病灶是否具有活動性,如存在視網膜下積液或視網膜層間水腫給予重復治療。
首次治療后隨訪時間≥12個月。治療后3、6、12個月采用與治療前相同的檢查設備和方法行BCVA、FAF檢查。觀察兩組患眼治療前和治療后3、6、12個月BCVA、FAF變化;同時觀察與藥物和治療方式相關的眼部并發癥發生情況。以BCVA提高≥15個字母為視力提高;BCVA下降≥15個字母為視力下降;BCVA變化在兩者之間為視力穩定。
采用SPSS17.0統計軟件行統計學分析。數據以均數±標準差(
 )表示。兩組患者年齡比較采用完全隨機t檢驗;治療前后BCVA比較采用獨立樣本t檢驗;兩組患者性別構成比及視力提高的眼數比較采用Fisher確切概率法。P<0.05為差異有統計學意義。
)表示。兩組患者年齡比較采用完全隨機t檢驗;治療前后BCVA比較采用獨立樣本t檢驗;兩組患者性別構成比及視力提高的眼數比較采用Fisher確切概率法。P<0.05為差異有統計學意義。
2 結果
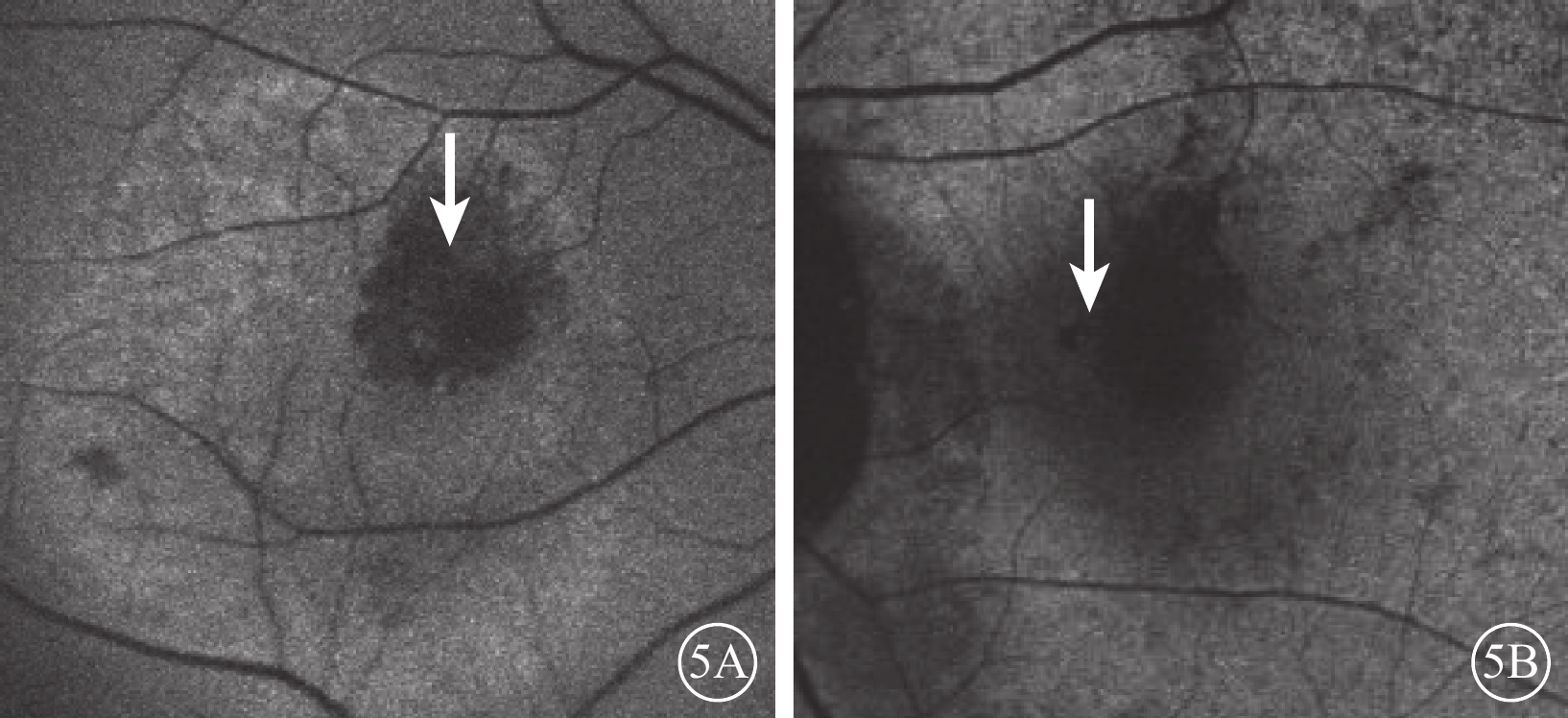
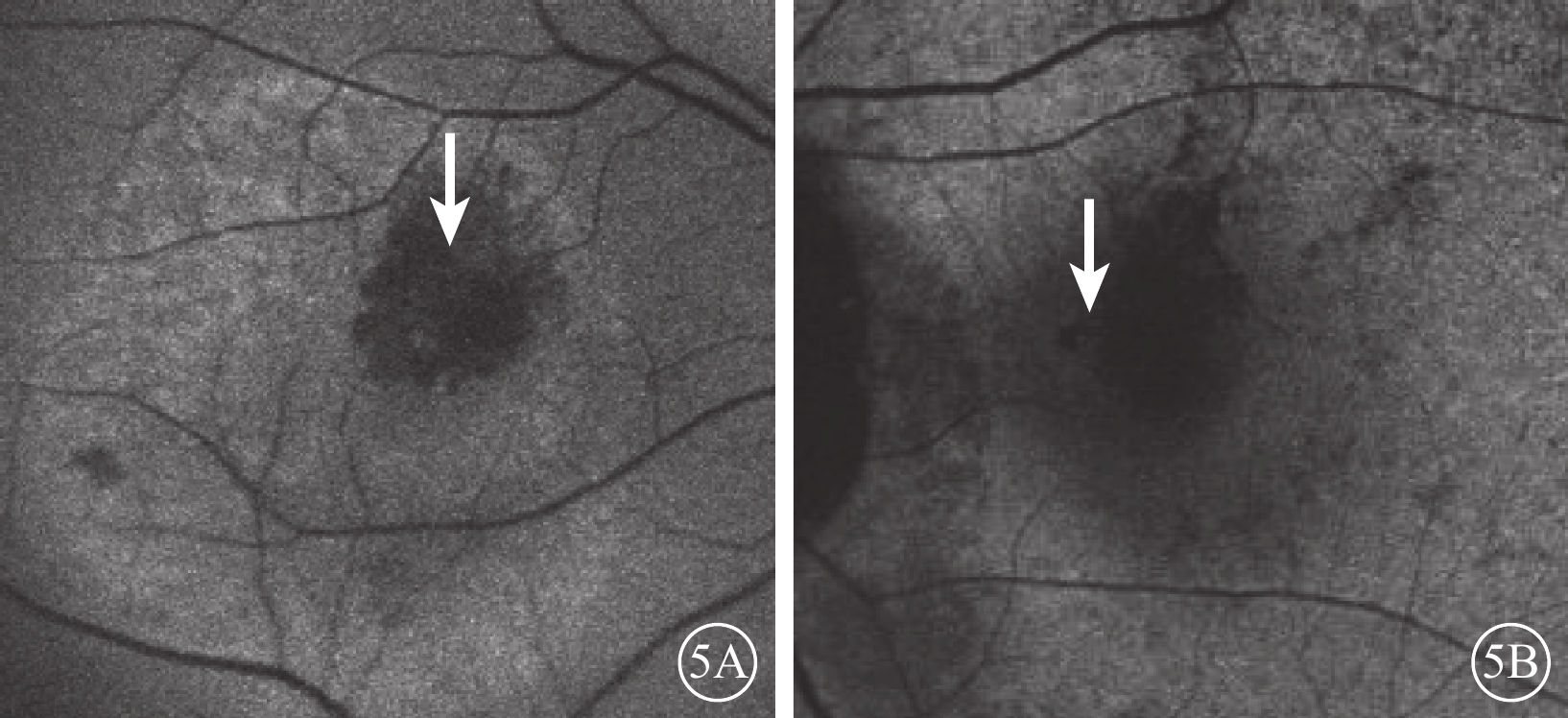
FAF檢查,治療前混合熒光組患眼病灶區呈弱熒光夾雜點狀、網狀或片狀強熒光,病灶周圍強熒光;相應息肉樣病灶呈融合弱熒光(圖5A)。弱熒光組患眼病灶區呈弱熒光,病灶周圍稍強熒光;相應息肉樣病灶中央無熒光,周圍弱熒光圍繞(圖5B)。兩組患眼BVN均呈顆粒狀弱熒光。
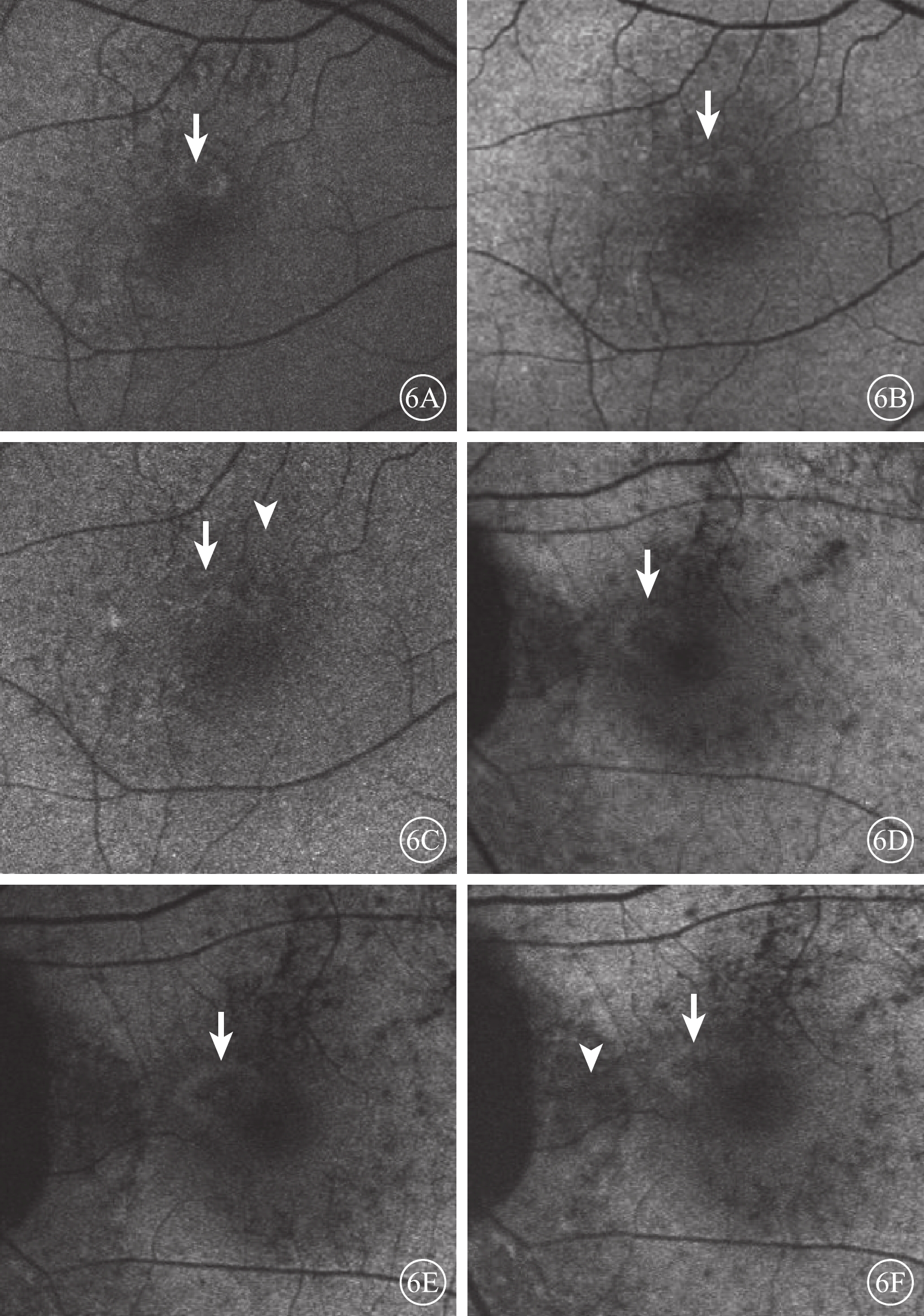
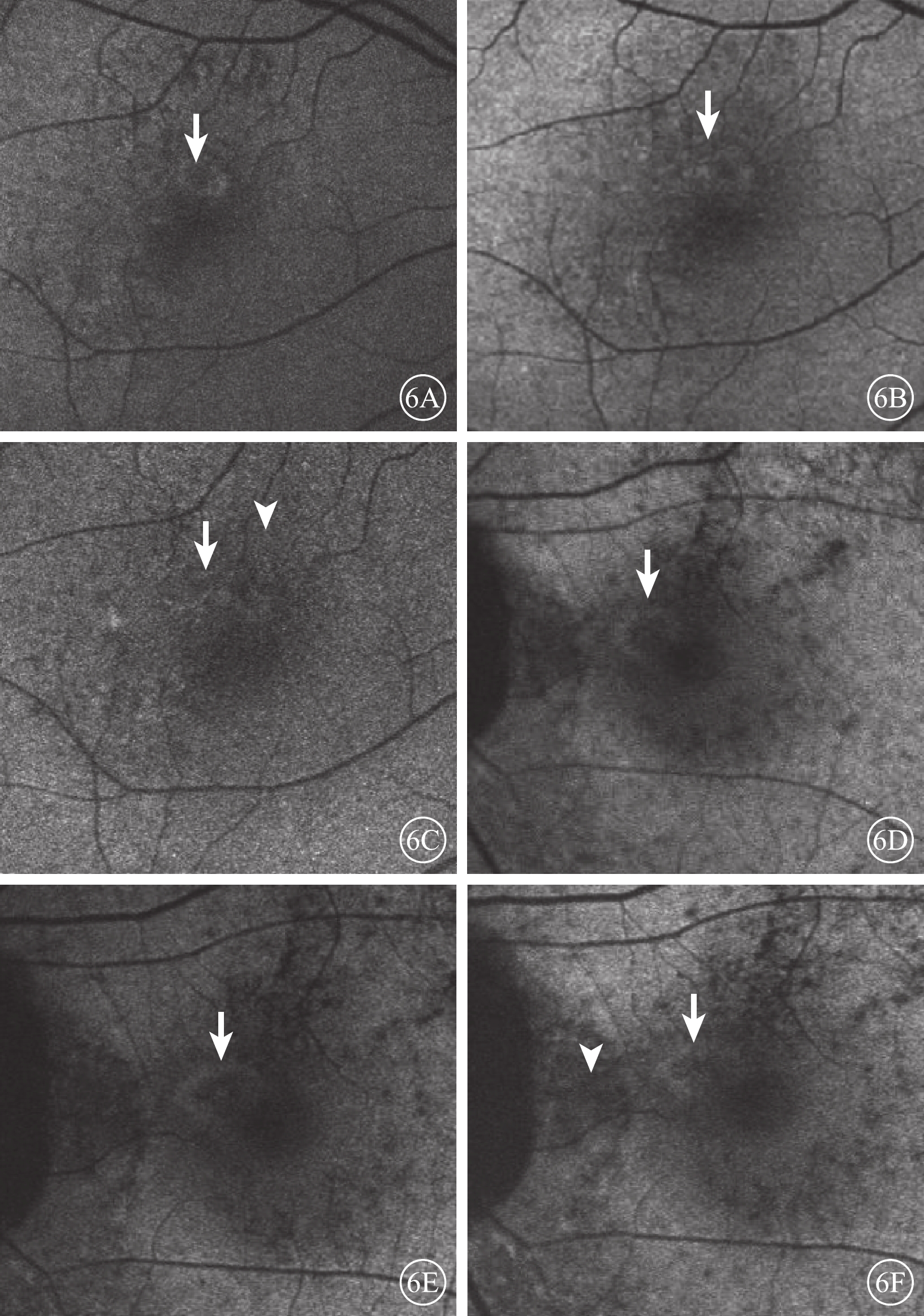
混合熒光組患眼治療后病灶區熒光逐漸增強;病灶周圍熒光逐漸減弱至正常背景熒光。治療后3個月,息肉樣病灶中央熒光增強,其周圍可見強熒光環(圖6A);治療后6、12個月,強熒光環逐漸減弱或消失(圖6B)。兩組患眼治療后不同時間BVN弱熒光較治療前無變化(圖6C)。弱熒光組患眼治療后病灶區熒光逐漸增強。治療后3個月,息肉樣病灶中央呈弱熒光,其周圍出現強熒光環(圖6D);治療后6、12個月,息肉樣病灶中央熒光逐漸增強,其周圍強熒光環逐漸減弱(圖6E,6F)。
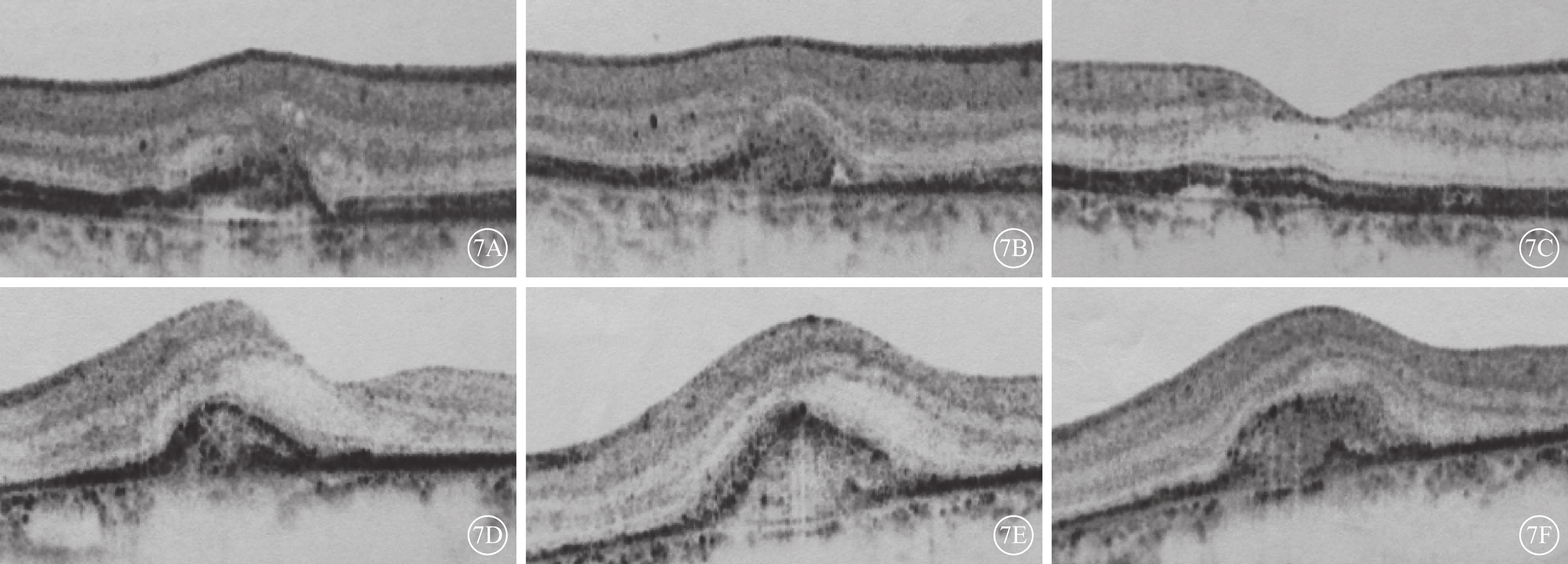
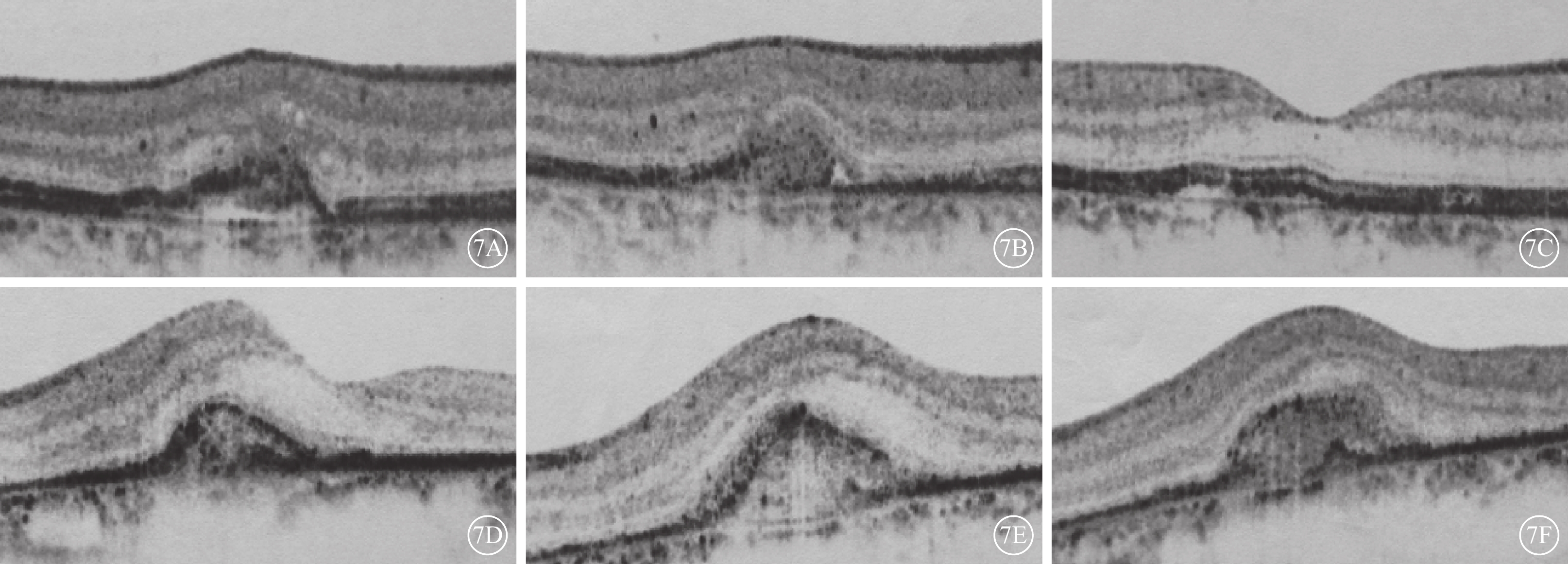
治療后3、6、12個月,OCT檢查可見兩組患眼黃斑區視網膜神經上皮層間及視網膜下積液逐漸吸收;RPE凸起局限,部分患眼可見不規則雙層征(圖7A~7F)。
治療后3、6、12個月,弱熒光組患眼平均BCVA均高于混合熒光組,但差異無統計學意義(P>0.05)(表2)。末次隨訪時,弱熒光組、混合熒光組視力提高的眼數分別為5、3只眼,占本組患眼的62.5%、33.3%;兩組視力提高的眼數比較,差異無統計學意義(P=0.347)。其余患眼視力穩定,無視力下降者。
治療后,所有患眼黃斑區病灶周圍不同程度出血、水腫吸收;隨訪期間未發生玻璃體積血、視網膜下出血加重、眼內炎、視力嚴重下降等并發癥。
3 討論
PCV臨床診斷基于檢眼鏡下表現及ICGA檢查所見BVN末端息肉樣擴張;OCT檢查可見息肉樣病灶表現為內部中等強度反射的RPE凸起,BVN呈不規則的RPE與Bruch膜的雙反射層征象[10, 11]。雖然ICGA仍是目前PCV診斷及治療后評估病情的金標準,但其為侵入性檢查,重復性差;OCT僅能提供某一徑線的切面信息,不能反映病變的延展和范圍。FAF是一種非侵入性技術,可以直接觀察脂褐素在RPE水平的分布和積累,達到形態及功能上的對應[12]。Hikichi等[13]認為PCV的息肉樣病灶上RPE的機械性張力和息肉樣病灶伴發的滲出可能導致RPE細胞的直接損傷,也可能導致病灶鄰近的RPE細胞內代謝功能中度障礙,這使得FAF技術在PCV的應用成為可能。
Nakashizuka等[14]、Schmitz-Valckenberg等[15]認為可能受異常血管的血流動力學影響,PCV病灶組織病理上表現為RPE的不連續性改變,其在FAF上表現為弱熒光,預示RPE不可逆的損傷或萎縮,RPE細胞漿內脂褐素顆粒也隨之減少。Yamagishi等[9]描述了PCV患眼病灶對應于ICGA的FAF特征性弱熒光,即息肉樣病灶呈邊界清楚的融合弱熒光和BVN的顆粒狀弱熒光。此特征性弱熒光具有異常FAF的高度特異性。本組患眼病灶FAF均有此類似表現。Suzuki等[8]回顧分析了47例PCV患者的48只眼在治療觀察的3年期間FAF的變化情況。結果發現,息肉樣病灶在基線和3年隨訪時FAF表現為3種形式,即融合弱熒光環繞強熒光環、融合弱熒光不伴有強熒光環和無明顯改變;在息肉樣病灶消退的患者中仍有96.0%的患眼FAF存在持續異常;基線BVN的顆粒狀弱熒光在隨訪期間無變化或呈融合性弱熒光,但BVN病灶面積明顯擴大。因此,可以認為FAF可對PCV病灶和RPE病灶進行動態觀察及評估。
本研究納入觀察的17只眼,其息肉樣病灶在基線時表現為融合弱熒光,治療早期表現為中央弱熒光強度逐漸增強,在其周圍出現強熒光環,但是隨著治療后時間延長,病灶趨于穩定,強熒光環強度逐漸減弱或消失。我們推測可能是由于治療后視網膜神經上皮層間的出血、水腫逐漸吸收,其對息肉樣病灶上RPE的熒光遮蔽減弱而使息肉樣病灶中央逐漸出現熒光增強,治療過程中息肉樣病灶周圍出現強熒光環;在治療后期病灶穩定,強熒光環的熒光強度逐漸減弱可能表明RPE細胞功能的部分修復。有學者認為,強熒光環來源于RPE細胞的重復結構,即在息肉樣病灶部位RPE凸起的斜面及RPE細胞移位在光學上重疊;強熒光環的消失與ICGA顯示的息肉樣病灶消退明顯一致,即息肉樣病灶消退后,鄰近RPE細胞的代謝功能正常化,隨后強熒光環消失[7, 8]。Yamagishi等[7]采用光動力療法(PDT)、玻璃體腔注射藥物或聯合治療等方法治療了一組PCV患眼,ICGA檢查顯示71.4%的患眼息肉樣病灶緩解,對應的FAF強熒光環消除;而持續存在息肉樣病灶的患眼FAF則表現為強熒光環持續存在。因此作者認為強熒光環的消除與息肉樣病灶緩解相一致。本組患眼隨訪時由于未行ICGA檢查,因此未對息肉樣病灶的消退情況進行分析。但OCT檢查病灶的穩定變化可推測病灶FAF強熒光環的變化可能反應了息肉樣病灶的緩解情況。
臨床上認為息肉樣病灶是可治療的,但是BVN不能退化,且在PDT或抗VEGF藥物治療后仍有進展[16, 17]。本組患眼在隨訪中發現治療前BVN對應部位的弱熒光經治療后仍無明顯變化,此結果與國外學者研究結果一致[7, 8]。Suzuki等[8]研究還發現無論PCV患眼是否接受治療,ICGA顯示所有BVN病灶持續存在或擴大,相對應于BVN的異常FAF范圍也持續存在或擴大。因此推測,一旦PCV的BVN長在RPE下,就會產生一個實質性血液動力學影響RPE功能,形成異常的FAF表現[6-9]。基于這些發現,我們認為RPE長期受持續存在的BVN侵犯可能導致隨后的RPE損傷,引起FAF弱熒光范圍擴大,視力下降。PCV的長期預后可能依賴于BVN的殘留和擴大。為方便觀察FAF變化,本組所有患眼病灶均累及黃斑中心凹或位于旁中心凹。患眼治療前BCVA均較好。治療后患眼視力提高或穩定;OCT檢查提示病灶穩定;FAF異常熒光范圍逐漸縮小,熒光強度趨于正常。此結果說明RPE功能逐漸恢復。由于治療后隨訪時間不長,故本組患眼遠期視力與FAF變化需進一步觀察。
本研究為回顧性病例觀察、納入觀察的樣本量較少,缺乏長期隨訪;FAF缺乏客觀評價且不能定量分析。但FAF提供了其他檢查方法所不能獲得的新信息,或許會成為評價PCV療效的一個輔助的非侵入性方法而應用于臨床實踐。
息肉樣脈絡膜血管病變(PCV)臨床表現為視網膜色素上皮(RPE)下的橘紅色息肉樣病灶及出血性RPE脫離[1-3]。吲哚青綠血管造影(ICGA)檢查特征為后極部脈絡膜異常分支血管網(BVN)、終末息肉樣擴張[4, 5]。但ICGA為有創檢查,不適宜應用于治療后療效的隨訪觀察。近年,眼底自身熒光(FAF)技術因其無創、簡便、可重復性好已廣泛應用于黃斑疾病的臨床監測。眼底主要熒光物質脂褐素主要沉積于RPE細胞,通過FAF對脂褐素的檢測可反應RPE細胞和外層視網膜生理和病理過程[6]。Yamagishi等[7]、Suzuki等[8]認為PCV病灶的存在可能直接影響RPE細胞的代謝功能,應用FAF技術可評估PCV病灶情況。我們觀察了一組PCV患者玻璃體腔注射雷珠單抗治療前后息肉樣病灶FAF的變化特點。現將結果報道如下。
1 對象和方法
回顧性病例研究。患者均知情并簽署治療同意書。2014年5月至2016年5月在我院檢查確診并有連續隨訪記錄的PCV患者17例17只眼納入研究。其中,男性11例11只眼,女性6例6只眼;均為單眼。年齡55~81歲,平均年齡(68.24±7.17)歲。納入標準:(1)間接檢眼鏡檢查可見視網膜下橘紅色病灶、漿液性視網膜脫離、視網膜下出血、RPE脫離。(2)ICGA檢查可見BVN、末端有擴張的息肉樣病灶;病灶累及黃斑中心凹或位于旁中心凹。(3)未接受過玻璃體腔注射抗血管內皮生長因子(VEGF)藥物治療。排除新生血管性老年性黃斑變性、視網膜下出血累及中心凹并超過2個視盤直徑(DD)范圍、伴有>2 DD范圍的RPE脫離、繼發原有新生血管瘢痕病灶的出血、屈光間質明顯混濁、高度近視黃斑病變、糖尿病視網膜病變、視網膜靜脈阻塞等。
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、光相干斷層掃描(OCT)、FAF、熒光素眼底血管造影(FFA)、ICGA檢查。患眼均可見黃斑區病灶周圍有不同程度出血、水腫(圖1A,1B);FFA檢查可見出血部位呈熒光遮蔽,晚期熒光增強,病灶邊緣不清楚(圖2A,2B);ICGA檢查早期息肉樣病灶呈強熒光點,部分患眼可見BVN(圖3A,3B);OCT檢查可見黃斑區視網膜神經上皮層淺脫離,視網膜下可見強反射帶,部分患眼可見RPE層局限凸起(圖4A,4B)。
 圖1
患眼彩色眼底像。1A. 右眼,黃斑區出血、水腫;1B. 左眼,黃斑區中央灰白色邊界模糊病灶伴顳側出血、水腫
圖1
患眼彩色眼底像。1A. 右眼,黃斑區出血、水腫;1B. 左眼,黃斑區中央灰白色邊界模糊病灶伴顳側出血、水腫
 圖4
患眼OCT圖像。4A. 右眼,4B. 左眼。黃斑區視網膜神經上皮層淺脫離,神經上皮層下可見強反射帶,RPE連續性中斷,呈指狀凸起輪廓
圖4
患眼OCT圖像。4A. 右眼,4B. 左眼。黃斑區視網膜神經上皮層淺脫離,神經上皮層下可見強反射帶,RPE連續性中斷,呈指狀凸起輪廓
采用糖尿病視網膜病變早期治療研究組視力表行BCVA檢查。采用德國海德堡公司共焦激光眼底血管造影儀HRA2行FAF檢查。激發光波長488 nm,激發強度96%;屏障濾片濾過波長為500 nm。圖像采集由同一位技術員完成,記錄模式9張/s;最終輸出圖像由儀器自動合成。范圍:黃斑30°×30°,像素768×822。根據文獻[8, 9]標準將FAF異常熒光分為強熒光或弱熒光。強熒光定義為相對于正常背景熒光增強的FAF;弱熒光定義為相對于正常背景熒光降低的FAF。混合熒光為強弱熒光灶的不均勻混雜。弱熒光又分為融合弱熒光和顆粒狀弱熒光。融合弱熒光為均勻的可與周圍區域明顯區分的熒光缺損;顆粒狀弱熒光為不同程度的弱熒光灶的不均勻混雜。排除由視網膜下出血引起的遮蔽熒光。
根據FAF強度將患眼分為弱熒光組和混合熒光組,分別為8例8只眼、9例9只眼。兩組患者性別構成比、平均年齡比較,差異無統計學意義(P>0.05)(表1);兩組患眼BCVA分別為(58.88±11.66)、(46.56±9.15)個字母,差異無統計學意義(t=2.403,P=0.072)。
所有患者均為首次治療。玻璃體腔注射均在無菌手術室內按內眼手術常規操作完成。患眼玻璃體腔注射10.0 mg/ml的雷珠單抗(瑞士諾華制藥有限公司)0.05 ml(含雷珠單抗0.5 mg);每一個月注射1次,連續注射3個月。其后根據隨訪時OCT檢查結果評估病灶是否具有活動性,如存在視網膜下積液或視網膜層間水腫給予重復治療。
首次治療后隨訪時間≥12個月。治療后3、6、12個月采用與治療前相同的檢查設備和方法行BCVA、FAF檢查。觀察兩組患眼治療前和治療后3、6、12個月BCVA、FAF變化;同時觀察與藥物和治療方式相關的眼部并發癥發生情況。以BCVA提高≥15個字母為視力提高;BCVA下降≥15個字母為視力下降;BCVA變化在兩者之間為視力穩定。
采用SPSS17.0統計軟件行統計學分析。數據以均數±標準差(
 )表示。兩組患者年齡比較采用完全隨機t檢驗;治療前后BCVA比較采用獨立樣本t檢驗;兩組患者性別構成比及視力提高的眼數比較采用Fisher確切概率法。P<0.05為差異有統計學意義。
)表示。兩組患者年齡比較采用完全隨機t檢驗;治療前后BCVA比較采用獨立樣本t檢驗;兩組患者性別構成比及視力提高的眼數比較采用Fisher確切概率法。P<0.05為差異有統計學意義。
2 結果
FAF檢查,治療前混合熒光組患眼病灶區呈弱熒光夾雜點狀、網狀或片狀強熒光,病灶周圍強熒光;相應息肉樣病灶呈融合弱熒光(圖5A)。弱熒光組患眼病灶區呈弱熒光,病灶周圍稍強熒光;相應息肉樣病灶中央無熒光,周圍弱熒光圍繞(圖5B)。兩組患眼BVN均呈顆粒狀弱熒光。
混合熒光組患眼治療后病灶區熒光逐漸增強;病灶周圍熒光逐漸減弱至正常背景熒光。治療后3個月,息肉樣病灶中央熒光增強,其周圍可見強熒光環(圖6A);治療后6、12個月,強熒光環逐漸減弱或消失(圖6B)。兩組患眼治療后不同時間BVN弱熒光較治療前無變化(圖6C)。弱熒光組患眼治療后病灶區熒光逐漸增強。治療后3個月,息肉樣病灶中央呈弱熒光,其周圍出現強熒光環(圖6D);治療后6、12個月,息肉樣病灶中央熒光逐漸增強,其周圍強熒光環逐漸減弱(圖6E,6F)。
治療后3、6、12個月,OCT檢查可見兩組患眼黃斑區視網膜神經上皮層間及視網膜下積液逐漸吸收;RPE凸起局限,部分患眼可見不規則雙層征(圖7A~7F)。
治療后3、6、12個月,弱熒光組患眼平均BCVA均高于混合熒光組,但差異無統計學意義(P>0.05)(表2)。末次隨訪時,弱熒光組、混合熒光組視力提高的眼數分別為5、3只眼,占本組患眼的62.5%、33.3%;兩組視力提高的眼數比較,差異無統計學意義(P=0.347)。其余患眼視力穩定,無視力下降者。
治療后,所有患眼黃斑區病灶周圍不同程度出血、水腫吸收;隨訪期間未發生玻璃體積血、視網膜下出血加重、眼內炎、視力嚴重下降等并發癥。
3 討論
PCV臨床診斷基于檢眼鏡下表現及ICGA檢查所見BVN末端息肉樣擴張;OCT檢查可見息肉樣病灶表現為內部中等強度反射的RPE凸起,BVN呈不規則的RPE與Bruch膜的雙反射層征象[10, 11]。雖然ICGA仍是目前PCV診斷及治療后評估病情的金標準,但其為侵入性檢查,重復性差;OCT僅能提供某一徑線的切面信息,不能反映病變的延展和范圍。FAF是一種非侵入性技術,可以直接觀察脂褐素在RPE水平的分布和積累,達到形態及功能上的對應[12]。Hikichi等[13]認為PCV的息肉樣病灶上RPE的機械性張力和息肉樣病灶伴發的滲出可能導致RPE細胞的直接損傷,也可能導致病灶鄰近的RPE細胞內代謝功能中度障礙,這使得FAF技術在PCV的應用成為可能。
Nakashizuka等[14]、Schmitz-Valckenberg等[15]認為可能受異常血管的血流動力學影響,PCV病灶組織病理上表現為RPE的不連續性改變,其在FAF上表現為弱熒光,預示RPE不可逆的損傷或萎縮,RPE細胞漿內脂褐素顆粒也隨之減少。Yamagishi等[9]描述了PCV患眼病灶對應于ICGA的FAF特征性弱熒光,即息肉樣病灶呈邊界清楚的融合弱熒光和BVN的顆粒狀弱熒光。此特征性弱熒光具有異常FAF的高度特異性。本組患眼病灶FAF均有此類似表現。Suzuki等[8]回顧分析了47例PCV患者的48只眼在治療觀察的3年期間FAF的變化情況。結果發現,息肉樣病灶在基線和3年隨訪時FAF表現為3種形式,即融合弱熒光環繞強熒光環、融合弱熒光不伴有強熒光環和無明顯改變;在息肉樣病灶消退的患者中仍有96.0%的患眼FAF存在持續異常;基線BVN的顆粒狀弱熒光在隨訪期間無變化或呈融合性弱熒光,但BVN病灶面積明顯擴大。因此,可以認為FAF可對PCV病灶和RPE病灶進行動態觀察及評估。
本研究納入觀察的17只眼,其息肉樣病灶在基線時表現為融合弱熒光,治療早期表現為中央弱熒光強度逐漸增強,在其周圍出現強熒光環,但是隨著治療后時間延長,病灶趨于穩定,強熒光環強度逐漸減弱或消失。我們推測可能是由于治療后視網膜神經上皮層間的出血、水腫逐漸吸收,其對息肉樣病灶上RPE的熒光遮蔽減弱而使息肉樣病灶中央逐漸出現熒光增強,治療過程中息肉樣病灶周圍出現強熒光環;在治療后期病灶穩定,強熒光環的熒光強度逐漸減弱可能表明RPE細胞功能的部分修復。有學者認為,強熒光環來源于RPE細胞的重復結構,即在息肉樣病灶部位RPE凸起的斜面及RPE細胞移位在光學上重疊;強熒光環的消失與ICGA顯示的息肉樣病灶消退明顯一致,即息肉樣病灶消退后,鄰近RPE細胞的代謝功能正常化,隨后強熒光環消失[7, 8]。Yamagishi等[7]采用光動力療法(PDT)、玻璃體腔注射藥物或聯合治療等方法治療了一組PCV患眼,ICGA檢查顯示71.4%的患眼息肉樣病灶緩解,對應的FAF強熒光環消除;而持續存在息肉樣病灶的患眼FAF則表現為強熒光環持續存在。因此作者認為強熒光環的消除與息肉樣病灶緩解相一致。本組患眼隨訪時由于未行ICGA檢查,因此未對息肉樣病灶的消退情況進行分析。但OCT檢查病灶的穩定變化可推測病灶FAF強熒光環的變化可能反應了息肉樣病灶的緩解情況。
臨床上認為息肉樣病灶是可治療的,但是BVN不能退化,且在PDT或抗VEGF藥物治療后仍有進展[16, 17]。本組患眼在隨訪中發現治療前BVN對應部位的弱熒光經治療后仍無明顯變化,此結果與國外學者研究結果一致[7, 8]。Suzuki等[8]研究還發現無論PCV患眼是否接受治療,ICGA顯示所有BVN病灶持續存在或擴大,相對應于BVN的異常FAF范圍也持續存在或擴大。因此推測,一旦PCV的BVN長在RPE下,就會產生一個實質性血液動力學影響RPE功能,形成異常的FAF表現[6-9]。基于這些發現,我們認為RPE長期受持續存在的BVN侵犯可能導致隨后的RPE損傷,引起FAF弱熒光范圍擴大,視力下降。PCV的長期預后可能依賴于BVN的殘留和擴大。為方便觀察FAF變化,本組所有患眼病灶均累及黃斑中心凹或位于旁中心凹。患眼治療前BCVA均較好。治療后患眼視力提高或穩定;OCT檢查提示病灶穩定;FAF異常熒光范圍逐漸縮小,熒光強度趨于正常。此結果說明RPE功能逐漸恢復。由于治療后隨訪時間不長,故本組患眼遠期視力與FAF變化需進一步觀察。
本研究為回顧性病例觀察、納入觀察的樣本量較少,缺乏長期隨訪;FAF缺乏客觀評價且不能定量分析。但FAF提供了其他檢查方法所不能獲得的新信息,或許會成為評價PCV療效的一個輔助的非侵入性方法而應用于臨床實踐。