引用本文: 殷曉雯, 邵珺, 鄒健, 殷瑩, 胡亞玲, 李正, 宗達, 陳璇, 莊淼, 譚澄燁, 劉艷, 姚勇. 高糖缺氧環境下轉甲狀腺素蛋白對人視網膜血管內皮細胞生長抑制作用機制. 中華眼底病雜志, 2017, 33(5): 523-526. doi: 10.3760/cma.j.issn.1005-1015.2017.05.019 復制
轉甲狀腺素蛋白(TTR)在眼組織中由視網膜色素上皮細胞合成,參與甲狀腺素和視黃醇的轉運,并存在蛋白酶活性及酯酶活性等一些特殊生物學功能[1-3]。我們前期研究發現,TTR對人視網膜血管內皮細胞(hREC)增生、遷移和損傷愈合有明顯促進作用;在高糖缺氧環境下,TTR能通過下調血管內皮生長因子受體(VEGFR)1、2的表達而抑制hREC生長[4-7]。但目前關于TTR抑制VEGFR后對其下游磷酸激酶B(Akt)信號通路的影響機制尚不清楚。為此,本研究以高糖缺氧環境下hREC為細胞模型,檢測了hREC凋亡率以及下游信號通路中Akt、磷酸化Akt(p-Akt)、B細胞淋巴瘤/白血病-2(Bcl-2)、內皮型一氧化氮合成酶(eNOS)及Bcl-2相關X蛋白(Bax)的蛋白表達量,以初步探討高糖缺氧環境下TTR對hREC生長抑制作用的機制。現將結果報道如下。
1 材料和方法
hREC(上海生命科學研究院細胞庫),Dulbecco改良Eagle培養基(DMEM)、磷酸鹽緩沖液(PBS)、青霉素和鏈霉素溶液雙抗、不含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化液(美國Hyclone公司),胎牛血清(美國CLARK Bioscience公司),膜聯蛋白Ⅴ-異硫氰酸熒光素(Annexin Ⅴ-FITC)/碘化丙啶(PI)凋亡檢測試劑盒(北京康為世紀生物科技有限公司),Akt、p-Akt、eNOS兔單抗及β-肌動蛋白(actin)(美國CST公司),Bcl-2兔多克隆抗體、Bax兔單克隆抗體(美國Abcam公司),二抗(美國Proteintech公司),干粉狀TTR(上海新百諾生物科技有限公司),氯化鈷(CoCl2,美國Sigma公司)。
將hREC分為正常組、高糖組、正常缺氧組、高糖缺氧組、正常+TTR組、高糖+TTR組、正常缺氧+TTR組及高糖缺氧+TTR組,各組細胞均置于含10%胎牛血清和2%青霉素、鏈霉素溶液雙抗的DMEM培養基,37℃、5% CO2培養箱中培養。正常組、正常缺氧組培養基中加入5.5 mmol/L葡萄糖;高糖組、高糖缺氧組培養基中加入25.0 mmol/L葡萄糖;正常缺氧組、高糖缺氧組培養基中加入200 μmol/L CoCl2;正常+TTR組、高糖+TTR組、正常缺氧+TTR組及高糖缺氧+TTR組除高糖及缺氧誘導外,于細胞貼壁后再加入用焦碳酸二乙酯水溶解的4 μmol/L TTR[5]。
采用流式細胞儀檢測各組hREC凋亡情況。細胞培養48 h后,收集細胞培養液到離心管內備用。用不含EDTA的0.25%胰蛋白酶消化細胞,至細胞可以被移液管或槍頭輕輕吹打下來時,加入收集的細胞培養液,吹打下所有貼壁細胞并輕輕吹散,再次收集到離心管內。1000×g離心3~5 min,沉淀細胞。小心吸除上清液,加入約1 ml 4℃預冷的PBS,重懸細胞,離心沉淀細胞;重復該操作1次。去離子水按1:3稀釋結合緩沖液。250 μl結合緩沖液重新懸浮細胞,調節其濃度為1×106個/ml。取100 μl細胞懸液于5 ml流式管中,加入5 μlAnnexin Ⅴ/FITC和20 μg/ml的PI溶液10 μl。混勻后于室溫避光孵育15 min。反應管中加400 μl PBS,流式細胞儀分析計算各組細胞凋亡率。重復3次,取平均值。
采用蛋白免疫印跡法(Western blot)檢測各組細胞中Akt、p-Akt、eNOS、Bcl-2、Bax的蛋白表達量。細胞培養48 h后,提取蛋白,二喹啉甲酸法測定蛋白濃度,各樣本等量蛋白電泳,濕法轉膜。一抗4℃孵育過夜,二抗1:3000室溫孵育1 h。增強化學發光試劑盒顯色溫育后暗室顯影。顯影后用Image J圖像分析系統對Akt、p-Akt、eNOS、Bcl-2、Bax蛋白灰度值進行分析。以目標蛋白灰度值/β-actin灰度值為目標蛋白的相對表達量。重復3次,取平均值。
采用SPSS19.0統計軟件進行統計學分析。兩組間計量資料比較采用獨立樣本 t 檢驗,百分率比較采用卡方檢驗;多組間計量資料比較采用方差分析。P<0.05為差異有統計學意義。
2 結果
正常缺氧組較正常組(χ2=25.360)、高糖缺氧組較高糖組(χ2=17.400)、高糖缺氧+TTR組較高糖缺氧組(χ2=9.900)均表現為細胞凋亡率明顯增加,差異有統計學意義(P<0.05)。高糖組與正常組(χ2=0.010)、正常+TTR組與正常組(χ2=0.140)、高糖+TTR組與高糖組(χ2=0.110)、正常缺氧+TTR組與正常缺氧組(χ2=0.010)之間細胞凋亡率比較,差異均無統計學意義(P>0.05)(圖1A)。
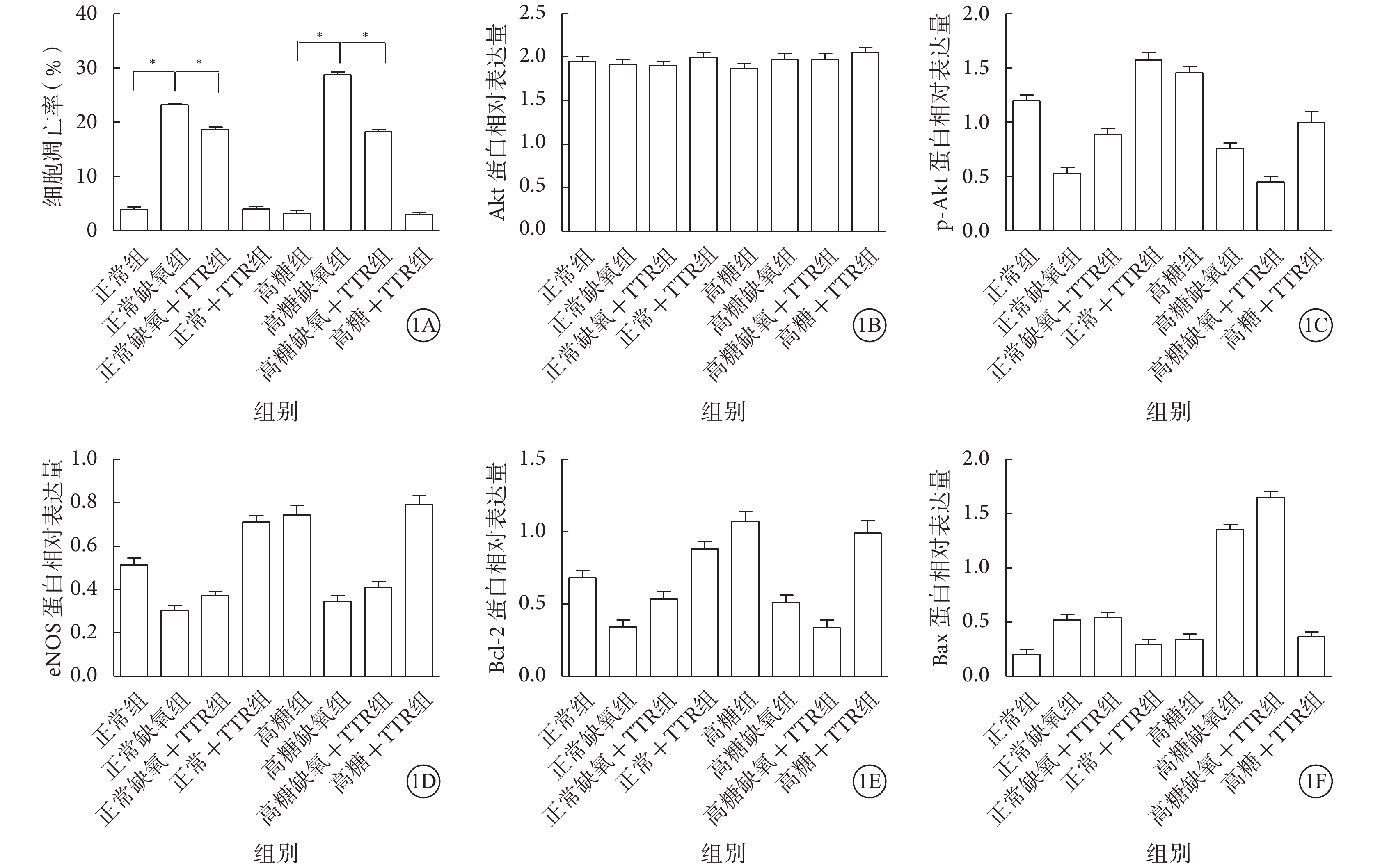 圖1
各組細胞凋亡率及Akt、p-Akt、eNOS、Bcl-2、Bax蛋白相對表達量比較。1A. 細胞凋亡率;1B. Akt;1C. p-Akt;1D. eNOS;1E. Bcl-2;1F. Bax。*P<0.05
圖1
各組細胞凋亡率及Akt、p-Akt、eNOS、Bcl-2、Bax蛋白相對表達量比較。1A. 細胞凋亡率;1B. Akt;1C. p-Akt;1D. eNOS;1E. Bcl-2;1F. Bax。*P<0.05
Western blot檢測結果顯示,各組Akt蛋白表達比較,差異無統計學意義(F=2.450,P>0.05)。正常缺氧組較正常組(t=9.406、5.306、4.819、?4.503)、高糖缺氧組較高糖組(t=8.877、7.723、6.500、?14.646)均表現為p-Akt、eNOS、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加,差異有統計學意義(P<0.05)。與正常缺氧組比較,正常缺氧+TTR組p-Akt蛋白表達量增加,差異有統計學意義(t=?5.024,P<0.05);eNOS、Bcl-2、Bax蛋白表達量無明顯變化,差異無統計學意義(t=?2.235、?2.656、?0.272,P>0.05)。與高糖缺氧組比較,高糖缺氧+TTR組p-Akt、Bcl-2蛋白表達量明顯減少(t=4.355、4.308),Bax蛋白表達量明顯增加(t=?4.311),差異有統計學意義(P<0.05);eNOS蛋白表達量無明顯變化,差異無統計學意義(t=?1.590,P>0.05)。高糖組與正常組(t=?3.407、?4.228、?4.302、?2.076)、正常+TTR組與正常組(t=?4.245、?4.298、?2.816、?1.326)、高糖+TTR組細胞與高糖組(t=4.016、?0.784、0.707、?0.328)之間p-Akt、eNOS、Bcl-2、Bax蛋白表達量比較,差異均無統計學意義(P>0.05)(圖1B~1F)。
3 討論
本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組、高糖缺氧+TTR組較高糖缺氧組均表現為細胞凋亡率明顯增加。正常組與高糖組、正常組與正常+TTR組、高糖組與高糖+TTR組、正常缺氧組與正常缺氧+TTR組之間細胞凋亡率均無明顯差異。說明單純葡萄糖及單純TTR在正常糖濃度和高糖條件下不會影響hREC的細胞凋亡率;缺氧能促進hREC凋亡;正常缺氧條件下TTR對hREC細胞凋亡率無影響,而高糖缺氧條件下TTR能抑制hREC生長。
細胞生存信號通路和eNOS/一氧化氮(NO)與血管重塑和血管生成密切相關[8]。Akt依賴的eNOS磷酸化和NO增加對內皮細胞存活非常重要。已有研究表明,Akt/eNOS信號通路的激活可以減輕心肌缺血、再灌注損傷和細胞凋亡[9-12]。本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組均表現為eNOS蛋白表達明顯降低,但在正常缺氧組和高糖缺氧組中加入TTR之后,eNOS蛋白表達并未發生明顯變化。據此我們認為,TTR在缺氧條件下對hREC凋亡產生的影響可能與Akt/eNOS信號通路無關。
Bcl-2是最具代表性的抑制細胞凋亡基因;Bax的作用正好與Bcl-2相反,其促使細胞凋亡[13, 14]。本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組均表現為p-Akt、eNOS、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加。說明在正常糖濃度和高糖條件下,缺氧能促進Bax蛋白表達并抑制p-Akt、eNOS、Bcl-2蛋白表達,從而促進hREC凋亡。我們還發現,與正常缺氧組比較,正常缺氧+TTR組p-Akt蛋白表達量增加,eNOS、Bcl-2、Bax蛋白表達量無明顯變化;與高糖缺氧組比較,高糖缺氧+TTR組p-Akt、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加,eNOS蛋白表達量無明顯變化。說明在缺氧條件下TTR影響Bcl-2、Bax表達的必要條件是高糖,即只有在高糖缺氧環境下TTR能通過Akt/Bcl-2/Bax信號通路促進hREC凋亡,從而抑制hREC生長。
本研究結果表明,在高糖缺氧環境下TTR抑制hREC生長與Akt/Bcl-2/Bax信號通路相關,而與Akt/eNOS通路無關。但由于本研究只是檢測了Bcl-2、Bax兩種凋亡因子的表達變化,對于TTR通過Akt/Bcl-2/Bax信號通路促進高糖缺氧條件下hREC凋亡后是否也能介導其他凋亡因子發生改變或影響其他信號通路尚不明確,有待更深入的研究加以分析探討。
轉甲狀腺素蛋白(TTR)在眼組織中由視網膜色素上皮細胞合成,參與甲狀腺素和視黃醇的轉運,并存在蛋白酶活性及酯酶活性等一些特殊生物學功能[1-3]。我們前期研究發現,TTR對人視網膜血管內皮細胞(hREC)增生、遷移和損傷愈合有明顯促進作用;在高糖缺氧環境下,TTR能通過下調血管內皮生長因子受體(VEGFR)1、2的表達而抑制hREC生長[4-7]。但目前關于TTR抑制VEGFR后對其下游磷酸激酶B(Akt)信號通路的影響機制尚不清楚。為此,本研究以高糖缺氧環境下hREC為細胞模型,檢測了hREC凋亡率以及下游信號通路中Akt、磷酸化Akt(p-Akt)、B細胞淋巴瘤/白血病-2(Bcl-2)、內皮型一氧化氮合成酶(eNOS)及Bcl-2相關X蛋白(Bax)的蛋白表達量,以初步探討高糖缺氧環境下TTR對hREC生長抑制作用的機制。現將結果報道如下。
1 材料和方法
hREC(上海生命科學研究院細胞庫),Dulbecco改良Eagle培養基(DMEM)、磷酸鹽緩沖液(PBS)、青霉素和鏈霉素溶液雙抗、不含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化液(美國Hyclone公司),胎牛血清(美國CLARK Bioscience公司),膜聯蛋白Ⅴ-異硫氰酸熒光素(Annexin Ⅴ-FITC)/碘化丙啶(PI)凋亡檢測試劑盒(北京康為世紀生物科技有限公司),Akt、p-Akt、eNOS兔單抗及β-肌動蛋白(actin)(美國CST公司),Bcl-2兔多克隆抗體、Bax兔單克隆抗體(美國Abcam公司),二抗(美國Proteintech公司),干粉狀TTR(上海新百諾生物科技有限公司),氯化鈷(CoCl2,美國Sigma公司)。
將hREC分為正常組、高糖組、正常缺氧組、高糖缺氧組、正常+TTR組、高糖+TTR組、正常缺氧+TTR組及高糖缺氧+TTR組,各組細胞均置于含10%胎牛血清和2%青霉素、鏈霉素溶液雙抗的DMEM培養基,37℃、5% CO2培養箱中培養。正常組、正常缺氧組培養基中加入5.5 mmol/L葡萄糖;高糖組、高糖缺氧組培養基中加入25.0 mmol/L葡萄糖;正常缺氧組、高糖缺氧組培養基中加入200 μmol/L CoCl2;正常+TTR組、高糖+TTR組、正常缺氧+TTR組及高糖缺氧+TTR組除高糖及缺氧誘導外,于細胞貼壁后再加入用焦碳酸二乙酯水溶解的4 μmol/L TTR[5]。
采用流式細胞儀檢測各組hREC凋亡情況。細胞培養48 h后,收集細胞培養液到離心管內備用。用不含EDTA的0.25%胰蛋白酶消化細胞,至細胞可以被移液管或槍頭輕輕吹打下來時,加入收集的細胞培養液,吹打下所有貼壁細胞并輕輕吹散,再次收集到離心管內。1000×g離心3~5 min,沉淀細胞。小心吸除上清液,加入約1 ml 4℃預冷的PBS,重懸細胞,離心沉淀細胞;重復該操作1次。去離子水按1:3稀釋結合緩沖液。250 μl結合緩沖液重新懸浮細胞,調節其濃度為1×106個/ml。取100 μl細胞懸液于5 ml流式管中,加入5 μlAnnexin Ⅴ/FITC和20 μg/ml的PI溶液10 μl。混勻后于室溫避光孵育15 min。反應管中加400 μl PBS,流式細胞儀分析計算各組細胞凋亡率。重復3次,取平均值。
采用蛋白免疫印跡法(Western blot)檢測各組細胞中Akt、p-Akt、eNOS、Bcl-2、Bax的蛋白表達量。細胞培養48 h后,提取蛋白,二喹啉甲酸法測定蛋白濃度,各樣本等量蛋白電泳,濕法轉膜。一抗4℃孵育過夜,二抗1:3000室溫孵育1 h。增強化學發光試劑盒顯色溫育后暗室顯影。顯影后用Image J圖像分析系統對Akt、p-Akt、eNOS、Bcl-2、Bax蛋白灰度值進行分析。以目標蛋白灰度值/β-actin灰度值為目標蛋白的相對表達量。重復3次,取平均值。
采用SPSS19.0統計軟件進行統計學分析。兩組間計量資料比較采用獨立樣本 t 檢驗,百分率比較采用卡方檢驗;多組間計量資料比較采用方差分析。P<0.05為差異有統計學意義。
2 結果
正常缺氧組較正常組(χ2=25.360)、高糖缺氧組較高糖組(χ2=17.400)、高糖缺氧+TTR組較高糖缺氧組(χ2=9.900)均表現為細胞凋亡率明顯增加,差異有統計學意義(P<0.05)。高糖組與正常組(χ2=0.010)、正常+TTR組與正常組(χ2=0.140)、高糖+TTR組與高糖組(χ2=0.110)、正常缺氧+TTR組與正常缺氧組(χ2=0.010)之間細胞凋亡率比較,差異均無統計學意義(P>0.05)(圖1A)。
 圖1
各組細胞凋亡率及Akt、p-Akt、eNOS、Bcl-2、Bax蛋白相對表達量比較。1A. 細胞凋亡率;1B. Akt;1C. p-Akt;1D. eNOS;1E. Bcl-2;1F. Bax。*P<0.05
圖1
各組細胞凋亡率及Akt、p-Akt、eNOS、Bcl-2、Bax蛋白相對表達量比較。1A. 細胞凋亡率;1B. Akt;1C. p-Akt;1D. eNOS;1E. Bcl-2;1F. Bax。*P<0.05
Western blot檢測結果顯示,各組Akt蛋白表達比較,差異無統計學意義(F=2.450,P>0.05)。正常缺氧組較正常組(t=9.406、5.306、4.819、?4.503)、高糖缺氧組較高糖組(t=8.877、7.723、6.500、?14.646)均表現為p-Akt、eNOS、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加,差異有統計學意義(P<0.05)。與正常缺氧組比較,正常缺氧+TTR組p-Akt蛋白表達量增加,差異有統計學意義(t=?5.024,P<0.05);eNOS、Bcl-2、Bax蛋白表達量無明顯變化,差異無統計學意義(t=?2.235、?2.656、?0.272,P>0.05)。與高糖缺氧組比較,高糖缺氧+TTR組p-Akt、Bcl-2蛋白表達量明顯減少(t=4.355、4.308),Bax蛋白表達量明顯增加(t=?4.311),差異有統計學意義(P<0.05);eNOS蛋白表達量無明顯變化,差異無統計學意義(t=?1.590,P>0.05)。高糖組與正常組(t=?3.407、?4.228、?4.302、?2.076)、正常+TTR組與正常組(t=?4.245、?4.298、?2.816、?1.326)、高糖+TTR組細胞與高糖組(t=4.016、?0.784、0.707、?0.328)之間p-Akt、eNOS、Bcl-2、Bax蛋白表達量比較,差異均無統計學意義(P>0.05)(圖1B~1F)。
3 討論
本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組、高糖缺氧+TTR組較高糖缺氧組均表現為細胞凋亡率明顯增加。正常組與高糖組、正常組與正常+TTR組、高糖組與高糖+TTR組、正常缺氧組與正常缺氧+TTR組之間細胞凋亡率均無明顯差異。說明單純葡萄糖及單純TTR在正常糖濃度和高糖條件下不會影響hREC的細胞凋亡率;缺氧能促進hREC凋亡;正常缺氧條件下TTR對hREC細胞凋亡率無影響,而高糖缺氧條件下TTR能抑制hREC生長。
細胞生存信號通路和eNOS/一氧化氮(NO)與血管重塑和血管生成密切相關[8]。Akt依賴的eNOS磷酸化和NO增加對內皮細胞存活非常重要。已有研究表明,Akt/eNOS信號通路的激活可以減輕心肌缺血、再灌注損傷和細胞凋亡[9-12]。本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組均表現為eNOS蛋白表達明顯降低,但在正常缺氧組和高糖缺氧組中加入TTR之后,eNOS蛋白表達并未發生明顯變化。據此我們認為,TTR在缺氧條件下對hREC凋亡產生的影響可能與Akt/eNOS信號通路無關。
Bcl-2是最具代表性的抑制細胞凋亡基因;Bax的作用正好與Bcl-2相反,其促使細胞凋亡[13, 14]。本研究結果顯示,正常缺氧組較正常組、高糖缺氧組較高糖組均表現為p-Akt、eNOS、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加。說明在正常糖濃度和高糖條件下,缺氧能促進Bax蛋白表達并抑制p-Akt、eNOS、Bcl-2蛋白表達,從而促進hREC凋亡。我們還發現,與正常缺氧組比較,正常缺氧+TTR組p-Akt蛋白表達量增加,eNOS、Bcl-2、Bax蛋白表達量無明顯變化;與高糖缺氧組比較,高糖缺氧+TTR組p-Akt、Bcl-2蛋白表達量明顯減少,Bax蛋白表達量明顯增加,eNOS蛋白表達量無明顯變化。說明在缺氧條件下TTR影響Bcl-2、Bax表達的必要條件是高糖,即只有在高糖缺氧環境下TTR能通過Akt/Bcl-2/Bax信號通路促進hREC凋亡,從而抑制hREC生長。
本研究結果表明,在高糖缺氧環境下TTR抑制hREC生長與Akt/Bcl-2/Bax信號通路相關,而與Akt/eNOS通路無關。但由于本研究只是檢測了Bcl-2、Bax兩種凋亡因子的表達變化,對于TTR通過Akt/Bcl-2/Bax信號通路促進高糖缺氧條件下hREC凋亡后是否也能介導其他凋亡因子發生改變或影響其他信號通路尚不明確,有待更深入的研究加以分析探討。