引用本文: 金姬, 盧一, 馮佳, 任艷紅, 楊莉麗, 顧偉忠. 視網膜Müller細胞條件性基因敲除血管內皮生長因子對氧誘導視網膜病變小鼠的影響. 中華眼底病雜志, 2017, 33(5): 508-512. doi: 10.3760/cma.j.issn.1005-1015.2017.05.016 復制
早產兒視網膜病變(ROP)的發病機制是相對高濃度氧抑制正常視網膜血管發育并伴隨血管內皮生長因子(VEGF)低表達,而后因缺氧,VEGF、缺氧誘導因子-1α(HIF-1α)表達增高,導致視網膜新生血管增生;視網膜神經纖維層中的Müller細胞參與其病理過程[1-4]。玻璃體腔注射抗VEGF藥物是治療ROP的一種有效方法,但存在ROP復發時間延后、視網膜纖維化、視網膜脫離等并發癥,甚至可能因為注射時機及劑量不當而引起患兒死亡[5-8]。我們應用Cre-Loxp重組酶技術建立Müller細胞條件性基因敲除VEGF小鼠來模擬玻璃體腔早期、大量注射抗VEGF藥物治療環境,再將小鼠置于氧誘導視網膜病變(OIR)環境中觀察其生存情況及視網膜血管形態、組織結構的變化,以期為臨床玻璃體腔注射抗VEGF藥物治療ROP的安全性研究提供實驗理論依據。現將結果報道如下。
1 材料和方法
1.1 Müller細胞條件性基因敲除VEGF小鼠建立與鑒定、OIR模型建立與分組
所有動物實驗均遵循美國眼科和視覺科學研究協會聲明的“眼科和視覺研究動物使用指南”。應用Cre-Loxp重組酶技術建立Müller細胞條件性基因敲除VEGF小鼠[9]。將轉有卵黃樣黃斑營養不良2啟動子并表達反向四環素反式激活因子重組酶Müller細胞的FVB小鼠和兩側標有Loxp位點floxed-VEGF等位基因的C57/BL6小鼠雜交,兩種小鼠均由美國Oklahoma大學生理系提供。孕母鼠從孕15 d至小鼠出生第1天持續服用強力霉素,采用逆轉錄聚合酶鏈反應對小鼠進行鑒定。Cre陽性為敲除VEGF(CKO)小鼠,Cre陰性為未敲除VEGF(NKO)小鼠。
選取7日齡CKO小鼠(CKO組)、NKO小鼠(NKO組)各20只與代哺乳母鼠一同置于75%氧艙喂養5 d,小鼠12日齡時移出氧艙在室內空氣中喂養至17日齡,生長環境清潔無菌。觀察兩組小鼠建模過程中的死亡情況。同時選取在正常空氣環境下飼養的17日齡野生型小鼠7只作為正常對照組。
1.2 視網膜鋪片、視網膜石蠟切片及免疫熒光組織化學染色
小鼠17日齡時,3組各取5只小鼠10只眼行異硫氰酸熒光素-葡聚糖(FITC-Dextran,相對分子質量2×106,美國Sigma公司)熒光造影后視網膜鋪片,熒光顯微鏡(日本Olympus公司)下觀察視網膜血管形態變化,并計算分析視網膜無血管區面積百分比。將FITC-Dextran溶于4%多聚甲醛中,濃度為50 mg/ml,震動,以離心半徑10 cm、轉速2000 r/min離心5 min,制備造影液備用。麻醉固定小鼠,打開胸腔,平衡鹽溶液從左心室灌注5 min,并剪開右心耳放血,抽取配置的造影液1 ml,用2 ml注射器針頭注入左心室,以口、鼻、耳廓變黃為灌注成功。迅速摘除眼球,置于4%多聚甲醛固定30 min。在便攜式顯微鏡(日本Olympus公司)下,沿角鞏膜剪開眼球,去除角膜、晶狀體,小心剜出視網膜,放射狀剪開,置于干凈載玻片上,鋪平,滴甘油固定液1滴,蓋上蓋玻片。取490 nm激發光,520 nm濾過波,于熒光顯微鏡下觀察拍片。測量全視網膜和視網膜無血管區面積,計算無血管區面積所占百分比。
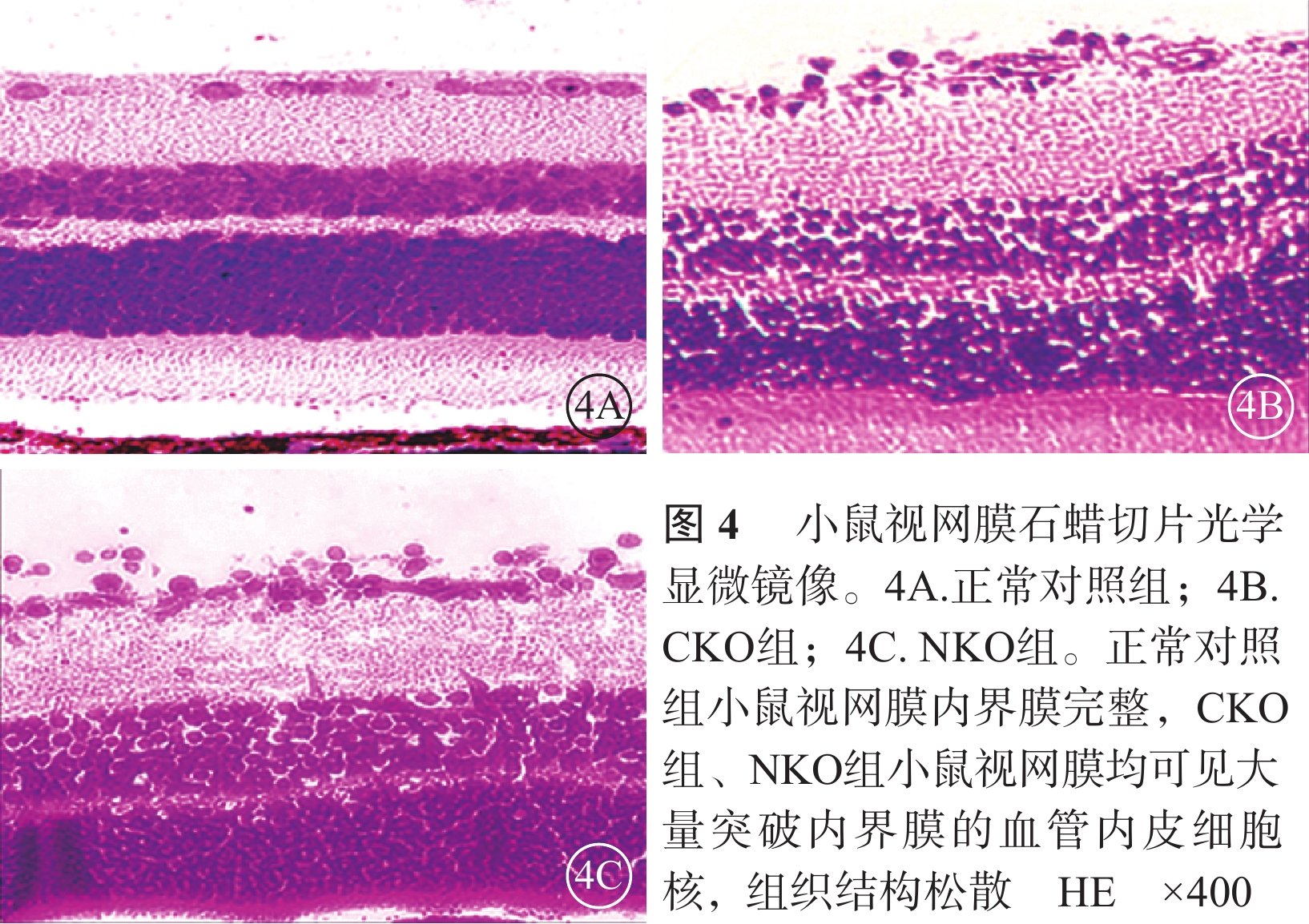
小鼠17日齡時,3組各取2只小鼠4只眼行視網膜石蠟切片,計數突破內界膜的血管內皮細胞核數。摘取眼球,常規石蠟包埋,連續切片厚度為4 μm,每只眼球隨機取出20張切片,常規蘇木精-伊紅(HE)染色。除外含視神經的切片,每組共80張切片。400倍光學顯微鏡下計數突破內界膜的血管內皮細胞核數,取平均數。
采用免疫熒光組織化學染色檢測CKO組、NKO組小鼠視網膜中HIF-1α的表達。取視網膜石蠟切片,經常規脫蠟水化后,磷酸鹽緩沖液(PBS)洗滌3次,正常山羊血清室溫封閉1 h,加入山羊抗鼠HIF-1α單克隆抗體一抗(1:100),4 ℃孵育過夜,PBS洗滌3次,山羊抗兔IgG綠色DyLight488熒光標記二抗(美國Invitrogen公司)37 ℃孵育1 h,苯基吲哚(DAPI)復染細胞核5 min,PBS洗滌3次,抗熒光淬滅封片液封片,熒光顯微鏡拍片。PBS替代一抗設為陰性對照。
1.3 統計學分析
采用SPSS 12.0統計學軟件進行統計處理。實驗數據計數資料以百分比表示,組間比較采用卡方檢驗。計量資料以均數±標準差(
 )表示,組間比較采用非配對 t 檢驗。P<0.05為差異有統計學意義。
)表示,組間比較采用非配對 t 檢驗。P<0.05為差異有統計學意義。
2 結果
OIR建模過程中,CKO組、NKO組小鼠總死亡率分別為65.00%、30.00%。CKO組小鼠總死亡率是NKO組小鼠的2.17倍,差異有統計學意義(χ2=4.912,P=0.027)。在高氧環境中,CKO組、NKO組小鼠總死亡率分別為40.00%、20.00%;CKO組小鼠死亡率是NKO組的2.00倍。出氧艙后,CKO組、NKO組小鼠總死亡率分別為41.67%、12.50%;CKO組小鼠死亡率是NKO組的3.30倍。CKO組、NKO組在高氧艙內及出氧艙后的小鼠死亡率比較,差異均無統計學意義(χ2=1.905、1.764,P=0.166、0.078)。
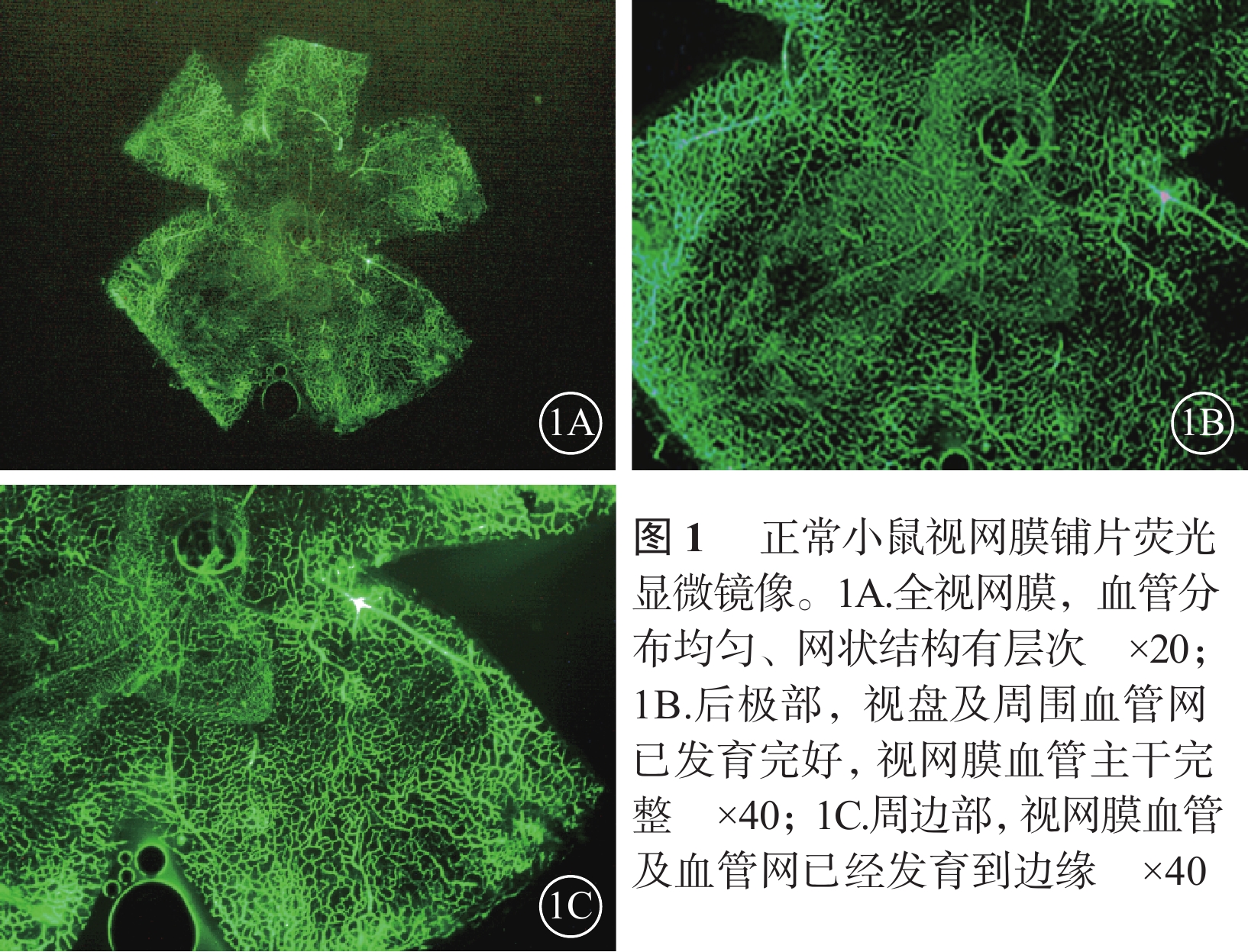
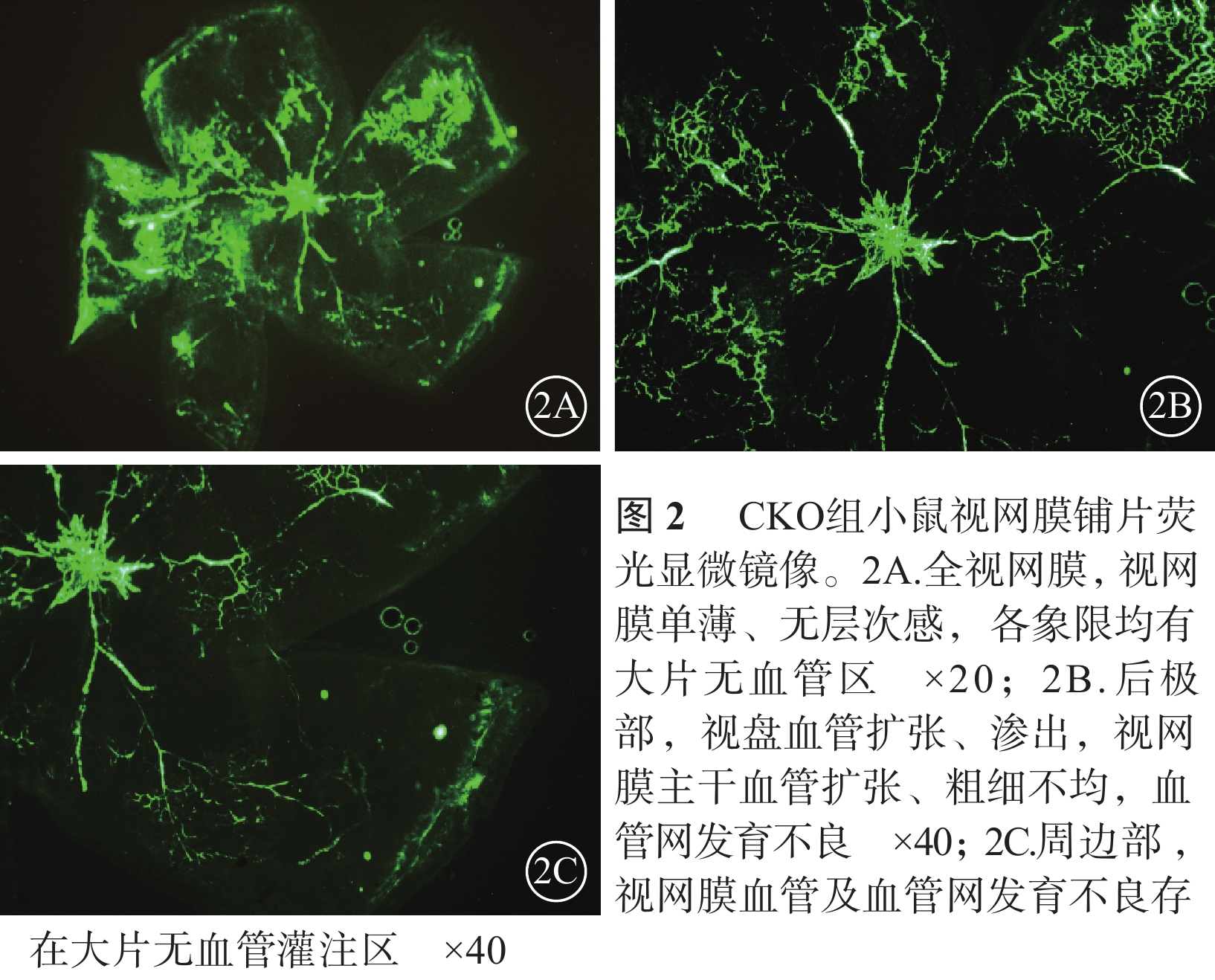
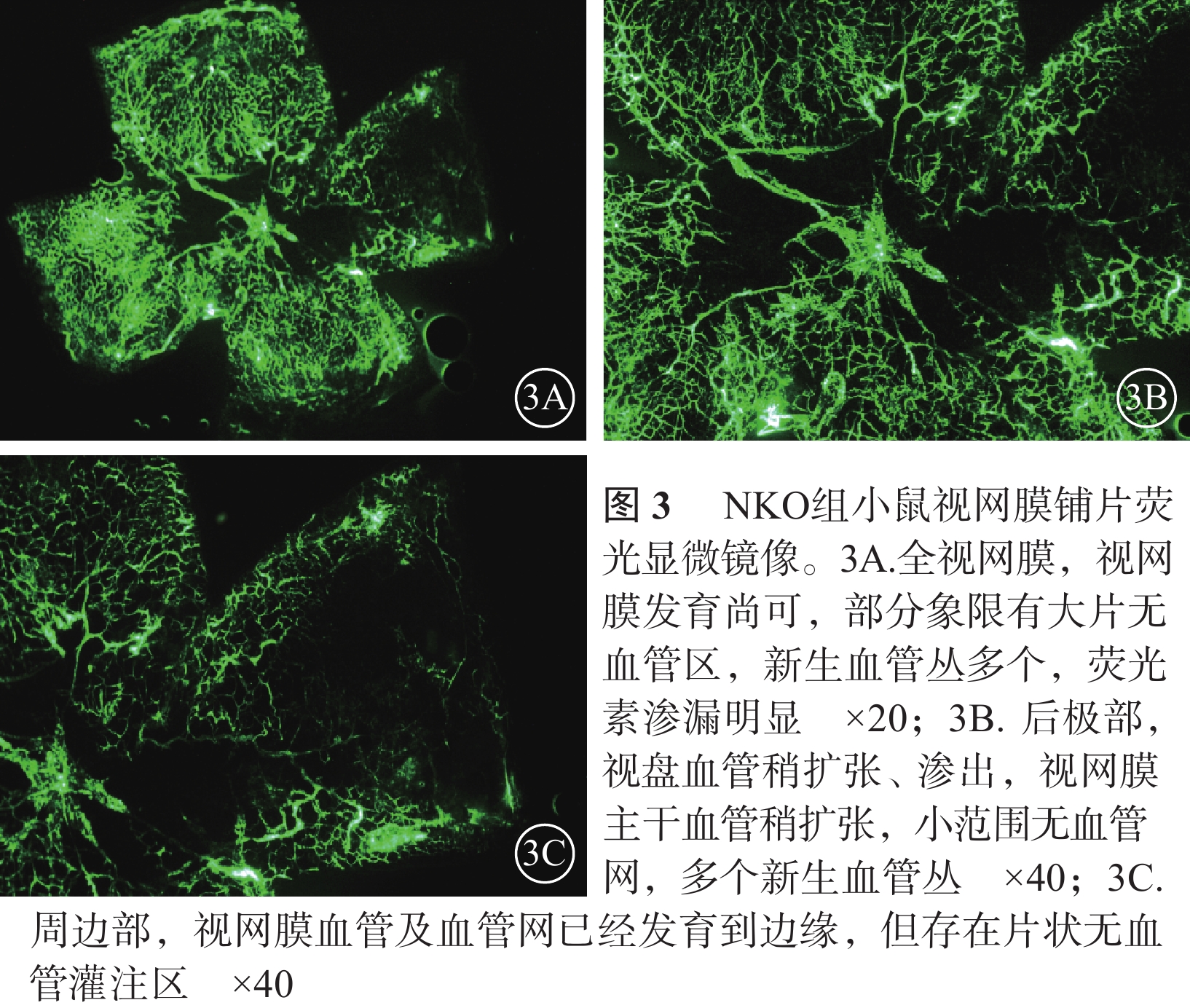
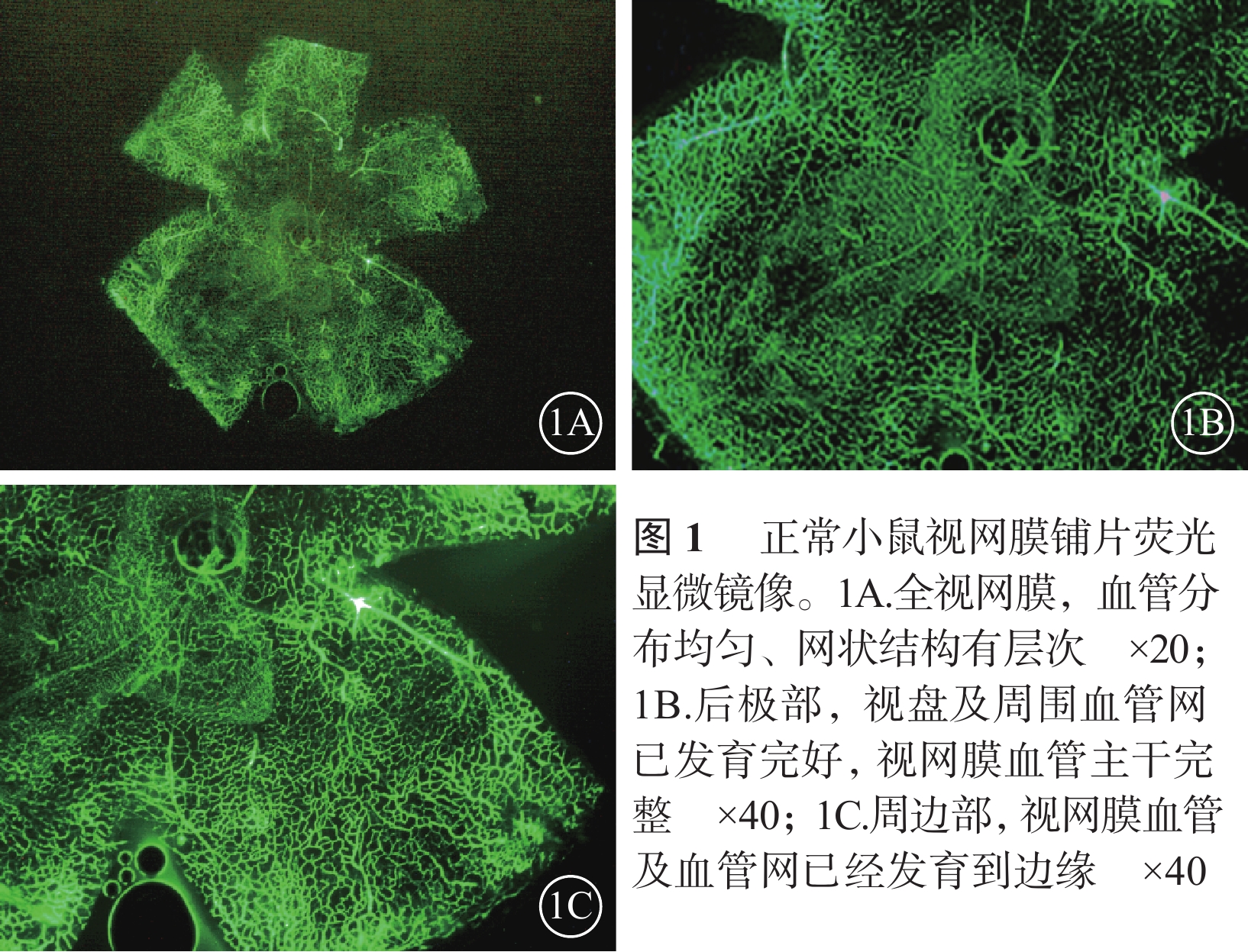
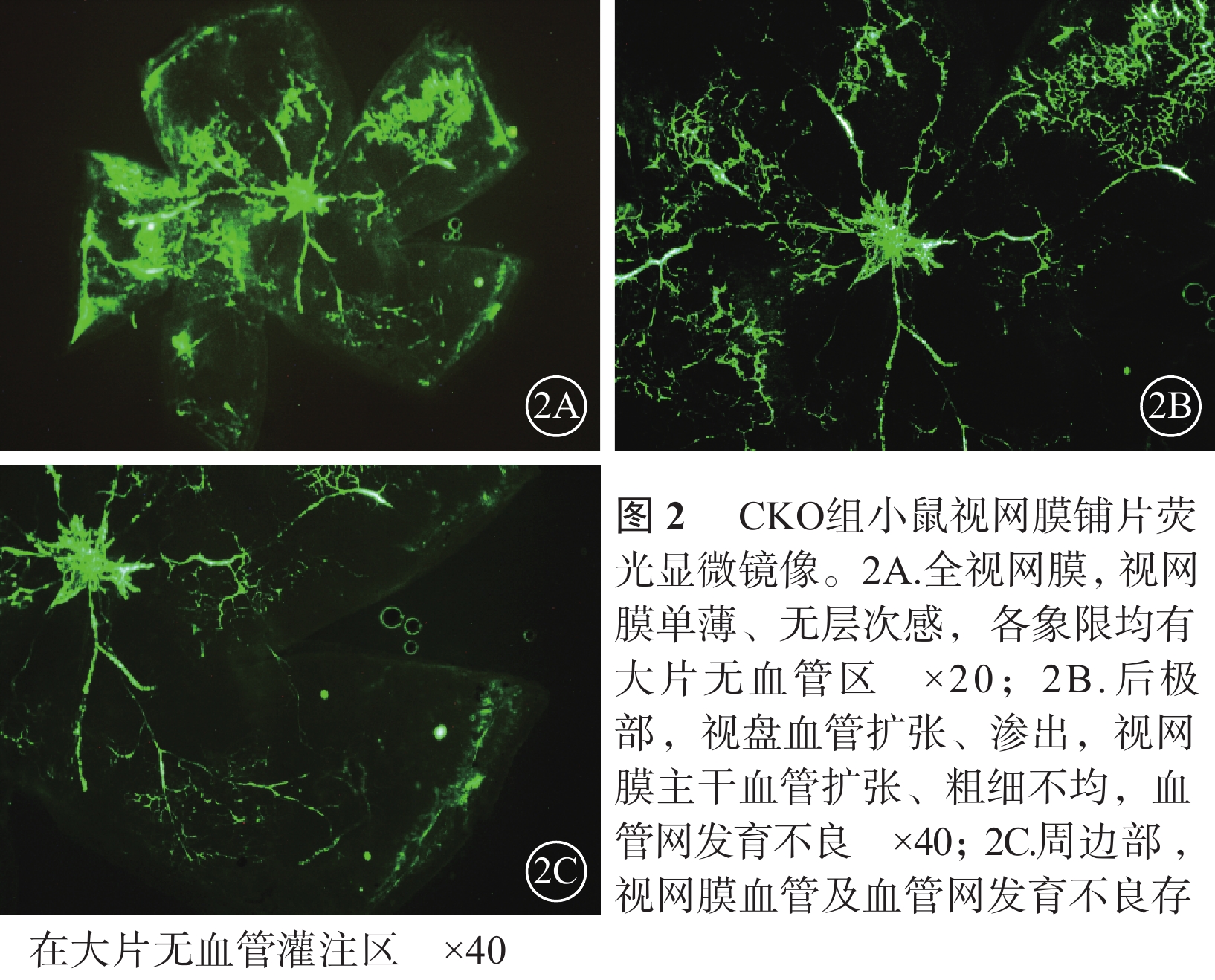
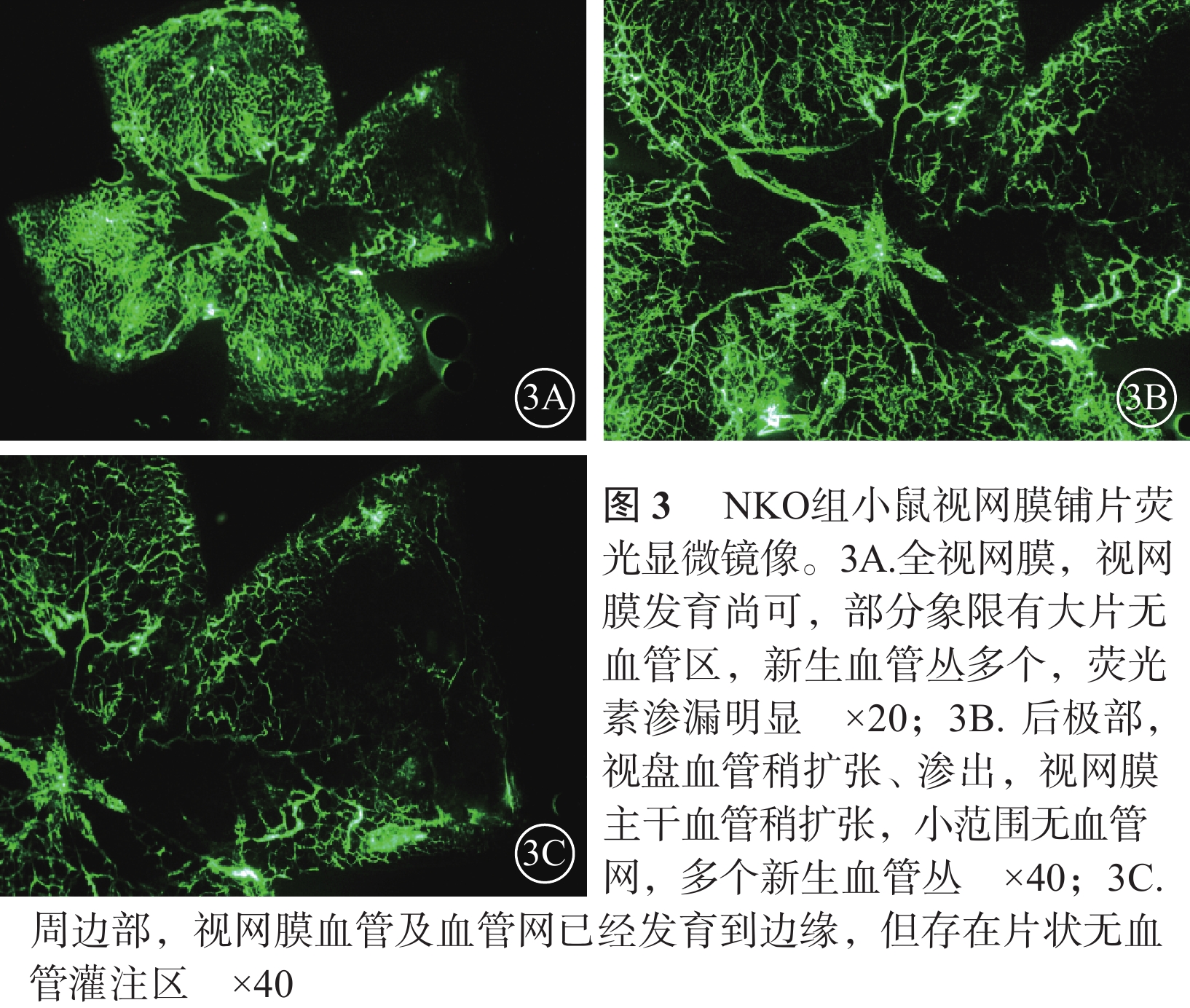
熒光顯微鏡觀察發現,正常對照組小鼠視盤及視網膜血管發育完全至邊緣,血管網分布均勻厚實,沒有無血管區(圖1)。CKO組小鼠視盤周圍毛細血管閉塞,視網膜血管擴張、紆曲,可見大片無血管區,新生血管叢較少;熒光素滲漏情況不明顯;中周部正常毛細血管網少、密度低且分布紊亂,血管未發育到邊緣;整個視網膜單薄、無層次感(圖2)。NKO組小鼠視盤周圍無血管區較少,血管紆曲、擴張較輕,視網膜正常血管網狀結構可見范圍較大,血管密度高且分布紊亂,新生血管叢較多,熒光素滲漏較明顯(圖3)。CKO組、NKO組小鼠視網膜無血管區面積所占全視網膜面積的百分比分別為(28.31±11.15)%、(16.82±7.23)%;兩者比較,差異有統計學意義(t=2.734,P=0.014)。
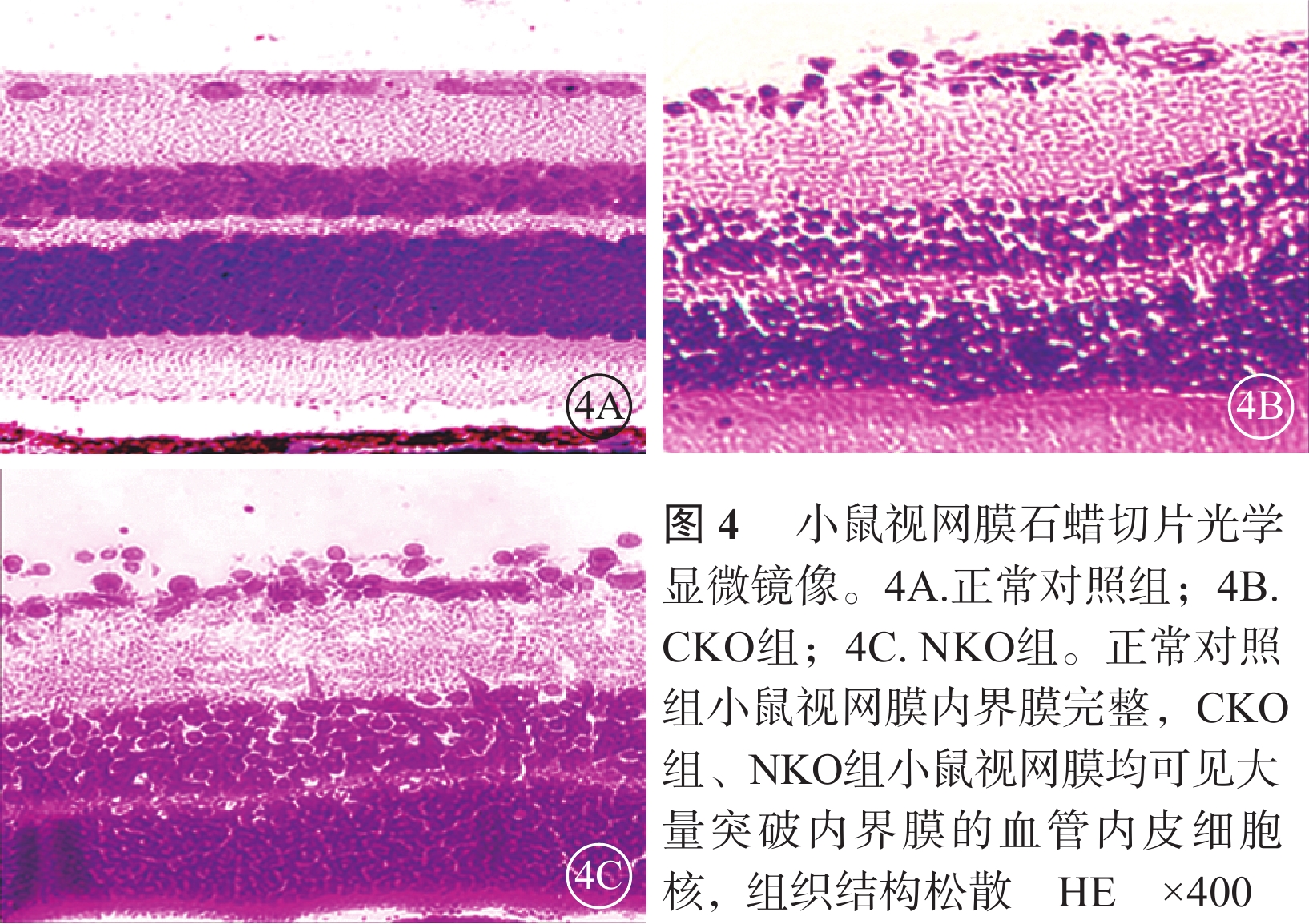
光學顯微鏡觀察發現,正常對照組小鼠未見突破內界膜的內皮細胞核,CKO組、NKO組小鼠均可見大量突破內界膜的血管內皮細胞核(圖4)。CKO組、NKO組小鼠平均每張切片突破內界膜的血管內皮細胞核數分別為(26.10±6.37)、(28.80±7.59)個;兩者比較,差異有統計學意義(t=2.437,P=0.016)。
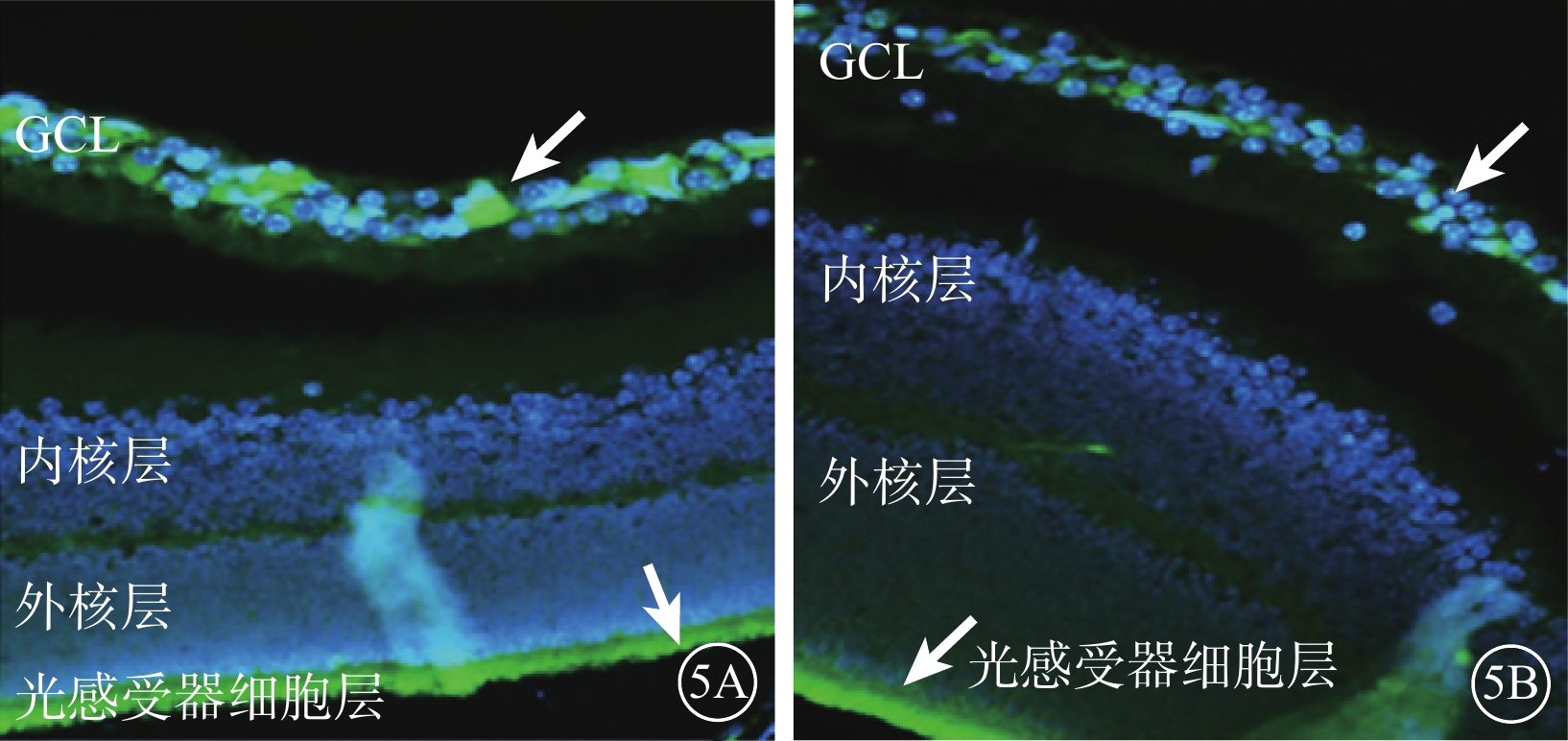
熒光顯微鏡觀察發現,CKO組、NKO組小鼠視網膜均可見HIF-1α呈陽性表達,主要位于神經節細胞層(GCL)和光感受器細胞層。CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組(圖5)。
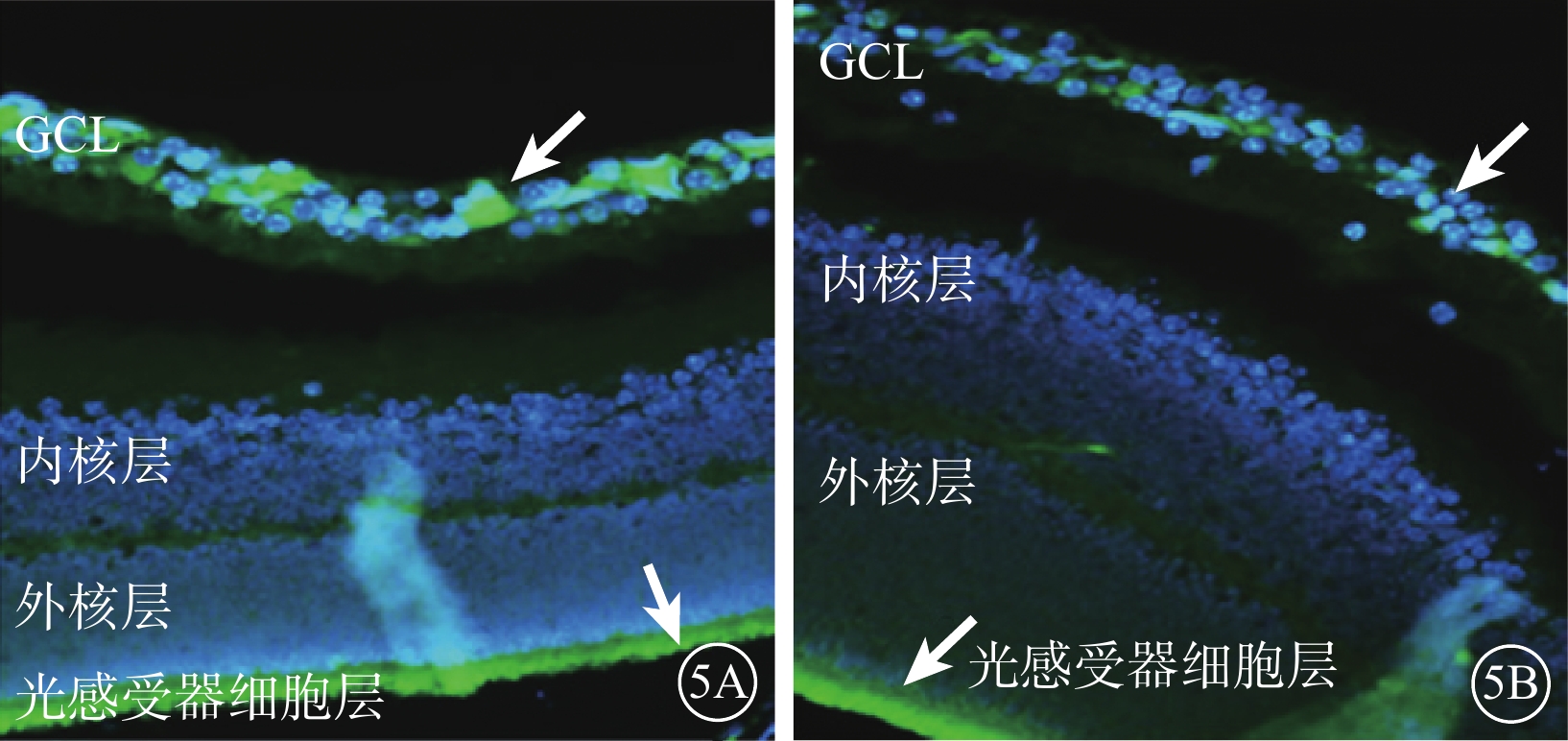 圖5
小鼠視網膜石蠟切片熒光顯微鏡像。5A.CKO組;5B.NKO組。兩組小鼠視網膜可見HIF-1α陽性表達主要位于GCL和光感受器細胞層(白箭),CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組 DAPI ×400
圖5
小鼠視網膜石蠟切片熒光顯微鏡像。5A.CKO組;5B.NKO組。兩組小鼠視網膜可見HIF-1α陽性表達主要位于GCL和光感受器細胞層(白箭),CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組 DAPI ×400
3 討論
應用Cre-Loxp重組酶技術建立的CKO小鼠可通過強力霉素調控Cre表達,這就賦予CKO小鼠視網膜VEGF缺失的時間可以人為調控,使進行性疾病及退行性疾病的研究更加方便[9]。本研究對孕母鼠從孕15 d至小鼠出生第1天持續服用強力霉素,調控Müller細胞在CKO小鼠出生第2天起不表達VEGF,模擬了早期、大量玻璃體腔注射抗VEGF藥物的效果。在這個模式下,我們建立與ROP極其相似的OIR動物模型觀察小鼠視網膜血管的發生發展情況。結果顯示,與NKO組比較,CKO組小鼠整個視網膜較單薄、貧瘠,血管化推遲,正常毛細血管網和新生血管叢均少,熒光素滲漏較不明顯;視盤及后極部血管網發育不良,視網膜可見大片無血管區;視網膜無血管區所占面積更大。提示早期、大量玻璃體腔注射抗VEGF藥物有減少視網膜新生血管生長和降低血管通透性的作用,但也明顯影響視網膜血管和神經正常發育。說明VEGF除了刺激病理性新生血管外,也是有效的神經保護和神經再生因子[10]。提示臨床對于ROP發病早期及較早發生ROP的患兒,應用抗VEGF藥物應謹慎。
我們還發現,CKO組小鼠突破內界膜的血管內皮細胞核數較NKO組少,但視網膜基質及內界膜的破壞程度兩者沒有分別。據此推測,抗VEGF藥物治療不能減輕或恢復ROP引起的血眼屏障功能的破壞,其他一些血管生長因子、纖維化因子等仍然會滲透入視網膜、玻璃體中,引起ROP復發、視網膜纖維化等。
HIF-1α是介導細胞對低氧微環境進行適應性反應的關鍵性轉錄調控因子,可上調VEGF、胰島素樣生長因子-1、促紅細胞生成素及其受體的表達,從而促進血管新生,在ROP的發生發展中也起到重要作用[3]。本研究結果顯示,CKO組、NKO組小鼠視網膜GCL和光感受器細胞層均可見HIF-1α陽性表達,且CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組。證明Müller細胞條件性基因敲除VEGF不能阻止OIR的HIF-1α表達增高。HIF-1α是否可以成為ROP治療的新靶點有待進一步研究揭示。
已有研究報道,玻璃體腔注射抗VEGF藥物可通過滲透到達全身血液循環,這可能會增加早產兒發生全身并發癥的風險[11]。Mintz-Hittner等[6]采用玻璃體腔注射貝伐單抗治療3期以上的ROP患兒,其中4例發生死亡。說明VEGF可能在其他器官發育中也發揮著非常重要的作用,抗VEGF藥物治療可能對早產兒正常發育造成影響[12]。本研究中CKO小鼠總死亡率是NKO小鼠的2.17倍。推測視網膜局部VEGF基因敲除新生小鼠的生存能力下降可能還是因為VEGF缺乏,后者是生長發育過程中必需的生長因子。
本研究結果表明,Müller細胞條件性基因敲除VEGF模擬早期、大量玻璃體腔注射抗VEGF藥物的效果會明顯減弱新生小鼠在OIR環境中的生存能力,抑制部分視網膜新生血管的同時推遲了視網膜正常血管化。但由于本研究存在樣本量小、時間設計單一以及HIF-1α及其信息通路缺乏系統設計等缺陷,其結果有待進一步研究加以驗證。
早產兒視網膜病變(ROP)的發病機制是相對高濃度氧抑制正常視網膜血管發育并伴隨血管內皮生長因子(VEGF)低表達,而后因缺氧,VEGF、缺氧誘導因子-1α(HIF-1α)表達增高,導致視網膜新生血管增生;視網膜神經纖維層中的Müller細胞參與其病理過程[1-4]。玻璃體腔注射抗VEGF藥物是治療ROP的一種有效方法,但存在ROP復發時間延后、視網膜纖維化、視網膜脫離等并發癥,甚至可能因為注射時機及劑量不當而引起患兒死亡[5-8]。我們應用Cre-Loxp重組酶技術建立Müller細胞條件性基因敲除VEGF小鼠來模擬玻璃體腔早期、大量注射抗VEGF藥物治療環境,再將小鼠置于氧誘導視網膜病變(OIR)環境中觀察其生存情況及視網膜血管形態、組織結構的變化,以期為臨床玻璃體腔注射抗VEGF藥物治療ROP的安全性研究提供實驗理論依據。現將結果報道如下。
1 材料和方法
1.1 Müller細胞條件性基因敲除VEGF小鼠建立與鑒定、OIR模型建立與分組
所有動物實驗均遵循美國眼科和視覺科學研究協會聲明的“眼科和視覺研究動物使用指南”。應用Cre-Loxp重組酶技術建立Müller細胞條件性基因敲除VEGF小鼠[9]。將轉有卵黃樣黃斑營養不良2啟動子并表達反向四環素反式激活因子重組酶Müller細胞的FVB小鼠和兩側標有Loxp位點floxed-VEGF等位基因的C57/BL6小鼠雜交,兩種小鼠均由美國Oklahoma大學生理系提供。孕母鼠從孕15 d至小鼠出生第1天持續服用強力霉素,采用逆轉錄聚合酶鏈反應對小鼠進行鑒定。Cre陽性為敲除VEGF(CKO)小鼠,Cre陰性為未敲除VEGF(NKO)小鼠。
選取7日齡CKO小鼠(CKO組)、NKO小鼠(NKO組)各20只與代哺乳母鼠一同置于75%氧艙喂養5 d,小鼠12日齡時移出氧艙在室內空氣中喂養至17日齡,生長環境清潔無菌。觀察兩組小鼠建模過程中的死亡情況。同時選取在正常空氣環境下飼養的17日齡野生型小鼠7只作為正常對照組。
1.2 視網膜鋪片、視網膜石蠟切片及免疫熒光組織化學染色
小鼠17日齡時,3組各取5只小鼠10只眼行異硫氰酸熒光素-葡聚糖(FITC-Dextran,相對分子質量2×106,美國Sigma公司)熒光造影后視網膜鋪片,熒光顯微鏡(日本Olympus公司)下觀察視網膜血管形態變化,并計算分析視網膜無血管區面積百分比。將FITC-Dextran溶于4%多聚甲醛中,濃度為50 mg/ml,震動,以離心半徑10 cm、轉速2000 r/min離心5 min,制備造影液備用。麻醉固定小鼠,打開胸腔,平衡鹽溶液從左心室灌注5 min,并剪開右心耳放血,抽取配置的造影液1 ml,用2 ml注射器針頭注入左心室,以口、鼻、耳廓變黃為灌注成功。迅速摘除眼球,置于4%多聚甲醛固定30 min。在便攜式顯微鏡(日本Olympus公司)下,沿角鞏膜剪開眼球,去除角膜、晶狀體,小心剜出視網膜,放射狀剪開,置于干凈載玻片上,鋪平,滴甘油固定液1滴,蓋上蓋玻片。取490 nm激發光,520 nm濾過波,于熒光顯微鏡下觀察拍片。測量全視網膜和視網膜無血管區面積,計算無血管區面積所占百分比。
小鼠17日齡時,3組各取2只小鼠4只眼行視網膜石蠟切片,計數突破內界膜的血管內皮細胞核數。摘取眼球,常規石蠟包埋,連續切片厚度為4 μm,每只眼球隨機取出20張切片,常規蘇木精-伊紅(HE)染色。除外含視神經的切片,每組共80張切片。400倍光學顯微鏡下計數突破內界膜的血管內皮細胞核數,取平均數。
采用免疫熒光組織化學染色檢測CKO組、NKO組小鼠視網膜中HIF-1α的表達。取視網膜石蠟切片,經常規脫蠟水化后,磷酸鹽緩沖液(PBS)洗滌3次,正常山羊血清室溫封閉1 h,加入山羊抗鼠HIF-1α單克隆抗體一抗(1:100),4 ℃孵育過夜,PBS洗滌3次,山羊抗兔IgG綠色DyLight488熒光標記二抗(美國Invitrogen公司)37 ℃孵育1 h,苯基吲哚(DAPI)復染細胞核5 min,PBS洗滌3次,抗熒光淬滅封片液封片,熒光顯微鏡拍片。PBS替代一抗設為陰性對照。
1.3 統計學分析
采用SPSS 12.0統計學軟件進行統計處理。實驗數據計數資料以百分比表示,組間比較采用卡方檢驗。計量資料以均數±標準差(
 )表示,組間比較采用非配對 t 檢驗。P<0.05為差異有統計學意義。
)表示,組間比較采用非配對 t 檢驗。P<0.05為差異有統計學意義。
2 結果
OIR建模過程中,CKO組、NKO組小鼠總死亡率分別為65.00%、30.00%。CKO組小鼠總死亡率是NKO組小鼠的2.17倍,差異有統計學意義(χ2=4.912,P=0.027)。在高氧環境中,CKO組、NKO組小鼠總死亡率分別為40.00%、20.00%;CKO組小鼠死亡率是NKO組的2.00倍。出氧艙后,CKO組、NKO組小鼠總死亡率分別為41.67%、12.50%;CKO組小鼠死亡率是NKO組的3.30倍。CKO組、NKO組在高氧艙內及出氧艙后的小鼠死亡率比較,差異均無統計學意義(χ2=1.905、1.764,P=0.166、0.078)。
熒光顯微鏡觀察發現,正常對照組小鼠視盤及視網膜血管發育完全至邊緣,血管網分布均勻厚實,沒有無血管區(圖1)。CKO組小鼠視盤周圍毛細血管閉塞,視網膜血管擴張、紆曲,可見大片無血管區,新生血管叢較少;熒光素滲漏情況不明顯;中周部正常毛細血管網少、密度低且分布紊亂,血管未發育到邊緣;整個視網膜單薄、無層次感(圖2)。NKO組小鼠視盤周圍無血管區較少,血管紆曲、擴張較輕,視網膜正常血管網狀結構可見范圍較大,血管密度高且分布紊亂,新生血管叢較多,熒光素滲漏較明顯(圖3)。CKO組、NKO組小鼠視網膜無血管區面積所占全視網膜面積的百分比分別為(28.31±11.15)%、(16.82±7.23)%;兩者比較,差異有統計學意義(t=2.734,P=0.014)。



光學顯微鏡觀察發現,正常對照組小鼠未見突破內界膜的內皮細胞核,CKO組、NKO組小鼠均可見大量突破內界膜的血管內皮細胞核(圖4)。CKO組、NKO組小鼠平均每張切片突破內界膜的血管內皮細胞核數分別為(26.10±6.37)、(28.80±7.59)個;兩者比較,差異有統計學意義(t=2.437,P=0.016)。

熒光顯微鏡觀察發現,CKO組、NKO組小鼠視網膜均可見HIF-1α呈陽性表達,主要位于神經節細胞層(GCL)和光感受器細胞層。CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組(圖5)。
 圖5
小鼠視網膜石蠟切片熒光顯微鏡像。5A.CKO組;5B.NKO組。兩組小鼠視網膜可見HIF-1α陽性表達主要位于GCL和光感受器細胞層(白箭),CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組 DAPI ×400
圖5
小鼠視網膜石蠟切片熒光顯微鏡像。5A.CKO組;5B.NKO組。兩組小鼠視網膜可見HIF-1α陽性表達主要位于GCL和光感受器細胞層(白箭),CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組 DAPI ×400
3 討論
應用Cre-Loxp重組酶技術建立的CKO小鼠可通過強力霉素調控Cre表達,這就賦予CKO小鼠視網膜VEGF缺失的時間可以人為調控,使進行性疾病及退行性疾病的研究更加方便[9]。本研究對孕母鼠從孕15 d至小鼠出生第1天持續服用強力霉素,調控Müller細胞在CKO小鼠出生第2天起不表達VEGF,模擬了早期、大量玻璃體腔注射抗VEGF藥物的效果。在這個模式下,我們建立與ROP極其相似的OIR動物模型觀察小鼠視網膜血管的發生發展情況。結果顯示,與NKO組比較,CKO組小鼠整個視網膜較單薄、貧瘠,血管化推遲,正常毛細血管網和新生血管叢均少,熒光素滲漏較不明顯;視盤及后極部血管網發育不良,視網膜可見大片無血管區;視網膜無血管區所占面積更大。提示早期、大量玻璃體腔注射抗VEGF藥物有減少視網膜新生血管生長和降低血管通透性的作用,但也明顯影響視網膜血管和神經正常發育。說明VEGF除了刺激病理性新生血管外,也是有效的神經保護和神經再生因子[10]。提示臨床對于ROP發病早期及較早發生ROP的患兒,應用抗VEGF藥物應謹慎。
我們還發現,CKO組小鼠突破內界膜的血管內皮細胞核數較NKO組少,但視網膜基質及內界膜的破壞程度兩者沒有分別。據此推測,抗VEGF藥物治療不能減輕或恢復ROP引起的血眼屏障功能的破壞,其他一些血管生長因子、纖維化因子等仍然會滲透入視網膜、玻璃體中,引起ROP復發、視網膜纖維化等。
HIF-1α是介導細胞對低氧微環境進行適應性反應的關鍵性轉錄調控因子,可上調VEGF、胰島素樣生長因子-1、促紅細胞生成素及其受體的表達,從而促進血管新生,在ROP的發生發展中也起到重要作用[3]。本研究結果顯示,CKO組、NKO組小鼠視網膜GCL和光感受器細胞層均可見HIF-1α陽性表達,且CKO組小鼠視網膜HIF-1α陽性表達明顯強于NKO組。證明Müller細胞條件性基因敲除VEGF不能阻止OIR的HIF-1α表達增高。HIF-1α是否可以成為ROP治療的新靶點有待進一步研究揭示。
已有研究報道,玻璃體腔注射抗VEGF藥物可通過滲透到達全身血液循環,這可能會增加早產兒發生全身并發癥的風險[11]。Mintz-Hittner等[6]采用玻璃體腔注射貝伐單抗治療3期以上的ROP患兒,其中4例發生死亡。說明VEGF可能在其他器官發育中也發揮著非常重要的作用,抗VEGF藥物治療可能對早產兒正常發育造成影響[12]。本研究中CKO小鼠總死亡率是NKO小鼠的2.17倍。推測視網膜局部VEGF基因敲除新生小鼠的生存能力下降可能還是因為VEGF缺乏,后者是生長發育過程中必需的生長因子。
本研究結果表明,Müller細胞條件性基因敲除VEGF模擬早期、大量玻璃體腔注射抗VEGF藥物的效果會明顯減弱新生小鼠在OIR環境中的生存能力,抑制部分視網膜新生血管的同時推遲了視網膜正常血管化。但由于本研究存在樣本量小、時間設計單一以及HIF-1α及其信息通路缺乏系統設計等缺陷,其結果有待進一步研究加以驗證。