引用本文: 擺茹, 周月, 蘆曉紅, 蔡金金, 姚青. 靶向大鼠沉默信息調節因子1基因小干擾RNA慢病毒載體對大鼠視網膜神經節細胞中沉默信息調節因子1表達的影響. 中華眼底病雜志, 2017, 33(5): 503-507. doi: 10.3760/cma.j.issn.1005-1015.2017.05.015 復制
沉默信息調節因子1(Sirt1)是一種煙堿腺嘌呤二核苷酸(NAD+)依賴性組蛋白去乙酰化酶,能夠將蛋白質的乙酰基轉移到NAD+而發揮去乙酰化的作用,參與能量平衡、細胞自噬、DNA損傷修復、神經退行性病變、糖尿病、心臟病、炎癥以及腫瘤發生等眾多生理和病理過程[1]。在視網膜中,Sirt1可分布于視網膜神經節細胞(RGC)、光感受器細胞和視網膜色素上皮細胞[2]。已有研究發現,缺血、視神經損傷等原因造成RGC細胞損傷后,Sirt1的表達水平降低;而使用檸檬酸苷、白藜蘆醇干預后,Sirt1的表達水平升高,有利于RGC細胞損傷的恢復。說明Sirt1對RGC有保護作用,但其發揮保護作用的機制尚不明確[3, 4]。本研究構建了靶向大鼠Sirt1小干擾(si)RNA慢病毒載體,觀察其轉染大鼠RGC細胞后對RGC細胞中Sirt1表達的影響,以期為進一步研究Sirt1基因對RGC細胞生物學功能的影響及動物實驗奠定實驗基礎。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
慢病毒表達載體pGLV3/H1/GFP-Puro、Taq DNA聚合酶、聚合酶鏈反應(PCR)回收試劑盒、大腸桿菌克隆表達菌株DH5α感受態細胞、Luria-Bertani培養基、質粒DNA提取試劑盒、脂質體Lipofectamine2000(北京鼎國昌盛生物技術有限責任公司),Trizol試劑(美國Invitrogen公司),cDNA逆轉錄試劑盒、實時PCR試劑盒(日本TakaRa公司),293T細胞株、大鼠RGC(北京協和細胞中心),Dulbecco改良Eagle培養基(DMEM)、胎牛血清(美國Gbico公司),青鏈霉素、胰蛋白酶(德國Greiner公司),聚凝胺轉染試劑(美國Sigma公司),限制性內切酶和T4 DNA連接酶(美國NEB公司),鼠抗Sirt1抗體、鼠抗磷酸甘油醛脫氫酶(GAPDH)抗體、羊抗鼠IgG抗體(美國SantaCruz公司)。
1.2 Sirt1 RNA干擾慢病毒表達載體的構建與鑒定
根據基因庫中Sirt1 mRNA(序列號XM_006256146.2)的基因序列,按照RNA干擾序列設計原則,設計4條靶向Sirt1基因的特異性寡核苷酸序列(表1)。根據4條序列分別設計合成siRNA的單鏈DNA序列,序列末端加入BamHⅠ和EcoRⅠ酶切位點。合成后成對的引物干粉溶解于退火緩沖液中,90 ℃水浴15 min,自然冷卻至室溫。
取慢病毒表達載體pGLV3/H1/GFP+Puro 5 μg,用BamHⅠ和EcoRⅠ進行雙酶切反應。經37 ℃水浴作用4 h后,取出酶切產物進行1.5%瓊脂糖凝膠電泳,切取并回收目的片斷。取2 μl雙酶切后線性化的載體片段,加入退火反應產物8 μl,10×T4 DNA連接反應液2 μl,T4連接酶1 μl,滅菌水7 μl配置成20 μl連接反應體系,16 ℃連接過夜。將10 μl連接反應產物加入到100 μl感受態細胞中,輕彈管壁數下混勻,在冰上放置 30 min。42 ℃熱激90 s,冰水浴孵育2 min。加入500 μl Luria-Bertani培養基,置于37 ℃搖床振蕩培養1 h。取適量菌液均勻涂布在含有相應抗生素的平板上,在恒溫培養箱中倒置培養12~16 h,進行藍白斑篩選;挑取白斑進行菌落PCR鑒定,陽性克隆送DNA測序。
1.3 慢病毒包裝、滴度測定及感染RGC
將對數生長期的293T細胞以6×106個/ml的細胞密度接種于15 cm細胞培養皿,37 ℃、5%CO2培養箱內培養24 h,待細胞密度達70%~80%時用于轉染。分別將帶目的基因Sirt1的慢病毒表達質粒si-Sirt-1、si-Sirt-2、si-Sirt-3、si-Sirt-4和包裝質粒Gag/Pol、Rev、VSV-G按3:1:1:1混勻,與Lipofectamine2000制成轉染復合物后轉染293T細胞,培養8 h后換完全培養液。轉染48 h后收集293T細胞上清液,0.45 μm過濾器過濾濃縮病毒液,分裝后?80℃長期保存。熒光顯微鏡觀察綠色熒光蛋白(GFP)的表達情況。
將對數生長期的293T細胞以5×102個/μl的細胞密度接種于96孔板中,37 ℃、5%CO2培養箱內培養24 h,待細胞密度達70%~80%時用于病毒感染。采用逐孔梯度稀釋法進行病毒滴度測定。將稀釋好的病毒液依次加入細胞孔中,37 ℃、5%CO2培養箱中培養48 h后,每孔加入新鮮培養液100 μl。4 d后,觀察熒光表達情況,計算病毒滴度。病毒滴度(TU/ml)=熒光細胞數/對應稀釋倍數。
將RGC按6×104個/ml的細胞密度接種于6孔板中,分為空白對照組、轉染陰性對照病毒載體組(NC組)以及分別轉染4個帶有干擾序列的si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組,每組3個復孔。待細胞貼壁后更換新的不含雙抗、含5%胎牛血清的細胞培養液2 ml,同時加入濃度為5 μg/ml的聚凝胺2 μl。倒置熒光顯微鏡熒光視野和明視野下,觀察GFP的表達,并計算感染復數(MOI)值為10時的感染效率。根據RGC的MOI值和病毒滴度向NC組、si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組加入相應病毒液,空白對照組中不加病毒液,輕輕混勻,放入37 ℃、5%CO2培養箱培養過夜后,更換新鮮的完全培養液繼續培養48 h,收集細胞進行后續檢測。
1.4 Sirt1 mRNA、蛋白表達檢測
采用熒光定量PCR檢測RGC中Sirt1 mRNA相對表達量。收集病毒感染后的RGC,Trizol法提取細胞總RNA,逆轉錄cDNA。設計引物序列。Sirt1:上游引物5′-CCGGACAGCTTCAATAGTG-3′,下游引物5′-CCTGTGGCAGTAACAGTGAC-3′,擴增片段長度249堿基對(bp);內參照GAPDH:上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物5′-TTTGAGGGTGCAGCGAACTT-3′,擴增片段長度252 bp。PCR反應條件:94℃預變性2 min,94℃變性30 s,56℃退火30 s,72℃延伸30 s,72℃延伸10 min。重復35個循環。循環結束后讀取各樣本的循環閾值(Ct值)。采用2?△△Ct方法計算Sirt1和GAPDH的mRNA相對表達量。
采用蛋白免疫印跡法(Western blot)檢測RGC中Sirt1蛋白相對表達量。收集病毒感染后的各組RGC,裂解蛋白,二喹啉甲酸進行蛋白定量。每個樣品抽取20 μg進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,半干法轉膜、封閉后加鼠抗Sirt1抗體(1:500)、鼠抗GAPDH抗體(1:2000)一抗,4℃過夜孵育,洗膜后用羊抗鼠IgG抗體在室溫下雜交1 h,洗膜,增強化學發光,膠片曝光,顯影定影。
1.5 統計學方法
采用SPSS18.0統計軟件進行統計學分析,計量資料以均數±標準差(
 )表示。多樣本均數比較采用單因素方差分析。兩組間比較采用 t 檢驗。P<0.05為差異有統計學意義。
)表示。多樣本均數比較采用單因素方差分析。兩組間比較采用 t 檢驗。P<0.05為差異有統計學意義。
2 結果
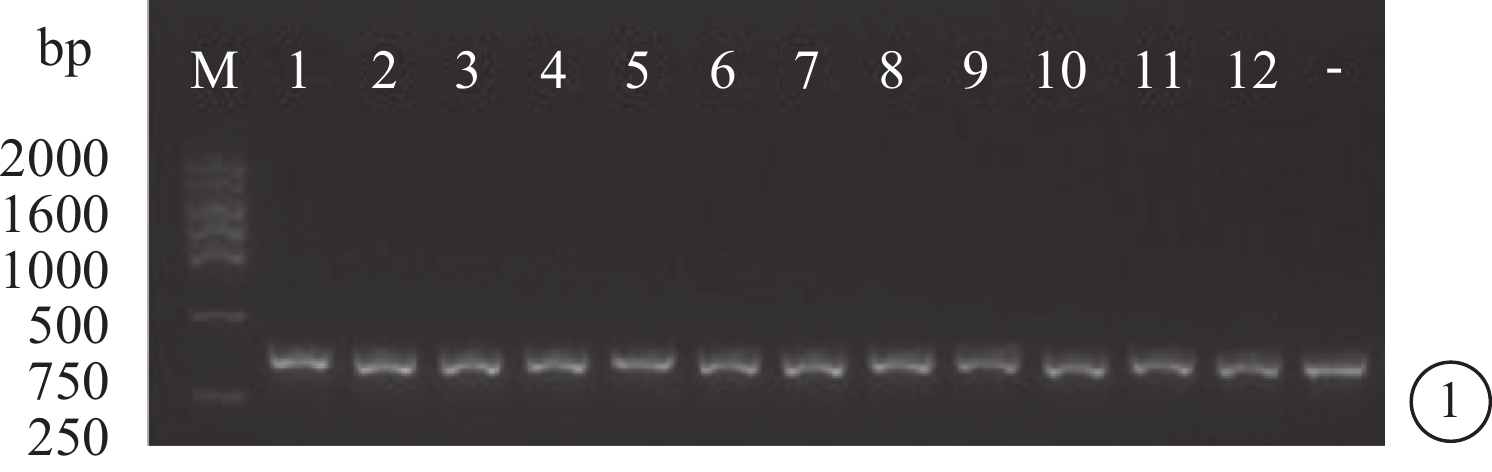
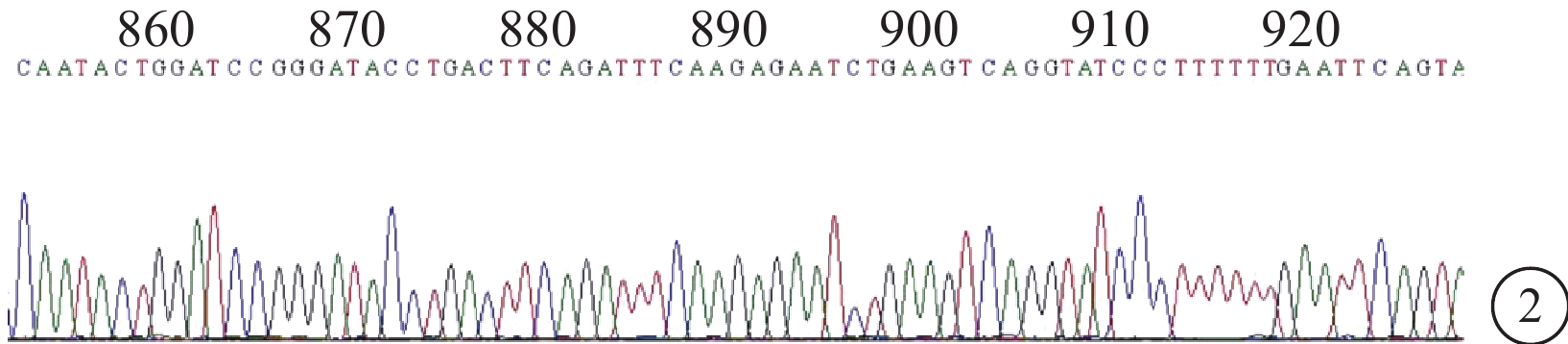
菌落PCR鑒定和DNA測序結果顯示,靶向Sirt1基因的siRNA慢病毒重組質粒構建正確(圖1,2)。
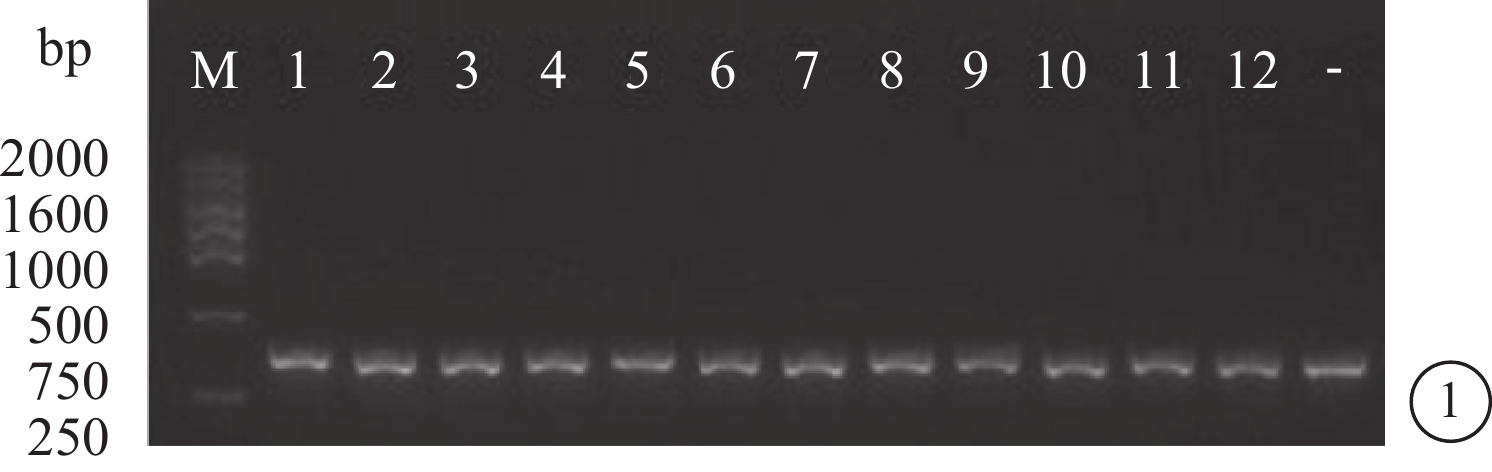 圖1
菌落PCR鑒定圖。M為DNA標記物;1、5、8、9、11為陽性克隆(400 bp);2、3、4、6、7、10、12為陰性克隆(340 bp);-為未插入Sirt1序列的陰性對照(340 bp)
圖1
菌落PCR鑒定圖。M為DNA標記物;1、5、8、9、11為陽性克隆(400 bp);2、3、4、6、7、10、12為陰性克隆(340 bp);-為未插入Sirt1序列的陰性對照(340 bp)
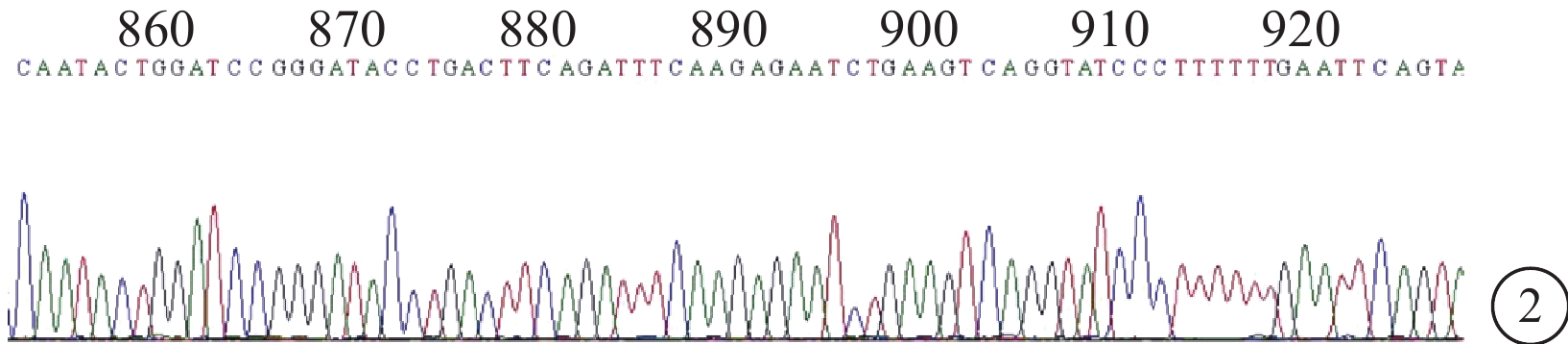 圖2
si-Sirt1-2 DNA測序結果。860~920區為目的序列
圖2
si-Sirt1-2 DNA測序結果。860~920區為目的序列
熒光顯微鏡觀察發現,細胞轉染48 h后,各組RGC均可見GFP表達(圖3)。病毒滴度測定結果顯示,病毒侵染72 h后,慢病毒pGLV3-Sirt1濃縮后的病毒滴度約為8×108 TU/ml,空載體慢病毒濃縮后的病毒滴度為4×108 TU/ml。熒光倒置顯微鏡熒光視野和明視野對比觀察發現,RGC的MOI為10時,其感染效率約90%。在終濃度為5μg/ml凝聚胺條件下,細胞感染及生長狀態良好,GFP可持續穩定表達(圖4)。
 圖3
慢病毒包裝293T細胞后熒光顯微鏡像。3A. NC組;3B. si-Sirt1-1組;3C. si-Sirt1-2組;3D. si-Sirt1-3組;3E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
圖3
慢病毒包裝293T細胞后熒光顯微鏡像。3A. NC組;3B. si-Sirt1-1組;3C. si-Sirt1-2組;3D. si-Sirt1-3組;3E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
 圖4
慢病毒感染RGC熒光倒置顯微鏡像。4A. NC組;4B. si-Sirt1-1組;4C. si-Sirt1-2組;4D. si-Sirt1-3組;4E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
圖4
慢病毒感染RGC熒光倒置顯微鏡像。4A. NC組;4B. si-Sirt1-1組;4C. si-Sirt1-2組;4D. si-Sirt1-3組;4E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
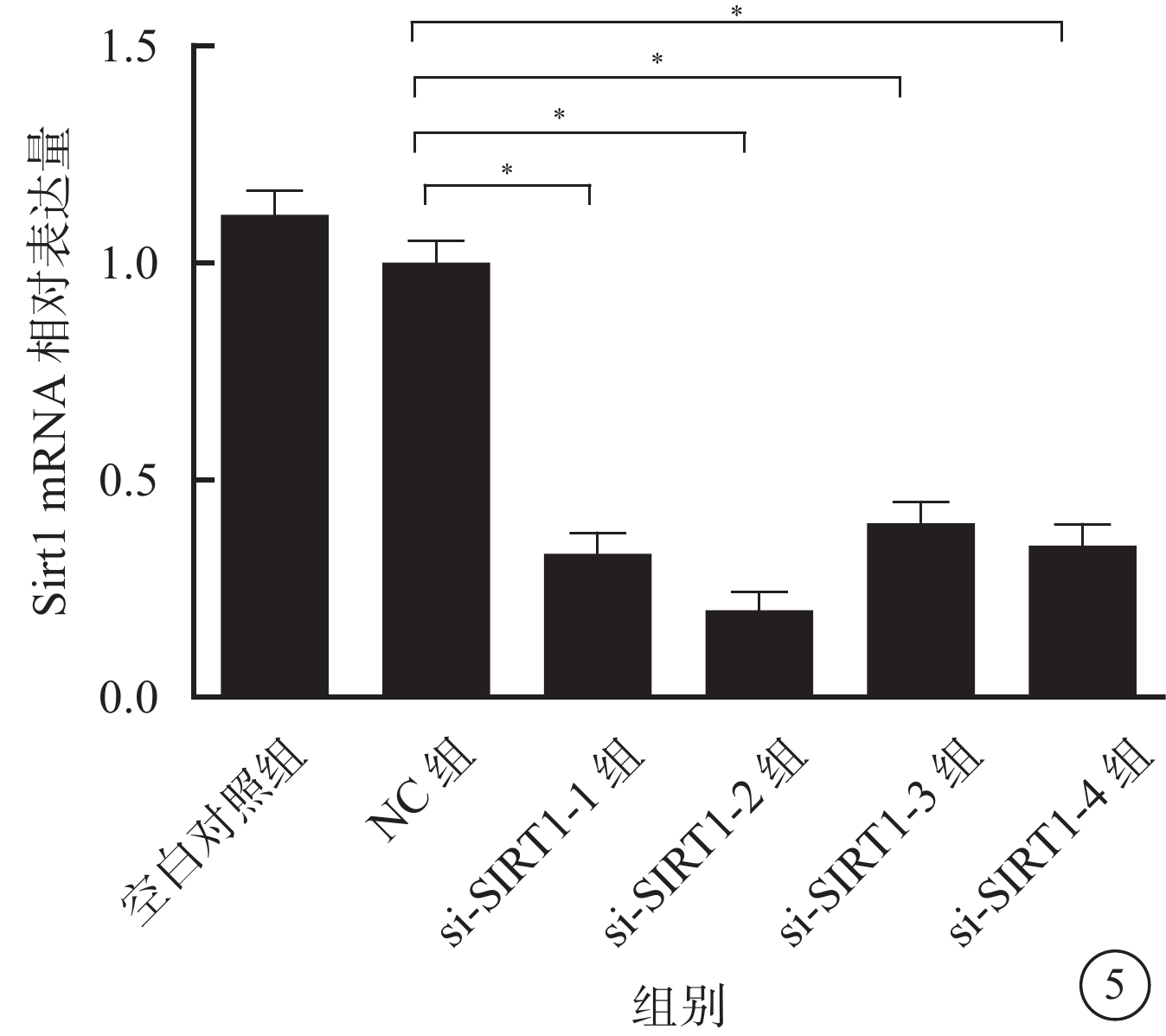
熒光定量PCR檢測結果顯示,與NC組比較,si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組RGC中Sirt1 mRNA相對表達量均明顯下降,其平均下降幅度約為67.8%,差異有統計學意義(F=27.682,P=0.000)。其中,si-Sirt1-2組下降幅度最大,為78.6%(圖5)。
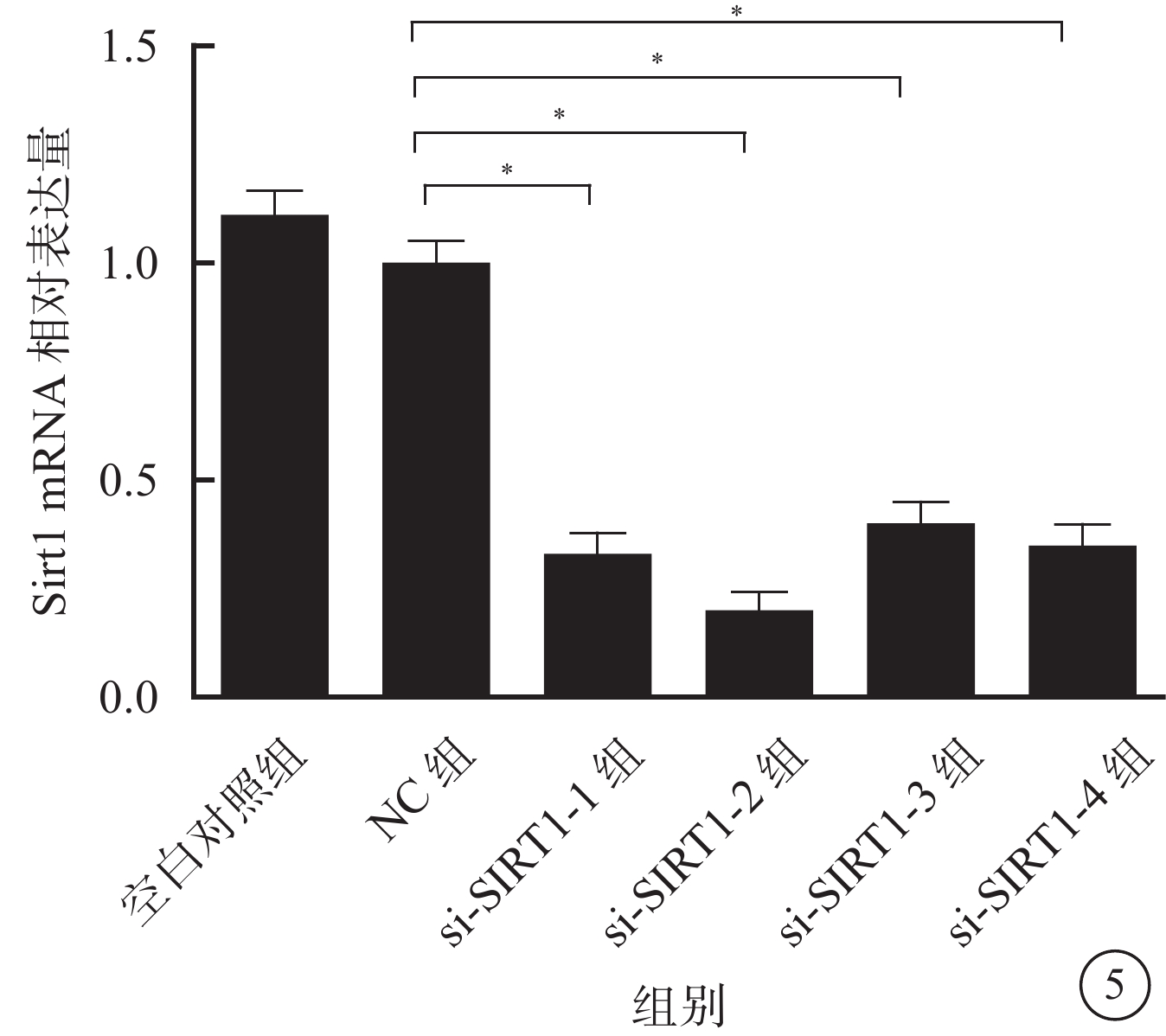 圖5
各組RGC中Sirt1 mRNA相對表達量比較。*與NC組比較,P<0.01
圖5
各組RGC中Sirt1 mRNA相對表達量比較。*與NC組比較,P<0.01
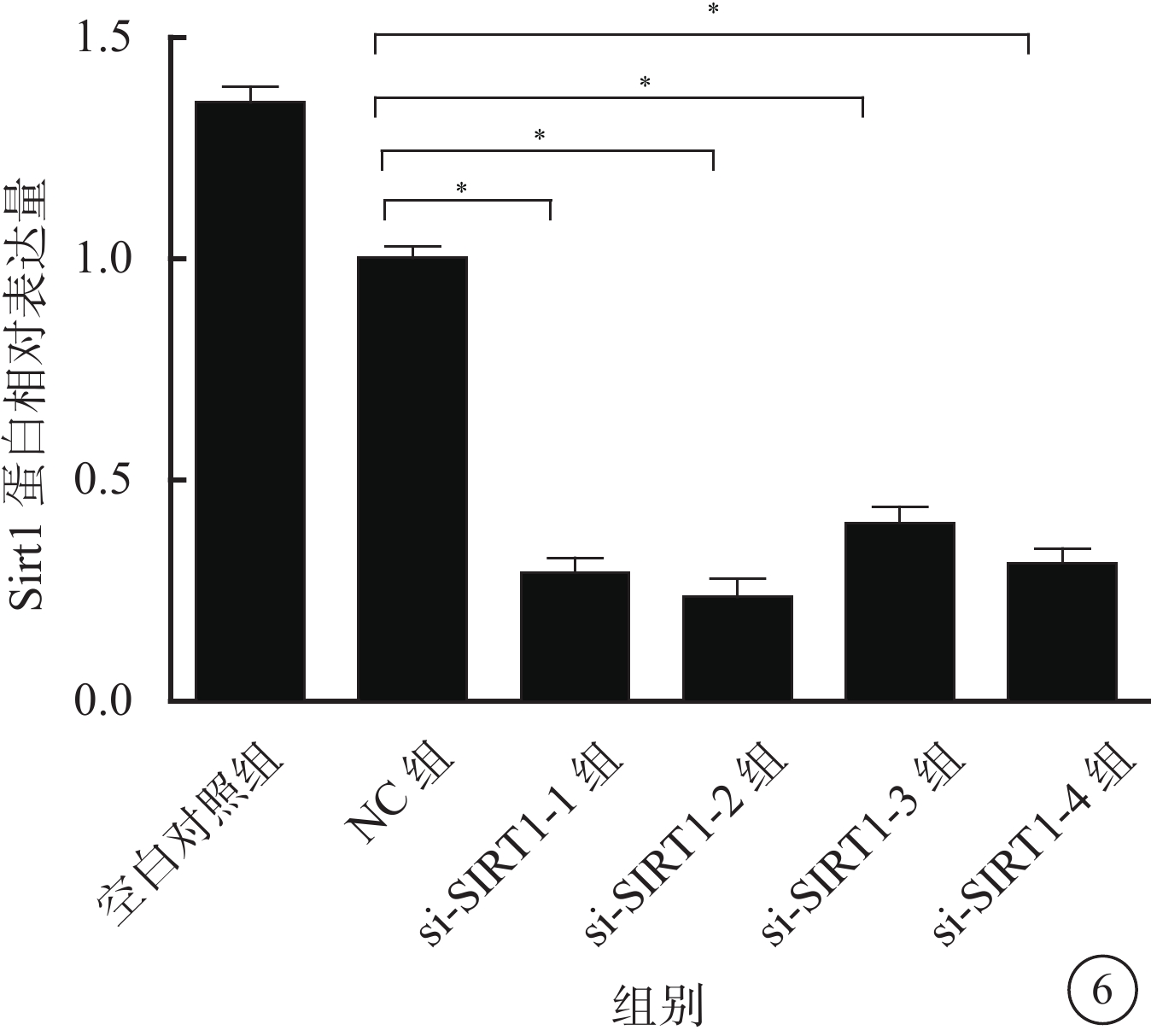
Western blot檢測結果顯示,與NC組比較,si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組RGC中Sirt1蛋白相對表達量均下降,其平均下降幅度為68.3%,差異有統計學意義(F=1 185.206,P=0.000)。其中,si-Sirt1-2組下降幅度最大,為75.6%(圖6)。
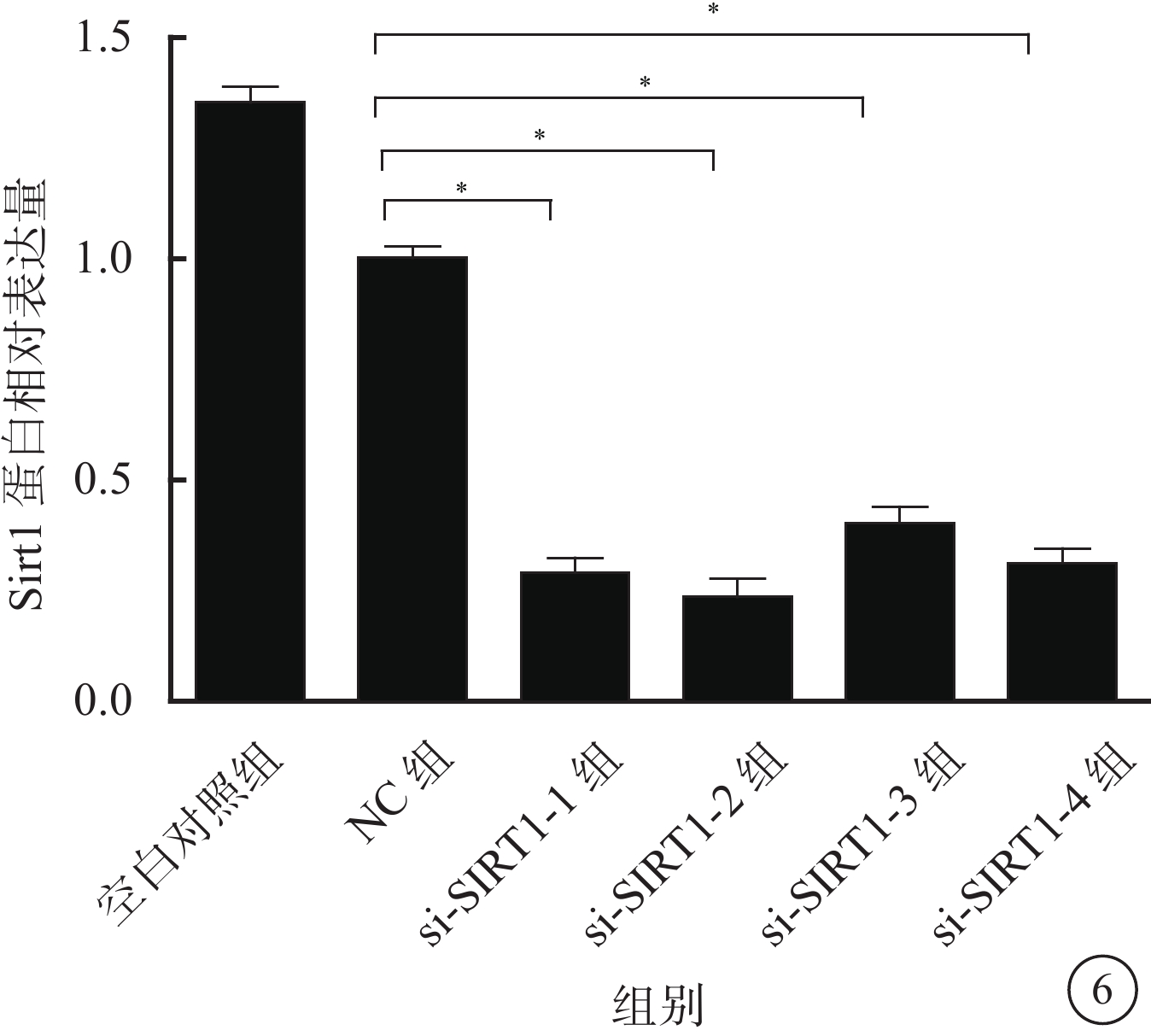 圖6
各組RGC中Sirt1蛋白相對表達量比較。*與NC組比較,P<0.01
圖6
各組RGC中Sirt1蛋白相對表達量比較。*與NC組比較,P<0.01
3 討論
siRNA是長度約21~23個核苷酸的小分子雙鏈RNA,進入細胞后可以作為雙鏈RNA的類似物,從而被納入RNA誘導的沉默復合體(RISC),觸發RISC特異性降解與siRNA同源的mRNA[5]。慢病毒載體是以人類免疫缺陷病毒Ⅰ型為基礎發展來的第三代基因治療載體。該載體可以將外源基因有效地整合到宿主染色體上,從而達到持久性表達。慢病毒載體對分裂細胞和非分裂細胞均具有感染能力,可有效地感染神經元細胞、肝細胞、心肌細胞、腫瘤細胞、內皮細胞、干細胞等多種類型的細胞。采用慢病毒作為RNA干擾的表達載體,可在體內長期穩定的表達;因其具有免疫反應性小、安全性高等優點,已被視為一個治療人類疾病的潛在治療策略[6]。
雖然已有學者應用RNA干擾技術對Sirt1基因進行研究,但這些研究主要集中在急性或慢性髓性白血病細胞、前列腺癌細胞、胰腺癌細胞、肝癌細胞等人類腫瘤細胞中[7-11]。這些研究通過RNA干擾抑制Sirt1的表達后,發現Sirt1在不同的腫瘤細胞中既可能發揮類似抑癌基因的作用,也可能表現出類似癌基因的作用[7-11]。目前針對siRNA抑制Sirt1基因的表達后,Sirt1在RGC細胞中的表達研究較少。為了能夠深入研究Sirt1基因在RGC細胞中的功能,本研究選擇設計了4個靶向Sirt1基因不同起始位點的RNA干擾序列,將目的基因插入慢病毒質粒pGLV3/H1/GFP+Puro中,再將pGLV3和pGag/Pol、pRev、pVSV-G共轉染到293T細胞中,得到高滴度且具有一次侵染性的帶目的基因的慢病毒粒子。將si-Sirt1重組慢病毒粒子感染RGC后,通過定量PCR、Western blot驗證4個不同干擾序列的沉默效果。結果顯示,與NC組比較,4個si-Sirt1慢病毒載體均對Sirt1 mRNA和蛋白表達水平有顯著的抑制作用。表明4個靶點均為有效靶點。已有研究表明,應用pGLV3/H1/GFP + Puro載體構建的siRNA重組質粒,具有干擾高效、特異性強、效果穩定、能夠篩選穩定轉染細胞等特點;而且4個質粒的慢病毒系統,比3個質粒的慢病毒系統更安全[12, 13]。本研究結果也體現出了LV3慢病毒載體在RNA干擾中的應用優勢,為后續建立持續干擾Sirt1基因的穩定轉染細胞株、研究Sirt1基因對RGC細胞生長、增生、凋亡等生物學功能及動物實驗提供了實驗基礎。但值得注意的是,本研究構建的靶向Sirt1基因的4個干擾序列雖對Sirt1基因表達均有抑制作用,但部分序列的抑制效率較低,這有待于今后優化實驗條件,提高干擾效率。
沉默信息調節因子1(Sirt1)是一種煙堿腺嘌呤二核苷酸(NAD+)依賴性組蛋白去乙酰化酶,能夠將蛋白質的乙酰基轉移到NAD+而發揮去乙酰化的作用,參與能量平衡、細胞自噬、DNA損傷修復、神經退行性病變、糖尿病、心臟病、炎癥以及腫瘤發生等眾多生理和病理過程[1]。在視網膜中,Sirt1可分布于視網膜神經節細胞(RGC)、光感受器細胞和視網膜色素上皮細胞[2]。已有研究發現,缺血、視神經損傷等原因造成RGC細胞損傷后,Sirt1的表達水平降低;而使用檸檬酸苷、白藜蘆醇干預后,Sirt1的表達水平升高,有利于RGC細胞損傷的恢復。說明Sirt1對RGC有保護作用,但其發揮保護作用的機制尚不明確[3, 4]。本研究構建了靶向大鼠Sirt1小干擾(si)RNA慢病毒載體,觀察其轉染大鼠RGC細胞后對RGC細胞中Sirt1表達的影響,以期為進一步研究Sirt1基因對RGC細胞生物學功能的影響及動物實驗奠定實驗基礎。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
慢病毒表達載體pGLV3/H1/GFP-Puro、Taq DNA聚合酶、聚合酶鏈反應(PCR)回收試劑盒、大腸桿菌克隆表達菌株DH5α感受態細胞、Luria-Bertani培養基、質粒DNA提取試劑盒、脂質體Lipofectamine2000(北京鼎國昌盛生物技術有限責任公司),Trizol試劑(美國Invitrogen公司),cDNA逆轉錄試劑盒、實時PCR試劑盒(日本TakaRa公司),293T細胞株、大鼠RGC(北京協和細胞中心),Dulbecco改良Eagle培養基(DMEM)、胎牛血清(美國Gbico公司),青鏈霉素、胰蛋白酶(德國Greiner公司),聚凝胺轉染試劑(美國Sigma公司),限制性內切酶和T4 DNA連接酶(美國NEB公司),鼠抗Sirt1抗體、鼠抗磷酸甘油醛脫氫酶(GAPDH)抗體、羊抗鼠IgG抗體(美國SantaCruz公司)。
1.2 Sirt1 RNA干擾慢病毒表達載體的構建與鑒定
根據基因庫中Sirt1 mRNA(序列號XM_006256146.2)的基因序列,按照RNA干擾序列設計原則,設計4條靶向Sirt1基因的特異性寡核苷酸序列(表1)。根據4條序列分別設計合成siRNA的單鏈DNA序列,序列末端加入BamHⅠ和EcoRⅠ酶切位點。合成后成對的引物干粉溶解于退火緩沖液中,90 ℃水浴15 min,自然冷卻至室溫。
取慢病毒表達載體pGLV3/H1/GFP+Puro 5 μg,用BamHⅠ和EcoRⅠ進行雙酶切反應。經37 ℃水浴作用4 h后,取出酶切產物進行1.5%瓊脂糖凝膠電泳,切取并回收目的片斷。取2 μl雙酶切后線性化的載體片段,加入退火反應產物8 μl,10×T4 DNA連接反應液2 μl,T4連接酶1 μl,滅菌水7 μl配置成20 μl連接反應體系,16 ℃連接過夜。將10 μl連接反應產物加入到100 μl感受態細胞中,輕彈管壁數下混勻,在冰上放置 30 min。42 ℃熱激90 s,冰水浴孵育2 min。加入500 μl Luria-Bertani培養基,置于37 ℃搖床振蕩培養1 h。取適量菌液均勻涂布在含有相應抗生素的平板上,在恒溫培養箱中倒置培養12~16 h,進行藍白斑篩選;挑取白斑進行菌落PCR鑒定,陽性克隆送DNA測序。
1.3 慢病毒包裝、滴度測定及感染RGC
將對數生長期的293T細胞以6×106個/ml的細胞密度接種于15 cm細胞培養皿,37 ℃、5%CO2培養箱內培養24 h,待細胞密度達70%~80%時用于轉染。分別將帶目的基因Sirt1的慢病毒表達質粒si-Sirt-1、si-Sirt-2、si-Sirt-3、si-Sirt-4和包裝質粒Gag/Pol、Rev、VSV-G按3:1:1:1混勻,與Lipofectamine2000制成轉染復合物后轉染293T細胞,培養8 h后換完全培養液。轉染48 h后收集293T細胞上清液,0.45 μm過濾器過濾濃縮病毒液,分裝后?80℃長期保存。熒光顯微鏡觀察綠色熒光蛋白(GFP)的表達情況。
將對數生長期的293T細胞以5×102個/μl的細胞密度接種于96孔板中,37 ℃、5%CO2培養箱內培養24 h,待細胞密度達70%~80%時用于病毒感染。采用逐孔梯度稀釋法進行病毒滴度測定。將稀釋好的病毒液依次加入細胞孔中,37 ℃、5%CO2培養箱中培養48 h后,每孔加入新鮮培養液100 μl。4 d后,觀察熒光表達情況,計算病毒滴度。病毒滴度(TU/ml)=熒光細胞數/對應稀釋倍數。
將RGC按6×104個/ml的細胞密度接種于6孔板中,分為空白對照組、轉染陰性對照病毒載體組(NC組)以及分別轉染4個帶有干擾序列的si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組,每組3個復孔。待細胞貼壁后更換新的不含雙抗、含5%胎牛血清的細胞培養液2 ml,同時加入濃度為5 μg/ml的聚凝胺2 μl。倒置熒光顯微鏡熒光視野和明視野下,觀察GFP的表達,并計算感染復數(MOI)值為10時的感染效率。根據RGC的MOI值和病毒滴度向NC組、si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組加入相應病毒液,空白對照組中不加病毒液,輕輕混勻,放入37 ℃、5%CO2培養箱培養過夜后,更換新鮮的完全培養液繼續培養48 h,收集細胞進行后續檢測。
1.4 Sirt1 mRNA、蛋白表達檢測
采用熒光定量PCR檢測RGC中Sirt1 mRNA相對表達量。收集病毒感染后的RGC,Trizol法提取細胞總RNA,逆轉錄cDNA。設計引物序列。Sirt1:上游引物5′-CCGGACAGCTTCAATAGTG-3′,下游引物5′-CCTGTGGCAGTAACAGTGAC-3′,擴增片段長度249堿基對(bp);內參照GAPDH:上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物5′-TTTGAGGGTGCAGCGAACTT-3′,擴增片段長度252 bp。PCR反應條件:94℃預變性2 min,94℃變性30 s,56℃退火30 s,72℃延伸30 s,72℃延伸10 min。重復35個循環。循環結束后讀取各樣本的循環閾值(Ct值)。采用2?△△Ct方法計算Sirt1和GAPDH的mRNA相對表達量。
采用蛋白免疫印跡法(Western blot)檢測RGC中Sirt1蛋白相對表達量。收集病毒感染后的各組RGC,裂解蛋白,二喹啉甲酸進行蛋白定量。每個樣品抽取20 μg進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,半干法轉膜、封閉后加鼠抗Sirt1抗體(1:500)、鼠抗GAPDH抗體(1:2000)一抗,4℃過夜孵育,洗膜后用羊抗鼠IgG抗體在室溫下雜交1 h,洗膜,增強化學發光,膠片曝光,顯影定影。
1.5 統計學方法
采用SPSS18.0統計軟件進行統計學分析,計量資料以均數±標準差(
 )表示。多樣本均數比較采用單因素方差分析。兩組間比較采用 t 檢驗。P<0.05為差異有統計學意義。
)表示。多樣本均數比較采用單因素方差分析。兩組間比較采用 t 檢驗。P<0.05為差異有統計學意義。
2 結果
菌落PCR鑒定和DNA測序結果顯示,靶向Sirt1基因的siRNA慢病毒重組質粒構建正確(圖1,2)。
 圖1
菌落PCR鑒定圖。M為DNA標記物;1、5、8、9、11為陽性克隆(400 bp);2、3、4、6、7、10、12為陰性克隆(340 bp);-為未插入Sirt1序列的陰性對照(340 bp)
圖1
菌落PCR鑒定圖。M為DNA標記物;1、5、8、9、11為陽性克隆(400 bp);2、3、4、6、7、10、12為陰性克隆(340 bp);-為未插入Sirt1序列的陰性對照(340 bp)
 圖2
si-Sirt1-2 DNA測序結果。860~920區為目的序列
圖2
si-Sirt1-2 DNA測序結果。860~920區為目的序列
熒光顯微鏡觀察發現,細胞轉染48 h后,各組RGC均可見GFP表達(圖3)。病毒滴度測定結果顯示,病毒侵染72 h后,慢病毒pGLV3-Sirt1濃縮后的病毒滴度約為8×108 TU/ml,空載體慢病毒濃縮后的病毒滴度為4×108 TU/ml。熒光倒置顯微鏡熒光視野和明視野對比觀察發現,RGC的MOI為10時,其感染效率約90%。在終濃度為5μg/ml凝聚胺條件下,細胞感染及生長狀態良好,GFP可持續穩定表達(圖4)。
 圖3
慢病毒包裝293T細胞后熒光顯微鏡像。3A. NC組;3B. si-Sirt1-1組;3C. si-Sirt1-2組;3D. si-Sirt1-3組;3E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
圖3
慢病毒包裝293T細胞后熒光顯微鏡像。3A. NC組;3B. si-Sirt1-1組;3C. si-Sirt1-2組;3D. si-Sirt1-3組;3E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
 圖4
慢病毒感染RGC熒光倒置顯微鏡像。4A. NC組;4B. si-Sirt1-1組;4C. si-Sirt1-2組;4D. si-Sirt1-3組;4E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
圖4
慢病毒感染RGC熒光倒置顯微鏡像。4A. NC組;4B. si-Sirt1-1組;4C. si-Sirt1-2組;4D. si-Sirt1-3組;4E. si-Sirt1-4組。各組RGC中均可見GFP表達 ×200
熒光定量PCR檢測結果顯示,與NC組比較,si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組RGC中Sirt1 mRNA相對表達量均明顯下降,其平均下降幅度約為67.8%,差異有統計學意義(F=27.682,P=0.000)。其中,si-Sirt1-2組下降幅度最大,為78.6%(圖5)。
 圖5
各組RGC中Sirt1 mRNA相對表達量比較。*與NC組比較,P<0.01
圖5
各組RGC中Sirt1 mRNA相對表達量比較。*與NC組比較,P<0.01
Western blot檢測結果顯示,與NC組比較,si-Sirt1-1組、si-Sirt1-2組、si-Sirt1-3組、si-Sirt1-4組RGC中Sirt1蛋白相對表達量均下降,其平均下降幅度為68.3%,差異有統計學意義(F=1 185.206,P=0.000)。其中,si-Sirt1-2組下降幅度最大,為75.6%(圖6)。
 圖6
各組RGC中Sirt1蛋白相對表達量比較。*與NC組比較,P<0.01
圖6
各組RGC中Sirt1蛋白相對表達量比較。*與NC組比較,P<0.01
3 討論
siRNA是長度約21~23個核苷酸的小分子雙鏈RNA,進入細胞后可以作為雙鏈RNA的類似物,從而被納入RNA誘導的沉默復合體(RISC),觸發RISC特異性降解與siRNA同源的mRNA[5]。慢病毒載體是以人類免疫缺陷病毒Ⅰ型為基礎發展來的第三代基因治療載體。該載體可以將外源基因有效地整合到宿主染色體上,從而達到持久性表達。慢病毒載體對分裂細胞和非分裂細胞均具有感染能力,可有效地感染神經元細胞、肝細胞、心肌細胞、腫瘤細胞、內皮細胞、干細胞等多種類型的細胞。采用慢病毒作為RNA干擾的表達載體,可在體內長期穩定的表達;因其具有免疫反應性小、安全性高等優點,已被視為一個治療人類疾病的潛在治療策略[6]。
雖然已有學者應用RNA干擾技術對Sirt1基因進行研究,但這些研究主要集中在急性或慢性髓性白血病細胞、前列腺癌細胞、胰腺癌細胞、肝癌細胞等人類腫瘤細胞中[7-11]。這些研究通過RNA干擾抑制Sirt1的表達后,發現Sirt1在不同的腫瘤細胞中既可能發揮類似抑癌基因的作用,也可能表現出類似癌基因的作用[7-11]。目前針對siRNA抑制Sirt1基因的表達后,Sirt1在RGC細胞中的表達研究較少。為了能夠深入研究Sirt1基因在RGC細胞中的功能,本研究選擇設計了4個靶向Sirt1基因不同起始位點的RNA干擾序列,將目的基因插入慢病毒質粒pGLV3/H1/GFP+Puro中,再將pGLV3和pGag/Pol、pRev、pVSV-G共轉染到293T細胞中,得到高滴度且具有一次侵染性的帶目的基因的慢病毒粒子。將si-Sirt1重組慢病毒粒子感染RGC后,通過定量PCR、Western blot驗證4個不同干擾序列的沉默效果。結果顯示,與NC組比較,4個si-Sirt1慢病毒載體均對Sirt1 mRNA和蛋白表達水平有顯著的抑制作用。表明4個靶點均為有效靶點。已有研究表明,應用pGLV3/H1/GFP + Puro載體構建的siRNA重組質粒,具有干擾高效、特異性強、效果穩定、能夠篩選穩定轉染細胞等特點;而且4個質粒的慢病毒系統,比3個質粒的慢病毒系統更安全[12, 13]。本研究結果也體現出了LV3慢病毒載體在RNA干擾中的應用優勢,為后續建立持續干擾Sirt1基因的穩定轉染細胞株、研究Sirt1基因對RGC細胞生長、增生、凋亡等生物學功能及動物實驗提供了實驗基礎。但值得注意的是,本研究構建的靶向Sirt1基因的4個干擾序列雖對Sirt1基因表達均有抑制作用,但部分序列的抑制效率較低,這有待于今后優化實驗條件,提高干擾效率。