引用本文: 馬映雪, 陳松, 何廣輝, 楊婧, 陳莉, 姜鑒洪, 宋建. 藍光誘導人視網膜色素上皮細胞分泌外泌體與核苷酸結合寡聚化結構樣受體蛋白炎性體的相關性研究. 中華眼底病雜志, 2017, 33(5): 498-502. doi: 10.3760/cma.j.issn.1005-1015.2017.05.014 復制
老年性黃斑變性(AMD)病理損害累及視網膜色素上皮(RPE)細胞和Bruch膜,引起光感受器變性;多種免疫活化和調節異常均參與了AMD發病,其中炎性體是近年研究熱點。Tseng等[1]發現AMD患眼RPE細胞炎性體激活,RPE細胞中核苷酸結合寡聚化結構樣受體蛋白(NLRP3)、白細胞介素(IL)-18和激活的半胱氨酸天冬氨酸蛋白酶(caspase)水平上調。外泌體(exosomes)是一種活細胞分泌的直徑在50~200 nm之間的具有脂質雙分子層結構的小囊泡,囊泡內含有的蛋白組成與其分泌的細胞具有相關性[2]。研究結果表明,外泌體可攜帶核酸、蛋白質等生物活性小分子進行細胞間的信號傳遞;具有免疫活化和抑制功能,參與維持機體的免疫平衡[3, 4]。本研究通過藍光誘導建立人RPE細胞光損傷模型模仿AMD損傷的RPE,觀察光氧化損傷RPE細胞分泌的外泌體與NLRP3炎性體的相關性,旨為AMD發病機制的研究提供新思路。現將結果報道如下。
1 材料和方法
?
取對數生長期人RPE細胞株(ARPE-19)貼壁細胞分為實驗組和對照組。實驗組細胞采用4個波長為(448.0±24.0)nm的藍光發光二極管燈,距離細胞35 cm連續照射6 h;對照組細胞常規培養。光學顯微鏡觀察細胞形態;噻唑藍(MTT)檢測兩組細胞增生活力,以對照組細胞增生率為1。12 h后收集培養液,分級低溫超速離心獲取外泌體。將培養液放入普通離心管,4 ℃條件下300×g離心10 min,去沉淀后2000×g離心20 min,去沉淀后再次10 000×g離心30 min,去沉淀后將得到的濃縮液移至Beckman離心管中,4 ℃條件下100 000×g離心70 min,收集沉淀用磷酸鹽緩沖液(PBS)稀釋后,再次100 000×g離心70 min,得到的外泌體濃縮液以20 μl PBS重懸,?80 ℃冷藏備用。
將外泌體樣本1∶10稀釋,銅網蘸取少量稀釋后樣品,將銅網放入3%磷鎢酸溶液中染色5 min加深背景,透射電子顯微鏡80 kV下觀察并拍攝相片。
蛋白免疫印跡法(Western blot)檢測外泌體表面特異性標志蛋白CD63和NLRP3炎性體相關細胞因子IL-1β、IL-18和caspase-1蛋白水平表達。外泌體懸液100 μl加20 μl苯甲基磺酰氟裂解液,二喹啉甲酸蛋白定量,加樣前煮沸變性5 min;加樣后聚丙烯酰胺凝膠電泳,轉移至聚偏二氟乙烯膜上,5%脫脂奶粉封閉1 h,加入1∶1000鼠抗人一抗CD63、IL-1β、IL-18和caspase-1,4 ℃過夜;1倍硬酯酸鉛(PBST)浸洗,加入稀釋至1∶5000的二抗,室溫下搖床1 h,PBST浸洗3次后應用超敏化學發光試劑盒顯色2 min,X光顯影后掃描分析。
?
將濃度為200 μg/ml的實驗組、對照組細胞外泌體分別作用于12孔板中平鋪的正常RPE細胞,據此分為藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組。37 ℃、5%CO2培養24 h,培養期間不更換培養液;24 h后MTT檢測兩組細胞增生活力。以正常細胞外泌體+對照組細胞增生率為1。
Western blot檢測兩組RPE細胞NLRP3炎性體相關細胞因子IL-1β、IL-18、caspase-1蛋白表達。檢測方法同前。免疫熒光法檢測兩組RPE細胞外沁體中IL-1β、IL-18、caspase-1蛋白表達。將外泌體作用后的兩組細胞平鋪在24孔板上,濃度約5×104/ml,4%多聚甲醛固定爬片后加入0.5%Triton-100避光處理 20 min;PBS浸洗3次,加入1 ml 3%的牛血清白蛋白室溫封閉1 h;加足量稀釋一抗(1∶100),濕盒中4 ℃ 過夜;PBST浸洗3次后滴加熒光二抗(1∶100),避光室溫孵育1 h,再次PBST浸洗3次,滴加4’,6-二脒基-2-苯基吲哚(DAPI)染核后PBST浸洗4次,抗熒光淬滅封片劑封片,熒光顯微鏡下觀察并采集圖像。應用Image Pro Plus軟件將細胞熒光亮度轉化為灰度值進行量化分析。
實時定量聚合酶鏈反應(RT-PCR)檢測兩組RPE細胞內NLRP3 mRNA的表達。按照Trizol試劑盒說明書提取細胞總RNA,?80 ℃保存。運用Primer Premier 5.0軟件設計上下游引物。NLRP3:上游引物 5′-GGCATATCACAGTGGGATTC-3′,下游引物5′-GATCTTCGCTGCGATCAAC-3′。甘油醛脫氫酶(GAPDH):上游引物5′-CGAGATCCCTCCAAAATCAA-3′,下游引物:5′-GGTGCTAAGCAGTTGGTGGT-3′。反應條件:94 ℃,30 s;50~60 ℃,30 s;72 ℃,60 s。變性、退火、延伸重復35~40個循環。將得到的各組循環閾值(CT)數據以GAPDH為內參,采用2?△△CT法計算目的基因mRNA相對表達量。
?
采用SPSS18.0統計軟件進行統計學分析處理。數據以均數±標準差(
 )表示。兩組細胞免疫熒光檢測結果行方差齊性檢驗,MTT檢測結果采用配對t檢驗,其余兩組間比較采用兩獨立樣本t檢驗。P<0.05為差異有統計學意義。
)表示。兩組細胞免疫熒光檢測結果行方差齊性檢驗,MTT檢測結果采用配對t檢驗,其余兩組間比較采用兩獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
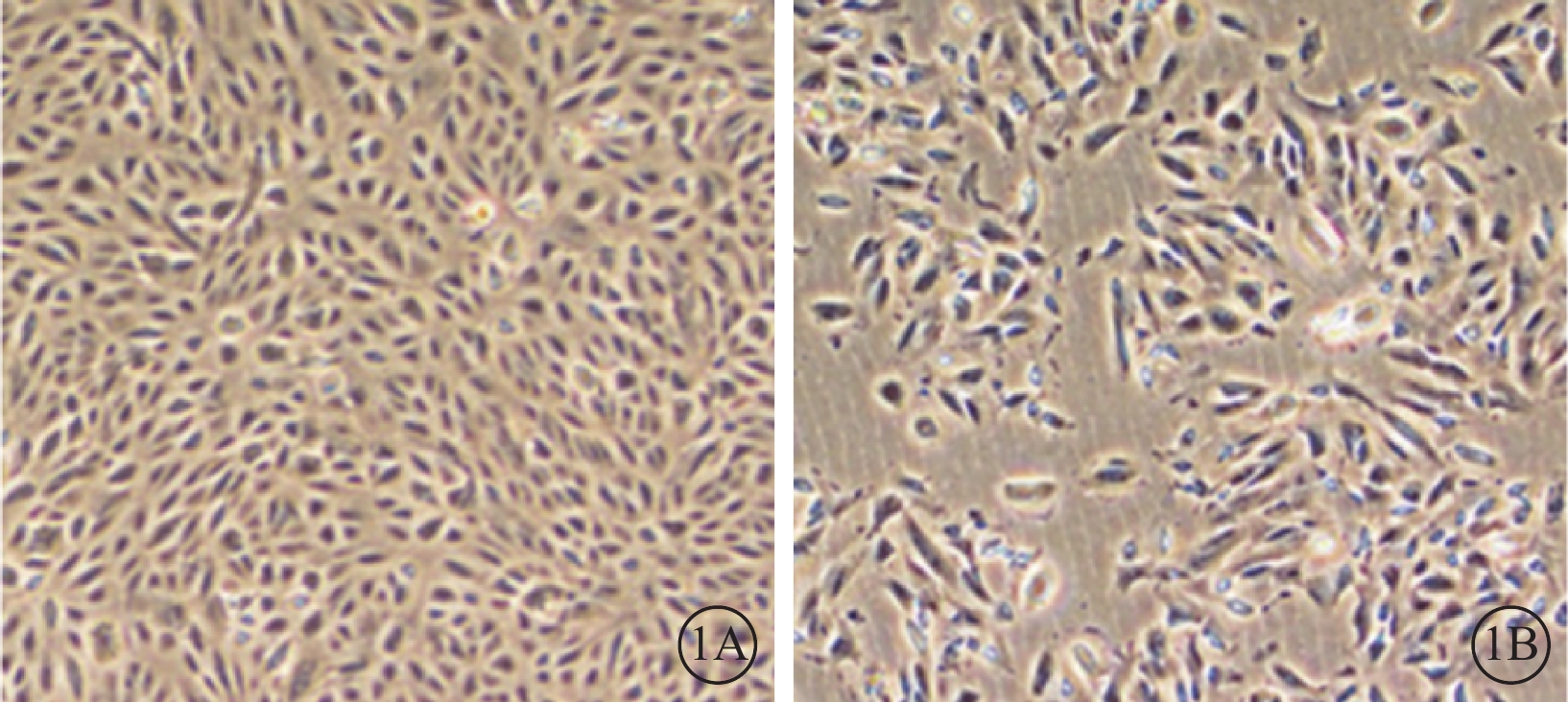
光學顯微鏡觀察發現,對照組細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;實驗組細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態(圖1)。MTT檢測結果顯示,實驗組細胞增生率為66.0%,低于對照組細胞,差異有統計學意義(t=3.92,P<0.050)。
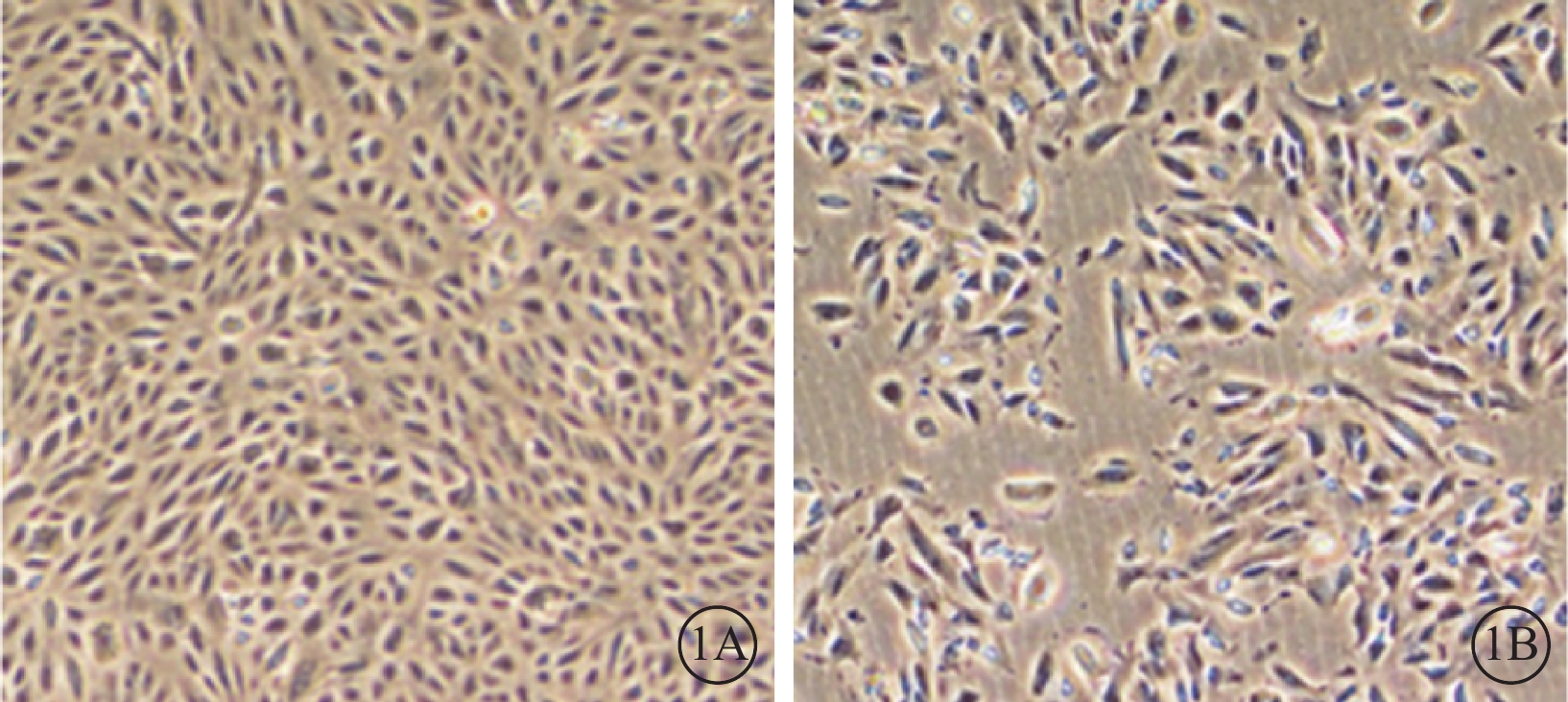 圖1
培養的RPE細胞光學顯微鏡像。1A. 正常組,細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;1B. 實驗組,細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態 ×400
圖1
培養的RPE細胞光學顯微鏡像。1A. 正常組,細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;1B. 實驗組,細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態 ×400
透射電子顯微鏡觀察發現,實驗組、對照組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見(圖2)。
 圖2
外泌體透射電子顯微鏡像。2A. 實驗組;2B. 對照組。兩組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見 磷鎢酸 標尺:2A. 400 nm;2B. 100 nm
圖2
外泌體透射電子顯微鏡像。2A. 實驗組;2B. 對照組。兩組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見 磷鎢酸 標尺:2A. 400 nm;2B. 100 nm
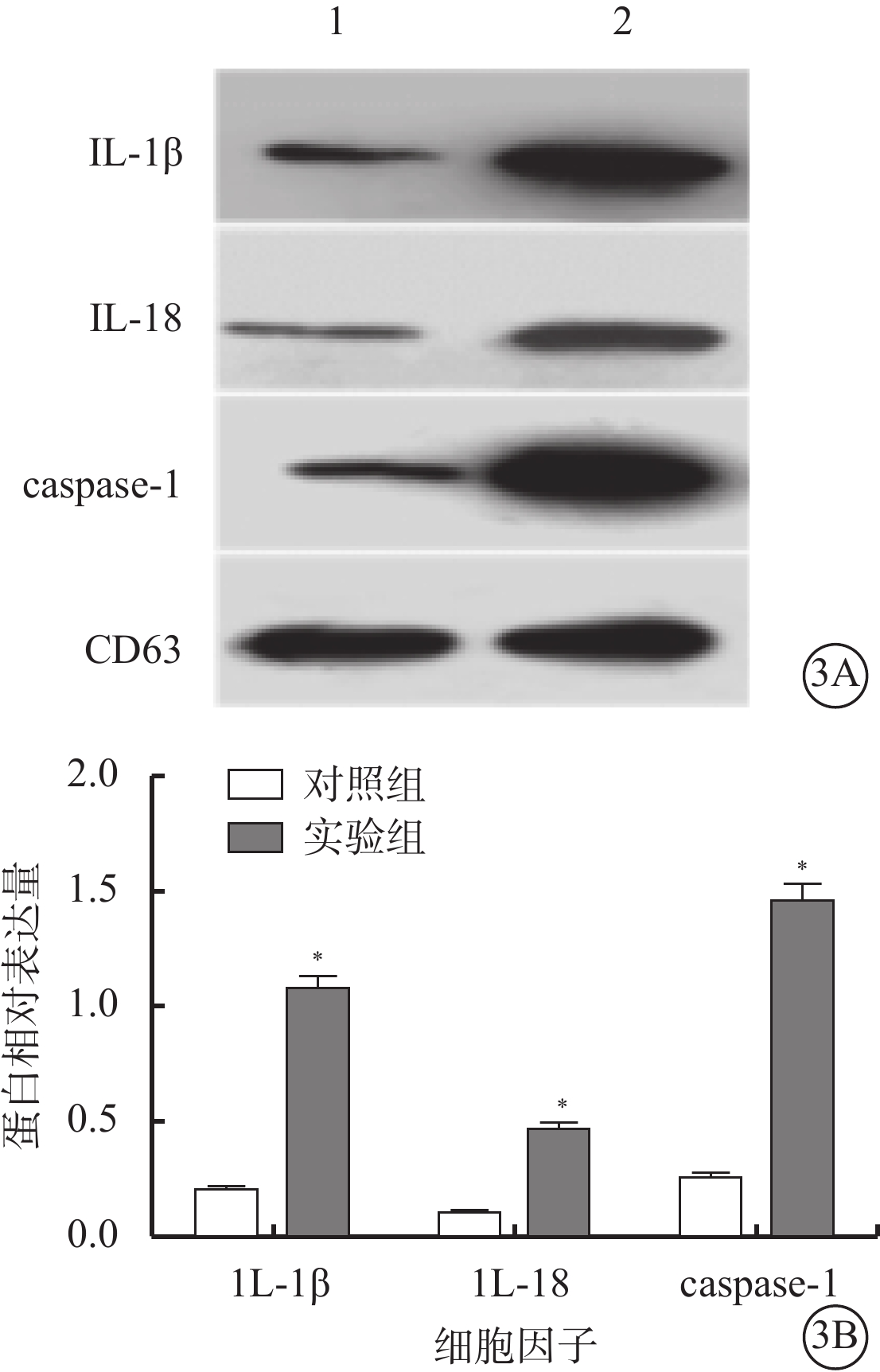
Western blot檢測發現,實驗組、對照組細胞外泌體均表達CD63。兩組細胞外泌體中IL-1β(t=18.04)、IL-18(t=12.55)、caspase-1(t=14.70)蛋白表達量比較,差異均有統計學意義(P<0.001)(圖3)。
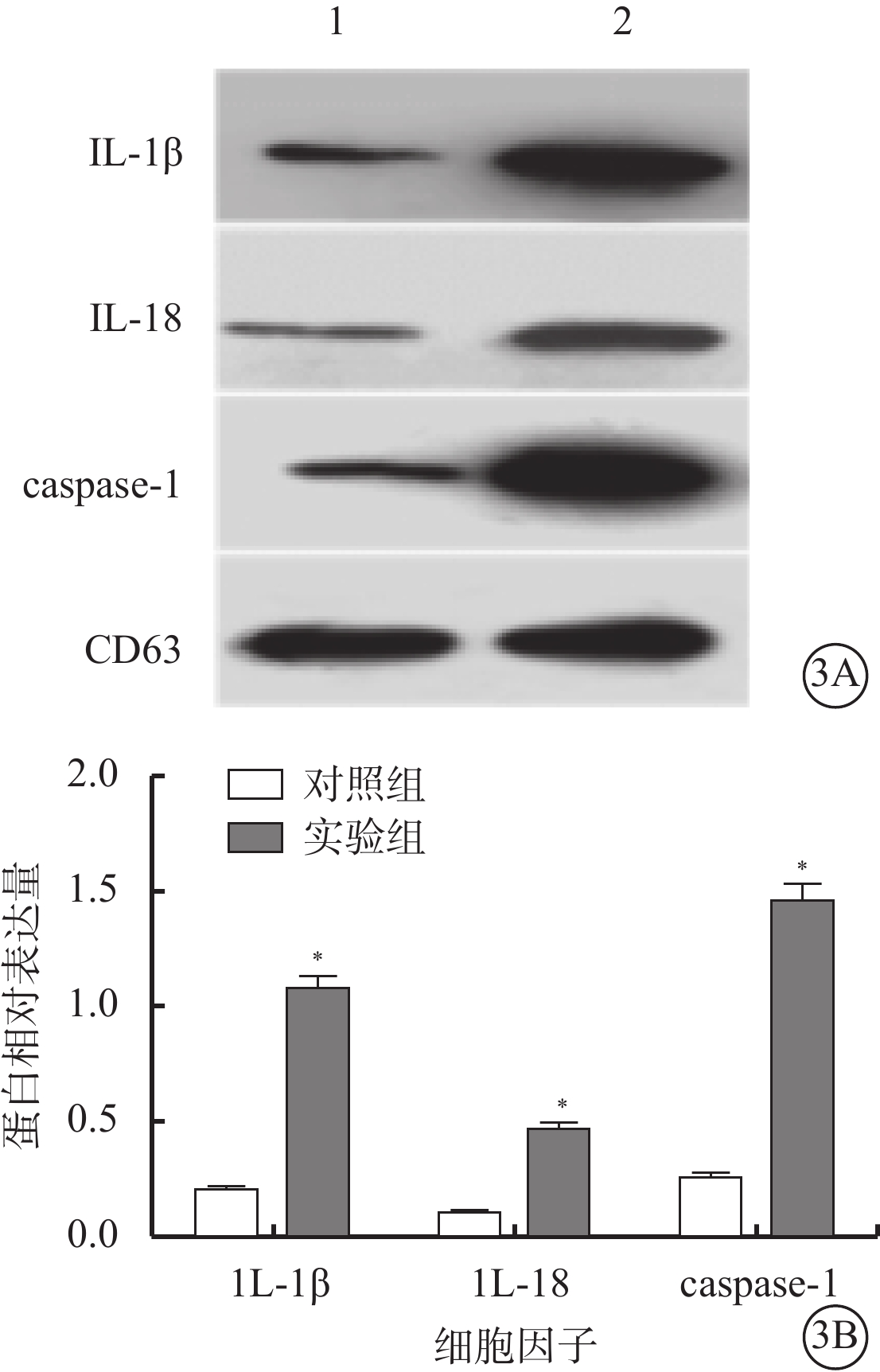 圖3
實驗組、對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。3A. 電泳圖,1、2分別為對照組、實驗組;3B. 統計結果。*與對照組比較,P<0.050
圖3
實驗組、對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。3A. 電泳圖,1、2分別為對照組、實驗組;3B. 統計結果。*與對照組比較,P<0.050
MTT檢測發現,藍光誘導細胞外泌體+實驗組細胞增生率為76.5%,低于正常細胞外泌體+對照組,差異有統計學意義(t=3.49,P<0.050)。
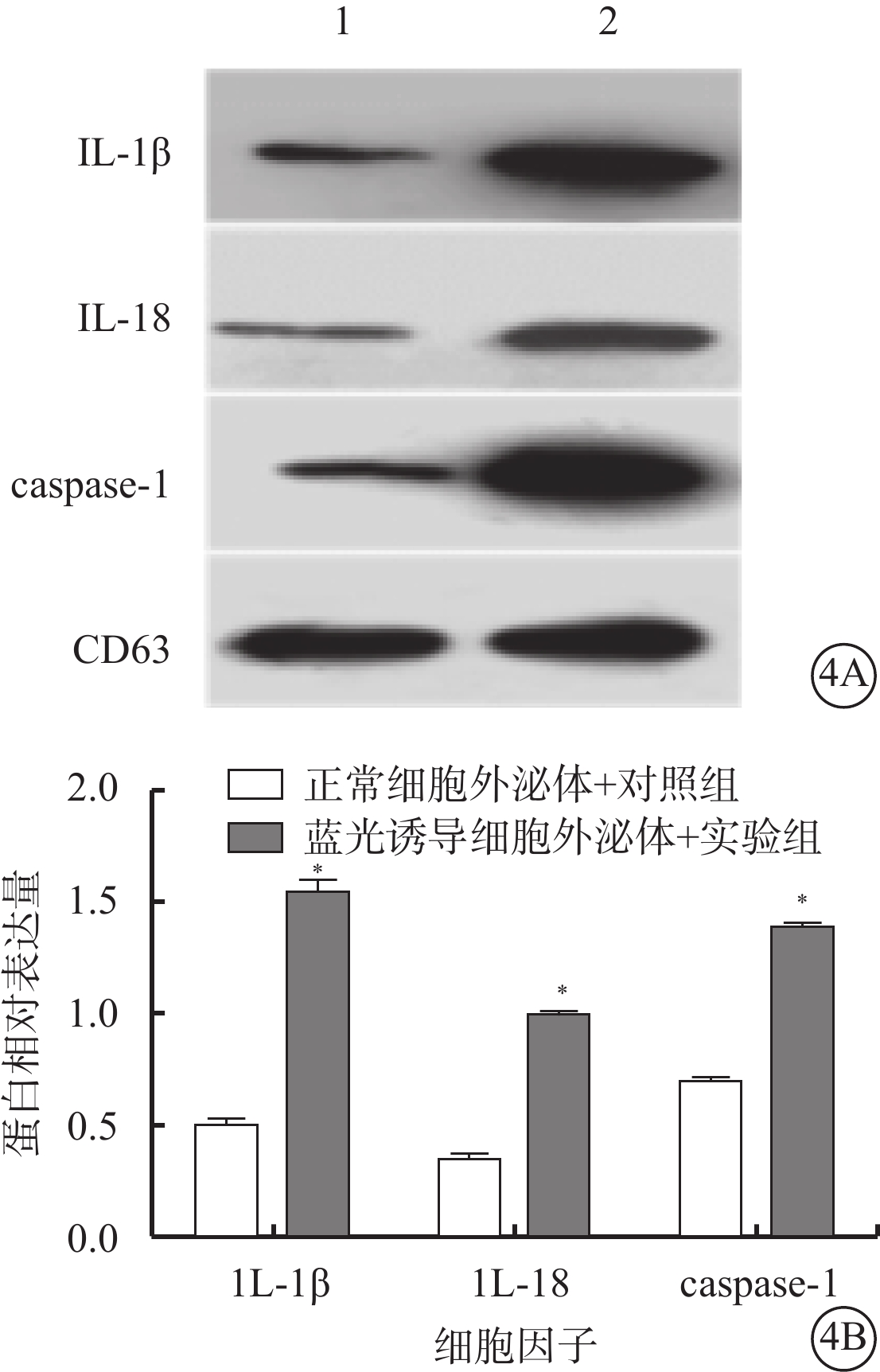
Western blot檢測發現,藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β(t=18.59)、IL-18(t=23.95)、caspase-1(t=35.27)蛋白相對表達量比較,差異均有統計學意義(P<0.001)(圖4)。
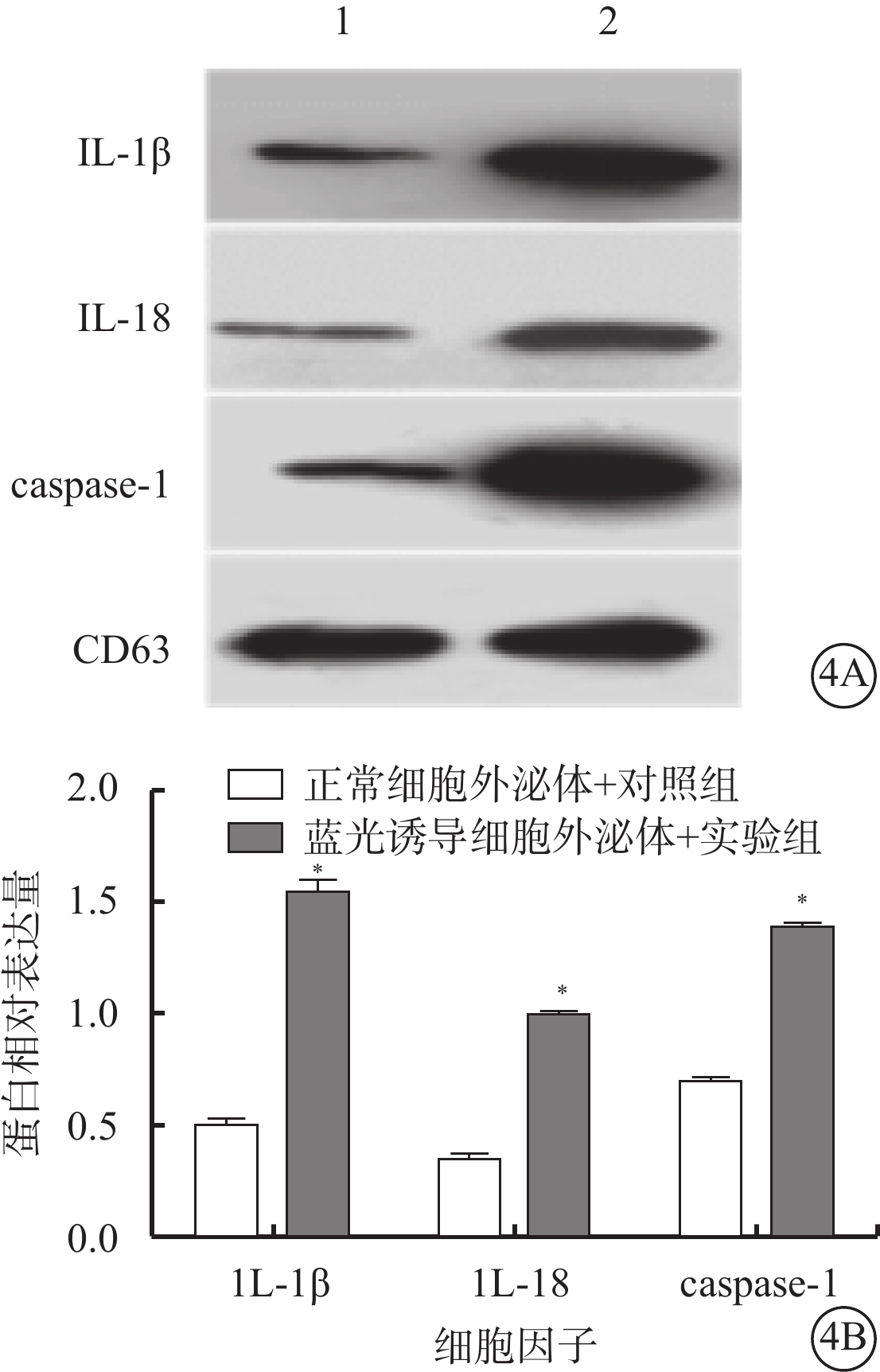 圖4
藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。4A. 電泳圖,1、2分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組;4B. 統計結果。*與正常細胞外泌體+對照組比較,P<0.050
圖4
藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。4A. 電泳圖,1、2分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組;4B. 統計結果。*與正常細胞外泌體+對照組比較,P<0.050
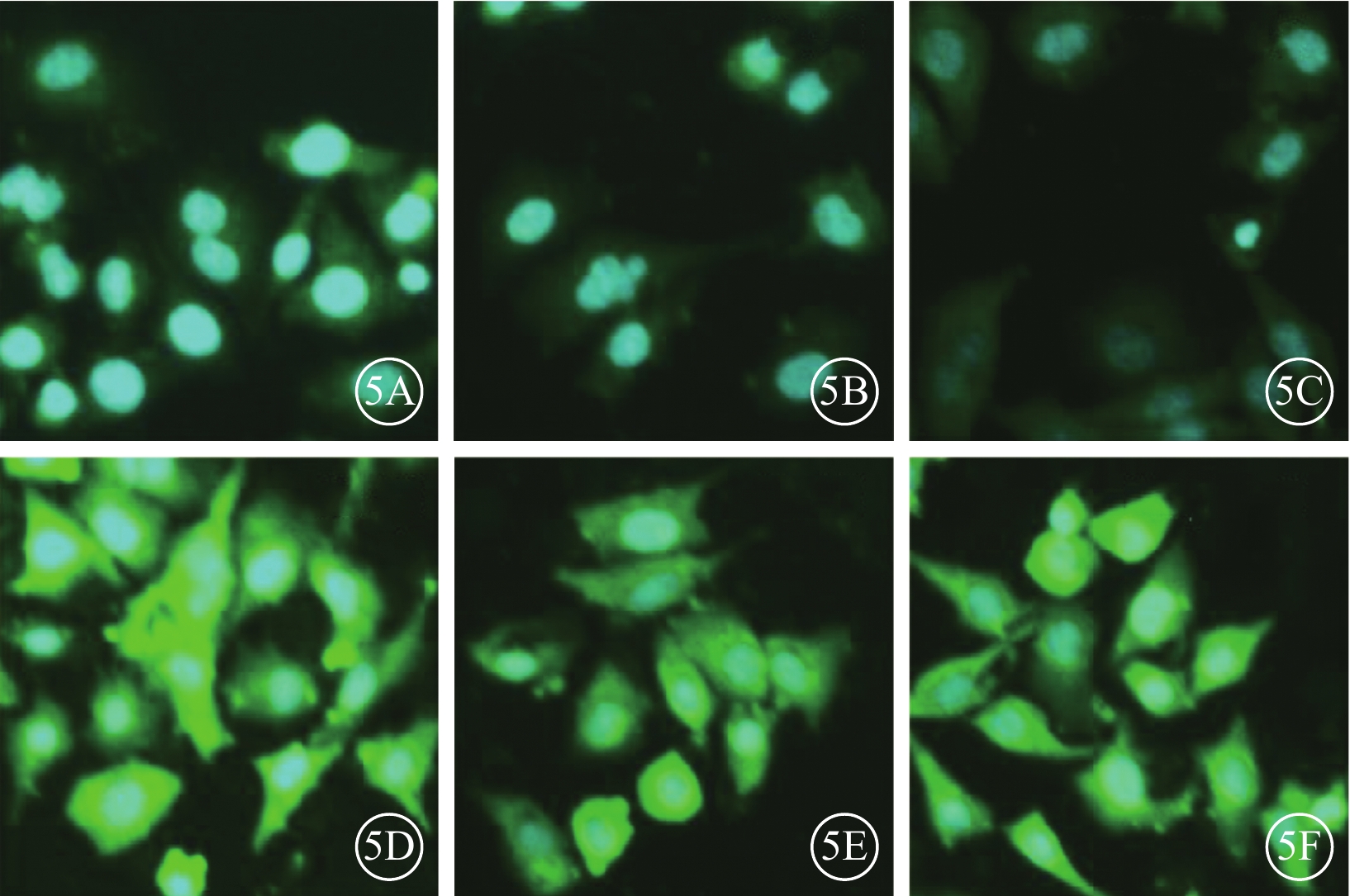
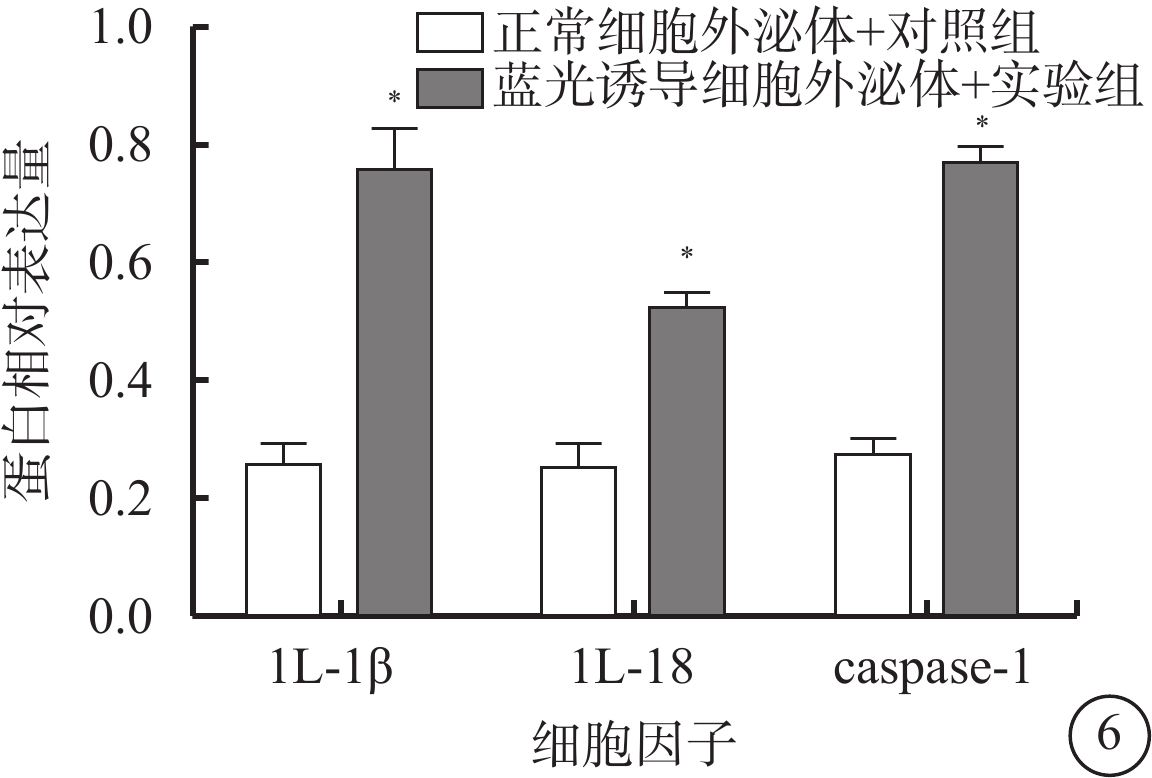
熒光顯微鏡觀察發現,藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達高于正常細胞外泌體+對照組(圖5);兩組細胞外泌體中IL-18(t=6.11)、IL-1β(t=6.30)、caspase-1(t=12.77)蛋白表達量比較,差異均有統計學意義(P<0.001)(圖6)。
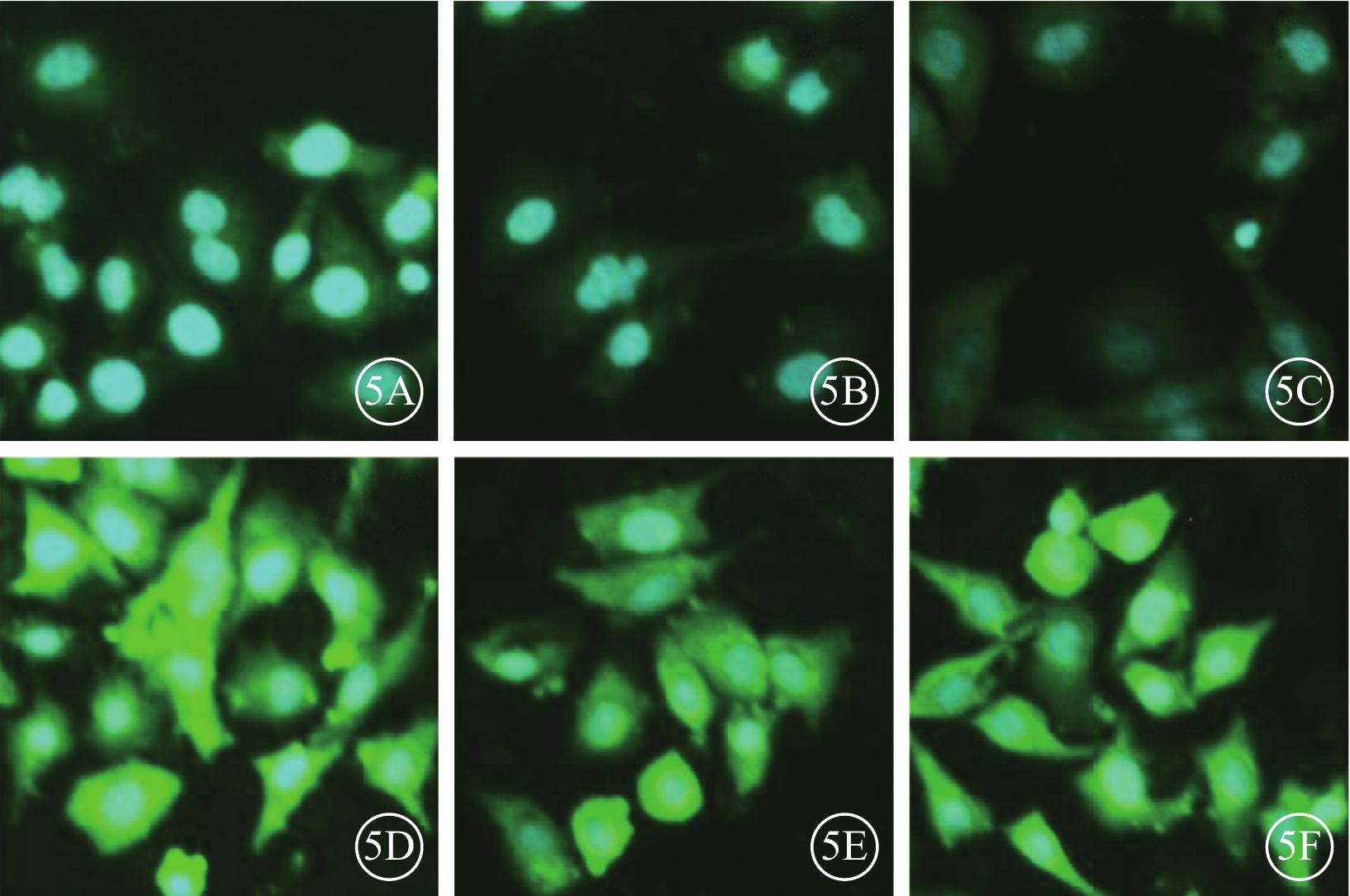 圖5
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達熒光顯微鏡像。5A~5C、5D~5F.分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達。藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1表達明顯強于正常細胞外泌體+對照組 DAPI ×100
圖5
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達熒光顯微鏡像。5A~5C、5D~5F.分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達。藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1表達明顯強于正常細胞外泌體+對照組 DAPI ×100
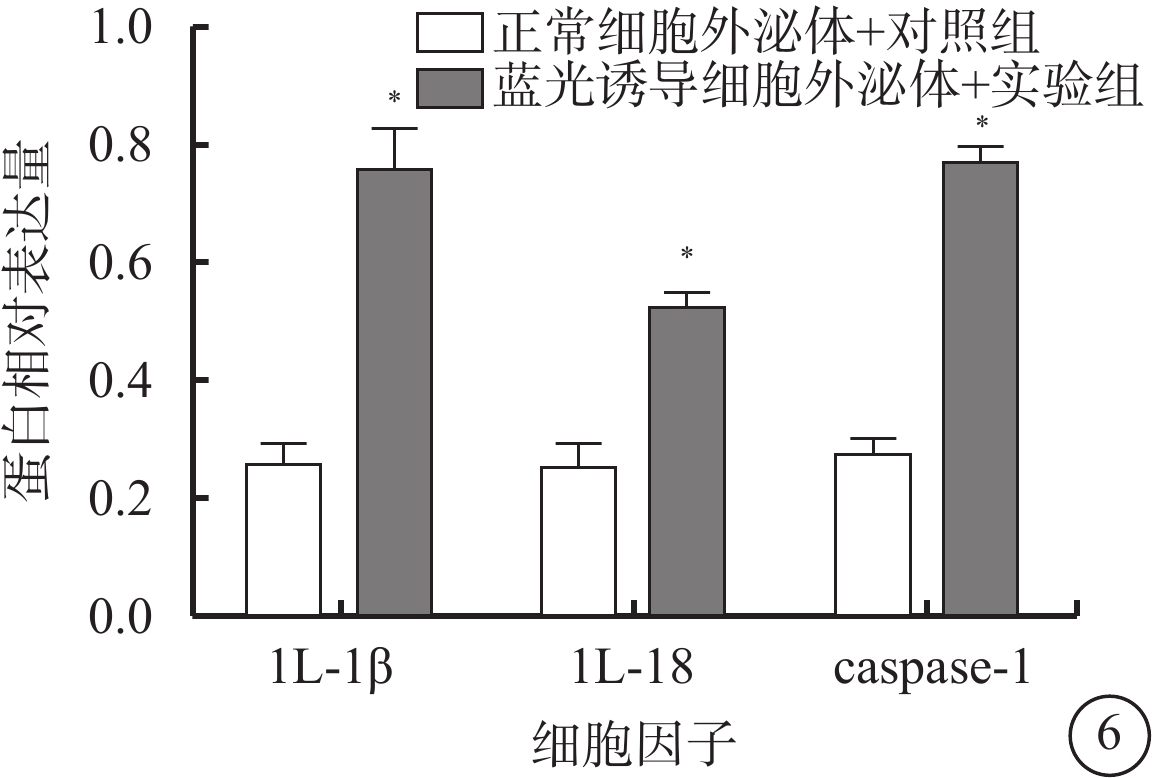 圖6
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達量比較。*與正常細胞外泌體+對照組比較,P<0.050
圖6
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達量比較。*與正常細胞外泌體+對照組比較,P<0.050
RT-PCR檢測發現,實驗組、對照組細胞NLRP3 mRNA相對表達量分別為1.000±0.069、0.200±0.010;實驗組細胞NLRP3 mRNA相對表達量明顯高于對照組,差異有統計學意義(t=12.20,P<0.001)。
3 討論
光損傷機制在AMD發病中被廣泛研究并證實,藍光暴露與AMD之間存在相關性[5, 6];波長440 nm藍光可誘導體外培養的RPE細胞通過氧化應激反應或光氧化損傷發生細胞凋亡及壞死[7]。蔡善君等[8]認為,閾值上光照強度下藍光照射6 h,光照后12 h為誘導體外培養人RPE細胞凋亡的最佳條件。本研究選擇4組藍光LED燈距離細胞35 cm處照射6 h后培養12 h作為實驗組,輻射強度約為3.2 mW/cm2。光照后RPE細胞腫脹,失去多角形態,細胞體變長,且增生活力明顯減弱,提示體外培養的ARPE-19細胞系在藍光照射后發生了光氧化損傷作用。可應用光氧化損傷的RPE細胞近似模擬早期AMD的RPE細胞。
外泌體是一類直徑在50~200 nm的具有脂質雙分子層結構的小囊泡,由各種活細胞分泌,其蛋白組成與其分泌的細胞具有相關性,外泌體可攜帶核酸、蛋白質等生物活性小分子進行細胞間的信號傳遞,且具有免疫活化、免疫抑制功能,參與機體免疫平衡的維持[3, 4]。近年來外泌體與AMD發病之間的關系受到廣泛關注。Biasutto等[9]在ARPE-19細胞分泌的外泌體中檢測到13種蛋白質、38種磷酸化蛋白和3種裂解蛋白質,這些蛋白同時也在AMD患者玻璃體中被檢測到,提示視網膜細胞通過外泌體向玻璃體腔分泌細胞內、非水溶性、受體蛋白質。此外,Wang等[10]研究發現,玻璃膜疣含有外泌體的標記物,而且這些標記物同樣存在于老齡鼠Bruch膜中。在應激狀態下,RPE細胞釋放外泌體,其表面可包被補體,并與補體因子H結合,這一過程也可能參與了AMD發病。本研究結果發現,藍光誘導細胞外泌體+實驗組細胞中IL-1β、IL-18、caspase-1相對表達量均較正常細胞外泌體+對照組升高,提示RPE細胞受到光氧化損傷后分泌含有致病信息的外泌體,并且通過出胞作用分布在細胞外環境中,即這些致病信息可能通過人體內環境分布和擴散,在AMD發病過程中發揮了重要作用。
近年來NLRP3炎性體在AMD中發揮的作用被廣泛研究,尤其玻璃膜疣中的補體調節成分、β淀粉樣蛋白及氧化副產物對NLRP3炎性體激活作用[11-13]。作為先天免疫的一部分,補體系統首先對組織損傷做出反應并且能夠被細胞凋亡激活[14]。Doyle等[15]研究發現,玻璃膜疣成分可以激活粘多糖預刺激過的巨噬細胞;另外,C1q作用于粘多糖預刺激小鼠骨髓來源的巨噬細胞和單核細胞系真核細胞后,可激發caspase-1切割和IL-1β分泌增多,提示補體成分C1q在激活NLRP3炎性體中的重要作用;另有研究結果則證明了其他補體成分如C3a和膜攻擊復合物對于激活NLRP3炎性體的重要作用[16-18]。隨著年齡的增長,RPE細胞對光感受器外節的吞噬能力下降,脂質過氧化物和脂褐素沉積在RPE細胞,因此有學者認為脂褐質在RPE細胞的沉積導致了溶酶體損傷并直接激活NLRP3炎性體[1, 19, 20]。其他脂質過氧化產物和成分如4-羥基壬烯醛和羥乙基吡咯,也能夠刺激NLRP3炎性體的激活[15, 21]。Piippo等[22]發現,細胞分解自噬功能衰退后,不僅導致細胞內蛋白質聚積和氧化應激,還可以活化NLRP3炎性體,增加有生物活性的IL-1β產生,NLRP3炎性體的靜止則將大大減少caspase-1的激活和炎癥因子IL-18、IL-1β的釋放。上述所有因素,包括脂質沉積、慢性促炎癥反應、氧化應激都能誘導持續的RPE細胞應激反應,損傷線粒體并促進NLRP3炎性體通路的激活。本研究結果顯示,藍光誘導后RPE細胞分泌的外泌體中IL-18、IL-1β以及caspase-1蛋白表達明顯增多,證明光氧化損傷RPE細胞后確能激活NLRP3炎性體,且外泌體很可能作為某種媒介在NLRP3的激活中發揮了作用。
本研究將ARPE-19細胞系作為研究對象,并采用藍光誘導造模,成功提取了藍光模型ARPE-19分泌的外泌體,并將其作用于正常RPE細胞,檢測到實驗組細胞分泌的外泌體上調了正常RPE細胞內NLRP3相關細胞因子IL-1β、IL-18和caspase-1以及NLRP3 mRNA水平,提示外泌體能夠在蛋白水平和基因水平上影響RPE細胞的生理活動。而其具體機制途徑及這一過程是否在AMD的發病中發揮作用,尚且需要進一步的研究。
老年性黃斑變性(AMD)病理損害累及視網膜色素上皮(RPE)細胞和Bruch膜,引起光感受器變性;多種免疫活化和調節異常均參與了AMD發病,其中炎性體是近年研究熱點。Tseng等[1]發現AMD患眼RPE細胞炎性體激活,RPE細胞中核苷酸結合寡聚化結構樣受體蛋白(NLRP3)、白細胞介素(IL)-18和激活的半胱氨酸天冬氨酸蛋白酶(caspase)水平上調。外泌體(exosomes)是一種活細胞分泌的直徑在50~200 nm之間的具有脂質雙分子層結構的小囊泡,囊泡內含有的蛋白組成與其分泌的細胞具有相關性[2]。研究結果表明,外泌體可攜帶核酸、蛋白質等生物活性小分子進行細胞間的信號傳遞;具有免疫活化和抑制功能,參與維持機體的免疫平衡[3, 4]。本研究通過藍光誘導建立人RPE細胞光損傷模型模仿AMD損傷的RPE,觀察光氧化損傷RPE細胞分泌的外泌體與NLRP3炎性體的相關性,旨為AMD發病機制的研究提供新思路。現將結果報道如下。
1 材料和方法
?
取對數生長期人RPE細胞株(ARPE-19)貼壁細胞分為實驗組和對照組。實驗組細胞采用4個波長為(448.0±24.0)nm的藍光發光二極管燈,距離細胞35 cm連續照射6 h;對照組細胞常規培養。光學顯微鏡觀察細胞形態;噻唑藍(MTT)檢測兩組細胞增生活力,以對照組細胞增生率為1。12 h后收集培養液,分級低溫超速離心獲取外泌體。將培養液放入普通離心管,4 ℃條件下300×g離心10 min,去沉淀后2000×g離心20 min,去沉淀后再次10 000×g離心30 min,去沉淀后將得到的濃縮液移至Beckman離心管中,4 ℃條件下100 000×g離心70 min,收集沉淀用磷酸鹽緩沖液(PBS)稀釋后,再次100 000×g離心70 min,得到的外泌體濃縮液以20 μl PBS重懸,?80 ℃冷藏備用。
將外泌體樣本1∶10稀釋,銅網蘸取少量稀釋后樣品,將銅網放入3%磷鎢酸溶液中染色5 min加深背景,透射電子顯微鏡80 kV下觀察并拍攝相片。
蛋白免疫印跡法(Western blot)檢測外泌體表面特異性標志蛋白CD63和NLRP3炎性體相關細胞因子IL-1β、IL-18和caspase-1蛋白水平表達。外泌體懸液100 μl加20 μl苯甲基磺酰氟裂解液,二喹啉甲酸蛋白定量,加樣前煮沸變性5 min;加樣后聚丙烯酰胺凝膠電泳,轉移至聚偏二氟乙烯膜上,5%脫脂奶粉封閉1 h,加入1∶1000鼠抗人一抗CD63、IL-1β、IL-18和caspase-1,4 ℃過夜;1倍硬酯酸鉛(PBST)浸洗,加入稀釋至1∶5000的二抗,室溫下搖床1 h,PBST浸洗3次后應用超敏化學發光試劑盒顯色2 min,X光顯影后掃描分析。
?
將濃度為200 μg/ml的實驗組、對照組細胞外泌體分別作用于12孔板中平鋪的正常RPE細胞,據此分為藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組。37 ℃、5%CO2培養24 h,培養期間不更換培養液;24 h后MTT檢測兩組細胞增生活力。以正常細胞外泌體+對照組細胞增生率為1。
Western blot檢測兩組RPE細胞NLRP3炎性體相關細胞因子IL-1β、IL-18、caspase-1蛋白表達。檢測方法同前。免疫熒光法檢測兩組RPE細胞外沁體中IL-1β、IL-18、caspase-1蛋白表達。將外泌體作用后的兩組細胞平鋪在24孔板上,濃度約5×104/ml,4%多聚甲醛固定爬片后加入0.5%Triton-100避光處理 20 min;PBS浸洗3次,加入1 ml 3%的牛血清白蛋白室溫封閉1 h;加足量稀釋一抗(1∶100),濕盒中4 ℃ 過夜;PBST浸洗3次后滴加熒光二抗(1∶100),避光室溫孵育1 h,再次PBST浸洗3次,滴加4’,6-二脒基-2-苯基吲哚(DAPI)染核后PBST浸洗4次,抗熒光淬滅封片劑封片,熒光顯微鏡下觀察并采集圖像。應用Image Pro Plus軟件將細胞熒光亮度轉化為灰度值進行量化分析。
實時定量聚合酶鏈反應(RT-PCR)檢測兩組RPE細胞內NLRP3 mRNA的表達。按照Trizol試劑盒說明書提取細胞總RNA,?80 ℃保存。運用Primer Premier 5.0軟件設計上下游引物。NLRP3:上游引物 5′-GGCATATCACAGTGGGATTC-3′,下游引物5′-GATCTTCGCTGCGATCAAC-3′。甘油醛脫氫酶(GAPDH):上游引物5′-CGAGATCCCTCCAAAATCAA-3′,下游引物:5′-GGTGCTAAGCAGTTGGTGGT-3′。反應條件:94 ℃,30 s;50~60 ℃,30 s;72 ℃,60 s。變性、退火、延伸重復35~40個循環。將得到的各組循環閾值(CT)數據以GAPDH為內參,采用2?△△CT法計算目的基因mRNA相對表達量。
?
采用SPSS18.0統計軟件進行統計學分析處理。數據以均數±標準差(
 )表示。兩組細胞免疫熒光檢測結果行方差齊性檢驗,MTT檢測結果采用配對t檢驗,其余兩組間比較采用兩獨立樣本t檢驗。P<0.05為差異有統計學意義。
)表示。兩組細胞免疫熒光檢測結果行方差齊性檢驗,MTT檢測結果采用配對t檢驗,其余兩組間比較采用兩獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
光學顯微鏡觀察發現,對照組細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;實驗組細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態(圖1)。MTT檢測結果顯示,實驗組細胞增生率為66.0%,低于對照組細胞,差異有統計學意義(t=3.92,P<0.050)。
 圖1
培養的RPE細胞光學顯微鏡像。1A. 正常組,細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;1B. 實驗組,細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態 ×400
圖1
培養的RPE細胞光學顯微鏡像。1A. 正常組,細胞呈單層生長,梭形或多角形,融合后呈鋪路石樣生長;1B. 實驗組,細胞腫脹,細胞胞體失去多角形態,部分胞體變長,呈成纖維細胞形態 ×400
透射電子顯微鏡觀察發現,實驗組、對照組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見(圖2)。
 圖2
外泌體透射電子顯微鏡像。2A. 實驗組;2B. 對照組。兩組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見 磷鎢酸 標尺:2A. 400 nm;2B. 100 nm
圖2
外泌體透射電子顯微鏡像。2A. 實驗組;2B. 對照組。兩組細胞外泌體形態無明顯差異;直徑約50~200 nm,呈雙凹托盤狀,有立體感,表面膜結構脂質雙分子可見 磷鎢酸 標尺:2A. 400 nm;2B. 100 nm
Western blot檢測發現,實驗組、對照組細胞外泌體均表達CD63。兩組細胞外泌體中IL-1β(t=18.04)、IL-18(t=12.55)、caspase-1(t=14.70)蛋白表達量比較,差異均有統計學意義(P<0.001)(圖3)。
 圖3
實驗組、對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。3A. 電泳圖,1、2分別為對照組、實驗組;3B. 統計結果。*與對照組比較,P<0.050
圖3
實驗組、對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。3A. 電泳圖,1、2分別為對照組、實驗組;3B. 統計結果。*與對照組比較,P<0.050
MTT檢測發現,藍光誘導細胞外泌體+實驗組細胞增生率為76.5%,低于正常細胞外泌體+對照組,差異有統計學意義(t=3.49,P<0.050)。
Western blot檢測發現,藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β(t=18.59)、IL-18(t=23.95)、caspase-1(t=35.27)蛋白相對表達量比較,差異均有統計學意義(P<0.001)(圖4)。
 圖4
藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。4A. 電泳圖,1、2分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組;4B. 統計結果。*與正常細胞外泌體+對照組比較,P<0.050
圖4
藍光誘導細胞外泌體+實驗組、正常細胞外泌體+對照組細胞外泌體中IL-1β、1L-18、caspase-1蛋白表達比較。4A. 電泳圖,1、2分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組;4B. 統計結果。*與正常細胞外泌體+對照組比較,P<0.050
熒光顯微鏡觀察發現,藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達高于正常細胞外泌體+對照組(圖5);兩組細胞外泌體中IL-18(t=6.11)、IL-1β(t=6.30)、caspase-1(t=12.77)蛋白表達量比較,差異均有統計學意義(P<0.001)(圖6)。
 圖5
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達熒光顯微鏡像。5A~5C、5D~5F.分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達。藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1表達明顯強于正常細胞外泌體+對照組 DAPI ×100
圖5
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達熒光顯微鏡像。5A~5C、5D~5F.分別為正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1的表達。藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1表達明顯強于正常細胞外泌體+對照組 DAPI ×100
 圖6
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達量比較。*與正常細胞外泌體+對照組比較,P<0.050
圖6
正常細胞外泌體+對照組、藍光誘導細胞外泌體+實驗組細胞外泌體中IL-1β、IL-18、caspase-1蛋白表達量比較。*與正常細胞外泌體+對照組比較,P<0.050
RT-PCR檢測發現,實驗組、對照組細胞NLRP3 mRNA相對表達量分別為1.000±0.069、0.200±0.010;實驗組細胞NLRP3 mRNA相對表達量明顯高于對照組,差異有統計學意義(t=12.20,P<0.001)。
3 討論
光損傷機制在AMD發病中被廣泛研究并證實,藍光暴露與AMD之間存在相關性[5, 6];波長440 nm藍光可誘導體外培養的RPE細胞通過氧化應激反應或光氧化損傷發生細胞凋亡及壞死[7]。蔡善君等[8]認為,閾值上光照強度下藍光照射6 h,光照后12 h為誘導體外培養人RPE細胞凋亡的最佳條件。本研究選擇4組藍光LED燈距離細胞35 cm處照射6 h后培養12 h作為實驗組,輻射強度約為3.2 mW/cm2。光照后RPE細胞腫脹,失去多角形態,細胞體變長,且增生活力明顯減弱,提示體外培養的ARPE-19細胞系在藍光照射后發生了光氧化損傷作用。可應用光氧化損傷的RPE細胞近似模擬早期AMD的RPE細胞。
外泌體是一類直徑在50~200 nm的具有脂質雙分子層結構的小囊泡,由各種活細胞分泌,其蛋白組成與其分泌的細胞具有相關性,外泌體可攜帶核酸、蛋白質等生物活性小分子進行細胞間的信號傳遞,且具有免疫活化、免疫抑制功能,參與機體免疫平衡的維持[3, 4]。近年來外泌體與AMD發病之間的關系受到廣泛關注。Biasutto等[9]在ARPE-19細胞分泌的外泌體中檢測到13種蛋白質、38種磷酸化蛋白和3種裂解蛋白質,這些蛋白同時也在AMD患者玻璃體中被檢測到,提示視網膜細胞通過外泌體向玻璃體腔分泌細胞內、非水溶性、受體蛋白質。此外,Wang等[10]研究發現,玻璃膜疣含有外泌體的標記物,而且這些標記物同樣存在于老齡鼠Bruch膜中。在應激狀態下,RPE細胞釋放外泌體,其表面可包被補體,并與補體因子H結合,這一過程也可能參與了AMD發病。本研究結果發現,藍光誘導細胞外泌體+實驗組細胞中IL-1β、IL-18、caspase-1相對表達量均較正常細胞外泌體+對照組升高,提示RPE細胞受到光氧化損傷后分泌含有致病信息的外泌體,并且通過出胞作用分布在細胞外環境中,即這些致病信息可能通過人體內環境分布和擴散,在AMD發病過程中發揮了重要作用。
近年來NLRP3炎性體在AMD中發揮的作用被廣泛研究,尤其玻璃膜疣中的補體調節成分、β淀粉樣蛋白及氧化副產物對NLRP3炎性體激活作用[11-13]。作為先天免疫的一部分,補體系統首先對組織損傷做出反應并且能夠被細胞凋亡激活[14]。Doyle等[15]研究發現,玻璃膜疣成分可以激活粘多糖預刺激過的巨噬細胞;另外,C1q作用于粘多糖預刺激小鼠骨髓來源的巨噬細胞和單核細胞系真核細胞后,可激發caspase-1切割和IL-1β分泌增多,提示補體成分C1q在激活NLRP3炎性體中的重要作用;另有研究結果則證明了其他補體成分如C3a和膜攻擊復合物對于激活NLRP3炎性體的重要作用[16-18]。隨著年齡的增長,RPE細胞對光感受器外節的吞噬能力下降,脂質過氧化物和脂褐素沉積在RPE細胞,因此有學者認為脂褐質在RPE細胞的沉積導致了溶酶體損傷并直接激活NLRP3炎性體[1, 19, 20]。其他脂質過氧化產物和成分如4-羥基壬烯醛和羥乙基吡咯,也能夠刺激NLRP3炎性體的激活[15, 21]。Piippo等[22]發現,細胞分解自噬功能衰退后,不僅導致細胞內蛋白質聚積和氧化應激,還可以活化NLRP3炎性體,增加有生物活性的IL-1β產生,NLRP3炎性體的靜止則將大大減少caspase-1的激活和炎癥因子IL-18、IL-1β的釋放。上述所有因素,包括脂質沉積、慢性促炎癥反應、氧化應激都能誘導持續的RPE細胞應激反應,損傷線粒體并促進NLRP3炎性體通路的激活。本研究結果顯示,藍光誘導后RPE細胞分泌的外泌體中IL-18、IL-1β以及caspase-1蛋白表達明顯增多,證明光氧化損傷RPE細胞后確能激活NLRP3炎性體,且外泌體很可能作為某種媒介在NLRP3的激活中發揮了作用。
本研究將ARPE-19細胞系作為研究對象,并采用藍光誘導造模,成功提取了藍光模型ARPE-19分泌的外泌體,并將其作用于正常RPE細胞,檢測到實驗組細胞分泌的外泌體上調了正常RPE細胞內NLRP3相關細胞因子IL-1β、IL-18和caspase-1以及NLRP3 mRNA水平,提示外泌體能夠在蛋白水平和基因水平上影響RPE細胞的生理活動。而其具體機制途徑及這一過程是否在AMD的發病中發揮作用,尚且需要進一步的研究。