引用本文: 陳璇, 邵珺, 夏大云, 王如興, 姚勇. 二十二碳六烯酸對視網膜動脈平滑肌細胞大電導鈣激活鉀離子通道的激活作用. 中華眼底病雜志, 2017, 33(3): 295-297. doi: 10.3760/cma.j.issn.1005-1015.2017.03.017 復制
二十二碳六烯酸(DHA)是人體必需脂肪酸n-3多不飽和脂肪酸(n-3PUFA)的一種,同時也是大腦和視網膜的重要構成成分[1]。n-3PUFA不僅可以抑制血小板聚集、降低血脂及直接擴張血管,亦有改善胰島素抵抗以及抑制新生血管和保護視神經功能的作用[2-8]。大電導鈣激活鉀離子(BK)通道廣泛分布于人體組織和細胞,參與血管張力調節、神經興奮和神經遞質釋放等多種重要生理活動,不僅參與細胞膜電位的形成,而且可以維持血管平滑肌細胞舒縮功能的動態平衡[9]。我們推測,DHA對視網膜動脈的保護作用可能與激活視網膜動脈平滑肌細胞(RASMCs)BK通道有關。為了驗證這一觀點,我們觀察了不同濃度DHA對RASMCs的BK通道總開放概率(NP0)及β1亞基的相對蛋白表達量。現將結果報道如下。
1 材料和方法
實驗室自存RASMCs,經形態學觀察確認細胞呈長梭形或橢圓形,免疫組織化學染色呈陽性[10]。澳洲胎牛血清(FBS,美國Gibco公司),Dulbecco改良Eagle培養基(DMEM,美國Hyclone公司),0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液(凱基生物科技發展有限公司),二甲基亞砜(DMSO,美國Amresco公司),DHA(美國Sigma公司)。
RASMCs置于含10% FBS的DMEM培養基中,于37℃、5%CO2培養箱中傳代培養,1.25 g/L 0.25%胰蛋白酶-EDTA消化。取第6~8代細胞用于膜片鉗實驗。采用Axopatch 200B膜片鉗放大器和pCLAMP 10.2軟件記錄BK單通道電流。以膜內向外型模式記錄BK單通道電流。輸出信號經8極Bessel濾波器濾波,采樣頻率20 kHz,濾波頻率5 kHz,電極電阻5~10 MΩ。電極內液:KCl 140.0 mmol/L、4-羥乙基哌嗪乙磺酸(HEPES) 10.0 mmol/L、乙二醇雙四乙酸(EGTA)1.0 mmol/L、MgCl2 1.0 mmol/L、CaCl2 1.0 mmol/L,pH 7.4;電極外液:KCl 140.0 mmol/L、HEPES 10.0 mmol/L、EGTA 1.0 mmol/L、MgCl2 1.0 mmol/L,pH 7.35。在電極外液鈣離子濃度1 μmol/L,刺激電位60 mV,DHA濃度0.0、1.0、3.0、5.0、7.5、10.0 μmol/L條件下,分別記錄RAMSCs的BK通道電流,計算NP0。NP0=∑(Onn)/T[11]。其中,N為通道的開放數量,P0代表平均開放概率,T代表記錄持續時間,On代表每個開放水平所需時間。
采用蛋白免疫印跡法(Western blot)檢測RASMCs的BK通道中β1亞基的相對蛋白表達量。待細胞長至80%~90%融合時,1.25 g/L 0.25%胰蛋白酶-EDTA消化。按細胞密度2×105個/孔接種至6孔板,37℃、5%CO2培養箱中培養24 h,更換無FBS培養基饑餓培養12 h。按0.0、1.0、5.0 μmol/L不同濃度的DHA干預RASMCs,并以此分為對照組、低劑量組及高劑量組,每組設2個復孔,37℃、5%CO2培養箱中培養36 h后棄去培養液。用預冷的磷酸鹽緩沖液沖洗細胞3次,加入RIPA裂解液,在冰上充分裂解,以離心半徑3 cm、轉速12 000 r/min,4 ℃條件下離心15 min,離心后收集上清液,采用二喹啉甲酸法測定蛋白濃度。等量蛋白行12%(β1亞基,相對分子質量約28×103)丙烯酰胺凝膠電泳,5%脫脂牛奶室溫封閉2 h,抗BK通道β亞基抗體4 ℃孵育過夜,洗膜,辣根過氧化物酶標記二抗室溫孵育2 h。洗膜后再用超敏增強化學發光試劑盒發光采集圖像,采用Image J軟件對圖像進行分析處理。β-肌動蛋白(β-actin)作為內參照。
采用SPSS 22.0統計軟件行統計學分析。計量資料用均數±標準差( )表示。不同濃度DHA作用下RASMCs的BK通道NP0的變化以及對照組、低劑量組和高劑量組BK通道β1亞基相對蛋白表達量比較均采用方差分析。P<0.05為差異有統計學意義。
2 結果
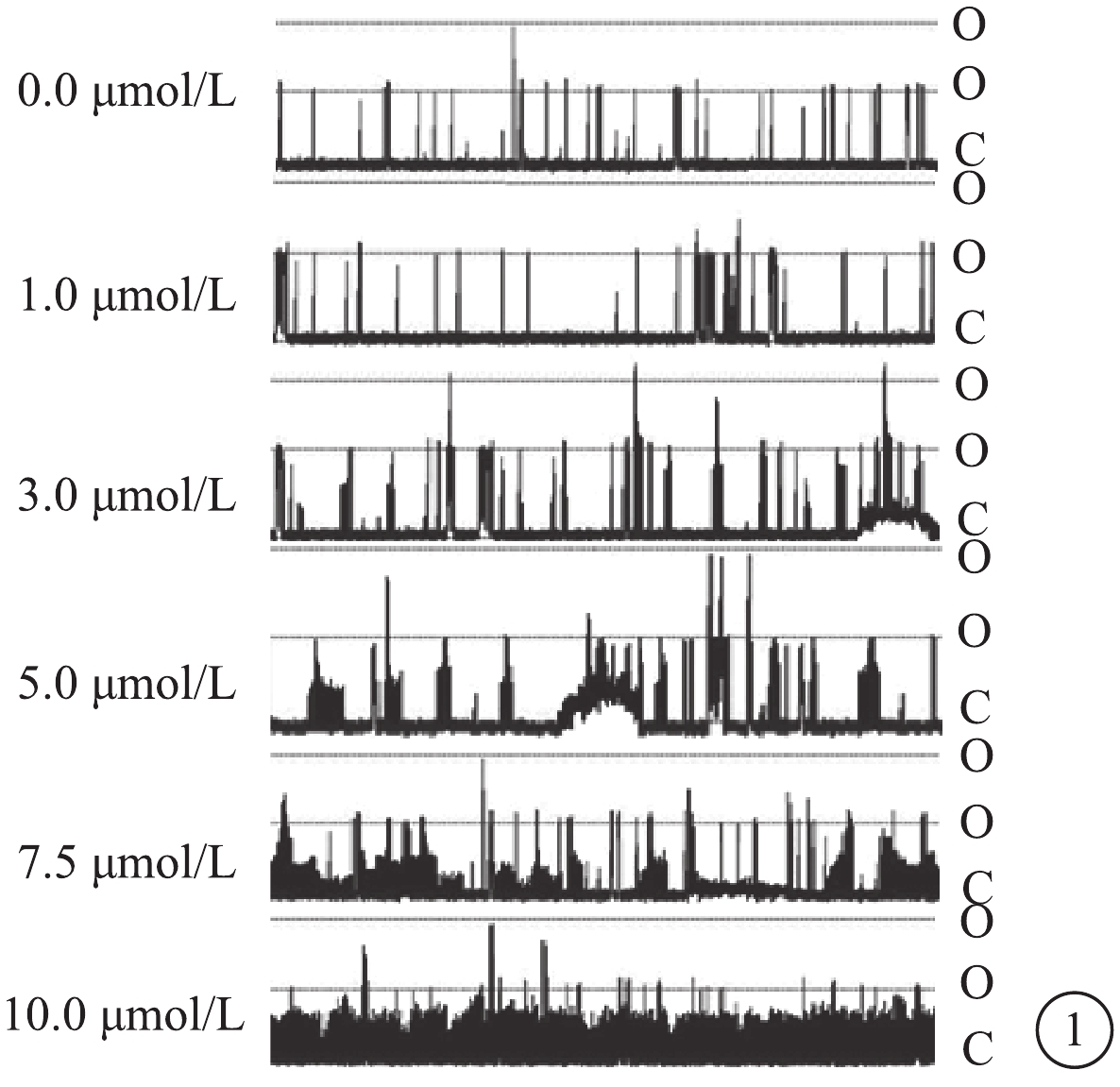
DHA濃度為0.0、1.0、3.0、5.0、7.5、10.0 μmol/L時,RASMCs的BK通道NP0分別為0.044 4±0.001 2、0.081 2±0.004 2、0.209 0±0.006 1、0.310 5±0.005 3、0.465 0±0.007 8、0.497 7±0.014 5。隨DHA濃度的升高,BK通道NP0增加。不同DHA濃度作用下RASMCs的BK通道NP0比較,差異有統計學意義(F=2.621,P<0.05)(圖1)。
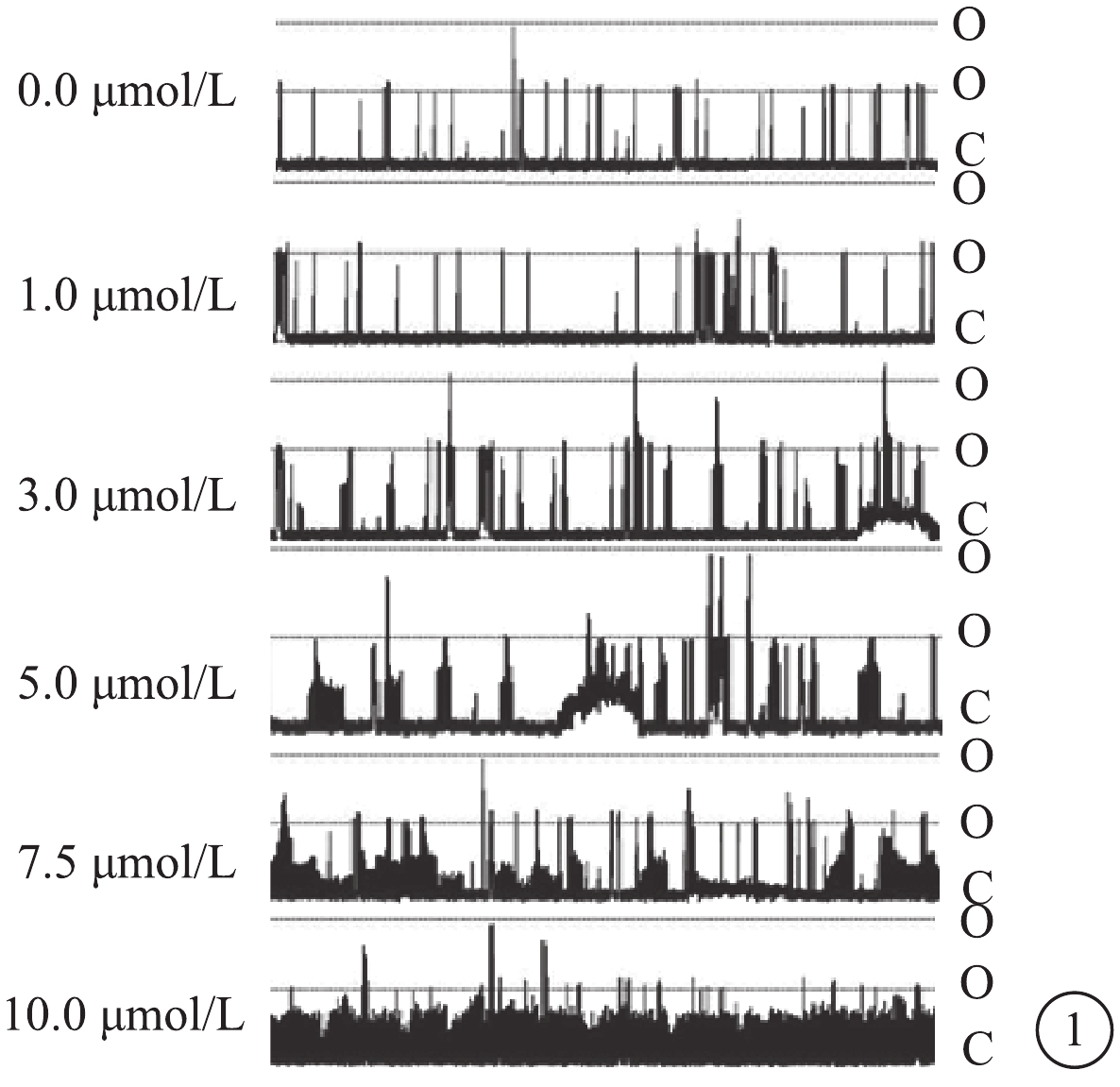 圖1
不同DHA濃度下BK通道電流圖。O:通道開放;C:通道關閉
圖1
不同DHA濃度下BK通道電流圖。O:通道開放;C:通道關閉
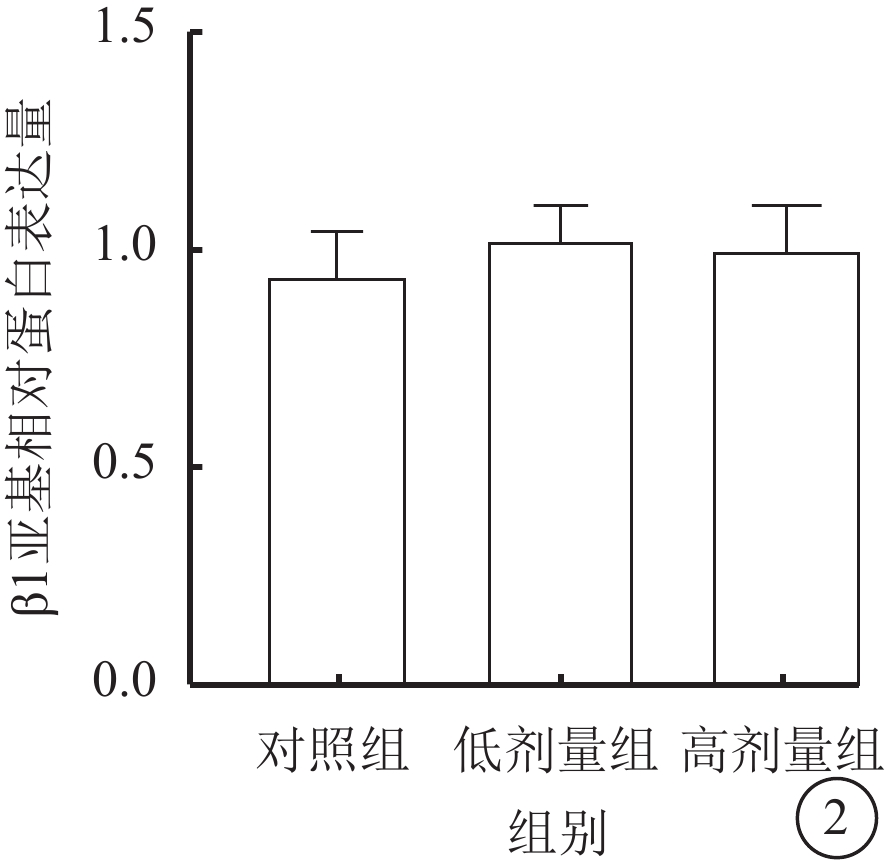
Western blot檢測結果顯示,對照組、低劑量組、高劑量組RASMCs的BK通道中β1亞基相對蛋白表達量比較,差異無統計學意義(F=11.657,P>0.05)(圖2)。
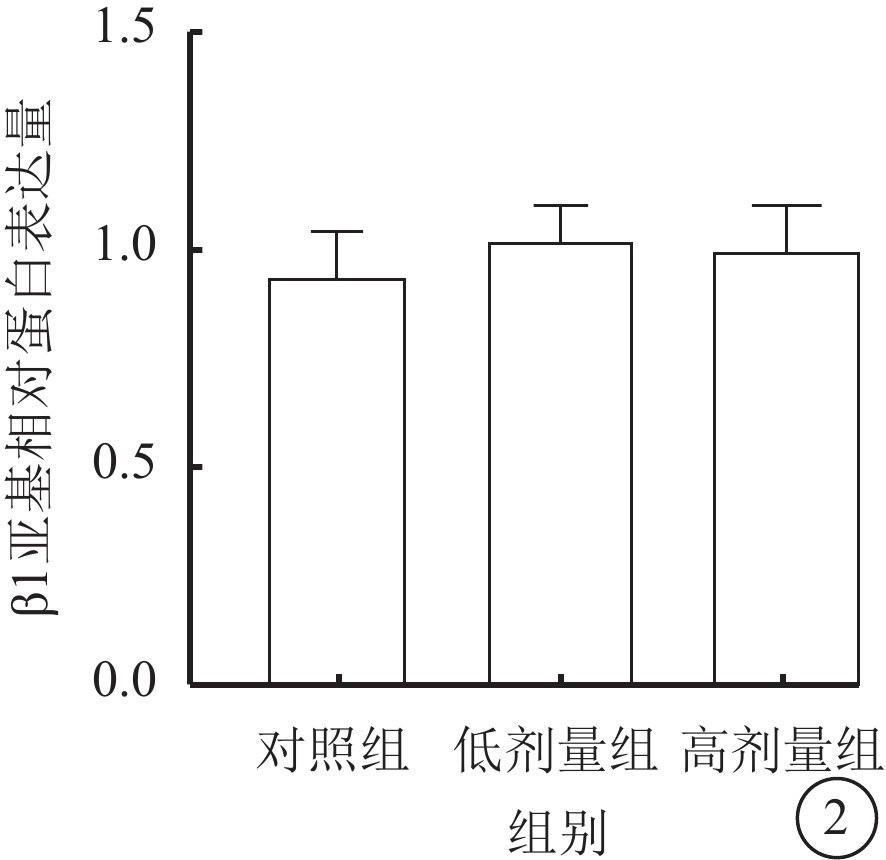 圖2
3組RASMCs的BK通道β1亞基相對蛋白表達量比較
圖2
3組RASMCs的BK通道β1亞基相對蛋白表達量比較
3 討論
BK通道由孔道形成亞基α與調節亞基β組成,一個α亞單位結合一個β亞單位,形成四聚體[12]。BK通道主要受細胞跨膜電位及細胞內鈣離子濃度的影響,正常情況下BK通道激活后鉀離子外流,產生超極化,抑制電壓依賴性鈣離子通道開放,繼而鈣離子內流減少,引起血管平滑肌舒張,故BK通道功能主要為參與血管的舒張[13]。本研究采用單通道膜片鉗技術研究不同濃度DHA對正常RASMCs的BK通道NP0的影響。結果表明,隨著DHA濃度的增高,BK通道的NP0增高。這說明DHA可激活BK通道。因為單通道膜片鉗技術是在無細胞內環境的條件下記錄BK通道開放電流的,故該實驗結果表明DHA激活BK通道的機制可能是DHA與BK通道作用后直接激活所致,但其作用機制尚不清楚。由于BK通道具有電壓依賴及鈣離子依賴性,因此我們推測DHA可能通過增加鈣離子敏感性激活BK通道,其機制有待進一步研究。
BK通道亞單位尤其是調節亞基β1對BK通道的動力學和鈣離子敏感性起重要調節作用[14,15]。因此,本研究觀察了不同濃度DHA對RASMCs的BK通道β1亞基表達的影響。結果表明,不同濃度DHA對RASMCs的BK通道β1亞基蛋白表達沒有影響。出現上述陰性結果的原因可能與以下幾個方面有關:(1)本研究設置的DHA濃度是根據美國心臟協會建議成人每日服用1 g左右n-3 PUFA推測出來的,用于細胞實驗有一定不確定性;(2)DHA對BK通道的激活作用可能不通過影響其亞單位表達來實現,而是直接作用或激活其他途徑等[16];(3)DHA對BK通道的激活作用可能本身具有瞬效性,并不具有長期的作用能力。
本研究結果表明,DHA可直接激活RASMCs的BK通道,增加視網膜動脈BK通道的NP0,但DHA對視網膜動脈BK通道亞單位表達無明顯影響。提示DHA可能并非通過影響BK通道亞單位的表達激活BK通道,而是通過與BK通道作用后直接激活,從而擴張視網膜動脈,對視網膜動脈起保護作用。但本研究也存在一定局限性。首先,本研究只基于細胞層面,未能構建動物灌胃模型去探討DHA對BK通道的激活是否具有長效作用,并且人為構建的細胞環境與動物體內實際內環境有一定差別。其次,膜片鉗技術主要分為單通道及全細胞實驗技術,本研究只采用了單通道膜片鉗技術探討了DHA對RASMCs細胞膜上BK通道的直接作用,而未行全細胞膜片鉗技術研究兩者對完整細胞膜上BK通道電流密度的影響。在接下來的研究中,我們將繼續完善細胞實驗,測定DHA對BK通道亞單位基因表達的影響;同時進行膜片鉗全細胞實驗測定BK通道電流密度的改變。更重要的是構建動物灌胃模型,分離消化RASMCs,并同時進行上述研究獲得更為全面穩定的結果,進而闡明DHA對視網膜動脈BK通道的作用機制,為未來研究各種病理狀態下視網膜動脈BK通道變化提供實驗基礎。
二十二碳六烯酸(DHA)是人體必需脂肪酸n-3多不飽和脂肪酸(n-3PUFA)的一種,同時也是大腦和視網膜的重要構成成分[1]。n-3PUFA不僅可以抑制血小板聚集、降低血脂及直接擴張血管,亦有改善胰島素抵抗以及抑制新生血管和保護視神經功能的作用[2-8]。大電導鈣激活鉀離子(BK)通道廣泛分布于人體組織和細胞,參與血管張力調節、神經興奮和神經遞質釋放等多種重要生理活動,不僅參與細胞膜電位的形成,而且可以維持血管平滑肌細胞舒縮功能的動態平衡[9]。我們推測,DHA對視網膜動脈的保護作用可能與激活視網膜動脈平滑肌細胞(RASMCs)BK通道有關。為了驗證這一觀點,我們觀察了不同濃度DHA對RASMCs的BK通道總開放概率(NP0)及β1亞基的相對蛋白表達量。現將結果報道如下。
1 材料和方法
實驗室自存RASMCs,經形態學觀察確認細胞呈長梭形或橢圓形,免疫組織化學染色呈陽性[10]。澳洲胎牛血清(FBS,美國Gibco公司),Dulbecco改良Eagle培養基(DMEM,美國Hyclone公司),0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液(凱基生物科技發展有限公司),二甲基亞砜(DMSO,美國Amresco公司),DHA(美國Sigma公司)。
RASMCs置于含10% FBS的DMEM培養基中,于37℃、5%CO2培養箱中傳代培養,1.25 g/L 0.25%胰蛋白酶-EDTA消化。取第6~8代細胞用于膜片鉗實驗。采用Axopatch 200B膜片鉗放大器和pCLAMP 10.2軟件記錄BK單通道電流。以膜內向外型模式記錄BK單通道電流。輸出信號經8極Bessel濾波器濾波,采樣頻率20 kHz,濾波頻率5 kHz,電極電阻5~10 MΩ。電極內液:KCl 140.0 mmol/L、4-羥乙基哌嗪乙磺酸(HEPES) 10.0 mmol/L、乙二醇雙四乙酸(EGTA)1.0 mmol/L、MgCl2 1.0 mmol/L、CaCl2 1.0 mmol/L,pH 7.4;電極外液:KCl 140.0 mmol/L、HEPES 10.0 mmol/L、EGTA 1.0 mmol/L、MgCl2 1.0 mmol/L,pH 7.35。在電極外液鈣離子濃度1 μmol/L,刺激電位60 mV,DHA濃度0.0、1.0、3.0、5.0、7.5、10.0 μmol/L條件下,分別記錄RAMSCs的BK通道電流,計算NP0。NP0=∑(Onn)/T[11]。其中,N為通道的開放數量,P0代表平均開放概率,T代表記錄持續時間,On代表每個開放水平所需時間。
采用蛋白免疫印跡法(Western blot)檢測RASMCs的BK通道中β1亞基的相對蛋白表達量。待細胞長至80%~90%融合時,1.25 g/L 0.25%胰蛋白酶-EDTA消化。按細胞密度2×105個/孔接種至6孔板,37℃、5%CO2培養箱中培養24 h,更換無FBS培養基饑餓培養12 h。按0.0、1.0、5.0 μmol/L不同濃度的DHA干預RASMCs,并以此分為對照組、低劑量組及高劑量組,每組設2個復孔,37℃、5%CO2培養箱中培養36 h后棄去培養液。用預冷的磷酸鹽緩沖液沖洗細胞3次,加入RIPA裂解液,在冰上充分裂解,以離心半徑3 cm、轉速12 000 r/min,4 ℃條件下離心15 min,離心后收集上清液,采用二喹啉甲酸法測定蛋白濃度。等量蛋白行12%(β1亞基,相對分子質量約28×103)丙烯酰胺凝膠電泳,5%脫脂牛奶室溫封閉2 h,抗BK通道β亞基抗體4 ℃孵育過夜,洗膜,辣根過氧化物酶標記二抗室溫孵育2 h。洗膜后再用超敏增強化學發光試劑盒發光采集圖像,采用Image J軟件對圖像進行分析處理。β-肌動蛋白(β-actin)作為內參照。
采用SPSS 22.0統計軟件行統計學分析。計量資料用均數±標準差( )表示。不同濃度DHA作用下RASMCs的BK通道NP0的變化以及對照組、低劑量組和高劑量組BK通道β1亞基相對蛋白表達量比較均采用方差分析。P<0.05為差異有統計學意義。
2 結果
DHA濃度為0.0、1.0、3.0、5.0、7.5、10.0 μmol/L時,RASMCs的BK通道NP0分別為0.044 4±0.001 2、0.081 2±0.004 2、0.209 0±0.006 1、0.310 5±0.005 3、0.465 0±0.007 8、0.497 7±0.014 5。隨DHA濃度的升高,BK通道NP0增加。不同DHA濃度作用下RASMCs的BK通道NP0比較,差異有統計學意義(F=2.621,P<0.05)(圖1)。
 圖1
不同DHA濃度下BK通道電流圖。O:通道開放;C:通道關閉
圖1
不同DHA濃度下BK通道電流圖。O:通道開放;C:通道關閉
Western blot檢測結果顯示,對照組、低劑量組、高劑量組RASMCs的BK通道中β1亞基相對蛋白表達量比較,差異無統計學意義(F=11.657,P>0.05)(圖2)。
 圖2
3組RASMCs的BK通道β1亞基相對蛋白表達量比較
圖2
3組RASMCs的BK通道β1亞基相對蛋白表達量比較
3 討論
BK通道由孔道形成亞基α與調節亞基β組成,一個α亞單位結合一個β亞單位,形成四聚體[12]。BK通道主要受細胞跨膜電位及細胞內鈣離子濃度的影響,正常情況下BK通道激活后鉀離子外流,產生超極化,抑制電壓依賴性鈣離子通道開放,繼而鈣離子內流減少,引起血管平滑肌舒張,故BK通道功能主要為參與血管的舒張[13]。本研究采用單通道膜片鉗技術研究不同濃度DHA對正常RASMCs的BK通道NP0的影響。結果表明,隨著DHA濃度的增高,BK通道的NP0增高。這說明DHA可激活BK通道。因為單通道膜片鉗技術是在無細胞內環境的條件下記錄BK通道開放電流的,故該實驗結果表明DHA激活BK通道的機制可能是DHA與BK通道作用后直接激活所致,但其作用機制尚不清楚。由于BK通道具有電壓依賴及鈣離子依賴性,因此我們推測DHA可能通過增加鈣離子敏感性激活BK通道,其機制有待進一步研究。
BK通道亞單位尤其是調節亞基β1對BK通道的動力學和鈣離子敏感性起重要調節作用[14,15]。因此,本研究觀察了不同濃度DHA對RASMCs的BK通道β1亞基表達的影響。結果表明,不同濃度DHA對RASMCs的BK通道β1亞基蛋白表達沒有影響。出現上述陰性結果的原因可能與以下幾個方面有關:(1)本研究設置的DHA濃度是根據美國心臟協會建議成人每日服用1 g左右n-3 PUFA推測出來的,用于細胞實驗有一定不確定性;(2)DHA對BK通道的激活作用可能不通過影響其亞單位表達來實現,而是直接作用或激活其他途徑等[16];(3)DHA對BK通道的激活作用可能本身具有瞬效性,并不具有長期的作用能力。
本研究結果表明,DHA可直接激活RASMCs的BK通道,增加視網膜動脈BK通道的NP0,但DHA對視網膜動脈BK通道亞單位表達無明顯影響。提示DHA可能并非通過影響BK通道亞單位的表達激活BK通道,而是通過與BK通道作用后直接激活,從而擴張視網膜動脈,對視網膜動脈起保護作用。但本研究也存在一定局限性。首先,本研究只基于細胞層面,未能構建動物灌胃模型去探討DHA對BK通道的激活是否具有長效作用,并且人為構建的細胞環境與動物體內實際內環境有一定差別。其次,膜片鉗技術主要分為單通道及全細胞實驗技術,本研究只采用了單通道膜片鉗技術探討了DHA對RASMCs細胞膜上BK通道的直接作用,而未行全細胞膜片鉗技術研究兩者對完整細胞膜上BK通道電流密度的影響。在接下來的研究中,我們將繼續完善細胞實驗,測定DHA對BK通道亞單位基因表達的影響;同時進行膜片鉗全細胞實驗測定BK通道電流密度的改變。更重要的是構建動物灌胃模型,分離消化RASMCs,并同時進行上述研究獲得更為全面穩定的結果,進而闡明DHA對視網膜動脈BK通道的作用機制,為未來研究各種病理狀態下視網膜動脈BK通道變化提供實驗基礎。