引用本文: 呂喆, 陳亦棋, 沈麗君, 林麗, 陳立鋒, 李亮, 吳韓飛, 黎楚嵐, 毛劍波. 2型糖尿病患者糖尿病視網膜病變風險預測模型的建立和初步驗證. 中華眼底病雜志, 2017, 33(3): 257-261. doi: 10.3760/cma.j.issn.1005-1015.2017.03.009 復制
目前糖尿病(DM)視網膜病變(DR)早期篩查主要依靠眼底檢查以及眼底彩色照相,但由于專業眼底檢查與診斷需要一定的學習曲線,全科醫師對DM患者進行眼底檢查與DR診斷受到一定限制。廣泛DR篩查需投入大量資源[1],我國DM人群基數較大,因此需要建立簡單有效的風險評估策略以明確DR的高風險人群。國外文獻報道,研究者根據DR全身相關風險因素建立統計學模型以評估和預測DR的發生[2-4]。其預測模型納入的風險因素指標主要為患者全身相關因素如DM病程、糖化血紅蛋白(HbA1c)、體重指數(BMI)、年齡、血壓、尿蛋白等。而近年文獻報道,在DM患者中,眼軸長度(AL)也是DR發病的重要影響因素。AL越長,DR發病風險越低;同一DM患者雙眼DR發病風險因AL的影響而產生差異[5-7]。為此,本研究納入DM患者的全身相關風險因素及AL,擬建立一個簡單有效的風險預測模型,以期能有效預測單眼DR的患病情況。
1 對象和方法
回顧性病例系列研究。2016年1~11月在我院就診的2型DM(T2DM)患者315例630只眼納入研究。其中,男性132例264只眼;女性183例366只眼。年齡30~91歲,平均年齡(67.28±12.17)歲。DM病程2周~40年,平均DM病程(10.86±7.81)年。所有患者符合T2DM診斷標準[8]。納入標準:(1)隨機血糖≥11.1 mmol/L或空腹血糖(FPG)≥7.0 mmol/L。排除標準:(1)1型DM;(2)晶狀體混濁程度影響眼底檢查;(3)既往有眼內激光光凝史和眼部手術史;(4)屈光間質混濁程度不能測量AL。
第三方統計人員根據隨機數字表法將患者隨機分為模型組和檢驗組,分別為252例504只眼、63例126只眼。參照文獻[9-11]納入相關指標。詳細記錄患者性別、年齡、DM病程、學歷;測量身高、體重并計算BMI,BMI=體重(kg)/身高(m)2(表1)。同時進行FBG、HbA1c、血肌酐、血尿酸、甘油三脂(TG)、總膽固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)和尿蛋白等實驗室檢查。血壓檢查,靜息5 min坐位連續測量3次,取平均值。血液及尿液標本眼科檢查后2 d內采集,由本院檢驗中心檢測并詳細記錄結果(表2,3)。
采用日本Canon公司D80免散瞳數碼照相機,拍攝以黃斑中心凹為中心45°后極部彩色眼底像;同時散瞳后行眼底檢查。黃斑水腫者行光相干斷層掃描檢查;重度非增生型DR(NPDR)以及存在新生血管的患者行熒光素眼底血管造影檢查。根據我國糖尿病視網膜病變臨床診療指南(2014年)[9]對DR進行診斷和分期。由另一名眼底病專科醫師對采集的圖像進行進行判讀,對不確定診斷者提交第三名眼底專家進行判讀。采用德國Carl Zeiss公司IOL-Master測量患者雙眼AL,連續測量3次取平均值。模型組、檢驗組患者右眼AL分別為(23.81±2.37)、(23.52±1.72)mm,左眼AL分別為(23.64±2.23)、(23.56±1.68)mm。
采用SPSS 19.0統計軟件進行統計學分析處理。模型組、檢驗組患者基本信息中符合正態分布的數據以均數±標準差( )表示,不符合正態分布數據采用四分位數間距表示。運用單因素logistic回歸分析模型組患者DR發生的相關風險因素,并進一步行多因素logistic回歸分析明確DR發生的獨立風險因素,控制混雜偏倚。根據相關風險因素的回歸系數建立回歸方程即風險預測模型。根據受試者工作特征曲線(ROC曲線)確定方程的曲線下面積,以約登指數(敏感性+特異性–1)最大為標準確定風險預測模型的診斷臨界值。將檢驗組患者相關參數帶入風險預測模型,計算預測結果,如預測結果的評分高于診斷臨界值則預測為有DR,低于診斷臨界值則預測為非DR。計算風險預測模型用于預測DR的敏感性和特異性。敏感性=預測結果為DR的眼數/實際DR的眼數;特異性=預測結果為非DR的眼數/實際非DR的眼數。并在檢驗組中運用評分結果作ROC曲線,評估風險預測模型的預測價值。ROC曲線下面積:0.5~0.7為診斷價值較低;0.8~0.9 為診斷價值中等;>0.9為診斷價值較高[12]。
2 結果
630只眼中,DR 215只眼。其中,NPDR 115只眼,增生型DR(PDR) 100只眼。模型組504只眼中,DR 170只眼,其中NPDR、PDR分別為78、92只眼;非DR 334只眼。檢驗組126只眼中,DR 45只眼,其中NPDR、PDR分別為22、23只眼;非DR 81只眼。
單因素logistic回歸分析結果顯示,AL、年齡、DM病程、HbA1c、尿蛋白與DR發生呈顯著相關(P<0.05);其余因素與DR的發生無相關(P>0.05)(表4)。
多因素logistic回歸分析結果顯示,AL(β=–0.196,OR=0.822,P<0.001)、年齡(β=–0.079,OR=0.924,P<0.001)、DM病程(β=0.048,OR=1.049,P=0.001)、HbA1c(β=0.184,OR=1.202,P=0.020)、尿蛋白(β=1.298,OR=3.661,P<0.001)為DR發生的相關風險因素。回歸方程Y=1/[1+e–(7.018–0.196X1–0.079X2+0.048X3+0.148X4+1.298X5)],其中X1=AL、X2=年齡、X3=DM病程、X4=HbA1c、X5=尿蛋白。模型組患者ROC曲線下面積為0.800,診斷臨界值為0.185;簡化回歸方程為7.018–0.196X1–0.079X2+0.048X3+0.148X4+1.298X5后,診斷臨界值為–1.485。
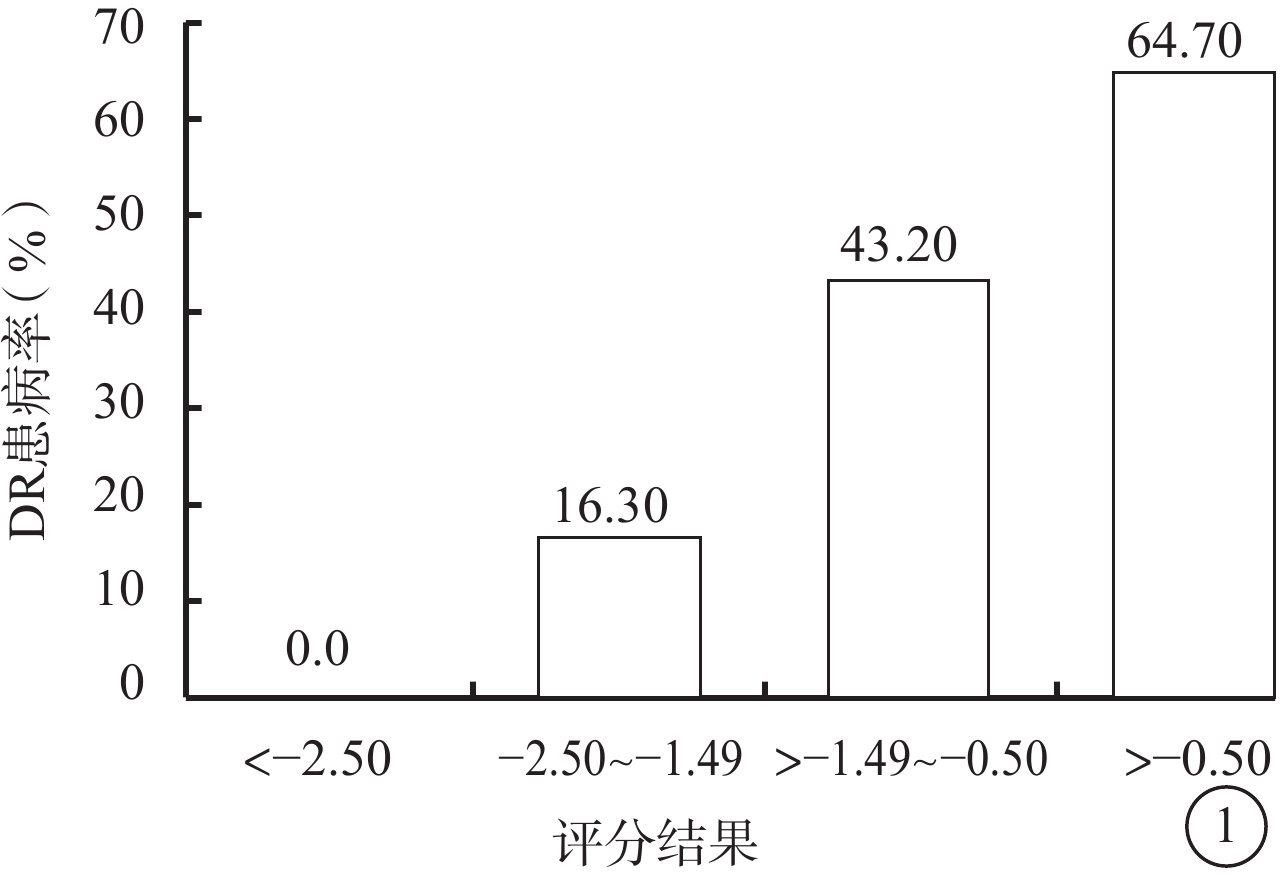
檢驗組患者相關參數帶入上述回歸方程,DR 45只眼中,預測為DR者38只眼,敏感性為84.0%;非DR 81只眼中,預測為非DR者48只眼,特異性為59.0%。ROC曲線下面積為0.756。隨著預測評分結果升高,DR患病率顯著上升,當評分結果小于–2.5時,DR實際患病率為0.0%(圖1)。
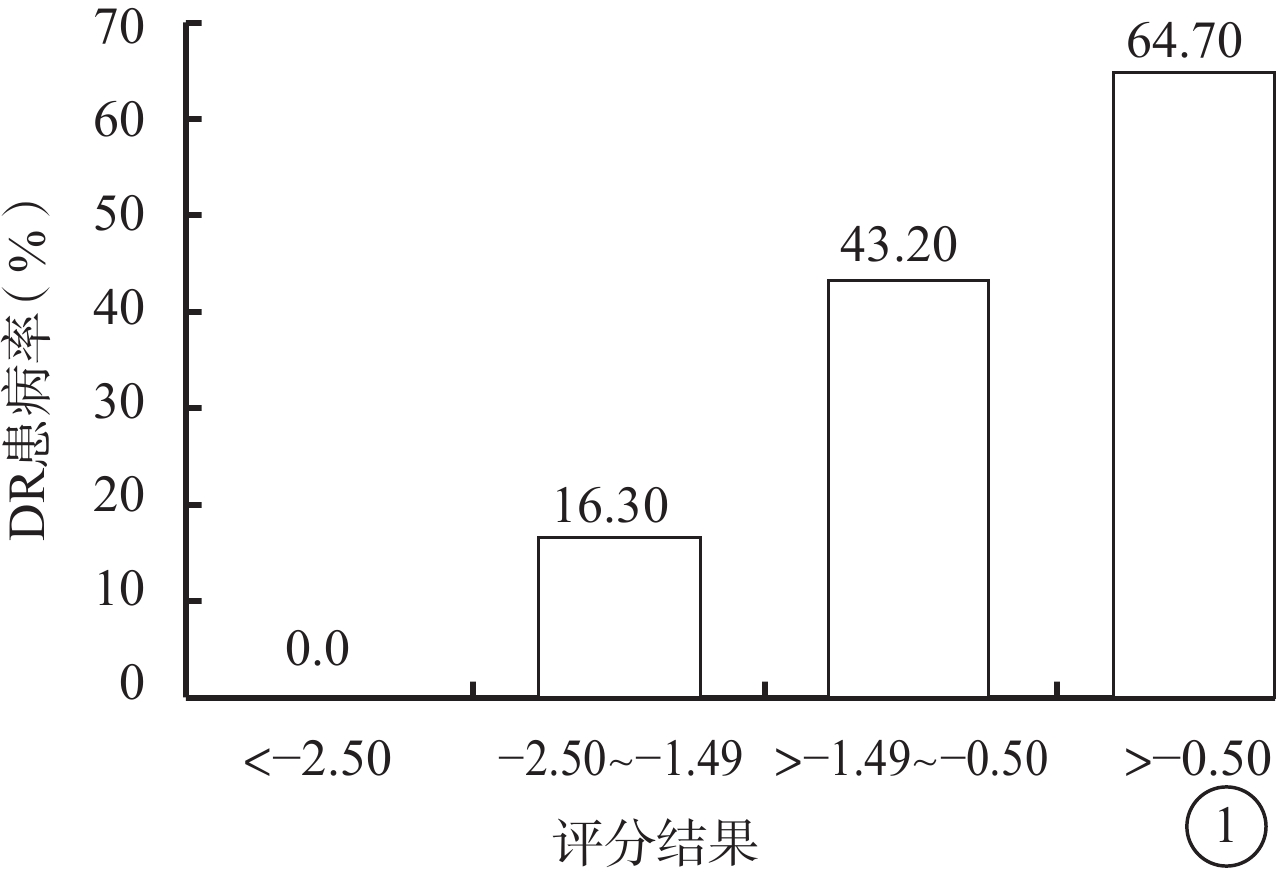 圖1
檢驗組評分結果與DR患病率
圖1
檢驗組評分結果與DR患病率
3 討論
DR發病初期患者可無視力下降等癥狀,而DM患者一般由內科醫師確診。有調查結果顯示,非眼科醫師對DR整體認知程度不高[13]。廣泛DR篩查需要投入大量專業眼科醫師以及眼底檢查設備,這對于醫療資源相對匱乏的地區實施較為困難。因此,本研究擬建立簡單有效的風險評估策略以明確T2DM患者DR的患病風險,為臨床醫師進一步檢查和治療提供參考依據。
本研究分析了DR發病的重要風險因素。并在此基礎上建立DM風險評分預測模型用于預測DR發生的高風險人群。近期多項研究結果表明,長AL是DR的保護因素,同一DM患者長眼軸眼DR患病率顯著低于短眼軸眼[5,6]。而僅根據患者全身相關因素難以評估不同眼別患DR的風險。因此,本研究將AL這一因素納入風險預測模型中,更加合理地評估不同AL患者,以及同一患者不同眼別DR患病風險。本研究結果顯示,長AL是DR發生的保護因素,這與以往研究結果相一致[14,15]。其可能的原因為:(1)AL增長可以使視網膜血流減低,從而減輕血管壁的滲漏[16];(2)長AL尤其是病理性近視患者的視網膜和脈絡膜處于萎縮狀態,外層視網膜代謝和耗氧量下降,從而減少因缺氧引起的一些炎癥因子的釋放以及促血管生成因子如血管內皮生長因子(VEGF)的產生[17];(3)近視患者尤其是病理性近視患者常常更早發生玻璃體液化和玻璃體不完全后脫離(PVD)[18],而有研究表明PVD可以減少發生新生血管和PDR的風險[19]。這是由于PVD減少了新生血管增生的支架并有利于玻璃體腔內氧氣的擴散。
本研究發現DR患病風險與患病年齡呈負相關,即DR患病年齡越大,DR患病風險越低,與以往研究結果相一致[20]。我們考慮這可能與年齡較大的患者視網膜血管的代謝水平以及耗氧量降低有關。同時,本研究表明DM病程也是DR患病的重要風險因素。這是由于DM患者長期處于高血糖微環境中,增加了蛋白激酶C的活化,增加了VEGF的生成,從而促進DR的發生[21]。
本研究還發現HbA1c與DR的發生有顯著相關性,與既往研究結果一致[22]。此外,本研究結果還顯示,尿蛋白也是DR發病的重要風險因素,而血肌酐和尿素氮與DR發生并不呈顯著相關性。尿蛋白可以反應全身其他各個器官的微血管受損情況。Dowse等[23]發現75%的有大量蛋白尿的患者同時患有DR。
有研究表明BMI、收縮壓、TC、TG等是DR發病的風險因素,但結果也存在一定爭議。如有研究表明脂質成分與DR的發病有顯著的相關性[24],而另一項研究則表明兩者并沒有顯著相關[25]。本研究多因素回歸分析結果也未顯示呈顯著相關,因此未納入預測模型中。
本研究根據DR相關風險因素建立統計學模型用于預測DR的發生。模型組患眼ROC曲線下面積為0.800,檢驗組患眼ROC曲線下面積為0.756,預測價值中等。近年來,國外也有部分研究建立DR風險預測指標。Cichosz等[3]研究納入HbA1c、BMI、腰圍、年齡、收縮壓、尿蛋白、尿肌酐等7項指標建立風險預測模型,結果顯示ROC曲線下面積為0.740,而僅納入HbA1c時ROC曲線下面積為0.610。Azizi-Soleiman等[4]納入DM病程、HbA1c、隨機血糖、收縮壓和尿蛋白建立風險預測模型,其ROC曲線下面積為0.760。Aspelund等[26]建立的風險預測模型納入指標包括HbA1c、收縮壓、性別以及DR分級,根據風險預測結果可以減少59%的復查次數。既往研究主要納入全身相關因素,而本研究首次將AL納入預測模型中,能更加全面地評估不同AL患者DR的發生風險。這對于雙眼高度近視以及雙眼屈光參差的DM患者DR發生風險的預測有重要的意義。
本研究尚存在一些不足:(1)本研究為單中心研究,并非大樣本流行病學調查結果,納入人群為在我院就診患者,存在選擇偏倚;(2)納入樣本量有限,因此適用的人群范圍有限,能否適用于其他人群尤其是篩查人群有待更大樣本量的數據進一步證實;(3)本預測模型并不能明確DR的實際發生情況而是根據DR的相關風險因素起到了風險預測的作用。本研究為探索性研究,且目前尚未見有相關預測模型的金標準報道,期待今后對普適的大樣本,多中心的研究進行進一步完善并提高模型的預測價值。
目前糖尿病(DM)視網膜病變(DR)早期篩查主要依靠眼底檢查以及眼底彩色照相,但由于專業眼底檢查與診斷需要一定的學習曲線,全科醫師對DM患者進行眼底檢查與DR診斷受到一定限制。廣泛DR篩查需投入大量資源[1],我國DM人群基數較大,因此需要建立簡單有效的風險評估策略以明確DR的高風險人群。國外文獻報道,研究者根據DR全身相關風險因素建立統計學模型以評估和預測DR的發生[2-4]。其預測模型納入的風險因素指標主要為患者全身相關因素如DM病程、糖化血紅蛋白(HbA1c)、體重指數(BMI)、年齡、血壓、尿蛋白等。而近年文獻報道,在DM患者中,眼軸長度(AL)也是DR發病的重要影響因素。AL越長,DR發病風險越低;同一DM患者雙眼DR發病風險因AL的影響而產生差異[5-7]。為此,本研究納入DM患者的全身相關風險因素及AL,擬建立一個簡單有效的風險預測模型,以期能有效預測單眼DR的患病情況。
1 對象和方法
回顧性病例系列研究。2016年1~11月在我院就診的2型DM(T2DM)患者315例630只眼納入研究。其中,男性132例264只眼;女性183例366只眼。年齡30~91歲,平均年齡(67.28±12.17)歲。DM病程2周~40年,平均DM病程(10.86±7.81)年。所有患者符合T2DM診斷標準[8]。納入標準:(1)隨機血糖≥11.1 mmol/L或空腹血糖(FPG)≥7.0 mmol/L。排除標準:(1)1型DM;(2)晶狀體混濁程度影響眼底檢查;(3)既往有眼內激光光凝史和眼部手術史;(4)屈光間質混濁程度不能測量AL。
第三方統計人員根據隨機數字表法將患者隨機分為模型組和檢驗組,分別為252例504只眼、63例126只眼。參照文獻[9-11]納入相關指標。詳細記錄患者性別、年齡、DM病程、學歷;測量身高、體重并計算BMI,BMI=體重(kg)/身高(m)2(表1)。同時進行FBG、HbA1c、血肌酐、血尿酸、甘油三脂(TG)、總膽固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)和尿蛋白等實驗室檢查。血壓檢查,靜息5 min坐位連續測量3次,取平均值。血液及尿液標本眼科檢查后2 d內采集,由本院檢驗中心檢測并詳細記錄結果(表2,3)。
采用日本Canon公司D80免散瞳數碼照相機,拍攝以黃斑中心凹為中心45°后極部彩色眼底像;同時散瞳后行眼底檢查。黃斑水腫者行光相干斷層掃描檢查;重度非增生型DR(NPDR)以及存在新生血管的患者行熒光素眼底血管造影檢查。根據我國糖尿病視網膜病變臨床診療指南(2014年)[9]對DR進行診斷和分期。由另一名眼底病專科醫師對采集的圖像進行進行判讀,對不確定診斷者提交第三名眼底專家進行判讀。采用德國Carl Zeiss公司IOL-Master測量患者雙眼AL,連續測量3次取平均值。模型組、檢驗組患者右眼AL分別為(23.81±2.37)、(23.52±1.72)mm,左眼AL分別為(23.64±2.23)、(23.56±1.68)mm。
采用SPSS 19.0統計軟件進行統計學分析處理。模型組、檢驗組患者基本信息中符合正態分布的數據以均數±標準差( )表示,不符合正態分布數據采用四分位數間距表示。運用單因素logistic回歸分析模型組患者DR發生的相關風險因素,并進一步行多因素logistic回歸分析明確DR發生的獨立風險因素,控制混雜偏倚。根據相關風險因素的回歸系數建立回歸方程即風險預測模型。根據受試者工作特征曲線(ROC曲線)確定方程的曲線下面積,以約登指數(敏感性+特異性–1)最大為標準確定風險預測模型的診斷臨界值。將檢驗組患者相關參數帶入風險預測模型,計算預測結果,如預測結果的評分高于診斷臨界值則預測為有DR,低于診斷臨界值則預測為非DR。計算風險預測模型用于預測DR的敏感性和特異性。敏感性=預測結果為DR的眼數/實際DR的眼數;特異性=預測結果為非DR的眼數/實際非DR的眼數。并在檢驗組中運用評分結果作ROC曲線,評估風險預測模型的預測價值。ROC曲線下面積:0.5~0.7為診斷價值較低;0.8~0.9 為診斷價值中等;>0.9為診斷價值較高[12]。
2 結果
630只眼中,DR 215只眼。其中,NPDR 115只眼,增生型DR(PDR) 100只眼。模型組504只眼中,DR 170只眼,其中NPDR、PDR分別為78、92只眼;非DR 334只眼。檢驗組126只眼中,DR 45只眼,其中NPDR、PDR分別為22、23只眼;非DR 81只眼。
單因素logistic回歸分析結果顯示,AL、年齡、DM病程、HbA1c、尿蛋白與DR發生呈顯著相關(P<0.05);其余因素與DR的發生無相關(P>0.05)(表4)。
多因素logistic回歸分析結果顯示,AL(β=–0.196,OR=0.822,P<0.001)、年齡(β=–0.079,OR=0.924,P<0.001)、DM病程(β=0.048,OR=1.049,P=0.001)、HbA1c(β=0.184,OR=1.202,P=0.020)、尿蛋白(β=1.298,OR=3.661,P<0.001)為DR發生的相關風險因素。回歸方程Y=1/[1+e–(7.018–0.196X1–0.079X2+0.048X3+0.148X4+1.298X5)],其中X1=AL、X2=年齡、X3=DM病程、X4=HbA1c、X5=尿蛋白。模型組患者ROC曲線下面積為0.800,診斷臨界值為0.185;簡化回歸方程為7.018–0.196X1–0.079X2+0.048X3+0.148X4+1.298X5后,診斷臨界值為–1.485。
檢驗組患者相關參數帶入上述回歸方程,DR 45只眼中,預測為DR者38只眼,敏感性為84.0%;非DR 81只眼中,預測為非DR者48只眼,特異性為59.0%。ROC曲線下面積為0.756。隨著預測評分結果升高,DR患病率顯著上升,當評分結果小于–2.5時,DR實際患病率為0.0%(圖1)。
 圖1
檢驗組評分結果與DR患病率
圖1
檢驗組評分結果與DR患病率
3 討論
DR發病初期患者可無視力下降等癥狀,而DM患者一般由內科醫師確診。有調查結果顯示,非眼科醫師對DR整體認知程度不高[13]。廣泛DR篩查需要投入大量專業眼科醫師以及眼底檢查設備,這對于醫療資源相對匱乏的地區實施較為困難。因此,本研究擬建立簡單有效的風險評估策略以明確T2DM患者DR的患病風險,為臨床醫師進一步檢查和治療提供參考依據。
本研究分析了DR發病的重要風險因素。并在此基礎上建立DM風險評分預測模型用于預測DR發生的高風險人群。近期多項研究結果表明,長AL是DR的保護因素,同一DM患者長眼軸眼DR患病率顯著低于短眼軸眼[5,6]。而僅根據患者全身相關因素難以評估不同眼別患DR的風險。因此,本研究將AL這一因素納入風險預測模型中,更加合理地評估不同AL患者,以及同一患者不同眼別DR患病風險。本研究結果顯示,長AL是DR發生的保護因素,這與以往研究結果相一致[14,15]。其可能的原因為:(1)AL增長可以使視網膜血流減低,從而減輕血管壁的滲漏[16];(2)長AL尤其是病理性近視患者的視網膜和脈絡膜處于萎縮狀態,外層視網膜代謝和耗氧量下降,從而減少因缺氧引起的一些炎癥因子的釋放以及促血管生成因子如血管內皮生長因子(VEGF)的產生[17];(3)近視患者尤其是病理性近視患者常常更早發生玻璃體液化和玻璃體不完全后脫離(PVD)[18],而有研究表明PVD可以減少發生新生血管和PDR的風險[19]。這是由于PVD減少了新生血管增生的支架并有利于玻璃體腔內氧氣的擴散。
本研究發現DR患病風險與患病年齡呈負相關,即DR患病年齡越大,DR患病風險越低,與以往研究結果相一致[20]。我們考慮這可能與年齡較大的患者視網膜血管的代謝水平以及耗氧量降低有關。同時,本研究表明DM病程也是DR患病的重要風險因素。這是由于DM患者長期處于高血糖微環境中,增加了蛋白激酶C的活化,增加了VEGF的生成,從而促進DR的發生[21]。
本研究還發現HbA1c與DR的發生有顯著相關性,與既往研究結果一致[22]。此外,本研究結果還顯示,尿蛋白也是DR發病的重要風險因素,而血肌酐和尿素氮與DR發生并不呈顯著相關性。尿蛋白可以反應全身其他各個器官的微血管受損情況。Dowse等[23]發現75%的有大量蛋白尿的患者同時患有DR。
有研究表明BMI、收縮壓、TC、TG等是DR發病的風險因素,但結果也存在一定爭議。如有研究表明脂質成分與DR的發病有顯著的相關性[24],而另一項研究則表明兩者并沒有顯著相關[25]。本研究多因素回歸分析結果也未顯示呈顯著相關,因此未納入預測模型中。
本研究根據DR相關風險因素建立統計學模型用于預測DR的發生。模型組患眼ROC曲線下面積為0.800,檢驗組患眼ROC曲線下面積為0.756,預測價值中等。近年來,國外也有部分研究建立DR風險預測指標。Cichosz等[3]研究納入HbA1c、BMI、腰圍、年齡、收縮壓、尿蛋白、尿肌酐等7項指標建立風險預測模型,結果顯示ROC曲線下面積為0.740,而僅納入HbA1c時ROC曲線下面積為0.610。Azizi-Soleiman等[4]納入DM病程、HbA1c、隨機血糖、收縮壓和尿蛋白建立風險預測模型,其ROC曲線下面積為0.760。Aspelund等[26]建立的風險預測模型納入指標包括HbA1c、收縮壓、性別以及DR分級,根據風險預測結果可以減少59%的復查次數。既往研究主要納入全身相關因素,而本研究首次將AL納入預測模型中,能更加全面地評估不同AL患者DR的發生風險。這對于雙眼高度近視以及雙眼屈光參差的DM患者DR發生風險的預測有重要的意義。
本研究尚存在一些不足:(1)本研究為單中心研究,并非大樣本流行病學調查結果,納入人群為在我院就診患者,存在選擇偏倚;(2)納入樣本量有限,因此適用的人群范圍有限,能否適用于其他人群尤其是篩查人群有待更大樣本量的數據進一步證實;(3)本預測模型并不能明確DR的實際發生情況而是根據DR的相關風險因素起到了風險預測的作用。本研究為探索性研究,且目前尚未見有相關預測模型的金標準報道,期待今后對普適的大樣本,多中心的研究進行進一步完善并提高模型的預測價值。