引用本文: 張海濤, 張杰, 王峰, 任艷凡, 王保君. 貝伐單抗膜聯蛋白A5脂質體兔眼點眼后眼內組織藥物濃度變化和藥代動力學特征. 中華眼底病雜志, 2017, 33(2): 176-180. doi: 10.3760/cma.j.issn.1005-1015.2017.02.015 復制
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是治療眼底新生血管性疾病的主要方法,但由于藥物半衰期(t?)較短,通常需要多次注射以維持療效[1,2]。而多次玻璃體腔注射可能引起眼內炎、玻璃體積血等相關并發癥[3-6]。滴眼液局部點眼方式簡單、安全,但因眼部存在各種生物學屏障,使抗VEGF藥物這類蛋白類藥物經點眼途徑無法有效穿透眼部屏障,導致眼內無法達到有效藥物濃度[7]。膜聯蛋白A5是一種鈣離子依賴的磷脂結合蛋白,除了與抗凝血及細胞凋亡有關外,其在鈣離子存在的條件下可與磷脂酰絲氨酸結合,迅速形成三聚體[8]。膜聯蛋白A5三聚體形成與促進肌動蛋白非依賴性的內吞囊泡形成有關,能較為容易地穿過血管障礙并在角膜上皮內高濃度存在。據此推斷膜聯蛋白A5這一特性可用來增強藥物分子穿透眼內組織的能力。為提高藥物局部應用的眼內通透性,本研究通過制備一種新型貝伐單抗膜聯蛋白A5脂質緩釋制劑,利用新西蘭大白兔局部點眼,觀察眼內各組織藥物濃度變化并進行了藥代動力學分析。現將結果報道如下。
1 材料和方法
1.1 實驗動物、試劑及脂質體制備
健康無眼病的成年新西蘭大白兔(鄭州大學醫學院動物中心提供,動物使用許可證號SCXK20140037)105只,雌雄不限,體重(2.5±0.1)kg。25 mg/ml貝伐單抗注射液(商品名:安維汀,美國Genentech公司),磷酸鹽緩沖液(PBS)干粉(北京索萊寶科技有限公司),水合氯醛(鄭州天翔生物制品有限公司),酶聯免疫吸附試驗(ELISA)試劑盒(土耳其Matriks Biotechnology公司),全波長掃描酶標儀(美國Thermo公司),超低溫冰箱(型號991,美國Thermo公司)。
貝伐單抗脂質體由磷脂制備的脂質體采用雙水化法制成[9]。取1 ml脂質體微泡和1 ml貝伐單抗混勻后經冷凍干燥、水化并超聲溶解后制備成貝伐單抗脂質體。貝伐單抗膜聯蛋白A5脂質體由貝伐單抗脂質體微泡加膜聯蛋白A5通過生物素與卵白素橋接法制備,攪拌器上低速旋轉制成[10]。
1.2 實驗分組、給藥及樣品采集、ELISA測定
采用隨機數字表法將兔分為貝伐單抗膜聯蛋白A5脂質體組(A組)、貝伐單抗脂質體組(B組)、貝伐單抗組(C組),每組35只兔。分別給予貝伐單抗膜聯蛋白A5脂質體、貝伐單抗脂質體、貝伐單抗50 μl點眼。為防止點眼后雙眼之間眼內藥物濃度互相干擾,每只兔選擇右眼點眼。
點眼后5、15、30 min及1、2、4、8 h,各組取5只兔以過量10%水合氯醛于耳緣靜脈注射處死,摘取眼球,用PBS沖洗2次。以1.5 ml注射器抽取房水,置于事先標記好的離心管中,將眼球和裝有房水的離心管以標本袋裝好,置入–80 ℃冰箱,冷凍過夜。擇日在常溫下取出眼球標本,于眼球后極部位以“十”字形切開眼球壁,剝離冰凍的眼內容物;切取冰凍玻璃體,置入事先標記好的離心管中;在后半部眼球壁組織,雙手各持一顯微鑷分別夾取眼球壁內側視網膜脈絡膜組織和后半部眼球壁切口處并進行鈍性分離,使視網膜脈絡膜組織與鞏膜分離,將分離出來的視網膜脈絡膜組織置入另一事先標記好的離心管中備用;將–80 ℃冰箱中的房水和玻璃體樣本取出,室溫下融化,備用。
貝伐單抗ELISA試劑盒室溫平衡20 min,嚴格按照試劑盒說明書中所述步驟操作。在450 nm波長處測定各孔吸光度[A,舊稱光密度(OD)]值。繪制標準品線性回歸曲線,按曲線方程計算各樣本貝伐單抗濃度值。
1.3 統計學方法
采用SPSS16.0統計學軟件進行統計分析。應用DAS 2.1.1軟件擬合分析3組兔眼房水、玻璃體及視網膜脈絡膜中貝伐單抗的t?、達峰時間(Tmax)、最大藥物濃度(Cmax)及藥-時曲線下面積(AUC0-t)等藥代動力學參數。各時間點3組兔眼房水、玻璃體及視網膜脈絡膜中貝伐單抗濃度變化比較采用單因素方差分析和最小顯著差法兩兩比較檢驗。P<0.05為差異有統計學意義。
2 結果
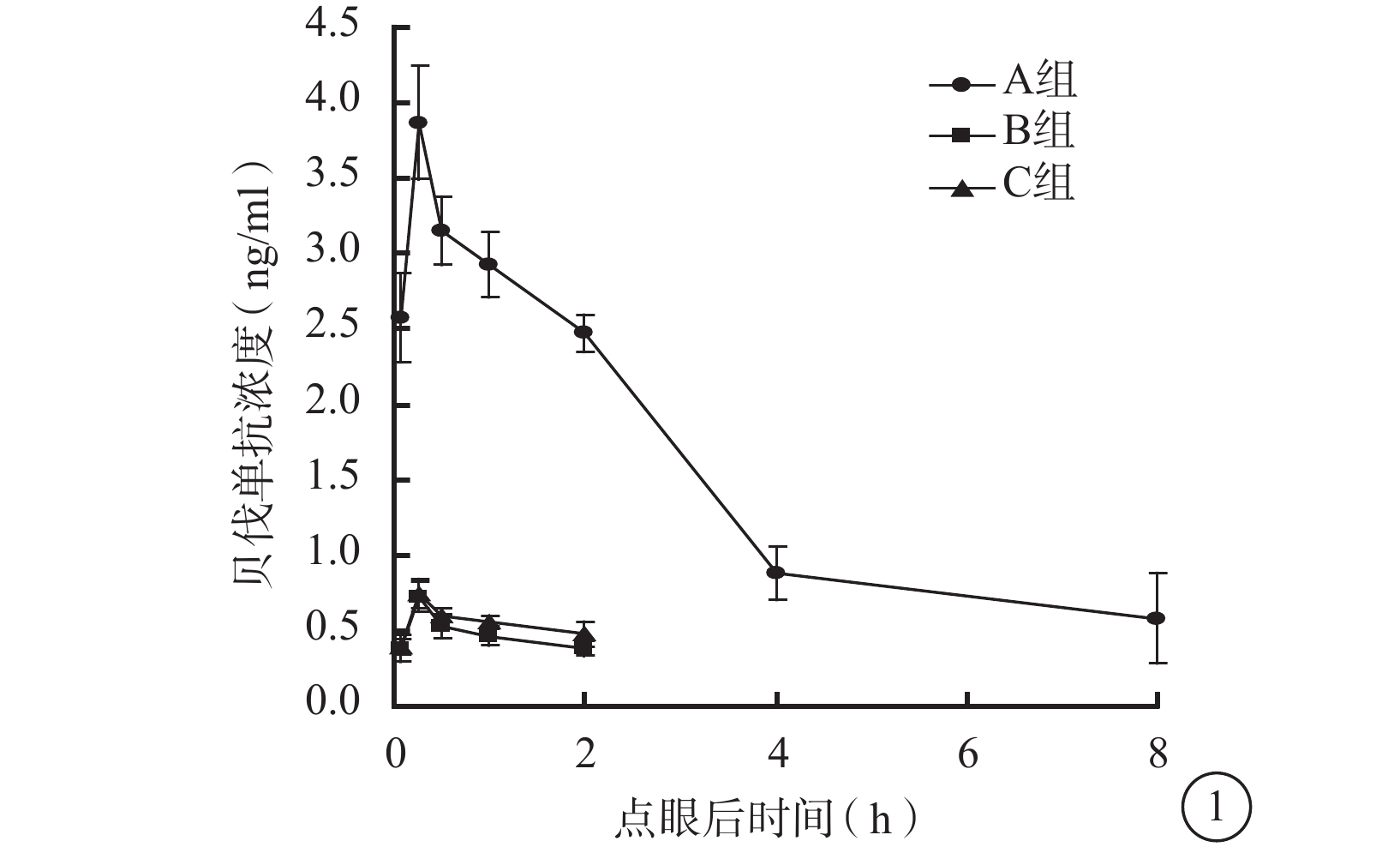
點眼后15 min,3組兔眼房水中貝伐單抗濃度達到峰值;之后隨時間推移,3組兔眼房水中貝伐單抗濃度呈逐漸下降趨勢(圖1)。點眼后5、15、30 min及1、2 h,3組兔眼房水中貝伐單抗濃度比較,差異均有統計學意義(F=255.431、301.061、566.157、563.738、860.455,P<0.01)。組間兩兩比較,A組與B組、A組與C組之間兔眼房水中貝伐單抗濃度比較,差異均有統計學意義(P<0.05);B組和C組之間兔眼房水中貝伐單抗濃度比較,差異無統計學意義(P>0.05)。點眼后4、8 h,A組兔眼房水中貝伐單抗濃度分別降至(0.88±0.18)、(0.59±0.30)ng/ml,而B、C組的兔眼房水中貝伐單抗濃度低至無法測出。
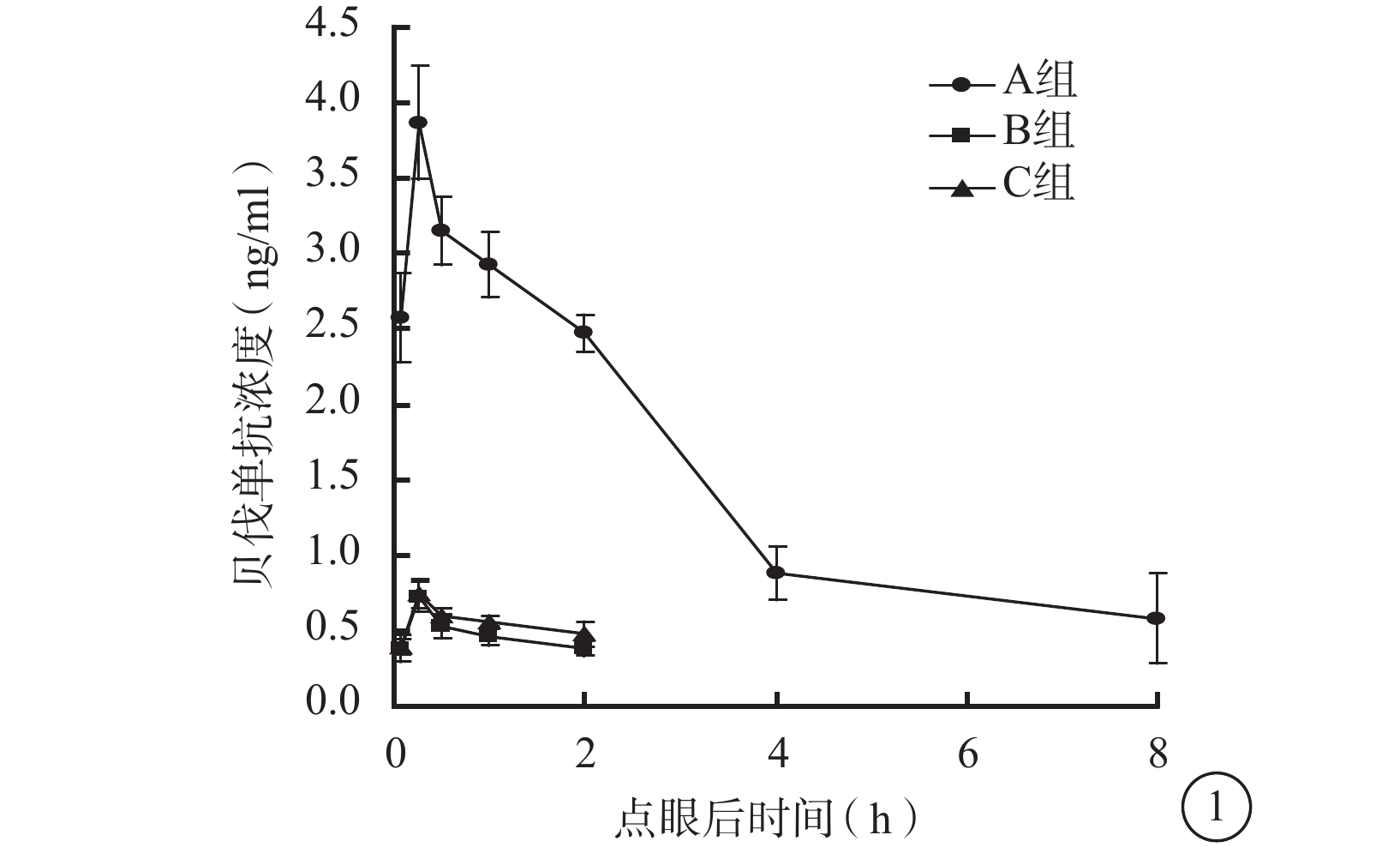 圖1
點眼后不同時間3組兔眼房水中貝伐單抗濃度變化
圖1
點眼后不同時間3組兔眼房水中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼房水中貝伐單抗濃度變化符合一室模型(表1)。
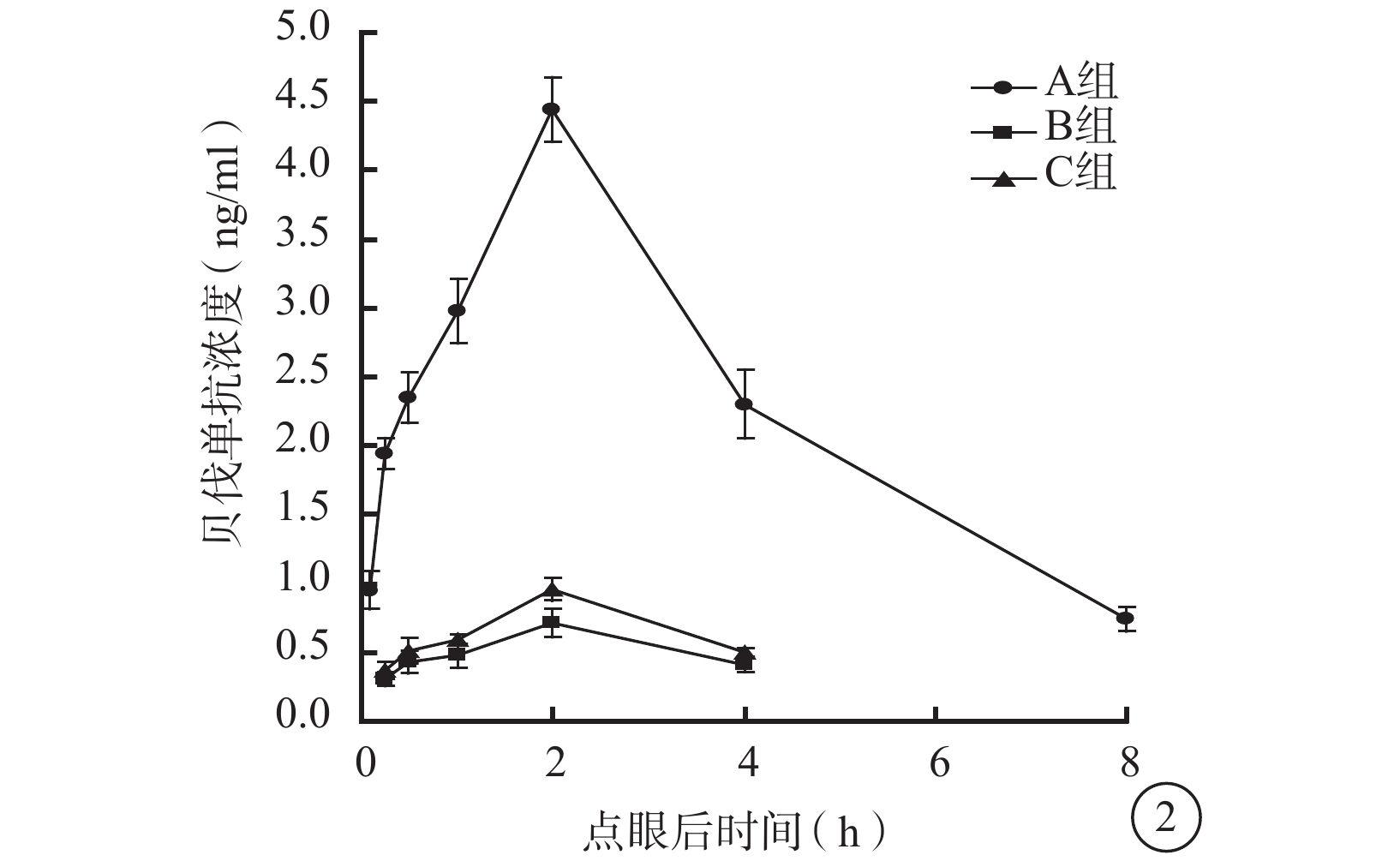
點眼后2 h,3組兔眼玻璃體中貝伐單抗濃度達到峰值;之后3組兔眼玻璃體中貝伐單抗濃度逐漸下降(圖2)。點眼后5 min,A組兔眼玻璃體中貝伐單抗濃度為(0.95±0.14)ng/ml,B、C組兔眼玻璃體中貝伐單抗濃度低至無法測出。點眼后15、30 min及1、2、4 h,3組兔眼玻璃體中貝伐單抗濃度比較,差異均有統計學意義(F=901.952、361.554、475.497、885.997、269.924,P<0.01)。組間兩兩比較,A組與B組、A組與C組之間兔眼玻璃體中貝伐單抗濃度比較,差異均有統計學意義(P<0.05);B組和C組之間兔眼玻璃體中貝伐單抗濃度比較,差異無統計學意義(P>0.05)。點眼后8 h,A組兔眼玻璃體中貝伐單抗濃度降至(0.74±0.09)ng/ml,而B、C組兔眼玻璃體中貝伐單抗濃度低至無法測出。
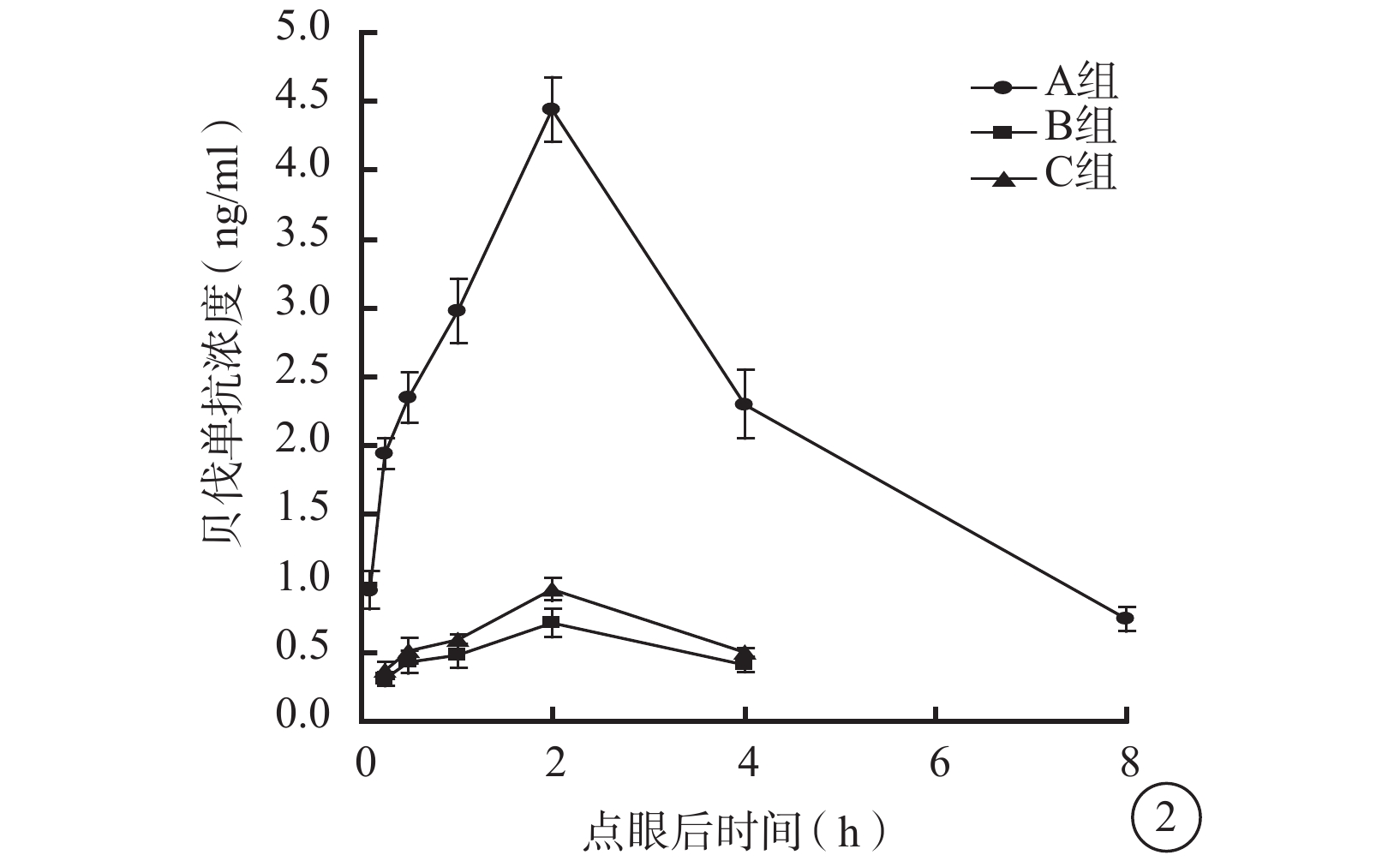 圖2
點眼后不同時間3組兔眼玻璃體中貝伐單抗濃度變化
圖2
點眼后不同時間3組兔眼玻璃體中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼玻璃體中貝伐單抗濃度變化符合二室模型(表2)。
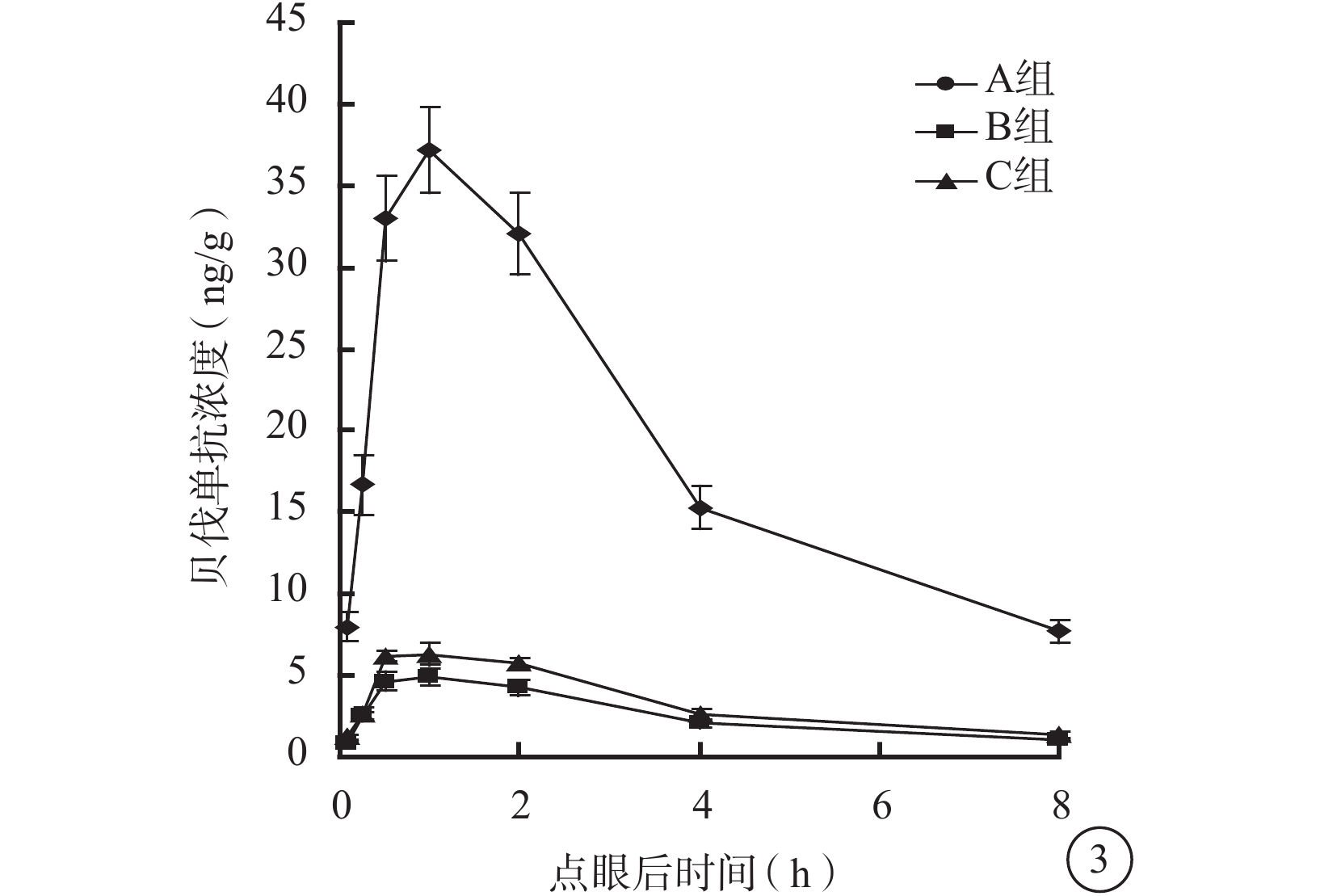
點眼后1 h,A、B、C組兔眼視網膜脈絡膜中貝伐單抗濃度達到峰值;之后3組兔眼視網膜脈絡膜中貝伐單抗濃度隨時間逐漸下降(圖3)。點眼后5、15、30 min及1、2、4、8 h,3組兔眼視網膜脈絡膜中貝伐單抗濃度比較,差異均有統計學意義(F=300.936、278.169、511.022、644.908、565.713、448.134、396.500,P<0.05)。組間兩兩比較,A組與B組、A組與C組之間兔眼視網膜脈絡膜中貝伐單抗濃度比較,差異有統計學意義(P<0.05);B組與C組之間兔眼視網膜脈絡膜中貝伐單抗濃度,差異無統計學意義(P>0.05)。
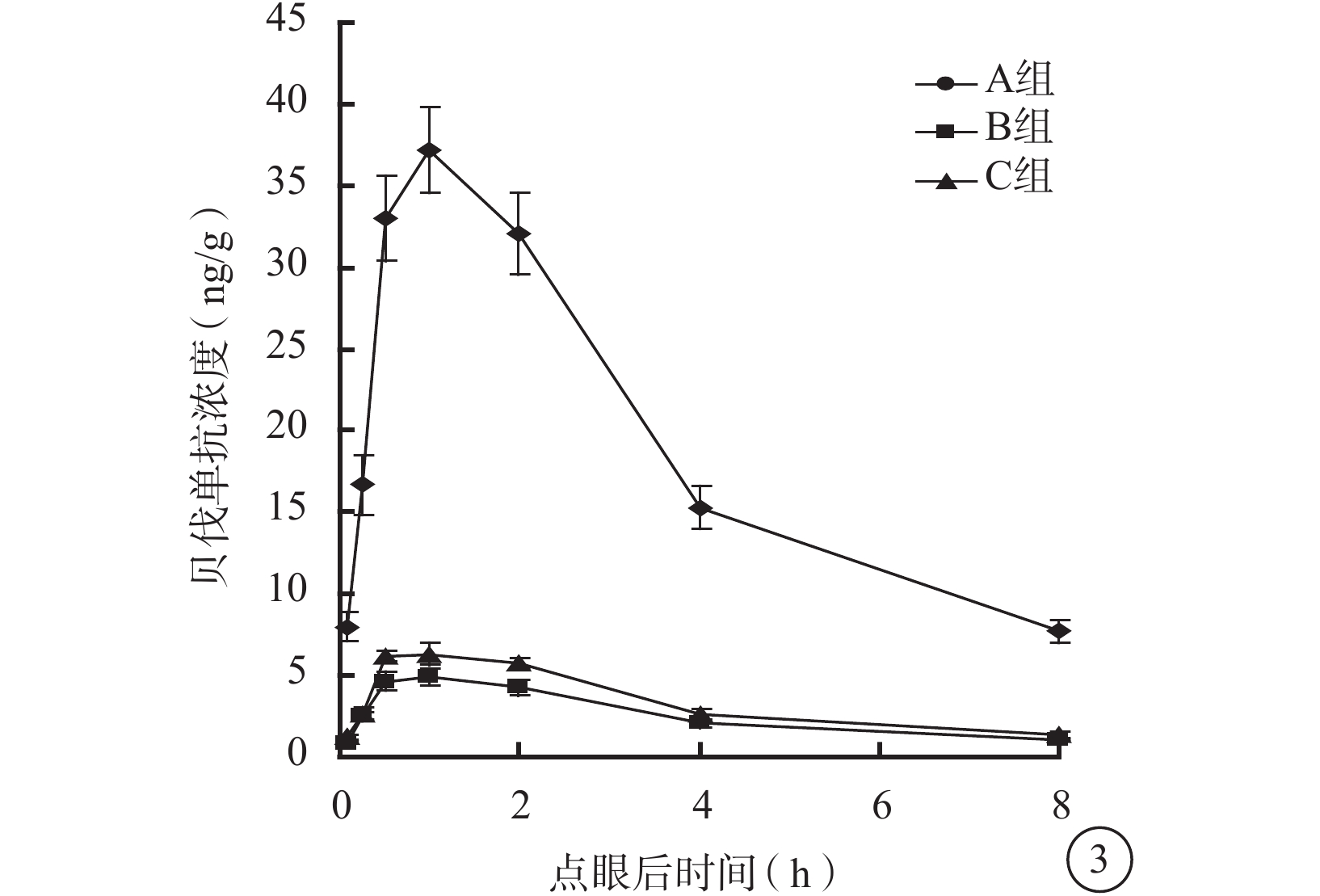 圖3
點眼后不同時間3組兔眼視網膜脈絡膜中貝伐單抗濃度變化
圖3
點眼后不同時間3組兔眼視網膜脈絡膜中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼視網膜脈絡膜中貝伐單抗濃度變化符合二室模型(表3)。
3 討論
本研究結果顯示,貝伐單抗膜聯蛋白A5脂質體對兔單次點眼后,在房水、玻璃體、視網膜脈絡膜中的貝伐單抗濃度在各個測量時間點均高于貝伐單抗脂質體、貝伐單抗局部點眼。進一步的藥代動力學參數擬合分析發現,A組兔接受貝伐單抗膜聯蛋白A5脂質體單次點眼后在房水、玻璃體、視網膜脈絡膜中Tmax分別為15 min及2、1 h,Cmax分別為3.87、4.44 ng/ml及37.16 ng/g,t?分別為1.32、2.62、2.61 h,AUC(0-t)分別為12.02、18.68 ng/ml·h及153.94 ng/g·h。這些結果說明,利用膜聯蛋白A5脂質體可以增加貝伐單抗點眼后的眼部通透性,使得貝伐單抗在眼內各組織內的濃度明顯提高。這與Davis等[10]的研究結論相同。另一方面,本研究通過藥代動力學擬合分析發現,與接受貝伐單抗脂質體點眼的B組和接受貝伐單抗點眼的C組相比,接受貝伐單抗膜聯蛋白A5脂質體點眼的A組Tmax和t?沒有明顯變化。提示膜聯蛋白A5脂質體在增加貝伐單抗點眼后的眼部通透性及眼內生物利用度的同時,并沒有影響貝伐單抗在眼內的其他藥物代謝特征,具體的原因和機制尚需進一步實驗探索。
以往國內外文獻報道主要針對單純的貝伐單抗局部點眼進行藥代動力學研究。Nomoto等[11]應用動物實驗研究發現,貝伐單抗(1.25 mg/0.05 ml)多次點眼后(6次/d,共7 d),虹膜睫狀體、玻璃體及視網膜脈絡膜中貝伐單抗Cmax分別為16.1、1.7、18.2 ng/g,遠低于玻璃體注射后眼內組織的藥物濃度。另外一些研究則認為,貝伐單抗局部點眼角膜通透性很差,甚至無法進入眼內[12,13]。目前許多研究認為貝伐單抗局部用藥,可用于翼狀胬肉、角膜化學傷等眼表疾病的治療[14,15]。我們發現貝伐單抗兔眼單次點眼后眼內濃度較低,可以認為單純的貝伐單抗局部點眼無法有效治療眼后節的新生血管性疾病;而貝伐單抗膜聯蛋白A5脂質體點眼后眼內濃度明顯提高。體外實驗研究發現,貝伐單抗抑制半數新生血管有效濃度為22 ng/g[16]。本研究結果顯示,貝伐單抗膜聯蛋白A5脂質體局部點眼后視網膜脈絡膜中的貝伐單抗濃度可達到37.16 ng/g。這提示貝伐單抗膜聯蛋白A5脂質體點眼對眼底新生血管可能產生抑制作用。
我們還發現,3組兔眼視網膜脈絡膜中貝伐單抗濃度均較房水及玻璃體高。其原因可能在于動物實驗中,局部點眼后一方面藥物直接從角膜穿透入眼內到眼后節,另一方面還會迅速經淚道、鼻腔吸收入全身血管系統或者直接吸收入眼周圍血管,從而進入眼后節組織[10,11]。
本研究將貝伐單抗脂質體作為B組進行對照研究,發現貝伐單抗脂質體點眼后在房水、玻璃體和視網膜脈絡膜中的濃度比單純貝伐單抗點眼的C組稍低,但差異無統計學意義。這種情況可能在于緩釋制劑的制作所需的原料貝伐單抗來源于貝伐單抗注射液,因此在此基礎上制作緩釋制劑均需不同程度的加入其他輔助成分,造成緩釋制劑中的藥物載藥量下降。由于膜聯蛋白增加眼部通透性作用顯著,A組在眼內各組織中的藥物濃度仍然高于B、C組;但僅使用脂質體包裹貝伐單抗的B組,由于不能明顯增加角膜通透性,因此眼內各組織濃度并未明顯高于C組。相反,由于脂質體內貝伐單抗的載藥量下降,造成點眼后眼內各組織藥物濃度可能偏低。如果能夠采購到貝伐單抗原料藥進行制作緩釋藥物可能顯著提高緩釋藥物載藥量,這也是今后研究的努力方向。
本研究結果表明,貝伐單抗膜聯蛋白A5脂質體點眼后在各個時間點的藥物濃度明顯高于貝伐單抗脂質體及貝伐單抗點眼,眼內通透性及生物利用度明顯提高;證實膜聯蛋白A5脂質體能夠促進貝伐單抗通過眼部屏障,使眼內組織內到達一定治療濃度。這為進一步進行貝伐單抗膜聯蛋白A5脂質體點眼治療新生血管眼底病變的臨床研究提供實驗理論基礎。但本研究仍存在一些局限性,如未檢測對側眼內及血液樣本的藥物濃度。盡管以往研究發現,單純貝伐單抗點眼后對側眼內及血液內濃度很低[11]。但膜聯蛋白A5脂質體加入后的情況仍需研究探討,今后應注意完善這方面數據并進行分析。
讀者?作者?編者 關于名詞術語使用規范的要求 學術期刊使用規范的科技名詞術語,對準確傳遞學術信息,支撐科技發展具有重要意義;是否使用已公布的規范名詞也是衡量期刊質量的標準之一。為此,將本刊關于文稿中名詞術語使用規范的要求說明如下:(1)醫學名詞應使用全國科學技術名詞審定委員會公布的名詞。作者可登陸全國科學技術名稱委員會網站(),免費查詢科技名詞并按要求規范使用;(2)尚未通過審定的學科名詞,可選用最新版《醫學主題詞表(MeSH)》、《醫學主題詞注釋字順表》、《中醫藥主題詞表》中的主題詞;(3)對沒有通用譯名的名詞術語于文內第一次出現時應注明原詞;(4)中西藥名以最新版本《中華人民共和國藥典》和《中國藥品通用名稱》(均由中國藥典委員會編寫)為準,英文藥物名稱則采用國際非專利藥名。在題名及正文中藥名一般不得使用商品名,確需使用商品名時應先注明其通用名稱。 本刊編輯部
玻璃體腔注射抗血管內皮生長因子(VEGF)藥物是治療眼底新生血管性疾病的主要方法,但由于藥物半衰期(t?)較短,通常需要多次注射以維持療效[1,2]。而多次玻璃體腔注射可能引起眼內炎、玻璃體積血等相關并發癥[3-6]。滴眼液局部點眼方式簡單、安全,但因眼部存在各種生物學屏障,使抗VEGF藥物這類蛋白類藥物經點眼途徑無法有效穿透眼部屏障,導致眼內無法達到有效藥物濃度[7]。膜聯蛋白A5是一種鈣離子依賴的磷脂結合蛋白,除了與抗凝血及細胞凋亡有關外,其在鈣離子存在的條件下可與磷脂酰絲氨酸結合,迅速形成三聚體[8]。膜聯蛋白A5三聚體形成與促進肌動蛋白非依賴性的內吞囊泡形成有關,能較為容易地穿過血管障礙并在角膜上皮內高濃度存在。據此推斷膜聯蛋白A5這一特性可用來增強藥物分子穿透眼內組織的能力。為提高藥物局部應用的眼內通透性,本研究通過制備一種新型貝伐單抗膜聯蛋白A5脂質緩釋制劑,利用新西蘭大白兔局部點眼,觀察眼內各組織藥物濃度變化并進行了藥代動力學分析。現將結果報道如下。
1 材料和方法
1.1 實驗動物、試劑及脂質體制備
健康無眼病的成年新西蘭大白兔(鄭州大學醫學院動物中心提供,動物使用許可證號SCXK20140037)105只,雌雄不限,體重(2.5±0.1)kg。25 mg/ml貝伐單抗注射液(商品名:安維汀,美國Genentech公司),磷酸鹽緩沖液(PBS)干粉(北京索萊寶科技有限公司),水合氯醛(鄭州天翔生物制品有限公司),酶聯免疫吸附試驗(ELISA)試劑盒(土耳其Matriks Biotechnology公司),全波長掃描酶標儀(美國Thermo公司),超低溫冰箱(型號991,美國Thermo公司)。
貝伐單抗脂質體由磷脂制備的脂質體采用雙水化法制成[9]。取1 ml脂質體微泡和1 ml貝伐單抗混勻后經冷凍干燥、水化并超聲溶解后制備成貝伐單抗脂質體。貝伐單抗膜聯蛋白A5脂質體由貝伐單抗脂質體微泡加膜聯蛋白A5通過生物素與卵白素橋接法制備,攪拌器上低速旋轉制成[10]。
1.2 實驗分組、給藥及樣品采集、ELISA測定
采用隨機數字表法將兔分為貝伐單抗膜聯蛋白A5脂質體組(A組)、貝伐單抗脂質體組(B組)、貝伐單抗組(C組),每組35只兔。分別給予貝伐單抗膜聯蛋白A5脂質體、貝伐單抗脂質體、貝伐單抗50 μl點眼。為防止點眼后雙眼之間眼內藥物濃度互相干擾,每只兔選擇右眼點眼。
點眼后5、15、30 min及1、2、4、8 h,各組取5只兔以過量10%水合氯醛于耳緣靜脈注射處死,摘取眼球,用PBS沖洗2次。以1.5 ml注射器抽取房水,置于事先標記好的離心管中,將眼球和裝有房水的離心管以標本袋裝好,置入–80 ℃冰箱,冷凍過夜。擇日在常溫下取出眼球標本,于眼球后極部位以“十”字形切開眼球壁,剝離冰凍的眼內容物;切取冰凍玻璃體,置入事先標記好的離心管中;在后半部眼球壁組織,雙手各持一顯微鑷分別夾取眼球壁內側視網膜脈絡膜組織和后半部眼球壁切口處并進行鈍性分離,使視網膜脈絡膜組織與鞏膜分離,將分離出來的視網膜脈絡膜組織置入另一事先標記好的離心管中備用;將–80 ℃冰箱中的房水和玻璃體樣本取出,室溫下融化,備用。
貝伐單抗ELISA試劑盒室溫平衡20 min,嚴格按照試劑盒說明書中所述步驟操作。在450 nm波長處測定各孔吸光度[A,舊稱光密度(OD)]值。繪制標準品線性回歸曲線,按曲線方程計算各樣本貝伐單抗濃度值。
1.3 統計學方法
采用SPSS16.0統計學軟件進行統計分析。應用DAS 2.1.1軟件擬合分析3組兔眼房水、玻璃體及視網膜脈絡膜中貝伐單抗的t?、達峰時間(Tmax)、最大藥物濃度(Cmax)及藥-時曲線下面積(AUC0-t)等藥代動力學參數。各時間點3組兔眼房水、玻璃體及視網膜脈絡膜中貝伐單抗濃度變化比較采用單因素方差分析和最小顯著差法兩兩比較檢驗。P<0.05為差異有統計學意義。
2 結果
點眼后15 min,3組兔眼房水中貝伐單抗濃度達到峰值;之后隨時間推移,3組兔眼房水中貝伐單抗濃度呈逐漸下降趨勢(圖1)。點眼后5、15、30 min及1、2 h,3組兔眼房水中貝伐單抗濃度比較,差異均有統計學意義(F=255.431、301.061、566.157、563.738、860.455,P<0.01)。組間兩兩比較,A組與B組、A組與C組之間兔眼房水中貝伐單抗濃度比較,差異均有統計學意義(P<0.05);B組和C組之間兔眼房水中貝伐單抗濃度比較,差異無統計學意義(P>0.05)。點眼后4、8 h,A組兔眼房水中貝伐單抗濃度分別降至(0.88±0.18)、(0.59±0.30)ng/ml,而B、C組的兔眼房水中貝伐單抗濃度低至無法測出。
 圖1
點眼后不同時間3組兔眼房水中貝伐單抗濃度變化
圖1
點眼后不同時間3組兔眼房水中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼房水中貝伐單抗濃度變化符合一室模型(表1)。
點眼后2 h,3組兔眼玻璃體中貝伐單抗濃度達到峰值;之后3組兔眼玻璃體中貝伐單抗濃度逐漸下降(圖2)。點眼后5 min,A組兔眼玻璃體中貝伐單抗濃度為(0.95±0.14)ng/ml,B、C組兔眼玻璃體中貝伐單抗濃度低至無法測出。點眼后15、30 min及1、2、4 h,3組兔眼玻璃體中貝伐單抗濃度比較,差異均有統計學意義(F=901.952、361.554、475.497、885.997、269.924,P<0.01)。組間兩兩比較,A組與B組、A組與C組之間兔眼玻璃體中貝伐單抗濃度比較,差異均有統計學意義(P<0.05);B組和C組之間兔眼玻璃體中貝伐單抗濃度比較,差異無統計學意義(P>0.05)。點眼后8 h,A組兔眼玻璃體中貝伐單抗濃度降至(0.74±0.09)ng/ml,而B、C組兔眼玻璃體中貝伐單抗濃度低至無法測出。
 圖2
點眼后不同時間3組兔眼玻璃體中貝伐單抗濃度變化
圖2
點眼后不同時間3組兔眼玻璃體中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼玻璃體中貝伐單抗濃度變化符合二室模型(表2)。
點眼后1 h,A、B、C組兔眼視網膜脈絡膜中貝伐單抗濃度達到峰值;之后3組兔眼視網膜脈絡膜中貝伐單抗濃度隨時間逐漸下降(圖3)。點眼后5、15、30 min及1、2、4、8 h,3組兔眼視網膜脈絡膜中貝伐單抗濃度比較,差異均有統計學意義(F=300.936、278.169、511.022、644.908、565.713、448.134、396.500,P<0.05)。組間兩兩比較,A組與B組、A組與C組之間兔眼視網膜脈絡膜中貝伐單抗濃度比較,差異有統計學意義(P<0.05);B組與C組之間兔眼視網膜脈絡膜中貝伐單抗濃度,差異無統計學意義(P>0.05)。
 圖3
點眼后不同時間3組兔眼視網膜脈絡膜中貝伐單抗濃度變化
圖3
點眼后不同時間3組兔眼視網膜脈絡膜中貝伐單抗濃度變化
藥代動力學擬合分析發現,3組兔眼視網膜脈絡膜中貝伐單抗濃度變化符合二室模型(表3)。
3 討論
本研究結果顯示,貝伐單抗膜聯蛋白A5脂質體對兔單次點眼后,在房水、玻璃體、視網膜脈絡膜中的貝伐單抗濃度在各個測量時間點均高于貝伐單抗脂質體、貝伐單抗局部點眼。進一步的藥代動力學參數擬合分析發現,A組兔接受貝伐單抗膜聯蛋白A5脂質體單次點眼后在房水、玻璃體、視網膜脈絡膜中Tmax分別為15 min及2、1 h,Cmax分別為3.87、4.44 ng/ml及37.16 ng/g,t?分別為1.32、2.62、2.61 h,AUC(0-t)分別為12.02、18.68 ng/ml·h及153.94 ng/g·h。這些結果說明,利用膜聯蛋白A5脂質體可以增加貝伐單抗點眼后的眼部通透性,使得貝伐單抗在眼內各組織內的濃度明顯提高。這與Davis等[10]的研究結論相同。另一方面,本研究通過藥代動力學擬合分析發現,與接受貝伐單抗脂質體點眼的B組和接受貝伐單抗點眼的C組相比,接受貝伐單抗膜聯蛋白A5脂質體點眼的A組Tmax和t?沒有明顯變化。提示膜聯蛋白A5脂質體在增加貝伐單抗點眼后的眼部通透性及眼內生物利用度的同時,并沒有影響貝伐單抗在眼內的其他藥物代謝特征,具體的原因和機制尚需進一步實驗探索。
以往國內外文獻報道主要針對單純的貝伐單抗局部點眼進行藥代動力學研究。Nomoto等[11]應用動物實驗研究發現,貝伐單抗(1.25 mg/0.05 ml)多次點眼后(6次/d,共7 d),虹膜睫狀體、玻璃體及視網膜脈絡膜中貝伐單抗Cmax分別為16.1、1.7、18.2 ng/g,遠低于玻璃體注射后眼內組織的藥物濃度。另外一些研究則認為,貝伐單抗局部點眼角膜通透性很差,甚至無法進入眼內[12,13]。目前許多研究認為貝伐單抗局部用藥,可用于翼狀胬肉、角膜化學傷等眼表疾病的治療[14,15]。我們發現貝伐單抗兔眼單次點眼后眼內濃度較低,可以認為單純的貝伐單抗局部點眼無法有效治療眼后節的新生血管性疾病;而貝伐單抗膜聯蛋白A5脂質體點眼后眼內濃度明顯提高。體外實驗研究發現,貝伐單抗抑制半數新生血管有效濃度為22 ng/g[16]。本研究結果顯示,貝伐單抗膜聯蛋白A5脂質體局部點眼后視網膜脈絡膜中的貝伐單抗濃度可達到37.16 ng/g。這提示貝伐單抗膜聯蛋白A5脂質體點眼對眼底新生血管可能產生抑制作用。
我們還發現,3組兔眼視網膜脈絡膜中貝伐單抗濃度均較房水及玻璃體高。其原因可能在于動物實驗中,局部點眼后一方面藥物直接從角膜穿透入眼內到眼后節,另一方面還會迅速經淚道、鼻腔吸收入全身血管系統或者直接吸收入眼周圍血管,從而進入眼后節組織[10,11]。
本研究將貝伐單抗脂質體作為B組進行對照研究,發現貝伐單抗脂質體點眼后在房水、玻璃體和視網膜脈絡膜中的濃度比單純貝伐單抗點眼的C組稍低,但差異無統計學意義。這種情況可能在于緩釋制劑的制作所需的原料貝伐單抗來源于貝伐單抗注射液,因此在此基礎上制作緩釋制劑均需不同程度的加入其他輔助成分,造成緩釋制劑中的藥物載藥量下降。由于膜聯蛋白增加眼部通透性作用顯著,A組在眼內各組織中的藥物濃度仍然高于B、C組;但僅使用脂質體包裹貝伐單抗的B組,由于不能明顯增加角膜通透性,因此眼內各組織濃度并未明顯高于C組。相反,由于脂質體內貝伐單抗的載藥量下降,造成點眼后眼內各組織藥物濃度可能偏低。如果能夠采購到貝伐單抗原料藥進行制作緩釋藥物可能顯著提高緩釋藥物載藥量,這也是今后研究的努力方向。
本研究結果表明,貝伐單抗膜聯蛋白A5脂質體點眼后在各個時間點的藥物濃度明顯高于貝伐單抗脂質體及貝伐單抗點眼,眼內通透性及生物利用度明顯提高;證實膜聯蛋白A5脂質體能夠促進貝伐單抗通過眼部屏障,使眼內組織內到達一定治療濃度。這為進一步進行貝伐單抗膜聯蛋白A5脂質體點眼治療新生血管眼底病變的臨床研究提供實驗理論基礎。但本研究仍存在一些局限性,如未檢測對側眼內及血液樣本的藥物濃度。盡管以往研究發現,單純貝伐單抗點眼后對側眼內及血液內濃度很低[11]。但膜聯蛋白A5脂質體加入后的情況仍需研究探討,今后應注意完善這方面數據并進行分析。
讀者?作者?編者 關于名詞術語使用規范的要求 學術期刊使用規范的科技名詞術語,對準確傳遞學術信息,支撐科技發展具有重要意義;是否使用已公布的規范名詞也是衡量期刊質量的標準之一。為此,將本刊關于文稿中名詞術語使用規范的要求說明如下:(1)醫學名詞應使用全國科學技術名詞審定委員會公布的名詞。作者可登陸全國科學技術名稱委員會網站(),免費查詢科技名詞并按要求規范使用;(2)尚未通過審定的學科名詞,可選用最新版《醫學主題詞表(MeSH)》、《醫學主題詞注釋字順表》、《中醫藥主題詞表》中的主題詞;(3)對沒有通用譯名的名詞術語于文內第一次出現時應注明原詞;(4)中西藥名以最新版本《中華人民共和國藥典》和《中國藥品通用名稱》(均由中國藥典委員會編寫)為準,英文藥物名稱則采用國際非專利藥名。在題名及正文中藥名一般不得使用商品名,確需使用商品名時應先注明其通用名稱。 本刊編輯部