引用本文: 曹迪, 張曉梅, 盧晶, 王肖, 劉入源, 劉秋慧, 羅燕, 呂林. 抑制Claudin-3表達對體外培養鼠視網膜神經節細胞的作用研究. 中華眼底病雜志, 2017, 33(2): 166-171. doi: 10.3760/cma.j.issn.1005-1015.2017.02.013 復制
視網膜神經節細胞(RGC)功能障礙是糖尿病視網膜病變、青光眼等多種眼部疾病發生和發展的重要因素之一[1,2]。本課題組前期研究首次發現Claudin-3表達于小鼠RGC中,且在不同的發育階段及病理狀態下Claudin-3的表達和分布不同,提示Claudin-3參與小鼠RGC氧化損傷的病理過程[3]。Claudin-3是近年來新發現的Claudins蛋白超家族成員之一,參與細胞增生分化、基因轉錄、腫瘤抑制等信號轉導過程[4]。為進一步探討Claudin-3對RGC的作用,我們通過用攜帶Claudin-3小發夾RNA(shRNA)的腺相關病毒(AAV)轉染體外培養的小鼠RGC,探討干擾抑制Claudin-3表達對RGC軸突生長、存活及凋亡的可能機制。現將結果報道如下。
1 材料和方法
鼠齡1~3 d的新生C57BL/6J小鼠購于中山大學動物實驗中心。293T細胞(人胚腎細胞系,購自深圳市百恩維生物科技有限公司);Neurobasal?-A培養基、谷氨酰胺、青霉素和鏈霉素(美國Gibco公司),木瓜蛋白酶(美國Worthington公司),β-肌動蛋白(β-actin)一抗、抗兔Claudin-3一抗(美國Invitrogen公司),抗鼠β-微管蛋白(β-tubulin)一抗(美國Abcam公司),Alexa fluor 488 熒光二抗、Alexa fluor555熒光二抗(美國Cell Signaling公司),反轉錄及cDNA合成試劑盒、實時聚合酶鏈反應(RT-PCR)試劑盒(瑞士Roche公司),辣根過氧化物酶標記的二抗(美國DAKO公司)。
AAV-shClaudin3 AAV、AAV-shScramble陰性AAV構建于深圳市百恩維生物科技有限公司,經合成送測序鑒定。
AAV轉染293T細胞。培養293T細胞,細胞融合度達60%~80%時,加入AAV-shClaudin3 AAV或AAV-shScramble陰性AAV,按最佳感染復數(MOI)=106轉染293T細胞。轉染96 h后,活細胞動態熒光顯微鏡觀察綠色熒光蛋白(GFP)表達情況,判斷轉染效率。MOI=加入病毒總數/細胞總數。
RGC原代培養。取10只鼠齡1~3 d的新生C57BL/6J小鼠的視網膜,消化后吸取含2%B27和1%谷氨酰胺的Neurobasal?-A培養基計數,調整細胞密度至1×106 個/ml。將細胞懸液接種于經多聚賴氨酸包被的24孔培養板或6孔培養板中,置于37℃、5% CO2孵箱內培養。其后每3天半定量換液,倒置熒光顯微鏡觀察細胞形態。
RGC免疫熒光鑒定。取原代RGC接種于置有蓋玻片的24孔板中,細胞培養至5 d時,行β-tubulin免疫熒光染色,激光共聚焦顯微鏡下隨機取4個視野對β-tubulin標記為陽性的RGC進行計數并拍照,以上實驗重復3次取平均值。
AAV轉染RGC。將細胞懸液接種于6孔培養板中,分為正常對照組、AAV-shScramble組和AAV-shClaudin3組。培養24 h后,按MOI=106轉染,AAV-shClaudin3組加入AAV-shClaudin-3 AAV液,AAV-shScramble組加入AAV-shScramble陰性AAV液,正常對照組加入正常神經細胞培養液,混勻,置于37℃、5%CO2培養箱中孵育培養,轉染96 h后,活細胞動態熒光顯微鏡觀察拍照。
RGC軸突長度測量。取原代RGC分為正常對照組、AAV-shScramble組和AAV-shClaudin3組;AAV轉染96 h后免疫熒光染色鑒定RGC。倒置熒光顯微鏡高倍鏡下拍照并記錄。采用Image J圖像處理軟件測量RGC軸突。每組至少隨機選擇30個RGC測量軸突長度,測量距離為胞體至每個細胞最長軸突位置。以上實驗重復3次取平均值。
RT-PCR檢測各組RGC Claudin-3、血管內皮生長因子(VEGF)mRNA表達。Claudin-3:上游引物5′-CGTACAAGACGAGACGGCCAAG-3′,下游引物 5′-CACGTACAACCCAGCTCCCATC-3′;VEGF:上游引物5′-TGAAGCCCTGGAGTGCGT-3′,下游引物5’-AGGTTTGATCCGCATGATCTG-3′;β-actin:上游引物5′-CATCCGTAAAGACCTCTATGCCAAC-3′,下游引物5′-ATGGAGCCACCGATCCACA-3′。接種于6孔培養板的RGC分為正常對照組、AAV-shScramble組、AAV-shClaudin3組,AAV轉染96 h后,提取總RNA,將總RNA逆轉錄成cDNA。將各組RGC的cDNA行RT-PCR檢測,采用相對定量方法,設定正常對照組表達量為基準,定為1.0,其他各組與之作比較。實驗均重復3次取平均值。
蛋白免疫印跡法(Western blot)檢測RGC Claudin-3、VEGF、Bcl-2、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)蛋白表達水平。接種于6孔培養板的RGC分為正常對照組、AAV-shScramble組、AAV-shClaudin3組,AAV轉染96 h后,取蛋白樣品于十二烷基硫酸鈉聚丙烯酰胺凝膠電泳凝膠中電泳,經電轉、孵育相應一抗和二抗后行增強化學發光定影、顯影并掃描分析。
采用SPSS 19.0統計軟件行統計學分析處理。多組間比較行單因素方差分析;兩兩比較行最小顯著差法(每組n>3)或Studentt檢驗(每組n=3)。α=0.05,P<0.05為差異有統計學意義。
2 結果
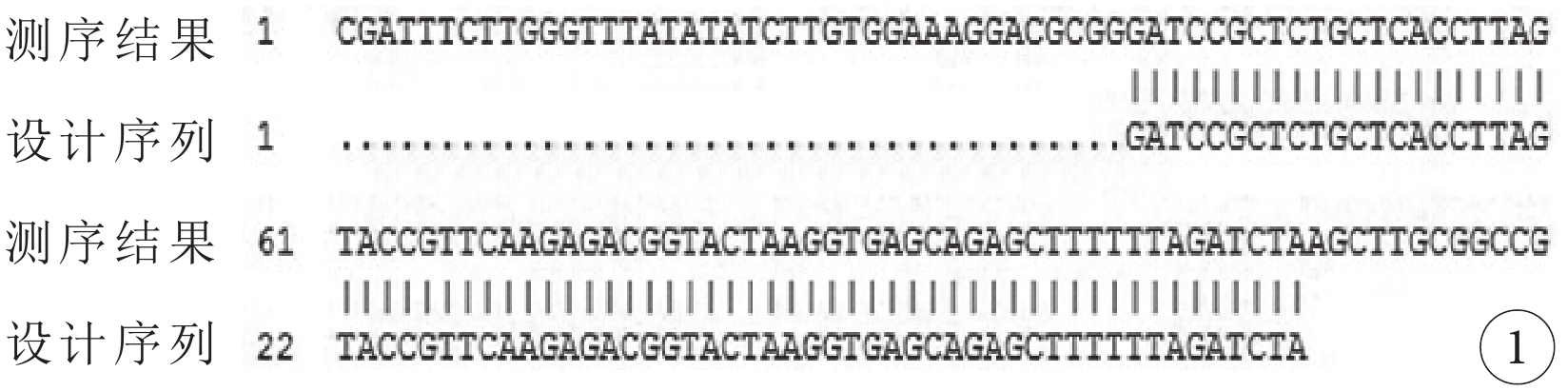
pAAV-ZsGreen-shClaudin-3測序結果顯示,插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架,pAAV-ZsGreen-shClaudin-3質粒構建成功(圖1)。
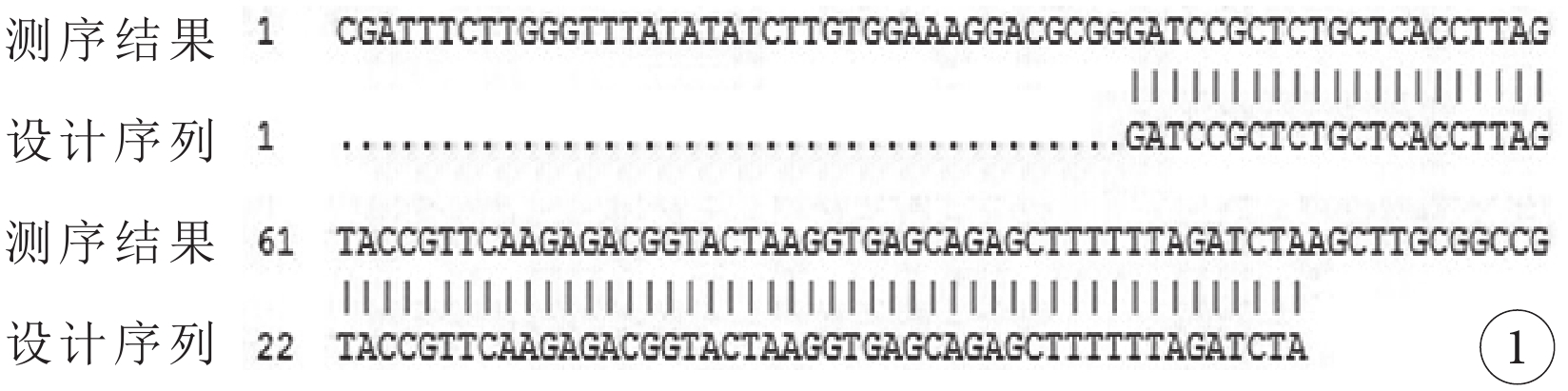 圖1
pAAV-ZsGreen-shClaudin3質粒測序圖。插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架
圖1
pAAV-ZsGreen-shClaudin3質粒測序圖。插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架
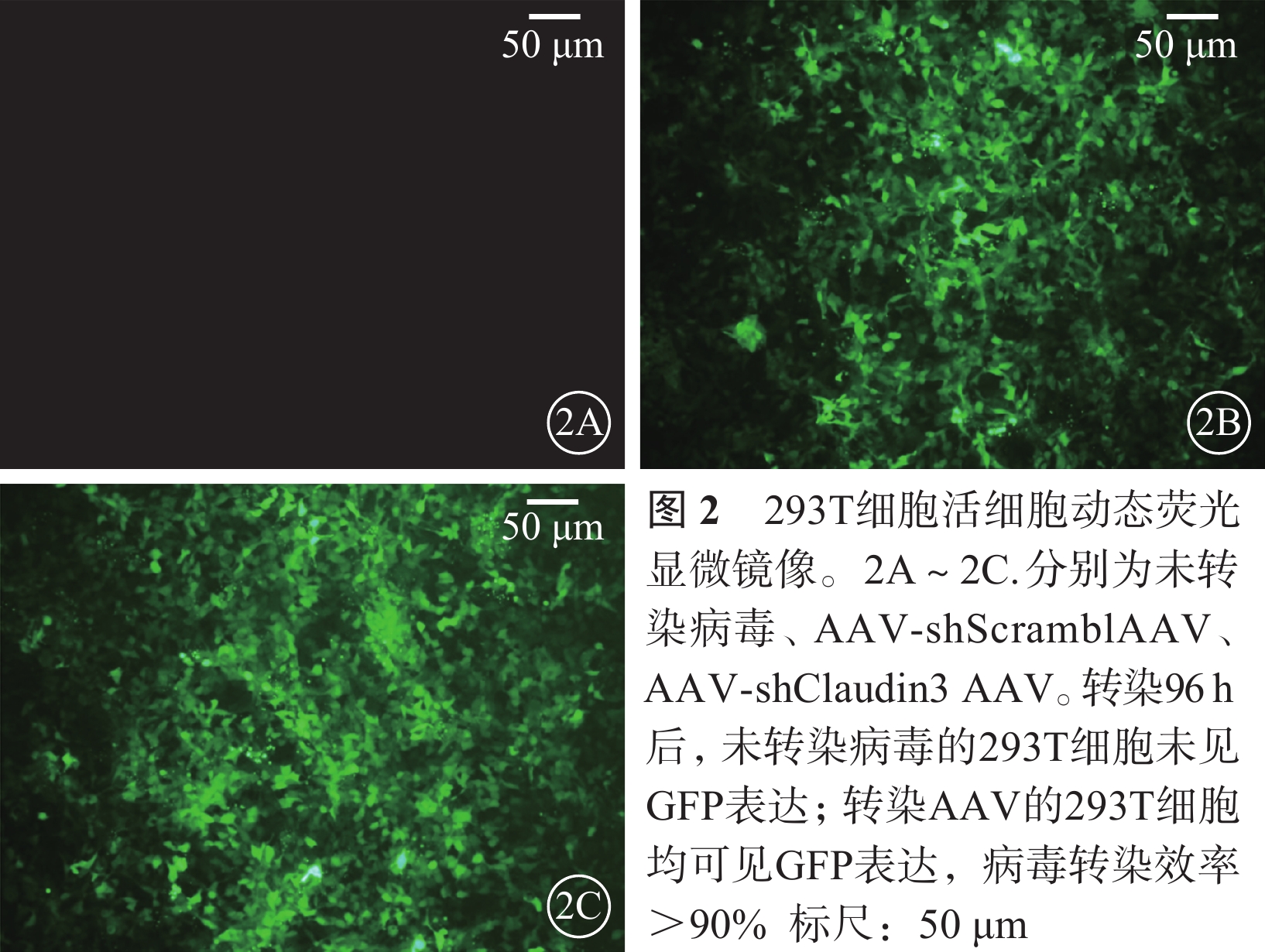
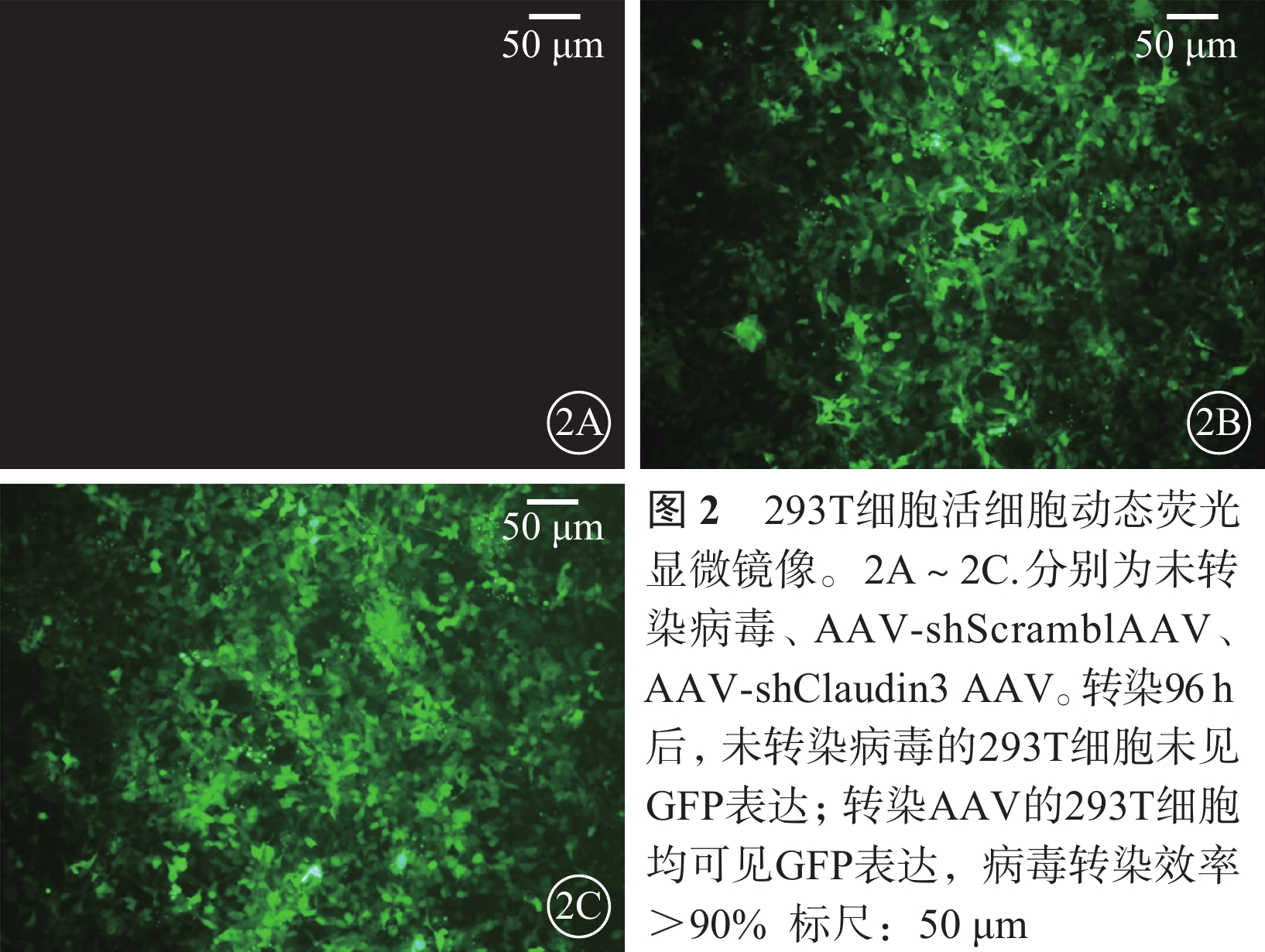
活細胞動態熒光顯微鏡觀察發現,AAV轉染293T細胞96 h后,293T細胞病毒轉染效率>90%(圖2)。
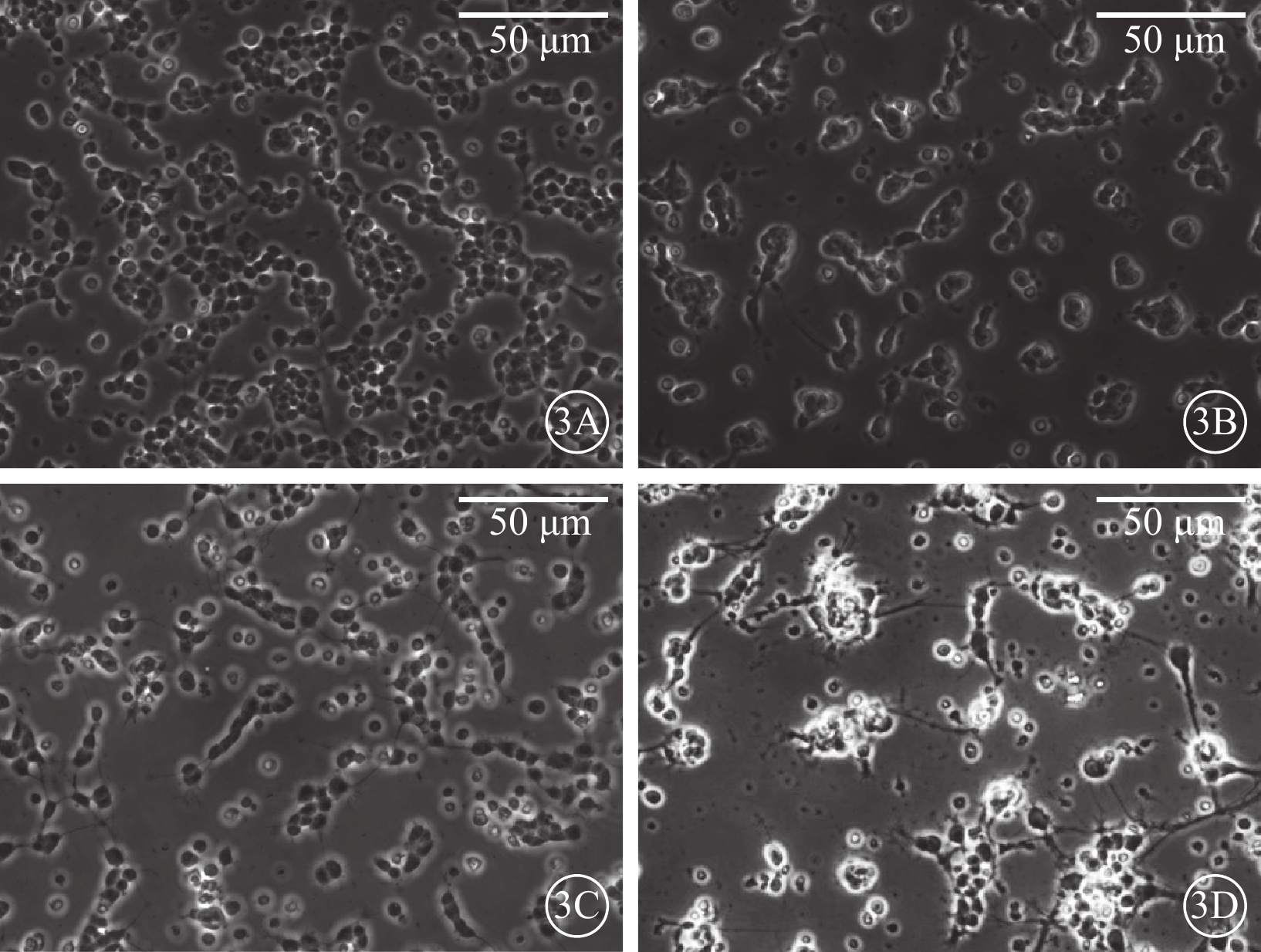
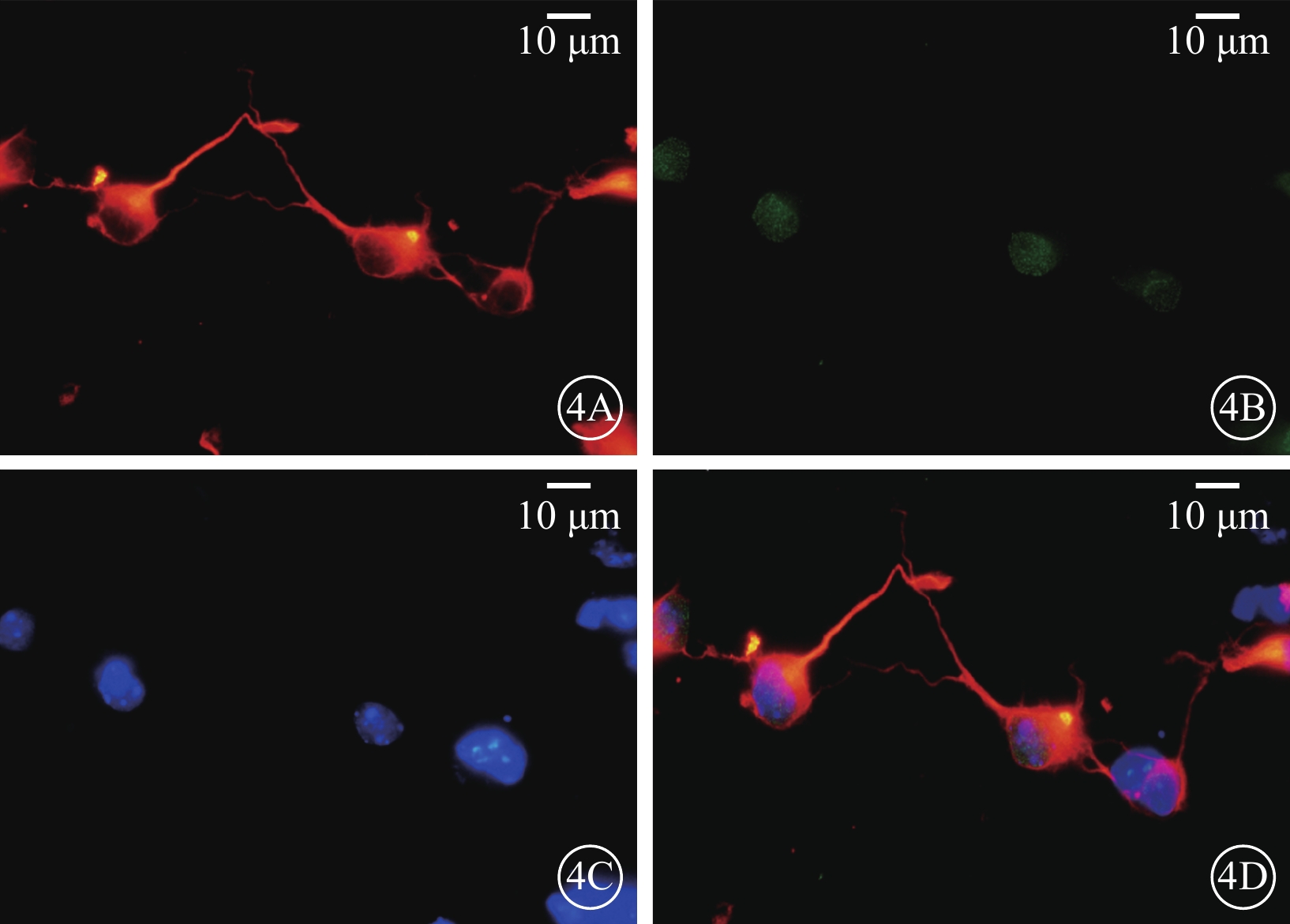
倒置相差顯微鏡觀察發現,細胞接種24 h后,可見細胞基本貼壁,大部分細胞聚集成簇(圖3A);48 h后,具有軸突的細胞數量明顯增多(圖3B);72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接(圖3C);7 d后,細胞開始出現凋亡,數量減少(圖3D)。激光共聚焦顯微鏡像觀察發現,分離混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達(圖4)。
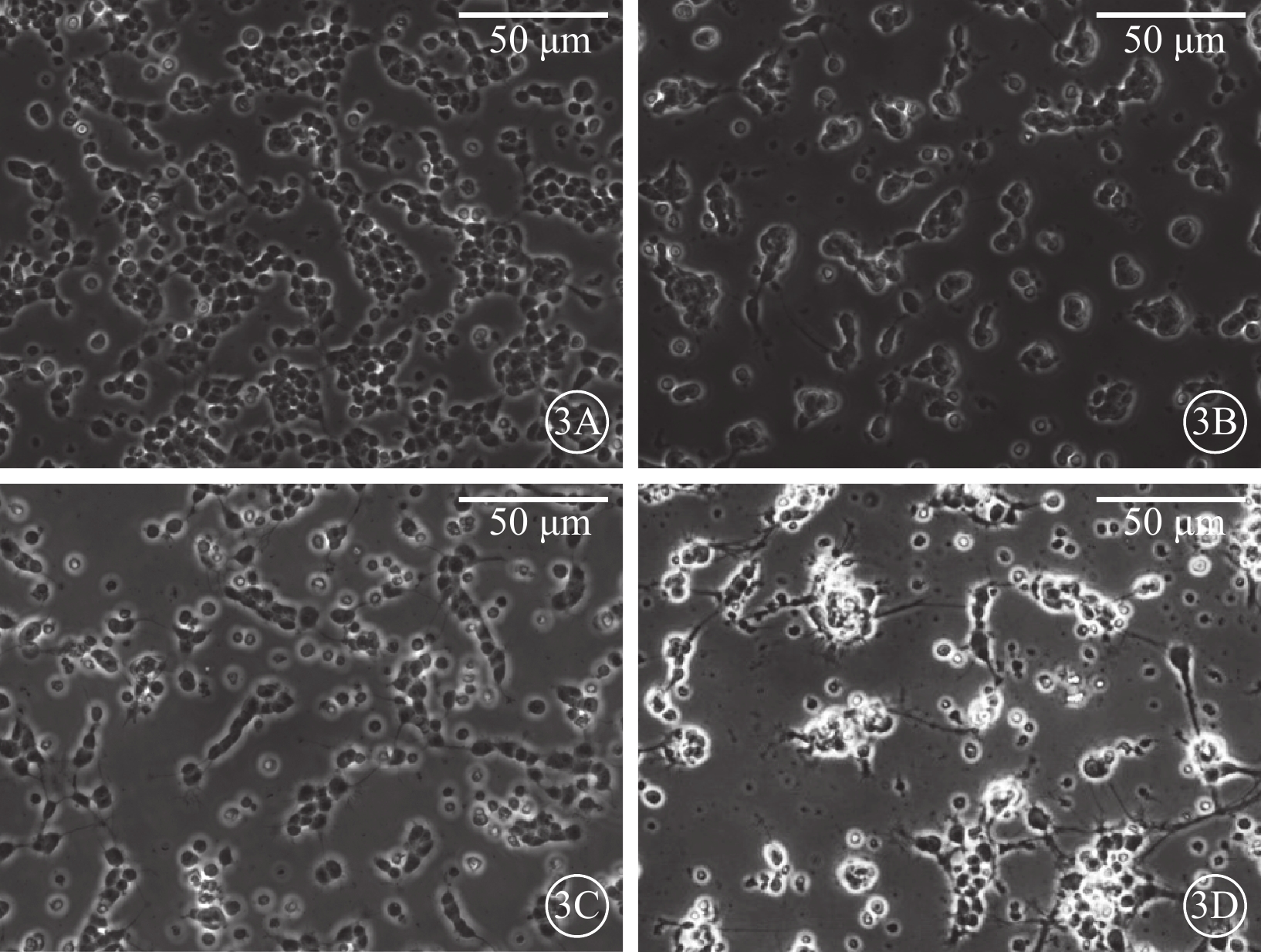 圖3
培養的RGC倒置相差顯微鏡像。3A. 培養24 h后,細胞基本貼壁;3B. 培養48 h后,伸出軸突的細胞數量明顯增多;3C. 培養72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接;3D. 培養7 d后,RGC開始出現凋亡,數量減少 標尺:50 μm
圖3
培養的RGC倒置相差顯微鏡像。3A. 培養24 h后,細胞基本貼壁;3B. 培養48 h后,伸出軸突的細胞數量明顯增多;3C. 培養72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接;3D. 培養7 d后,RGC開始出現凋亡,數量減少 標尺:50 μm
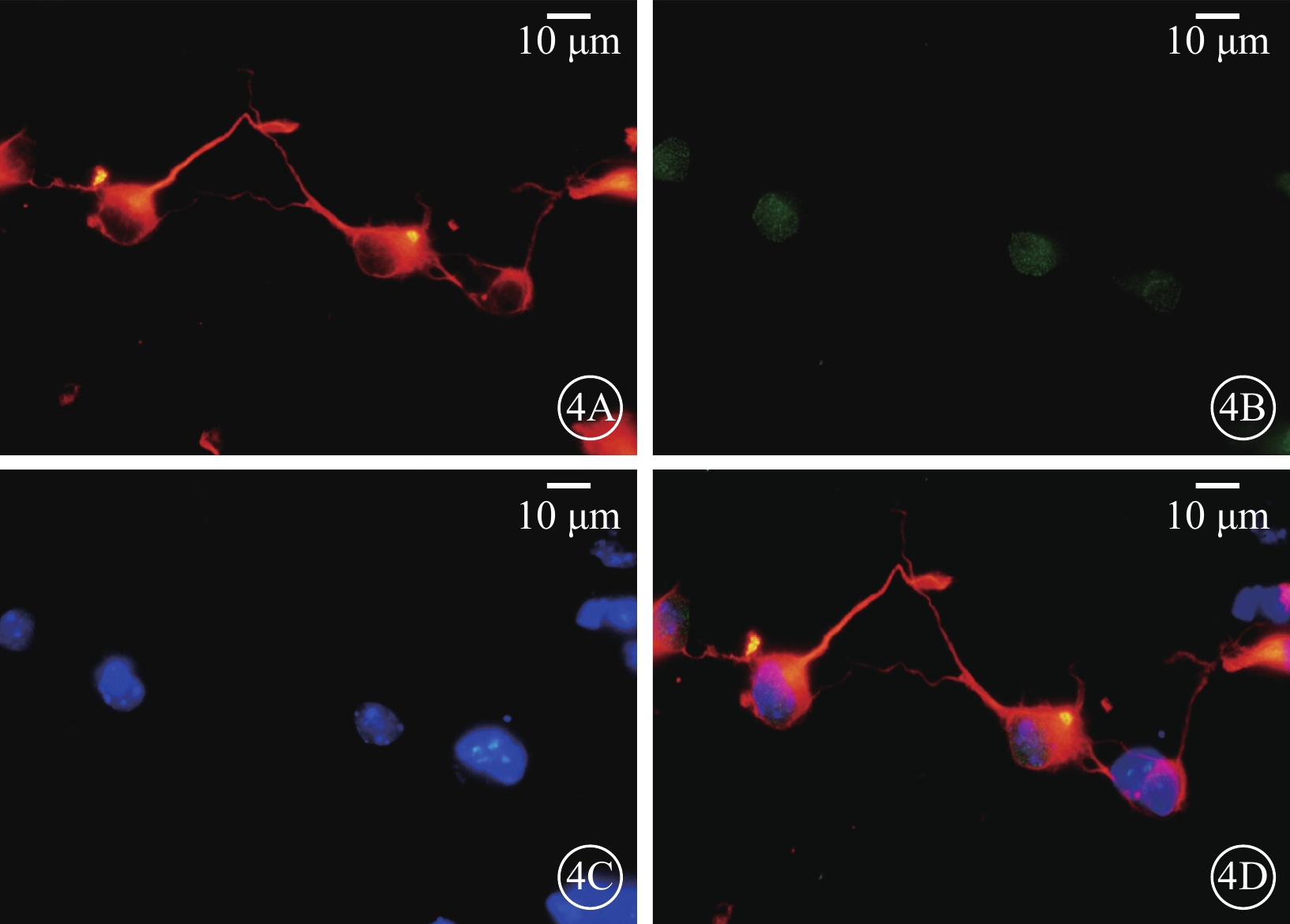 圖4
RGC激光共聚焦顯微鏡像。4A. β-tubulin標記的RGC呈紅色熒光;4B. RGC可見GFP;4G. 4',6-二脒基-2-苯基吲哚標記的RGC呈藍色熒光;4H. 共定位。混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達 標尺:10 μm
圖4
RGC激光共聚焦顯微鏡像。4A. β-tubulin標記的RGC呈紅色熒光;4B. RGC可見GFP;4G. 4',6-二脒基-2-苯基吲哚標記的RGC呈藍色熒光;4H. 共定位。混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達 標尺:10 μm
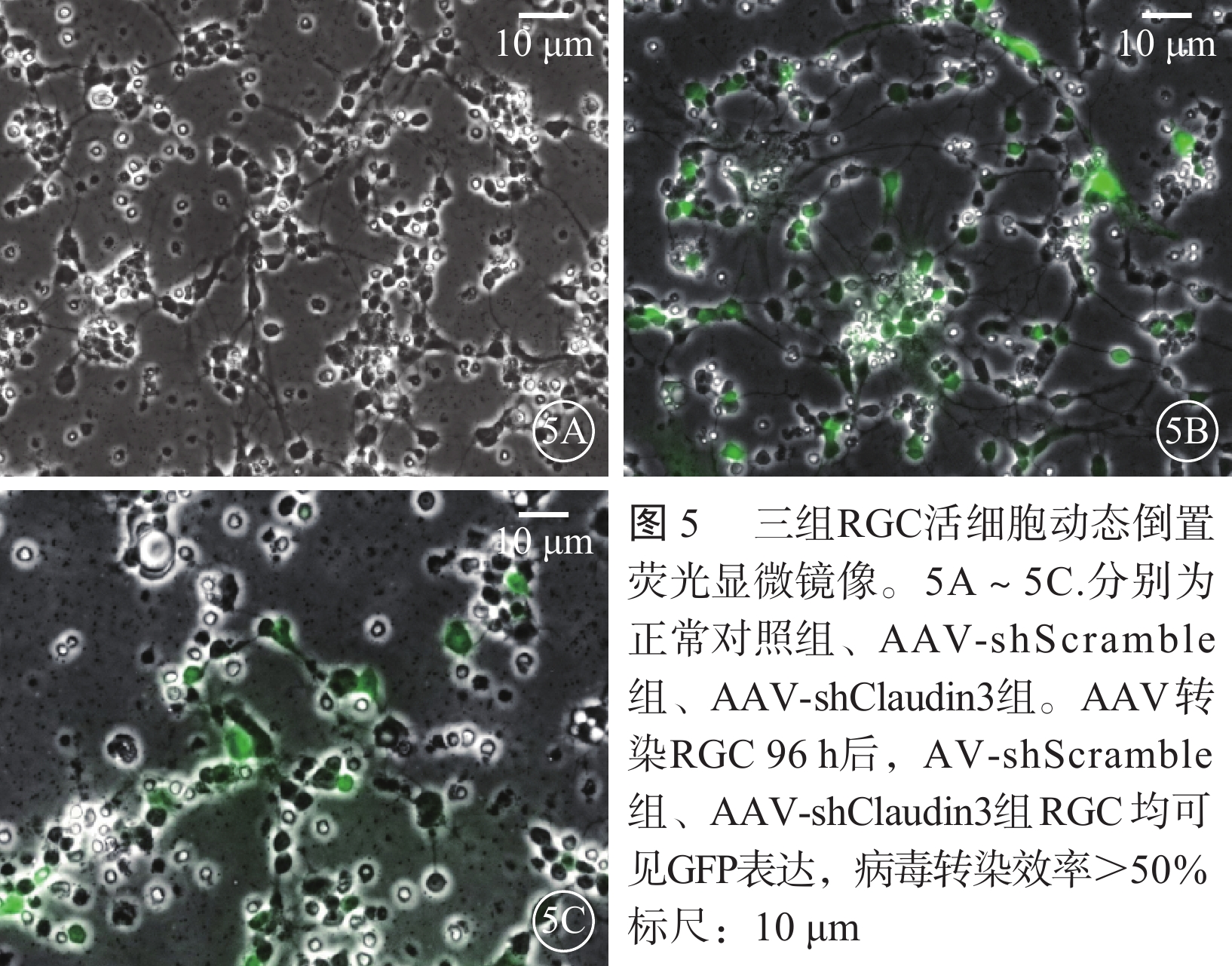
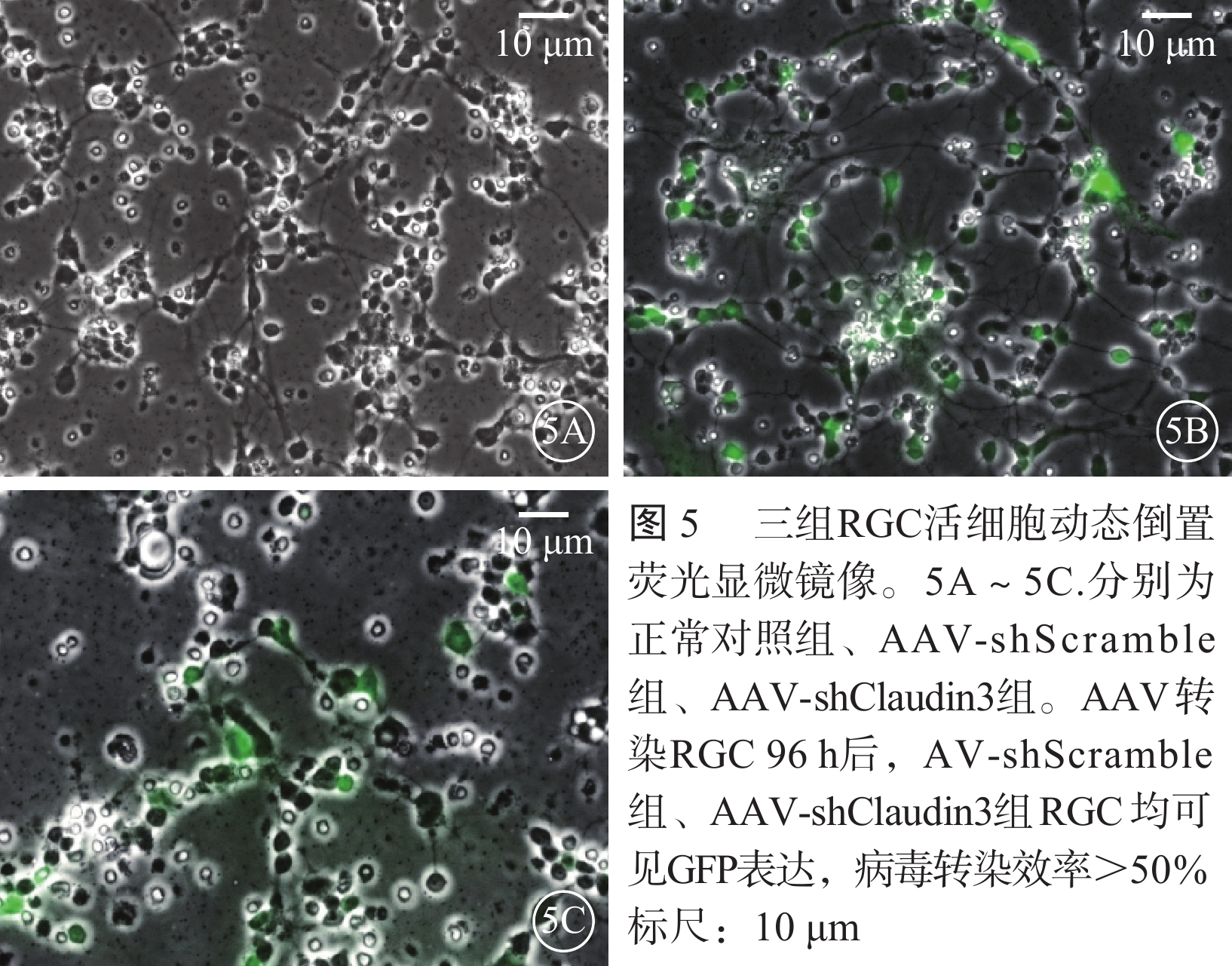
活細胞動態熒光顯微鏡像觀察發現,AAV以MOI=106轉染RGC 96 h后,AAV-shScramble組和AAV-shClaudin3組RGC病毒轉染效率均>50%(圖5)。
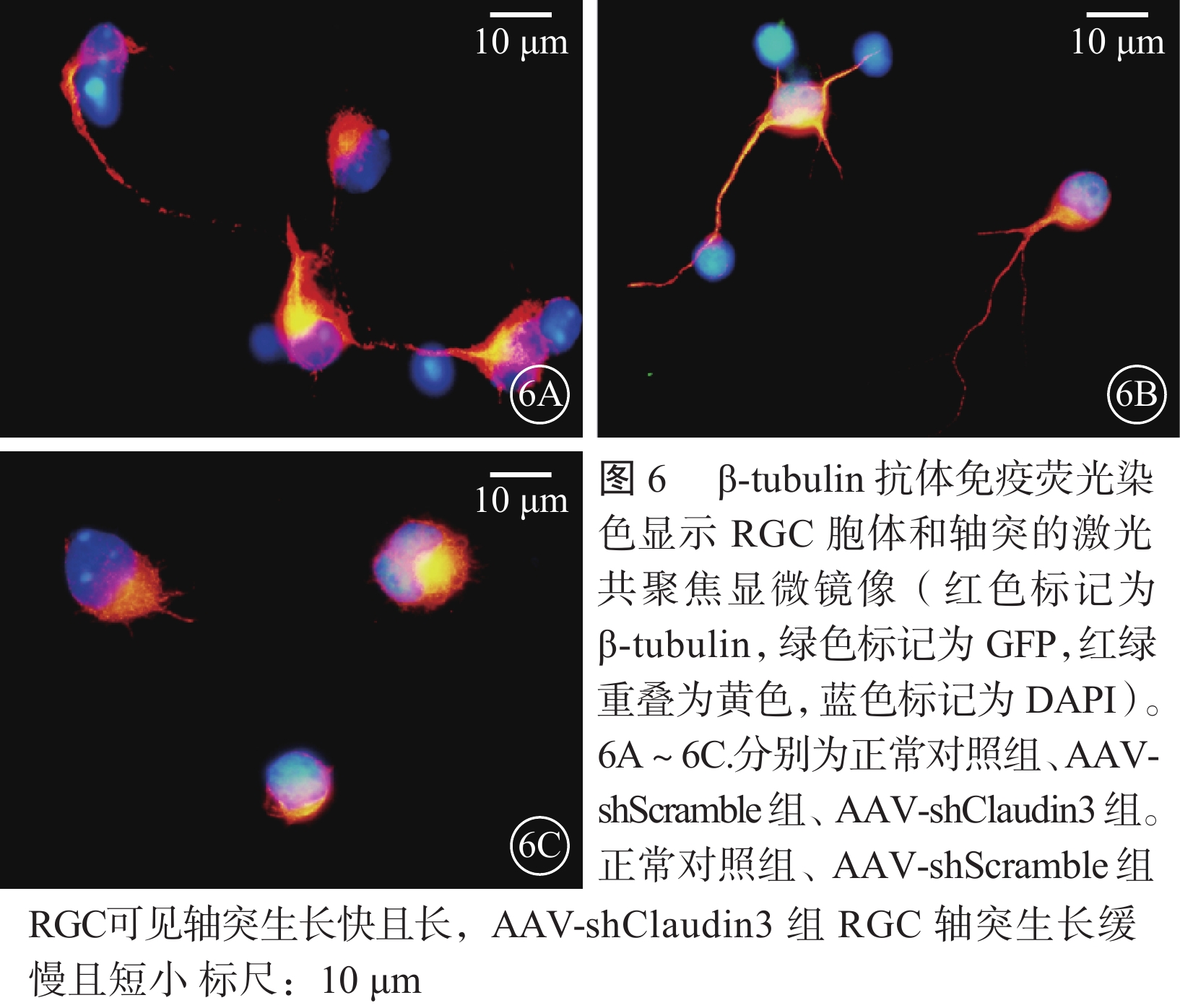
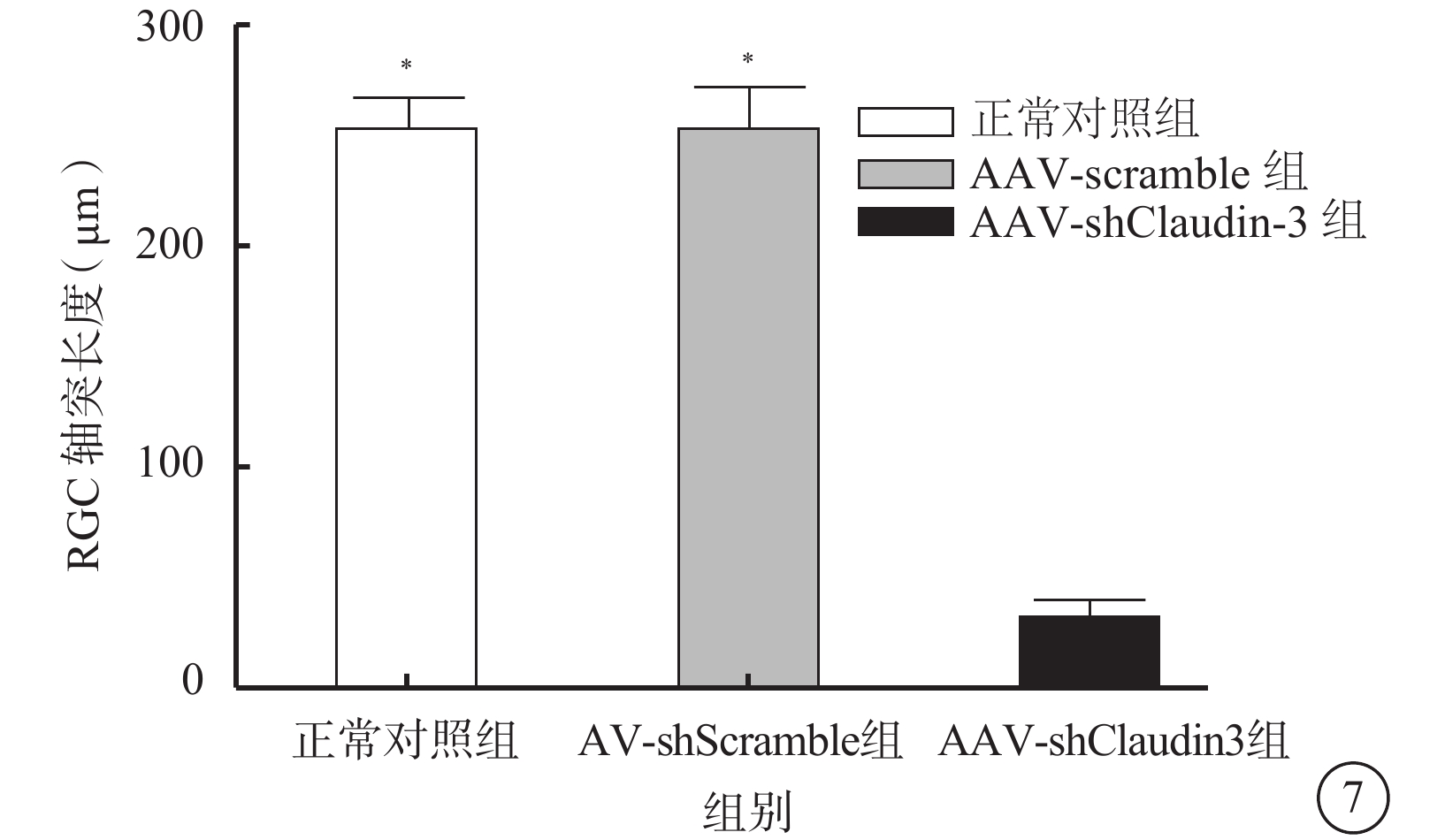
激光共聚焦顯微鏡觀察發現,β-tubulin抗體免疫熒光染色顯示的RGC胞體和軸突,AAV轉染RGC 96 h后,AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯降低(圖6),差異有統計學意義(F=2 363.274,P<0.05),正常對照組、AAV-shScramble組之間RGC軸突長度比較,差異無統計學意義(F=2.785,P>0.05)(圖7)。
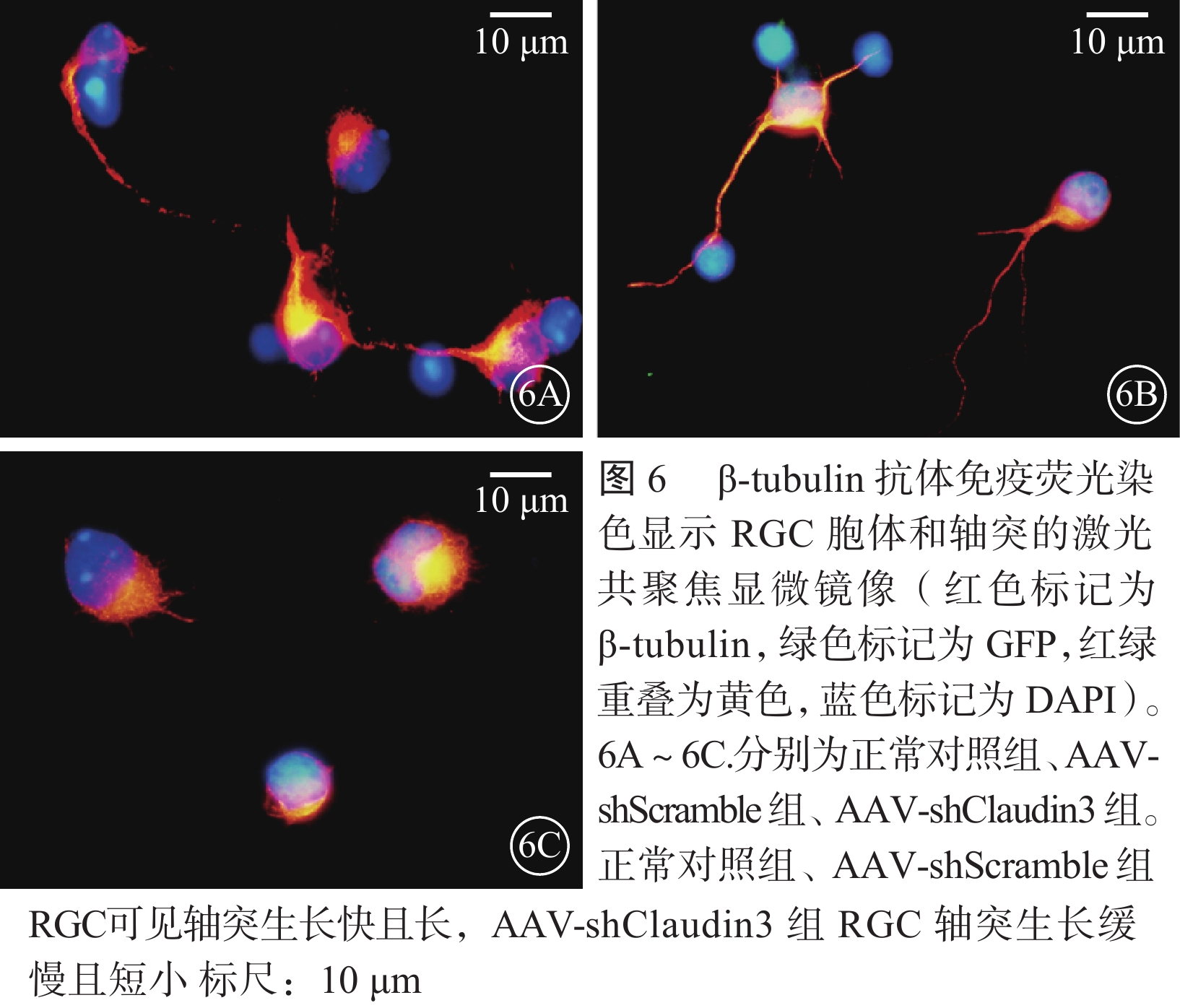
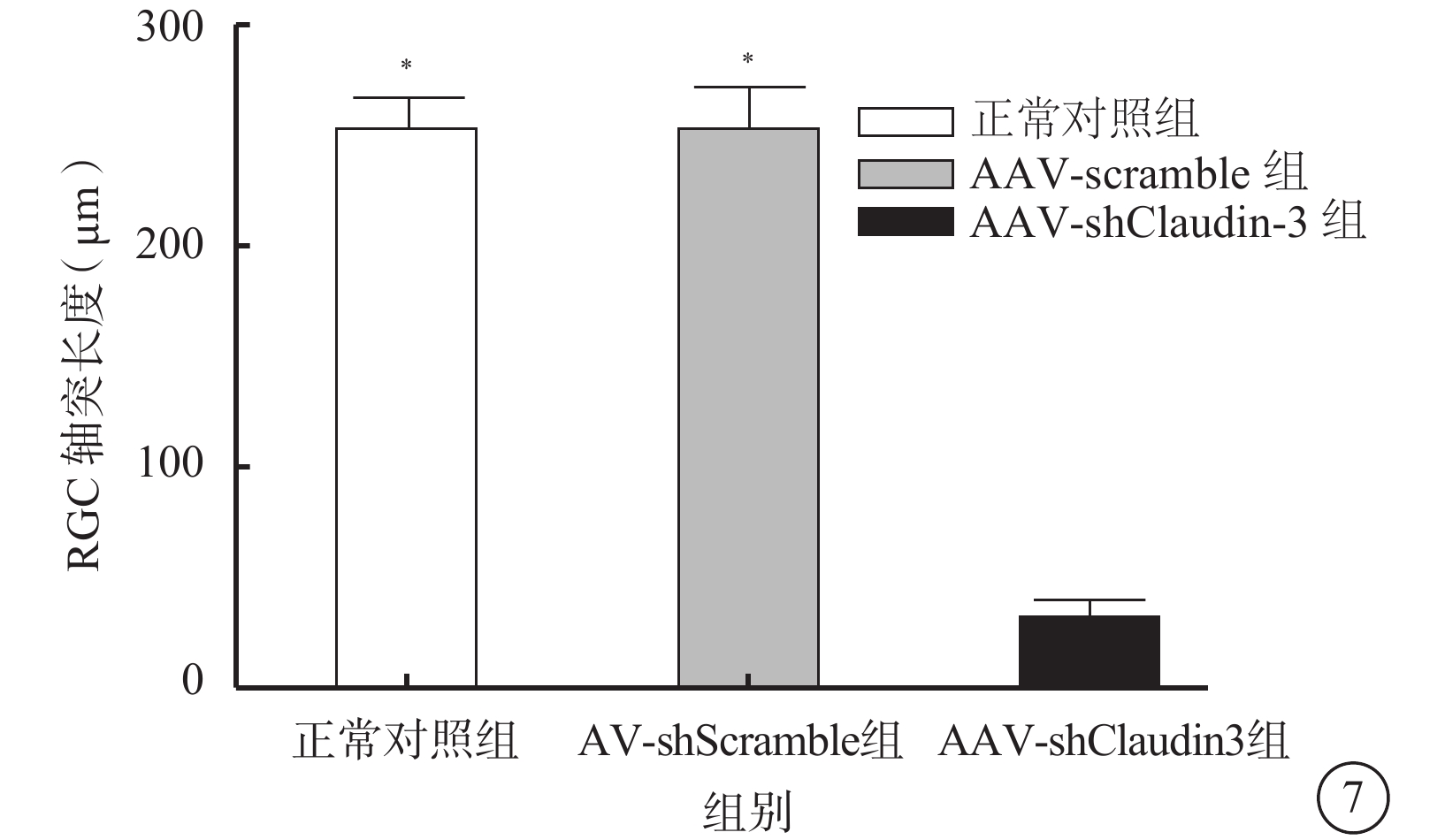 圖7
三組RGC軸突長度測量結果。AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯縮短。*與AAV-shClaudin3組比較,P<0.05
圖7
三組RGC軸突長度測量結果。AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯縮短。*與AAV-shClaudin3組比較,P<0.05
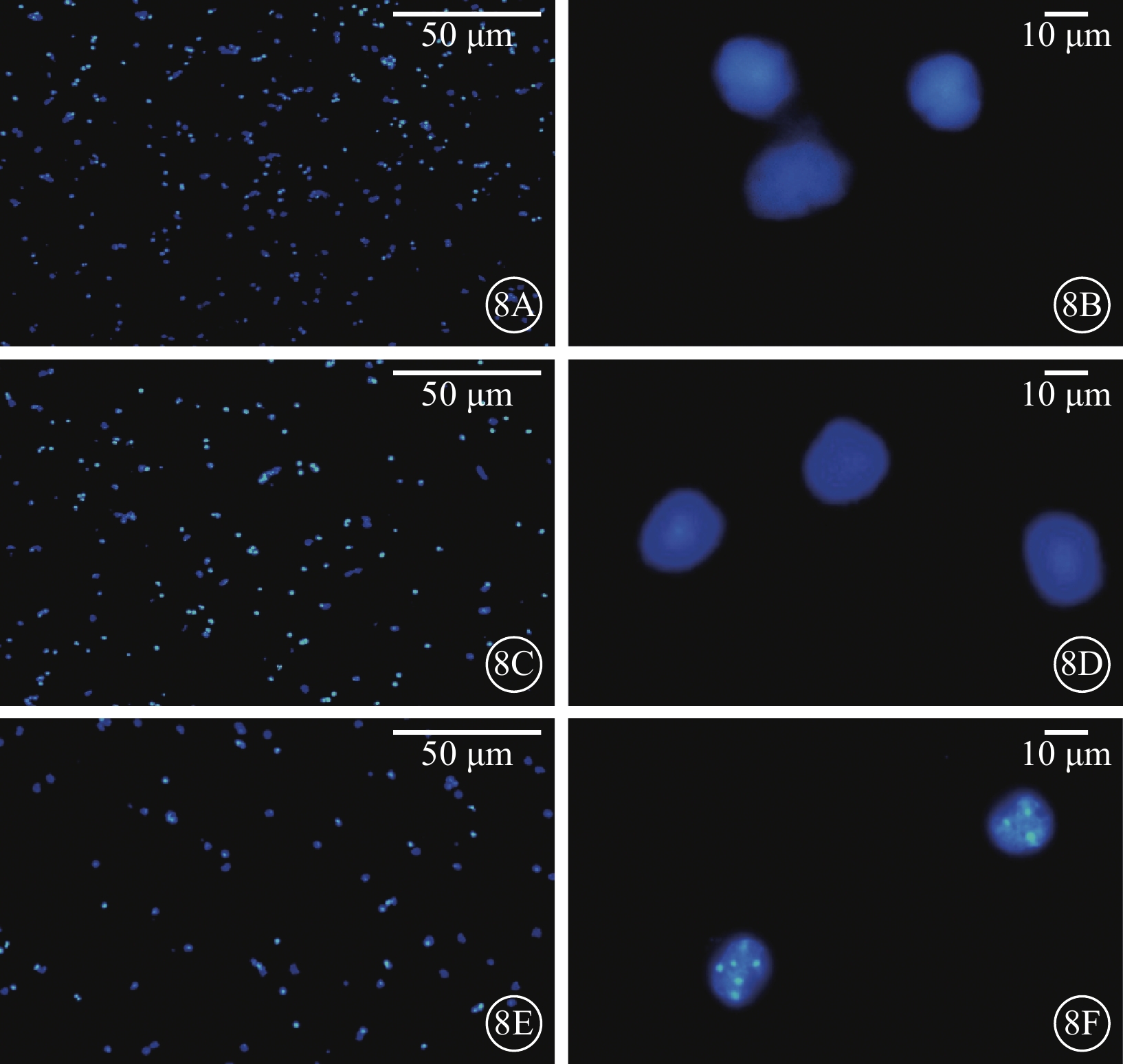
熒光顯微鏡觀察發現,AAV轉染RGC 96 h后,AAV-shClaudin3組RGC密度較正常對照組、AAV-shScramble組明顯減低;AAV-shClaudin3組呈現細胞核凋亡特征,細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體(圖8)。
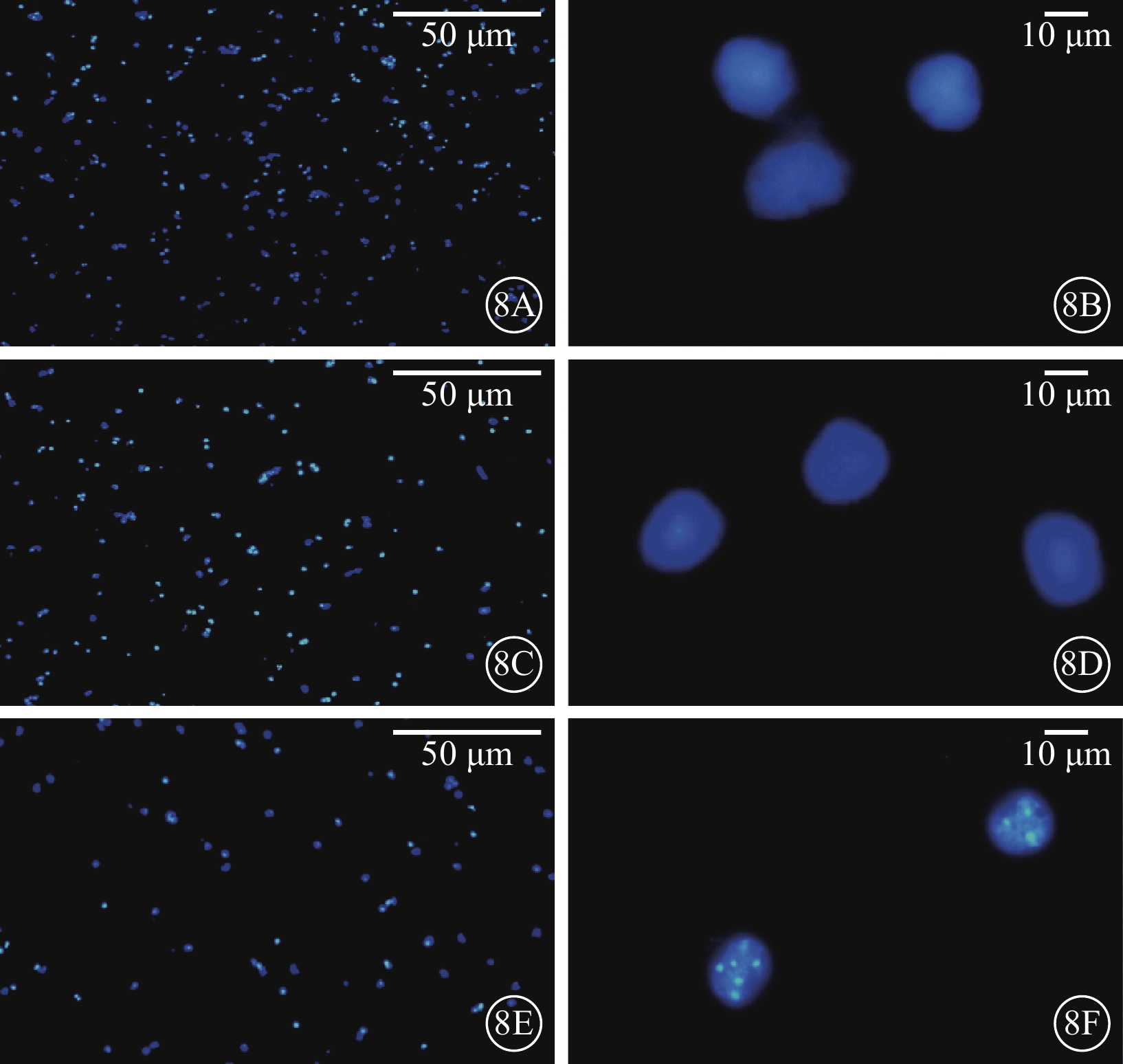 圖8
三組RGC熒光顯微鏡像。8A、8B. 正常對照組;8C、8D. AAV-shScramble組;8E、8F. AAV-shClaudin3組。AAV-shClaudin3組RGC密度明顯減低;AAV-shClaudin3組可見細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體 DAPI 8A、8B、8E標尺:50 μm;8B、8D、8F 標尺:10 μm
圖8
三組RGC熒光顯微鏡像。8A、8B. 正常對照組;8C、8D. AAV-shScramble組;8E、8F. AAV-shClaudin3組。AAV-shClaudin3組RGC密度明顯減低;AAV-shClaudin3組可見細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體 DAPI 8A、8B、8E標尺:50 μm;8B、8D、8F 標尺:10 μm
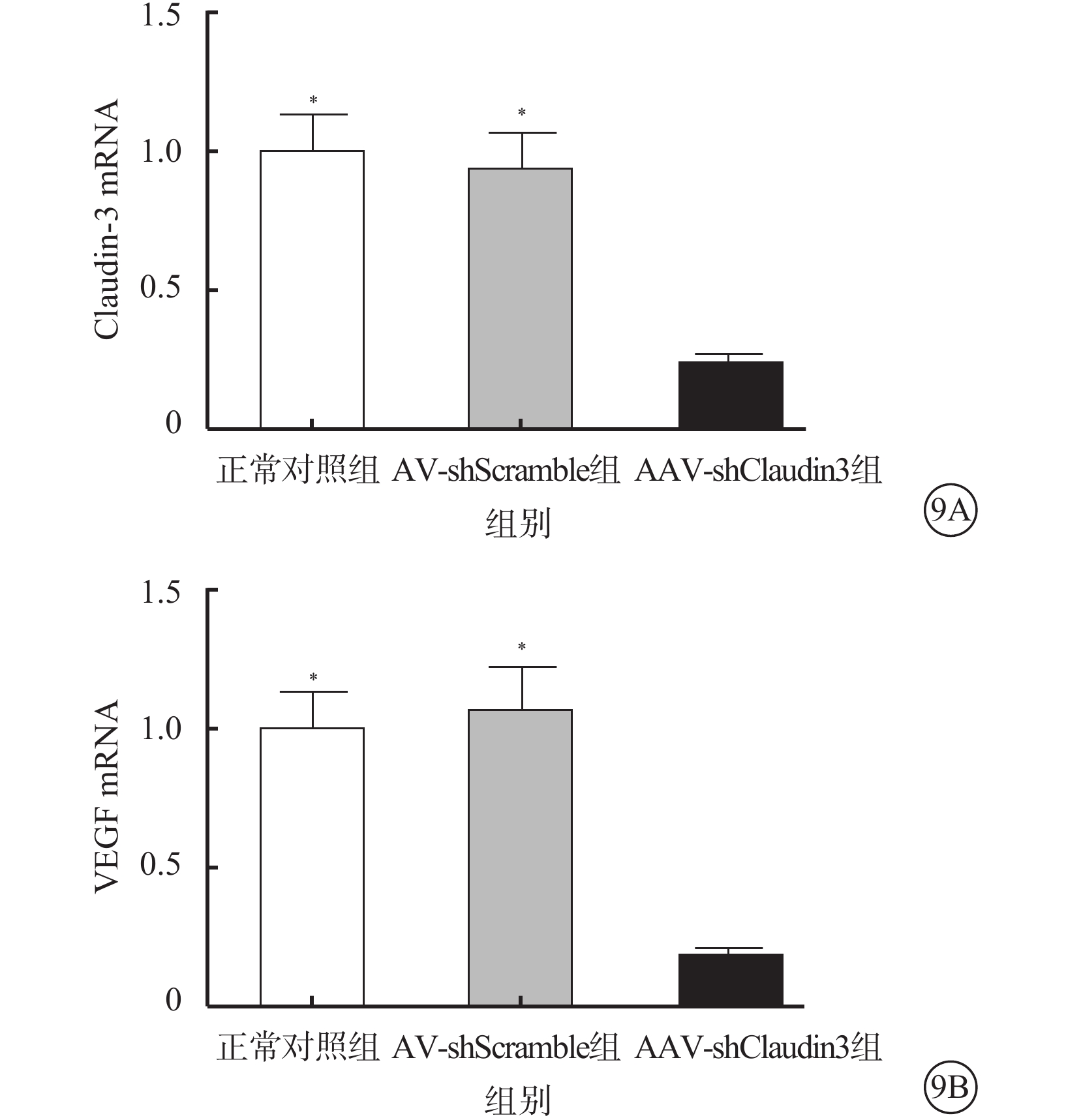
RT-PCR檢測結果顯示,AAV-shClaudin3組RGC Claudin-3、VEGF mRNA表達較正常對照組、AAV-shScramble組下降,差異均有統計學意義(F=257.408、160.533,P<0.05),正常對照組、AAV-shScramble組之間RGC Claudin-3、VEGF mRNA表達比較,差異無統計學(F=2.375,3.028,P>0.05)(圖9)。
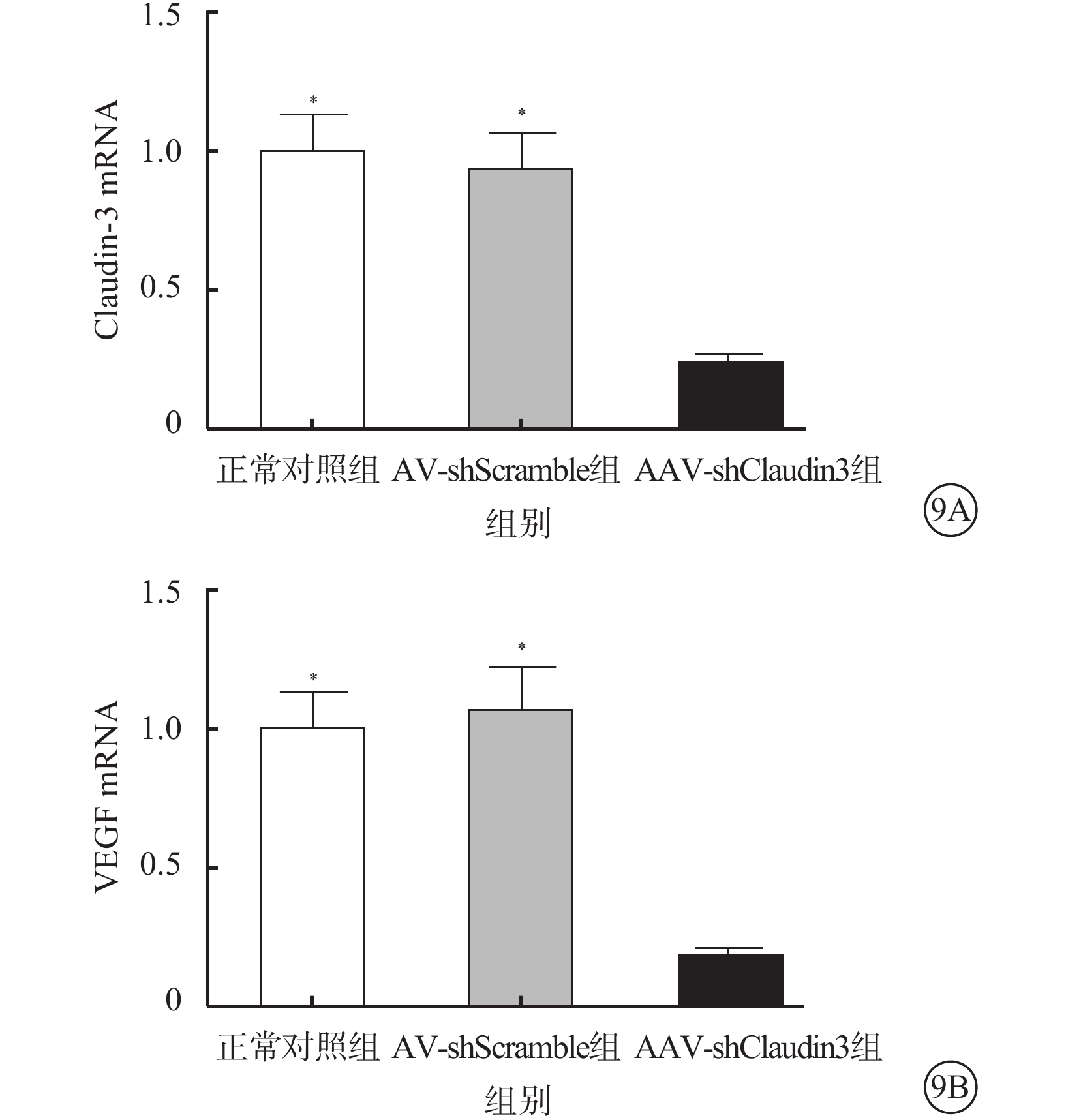 圖9
Claudin-3、VEGF mRNA表達結果。9A. Claudin-3 mRNA;9B. VEGF mRNA。AAV-shClaudin3組RGC Claudin-3及VEGF mRNA表達較正常對照組、AAV-shScramble組降低。*與AAV-shClaudin3組比較,P<0.05
圖9
Claudin-3、VEGF mRNA表達結果。9A. Claudin-3 mRNA;9B. VEGF mRNA。AAV-shClaudin3組RGC Claudin-3及VEGF mRNA表達較正常對照組、AAV-shScramble組降低。*與AAV-shClaudin3組比較,P<0.05
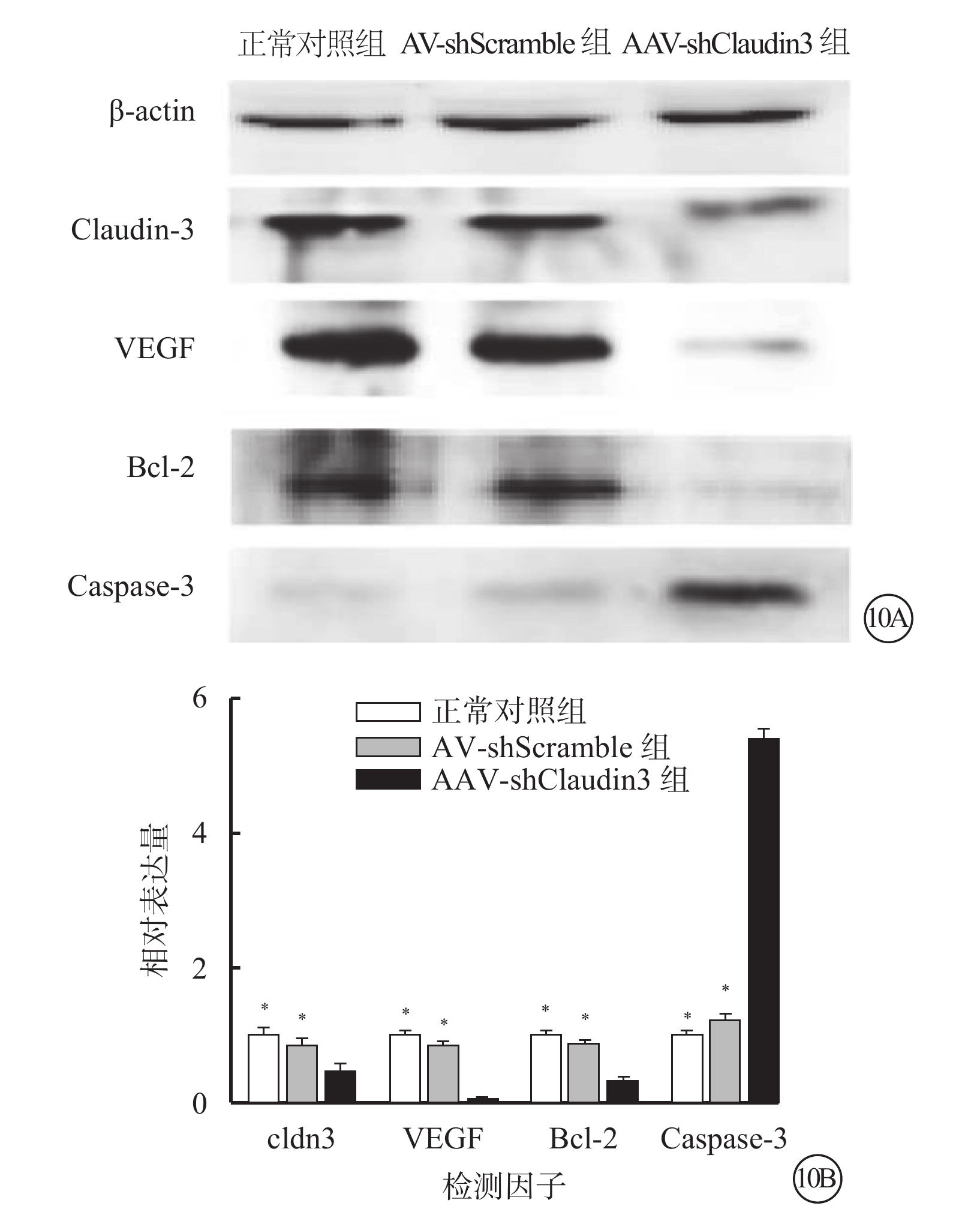
Western blot檢測結果顯示,與正常對照組、AAV-shScramble組比較,AAV-shClaudin3組RGC Claudin-3、VEGF、Bcl-2蛋白表達明顯降低(F=129.671、420.552、62.669),Caspase-3蛋白表達明顯升高(F=231.348),差異均有統計學意義(P<0.05),正常對照組、AAV-shScramble組之間Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達比較,差異無統計學意義(F=0.529、4.011、2.286、4.378,P>0.05)(圖10)。
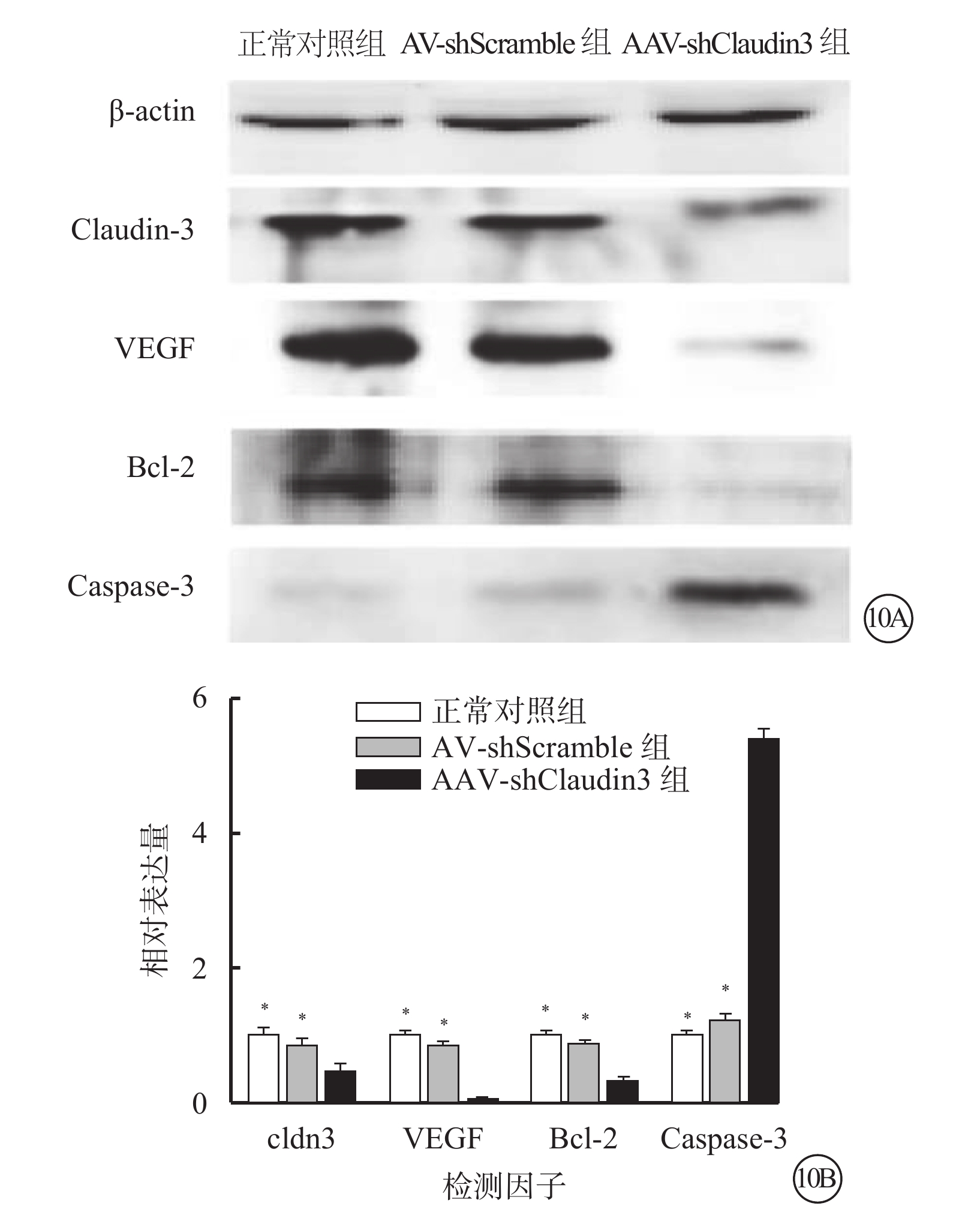 圖10
三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達情況。10A. 電泳圖;10B. 三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達結果。AAV-shClaudin3組RGC中Claudin-3、VEGF、Bcl-2蛋白表達較正常對照組、AAV-shScramble組明顯降低;Caspase-3蛋白表達明顯升高。*與AAV-shClaudin3組比較,P<0.05
圖10
三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達情況。10A. 電泳圖;10B. 三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達結果。AAV-shClaudin3組RGC中Claudin-3、VEGF、Bcl-2蛋白表達較正常對照組、AAV-shScramble組明顯降低;Caspase-3蛋白表達明顯升高。*與AAV-shClaudin3組比較,P<0.05
3 討論
shRNA進入細胞后形成RNA誘導沉默復合體,導致靶mRNA的降解,從而抑制相關基因表達,目前已廣泛應用于各種基因干擾設計[5]。AAV載體具有無致病性,低免疫原性,可介導外源基因長期表達等優點,已嘗試用于多種疾病的治療[6,7]。本研究首次應用AAV介導shRNA干擾抑制Claudin-3顯著下調Claudin-3基因和蛋白表達水平,進而抑制體外培養小鼠RGC軸突生長,促進其凋亡。
Claudin-3作為Claudins蛋白超家族成員之一,在調控細胞增生凋亡、腫瘤生長等信號轉導過程中有重要作用[8]。本研究結果發現,抑制Claudin-3表達會抑制RGC的軸突生長、促進其凋亡;同時可降低VEGF、Bcl-2蛋白表達,促進Caspase-3蛋白表達。Bcl-2可阻止凋亡形成因子如細胞色素C等從線粒體釋放出來[9],Caspase-3可促進細胞DNA的降解從而導致細胞凋亡[10]。因此,我們初步推測抑制Claudin-3表達可能通過降低抗凋亡基因Bcl-2及促進凋亡基因Caspase-3的表達來影響RGC軸突生長及凋亡,其具體機制將在今后的研究中進一步深入的探討。
本研究結果還發現,抑制Claudin-3基因表達會減少VEGF的表達。近年來一些研究均證實VEGF具有神經保護作用。VEGF會促進損傷后神經功能的恢復[11];直接作用于神經,如VEGF可促進神經軸突的生長和體外培養神經細胞的存活[12]。VEGF可保護由于缺氧引起的小鼠海馬神經元細胞和體外培養的大腦皮質神經元的死亡[13,14]。因此,我們推測AAV介導shRNA干擾抑制Claudin-3表達抑制RGC軸突的生長,促進細胞的凋亡可能與其下調VEGF表達也有關,具體機制有待進一步深入研究。
本研究首次發現AAV介導shRNA干擾抑制Claudin-3的表達會下調VEGF、Bcl-2及上調Caspase-3的表達,抑制RGC軸突的生長,促進RGC凋亡,降低其存活率。為視網膜神經細胞性疾病的治療提供了新思路。
讀者?作者?編者 關于本刊財務收支過程中涉及到的財務管理規定及注意事項說明 本刊財務收支均由承辦單位四川大學華西醫院統一管理。華西醫院賬戶眾多收款項目中,期刊收支項目占比較小,安排的工作人員有限,但管理規定及執行程序同樣非常嚴格。為了提高效率,方便工作,現將版面費等支付過程中涉及到的財務管理規定及注意事項說明如下:稿件送修并確認刊載后本刊將通知作者按要求數額支付版面費。版面費可通過郵局或銀行支付。 郵局支付者,收款人請寫“編輯部”,不能寄給任何個人。匯款單附言欄必須注明開具發票的抬頭和刊用稿件的編號。發票抬頭若開具單位名稱,應以單位組織機構代碼中的規范名稱為準,如四川大學華西醫院。 通過銀行匯款的版面費均匯至四川大學華西醫院銀行賬戶。匯款者若為個人,應在匯款后當天將匯款憑證掃描或照相后發到編輯部(Email:coretina@163.com);若通過單位對公賬戶匯款,請在提交匯款申請后當日將匯款申請信息告之編輯部,1周內將匯款憑證掃描或照相后發到編輯部。以便及時查找確認并開具發票。若未能按要求時間完成上述工作,發票開具時間則不能確定。跨年的轉款項目財務部門原則上不再查賬并開具發票。 發票出具時,匯款者若為個人,發票抬頭只能開具匯款者姓名;發票抬頭若需開具單位名稱,則只能通過發票抬頭單位對公賬戶匯款。凡依據付款方要求出具一次發票后,不再重新開具任何需要修改發票抬頭等內容的發票。收到版面費后3個月內,以快遞方式寄出版面費發票。 版面費收取及發票查詢的聯系方式,聯系人:萬苗,電話:028-85422060。 除版面費外,其他與本刊相關的財務收支及發票出具注意事項參照上述規定和要求執行。 關于征集作者、讀者個人信息的說明 根據本刊完善讀者、作者信息資源數據庫需要以及中華醫學會有關學分證申領者個人信息提交的相關要求,便于在日常工作中有效便捷地與讀者、作者進行信息交流與溝通和參與繼續教育等學術交流活動后申領學分證,凡通過網站向本刊投稿以及參與本刊主辦的各類學術活動者,均請按要求提供完整準確的個人信息,以免個人信息不完整及后續反復索取影響信息交流和工作進程。前期曾經提供過相關信息,但后來信息有變更者請及時通知編輯部修訂更正。敬請廣大讀者、作者理解支持。讀者、作者的個人相關信息只用于與雜志出版和學術交流活動過程中必要信息交流溝通以及申報學分證之用,不會向第三方提供。特此說明。 本刊編輯部
視網膜神經節細胞(RGC)功能障礙是糖尿病視網膜病變、青光眼等多種眼部疾病發生和發展的重要因素之一[1,2]。本課題組前期研究首次發現Claudin-3表達于小鼠RGC中,且在不同的發育階段及病理狀態下Claudin-3的表達和分布不同,提示Claudin-3參與小鼠RGC氧化損傷的病理過程[3]。Claudin-3是近年來新發現的Claudins蛋白超家族成員之一,參與細胞增生分化、基因轉錄、腫瘤抑制等信號轉導過程[4]。為進一步探討Claudin-3對RGC的作用,我們通過用攜帶Claudin-3小發夾RNA(shRNA)的腺相關病毒(AAV)轉染體外培養的小鼠RGC,探討干擾抑制Claudin-3表達對RGC軸突生長、存活及凋亡的可能機制。現將結果報道如下。
1 材料和方法
鼠齡1~3 d的新生C57BL/6J小鼠購于中山大學動物實驗中心。293T細胞(人胚腎細胞系,購自深圳市百恩維生物科技有限公司);Neurobasal?-A培養基、谷氨酰胺、青霉素和鏈霉素(美國Gibco公司),木瓜蛋白酶(美國Worthington公司),β-肌動蛋白(β-actin)一抗、抗兔Claudin-3一抗(美國Invitrogen公司),抗鼠β-微管蛋白(β-tubulin)一抗(美國Abcam公司),Alexa fluor 488 熒光二抗、Alexa fluor555熒光二抗(美國Cell Signaling公司),反轉錄及cDNA合成試劑盒、實時聚合酶鏈反應(RT-PCR)試劑盒(瑞士Roche公司),辣根過氧化物酶標記的二抗(美國DAKO公司)。
AAV-shClaudin3 AAV、AAV-shScramble陰性AAV構建于深圳市百恩維生物科技有限公司,經合成送測序鑒定。
AAV轉染293T細胞。培養293T細胞,細胞融合度達60%~80%時,加入AAV-shClaudin3 AAV或AAV-shScramble陰性AAV,按最佳感染復數(MOI)=106轉染293T細胞。轉染96 h后,活細胞動態熒光顯微鏡觀察綠色熒光蛋白(GFP)表達情況,判斷轉染效率。MOI=加入病毒總數/細胞總數。
RGC原代培養。取10只鼠齡1~3 d的新生C57BL/6J小鼠的視網膜,消化后吸取含2%B27和1%谷氨酰胺的Neurobasal?-A培養基計數,調整細胞密度至1×106 個/ml。將細胞懸液接種于經多聚賴氨酸包被的24孔培養板或6孔培養板中,置于37℃、5% CO2孵箱內培養。其后每3天半定量換液,倒置熒光顯微鏡觀察細胞形態。
RGC免疫熒光鑒定。取原代RGC接種于置有蓋玻片的24孔板中,細胞培養至5 d時,行β-tubulin免疫熒光染色,激光共聚焦顯微鏡下隨機取4個視野對β-tubulin標記為陽性的RGC進行計數并拍照,以上實驗重復3次取平均值。
AAV轉染RGC。將細胞懸液接種于6孔培養板中,分為正常對照組、AAV-shScramble組和AAV-shClaudin3組。培養24 h后,按MOI=106轉染,AAV-shClaudin3組加入AAV-shClaudin-3 AAV液,AAV-shScramble組加入AAV-shScramble陰性AAV液,正常對照組加入正常神經細胞培養液,混勻,置于37℃、5%CO2培養箱中孵育培養,轉染96 h后,活細胞動態熒光顯微鏡觀察拍照。
RGC軸突長度測量。取原代RGC分為正常對照組、AAV-shScramble組和AAV-shClaudin3組;AAV轉染96 h后免疫熒光染色鑒定RGC。倒置熒光顯微鏡高倍鏡下拍照并記錄。采用Image J圖像處理軟件測量RGC軸突。每組至少隨機選擇30個RGC測量軸突長度,測量距離為胞體至每個細胞最長軸突位置。以上實驗重復3次取平均值。
RT-PCR檢測各組RGC Claudin-3、血管內皮生長因子(VEGF)mRNA表達。Claudin-3:上游引物5′-CGTACAAGACGAGACGGCCAAG-3′,下游引物 5′-CACGTACAACCCAGCTCCCATC-3′;VEGF:上游引物5′-TGAAGCCCTGGAGTGCGT-3′,下游引物5’-AGGTTTGATCCGCATGATCTG-3′;β-actin:上游引物5′-CATCCGTAAAGACCTCTATGCCAAC-3′,下游引物5′-ATGGAGCCACCGATCCACA-3′。接種于6孔培養板的RGC分為正常對照組、AAV-shScramble組、AAV-shClaudin3組,AAV轉染96 h后,提取總RNA,將總RNA逆轉錄成cDNA。將各組RGC的cDNA行RT-PCR檢測,采用相對定量方法,設定正常對照組表達量為基準,定為1.0,其他各組與之作比較。實驗均重復3次取平均值。
蛋白免疫印跡法(Western blot)檢測RGC Claudin-3、VEGF、Bcl-2、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)蛋白表達水平。接種于6孔培養板的RGC分為正常對照組、AAV-shScramble組、AAV-shClaudin3組,AAV轉染96 h后,取蛋白樣品于十二烷基硫酸鈉聚丙烯酰胺凝膠電泳凝膠中電泳,經電轉、孵育相應一抗和二抗后行增強化學發光定影、顯影并掃描分析。
采用SPSS 19.0統計軟件行統計學分析處理。多組間比較行單因素方差分析;兩兩比較行最小顯著差法(每組n>3)或Studentt檢驗(每組n=3)。α=0.05,P<0.05為差異有統計學意義。
2 結果
pAAV-ZsGreen-shClaudin-3測序結果顯示,插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架,pAAV-ZsGreen-shClaudin-3質粒構建成功(圖1)。
 圖1
pAAV-ZsGreen-shClaudin3質粒測序圖。插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架
圖1
pAAV-ZsGreen-shClaudin3質粒測序圖。插入片斷與設計序列完全一致,shRNA編碼序列被正確插入質粒骨架
活細胞動態熒光顯微鏡觀察發現,AAV轉染293T細胞96 h后,293T細胞病毒轉染效率>90%(圖2)。

倒置相差顯微鏡觀察發現,細胞接種24 h后,可見細胞基本貼壁,大部分細胞聚集成簇(圖3A);48 h后,具有軸突的細胞數量明顯增多(圖3B);72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接(圖3C);7 d后,細胞開始出現凋亡,數量減少(圖3D)。激光共聚焦顯微鏡像觀察發現,分離混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達(圖4)。
 圖3
培養的RGC倒置相差顯微鏡像。3A. 培養24 h后,細胞基本貼壁;3B. 培養48 h后,伸出軸突的細胞數量明顯增多;3C. 培養72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接;3D. 培養7 d后,RGC開始出現凋亡,數量減少 標尺:50 μm
圖3
培養的RGC倒置相差顯微鏡像。3A. 培養24 h后,細胞基本貼壁;3B. 培養48 h后,伸出軸突的細胞數量明顯增多;3C. 培養72 h后,部分軸突長度可達到胞體的4倍以上,細胞間或細胞自身軸突間相互連接;3D. 培養7 d后,RGC開始出現凋亡,數量減少 標尺:50 μm
 圖4
RGC激光共聚焦顯微鏡像。4A. β-tubulin標記的RGC呈紅色熒光;4B. RGC可見GFP;4G. 4',6-二脒基-2-苯基吲哚標記的RGC呈藍色熒光;4H. 共定位。混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達 標尺:10 μm
圖4
RGC激光共聚焦顯微鏡像。4A. β-tubulin標記的RGC呈紅色熒光;4B. RGC可見GFP;4G. 4',6-二脒基-2-苯基吲哚標記的RGC呈藍色熒光;4H. 共定位。混合培養的RGC陽性率>80%,Claudin-3和RGC呈共定位表達 標尺:10 μm
活細胞動態熒光顯微鏡像觀察發現,AAV以MOI=106轉染RGC 96 h后,AAV-shScramble組和AAV-shClaudin3組RGC病毒轉染效率均>50%(圖5)。

激光共聚焦顯微鏡觀察發現,β-tubulin抗體免疫熒光染色顯示的RGC胞體和軸突,AAV轉染RGC 96 h后,AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯降低(圖6),差異有統計學意義(F=2 363.274,P<0.05),正常對照組、AAV-shScramble組之間RGC軸突長度比較,差異無統計學意義(F=2.785,P>0.05)(圖7)。

 圖7
三組RGC軸突長度測量結果。AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯縮短。*與AAV-shClaudin3組比較,P<0.05
圖7
三組RGC軸突長度測量結果。AAV-shClaudin3組RGC軸突長度較正常對照組、AAV-shScramble組明顯縮短。*與AAV-shClaudin3組比較,P<0.05
熒光顯微鏡觀察發現,AAV轉染RGC 96 h后,AAV-shClaudin3組RGC密度較正常對照組、AAV-shScramble組明顯減低;AAV-shClaudin3組呈現細胞核凋亡特征,細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體(圖8)。
 圖8
三組RGC熒光顯微鏡像。8A、8B. 正常對照組;8C、8D. AAV-shScramble組;8E、8F. AAV-shClaudin3組。AAV-shClaudin3組RGC密度明顯減低;AAV-shClaudin3組可見細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體 DAPI 8A、8B、8E標尺:50 μm;8B、8D、8F 標尺:10 μm
圖8
三組RGC熒光顯微鏡像。8A、8B. 正常對照組;8C、8D. AAV-shScramble組;8E、8F. AAV-shClaudin3組。AAV-shClaudin3組RGC密度明顯減低;AAV-shClaudin3組可見細胞核皺縮、趨邊以及細胞核裂解形成的凋亡小體 DAPI 8A、8B、8E標尺:50 μm;8B、8D、8F 標尺:10 μm
RT-PCR檢測結果顯示,AAV-shClaudin3組RGC Claudin-3、VEGF mRNA表達較正常對照組、AAV-shScramble組下降,差異均有統計學意義(F=257.408、160.533,P<0.05),正常對照組、AAV-shScramble組之間RGC Claudin-3、VEGF mRNA表達比較,差異無統計學(F=2.375,3.028,P>0.05)(圖9)。
 圖9
Claudin-3、VEGF mRNA表達結果。9A. Claudin-3 mRNA;9B. VEGF mRNA。AAV-shClaudin3組RGC Claudin-3及VEGF mRNA表達較正常對照組、AAV-shScramble組降低。*與AAV-shClaudin3組比較,P<0.05
圖9
Claudin-3、VEGF mRNA表達結果。9A. Claudin-3 mRNA;9B. VEGF mRNA。AAV-shClaudin3組RGC Claudin-3及VEGF mRNA表達較正常對照組、AAV-shScramble組降低。*與AAV-shClaudin3組比較,P<0.05
Western blot檢測結果顯示,與正常對照組、AAV-shScramble組比較,AAV-shClaudin3組RGC Claudin-3、VEGF、Bcl-2蛋白表達明顯降低(F=129.671、420.552、62.669),Caspase-3蛋白表達明顯升高(F=231.348),差異均有統計學意義(P<0.05),正常對照組、AAV-shScramble組之間Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達比較,差異無統計學意義(F=0.529、4.011、2.286、4.378,P>0.05)(圖10)。
 圖10
三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達情況。10A. 電泳圖;10B. 三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達結果。AAV-shClaudin3組RGC中Claudin-3、VEGF、Bcl-2蛋白表達較正常對照組、AAV-shScramble組明顯降低;Caspase-3蛋白表達明顯升高。*與AAV-shClaudin3組比較,P<0.05
圖10
三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達情況。10A. 電泳圖;10B. 三組RGC Claudin-3、VEGF、Bcl-2、Caspase-3蛋白表達結果。AAV-shClaudin3組RGC中Claudin-3、VEGF、Bcl-2蛋白表達較正常對照組、AAV-shScramble組明顯降低;Caspase-3蛋白表達明顯升高。*與AAV-shClaudin3組比較,P<0.05
3 討論
shRNA進入細胞后形成RNA誘導沉默復合體,導致靶mRNA的降解,從而抑制相關基因表達,目前已廣泛應用于各種基因干擾設計[5]。AAV載體具有無致病性,低免疫原性,可介導外源基因長期表達等優點,已嘗試用于多種疾病的治療[6,7]。本研究首次應用AAV介導shRNA干擾抑制Claudin-3顯著下調Claudin-3基因和蛋白表達水平,進而抑制體外培養小鼠RGC軸突生長,促進其凋亡。
Claudin-3作為Claudins蛋白超家族成員之一,在調控細胞增生凋亡、腫瘤生長等信號轉導過程中有重要作用[8]。本研究結果發現,抑制Claudin-3表達會抑制RGC的軸突生長、促進其凋亡;同時可降低VEGF、Bcl-2蛋白表達,促進Caspase-3蛋白表達。Bcl-2可阻止凋亡形成因子如細胞色素C等從線粒體釋放出來[9],Caspase-3可促進細胞DNA的降解從而導致細胞凋亡[10]。因此,我們初步推測抑制Claudin-3表達可能通過降低抗凋亡基因Bcl-2及促進凋亡基因Caspase-3的表達來影響RGC軸突生長及凋亡,其具體機制將在今后的研究中進一步深入的探討。
本研究結果還發現,抑制Claudin-3基因表達會減少VEGF的表達。近年來一些研究均證實VEGF具有神經保護作用。VEGF會促進損傷后神經功能的恢復[11];直接作用于神經,如VEGF可促進神經軸突的生長和體外培養神經細胞的存活[12]。VEGF可保護由于缺氧引起的小鼠海馬神經元細胞和體外培養的大腦皮質神經元的死亡[13,14]。因此,我們推測AAV介導shRNA干擾抑制Claudin-3表達抑制RGC軸突的生長,促進細胞的凋亡可能與其下調VEGF表達也有關,具體機制有待進一步深入研究。
本研究首次發現AAV介導shRNA干擾抑制Claudin-3的表達會下調VEGF、Bcl-2及上調Caspase-3的表達,抑制RGC軸突的生長,促進RGC凋亡,降低其存活率。為視網膜神經細胞性疾病的治療提供了新思路。
讀者?作者?編者 關于本刊財務收支過程中涉及到的財務管理規定及注意事項說明 本刊財務收支均由承辦單位四川大學華西醫院統一管理。華西醫院賬戶眾多收款項目中,期刊收支項目占比較小,安排的工作人員有限,但管理規定及執行程序同樣非常嚴格。為了提高效率,方便工作,現將版面費等支付過程中涉及到的財務管理規定及注意事項說明如下:稿件送修并確認刊載后本刊將通知作者按要求數額支付版面費。版面費可通過郵局或銀行支付。 郵局支付者,收款人請寫“編輯部”,不能寄給任何個人。匯款單附言欄必須注明開具發票的抬頭和刊用稿件的編號。發票抬頭若開具單位名稱,應以單位組織機構代碼中的規范名稱為準,如四川大學華西醫院。 通過銀行匯款的版面費均匯至四川大學華西醫院銀行賬戶。匯款者若為個人,應在匯款后當天將匯款憑證掃描或照相后發到編輯部(Email:coretina@163.com);若通過單位對公賬戶匯款,請在提交匯款申請后當日將匯款申請信息告之編輯部,1周內將匯款憑證掃描或照相后發到編輯部。以便及時查找確認并開具發票。若未能按要求時間完成上述工作,發票開具時間則不能確定。跨年的轉款項目財務部門原則上不再查賬并開具發票。 發票出具時,匯款者若為個人,發票抬頭只能開具匯款者姓名;發票抬頭若需開具單位名稱,則只能通過發票抬頭單位對公賬戶匯款。凡依據付款方要求出具一次發票后,不再重新開具任何需要修改發票抬頭等內容的發票。收到版面費后3個月內,以快遞方式寄出版面費發票。 版面費收取及發票查詢的聯系方式,聯系人:萬苗,電話:028-85422060。 除版面費外,其他與本刊相關的財務收支及發票出具注意事項參照上述規定和要求執行。 關于征集作者、讀者個人信息的說明 根據本刊完善讀者、作者信息資源數據庫需要以及中華醫學會有關學分證申領者個人信息提交的相關要求,便于在日常工作中有效便捷地與讀者、作者進行信息交流與溝通和參與繼續教育等學術交流活動后申領學分證,凡通過網站向本刊投稿以及參與本刊主辦的各類學術活動者,均請按要求提供完整準確的個人信息,以免個人信息不完整及后續反復索取影響信息交流和工作進程。前期曾經提供過相關信息,但后來信息有變更者請及時通知編輯部修訂更正。敬請廣大讀者、作者理解支持。讀者、作者的個人相關信息只用于與雜志出版和學術交流活動過程中必要信息交流溝通以及申報學分證之用,不會向第三方提供。特此說明。 本刊編輯部