引用本文: 沈策英, 陳蘭蘭, 姜利斌, TimothyY.Y. Lai. 綠茶提取物表沒食子兒茶素-3-沒食子酸酯對慢性青光眼小鼠神經保護作用觀察. 中華眼底病雜志, 2017, 33(1): 70-73. doi: 10.3760/cma.j.issn.1005-1015.2017.01.019 復制
青光眼是以絕對性或相對性眼壓增高而致視網膜神經節細胞(RGC)進行性凋亡為特征的視神經退行性病變[1,2]。減緩或防止RGC凋亡是防治青光眼視神經病變的重點[3]。綠茶提取物表沒食子兒茶素-3-沒食子酸酯(EGCG)是一種具有多種生物學功效的強抗氧化劑,通過抗氧化-自由基清除、抗炎以及擴張血管而可能發揮神經保護作用[4-10]。我們的前期研究發現,通過口服或腹腔注射方式,EGCG能有效到達視網膜組織,對視神經鉗夾傷及N-甲基-D-天冬氨酸毒性損傷動物模型的RGC均有保護作用[11,12]。但EGCG是否對慢性高眼壓小鼠模型的RGC也具有保護作用目前尚不明確。為此,本研究觀察了口服EGCG對慢性高眼壓小鼠模型RGC的保護作用。現將結果報道如下。
1 材料和方法
1.1 實驗動物分組及建模
C57BL/6L雌性小鼠54只,鼠齡8周,體重20~30 g,由首都醫科大學實驗動物中心飼養(實驗動物使用許可證號:SYXK(京)2010-0020)。動物飼養、照明環境及實驗操作均符合國際關于眼科與視覺科學研究中使用實驗動物的相關規定。所有小鼠均在12 h明光/12 h暗光室溫環境中飼養,可自由獲取食物和水。實驗前對所有小鼠進行眼部檢查,排除任何眼部異常。采用隨機數字表法將小鼠隨機分為正常對照組(A組)、單純口服EGCG組(B組)、前房注射微球+口服日常飲用水組(C組)及前房注射微球+口服EGCG組(D組),分別為12、12、18、12只。每只小鼠每天飲入液體量相近,約9 ml/d。
C、D組小鼠參照文獻[13,14]的方法建立慢性高眼壓模型。按8 ml/kg的劑量腹腔注射10%水合氯醛(上海國藥集團化學試劑有限公司)全身麻醉小鼠,將直徑10 μm聚苯乙烯微球原始懸浮液(美國Invitrogen公司)在無菌磷酸鹽緩沖液(PBS)中配成濃度為9.0×106個/ml的懸浮液,通過30G胰島素針頭及相連的聚乙烯毛細管和漢密爾頓微量進樣器(美國Hamilton公司)將大約2 μl微球懸浮液注入小鼠左眼前房內,注射后用左氧氟沙星滴眼液(日本參天公司)點眼。B、D組小鼠按50 mg/kg·d的劑量口服EGCG。以C、D組小鼠注射微球后第15、27天為實驗觀察時間點,每組各取6只小鼠進行相應實驗。
于C、D組小鼠注射微球當天開始,每3天相同時間在小鼠全身麻醉狀態下,使用TonoLab回彈式眼壓計(芬蘭Colonial公司)測量各組小鼠雙眼眼壓[15]。每連續測量6次后通過儀器內置軟件去掉最高值、最低值后自動產生的數字為單次眼壓值。小鼠失去意識后5 min內共完成6次單次眼壓值測量,取平均值作為最終眼壓值。所有眼壓測量由同一操作人員完成。
1.2 經上丘熒光金逆行標記及β-Ⅲ-微管蛋白(tubulin)免疫組織化學染色標記的RGC計數
處死小鼠前5 d,將其頭部固定于立體定位儀上,暴露頭骨。標記小鼠前囟點,在前囟點后移4.0 mm、旁開±0.5 mm處定位雙側上丘,在相應定位點用顱鉆鉆2個直徑2 mm的骨孔,使用漢密爾頓注射器(美國Hamilton公司)吸取4%熒光金注射液(美國Biotium公司),各孔內深入硬腦膜下1.2 mm注入熒光金1 μl,注射時間15 min,停針5 min,緩慢取回針頭。然后將浸泡在4%熒光金注射液中的明膠海綿放置在骨孔上2 min。用5-0絲線縫合頭皮后,切口處涂抗生素眼膏。
將4%多聚甲醛溶入0.1 mmol/L pH值為7.2的PBS中。于熒光金逆行標記RGC 5 d后,在小鼠深度麻醉狀態下以20 ml/min的流速做心臟灌注。摘除眼球,在邊緣處標記12點時鐘位,浸入4%多聚甲醛中固定15 min。于赤道部切開眼球,去除晶狀體,將視網膜與鞏膜/脈絡膜分開,沿4個方向在視網膜上做均勻的放射狀切口,制備視網膜鋪片。上述過程在冰上操作,并始終注意避光。再將視網膜組織浸入4%多聚甲醛中固定1 h,滴加RGC特異性標志物β-Ⅲ-tubulin一抗(1:50,美國Cell Signaling公司)4 ℃條件下孵育過夜,用異硫氰酸熒光素標記的二抗(1:1000,美國Cell Signaling公司)37 ℃條件下孵育2 h。將視網膜鋪片置于樹膠載玻片上,熒光顯微鏡(DM6000B,德國Leica公司)下照相。距視盤1.0~1.5 mm,每個象限分別隨機選取2個視野,共8個視野,采集圖像。在不同濾波器下分別計數各組小鼠被熒光金標記及β-Ⅲ-tubulin標記的RGC數量。由兩位觀察者對RGC進行獨立計數,取兩位觀察者計數的平均值作為結果,計算RGC存活率。RGC存活率=前房注射微球眼存活RGC數量/對側眼RGC數量。
注射微球后第15、27天,C組各取3只小鼠,腹腔注射過量10%水合氯醛處死。摘除眼球,4%多聚甲醛溶液中固定,4 ℃過夜,蔗糖溶液中梯度脫水,OCT(日本東京Tissue-Tek公司)包埋。平行于垂直矢狀面行眼球切片,厚度為10 μm,行蘇木精-伊紅染色。光學顯微鏡(LEICA DM4000B,德國Leica公司)觀察小鼠前房角微球分布情況。
1.3 統計學方法
采用SPSS 13.0統計學軟件進行統計學處理。各組小鼠不同時間點的眼壓比較采用重復測量兩因素方差分析;各組小鼠不同時間點的RGC存活率比較采用區組設計兩因素方差分析;組間數據多重比較采用SNK-q檢驗。采用Pearson相關性分析法分析兩位觀察者RGC計數數據間的差異。P<0.05為差異有統計學意義。
2 結果
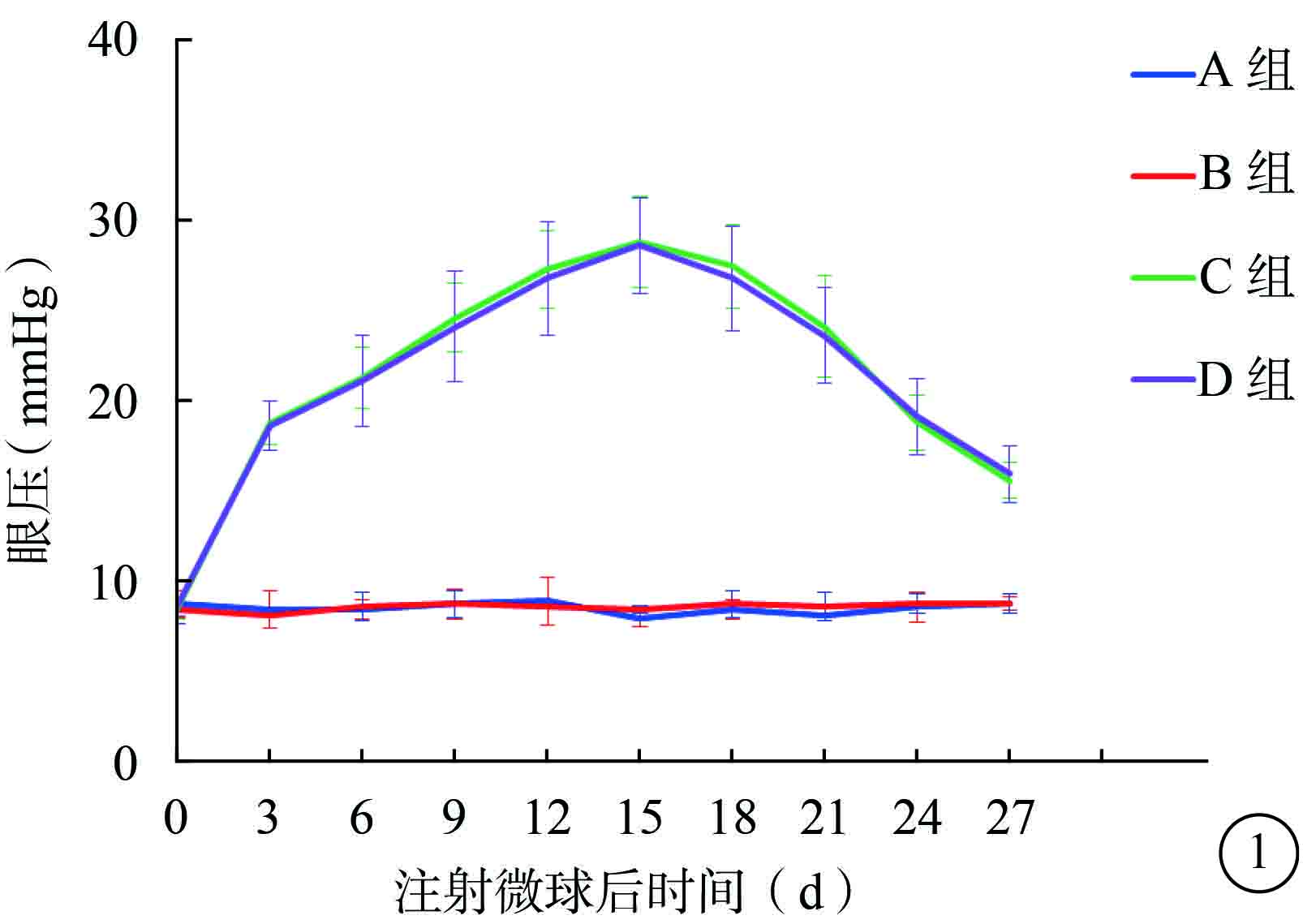
注射微球后第3天,C、D組小鼠眼壓較A、B組小鼠眼壓增高約125%。注射微球后第15天,A、B、C、D組小鼠眼壓分別為(7.83±0.40)、(8.33±0.21)、(28.67±2.50)、(28.50±2.66)mmHg(1 mm Hg=0.133 kPa)。C、D組小鼠眼壓達到峰值,較A、B組小鼠眼壓明顯增高,差異均有統計學意義(F=123.075,P<0.05)。A組與B組以及C組與D組小鼠之間的眼壓比較,差異無統計學意義(t=1.754、0.112,P>0.05)。注射微球后第27天,A、B、C、D組小鼠眼壓分別為(8.66±0.37)、(8.66±0.54)、(15.50±0.96)、(15.83±1.60)mmHg。C、D組小鼠眼壓較A、B組小鼠眼壓明顯增高,差異有統計學意義(F=61.540,P<0.05)。A組與B組以及C組與D組小鼠之間的眼壓比較,差異無統計學意義(t=0.415、0.426,P>0.05)(圖1)。
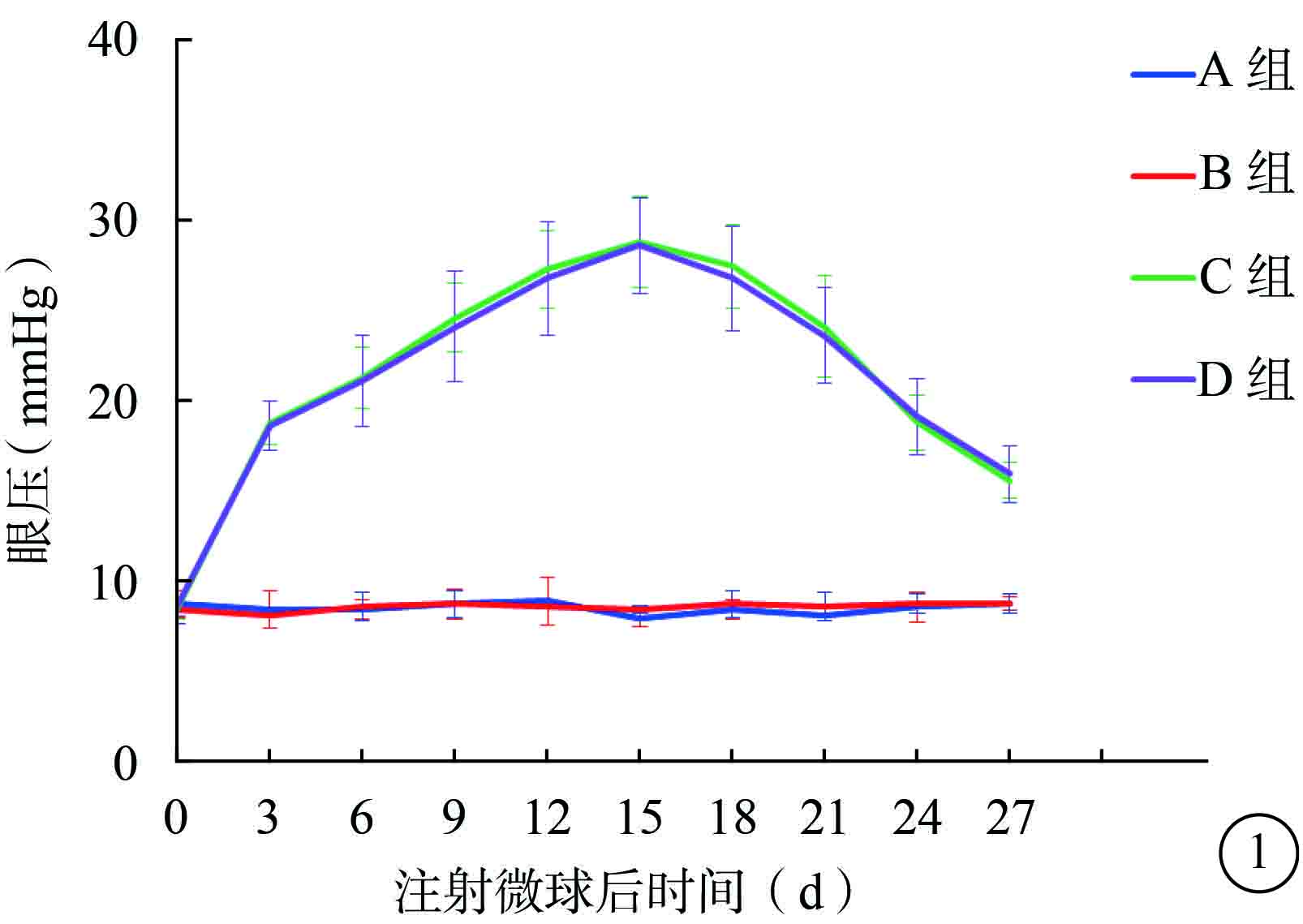 圖1
各組小鼠眼壓變化曲線
圖1
各組小鼠眼壓變化曲線
Pearson相關性分析結果顯示,兩位觀察者的RGC計數數據比較,差異無統計學意義(r=0.96,P>0.05)。注射微球后第15、27天,C組小鼠被熒光金逆行標記計數的RGC存活率分別為64.40%、52.16%;D組小鼠被熒光金逆行標記計數的RGC存活率分別為75.64%、65.88%。D組小鼠被熒光金逆行標記計數的RGC存活率較C組明顯增高,差異有統計學意義(t=4.111、5.995,P<0.01)。C、D組小鼠被熒光金逆行標記的RGC計數較A、B組明顯減少,差異有統計學意義(F=324.946、23.496,P<0.05)。A、B組小鼠被熒光金逆行標記的RGC計數比較,差異無統計學意義(t=0.473、0.401,P>0.05)。A、B組組內不同時間點被熒光金逆行標記的RGC計數比較,差異無統計學意義(t=0.126、0.149,P>0.05)。C、D組小鼠在注射微球后第27天被熒光金逆行標記的RGC計數較注射微球后第15天明顯下降,差異有統計學意義(t=4.840、3.820,P<0.05)(表1;圖2,3)。
 圖2
注射微球后第15天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。2A. A組;2B. B組;2C. C組;2D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
圖2
注射微球后第15天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。2A. A組;2B. B組;2C. C組;2D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
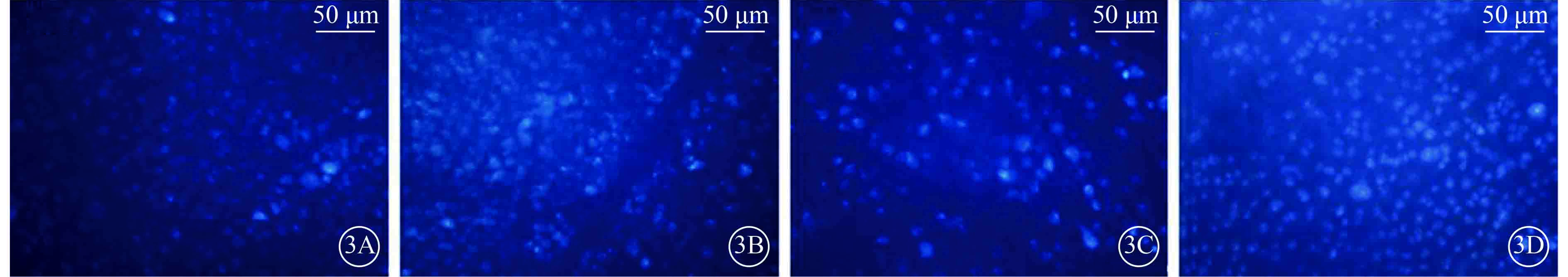 圖3
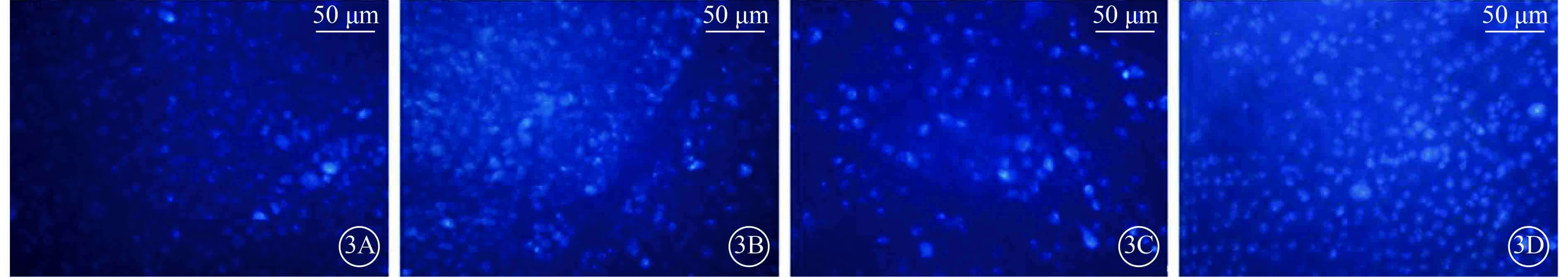
注射微球后第27天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。3A. A組;3B. B組;3C. C組;3D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
圖3
注射微球后第27天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。3A. A組;3B. B組;3C. C組;3D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
注射微球后第15、27天,C組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率分別為69.04%、56.61%,D組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率分別為78.99%、65.92%。D組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率較C組明顯增高,差異有統計學意義(t=4.265、3.759,P<0.01)。C、D組小鼠被β-Ⅲ-tubulin標記的RGC計數較A、B組明顯減少,差異有統計學意義(F=232.035、7.269,P<0.05)。A、B組小鼠被β-Ⅲ-tubulin標記的RGC計數比較,差異無統計學意義(t=0.295、0.324,P>0.05)。A、B組組內不同時間點被β-Ⅲ-tubulin標記的RGC計數比較,差異無統計學意義(t=0.187、0.038,P>0.05)。C、D組小鼠在注射微球后第27天被β-Ⅲ-tubulin標記的RGC計數較注射微球后第15天明顯下降,差異有統計學意義(t=5.005、5.031,P<0.05)(表1;圖4,5)。
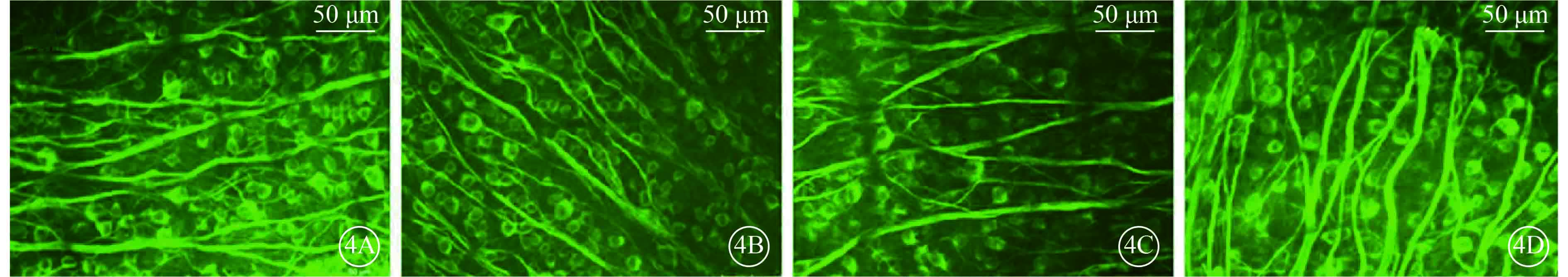 圖4
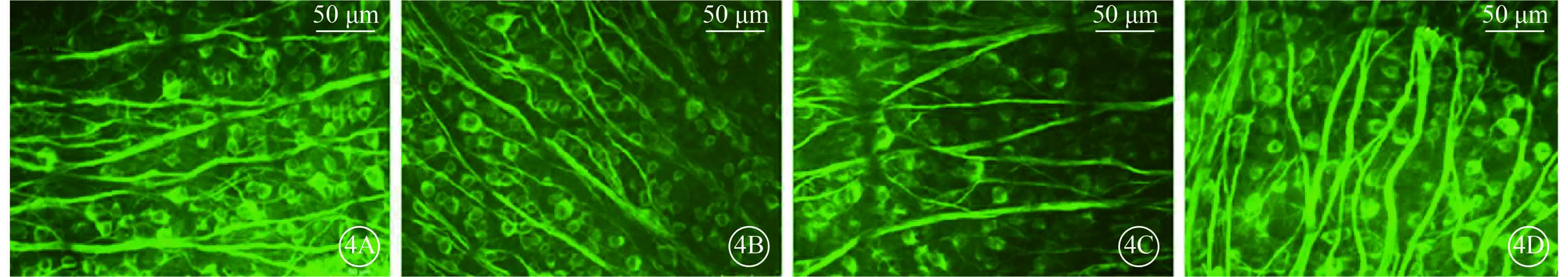
注射微球后第15天各組小鼠被β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。4A. A組;4B. B組;4C. C組;4D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
圖4
注射微球后第15天各組小鼠被β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。4A. A組;4B. B組;4C. C組;4D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
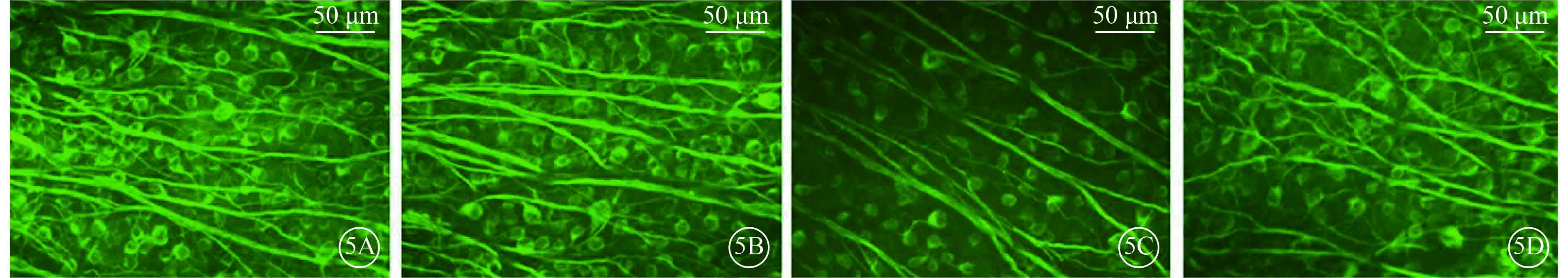 圖5
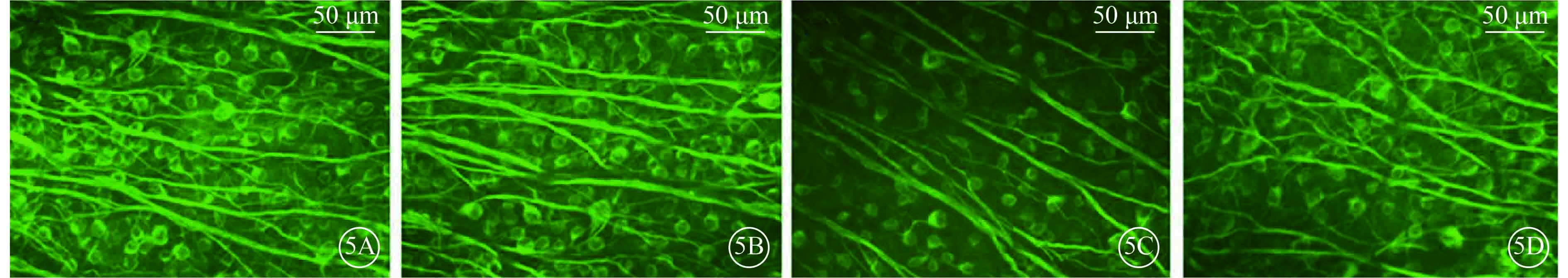
注射微球后第27天各組小鼠β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。5A. A組;5B. B組;5C. C組;5D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
圖5
注射微球后第27天各組小鼠β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。5A. A組;5B. B組;5C. C組;5D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
光學顯微鏡觀察發現,注射微球后第15、27天,C組小鼠前房角均可見密集微球聚集。
3 討論
本研究依據Sappington等[13]和Chen等[14]的方法,將聚苯乙烯微球一次性注入小鼠前房內建立慢性高眼壓模型。結果顯示,持續至注射微球后第27天,C、D組小鼠眼壓均較A、B組小鼠眼壓明顯增高,且RGC存活數量呈進行性降低。這表明本研究建立的慢性高眼壓模型成功地模擬了青光眼RGC退行性損傷。
經上丘熒光金逆行標記技術和β-Ⅲ-tubulin免疫組織化學染色方法觀察存活RGC已廣泛應用于青光眼基礎研究[16-20]。兩種方法同時用于計數RGC可彌補單種方法的不足,使結果更加客觀和準確[16-20]。本研究采用上述兩種方法評估了RGC退行性損傷程度以及EGCG對RGC的保護作用。結果顯示,在前房注射微球后第15、27天,D組小鼠的RGC存活率較C組小鼠的RGC存活率明顯提高。這提示口服EGCG對于慢性高眼壓小鼠RGC具有一定的保護作用,其確切的保護機制可能與EGCG多種生物學效應有關[5]。有研究發現,開角型青光眼和高眼壓患者口服3個月EGCG后,圖形視網膜電流圖(PERG)的振幅較初始或者口服安慰劑組有明顯升高,并據此認為EGCG可能對早中期青光眼患者內層視網膜功能具有保護作用[21]。本研究發現的口服EGCG可以提高慢性高眼壓小鼠RGC存活率的結果,可以在一定程度上解釋口服EGCG提高開角型青光眼患者PERG振幅的原因。但本研究結果顯示的EGCG對RGC保護性作用似乎比臨床觀察結果更為明顯,這種差異可能是由于我們所建立的青光眼模型僅限于高眼壓這一危險因素,而臨床中的青光眼發病機制存在著多種病理性因素。此外,我們還發現本研究中A組小鼠經熒光金逆行標記的RGC計數較其他研究者用同樣方法計數到的RGC數量要高[22]。分析這種偏差的產生可能與年齡相關的RGC丟失、制備視網膜鋪片過程或時間上的不同以及動物個體間差異有關。
本研究的不足之處在于沒有揭示出EGCG對慢性高眼壓小鼠RGC保護作用的確切機制;缺少對不同劑量EGCG神經保護作用的觀察。此外,EGCG對高眼壓下RGC保護作用是否會隨時間延長而消失等問題均有待進一步研究。
青光眼是以絕對性或相對性眼壓增高而致視網膜神經節細胞(RGC)進行性凋亡為特征的視神經退行性病變[1,2]。減緩或防止RGC凋亡是防治青光眼視神經病變的重點[3]。綠茶提取物表沒食子兒茶素-3-沒食子酸酯(EGCG)是一種具有多種生物學功效的強抗氧化劑,通過抗氧化-自由基清除、抗炎以及擴張血管而可能發揮神經保護作用[4-10]。我們的前期研究發現,通過口服或腹腔注射方式,EGCG能有效到達視網膜組織,對視神經鉗夾傷及N-甲基-D-天冬氨酸毒性損傷動物模型的RGC均有保護作用[11,12]。但EGCG是否對慢性高眼壓小鼠模型的RGC也具有保護作用目前尚不明確。為此,本研究觀察了口服EGCG對慢性高眼壓小鼠模型RGC的保護作用。現將結果報道如下。
1 材料和方法
1.1 實驗動物分組及建模
C57BL/6L雌性小鼠54只,鼠齡8周,體重20~30 g,由首都醫科大學實驗動物中心飼養(實驗動物使用許可證號:SYXK(京)2010-0020)。動物飼養、照明環境及實驗操作均符合國際關于眼科與視覺科學研究中使用實驗動物的相關規定。所有小鼠均在12 h明光/12 h暗光室溫環境中飼養,可自由獲取食物和水。實驗前對所有小鼠進行眼部檢查,排除任何眼部異常。采用隨機數字表法將小鼠隨機分為正常對照組(A組)、單純口服EGCG組(B組)、前房注射微球+口服日常飲用水組(C組)及前房注射微球+口服EGCG組(D組),分別為12、12、18、12只。每只小鼠每天飲入液體量相近,約9 ml/d。
C、D組小鼠參照文獻[13,14]的方法建立慢性高眼壓模型。按8 ml/kg的劑量腹腔注射10%水合氯醛(上海國藥集團化學試劑有限公司)全身麻醉小鼠,將直徑10 μm聚苯乙烯微球原始懸浮液(美國Invitrogen公司)在無菌磷酸鹽緩沖液(PBS)中配成濃度為9.0×106個/ml的懸浮液,通過30G胰島素針頭及相連的聚乙烯毛細管和漢密爾頓微量進樣器(美國Hamilton公司)將大約2 μl微球懸浮液注入小鼠左眼前房內,注射后用左氧氟沙星滴眼液(日本參天公司)點眼。B、D組小鼠按50 mg/kg·d的劑量口服EGCG。以C、D組小鼠注射微球后第15、27天為實驗觀察時間點,每組各取6只小鼠進行相應實驗。
于C、D組小鼠注射微球當天開始,每3天相同時間在小鼠全身麻醉狀態下,使用TonoLab回彈式眼壓計(芬蘭Colonial公司)測量各組小鼠雙眼眼壓[15]。每連續測量6次后通過儀器內置軟件去掉最高值、最低值后自動產生的數字為單次眼壓值。小鼠失去意識后5 min內共完成6次單次眼壓值測量,取平均值作為最終眼壓值。所有眼壓測量由同一操作人員完成。
1.2 經上丘熒光金逆行標記及β-Ⅲ-微管蛋白(tubulin)免疫組織化學染色標記的RGC計數
處死小鼠前5 d,將其頭部固定于立體定位儀上,暴露頭骨。標記小鼠前囟點,在前囟點后移4.0 mm、旁開±0.5 mm處定位雙側上丘,在相應定位點用顱鉆鉆2個直徑2 mm的骨孔,使用漢密爾頓注射器(美國Hamilton公司)吸取4%熒光金注射液(美國Biotium公司),各孔內深入硬腦膜下1.2 mm注入熒光金1 μl,注射時間15 min,停針5 min,緩慢取回針頭。然后將浸泡在4%熒光金注射液中的明膠海綿放置在骨孔上2 min。用5-0絲線縫合頭皮后,切口處涂抗生素眼膏。
將4%多聚甲醛溶入0.1 mmol/L pH值為7.2的PBS中。于熒光金逆行標記RGC 5 d后,在小鼠深度麻醉狀態下以20 ml/min的流速做心臟灌注。摘除眼球,在邊緣處標記12點時鐘位,浸入4%多聚甲醛中固定15 min。于赤道部切開眼球,去除晶狀體,將視網膜與鞏膜/脈絡膜分開,沿4個方向在視網膜上做均勻的放射狀切口,制備視網膜鋪片。上述過程在冰上操作,并始終注意避光。再將視網膜組織浸入4%多聚甲醛中固定1 h,滴加RGC特異性標志物β-Ⅲ-tubulin一抗(1:50,美國Cell Signaling公司)4 ℃條件下孵育過夜,用異硫氰酸熒光素標記的二抗(1:1000,美國Cell Signaling公司)37 ℃條件下孵育2 h。將視網膜鋪片置于樹膠載玻片上,熒光顯微鏡(DM6000B,德國Leica公司)下照相。距視盤1.0~1.5 mm,每個象限分別隨機選取2個視野,共8個視野,采集圖像。在不同濾波器下分別計數各組小鼠被熒光金標記及β-Ⅲ-tubulin標記的RGC數量。由兩位觀察者對RGC進行獨立計數,取兩位觀察者計數的平均值作為結果,計算RGC存活率。RGC存活率=前房注射微球眼存活RGC數量/對側眼RGC數量。
注射微球后第15、27天,C組各取3只小鼠,腹腔注射過量10%水合氯醛處死。摘除眼球,4%多聚甲醛溶液中固定,4 ℃過夜,蔗糖溶液中梯度脫水,OCT(日本東京Tissue-Tek公司)包埋。平行于垂直矢狀面行眼球切片,厚度為10 μm,行蘇木精-伊紅染色。光學顯微鏡(LEICA DM4000B,德國Leica公司)觀察小鼠前房角微球分布情況。
1.3 統計學方法
采用SPSS 13.0統計學軟件進行統計學處理。各組小鼠不同時間點的眼壓比較采用重復測量兩因素方差分析;各組小鼠不同時間點的RGC存活率比較采用區組設計兩因素方差分析;組間數據多重比較采用SNK-q檢驗。采用Pearson相關性分析法分析兩位觀察者RGC計數數據間的差異。P<0.05為差異有統計學意義。
2 結果
注射微球后第3天,C、D組小鼠眼壓較A、B組小鼠眼壓增高約125%。注射微球后第15天,A、B、C、D組小鼠眼壓分別為(7.83±0.40)、(8.33±0.21)、(28.67±2.50)、(28.50±2.66)mmHg(1 mm Hg=0.133 kPa)。C、D組小鼠眼壓達到峰值,較A、B組小鼠眼壓明顯增高,差異均有統計學意義(F=123.075,P<0.05)。A組與B組以及C組與D組小鼠之間的眼壓比較,差異無統計學意義(t=1.754、0.112,P>0.05)。注射微球后第27天,A、B、C、D組小鼠眼壓分別為(8.66±0.37)、(8.66±0.54)、(15.50±0.96)、(15.83±1.60)mmHg。C、D組小鼠眼壓較A、B組小鼠眼壓明顯增高,差異有統計學意義(F=61.540,P<0.05)。A組與B組以及C組與D組小鼠之間的眼壓比較,差異無統計學意義(t=0.415、0.426,P>0.05)(圖1)。
 圖1
各組小鼠眼壓變化曲線
圖1
各組小鼠眼壓變化曲線
Pearson相關性分析結果顯示,兩位觀察者的RGC計數數據比較,差異無統計學意義(r=0.96,P>0.05)。注射微球后第15、27天,C組小鼠被熒光金逆行標記計數的RGC存活率分別為64.40%、52.16%;D組小鼠被熒光金逆行標記計數的RGC存活率分別為75.64%、65.88%。D組小鼠被熒光金逆行標記計數的RGC存活率較C組明顯增高,差異有統計學意義(t=4.111、5.995,P<0.01)。C、D組小鼠被熒光金逆行標記的RGC計數較A、B組明顯減少,差異有統計學意義(F=324.946、23.496,P<0.05)。A、B組小鼠被熒光金逆行標記的RGC計數比較,差異無統計學意義(t=0.473、0.401,P>0.05)。A、B組組內不同時間點被熒光金逆行標記的RGC計數比較,差異無統計學意義(t=0.126、0.149,P>0.05)。C、D組小鼠在注射微球后第27天被熒光金逆行標記的RGC計數較注射微球后第15天明顯下降,差異有統計學意義(t=4.840、3.820,P<0.05)(表1;圖2,3)。
 圖2
注射微球后第15天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。2A. A組;2B. B組;2C. C組;2D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
圖2
注射微球后第15天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。2A. A組;2B. B組;2C. C組;2D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
 圖3
注射微球后第27天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。3A. A組;3B. B組;3C. C組;3D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
圖3
注射微球后第27天各組小鼠被熒光金逆行標記的RGC熒光顯微鏡像。3A. A組;3B. B組;3C. C組;3D. D組。A、B組小鼠被熒光金逆行標記的RGC數量相當,C、D組小鼠被熒光金逆行標記的RGC數量較A、B組明顯減少,D組小鼠被熒光金逆行標記的RGC數量較C組明顯增多
注射微球后第15、27天,C組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率分別為69.04%、56.61%,D組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率分別為78.99%、65.92%。D組小鼠被β-Ⅲ-tubulin標記計數的RGC存活率較C組明顯增高,差異有統計學意義(t=4.265、3.759,P<0.01)。C、D組小鼠被β-Ⅲ-tubulin標記的RGC計數較A、B組明顯減少,差異有統計學意義(F=232.035、7.269,P<0.05)。A、B組小鼠被β-Ⅲ-tubulin標記的RGC計數比較,差異無統計學意義(t=0.295、0.324,P>0.05)。A、B組組內不同時間點被β-Ⅲ-tubulin標記的RGC計數比較,差異無統計學意義(t=0.187、0.038,P>0.05)。C、D組小鼠在注射微球后第27天被β-Ⅲ-tubulin標記的RGC計數較注射微球后第15天明顯下降,差異有統計學意義(t=5.005、5.031,P<0.05)(表1;圖4,5)。
 圖4
注射微球后第15天各組小鼠被β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。4A. A組;4B. B組;4C. C組;4D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
圖4
注射微球后第15天各組小鼠被β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。4A. A組;4B. B組;4C. C組;4D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
 圖5
注射微球后第27天各組小鼠β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。5A. A組;5B. B組;5C. C組;5D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
圖5
注射微球后第27天各組小鼠β-Ⅲ-tubulin標記的RGC熒光顯微鏡像。5A. A組;5B. B組;5C. C組;5D. D組。A、B組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量相當,C、D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較A、B組明顯減少,D組小鼠β-Ⅲ-tubulin呈陽性表達的RCG數量較C組明顯增多
光學顯微鏡觀察發現,注射微球后第15、27天,C組小鼠前房角均可見密集微球聚集。
3 討論
本研究依據Sappington等[13]和Chen等[14]的方法,將聚苯乙烯微球一次性注入小鼠前房內建立慢性高眼壓模型。結果顯示,持續至注射微球后第27天,C、D組小鼠眼壓均較A、B組小鼠眼壓明顯增高,且RGC存活數量呈進行性降低。這表明本研究建立的慢性高眼壓模型成功地模擬了青光眼RGC退行性損傷。
經上丘熒光金逆行標記技術和β-Ⅲ-tubulin免疫組織化學染色方法觀察存活RGC已廣泛應用于青光眼基礎研究[16-20]。兩種方法同時用于計數RGC可彌補單種方法的不足,使結果更加客觀和準確[16-20]。本研究采用上述兩種方法評估了RGC退行性損傷程度以及EGCG對RGC的保護作用。結果顯示,在前房注射微球后第15、27天,D組小鼠的RGC存活率較C組小鼠的RGC存活率明顯提高。這提示口服EGCG對于慢性高眼壓小鼠RGC具有一定的保護作用,其確切的保護機制可能與EGCG多種生物學效應有關[5]。有研究發現,開角型青光眼和高眼壓患者口服3個月EGCG后,圖形視網膜電流圖(PERG)的振幅較初始或者口服安慰劑組有明顯升高,并據此認為EGCG可能對早中期青光眼患者內層視網膜功能具有保護作用[21]。本研究發現的口服EGCG可以提高慢性高眼壓小鼠RGC存活率的結果,可以在一定程度上解釋口服EGCG提高開角型青光眼患者PERG振幅的原因。但本研究結果顯示的EGCG對RGC保護性作用似乎比臨床觀察結果更為明顯,這種差異可能是由于我們所建立的青光眼模型僅限于高眼壓這一危險因素,而臨床中的青光眼發病機制存在著多種病理性因素。此外,我們還發現本研究中A組小鼠經熒光金逆行標記的RGC計數較其他研究者用同樣方法計數到的RGC數量要高[22]。分析這種偏差的產生可能與年齡相關的RGC丟失、制備視網膜鋪片過程或時間上的不同以及動物個體間差異有關。
本研究的不足之處在于沒有揭示出EGCG對慢性高眼壓小鼠RGC保護作用的確切機制;缺少對不同劑量EGCG神經保護作用的觀察。此外,EGCG對高眼壓下RGC保護作用是否會隨時間延長而消失等問題均有待進一步研究。