引用本文: 張惟, 楊婧, 陳松, 何廣輝, 馬映雪, 陳莉, 姜鑒洪, 宋建. 氧化應激下視網膜色素上皮細胞外泌體對視網膜色素上皮細胞血管內皮生長因子A及絲氨酸/蘇氨酸激酶表達的影響. 中華眼底病雜志, 2017, 33(1): 57-61. doi: 10.3760/cma.j.issn.1005-1015.2017.01.015 復制
研究表明,氧化應激反應引起了老年性黃斑變性(AMD)的早期改變;隨年齡增長,氧化應激對視網膜的損傷加重,相關物質在視網膜色素上皮細胞(RPE)中累積[1]。外泌體是一種直徑約30~200 nm的囊泡樣小體,可從各種細胞中獲得,參與細胞-細胞間通信,在生理及病理條件下發揮免疫作用并具有潛在的治療應用價值[2]。已有研究發現,在AMD發病過程中 RPE 可能通過外泌體參與玻璃膜疣形成,外泌體同時參與補體激活[3]。為了進一步驗證 RPE 細胞外泌體在AMD發病中的作用,本研究分離提取氧化應激下的RPE外泌體作用于正常RPE細胞,觀察其對細胞增生及血管內皮生長因子(VEGF)-A、絲氨酸/蘇氨酸激酶(Akt)表達的影響,以期為AMD的發病機制研究提供新的方法及研究思路。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
人RPE細胞株(ARPE-19 細胞,美國 ATCC 公司),Dulbecco改良Eagle培養基(DMEM培養基)、胎牛血清(美國Gibco公司),去外泌體胎牛血清(exo-FBS)、外泌體提取試劑盒(美國 SBI 公司),BioTrace?NT 硝酸纖維素膜(美國Millipore公司),Trizol RNA提取試劑盒(美國Invitrogen公司),M-MLV逆轉錄酶、RNA酶抑制劑(日本Takara公司),Western Lightning增強化學發光試劑盒(美國 Perkin Elmer公司),噻唑藍(MTT,上海碧云天生物技術有限公司),小鼠抗人CD63單克隆抗體(亞諾法生技股份有限公司),VEGF-A 一抗、辣根過氧化物酶(HRP)標記二抗(北京中杉金橋生物技術有限公司),TES1332A數字照度計(中國臺灣泰仕電子工業股份有限公司),20 W醫用藍光燈管(上海電工儀器廠),低溫超速離心機(美國Beckman公司)。
1.2 RPE 細胞外泌體的分離提取及鑒定
取對數生長期的ARPE-19貼壁細胞制成1×106 個/ ml的單細胞懸液,接種于96孔板置于37 ℃、5% CO2 恒溫培養箱中。細胞單層鋪滿孔底后吸棄原培養液,取魚藤酮2.5 μmol/L加入細胞培養基中,培養24 h后棄去含魚藤酮的培養液,加入含10% exo-FBS的DMEM培養基,培養氧化應激下ARPE-19細胞,24~36 h后收集細胞培養上清液,分離提取并鑒定外泌體。提取的氧化應激下ARPE-19細胞外泌體用磷酸鹽緩沖液(PBS)重懸后,?80 ℃低溫儲存備用。
按外泌體提取試劑盒說明書提取外泌體,將收集的細胞培養上清液移置離心管中,4 ℃條件下3000×g離心30 min去除細胞及碎片,然后濃縮細胞培養上清液。吸取上清液置于裝有Ultracel-30超濾膜 Amicon Ultra-15 ml離心超濾管中,4 ℃ 條件下4000×g離心50 min,吸取超濾膜內超濾液。按 2∶1的比例加入 Exo Quick提取液,混勻后靜置過夜,4 ℃條件下離心后將所獲得的外泌體沉淀用 PBS 重懸,?80 ℃凍存備用。
取外泌體懸液10 μl,加入PBS稀釋后,滴加在2 mm的載樣銅網上,室溫下靜置1 min,將多余液體用濾紙吸去,用3%磷鎢酸鈉溶液負染5 min,PBS洗一遍后晾干。透射電子顯微鏡80~120 kV 下觀察外泌體的形態特征并拍攝照片。
參照文獻[4,5] 的方法,采用蛋白免疫印跡法(Western blot)檢測ARPE-19細胞外泌體表面特異標志蛋白CD63 的表達。取20 μg外泌體懸液,加入蛋白上樣緩沖液,95 ℃煮沸5 min。冷卻后經14%聚丙烯酰胺凝膠電泳,轉移到聚偏二氟乙烯膜上。用5%脫脂奶粉封閉2 h。加入用抗體稀釋液稀釋的鼠抗人CD63單克隆抗體一抗(1∶500)4 ℃過夜,含吐溫20的三羥甲基氨基甲烷緩沖液(TBST)洗膜3次,10 min/次。加入用抗體稀釋液稀釋的 HRP 標記的二抗(1∶2000),室溫下緩慢振搖2 h,TBST洗膜3次,10 min/次。應用超敏化學發光試劑盒顯色2 min,X 光片顯影。
1.3 實驗分組及各組ARPE-19細胞的細胞活力和VEGF-A、Akt表達檢測
將氧化應激下200 μg/ml的ARPE-19細胞外泌體與ARPE-19細胞共培養作為實驗組,等量正常RPE外泌體與ARPE-19細胞共培養作為對照組。在 37 ℃、5% CO2培養箱中培養48 h,培養期間更換無血清培養基培養。
采用MTT比色法檢測ARPE-19細胞的細胞活力。取對數生長期的ARPE-19貼壁細胞制成1×106 個/ ml 的單細胞懸液,將細胞接種于96孔板,每孔加細胞懸液100 μl培養2 d使細胞貼壁。每孔加20 μl的MTT溶液,培養4 h后加入150 μl的二甲基亞砜。采用酶聯免疫檢測儀檢測波長570 nm 處各孔的吸光度[A,舊稱光密度(OD)]值。
采用免疫熒光染色法和Western blot檢測ARPE-19 細胞VEGF-A、Akt蛋白表達。ARPE-19細胞消化脫壁后,按細胞密度5×106 個/L、每孔1 ml接種于預先置有已消毒4 mm× 4 mm大小蓋玻片的24孔板內。4 ℃ 多聚甲醛固定 15 min,將已固定的細胞爬片用 4′,6-二脒基-2-苯基吲哚(DAPI)及HRP標記的二抗染色行VEGF-A和Akt免疫組織化學鑒定。熒光顯微鏡下隨機測量每張爬片3個高倍視野的VEGF-A和Akt蛋白陽性表達面積(像素值),取其平均值代表VEGF-A和Akt蛋白的陽性表達值。用Image J凝膠分析軟件分析VEGF-A與Akt特異性條帶A 值,以磷酸甘油醛脫氫酶(GAPDH)為內參照。以VEGF-A或Akt條帶A 值與GAPDH條帶A 值的比值表示VEGF-A或Akt蛋白的相對表達量。
參照文獻[6] 的方法,采用實時定量聚合酶鏈反應(RT-PCR)檢測ARPE-19 細胞 VEGF-A、Akt mRNA 表達。運用 Primer Premier 5.0軟件設計引物。VEGF-A:上游引物 5′-GAGCCTTGCCTTGCTGCTCTAC-3′,下游引物 5′-TGGCACCCAGCACAATGAA -3′,擴增片段長度為153堿基對(bp);Akt:上游引物5′-GGACAACCGCCATCCAGACT -3′,下游引物 5′- GCCAGGGACACCTCCATCTC-3′,擴增片段長度為 178 bp;內參照 GAPDH:上游引物5′-GAGTCAACGGATTTGGTCGT-3′,下游引物5′-TTGATTTTGGAGGGATCTCG-3′,擴增片段長度為106 bp。反應條件:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s。變性、退火、延伸重復39個循環。將得到的循環閾值(CT)數據與內參照分析處理后,采用2-△△CT法計算目的基因相對表達量。
1.4 統計學方法
采用SPSS18.0統計軟件進行統計學分析,實驗數據用均數±標準差( )表示。兩組間數據比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
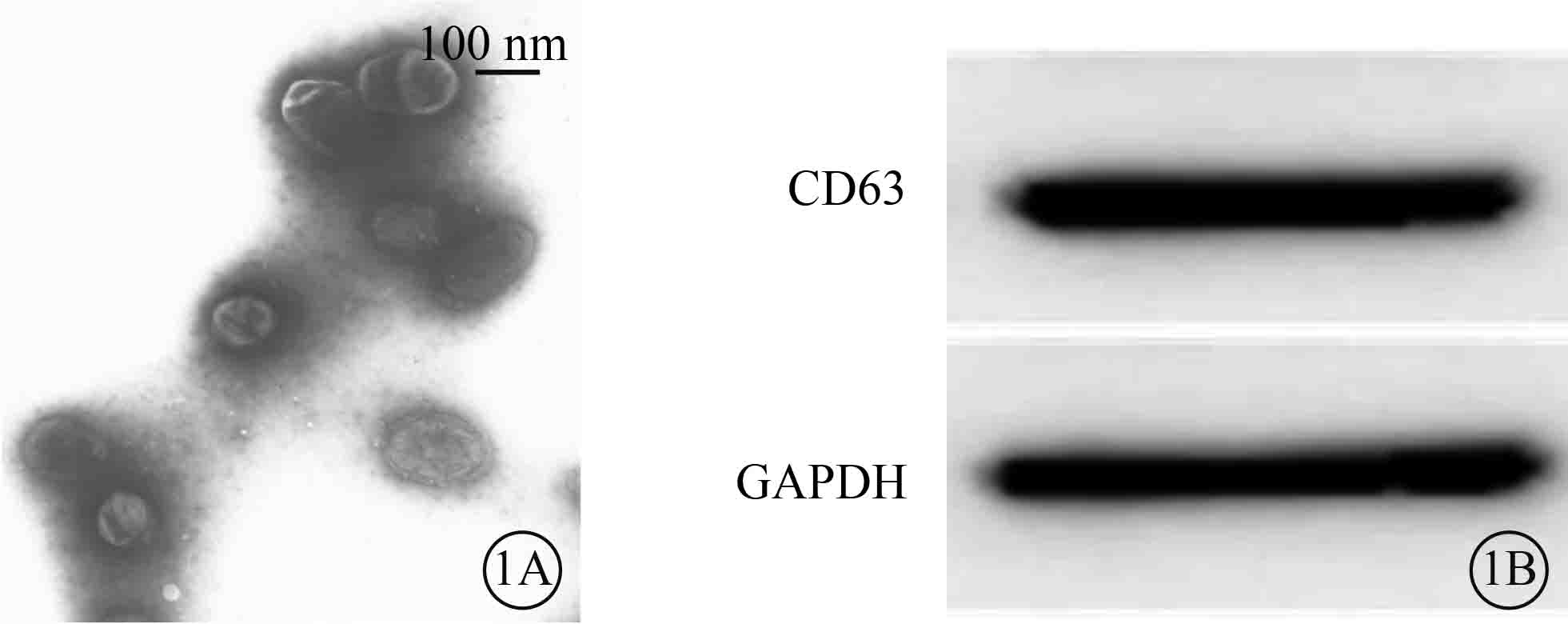
透射電子顯微鏡觀察發現,ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡;直徑50~150 nm,平均直徑(107.71 ± 47.57)nm;囊泡內存在低電子密度成分(圖 1A)。Western blot檢測結果顯示,ARPE-19細胞外泌體表面表達特異性標志蛋白CD63(圖 1B)。
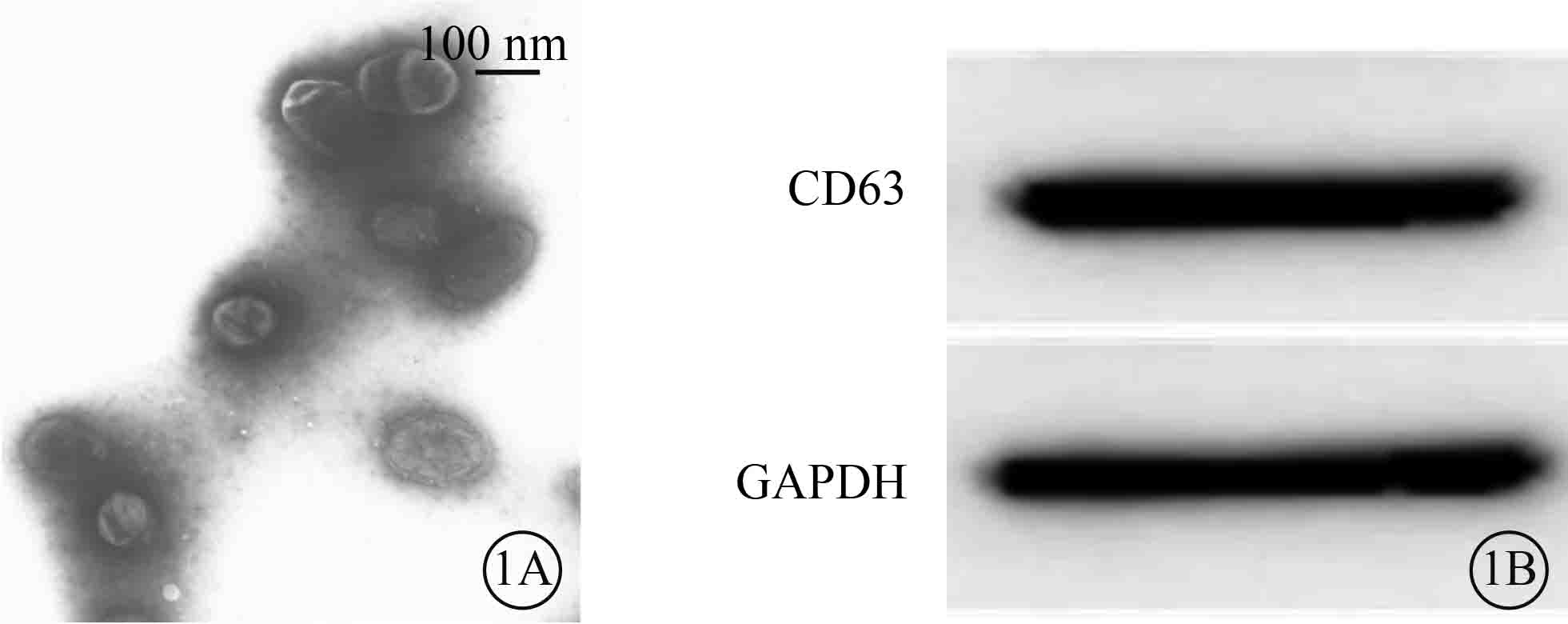 圖1
ARPE-19細胞外泌體鑒定像。1A.透射電子顯微鏡像,可見ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡,囊泡內存在低電子密度成分;1B.ARPE-19細胞外泌體表面特異性標志蛋白CD63 Western blot檢測像
圖1
ARPE-19細胞外泌體鑒定像。1A.透射電子顯微鏡像,可見ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡,囊泡內存在低電子密度成分;1B.ARPE-19細胞外泌體表面特異性標志蛋白CD63 Western blot檢測像
MTT比色法結果顯示,實驗組、對照組ARPE-19 細胞在波長570 nm處的A 值分別為0.582±0.015、0.787±0.032。實驗組 ARPE-19細胞在波長570 nm處的A值較對照組明顯降低,差異有統計學意義(t =20.886,P<0.05)。
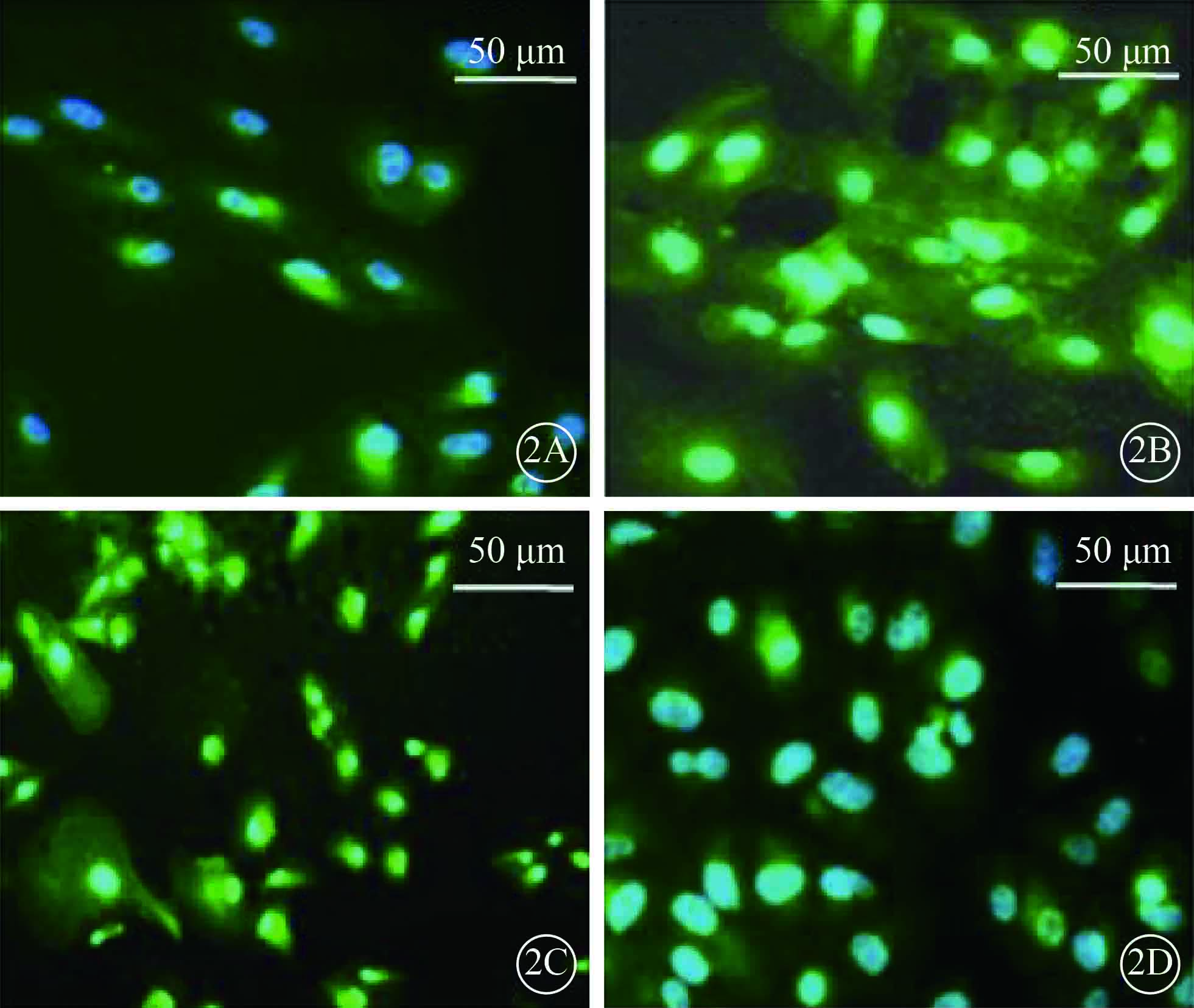
熒光顯微鏡觀察發現,DAPI將細胞核染成藍色,以HRP標記的二抗將VEGF-A、Akt蛋白染成綠色。免疫熒光檢測結果顯示,與對照組比較,實驗組ARPE-19細胞VEGF-A蛋白表達明顯增強,Akt蛋白表達明顯減弱(圖 2)。
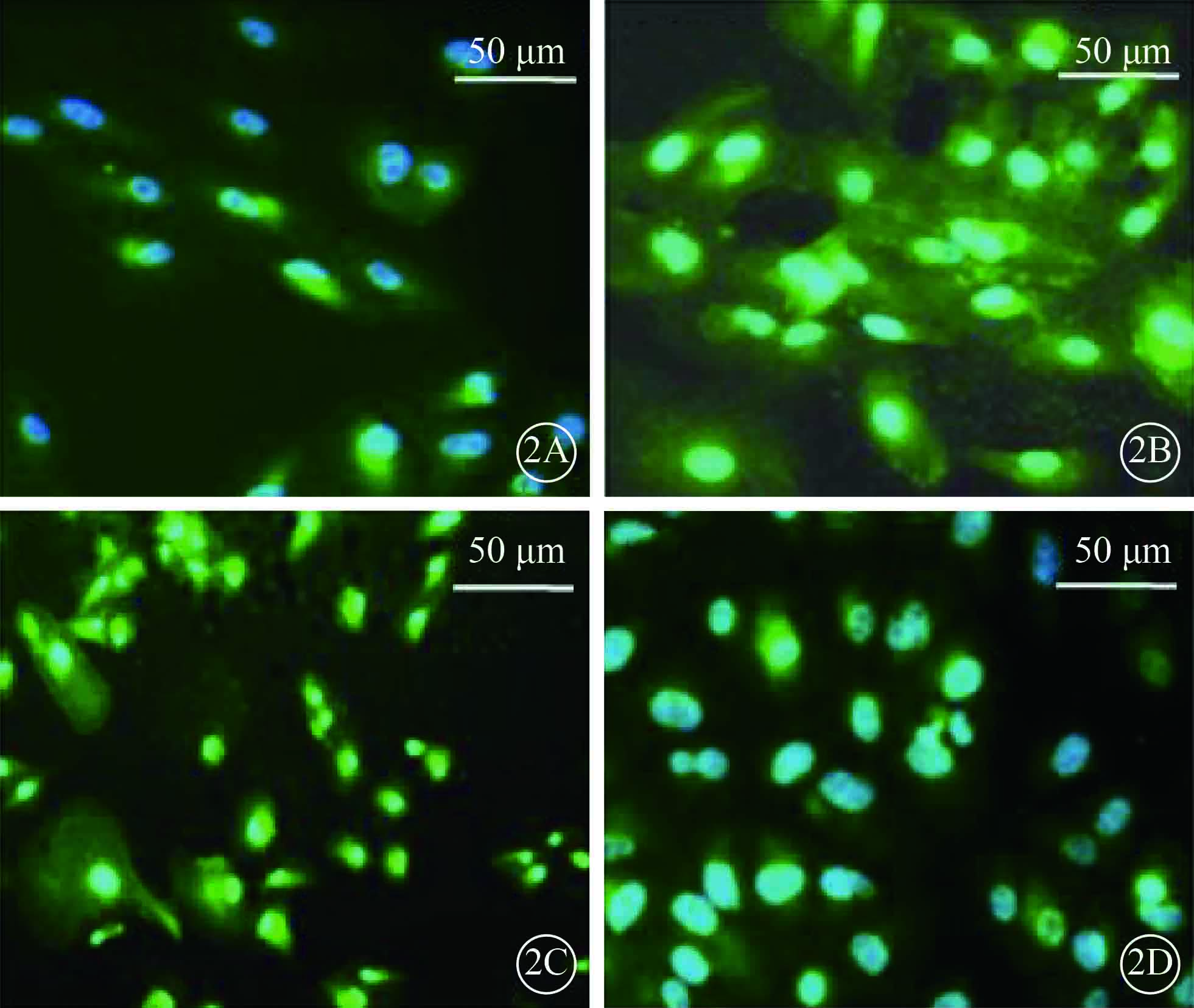 圖2
兩組ARPE-19細胞VEGF-A、Akt蛋白表達熒光顯微鏡像。2A.對照組VEGF-A蛋白表達;2B.實驗組 VEGF-A 蛋白表達;2C.對照組Akt蛋白表達;2D.實驗組Akt蛋白表達。與對照組比較,實驗組ARPE-19細胞VEGF-A 蛋白表達明顯增強,Akt蛋白表達明顯減弱 DAPI+HRP
圖2
兩組ARPE-19細胞VEGF-A、Akt蛋白表達熒光顯微鏡像。2A.對照組VEGF-A蛋白表達;2B.實驗組 VEGF-A 蛋白表達;2C.對照組Akt蛋白表達;2D.實驗組Akt蛋白表達。與對照組比較,實驗組ARPE-19細胞VEGF-A 蛋白表達明顯增強,Akt蛋白表達明顯減弱 DAPI+HRP
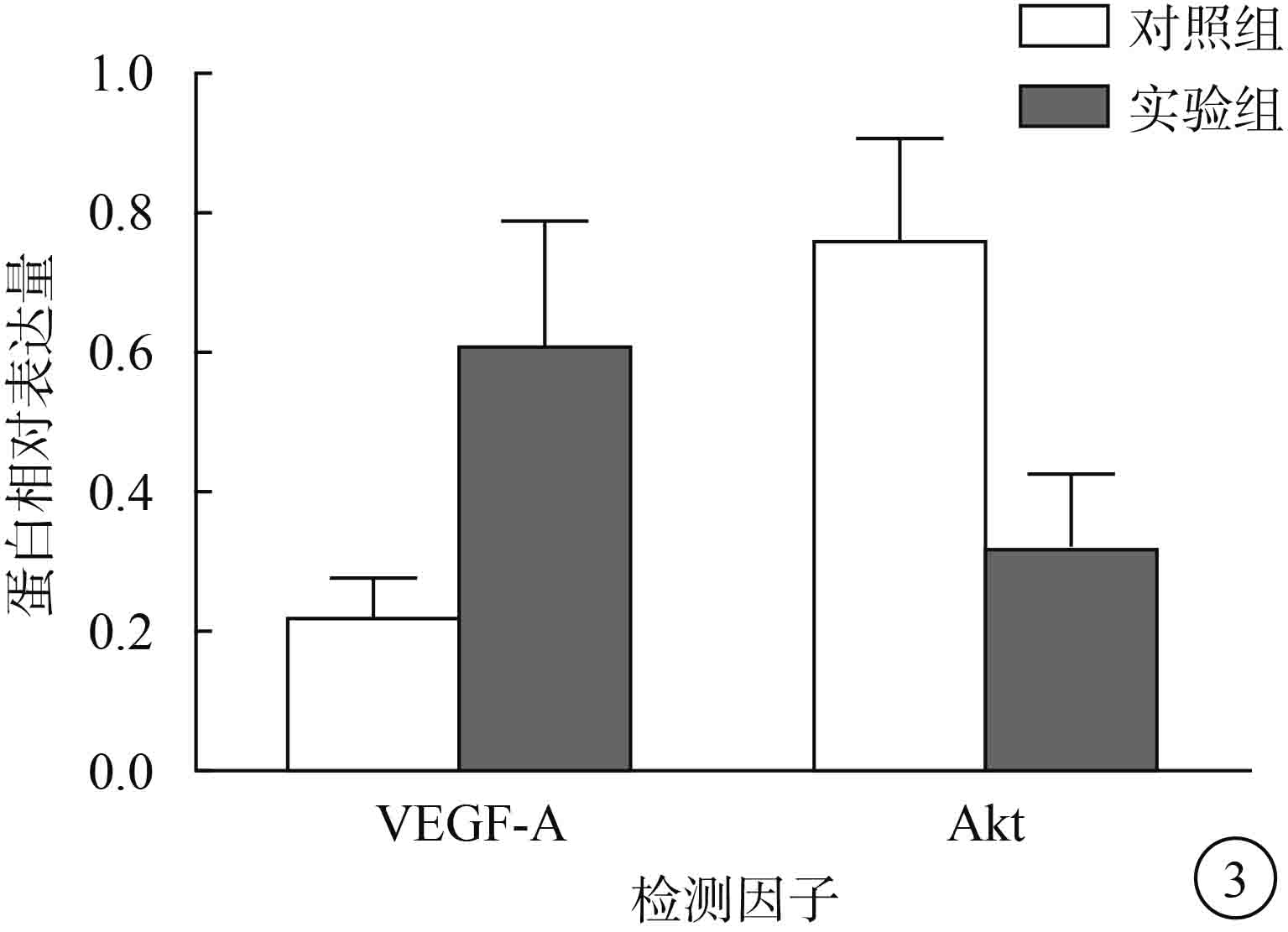
Western blot檢測結果顯示,實驗組、對照組 ARPE-19細胞VEGF-A蛋白相對表達量分別為 0.61±0.18、0.22±0.06,Akt蛋白相對表達量分別為 0.32±0.11、0.76±0.15。與對照組比較,實驗組ARPE-19細胞VEGF-A蛋白相對表達量明顯升高,Akt蛋白相對表達量明顯降低,差異均有統計學意義(t=3.822、6.527,P<0.05)(圖 3)。
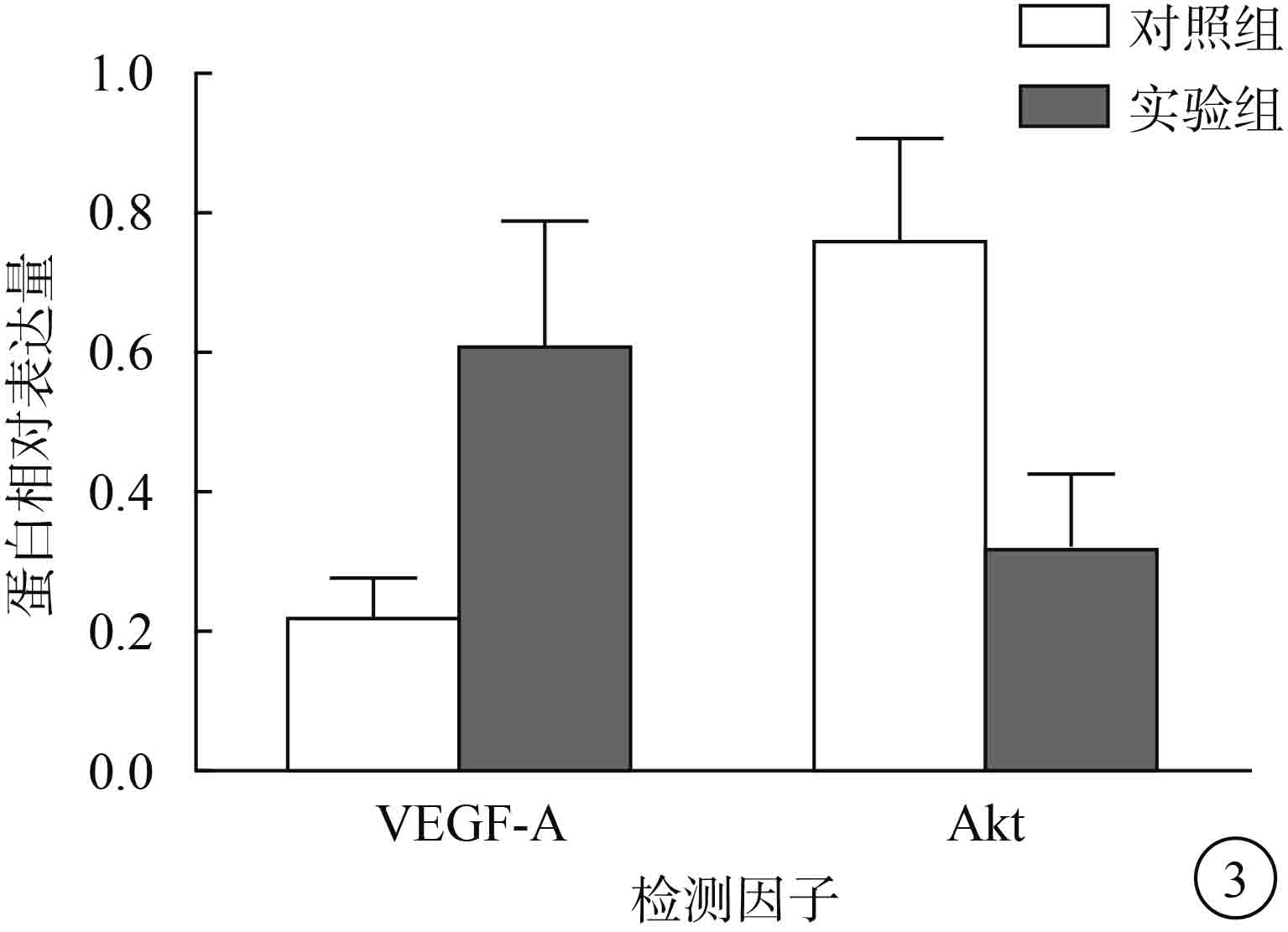 圖3
兩組ARPE-19細胞VEGF-A、Akt蛋白相對表達量比較
圖3
兩組ARPE-19細胞VEGF-A、Akt蛋白相對表達量比較
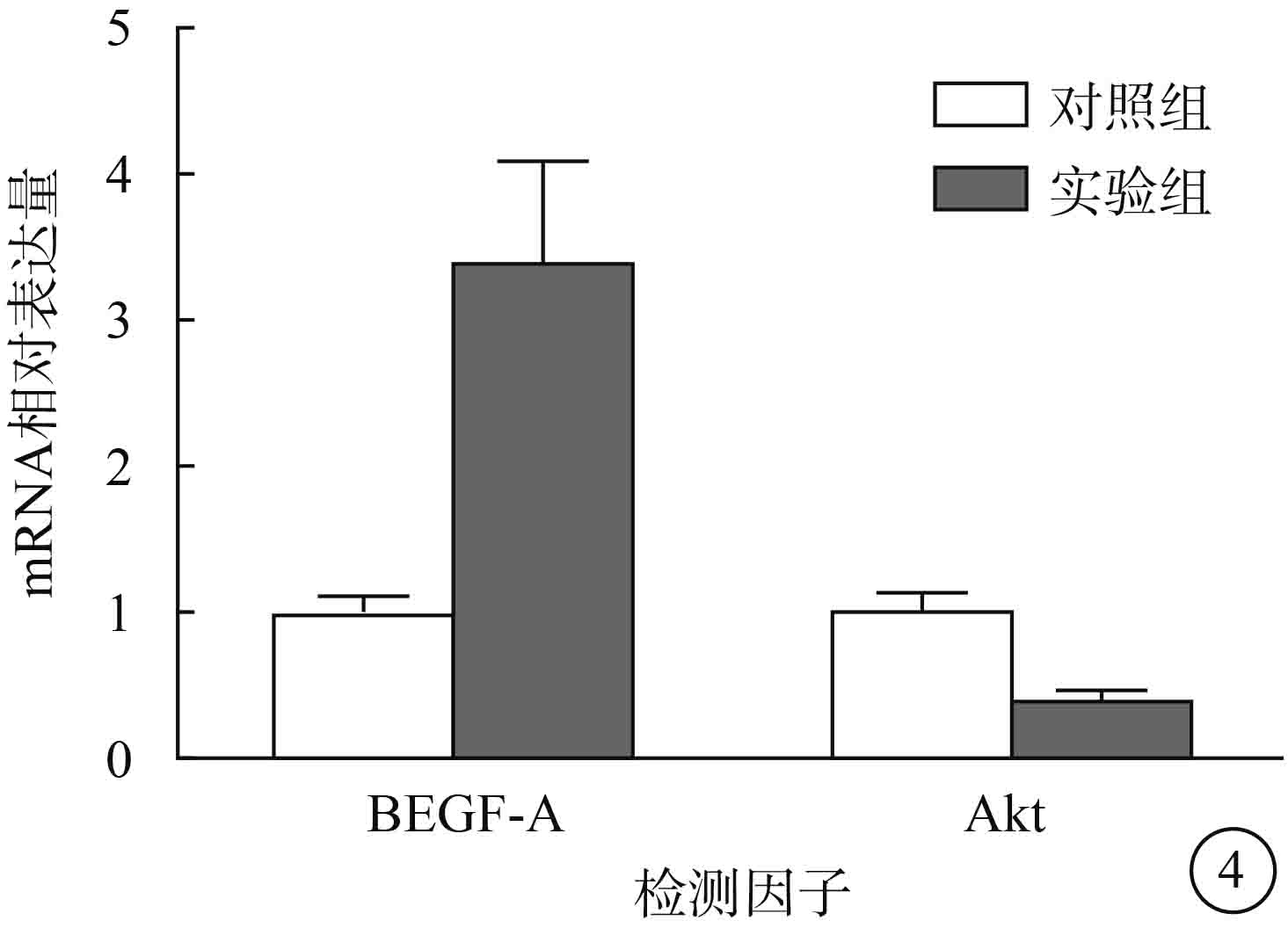
RT-PCR檢測結果顯示,與對照組比較,實驗組 ARPE-19細胞VEGF-A mRNA相對表達量明顯升高,Akt mRNA相對表達量明顯降低,差異均有統計學意義(t=8.805、?7.823,P<0.05)(圖 4)。
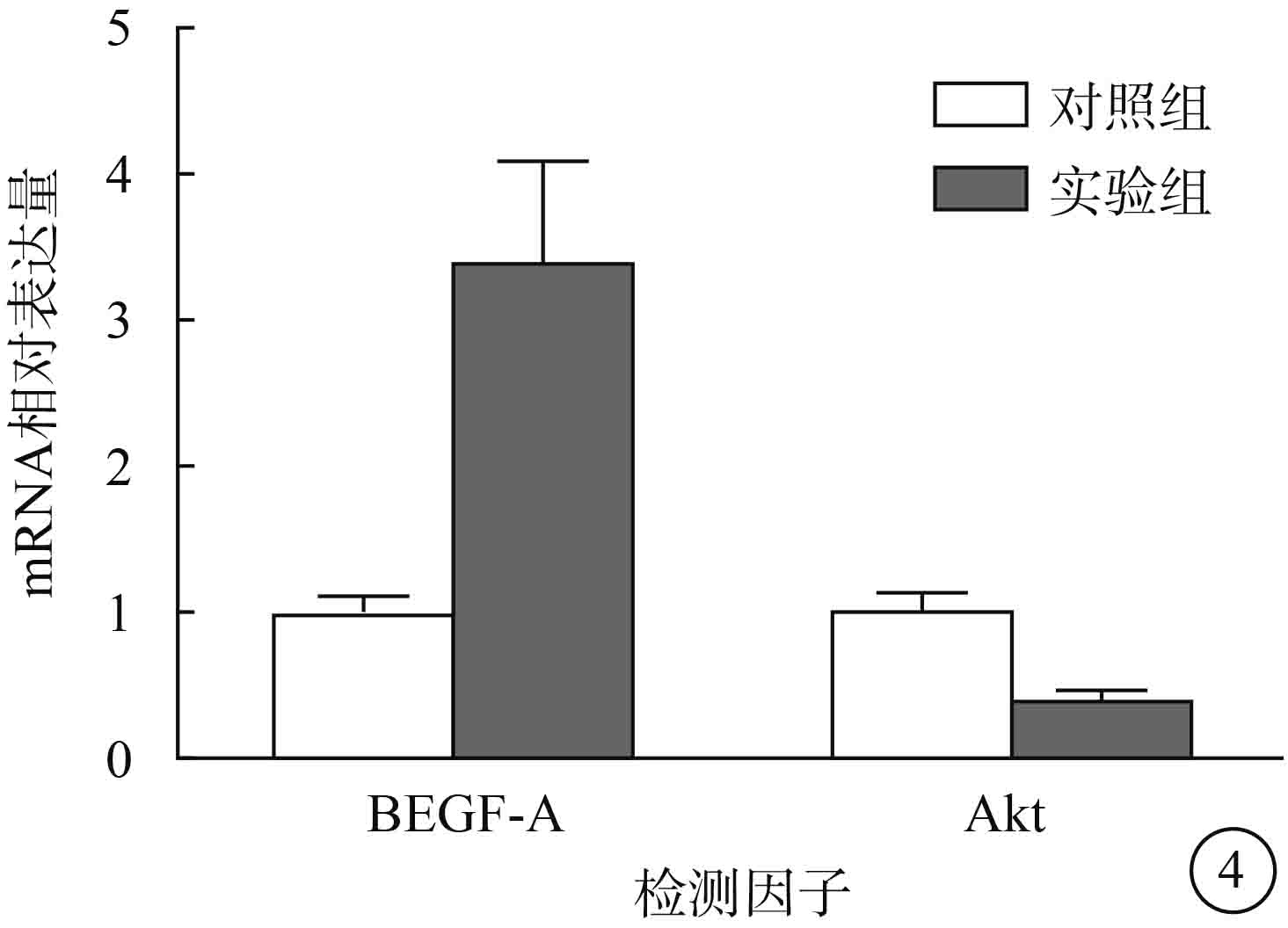 圖4
兩組ARPE-19細胞VEGF-A、Akt mRNA相對表達量比較
圖4
兩組ARPE-19細胞VEGF-A、Akt mRNA相對表達量比較
3 討論
細胞多泡體與細胞膜融合后將其內所含的小囊泡分泌到細胞外,這種包含細胞信息的小囊泡被稱為外泌體。實驗研究表明任何包含有囊泡的細胞都能分泌外泌體,在體外環境下現已發現多種細胞可分泌外泌體,包括B細胞、T細胞、粒細胞、樹突細胞、血小板、神經細胞、上皮細胞及腫瘤細胞等[7]。細胞外泌體攜帶多種蛋白質,可以參與細胞通訊、細胞遷移、血管新生及腫瘤細胞的生長等過程;同時還有可能成為藥物的天然載體,應用于臨床治療[8]。外泌體從活細胞分泌后,可分布于來源細胞的周圍,也可以通過各種途徑轉移至其他部位[9]。目前,外泌體的生物學功能主要體現在細胞間的信號傳遞及免疫調節兩個方面。細胞間的信號傳遞可能通過外泌體的膜與細胞膜直接融合、外泌體表面的黏附分子與細胞膜相接觸、細胞胞吞作用、細胞膜表面特異性受體-配體相結合等4種方式進行[10]。近年來,有研究發現外泌體內含有其來源細胞的mRNA及microRNA,可以從一個細胞傳遞給另一個細胞[11]。最新的外泌體提取方法有qEV外泌體純化柱及外泌體提取試劑盒。外泌體提取試劑盒主要是利用化合物沉淀法得到大量外泌體沉淀,與超速離心法相比,其外泌體產量明顯提高[12]。本研究選取人ARPE-19細胞并用含10%胎牛血清的DMEM培養基進行培養,由于血清中含有豐富的外泌體,胎牛血清在使用前進行梯度離心預處理以去除胎牛血清中所含的外泌體,收集細胞上清液,利用外泌體提取試劑盒成功分離提取外泌體。
RPE老化變性和逐步凋亡與AMD發病的關系非常密切。RPE細胞負擔加重、RPE細胞吞噬溶酶體降解光感受器碎片、未完全消化的降解物聚集均可增強氧化應激損傷,導致脂質在細胞內堆積,可干擾RPE細胞的正常代謝,最后導致代謝產物堆積及氧利用障礙,誘發新生血管生成[13,14]。目前,對于誘導RPE細胞氧化應激包括化學氧化劑、高氧環境等方法。過氧化氫(H2O2)作為一種較常用的細胞凋亡誘導劑在各種急性氧化損傷模型中有廣泛應用,但其極易通過細胞膜進入細胞,H2O2 濃度過高時會引起大量細胞壞死[15]。有研究表明,植物復合物魚藤酮作為RPE細胞的氧化損傷劑較 H2O2 相對穩定,與還原型煙酰胺腺嘌呤二核苷酸磷酸不可逆的結合使之失活,從而阻斷線粒體電子傳遞鏈,導致細胞對氧利用障礙[16]。我們參考文獻結論并結合預實驗結果,選擇濃度為2.5 μmol/L的魚藤酮成功誘導了RPE細胞氧化損傷,有利于后續細胞培養、細胞上清液的收集及外泌體的提取。
Akt功能包括了細胞存活、細胞增生與凋亡、細胞周期調控、細胞營養代謝等多個方面,在細胞的生理病理過程中發揮作用[17]。Yang 等[18] 研究發現,Akt激活能夠增強RPE細胞的存活,Akt活化可以防止 AMD病程中氧化應激所導致的細胞損傷死亡。VEGF在滲出型AMD的病理過程中呈高表達狀態,在脈絡膜新生血管(CNV)形成中發揮重要作用[19]。VEGF-A可以與內皮細胞內的囊泡結合,形成細胞膜通道,蛋白質等大分子物質可通過,從而增加了血管的通透性,加快其促進新生血管形成的作用[20]。在這個過程中,VEGF-A還是重要的炎性細胞趨化因子,在炎癥反應過程中發揮作用。另外,VEGF還可以促進其他的細胞因子表達,加快其促進新生血管形成的作用[21]。本研究結果顯示,氧化應激下ARPE-19細胞外泌體可抑制正常AREP-19細胞增生,上調VEGF-A表達,下調Akt表達,從而引起細胞活性減弱,加速VEGF的產生。與 Quittet 等[22] 報道結果相符。而氧化應激下外泌體在體內實驗中是否具有促進VEGF的作用則需要動物實驗來明確。
本研究結果表明,氧化應激下AREP-19細胞外泌體攜帶的細胞信息傳遞給正常RPE細胞,引起了RPE細胞的增生能力減弱,VEGF-A和Akt表達發生變化,為進一步研究外泌體在AMD發病中的作用奠定了基礎。但由于實驗條件限制,本研究未能對外泌體表面特異性標志蛋白CD63進行更為準確的流式細胞術檢測,有待今后研究加以改進。同時,今后進一步的體外實驗中,應考慮增設外泌體殘液作為對照組進行實驗,以排除非外泌體物質的作用。此外,有關外泌體攜帶哪些致病mRNA及具體的作用途徑也尚需進一步的研究證實。
研究表明,氧化應激反應引起了老年性黃斑變性(AMD)的早期改變;隨年齡增長,氧化應激對視網膜的損傷加重,相關物質在視網膜色素上皮細胞(RPE)中累積[1]。外泌體是一種直徑約30~200 nm的囊泡樣小體,可從各種細胞中獲得,參與細胞-細胞間通信,在生理及病理條件下發揮免疫作用并具有潛在的治療應用價值[2]。已有研究發現,在AMD發病過程中 RPE 可能通過外泌體參與玻璃膜疣形成,外泌體同時參與補體激活[3]。為了進一步驗證 RPE 細胞外泌體在AMD發病中的作用,本研究分離提取氧化應激下的RPE外泌體作用于正常RPE細胞,觀察其對細胞增生及血管內皮生長因子(VEGF)-A、絲氨酸/蘇氨酸激酶(Akt)表達的影響,以期為AMD的發病機制研究提供新的方法及研究思路。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
人RPE細胞株(ARPE-19 細胞,美國 ATCC 公司),Dulbecco改良Eagle培養基(DMEM培養基)、胎牛血清(美國Gibco公司),去外泌體胎牛血清(exo-FBS)、外泌體提取試劑盒(美國 SBI 公司),BioTrace?NT 硝酸纖維素膜(美國Millipore公司),Trizol RNA提取試劑盒(美國Invitrogen公司),M-MLV逆轉錄酶、RNA酶抑制劑(日本Takara公司),Western Lightning增強化學發光試劑盒(美國 Perkin Elmer公司),噻唑藍(MTT,上海碧云天生物技術有限公司),小鼠抗人CD63單克隆抗體(亞諾法生技股份有限公司),VEGF-A 一抗、辣根過氧化物酶(HRP)標記二抗(北京中杉金橋生物技術有限公司),TES1332A數字照度計(中國臺灣泰仕電子工業股份有限公司),20 W醫用藍光燈管(上海電工儀器廠),低溫超速離心機(美國Beckman公司)。
1.2 RPE 細胞外泌體的分離提取及鑒定
取對數生長期的ARPE-19貼壁細胞制成1×106 個/ ml的單細胞懸液,接種于96孔板置于37 ℃、5% CO2 恒溫培養箱中。細胞單層鋪滿孔底后吸棄原培養液,取魚藤酮2.5 μmol/L加入細胞培養基中,培養24 h后棄去含魚藤酮的培養液,加入含10% exo-FBS的DMEM培養基,培養氧化應激下ARPE-19細胞,24~36 h后收集細胞培養上清液,分離提取并鑒定外泌體。提取的氧化應激下ARPE-19細胞外泌體用磷酸鹽緩沖液(PBS)重懸后,?80 ℃低溫儲存備用。
按外泌體提取試劑盒說明書提取外泌體,將收集的細胞培養上清液移置離心管中,4 ℃條件下3000×g離心30 min去除細胞及碎片,然后濃縮細胞培養上清液。吸取上清液置于裝有Ultracel-30超濾膜 Amicon Ultra-15 ml離心超濾管中,4 ℃ 條件下4000×g離心50 min,吸取超濾膜內超濾液。按 2∶1的比例加入 Exo Quick提取液,混勻后靜置過夜,4 ℃條件下離心后將所獲得的外泌體沉淀用 PBS 重懸,?80 ℃凍存備用。
取外泌體懸液10 μl,加入PBS稀釋后,滴加在2 mm的載樣銅網上,室溫下靜置1 min,將多余液體用濾紙吸去,用3%磷鎢酸鈉溶液負染5 min,PBS洗一遍后晾干。透射電子顯微鏡80~120 kV 下觀察外泌體的形態特征并拍攝照片。
參照文獻[4,5] 的方法,采用蛋白免疫印跡法(Western blot)檢測ARPE-19細胞外泌體表面特異標志蛋白CD63 的表達。取20 μg外泌體懸液,加入蛋白上樣緩沖液,95 ℃煮沸5 min。冷卻后經14%聚丙烯酰胺凝膠電泳,轉移到聚偏二氟乙烯膜上。用5%脫脂奶粉封閉2 h。加入用抗體稀釋液稀釋的鼠抗人CD63單克隆抗體一抗(1∶500)4 ℃過夜,含吐溫20的三羥甲基氨基甲烷緩沖液(TBST)洗膜3次,10 min/次。加入用抗體稀釋液稀釋的 HRP 標記的二抗(1∶2000),室溫下緩慢振搖2 h,TBST洗膜3次,10 min/次。應用超敏化學發光試劑盒顯色2 min,X 光片顯影。
1.3 實驗分組及各組ARPE-19細胞的細胞活力和VEGF-A、Akt表達檢測
將氧化應激下200 μg/ml的ARPE-19細胞外泌體與ARPE-19細胞共培養作為實驗組,等量正常RPE外泌體與ARPE-19細胞共培養作為對照組。在 37 ℃、5% CO2培養箱中培養48 h,培養期間更換無血清培養基培養。
采用MTT比色法檢測ARPE-19細胞的細胞活力。取對數生長期的ARPE-19貼壁細胞制成1×106 個/ ml 的單細胞懸液,將細胞接種于96孔板,每孔加細胞懸液100 μl培養2 d使細胞貼壁。每孔加20 μl的MTT溶液,培養4 h后加入150 μl的二甲基亞砜。采用酶聯免疫檢測儀檢測波長570 nm 處各孔的吸光度[A,舊稱光密度(OD)]值。
采用免疫熒光染色法和Western blot檢測ARPE-19 細胞VEGF-A、Akt蛋白表達。ARPE-19細胞消化脫壁后,按細胞密度5×106 個/L、每孔1 ml接種于預先置有已消毒4 mm× 4 mm大小蓋玻片的24孔板內。4 ℃ 多聚甲醛固定 15 min,將已固定的細胞爬片用 4′,6-二脒基-2-苯基吲哚(DAPI)及HRP標記的二抗染色行VEGF-A和Akt免疫組織化學鑒定。熒光顯微鏡下隨機測量每張爬片3個高倍視野的VEGF-A和Akt蛋白陽性表達面積(像素值),取其平均值代表VEGF-A和Akt蛋白的陽性表達值。用Image J凝膠分析軟件分析VEGF-A與Akt特異性條帶A 值,以磷酸甘油醛脫氫酶(GAPDH)為內參照。以VEGF-A或Akt條帶A 值與GAPDH條帶A 值的比值表示VEGF-A或Akt蛋白的相對表達量。
參照文獻[6] 的方法,采用實時定量聚合酶鏈反應(RT-PCR)檢測ARPE-19 細胞 VEGF-A、Akt mRNA 表達。運用 Primer Premier 5.0軟件設計引物。VEGF-A:上游引物 5′-GAGCCTTGCCTTGCTGCTCTAC-3′,下游引物 5′-TGGCACCCAGCACAATGAA -3′,擴增片段長度為153堿基對(bp);Akt:上游引物5′-GGACAACCGCCATCCAGACT -3′,下游引物 5′- GCCAGGGACACCTCCATCTC-3′,擴增片段長度為 178 bp;內參照 GAPDH:上游引物5′-GAGTCAACGGATTTGGTCGT-3′,下游引物5′-TTGATTTTGGAGGGATCTCG-3′,擴增片段長度為106 bp。反應條件:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s。變性、退火、延伸重復39個循環。將得到的循環閾值(CT)數據與內參照分析處理后,采用2-△△CT法計算目的基因相對表達量。
1.4 統計學方法
采用SPSS18.0統計軟件進行統計學分析,實驗數據用均數±標準差( )表示。兩組間數據比較采用最小顯著差法t檢驗。P<0.05為差異有統計學意義。
2 結果
透射電子顯微鏡觀察發現,ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡;直徑50~150 nm,平均直徑(107.71 ± 47.57)nm;囊泡內存在低電子密度成分(圖 1A)。Western blot檢測結果顯示,ARPE-19細胞外泌體表面表達特異性標志蛋白CD63(圖 1B)。
 圖1
ARPE-19細胞外泌體鑒定像。1A.透射電子顯微鏡像,可見ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡,囊泡內存在低電子密度成分;1B.ARPE-19細胞外泌體表面特異性標志蛋白CD63 Western blot檢測像
圖1
ARPE-19細胞外泌體鑒定像。1A.透射電子顯微鏡像,可見ARPE-19細胞外泌體呈圓形或橢圓形膜性小囊泡,囊泡內存在低電子密度成分;1B.ARPE-19細胞外泌體表面特異性標志蛋白CD63 Western blot檢測像
MTT比色法結果顯示,實驗組、對照組ARPE-19 細胞在波長570 nm處的A 值分別為0.582±0.015、0.787±0.032。實驗組 ARPE-19細胞在波長570 nm處的A值較對照組明顯降低,差異有統計學意義(t =20.886,P<0.05)。
熒光顯微鏡觀察發現,DAPI將細胞核染成藍色,以HRP標記的二抗將VEGF-A、Akt蛋白染成綠色。免疫熒光檢測結果顯示,與對照組比較,實驗組ARPE-19細胞VEGF-A蛋白表達明顯增強,Akt蛋白表達明顯減弱(圖 2)。
 圖2
兩組ARPE-19細胞VEGF-A、Akt蛋白表達熒光顯微鏡像。2A.對照組VEGF-A蛋白表達;2B.實驗組 VEGF-A 蛋白表達;2C.對照組Akt蛋白表達;2D.實驗組Akt蛋白表達。與對照組比較,實驗組ARPE-19細胞VEGF-A 蛋白表達明顯增強,Akt蛋白表達明顯減弱 DAPI+HRP
圖2
兩組ARPE-19細胞VEGF-A、Akt蛋白表達熒光顯微鏡像。2A.對照組VEGF-A蛋白表達;2B.實驗組 VEGF-A 蛋白表達;2C.對照組Akt蛋白表達;2D.實驗組Akt蛋白表達。與對照組比較,實驗組ARPE-19細胞VEGF-A 蛋白表達明顯增強,Akt蛋白表達明顯減弱 DAPI+HRP
Western blot檢測結果顯示,實驗組、對照組 ARPE-19細胞VEGF-A蛋白相對表達量分別為 0.61±0.18、0.22±0.06,Akt蛋白相對表達量分別為 0.32±0.11、0.76±0.15。與對照組比較,實驗組ARPE-19細胞VEGF-A蛋白相對表達量明顯升高,Akt蛋白相對表達量明顯降低,差異均有統計學意義(t=3.822、6.527,P<0.05)(圖 3)。
 圖3
兩組ARPE-19細胞VEGF-A、Akt蛋白相對表達量比較
圖3
兩組ARPE-19細胞VEGF-A、Akt蛋白相對表達量比較
RT-PCR檢測結果顯示,與對照組比較,實驗組 ARPE-19細胞VEGF-A mRNA相對表達量明顯升高,Akt mRNA相對表達量明顯降低,差異均有統計學意義(t=8.805、?7.823,P<0.05)(圖 4)。
 圖4
兩組ARPE-19細胞VEGF-A、Akt mRNA相對表達量比較
圖4
兩組ARPE-19細胞VEGF-A、Akt mRNA相對表達量比較
3 討論
細胞多泡體與細胞膜融合后將其內所含的小囊泡分泌到細胞外,這種包含細胞信息的小囊泡被稱為外泌體。實驗研究表明任何包含有囊泡的細胞都能分泌外泌體,在體外環境下現已發現多種細胞可分泌外泌體,包括B細胞、T細胞、粒細胞、樹突細胞、血小板、神經細胞、上皮細胞及腫瘤細胞等[7]。細胞外泌體攜帶多種蛋白質,可以參與細胞通訊、細胞遷移、血管新生及腫瘤細胞的生長等過程;同時還有可能成為藥物的天然載體,應用于臨床治療[8]。外泌體從活細胞分泌后,可分布于來源細胞的周圍,也可以通過各種途徑轉移至其他部位[9]。目前,外泌體的生物學功能主要體現在細胞間的信號傳遞及免疫調節兩個方面。細胞間的信號傳遞可能通過外泌體的膜與細胞膜直接融合、外泌體表面的黏附分子與細胞膜相接觸、細胞胞吞作用、細胞膜表面特異性受體-配體相結合等4種方式進行[10]。近年來,有研究發現外泌體內含有其來源細胞的mRNA及microRNA,可以從一個細胞傳遞給另一個細胞[11]。最新的外泌體提取方法有qEV外泌體純化柱及外泌體提取試劑盒。外泌體提取試劑盒主要是利用化合物沉淀法得到大量外泌體沉淀,與超速離心法相比,其外泌體產量明顯提高[12]。本研究選取人ARPE-19細胞并用含10%胎牛血清的DMEM培養基進行培養,由于血清中含有豐富的外泌體,胎牛血清在使用前進行梯度離心預處理以去除胎牛血清中所含的外泌體,收集細胞上清液,利用外泌體提取試劑盒成功分離提取外泌體。
RPE老化變性和逐步凋亡與AMD發病的關系非常密切。RPE細胞負擔加重、RPE細胞吞噬溶酶體降解光感受器碎片、未完全消化的降解物聚集均可增強氧化應激損傷,導致脂質在細胞內堆積,可干擾RPE細胞的正常代謝,最后導致代謝產物堆積及氧利用障礙,誘發新生血管生成[13,14]。目前,對于誘導RPE細胞氧化應激包括化學氧化劑、高氧環境等方法。過氧化氫(H2O2)作為一種較常用的細胞凋亡誘導劑在各種急性氧化損傷模型中有廣泛應用,但其極易通過細胞膜進入細胞,H2O2 濃度過高時會引起大量細胞壞死[15]。有研究表明,植物復合物魚藤酮作為RPE細胞的氧化損傷劑較 H2O2 相對穩定,與還原型煙酰胺腺嘌呤二核苷酸磷酸不可逆的結合使之失活,從而阻斷線粒體電子傳遞鏈,導致細胞對氧利用障礙[16]。我們參考文獻結論并結合預實驗結果,選擇濃度為2.5 μmol/L的魚藤酮成功誘導了RPE細胞氧化損傷,有利于后續細胞培養、細胞上清液的收集及外泌體的提取。
Akt功能包括了細胞存活、細胞增生與凋亡、細胞周期調控、細胞營養代謝等多個方面,在細胞的生理病理過程中發揮作用[17]。Yang 等[18] 研究發現,Akt激活能夠增強RPE細胞的存活,Akt活化可以防止 AMD病程中氧化應激所導致的細胞損傷死亡。VEGF在滲出型AMD的病理過程中呈高表達狀態,在脈絡膜新生血管(CNV)形成中發揮重要作用[19]。VEGF-A可以與內皮細胞內的囊泡結合,形成細胞膜通道,蛋白質等大分子物質可通過,從而增加了血管的通透性,加快其促進新生血管形成的作用[20]。在這個過程中,VEGF-A還是重要的炎性細胞趨化因子,在炎癥反應過程中發揮作用。另外,VEGF還可以促進其他的細胞因子表達,加快其促進新生血管形成的作用[21]。本研究結果顯示,氧化應激下ARPE-19細胞外泌體可抑制正常AREP-19細胞增生,上調VEGF-A表達,下調Akt表達,從而引起細胞活性減弱,加速VEGF的產生。與 Quittet 等[22] 報道結果相符。而氧化應激下外泌體在體內實驗中是否具有促進VEGF的作用則需要動物實驗來明確。
本研究結果表明,氧化應激下AREP-19細胞外泌體攜帶的細胞信息傳遞給正常RPE細胞,引起了RPE細胞的增生能力減弱,VEGF-A和Akt表達發生變化,為進一步研究外泌體在AMD發病中的作用奠定了基礎。但由于實驗條件限制,本研究未能對外泌體表面特異性標志蛋白CD63進行更為準確的流式細胞術檢測,有待今后研究加以改進。同時,今后進一步的體外實驗中,應考慮增設外泌體殘液作為對照組進行實驗,以排除非外泌體物質的作用。此外,有關外泌體攜帶哪些致病mRNA及具體的作用途徑也尚需進一步的研究證實。