引用本文: 沈胤忱, 陳鳳娥, 孫濤, 顧青, 劉 , 鄭志, 陳軼卉, 王寧, 許迅. 慢病毒介導的解偶聯蛋白-2基因差異表達對人臍靜脈內皮細胞增生及凋亡的影響. 中華眼底病雜志, 2017, 33(1): 52-56. doi: 10.3760/cma.j.issn.1005-1015.2017.01.014 復制
糖尿病病程和全身情況是影響糖尿病視網膜病變(DR)進展重要因素,但并不能完全解釋DR發生發展中的差異性。美國威斯康星DR流行病學研究在對糖尿病患者長期隨訪中發現,部分患者血糖控制良好卻發生嚴重DR;而部分患者血糖控制欠佳,DR程度則較輕。遺傳學證據提示某些易感基因的多態性在DR的發生發展中起到了一定作用[1]。解偶聯蛋白(UCP)是一類位于線粒體內膜的跨膜蛋白[2], 通過消除線粒體質子梯度差從而抑制線粒體活性氧的產生[3]。已知的UCP有5類,其中UCP-2廣泛表達于哺乳動物的白色脂肪組織、肝臟、腎臟、胰島β細胞、巨噬細胞、視網膜血管內皮細胞及周細胞[4]。近年來,研究發現UCP-2基因多態性與2型糖尿病、肥胖、心血管疾病發生有關[2,5-8]。基因多態性導致UCP-2表達變化,引起氧化應激、脂肪代謝及胰島素分泌一系列內環境紊亂。Ala55Val(rs660339)位點定位于UCP-2第4外顯子,胞嘧啶(C)→胸腺嘧啶(T)堿基的變化導致編碼氨基酸的改變;已有文獻報道該位點與糖尿病和DR發生相關[2,5,6]。我們的前期研究發現,糖尿病患者中rs660339位點攜帶C的比例較T高,與對照組相比差異有統計學意義[9],但該位點差異表達是否會引起體內功能學改變尚無研究報道。由于DR的微血管病變主要累及視網膜血管內皮細胞和周細胞,而人臍靜脈內皮細胞(HUVEC)是進行血管內皮細胞實驗通常選用的細胞模型,與動物血管內皮細胞相比,更符合人體情況[10],也是視網膜新生血管疾病應用較多的細胞模型[11,12]。因此,本研究通過構建UCP-2差異表達的慢病毒載體UCP-2C和UCP-2T,轉染HUVEC,觀察其對細胞增生及凋亡影響。現將結果報道如下。
1 材料和方法
慢病毒構建及包裝(上海吉瑪制藥技術有限公司);包裝細胞293T及HUVEC(美國ScienCell公司);細胞計數試劑盒(CCK-8,日本Dojindo公司);7-氨基放線菌素D(7-AAD)單染色法細胞凋亡檢測試劑盒(CD004-2,上海銳賽生物技術有限公司);B細胞淋巴瘤/白血病-2(Bcl-2)抗體(ab7973,英國Abcam公司);磷酸甘油醛脫氫酶(GAPDH)抗體(KM9002,天津三箭生物技術有限公司)。
根據cDNA數據庫(上海吉瑪制藥技術有限公司)人UCP-2基因(NM_003355.2)序列設計并合成擴增引物;聚合酶鏈反應(PCR)分別得到UCP-2C和UCP-2T基因片段,即rs660339位點堿基分別是C或T;同時設計一條無意義的陰性對照(NC)序列。將目的基因克隆到載體慢病毒5中經NotⅠ和NsiⅠ雙酶切后測序驗證。
對數生長期的293T細胞培養至80%~90%融合時,培養液中按比例加入慢病毒質粒和輔助質粒pGag/Pol、pRev、pVSV-G,與RNAi轉染系統轉染試劑混合,收集轉染72 h后的上清液,濾器過濾,離心,測定病毒滴度。所得病毒濃縮液的病毒滴度為1.0×109 IFU/ml。
將處于對數生長期的HUVEC接種于96孔板,根據預實驗結果,設定HUVEC病毒最佳感染復數(MOI)梯度為0、1、10、50、100。根據病毒滴度依次加入相應劑量的病毒濃縮液,并同時加入濃度終為5 μg/ml的聚凝胺增強感染。病毒感染72 h后,熒光顯微鏡觀察HUVEC綠色熒光蛋白(GFP)的表達,確定HUVEC病毒最佳MOI值。MOI=病毒滴度×加入病毒體積/感染的細胞數。
抽提總RNA,實時定量-PCR(RT-PCR)檢測HUVEC UCP-2mRNA表達。UCP-2上游引物:5′-GGCTGGAGGTGGTCGGAG-3′;下游引物:5′-CAGAAGTGAAGTGGCAAGGGAG-3′;人肌動蛋白上游引物:5′-TCCTTCCTGGGCATGGAGT-3′;下游引物:5′-CAGGAGGAGCAATGATCTTGAT-3′。??Ct法進行定量。
CCK-8增生分析法檢測各組HUVEC增生。取3孔HUVEC分為NC組、UCP-2C組、UCP-2T組,每孔培養基體積為2 ml。分別加入目的病毒感染8~12 h。96孔培養板中加入100 μl細胞懸液,隔天每孔加入10 μl CCK-8,測定450 nm處的吸光度[A,舊稱光密度(OD)]值。測定1份/d,連續測定6 d。酶標儀讀取450 nm處的A值,將UCP-2C組、UCP-2T組的HUVECA值記為測量值,NC組的HUVECA值記為空白值,終值=測量值-空白值。將連續6 d的終值繪制柱狀圖。
流式細胞儀檢測各組HUVEC凋亡。另取3孔HUVEC分為NC組、UCP-2C組、UCP-2T組,目的病毒感染72 h后,離心,重懸細胞,加入5 μl 7-AAD,孵育30 min,采用FASAria Cell Sorter流式細胞儀定量檢測各組HUVEC凋亡情況。
蛋白免疫印跡法(Western blot)檢測各組HUVEC Bcl-2蛋白表達。分別收集3組細胞,提取總蛋白,蛋白定量后電泳,電轉。封閉后加入兔抗人Bcl-2一抗(1∶500稀釋)4 ℃過夜,洗膜后加入羊抗兔二抗(1∶5000稀釋),室溫孵育1 h,洗膜后與化學發光底物孵育1 min,曝光顯影,GAPDH作為內參照。
激光共聚焦顯微鏡觀察各組HUVEC Bcl-2蛋白熒光強度。將3組細胞懸液接種于小圓玻片上培養,固定;Triton-100處理;封閉液室溫封閉;兔抗人Bcl-2抗體按1∶100稀釋,4 ℃過夜;羊抗兔二抗抗體帶Cy3標記按1∶1000稀釋,室溫孵育,4′,6-二脒基-2-苯基吲哚(DAPI)染細胞核,激光共聚焦顯微鏡下觀察并拍照記錄。采用Image J軟件將原圖轉換成灰度圖并黑白反轉后,測量各組HUVEC的A值,重復3次取平均值。
采用SPSS13.0統計軟件進行統計學分析處理。結果以均數±標準差(
2 結果
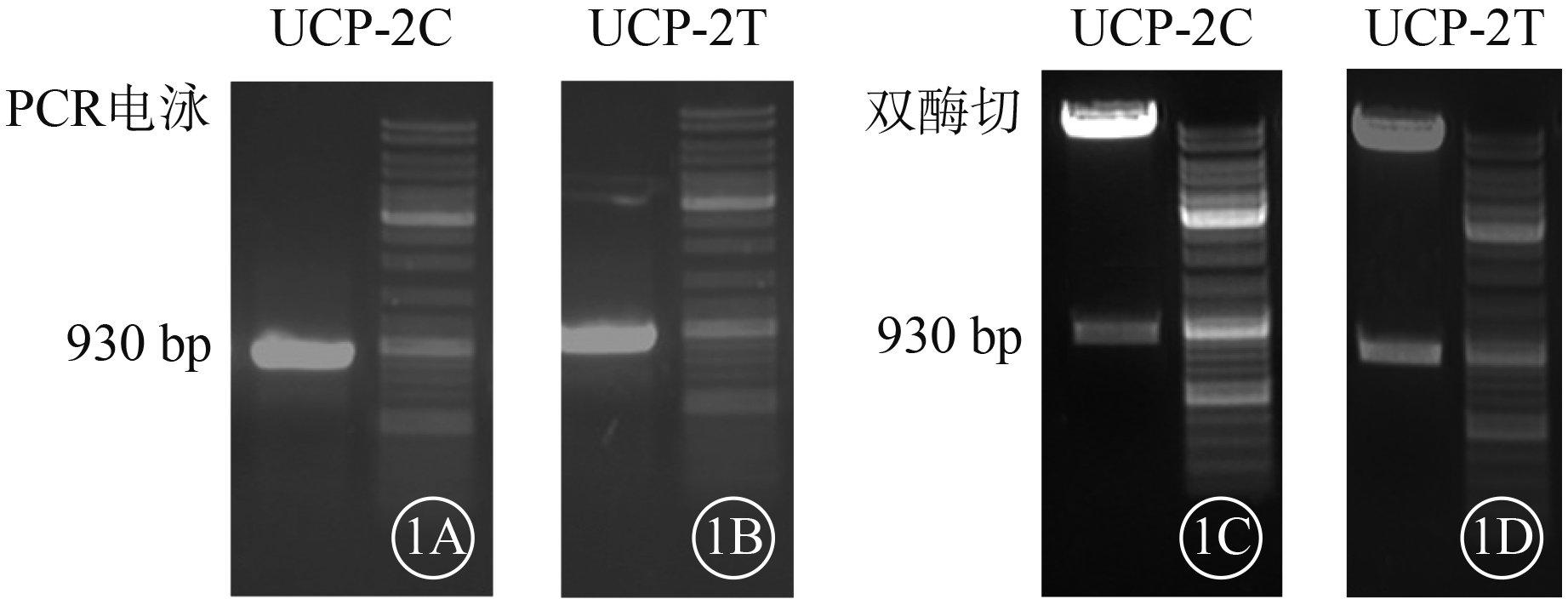
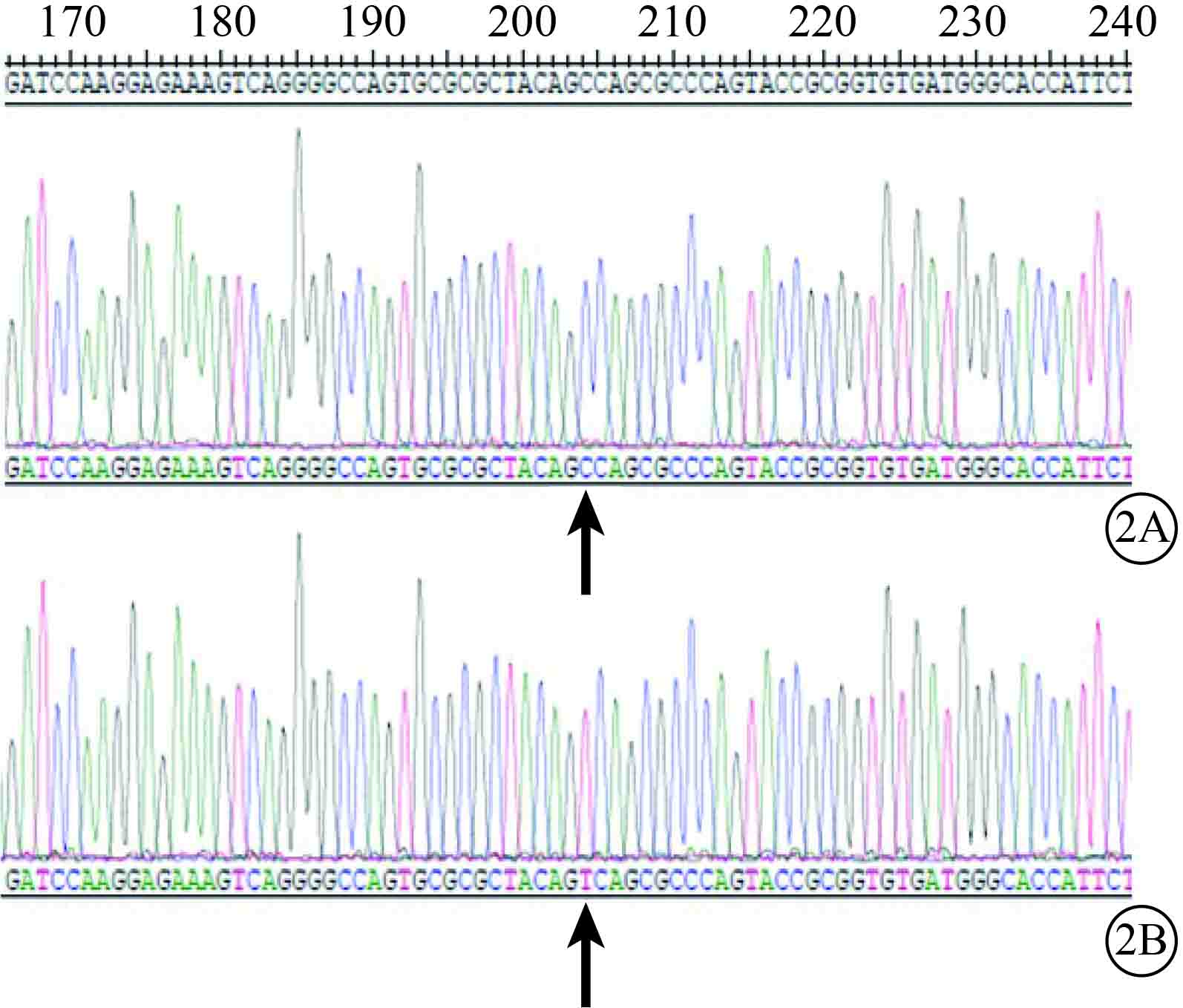
PCR檢測結果顯示,UCP-2C、UCP-2T均可見930堿基對(bp)左右的基因片段和載體慢病毒5(圖1)。基因測序結果顯示,rs660339位點分別攜帶堿基C和T(圖2),質粒構建成功。
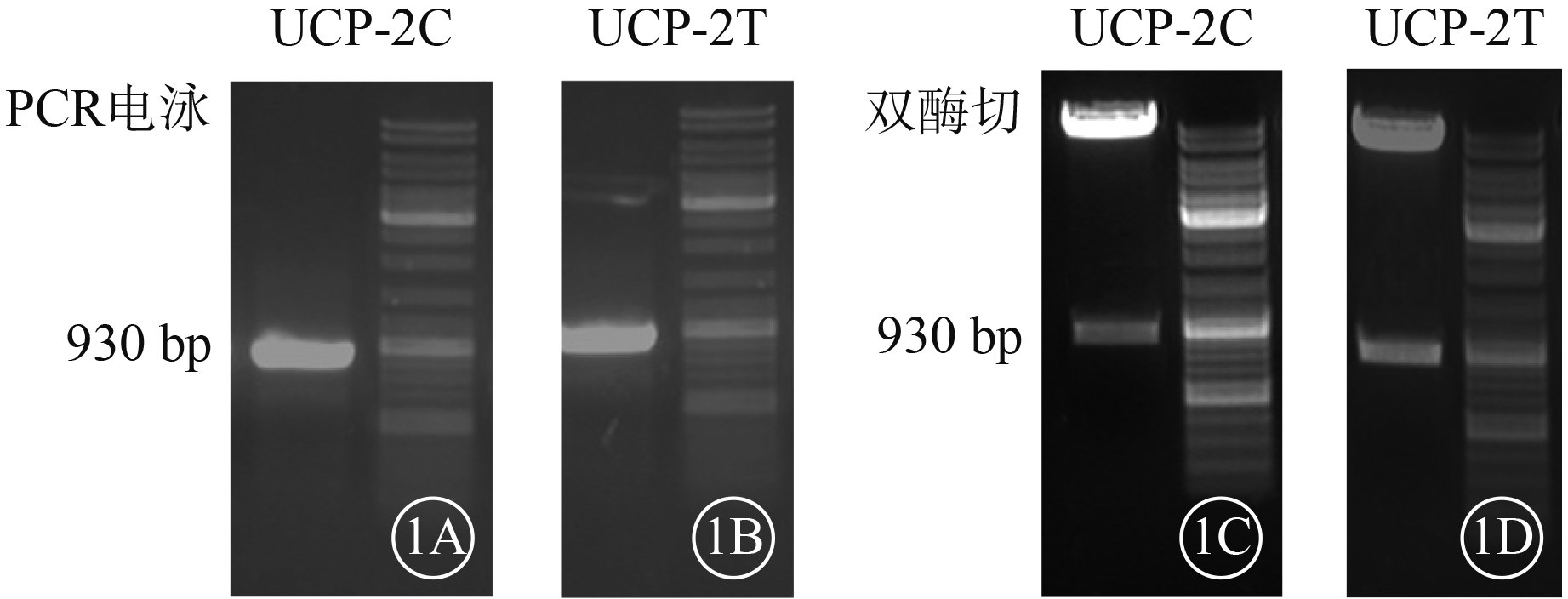 圖1
UCP-2C、UCP-2T電泳圖。1A、1B. 930 bp處可見UCP-2C、UCP-2T基因片段;1C、1D. 雙酶切后可見930 bp左右的UCP-2C、UCP-2T基因片段和載體慢病毒5
圖1
UCP-2C、UCP-2T電泳圖。1A、1B. 930 bp處可見UCP-2C、UCP-2T基因片段;1C、1D. 雙酶切后可見930 bp左右的UCP-2C、UCP-2T基因片段和載體慢病毒5
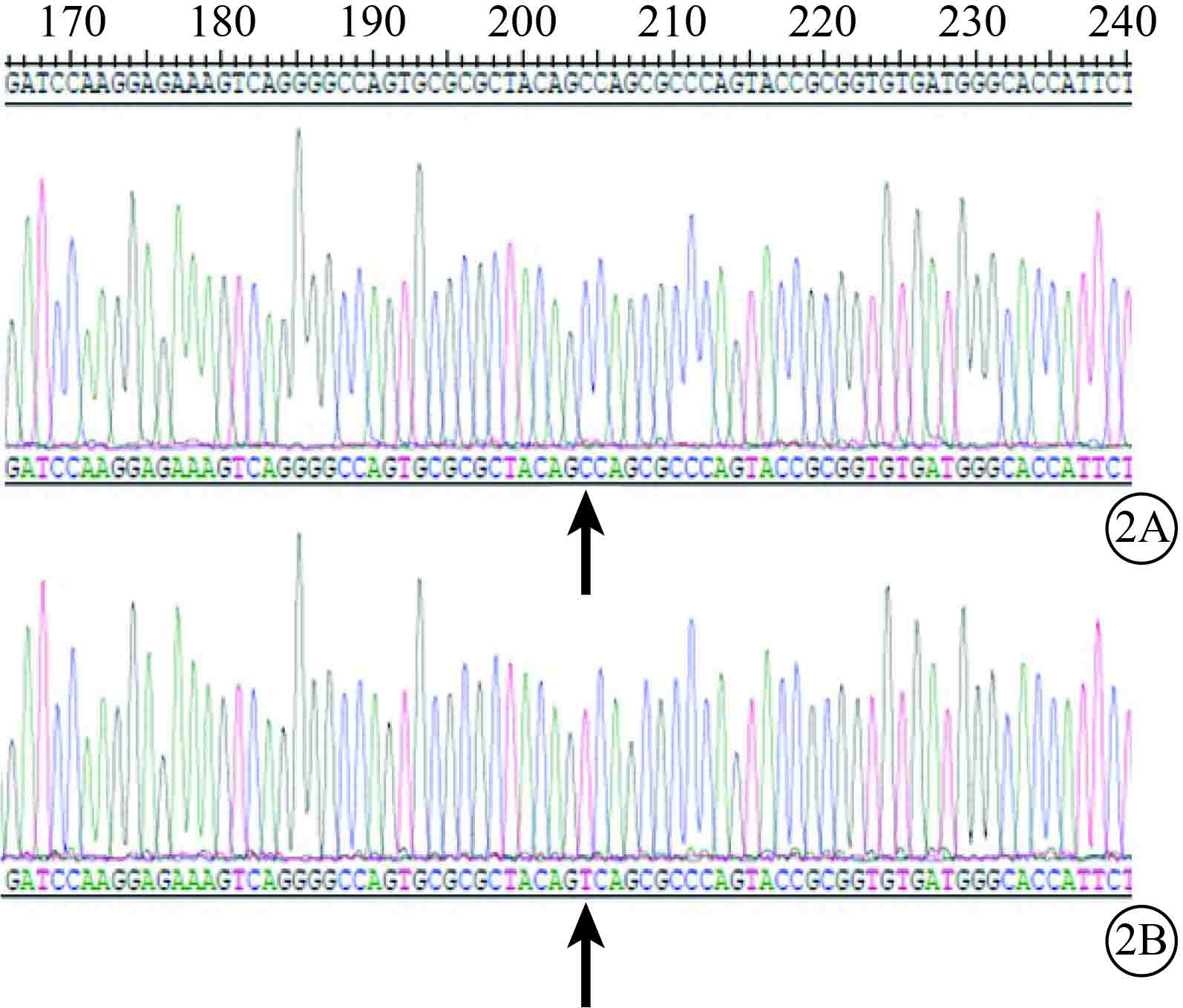 圖2
UCP-2基因測序圖。2A、2B. 分別為UCP-2C、UCP-2T。UCP-2C rs660339位點堿基為C,UCP-2T rs660339位點堿基為T(黑箭)
圖2
UCP-2基因測序圖。2A、2B. 分別為UCP-2C、UCP-2T。UCP-2C rs660339位點堿基為C,UCP-2T rs660339位點堿基為T(黑箭)
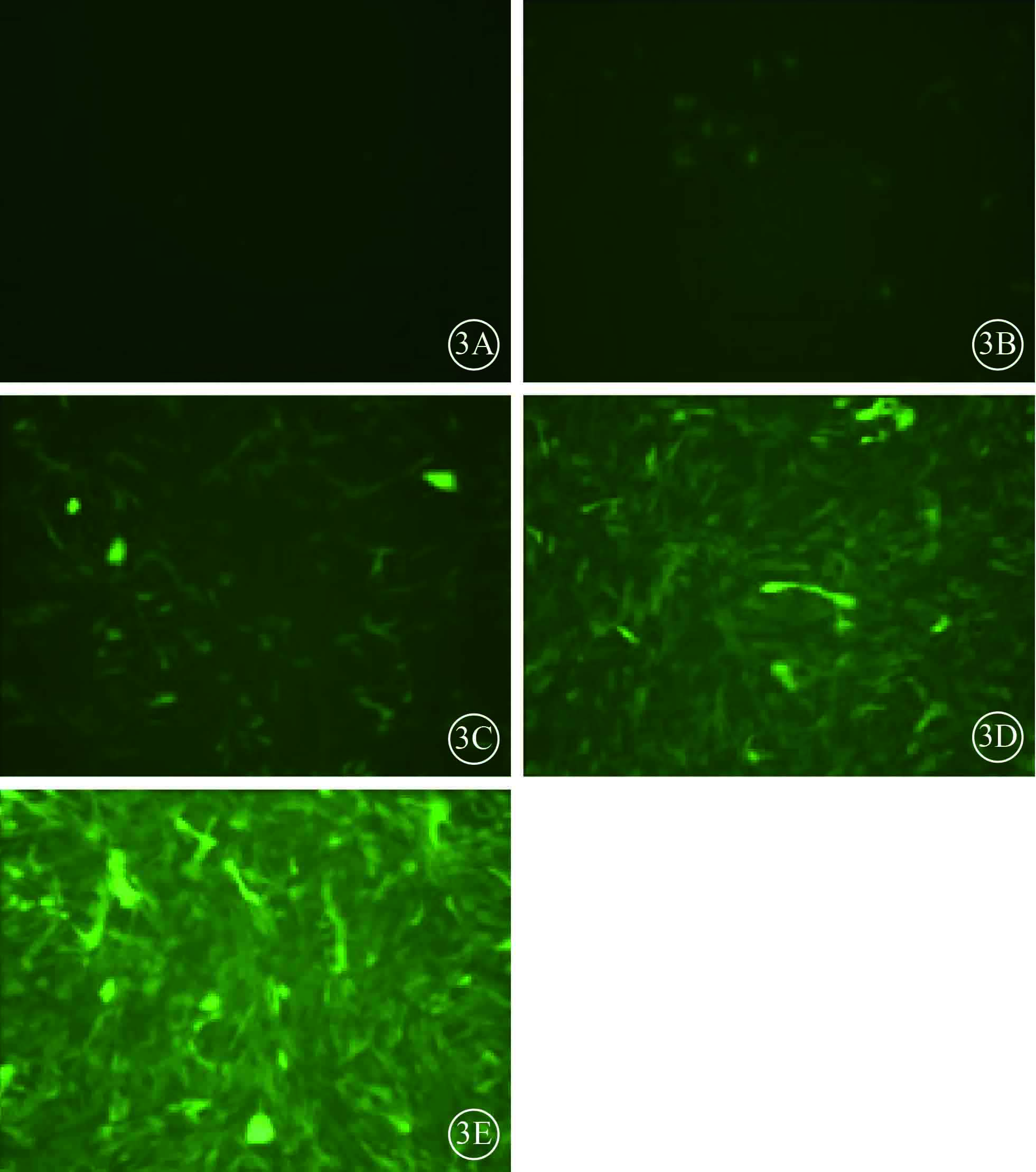
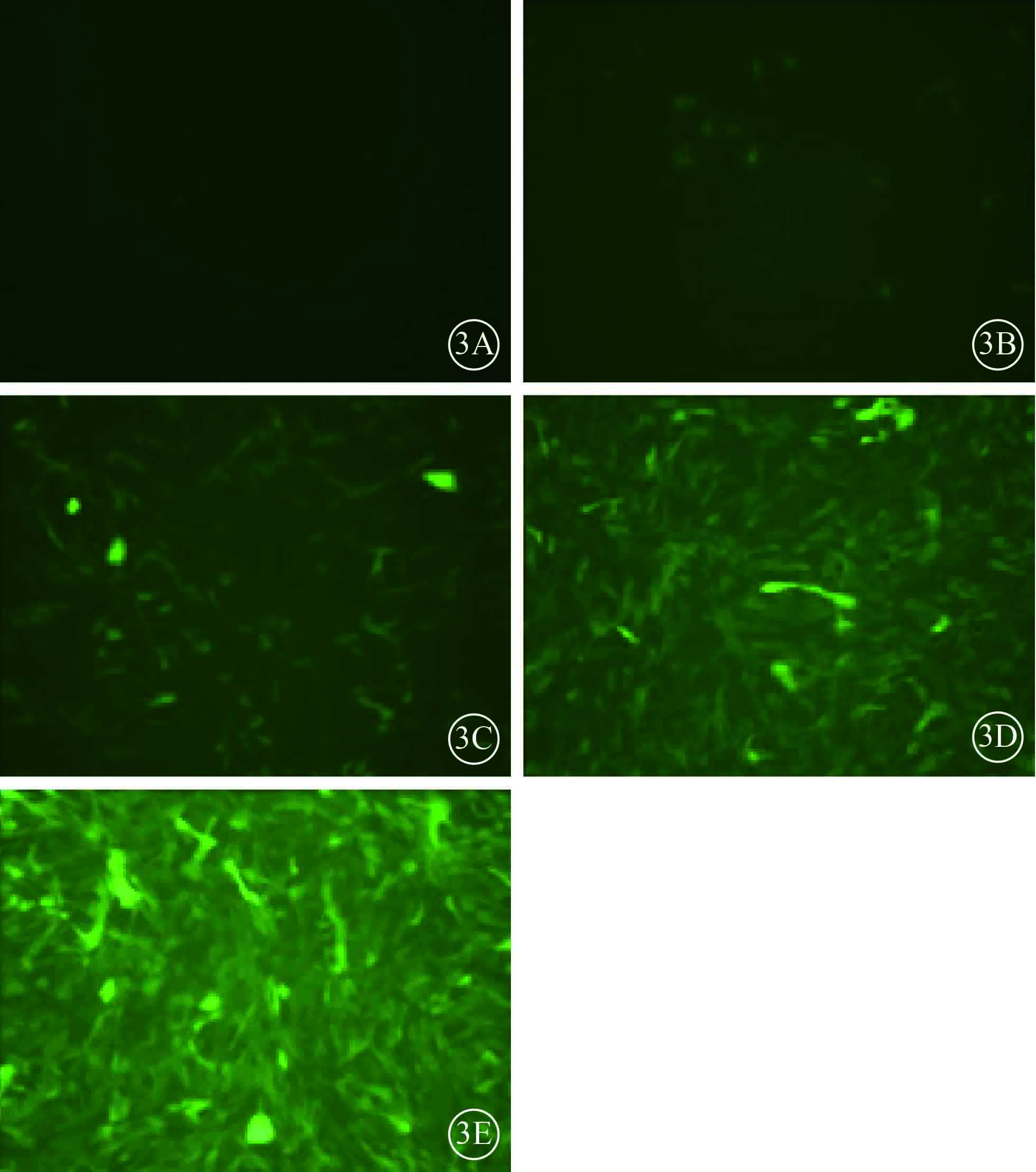
MOI值為10時,HUVEC病毒感染效率約30%;MOI值為50、100時,HUVEC病毒感染效率近100%,但MOI值為50時的HUVEC GFP表達較低。HUVEC病毒最佳MOI值選取為100(圖3)。
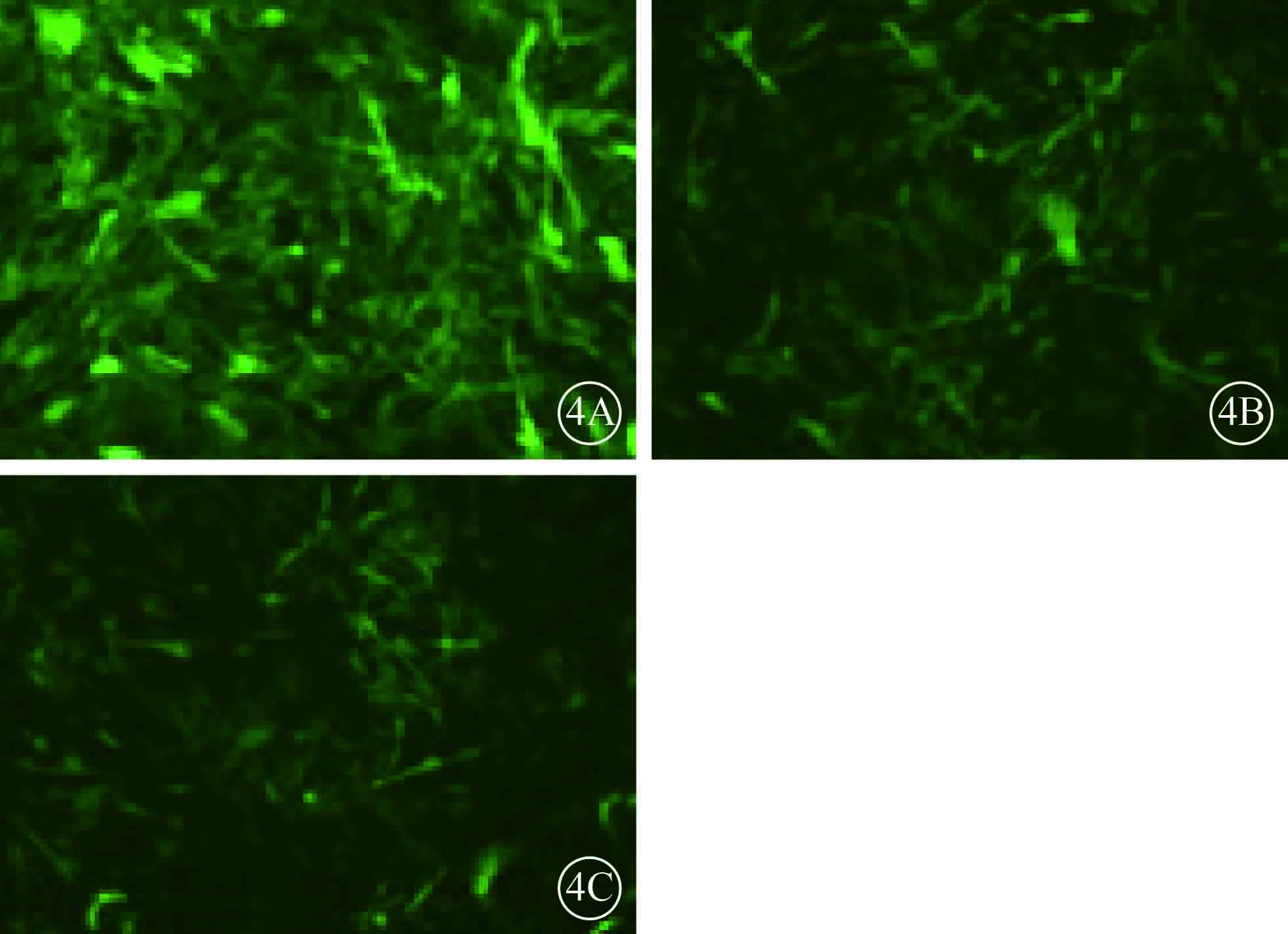
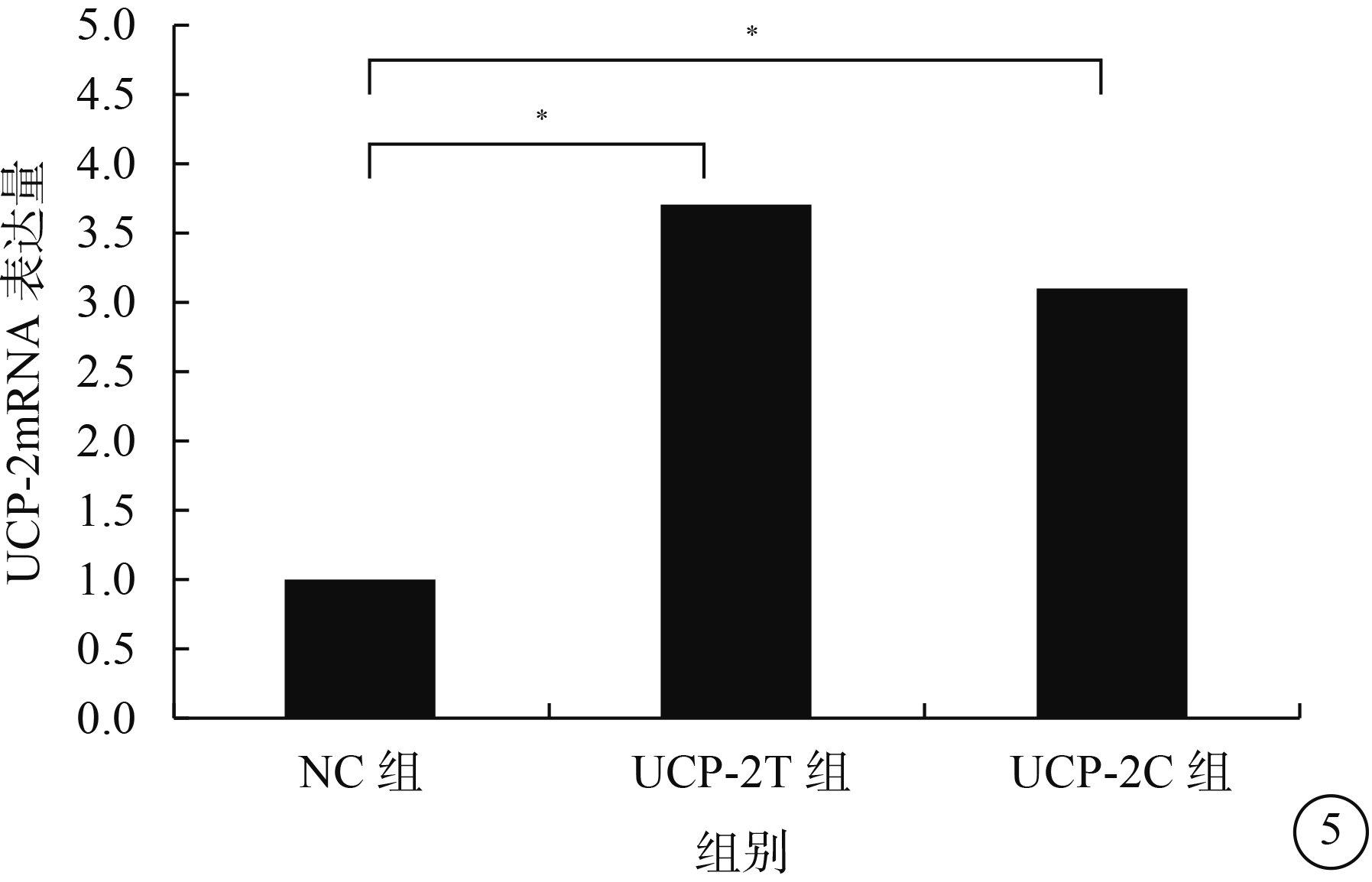
熒光顯微鏡觀察發現,NC組、UCP-2C組、UCP-2T組HUVEC均可見綠色熒光,病毒感染效率>80%(圖4)。RT-PCR檢測結果顯示,UCP-2C組、UCP-2T組HUVEC UCP-2mRNA表達均較NC組顯著增高,差異有統計學意義(F=29.183,P=0.001)(圖5)。
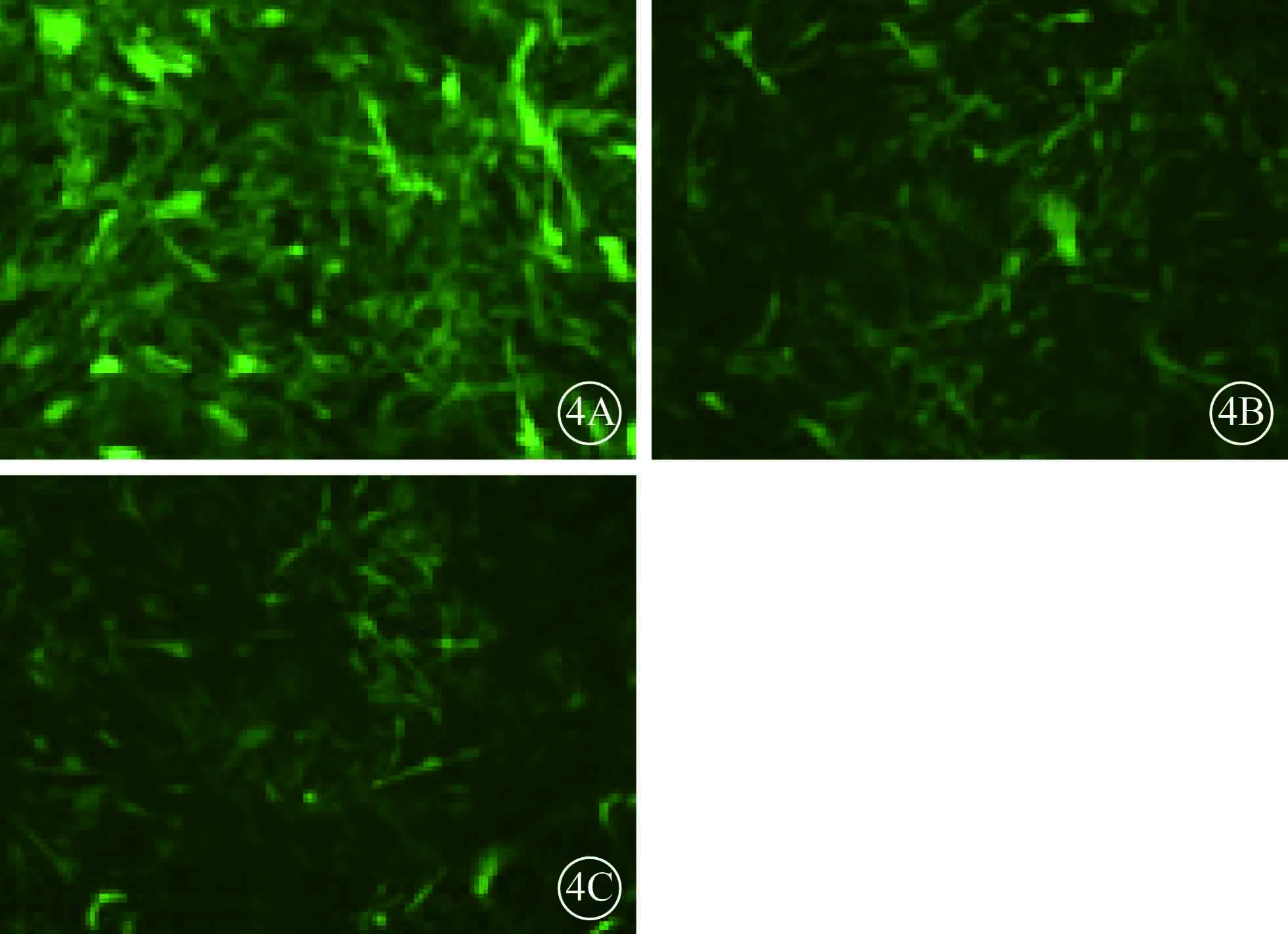
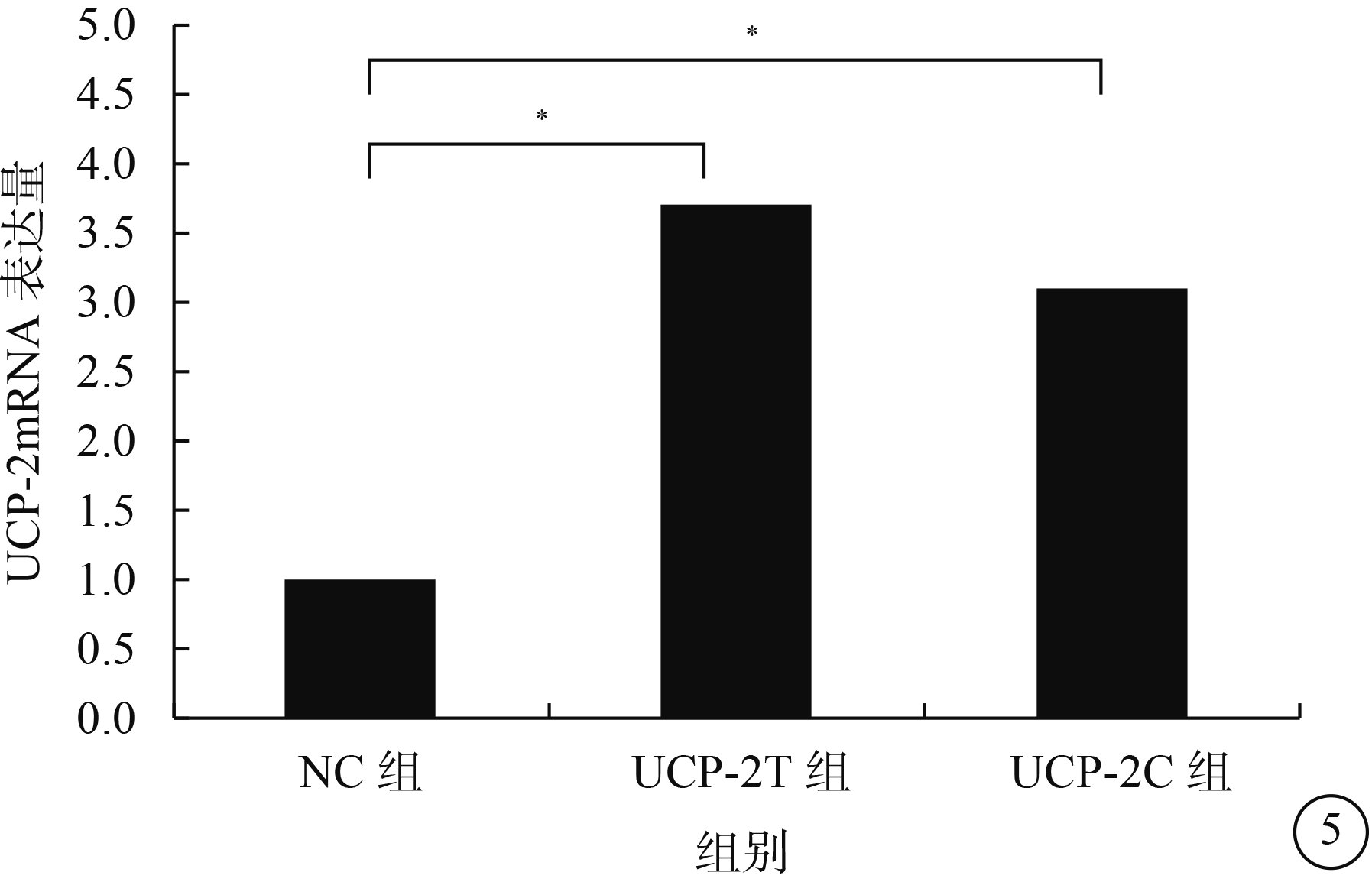 圖5
三組HUVEC中UCP-2mRNA表達結果。*P<0.05
圖5
三組HUVEC中UCP-2mRNA表達結果。*P<0.05
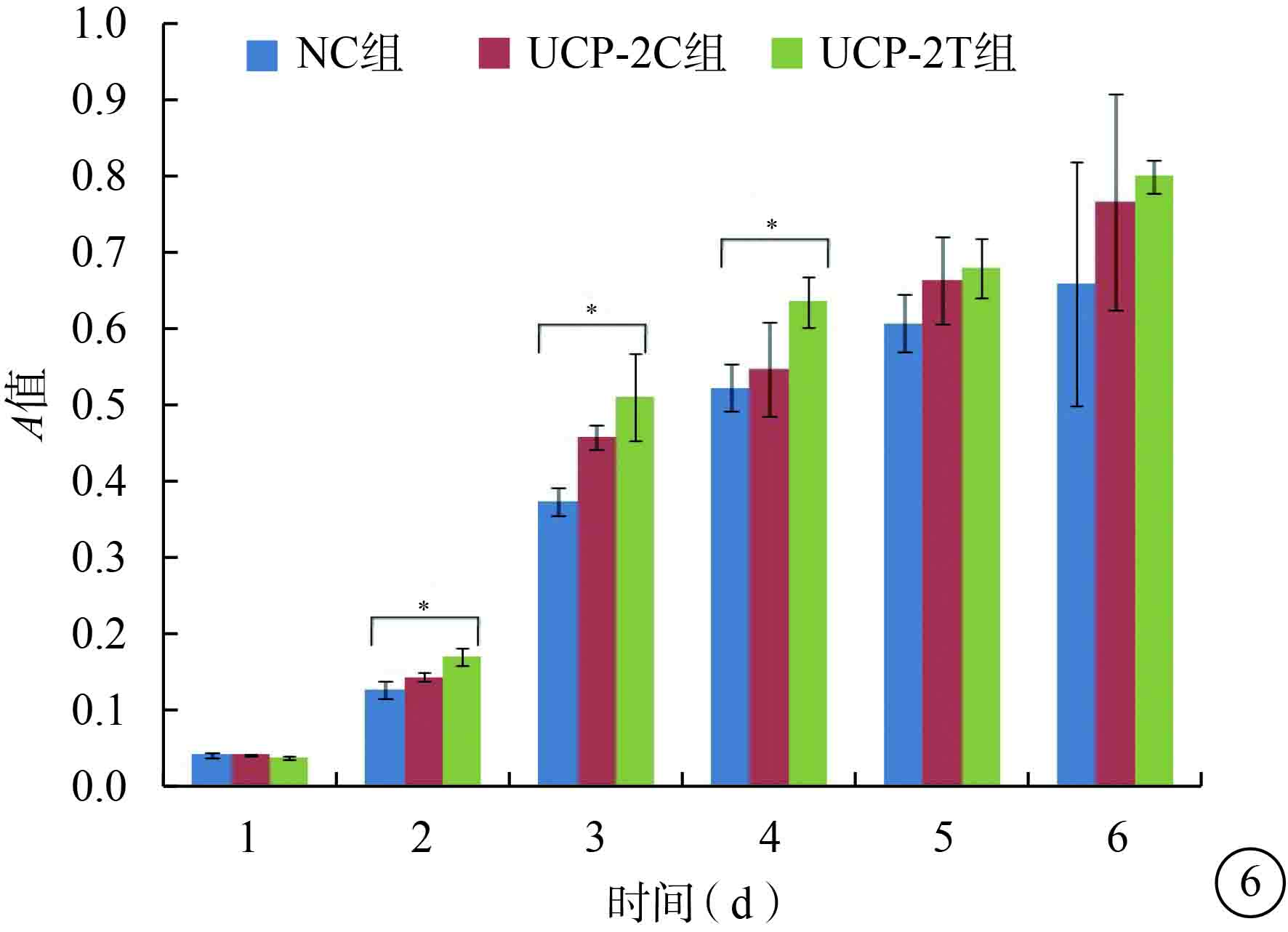
CCK-8增生分析法結果顯示,目的病毒感染后2、3、4 d,NC組、UCP-2C組、UCP-2T組HUVECA值比較,差異有統計學意義(F=15.970、16.738、5.414,P=0.004、0.004、0.045);1、5、6 d,三組HUVECA值比較,差異無統計學意義(F=0.140、2.964、1.018,P=0.873、0.127、0.416)(圖6)。
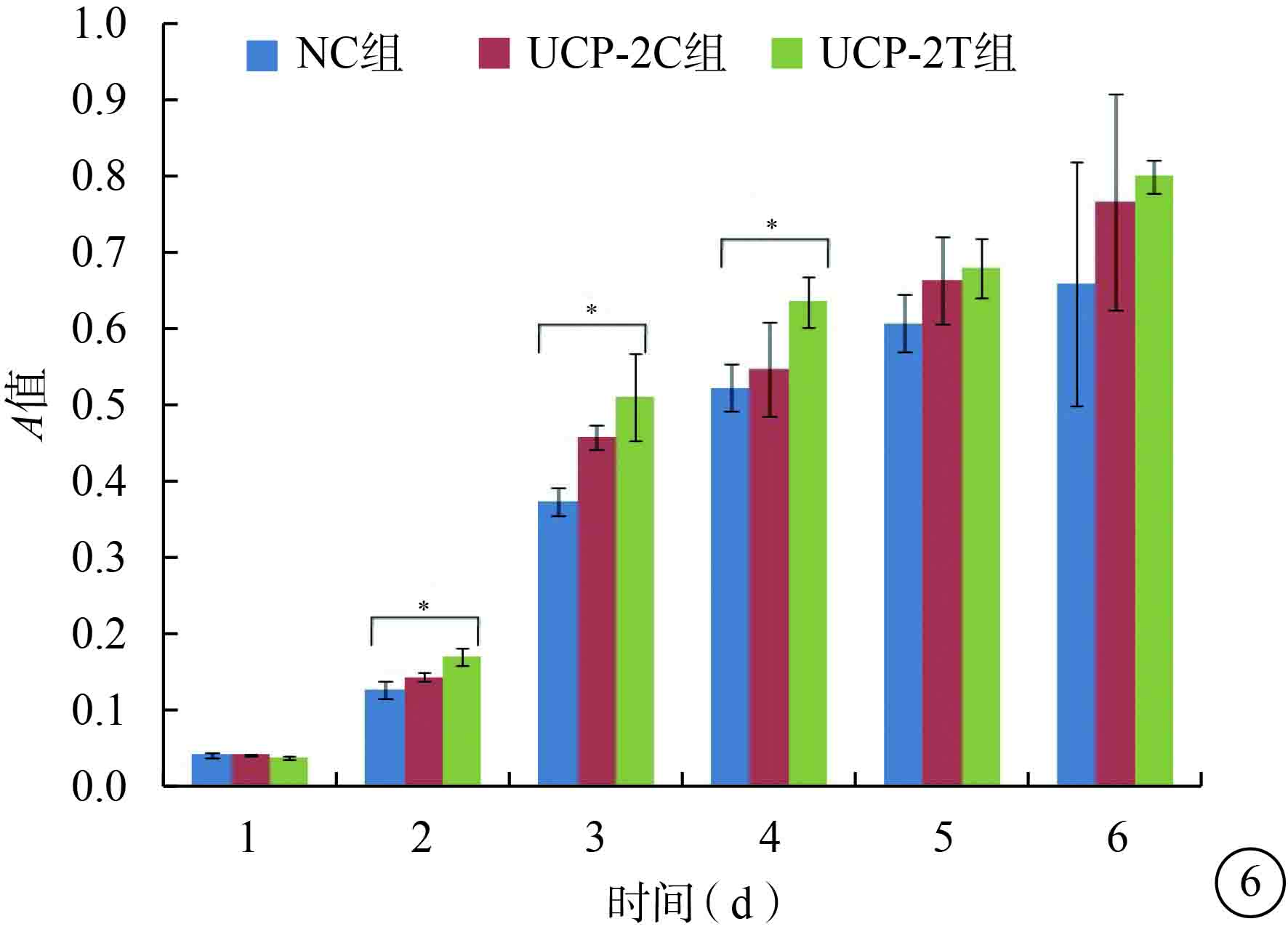 圖6
三組HUVEC目的病毒感染后不同時間A值比較。*P<0.05
圖6
三組HUVEC目的病毒感染后不同時間A值比較。*P<0.05
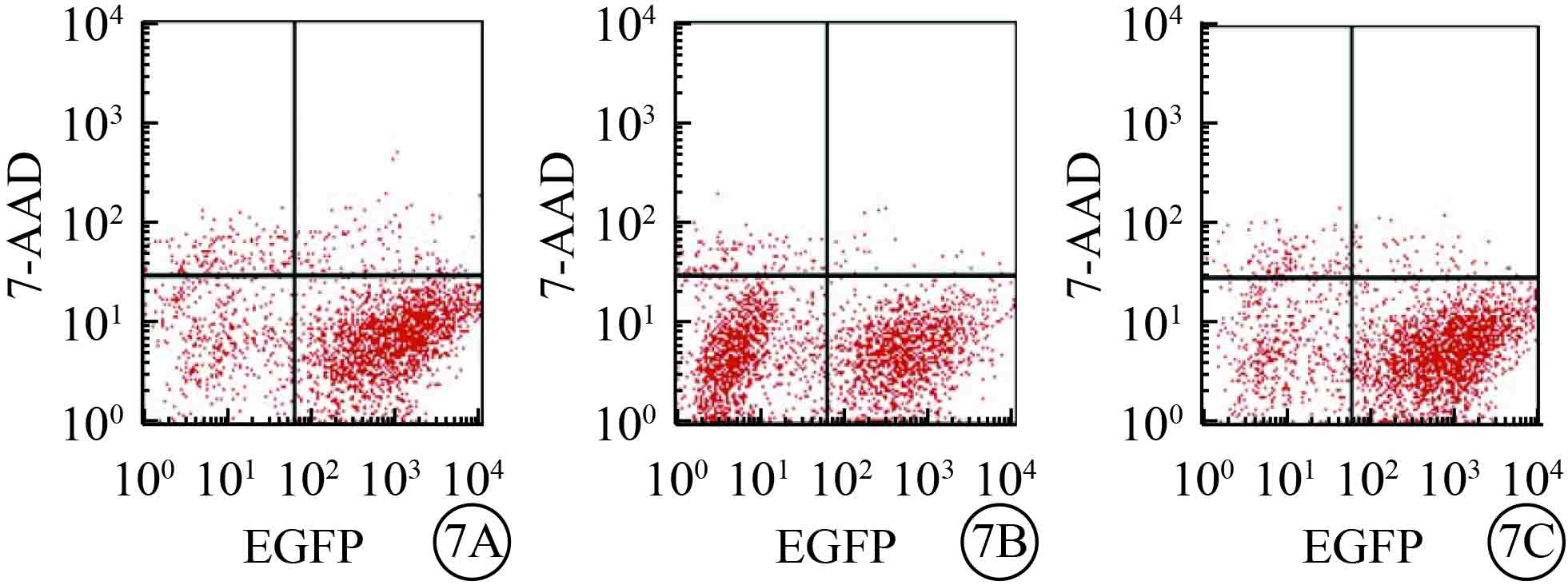
流式細胞儀檢測結果發現,目的病毒感染后72 h,與NC組比較,UCP-2T組、UCP-2C組HUVEC凋亡率均顯著降低,差異有統計學意義(F=277.138,P=0.000)。組間兩兩比較,UCP-2T組HUVEC凋亡率較UCP-2C組更低(P=0.003);UCP-2T組、UCP-2C組HUVEC凋亡率均小于NC組(P<0.001)(圖7)。
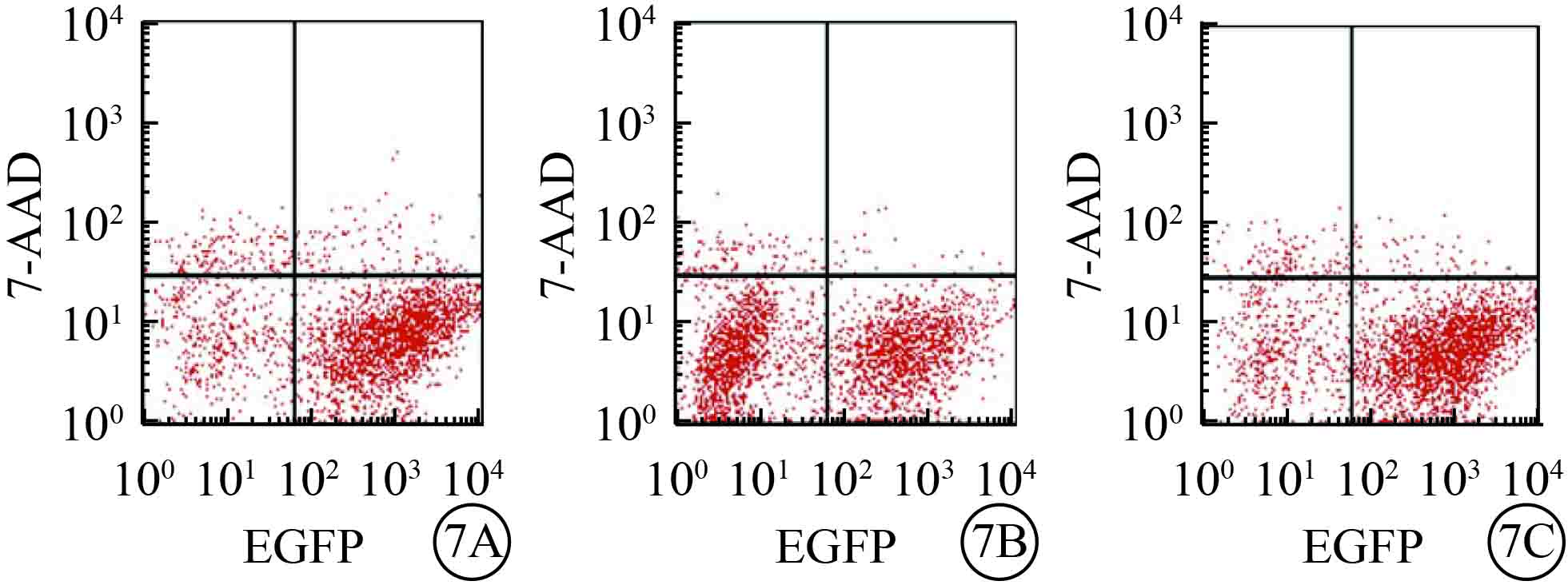 圖7
三組HUVEC凋亡流式細胞儀檢測結果。7A~7C. 分別為NC組、UCP-2T、UCP-2C組
圖7
三組HUVEC凋亡流式細胞儀檢測結果。7A~7C. 分別為NC組、UCP-2T、UCP-2C組
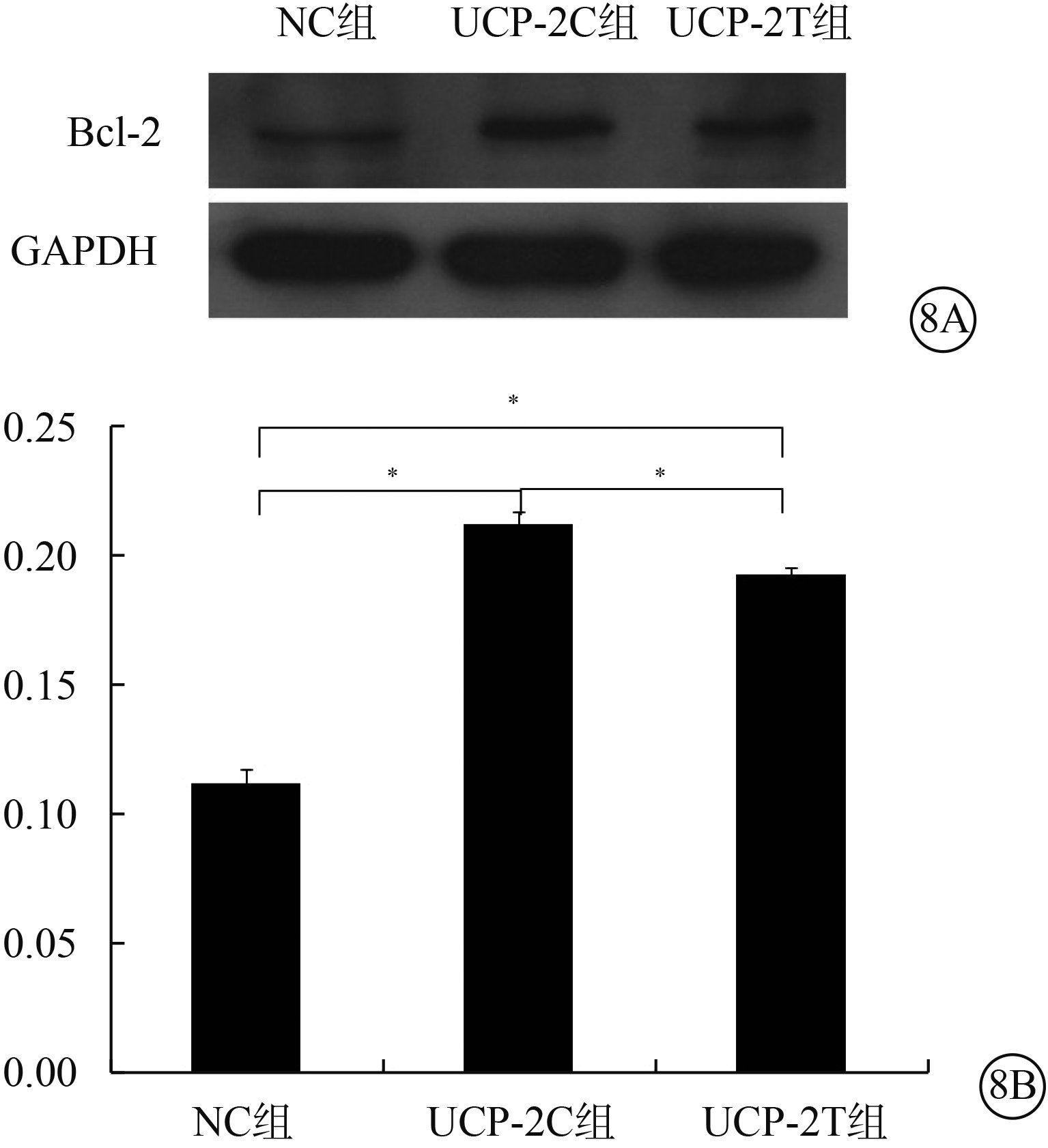
Western blot檢測結果顯示,UCP-2T組、UCP-2C組HUVEC Bcl-2蛋白表達顯著高于NC組,差異有統計學意義(F=425.679,P=0.000)。組間兩兩比較,UCP-2T組HUVEC Bcl-2表達高于UCP-2C組(P=0.002);UCP-2T組、UCP-2C組HUVEC Bcl-2表達均高于NC組(P<0.001)(圖8)。
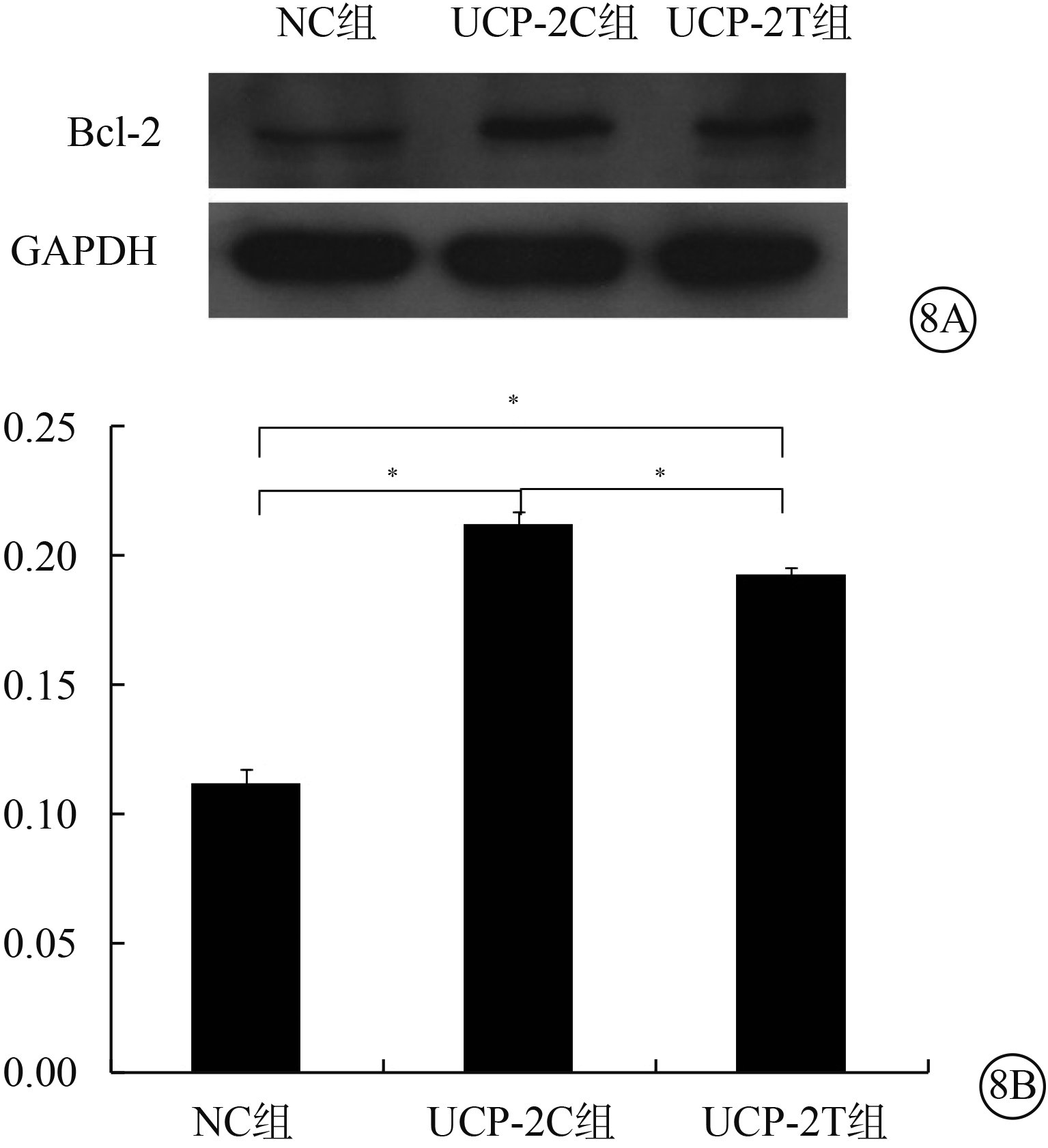 圖8
三組HUVEC Bcl-2蛋白表達情況。8A. 電泳圖;8B. 三組HUVEC Bcl-2蛋白表達結果。*P<0.05
圖8
三組HUVEC Bcl-2蛋白表達情況。8A. 電泳圖;8B. 三組HUVEC Bcl-2蛋白表達結果。*P<0.05
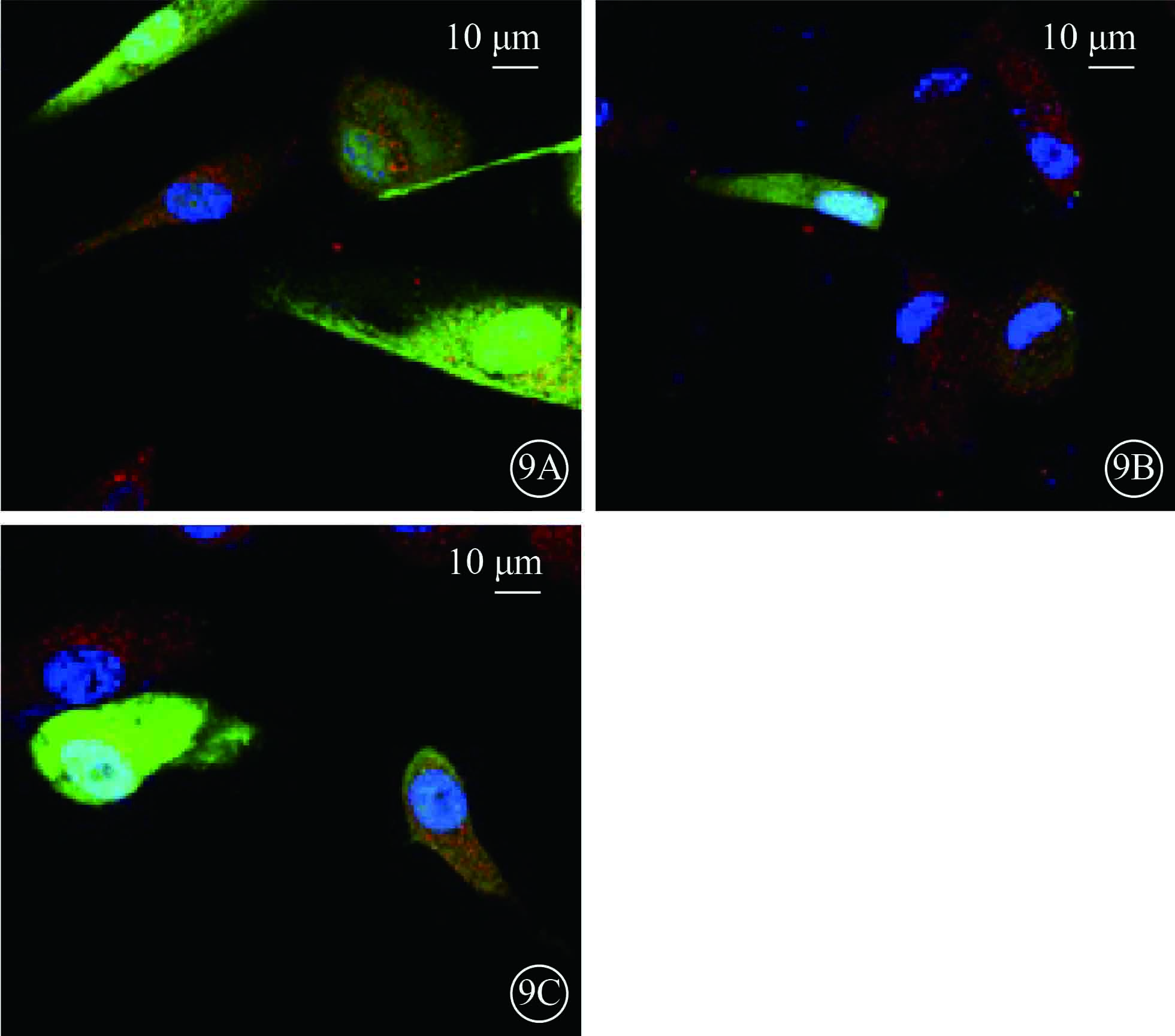
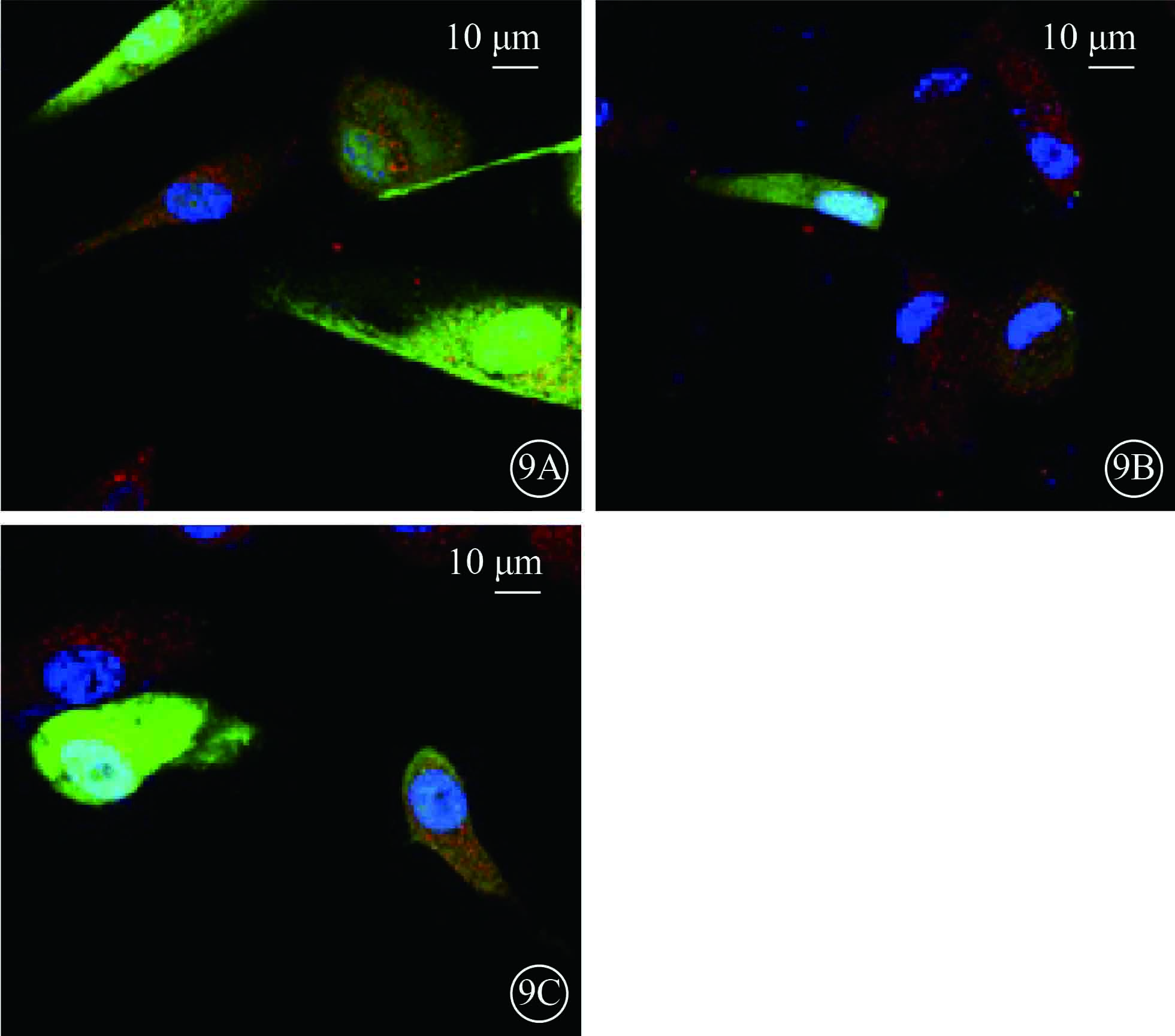
激光共聚焦顯微鏡觀察發現,UCP-2T組、UCP-2C組HUVEC Bcl-2蛋白熒光強度顯著高于NC組,差異有統計學意義(F=11.827,P=0.008)。組間兩兩比較,NC組與UCP-2T組、NC組與UCP-2C組HUVEC Bcl-2蛋白熒光強度差異有統計學意義(P=0.010、0.004);UCP-2T組和UCP-2C組HUVEC Bcl-2蛋白熒光強度差異無統計學意義(P=0.404)(圖9)。
3 討論
本研究在人群基因分析基礎上,應用慢病毒載體,設計不同序列的UCP-2基因轉染到培養的HUVEC中,觀察HUVEC增生、凋亡情況,探討基因差異表達對體外細胞功能學的影響。
通過基因測序證實慢病毒構建成功。細胞增生實驗表明,目的病毒感染后早期UCP-2基因具有促進HUVEC增生的作用;但在感染后期,病毒引起功能改變作用減弱。除目的病毒感染后第1天外,UCP-2T組HUVECA值均高于UCP-2C組,但差異無統計學意義。我們推測rs660339差異表達可能與HUVEC增生有著潛在聯系,但只是機制之一,尚不足以引起功能學明顯改變。在對HUVEC凋亡的影響方面,UCP-2基因有抑制凋亡作用,且UCP-2T較UCP-2C抑制凋亡作用更為顯著。Western blot檢測進一步表明,UCP-2抑制凋亡機制可能與Bcl-2上調有關,且UCP-2T上調Bcl-2作用更為明顯,解釋了基因差異表達對HUVEC凋亡的影響。共聚焦顯微鏡觀察雖然發現UCP-2T組HUVEC熒光強度高于UCP-2C組,但差異無統計學意義。推測病毒轉染一段時間后HUVEC形態產生變化,影響熒光的表達。體外實驗結果與我們前期流行病學研究結果一致[10],提示T等位基因可能對糖尿病和DR有保護作用。類似研究目前尚無報道,本研究是首個通過不同序列慢病毒轉染研究UCP-2基因多態性的體外研究。
本課題組前期將過表達UCP-2的慢病毒轉染HUVEC,觀察正常糖濃度和高糖狀態下對HUVEC的增生及凋亡,發現UCP-2具有促進HUVEC增生作用,并通過上調Bcl-2、下調半胱氨酸蛋白酶3及細胞色素C對高糖誘導的凋亡具有一定抑制作用[13]。本研究著重探討不同基因型對HUVEC增生及凋亡影響,未設不同糖濃度分組。今后尚需結合動物實驗進一步研究高糖狀態下UCP-2不同基因型對HUVEC增生及凋亡的影響。
本研究構建了UCP-2 rs660339位點差異表達的慢病毒載體,通過體外實驗發現基因差異表達可能影響HUVEC增生及凋亡,UCP-2T較UCP-2C抑制凋亡作用更為顯著,該作用可能與Bcl-2上調有關,為進一步探索UCP-2基因多態性與糖尿病及DR的關系和機制提供了初步依據。
糖尿病病程和全身情況是影響糖尿病視網膜病變(DR)進展重要因素,但并不能完全解釋DR發生發展中的差異性。美國威斯康星DR流行病學研究在對糖尿病患者長期隨訪中發現,部分患者血糖控制良好卻發生嚴重DR;而部分患者血糖控制欠佳,DR程度則較輕。遺傳學證據提示某些易感基因的多態性在DR的發生發展中起到了一定作用[1]。解偶聯蛋白(UCP)是一類位于線粒體內膜的跨膜蛋白[2], 通過消除線粒體質子梯度差從而抑制線粒體活性氧的產生[3]。已知的UCP有5類,其中UCP-2廣泛表達于哺乳動物的白色脂肪組織、肝臟、腎臟、胰島β細胞、巨噬細胞、視網膜血管內皮細胞及周細胞[4]。近年來,研究發現UCP-2基因多態性與2型糖尿病、肥胖、心血管疾病發生有關[2,5-8]。基因多態性導致UCP-2表達變化,引起氧化應激、脂肪代謝及胰島素分泌一系列內環境紊亂。Ala55Val(rs660339)位點定位于UCP-2第4外顯子,胞嘧啶(C)→胸腺嘧啶(T)堿基的變化導致編碼氨基酸的改變;已有文獻報道該位點與糖尿病和DR發生相關[2,5,6]。我們的前期研究發現,糖尿病患者中rs660339位點攜帶C的比例較T高,與對照組相比差異有統計學意義[9],但該位點差異表達是否會引起體內功能學改變尚無研究報道。由于DR的微血管病變主要累及視網膜血管內皮細胞和周細胞,而人臍靜脈內皮細胞(HUVEC)是進行血管內皮細胞實驗通常選用的細胞模型,與動物血管內皮細胞相比,更符合人體情況[10],也是視網膜新生血管疾病應用較多的細胞模型[11,12]。因此,本研究通過構建UCP-2差異表達的慢病毒載體UCP-2C和UCP-2T,轉染HUVEC,觀察其對細胞增生及凋亡影響。現將結果報道如下。
1 材料和方法
慢病毒構建及包裝(上海吉瑪制藥技術有限公司);包裝細胞293T及HUVEC(美國ScienCell公司);細胞計數試劑盒(CCK-8,日本Dojindo公司);7-氨基放線菌素D(7-AAD)單染色法細胞凋亡檢測試劑盒(CD004-2,上海銳賽生物技術有限公司);B細胞淋巴瘤/白血病-2(Bcl-2)抗體(ab7973,英國Abcam公司);磷酸甘油醛脫氫酶(GAPDH)抗體(KM9002,天津三箭生物技術有限公司)。
根據cDNA數據庫(上海吉瑪制藥技術有限公司)人UCP-2基因(NM_003355.2)序列設計并合成擴增引物;聚合酶鏈反應(PCR)分別得到UCP-2C和UCP-2T基因片段,即rs660339位點堿基分別是C或T;同時設計一條無意義的陰性對照(NC)序列。將目的基因克隆到載體慢病毒5中經NotⅠ和NsiⅠ雙酶切后測序驗證。
對數生長期的293T細胞培養至80%~90%融合時,培養液中按比例加入慢病毒質粒和輔助質粒pGag/Pol、pRev、pVSV-G,與RNAi轉染系統轉染試劑混合,收集轉染72 h后的上清液,濾器過濾,離心,測定病毒滴度。所得病毒濃縮液的病毒滴度為1.0×109 IFU/ml。
將處于對數生長期的HUVEC接種于96孔板,根據預實驗結果,設定HUVEC病毒最佳感染復數(MOI)梯度為0、1、10、50、100。根據病毒滴度依次加入相應劑量的病毒濃縮液,并同時加入濃度終為5 μg/ml的聚凝胺增強感染。病毒感染72 h后,熒光顯微鏡觀察HUVEC綠色熒光蛋白(GFP)的表達,確定HUVEC病毒最佳MOI值。MOI=病毒滴度×加入病毒體積/感染的細胞數。
抽提總RNA,實時定量-PCR(RT-PCR)檢測HUVEC UCP-2mRNA表達。UCP-2上游引物:5′-GGCTGGAGGTGGTCGGAG-3′;下游引物:5′-CAGAAGTGAAGTGGCAAGGGAG-3′;人肌動蛋白上游引物:5′-TCCTTCCTGGGCATGGAGT-3′;下游引物:5′-CAGGAGGAGCAATGATCTTGAT-3′。??Ct法進行定量。
CCK-8增生分析法檢測各組HUVEC增生。取3孔HUVEC分為NC組、UCP-2C組、UCP-2T組,每孔培養基體積為2 ml。分別加入目的病毒感染8~12 h。96孔培養板中加入100 μl細胞懸液,隔天每孔加入10 μl CCK-8,測定450 nm處的吸光度[A,舊稱光密度(OD)]值。測定1份/d,連續測定6 d。酶標儀讀取450 nm處的A值,將UCP-2C組、UCP-2T組的HUVECA值記為測量值,NC組的HUVECA值記為空白值,終值=測量值-空白值。將連續6 d的終值繪制柱狀圖。
流式細胞儀檢測各組HUVEC凋亡。另取3孔HUVEC分為NC組、UCP-2C組、UCP-2T組,目的病毒感染72 h后,離心,重懸細胞,加入5 μl 7-AAD,孵育30 min,采用FASAria Cell Sorter流式細胞儀定量檢測各組HUVEC凋亡情況。
蛋白免疫印跡法(Western blot)檢測各組HUVEC Bcl-2蛋白表達。分別收集3組細胞,提取總蛋白,蛋白定量后電泳,電轉。封閉后加入兔抗人Bcl-2一抗(1∶500稀釋)4 ℃過夜,洗膜后加入羊抗兔二抗(1∶5000稀釋),室溫孵育1 h,洗膜后與化學發光底物孵育1 min,曝光顯影,GAPDH作為內參照。
激光共聚焦顯微鏡觀察各組HUVEC Bcl-2蛋白熒光強度。將3組細胞懸液接種于小圓玻片上培養,固定;Triton-100處理;封閉液室溫封閉;兔抗人Bcl-2抗體按1∶100稀釋,4 ℃過夜;羊抗兔二抗抗體帶Cy3標記按1∶1000稀釋,室溫孵育,4′,6-二脒基-2-苯基吲哚(DAPI)染細胞核,激光共聚焦顯微鏡下觀察并拍照記錄。采用Image J軟件將原圖轉換成灰度圖并黑白反轉后,測量各組HUVEC的A值,重復3次取平均值。
采用SPSS13.0統計軟件進行統計學分析處理。結果以均數±標準差(
2 結果
PCR檢測結果顯示,UCP-2C、UCP-2T均可見930堿基對(bp)左右的基因片段和載體慢病毒5(圖1)。基因測序結果顯示,rs660339位點分別攜帶堿基C和T(圖2),質粒構建成功。
 圖1
UCP-2C、UCP-2T電泳圖。1A、1B. 930 bp處可見UCP-2C、UCP-2T基因片段;1C、1D. 雙酶切后可見930 bp左右的UCP-2C、UCP-2T基因片段和載體慢病毒5
圖1
UCP-2C、UCP-2T電泳圖。1A、1B. 930 bp處可見UCP-2C、UCP-2T基因片段;1C、1D. 雙酶切后可見930 bp左右的UCP-2C、UCP-2T基因片段和載體慢病毒5
 圖2
UCP-2基因測序圖。2A、2B. 分別為UCP-2C、UCP-2T。UCP-2C rs660339位點堿基為C,UCP-2T rs660339位點堿基為T(黑箭)
圖2
UCP-2基因測序圖。2A、2B. 分別為UCP-2C、UCP-2T。UCP-2C rs660339位點堿基為C,UCP-2T rs660339位點堿基為T(黑箭)
MOI值為10時,HUVEC病毒感染效率約30%;MOI值為50、100時,HUVEC病毒感染效率近100%,但MOI值為50時的HUVEC GFP表達較低。HUVEC病毒最佳MOI值選取為100(圖3)。

熒光顯微鏡觀察發現,NC組、UCP-2C組、UCP-2T組HUVEC均可見綠色熒光,病毒感染效率>80%(圖4)。RT-PCR檢測結果顯示,UCP-2C組、UCP-2T組HUVEC UCP-2mRNA表達均較NC組顯著增高,差異有統計學意義(F=29.183,P=0.001)(圖5)。

 圖5
三組HUVEC中UCP-2mRNA表達結果。*P<0.05
圖5
三組HUVEC中UCP-2mRNA表達結果。*P<0.05
CCK-8增生分析法結果顯示,目的病毒感染后2、3、4 d,NC組、UCP-2C組、UCP-2T組HUVECA值比較,差異有統計學意義(F=15.970、16.738、5.414,P=0.004、0.004、0.045);1、5、6 d,三組HUVECA值比較,差異無統計學意義(F=0.140、2.964、1.018,P=0.873、0.127、0.416)(圖6)。
 圖6
三組HUVEC目的病毒感染后不同時間A值比較。*P<0.05
圖6
三組HUVEC目的病毒感染后不同時間A值比較。*P<0.05
流式細胞儀檢測結果發現,目的病毒感染后72 h,與NC組比較,UCP-2T組、UCP-2C組HUVEC凋亡率均顯著降低,差異有統計學意義(F=277.138,P=0.000)。組間兩兩比較,UCP-2T組HUVEC凋亡率較UCP-2C組更低(P=0.003);UCP-2T組、UCP-2C組HUVEC凋亡率均小于NC組(P<0.001)(圖7)。
 圖7
三組HUVEC凋亡流式細胞儀檢測結果。7A~7C. 分別為NC組、UCP-2T、UCP-2C組
圖7
三組HUVEC凋亡流式細胞儀檢測結果。7A~7C. 分別為NC組、UCP-2T、UCP-2C組
Western blot檢測結果顯示,UCP-2T組、UCP-2C組HUVEC Bcl-2蛋白表達顯著高于NC組,差異有統計學意義(F=425.679,P=0.000)。組間兩兩比較,UCP-2T組HUVEC Bcl-2表達高于UCP-2C組(P=0.002);UCP-2T組、UCP-2C組HUVEC Bcl-2表達均高于NC組(P<0.001)(圖8)。
 圖8
三組HUVEC Bcl-2蛋白表達情況。8A. 電泳圖;8B. 三組HUVEC Bcl-2蛋白表達結果。*P<0.05
圖8
三組HUVEC Bcl-2蛋白表達情況。8A. 電泳圖;8B. 三組HUVEC Bcl-2蛋白表達結果。*P<0.05
激光共聚焦顯微鏡觀察發現,UCP-2T組、UCP-2C組HUVEC Bcl-2蛋白熒光強度顯著高于NC組,差異有統計學意義(F=11.827,P=0.008)。組間兩兩比較,NC組與UCP-2T組、NC組與UCP-2C組HUVEC Bcl-2蛋白熒光強度差異有統計學意義(P=0.010、0.004);UCP-2T組和UCP-2C組HUVEC Bcl-2蛋白熒光強度差異無統計學意義(P=0.404)(圖9)。

3 討論
本研究在人群基因分析基礎上,應用慢病毒載體,設計不同序列的UCP-2基因轉染到培養的HUVEC中,觀察HUVEC增生、凋亡情況,探討基因差異表達對體外細胞功能學的影響。
通過基因測序證實慢病毒構建成功。細胞增生實驗表明,目的病毒感染后早期UCP-2基因具有促進HUVEC增生的作用;但在感染后期,病毒引起功能改變作用減弱。除目的病毒感染后第1天外,UCP-2T組HUVECA值均高于UCP-2C組,但差異無統計學意義。我們推測rs660339差異表達可能與HUVEC增生有著潛在聯系,但只是機制之一,尚不足以引起功能學明顯改變。在對HUVEC凋亡的影響方面,UCP-2基因有抑制凋亡作用,且UCP-2T較UCP-2C抑制凋亡作用更為顯著。Western blot檢測進一步表明,UCP-2抑制凋亡機制可能與Bcl-2上調有關,且UCP-2T上調Bcl-2作用更為明顯,解釋了基因差異表達對HUVEC凋亡的影響。共聚焦顯微鏡觀察雖然發現UCP-2T組HUVEC熒光強度高于UCP-2C組,但差異無統計學意義。推測病毒轉染一段時間后HUVEC形態產生變化,影響熒光的表達。體外實驗結果與我們前期流行病學研究結果一致[10],提示T等位基因可能對糖尿病和DR有保護作用。類似研究目前尚無報道,本研究是首個通過不同序列慢病毒轉染研究UCP-2基因多態性的體外研究。
本課題組前期將過表達UCP-2的慢病毒轉染HUVEC,觀察正常糖濃度和高糖狀態下對HUVEC的增生及凋亡,發現UCP-2具有促進HUVEC增生作用,并通過上調Bcl-2、下調半胱氨酸蛋白酶3及細胞色素C對高糖誘導的凋亡具有一定抑制作用[13]。本研究著重探討不同基因型對HUVEC增生及凋亡影響,未設不同糖濃度分組。今后尚需結合動物實驗進一步研究高糖狀態下UCP-2不同基因型對HUVEC增生及凋亡的影響。
本研究構建了UCP-2 rs660339位點差異表達的慢病毒載體,通過體外實驗發現基因差異表達可能影響HUVEC增生及凋亡,UCP-2T較UCP-2C抑制凋亡作用更為顯著,該作用可能與Bcl-2上調有關,為進一步探索UCP-2基因多態性與糖尿病及DR的關系和機制提供了初步依據。