引用本文: 孟慶豐, 孫清, 楊明明, 滕巖. 無脈絡膜癥一家系的臨床觀察及基因突變檢測. 中華眼底病雜志, 2017, 33(1): 48-51. doi: 10.3760/cma.j.issn.1005-1015.2017.01.013 復制
無脈絡膜癥(CHM)是一種以進行性脈絡膜、視網膜色素上皮(RPE)和視網膜萎縮為特征的X染色體連鎖隱性遺傳性疾病[1,2]。患者多為男性, 女性為致病基因攜帶者。CHM基因定位于染色體Xq21.2區域[3],包含15個外顯子,跨度約150×103堿基對。該基因編碼一個包含653個氨基酸的胞內蛋白質Rabescortprotein-1(Rep -1)[4]。CHM是由于CHM基因突變失活,導致Rep-1缺失或者產生無功能的基因產物,從而出現脈絡膜血管層發育障礙,進行性RPE和脈絡膜營養不良、變性及進行性脈絡膜萎縮[1]。CHM基因突變已有較多家系報道[5-7]。目前已報告CHM基因突變已超過100種,包括堿基缺失、堿基易位和插入,以及各種無義移碼和剪接突變[7]。但目前國內東北地區CHM患者基因突變研究鮮見報道。我們對一個東北地區4代CHM家系中患者和致病基因攜帶者的臨床表現進行觀察,同時對其家系成員基因進行檢測,明確了一個新的致病突變位點c.1837G>A(p.D613N)。現將結果報道如下。
1 對象和方法
本研究經本院醫學倫理委員會審核批準。所有受試者和未成年受試者監護人均簽署知情同意書。
2008年2月我院眼科就診并隨訪觀察的一個4代CHM家系中15名家庭成員納入研究。其中,患者5例,女性致病基因攜帶者2名,健康成員8名。5例患者中,男性4例,女性1例;年齡分別為6(Ⅳ1)、26(Ⅲ6)、46(Ⅱ3)、51(Ⅱ2)、77(Ⅰ1)歲。2名女性致病基因攜帶者年齡分別為26(Ⅲ2)、59(Ⅱ7)歲。8名健康者中,男、女各4名;年齡19~44歲。同時招募180名無血緣關系的健康志愿者作為對照組進行CHM基因測序比對。其中,男性98名,女性82名;年齡18~65歲。
采集家系成員的完整信息,繪制家系圖譜。所有受試者進行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、熒光素眼底血管造影(FFA)、光相干斷層掃描(OCT)、視野、全視野視網膜電圖(ERG)檢查。依據臨床檢查結果,患者符合CHM診斷標準[5]。3年后僅對患者進行隨訪。隨訪時均行BCVA檢查,女性患者同時行視野檢查。
采集所有受試者空腹外周靜脈血5 ml,乙二胺四乙酸抗凝,離心,保存于-80 ℃冰箱中。采用全血DNA提取試劑盒[天根生化科技(北京)有限公司]按照標準操作程序提取基因組DNA。
應用Primer 5.0引物設計軟件,設計針對CHM基因15個外顯子和外顯子-內含子交界區的序列引物。CHM基因轉錄本采用Transcript ID:ENST00000357749,分別擴增該基因的15個外顯子及外顯子-內含子交界區。聚合酶鏈反應(PCR)設定35個循環,94 ℃,30 s變性;退火溫度58~62 ℃,30 s;延伸溫度72 ℃,60 s。PCR產物應用普通瓊脂糖凝膠DNA回收試劑盒[天根生化科技(北京)有限公司]進行純化,運用ABI3130xl基因分析儀(美國應用生物系統公司)進行測序,使用Chromas 2.22(澳大利亞Technelysium Pty公司)對受試者以及對照組健康志愿者測序結果進行分析以及CHM基因測序結果進行比對。
對Rep-1蛋白結構和剪接突變進行造模[8],以大鼠Rep-1蛋白為范本,結合單異戊烯基Rab7蛋白,建立人類Rep-1模型[9]。采用DeepView v4.0.1(軟件)展現構象變化,預測潛在突變影響[10]。
2 結果
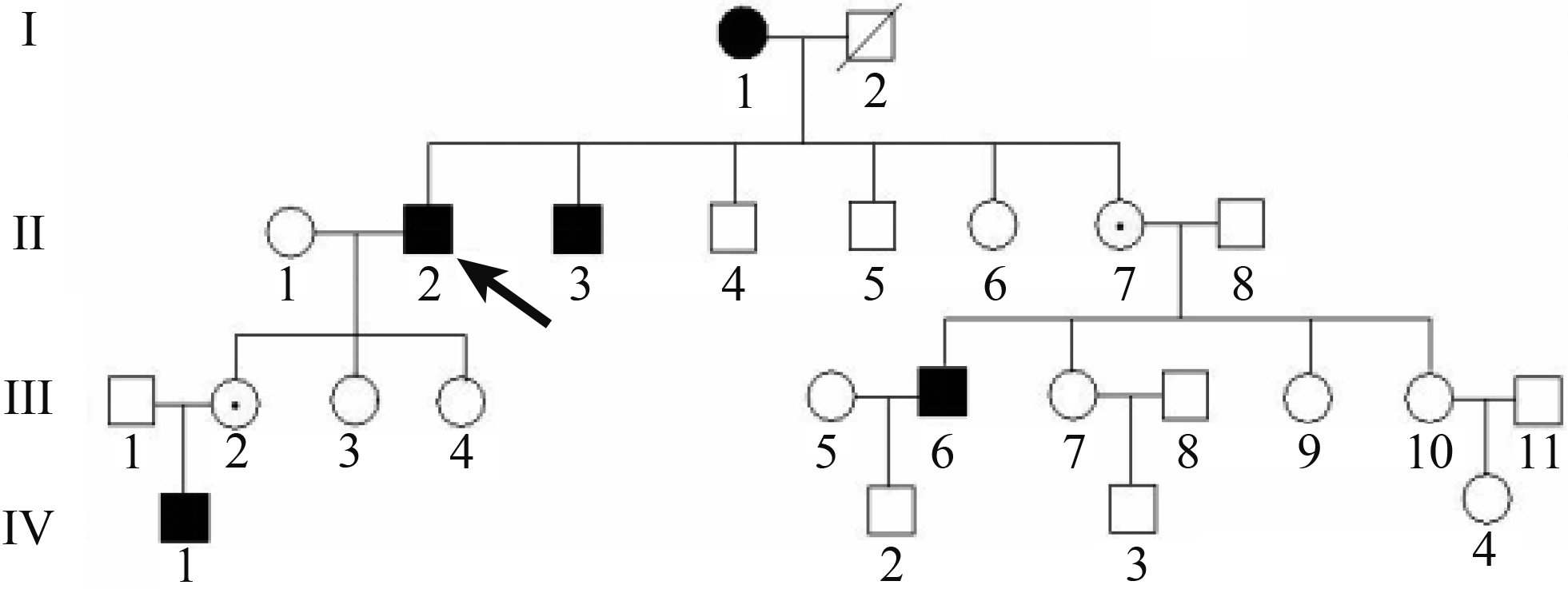
本家系具有X-連鎖遺傳方式特征(圖1)。4例男性患者中,3例成年患者(Ⅱ2、Ⅱ3、Ⅲ6)自幼出現夜盲,分別在年齡<10、10、30歲時出現視力下降;BCVA 0.3~0.6,平均BCVA為0.43。眼底呈彌漫性脈絡膜萎縮,視盤周圍暴露白色鞏膜,散在棕黑色斑片狀色素斑,黃斑部保留島狀正常區。FFA可清晰顯示脈絡膜大血管形態,黃斑中心凹呈完整圓形正常區域。視野分別表現為中心管狀視野、視野中央保留分葉狀視島、中心管狀視野伴光敏感度下降。全視野ERG檢查,視桿和視錐細胞反應均呈熄滅狀。OCT檢查,黃斑中心以外的橢圓體帶和嵌合帶消失。3年后隨訪,平均BCVA 0.01~0.3,平均BCVA為0.11;平均BCVA較3年前下降0.320。1例未成年患者為6歲男童(Ⅳ1),雙眼BCVA均為1.0。眼底僅見視盤周圍環形區顏色變淡;周圍視野光敏感度下降。女性患者(Ⅰ1)自幼出現夜盲,50歲開始出現視力下降;雙眼BCVA分別為0.5、0.25。眼底呈典型CHM改變;右眼周圍視野可見相對暗點,左眼視野中央大面積絕對和相對暗點。3年后隨訪,雙眼BCVA均為0.2,平均BCVA較3年前下降0.175。中心管狀視野伴光敏感度下降。
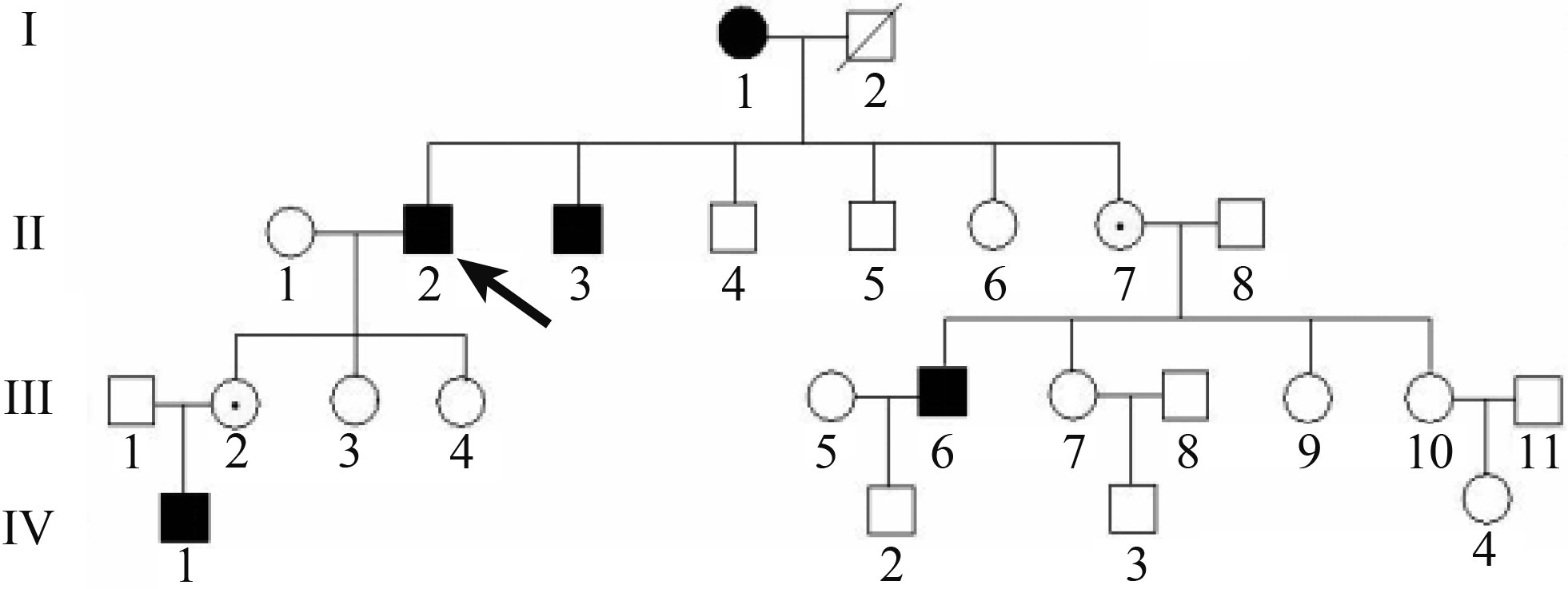 圖1
CHM患者家系圖。■:男性患者;●:女性患者;↑:先證者;⊙:女性致病基因攜帶者;□:正常男性;○:正常女性
圖1
CHM患者家系圖。■:男性患者;●:女性患者;↑:先證者;⊙:女性致病基因攜帶者;□:正常男性;○:正常女性
2名女性致病基因攜帶者中,Ⅲ2雙眼BCVA均為1.0。眼底周邊部可見有斑片狀色素沉著和RPE萎縮斑;全視野ERG正常。Ⅱ7雙眼BCVA均為0.7;晶狀體輕度混濁;眼底正常;全視野ERG正常。
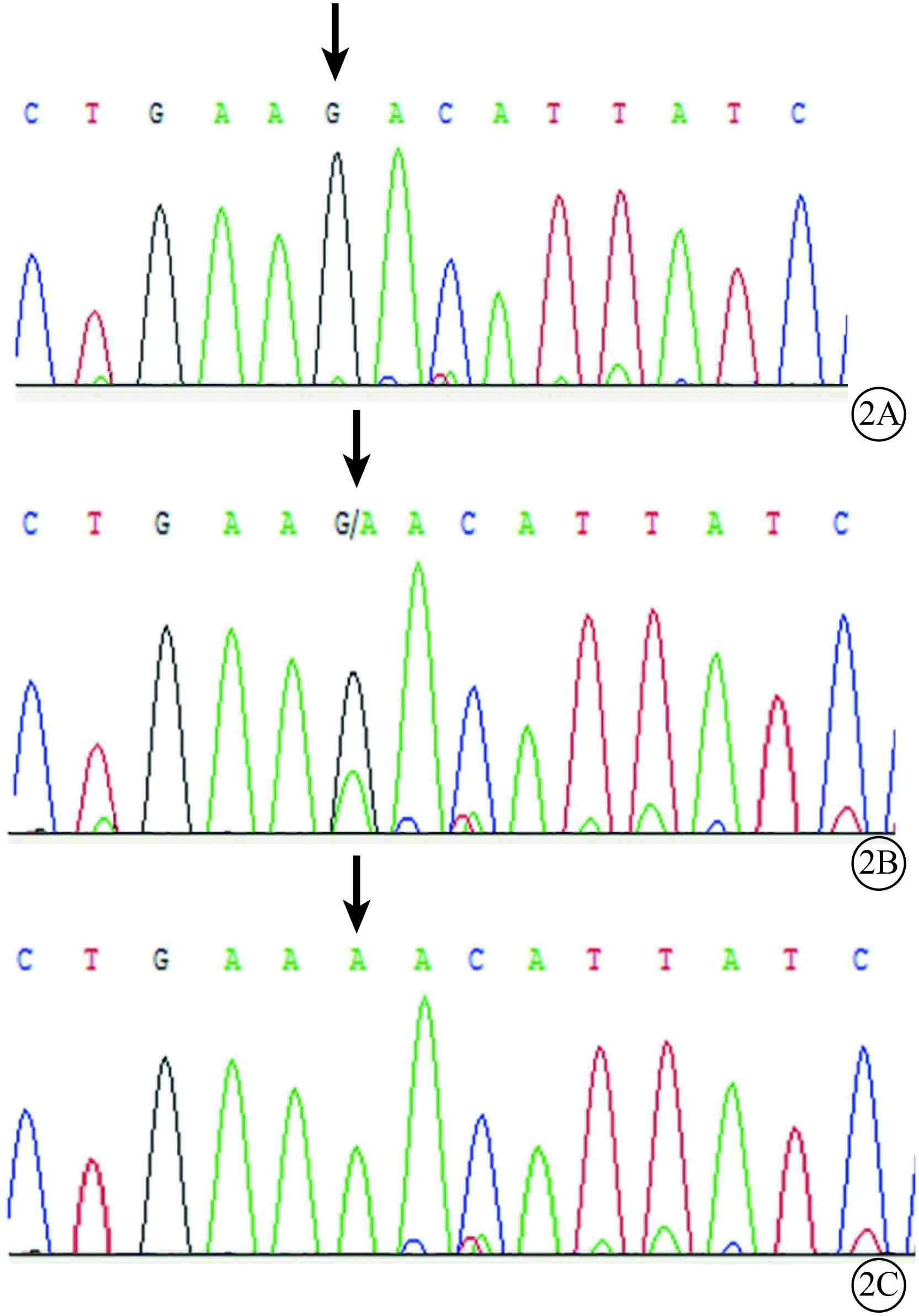
基因檢測結果顯示,患者和治病基因攜帶者CHM基因第15外顯子存在一個新的錯義突變c.1837G>A,導致天門冬酰胺代替天門冬氨酸(p.D613N);家系中健康成員和對照組健康志愿者均未檢測到此突變基因(圖2)。
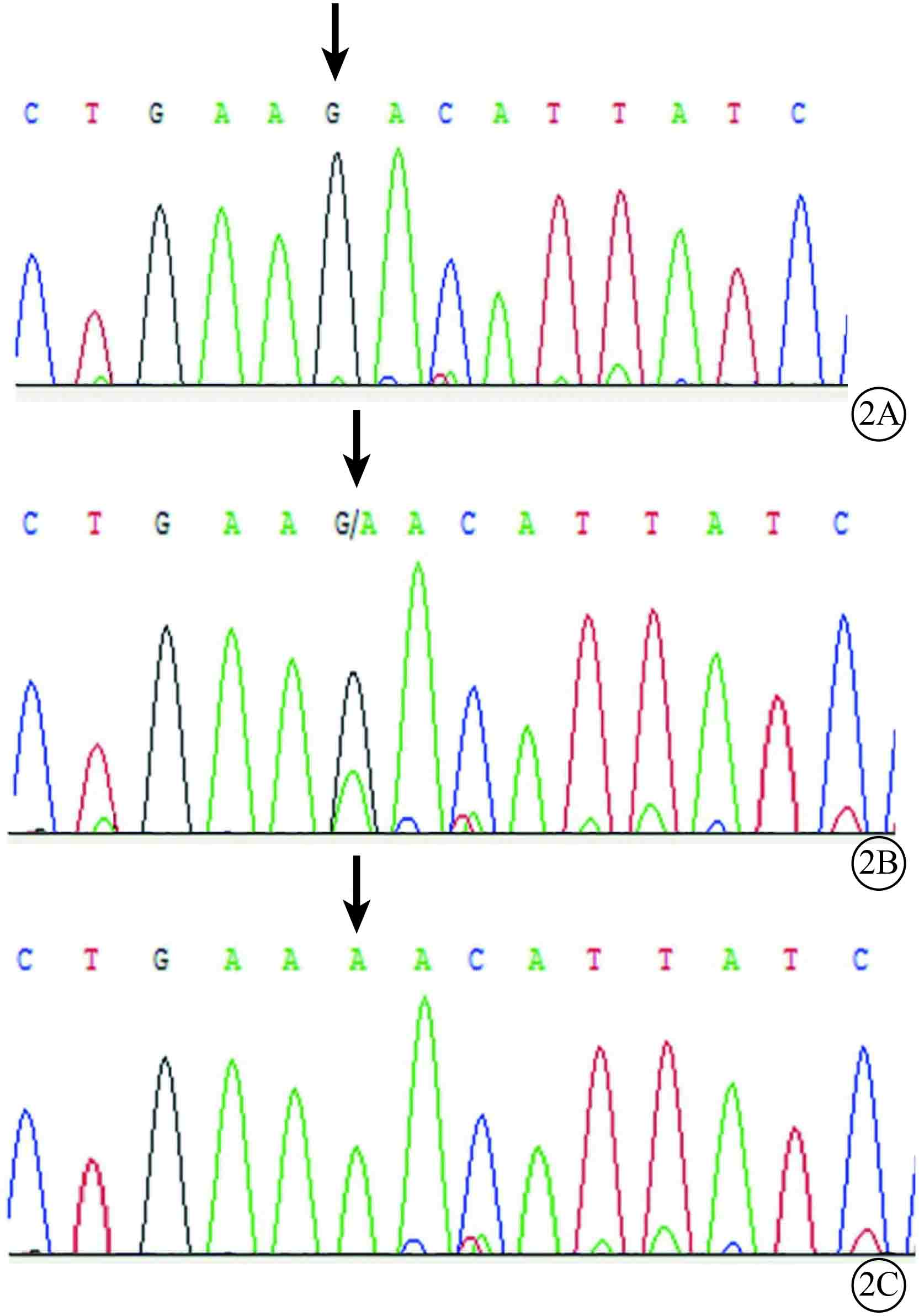 圖2
基因測序圖。2A.家系中健康成員;2B.家系中女性致病基因攜帶者;2C.CHM患者。患者和致病基因攜帶者CHM基因第15外顯子的c.1837G>A (p.D613N)突變(黑箭);家系中健康成員該位點不存在突變(黑箭)
圖2
基因測序圖。2A.家系中健康成員;2B.家系中女性致病基因攜帶者;2C.CHM患者。患者和致病基因攜帶者CHM基因第15外顯子的c.1837G>A (p.D613N)突變(黑箭);家系中健康成員該位點不存在突變(黑箭)
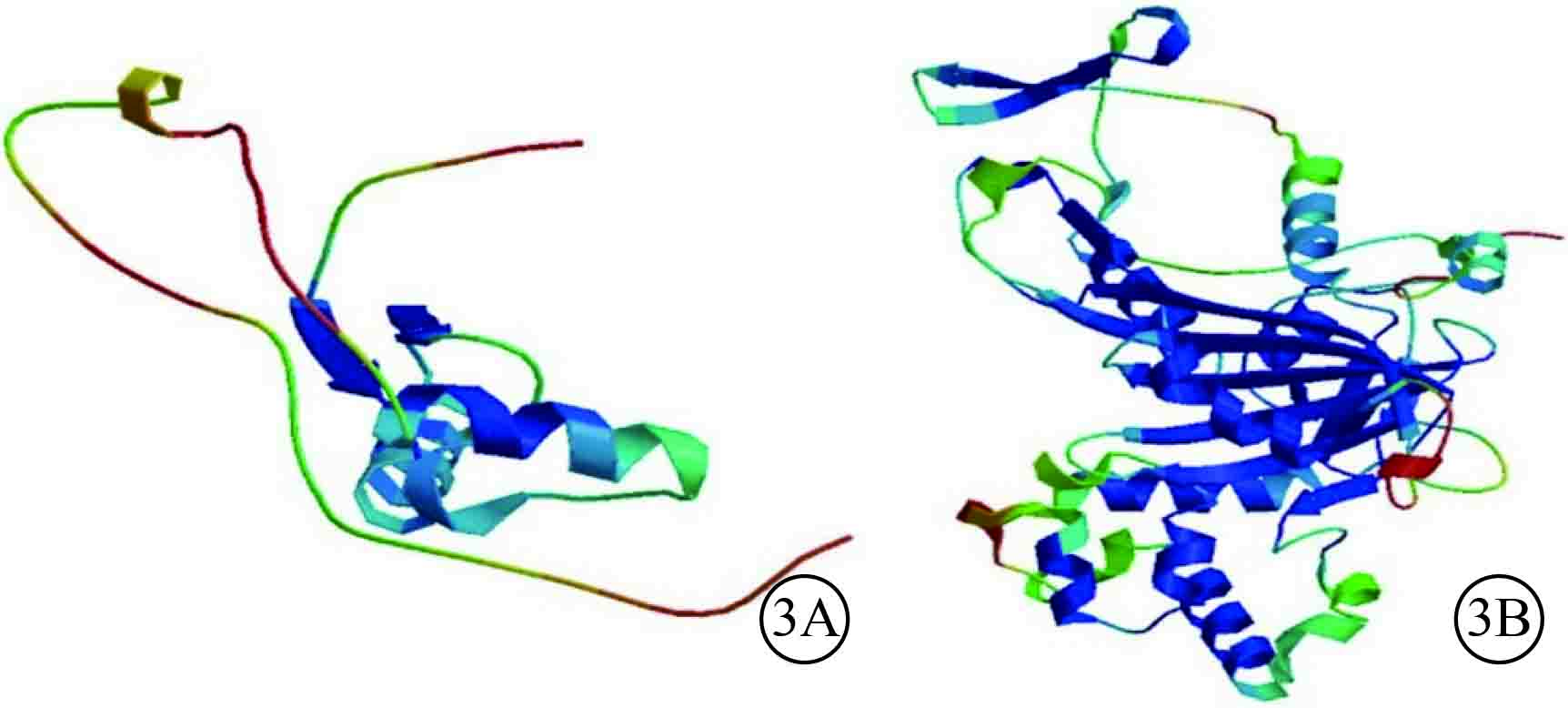
人類Rep-1蛋白分子結構和剪接突變造模結果顯示,Rep-1蛋白C末端結構改變導致Rep-1分子結構域缺失,影響與Rab蛋白相互作用,導致整個蛋白的構象改變(圖3)。
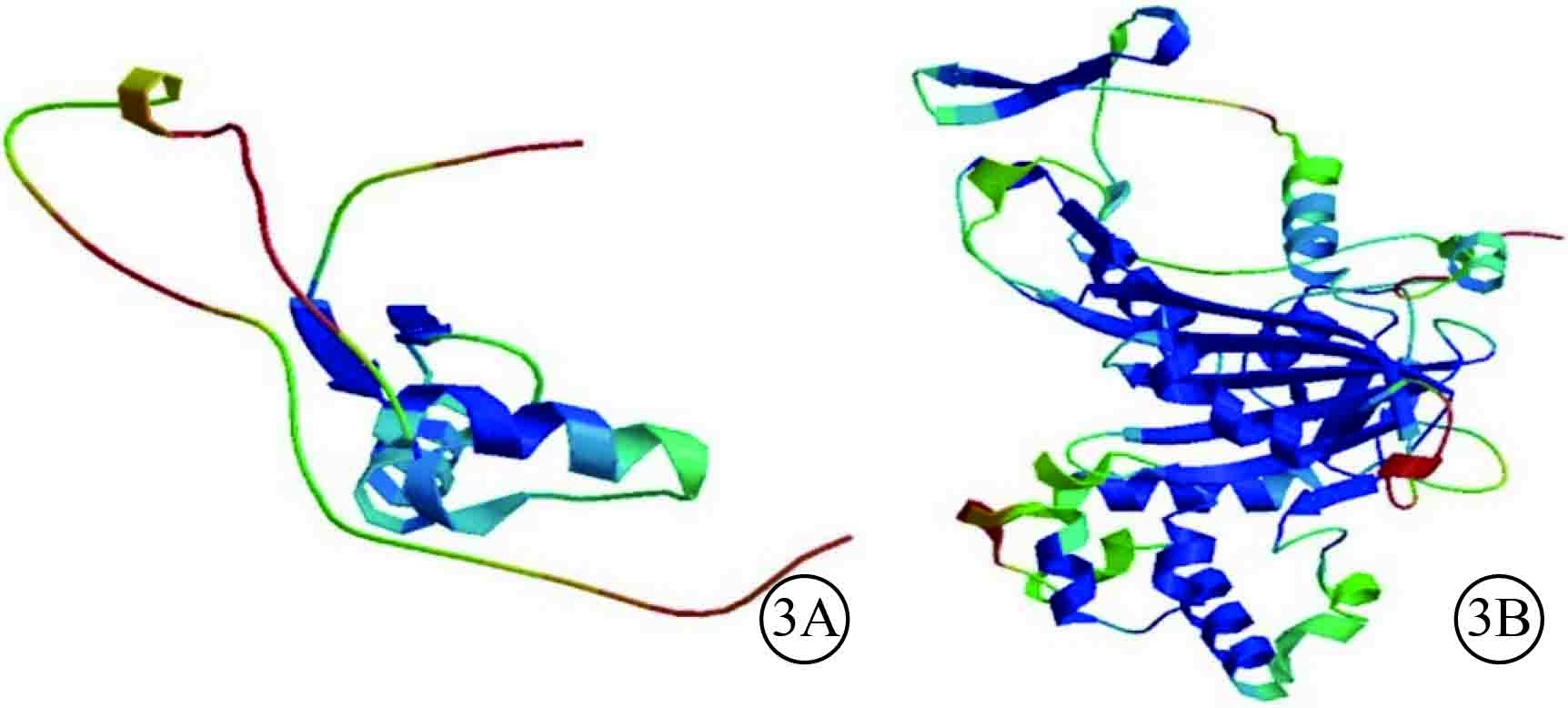 圖3
Rep-1蛋白分子結構和剪接突變造模三維結構圖。3A.Rep-1野生型蛋白;3B.Rep-1蛋白突變導致氨基酸殘基的C-末端結構域改變
圖3
Rep-1蛋白分子結構和剪接突變造模三維結構圖。3A.Rep-1野生型蛋白;3B.Rep-1蛋白突變導致氨基酸殘基的C-末端結構域改變
3 討論
CHM一般在青少年時期發病,常雙眼患病。臨床表現包括夜盲,視野呈向心性縮窄,晚期中心視力受損等[11,12]。國外報道CHM患者中心視力開始下降最早出現于51~80歲年齡段[13,14]。平均5年視力變化0.09最小分辨角對數視力。CHM患者視力下降緩慢,通常可以保留相對較好的中心視力。但Zhou等[5]的觀察發現,CHM患者可能較早出現嚴重視力喪失。本家系中成年男性患者的中心視力下降出現于30歲以前;3年平均BCVA變化0.320。較上述文獻報道視力出現下降時間早并且下降速度更快,與Zhou等[5]觀察結果一致。家系中另一男性未成年患者為6歲男童,眼底僅見輕度視盤周圍萎縮,可能尚未出現典型CHM眼底改變。表明CHM的脈絡膜視網膜病變可能起始于視盤周圍或周邊區[15]。
本家系3名女性致病基因攜帶者中,CHM患者1例,致病基因攜帶者2名。女性患者50歲時開始出現視力下降,眼底呈典型的CHM改變,但3年后隨訪時BCVA平均變化0.175,較成年男性患者出現視力下降時間晚并且下降速度慢。2名致病基因攜帶者中,1名僅眼底周邊部可見視網膜色素改變;另一名除晶狀體輕度混濁外,眼底、全視野ERG均正常。3名女性致病基因攜帶者來自同一家系,但臨床表型各異,并非完全呈年齡依賴性。女性致病基因攜帶者一般無癥狀,較大年齡時可能表現輕微CHM的體征和癥狀,為非進行性或進展緩慢,視力多無異常或偶有下降[16,17]。由于表達致病X染色體的細胞與表達正常X染色體的細胞混雜在一起,眼底可有斑片狀色素沉著、RPE萎縮斑或呈特征性的蠶食樣色素紊亂[17,18]。ERG異常概率出現較低[19]。視野正常,部分可能會出現輕度異常,表現為相對孤立的視野盲點或生理盲點擴大[20]。女性致病基因攜帶者不同的臨床表型可能與里昂化作用(Lyonization)程度相關[21]。里昂化作用又稱X染色體失活,是指雌性哺乳類動物細胞中兩條X染色體的其中之一失去活性的現象[22]。眼底呈典型CHM改變者,原因可能與非隨機里昂化作用機制即優先失活攜帶正常CHM等位基因的染色體作用有關[23-25]。
本研究在一個4代CHM家系中發現了CHM基因新的致病突變p.D613N,經文獻檢索,未發現有此突變位點的相關報道。CHM患者REP-1蛋白表達降低在CHM的發病機制中發揮了重要作用,Rep-1的C末端與Rab的C末端連接導致Rep-1失去活性[20-22]。我們推測REP-1的C末端突變,可能會導致細胞的蛋白水解系統被破壞,失去蛋白與蛋白之間相互作用的功能。
無脈絡膜癥(CHM)是一種以進行性脈絡膜、視網膜色素上皮(RPE)和視網膜萎縮為特征的X染色體連鎖隱性遺傳性疾病[1,2]。患者多為男性, 女性為致病基因攜帶者。CHM基因定位于染色體Xq21.2區域[3],包含15個外顯子,跨度約150×103堿基對。該基因編碼一個包含653個氨基酸的胞內蛋白質Rabescortprotein-1(Rep -1)[4]。CHM是由于CHM基因突變失活,導致Rep-1缺失或者產生無功能的基因產物,從而出現脈絡膜血管層發育障礙,進行性RPE和脈絡膜營養不良、變性及進行性脈絡膜萎縮[1]。CHM基因突變已有較多家系報道[5-7]。目前已報告CHM基因突變已超過100種,包括堿基缺失、堿基易位和插入,以及各種無義移碼和剪接突變[7]。但目前國內東北地區CHM患者基因突變研究鮮見報道。我們對一個東北地區4代CHM家系中患者和致病基因攜帶者的臨床表現進行觀察,同時對其家系成員基因進行檢測,明確了一個新的致病突變位點c.1837G>A(p.D613N)。現將結果報道如下。
1 對象和方法
本研究經本院醫學倫理委員會審核批準。所有受試者和未成年受試者監護人均簽署知情同意書。
2008年2月我院眼科就診并隨訪觀察的一個4代CHM家系中15名家庭成員納入研究。其中,患者5例,女性致病基因攜帶者2名,健康成員8名。5例患者中,男性4例,女性1例;年齡分別為6(Ⅳ1)、26(Ⅲ6)、46(Ⅱ3)、51(Ⅱ2)、77(Ⅰ1)歲。2名女性致病基因攜帶者年齡分別為26(Ⅲ2)、59(Ⅱ7)歲。8名健康者中,男、女各4名;年齡19~44歲。同時招募180名無血緣關系的健康志愿者作為對照組進行CHM基因測序比對。其中,男性98名,女性82名;年齡18~65歲。
采集家系成員的完整信息,繪制家系圖譜。所有受試者進行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、熒光素眼底血管造影(FFA)、光相干斷層掃描(OCT)、視野、全視野視網膜電圖(ERG)檢查。依據臨床檢查結果,患者符合CHM診斷標準[5]。3年后僅對患者進行隨訪。隨訪時均行BCVA檢查,女性患者同時行視野檢查。
采集所有受試者空腹外周靜脈血5 ml,乙二胺四乙酸抗凝,離心,保存于-80 ℃冰箱中。采用全血DNA提取試劑盒[天根生化科技(北京)有限公司]按照標準操作程序提取基因組DNA。
應用Primer 5.0引物設計軟件,設計針對CHM基因15個外顯子和外顯子-內含子交界區的序列引物。CHM基因轉錄本采用Transcript ID:ENST00000357749,分別擴增該基因的15個外顯子及外顯子-內含子交界區。聚合酶鏈反應(PCR)設定35個循環,94 ℃,30 s變性;退火溫度58~62 ℃,30 s;延伸溫度72 ℃,60 s。PCR產物應用普通瓊脂糖凝膠DNA回收試劑盒[天根生化科技(北京)有限公司]進行純化,運用ABI3130xl基因分析儀(美國應用生物系統公司)進行測序,使用Chromas 2.22(澳大利亞Technelysium Pty公司)對受試者以及對照組健康志愿者測序結果進行分析以及CHM基因測序結果進行比對。
對Rep-1蛋白結構和剪接突變進行造模[8],以大鼠Rep-1蛋白為范本,結合單異戊烯基Rab7蛋白,建立人類Rep-1模型[9]。采用DeepView v4.0.1(軟件)展現構象變化,預測潛在突變影響[10]。
2 結果
本家系具有X-連鎖遺傳方式特征(圖1)。4例男性患者中,3例成年患者(Ⅱ2、Ⅱ3、Ⅲ6)自幼出現夜盲,分別在年齡<10、10、30歲時出現視力下降;BCVA 0.3~0.6,平均BCVA為0.43。眼底呈彌漫性脈絡膜萎縮,視盤周圍暴露白色鞏膜,散在棕黑色斑片狀色素斑,黃斑部保留島狀正常區。FFA可清晰顯示脈絡膜大血管形態,黃斑中心凹呈完整圓形正常區域。視野分別表現為中心管狀視野、視野中央保留分葉狀視島、中心管狀視野伴光敏感度下降。全視野ERG檢查,視桿和視錐細胞反應均呈熄滅狀。OCT檢查,黃斑中心以外的橢圓體帶和嵌合帶消失。3年后隨訪,平均BCVA 0.01~0.3,平均BCVA為0.11;平均BCVA較3年前下降0.320。1例未成年患者為6歲男童(Ⅳ1),雙眼BCVA均為1.0。眼底僅見視盤周圍環形區顏色變淡;周圍視野光敏感度下降。女性患者(Ⅰ1)自幼出現夜盲,50歲開始出現視力下降;雙眼BCVA分別為0.5、0.25。眼底呈典型CHM改變;右眼周圍視野可見相對暗點,左眼視野中央大面積絕對和相對暗點。3年后隨訪,雙眼BCVA均為0.2,平均BCVA較3年前下降0.175。中心管狀視野伴光敏感度下降。
 圖1
CHM患者家系圖。■:男性患者;●:女性患者;↑:先證者;⊙:女性致病基因攜帶者;□:正常男性;○:正常女性
圖1
CHM患者家系圖。■:男性患者;●:女性患者;↑:先證者;⊙:女性致病基因攜帶者;□:正常男性;○:正常女性
2名女性致病基因攜帶者中,Ⅲ2雙眼BCVA均為1.0。眼底周邊部可見有斑片狀色素沉著和RPE萎縮斑;全視野ERG正常。Ⅱ7雙眼BCVA均為0.7;晶狀體輕度混濁;眼底正常;全視野ERG正常。
基因檢測結果顯示,患者和治病基因攜帶者CHM基因第15外顯子存在一個新的錯義突變c.1837G>A,導致天門冬酰胺代替天門冬氨酸(p.D613N);家系中健康成員和對照組健康志愿者均未檢測到此突變基因(圖2)。
 圖2
基因測序圖。2A.家系中健康成員;2B.家系中女性致病基因攜帶者;2C.CHM患者。患者和致病基因攜帶者CHM基因第15外顯子的c.1837G>A (p.D613N)突變(黑箭);家系中健康成員該位點不存在突變(黑箭)
圖2
基因測序圖。2A.家系中健康成員;2B.家系中女性致病基因攜帶者;2C.CHM患者。患者和致病基因攜帶者CHM基因第15外顯子的c.1837G>A (p.D613N)突變(黑箭);家系中健康成員該位點不存在突變(黑箭)
人類Rep-1蛋白分子結構和剪接突變造模結果顯示,Rep-1蛋白C末端結構改變導致Rep-1分子結構域缺失,影響與Rab蛋白相互作用,導致整個蛋白的構象改變(圖3)。
 圖3
Rep-1蛋白分子結構和剪接突變造模三維結構圖。3A.Rep-1野生型蛋白;3B.Rep-1蛋白突變導致氨基酸殘基的C-末端結構域改變
圖3
Rep-1蛋白分子結構和剪接突變造模三維結構圖。3A.Rep-1野生型蛋白;3B.Rep-1蛋白突變導致氨基酸殘基的C-末端結構域改變
3 討論
CHM一般在青少年時期發病,常雙眼患病。臨床表現包括夜盲,視野呈向心性縮窄,晚期中心視力受損等[11,12]。國外報道CHM患者中心視力開始下降最早出現于51~80歲年齡段[13,14]。平均5年視力變化0.09最小分辨角對數視力。CHM患者視力下降緩慢,通常可以保留相對較好的中心視力。但Zhou等[5]的觀察發現,CHM患者可能較早出現嚴重視力喪失。本家系中成年男性患者的中心視力下降出現于30歲以前;3年平均BCVA變化0.320。較上述文獻報道視力出現下降時間早并且下降速度更快,與Zhou等[5]觀察結果一致。家系中另一男性未成年患者為6歲男童,眼底僅見輕度視盤周圍萎縮,可能尚未出現典型CHM眼底改變。表明CHM的脈絡膜視網膜病變可能起始于視盤周圍或周邊區[15]。
本家系3名女性致病基因攜帶者中,CHM患者1例,致病基因攜帶者2名。女性患者50歲時開始出現視力下降,眼底呈典型的CHM改變,但3年后隨訪時BCVA平均變化0.175,較成年男性患者出現視力下降時間晚并且下降速度慢。2名致病基因攜帶者中,1名僅眼底周邊部可見視網膜色素改變;另一名除晶狀體輕度混濁外,眼底、全視野ERG均正常。3名女性致病基因攜帶者來自同一家系,但臨床表型各異,并非完全呈年齡依賴性。女性致病基因攜帶者一般無癥狀,較大年齡時可能表現輕微CHM的體征和癥狀,為非進行性或進展緩慢,視力多無異常或偶有下降[16,17]。由于表達致病X染色體的細胞與表達正常X染色體的細胞混雜在一起,眼底可有斑片狀色素沉著、RPE萎縮斑或呈特征性的蠶食樣色素紊亂[17,18]。ERG異常概率出現較低[19]。視野正常,部分可能會出現輕度異常,表現為相對孤立的視野盲點或生理盲點擴大[20]。女性致病基因攜帶者不同的臨床表型可能與里昂化作用(Lyonization)程度相關[21]。里昂化作用又稱X染色體失活,是指雌性哺乳類動物細胞中兩條X染色體的其中之一失去活性的現象[22]。眼底呈典型CHM改變者,原因可能與非隨機里昂化作用機制即優先失活攜帶正常CHM等位基因的染色體作用有關[23-25]。
本研究在一個4代CHM家系中發現了CHM基因新的致病突變p.D613N,經文獻檢索,未發現有此突變位點的相關報道。CHM患者REP-1蛋白表達降低在CHM的發病機制中發揮了重要作用,Rep-1的C末端與Rab的C末端連接導致Rep-1失去活性[20-22]。我們推測REP-1的C末端突變,可能會導致細胞的蛋白水解系統被破壞,失去蛋白與蛋白之間相互作用的功能。