引用本文: 陳莉, 陳松, 張惟, 姜鑒洪, 王健, 武斌, 何廣輝, 楊婧, 馬映雪. 人臍帶間充質干細胞對高糖環境中恒河猴視網膜血管內皮細胞的免疫調節作用. 中華眼底病雜志, 2016, 32(6): 611-614. doi: 10.3760/cma.j.issn.1005-1015.2016.06.011 復制
糖尿病視網膜病變(DR)與免疫調節密切相關,調節免疫平衡對其防治至關重要[1-5]。調節性T細胞(Treg)和輔助性T細胞(Th17)失衡在自身免疫性疾病和組織炎癥等疾病的發生發展中起重要作用[6-8]。Treg功能失調和調節異常可能引起DR炎癥反應加重,而阻滯或抑制過量的Th17表達可減輕DR炎癥反應[9, 10]。間充質干細胞(MSC)來源于胚胎中胚層,具有向多胚層細胞分化的能力,可向組織損傷部位定向遷移達到促進損傷修復、免疫抑制、抗炎以及神經營養等目的[11]。盡管目前國內外有關MSC移植干預早期DR的研究已取得較大進展,但關于MSC移植對DR患者體內Treg與Th17表達的影響及其機制卻并不明確[12, 13]。為此,我們利用復合培養體系將人臍帶MSC (hUCMSC)與恒河猴視網膜血管內皮細胞(RF/6A細胞)在高糖環境中共培養,模擬DR患者早期視網膜微血管損害,觀察hUCMSC對RF/6A細胞中Treg、Th17特定細胞轉錄因子叉頭蛋白(Foxp3)、白細胞介素(IL)-17表達的影響,分析hUCMSC是否可以通過調控Treg與Th17表達來平衡修復RF/6A細胞;探討其是否能對早期DR進行免疫調節,減輕DR微血管損害。現將結果報道如下。
1 材料和方法
1.1 主要材料、建模與分組
hUCMSC、RF/6A細胞分別購自中國醫學科學院血液學研究所泰達生命科學技術研究所、武漢普諾賽生命科技有限公司;均提供鑒定報告。噻唑藍(MTT)細胞增生檢測試劑盒(沈陽萬類生物科技有限公司);小牛血清白蛋白、十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳液、裂解液RIPA (上海碧云天生物技術有限公司);聚偏氟乙烯(PVDF)膜(美國Millipore公司);四甲基乙二胺(上海生工生物工程有限公司);Foxp3抗兔抗體一抗(武漢博士德生物工程有限公司);辣根過氧化物酶標記山羊抗兔IgG二抗(北京中杉金橋生物技術有限公司);增強化學發光(ECL)試劑盒(上海研卉生物科技有限公司);迷你濕式轉漬槽半干轉膜器(美國Bio-Rad公司);凝膠電泳裝置(北京醫療設備廠);二喹啉甲酸蛋白定量試劑盒(沈陽萬類生物科技有限公司)。
將RF/6A細胞接種于Dulbecco改良Eagle培養基(DMEM)/25 mmol/L D-葡萄糖完全培養液中,放于37℃、5%CO2恒溫培養箱中傳代至細胞穩定生長。取第3~5代處于對數生長期的RF/6A細胞,利用復合培養體系(Transwell培養板)將hUCMSC加入Transwell系統上層小室,下室中加入DMEM/25 mmol/L D-葡萄糖完全培養液及RF/6A細胞,將hUCMSC按照1 :1的比例與RF/6A細胞共培養。上下層小室間的半透隔膜孔徑為0.4 μm,保證上下層小室的大分子蛋白和細胞因子之間可以相互交流而細胞間不相互接觸。將復合培養體系置于恒溫培養箱中繼續培養。每隔2~3天更換一次新鮮DMEM/25 mmol/L D-葡萄糖完全培養液。
實驗分為對照組、高糖組及hUCMSC與高糖共培養組(hUCMSC組)進行,3組RF/6A細胞分別采用DMEM/F12完全培養液、DMEM/25 mmol/L D-葡萄糖完全培養液、hUCMSC與25 mmol/L D-葡萄糖完全培養液進行培養。
1.2 MTT比色法、蛋白免疫印跡法(Western blot)及酶聯免疫吸附法(ELISA)檢測
培養后第1、3、7天,采用MTT比色法檢測共培養后RF/6A細胞的增生活力。根據MTT細胞增生檢測試劑盒說明書進行操作,結晶物充分溶解后在酶聯免疫檢測儀上測定各孔570 nm波長處吸光度[A,舊稱光密度(OD)]值,以空白孔調零。計算不同作用條件下RF/6A細胞存活率,重復計算5次,取均值記錄。RF/6A細胞存活率=實驗孔A值/空白孔A值×100%。
培養后第7天,采用Western blot檢測RF/6A細胞中Foxp3蛋白的相對表達量。從RF/6A細胞中提取總蛋白,SDS-PAGE分離蛋白樣本,電泳將蛋白轉移到PVDF膜上,將膜上未反應位點經蛋白封閉后與一抗雜交,再與辣根過氧化物酶標記山羊抗兔IgG二抗反應。ECL曝光顯影,對Foxp3蛋白進行定量分析。蛋白條帶的灰度比值=目的蛋白Foxp3條帶灰度值/同標本磷酸甘油醛脫氫酶(GAPDH)條帶灰度值。
培養后第7天,采用ELISA檢測RF/6A細胞培養上清液中IL-17的濃度。嚴格按照ELISA試劑生產商提供的操作說明進行,所有操作均在室溫條件下完成。收集培養上清液后,以離心半徑9.6 cm、1000 r/min離心20 min,按照比例稀釋原倍標準品。在每個聚乙烯板反應孔中加0.1 ml稀釋的標準品,4℃過夜。次日,棄去孔內上清液,加一定稀釋的待測樣品0.1 ml于反應孔中,置37℃孵育1.0 h后洗滌。同時做陰性對照孔和空白孔。于各反應孔中,加入新鮮稀釋的酶標抗體0.1 ml,37°C放置0.5~1.0 h后洗滌。在反應孔中加入顯色劑0.1 ml,輕微震蕩搖勻,37℃放置10~30 min。加入終止液0.05 ml終止反應,于20 min內測定實驗結果,當最高濃度的標準品出現藍黑色時終止顏色反應。在ELISA檢測儀上,于波長450 nm處,以空白孔調零后測各孔A值。重復測量3次。
1.3 統計學方法
采用SPSS18.0統計學軟件進行統計分析,計量資料以均數±標準差(x±s)表示。組間比較采用單因素方差分析,多重比較采用最小顯著差法t檢驗。P < 0.05為差異有統計學意義。
2 結果
培養后第1天,對照組、高糖組及hUCMSC組RF/6A細胞存活率比較,差異無統計學意義(F=0.030,P > 0.05);培養后第3、7天,高糖組RF/6A細胞存活率較對照組明顯降低,差異有統計學意義(t=36.072、27.890,P < 0.05);hUCMSC組RF/6A細胞存活率較高糖組明顯提高,差異有統計學意義(t=13.280、19.650,P < 0.05)(表 1)。
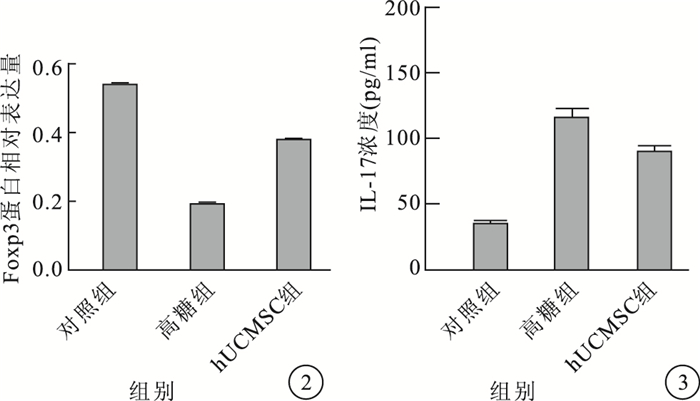
Western blot檢測結果顯示,RF/6A細胞中Foxp3蛋白條帶在相對分子質量48×103處顯影(圖 1)。培養后第7天,高糖組RF/6A細胞中Foxp3蛋白相對表達量較對照組明顯下降,差異有統計學意義(t=7.826,P < 0.05);hUCMSC組RF/6A細胞中Foxp3蛋白相對表達量較高糖組明顯提高,差異有統計學意義(t=19.936,P < 0.05)(圖 2)。
 圖1
3組RF/6A細胞中Foxp3蛋白表達Western blot像
圖1
3組RF/6A細胞中Foxp3蛋白表達Western blot像
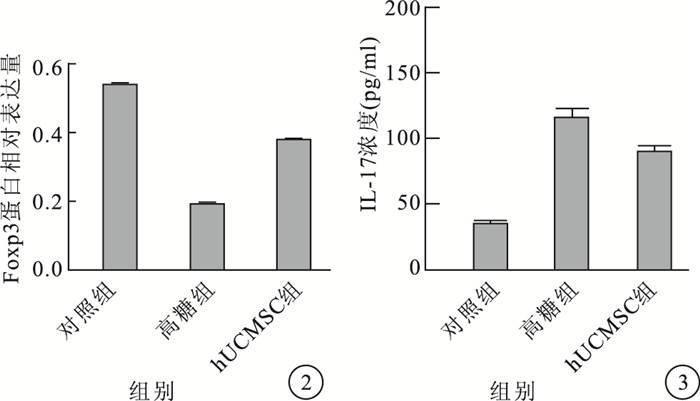 圖2
3組RF/6A細胞中Foxp3蛋白相對表達量比較??圖 3??3組細胞培養上清液中IL-17濃度比較
圖2
3組RF/6A細胞中Foxp3蛋白相對表達量比較??圖 3??3組細胞培養上清液中IL-17濃度比較
ELISA檢測結果顯示,培養后第7天,高糖組、hUCMSC組細胞培養上清液中IL-17濃度較對照組明顯升高,差異有統計學意義(F=1267.503,P < 0.05)。hUCMSC組細胞培養上清液中IL-17濃度較高糖組明顯下降,差異有統計學意義(t=17.386,P < 0.05)(圖 3)。
3 討論
hUCMSC能夠在體外分化為成熟的胰島樣細胞簇。糖尿病模型鼠移植hUCMSC后血內胰島素水平顯著提高,血糖水平明顯下降[13]。有研究者將誘導后的hUCMSC移植入缺氧動物模型,發現hUCMSC可以整合入血管壁,使缺氧動物移植區域血管密度升高;并由此推斷hUCMSC可能通過分化為視網膜血管樣細胞并對視網膜血管進行修復,從而改善視網膜的缺血、缺氧狀況[14]。本研究應用hUCMSC干預高糖環境培養的RF/6A細胞,采用MTT比色法檢測共培養后RF/6A細胞的增生活力。結果顯示,培養后第3、7天高糖組RF/6A細胞存活率明顯較hUCMSC組低。說明高糖可以降低RF/6A細胞活力,抑制細胞增生,而hUMSC可以明顯提高高糖環境中RF/6A細胞活力。
Treg是一種特殊的免疫調節細胞,具有很強的免疫抑制和維持免疫耐受能力。Foxp3是Treg的特異性標志,被認為是表達Treg的關鍵轉錄因子和調節Treg發育和發揮功能的重要開關[6, 7]。Th17可以通過分泌炎性介質IL-17誘導嚴重的自身免疫反應,而IL-17能夠誘導多種細胞產生炎性和趨化因子,從而誘導血管生成,并且能啟動和維持炎性反應過程[15-18]。Treg與Th17失衡在自身免疫性疾病和組織炎癥等疾病的發生發展中起重要作用,兩者功能上的差異往往是由其分泌的特定細胞轉錄因子Foxp3、IL-17決定的[6-8]。我們采用Western blot檢測各組RF/6A細胞中Foxp3的蛋白相對表達量。結果顯示,培養后第7天高糖組RF/6A細胞中Foxp3蛋白相對表達量較對照組明顯下降,而hUCMSC組RF/6A細胞中Foxp3蛋白相對表達量較高糖組明顯升高。經ELISA檢測發現,高糖組、hUCMSC組細胞培養上清液中IL-17濃度較對照組明顯升高。說明Th17誘導自身免疫反應,而Treg抑制自身免疫。提示調節Treg與Th17免疫平衡對DR的防治至關重要。
本研究通過探索hUCMSC對RF/6A細胞的免疫調節作用及相關免疫因素,發現早期介入并應用hUCMSC干預以保持Treg與Th17之間的平衡,可能是將來治療DR的一種新途徑。但本研究只進行了體外實驗并未進行相關體內實驗,且未針對RF/6A細胞中Foxp3 mRNA、細胞培養上清液中IL-17 mRNA表達進行檢測,有關Treg與Th17細胞分化所涉及的其他信號通路以及能否作為疾病治療及發展藥物作用的靶點等問題尚有待于進一步的探討和研究。
糖尿病視網膜病變(DR)與免疫調節密切相關,調節免疫平衡對其防治至關重要[1-5]。調節性T細胞(Treg)和輔助性T細胞(Th17)失衡在自身免疫性疾病和組織炎癥等疾病的發生發展中起重要作用[6-8]。Treg功能失調和調節異常可能引起DR炎癥反應加重,而阻滯或抑制過量的Th17表達可減輕DR炎癥反應[9, 10]。間充質干細胞(MSC)來源于胚胎中胚層,具有向多胚層細胞分化的能力,可向組織損傷部位定向遷移達到促進損傷修復、免疫抑制、抗炎以及神經營養等目的[11]。盡管目前國內外有關MSC移植干預早期DR的研究已取得較大進展,但關于MSC移植對DR患者體內Treg與Th17表達的影響及其機制卻并不明確[12, 13]。為此,我們利用復合培養體系將人臍帶MSC (hUCMSC)與恒河猴視網膜血管內皮細胞(RF/6A細胞)在高糖環境中共培養,模擬DR患者早期視網膜微血管損害,觀察hUCMSC對RF/6A細胞中Treg、Th17特定細胞轉錄因子叉頭蛋白(Foxp3)、白細胞介素(IL)-17表達的影響,分析hUCMSC是否可以通過調控Treg與Th17表達來平衡修復RF/6A細胞;探討其是否能對早期DR進行免疫調節,減輕DR微血管損害。現將結果報道如下。
1 材料和方法
1.1 主要材料、建模與分組
hUCMSC、RF/6A細胞分別購自中國醫學科學院血液學研究所泰達生命科學技術研究所、武漢普諾賽生命科技有限公司;均提供鑒定報告。噻唑藍(MTT)細胞增生檢測試劑盒(沈陽萬類生物科技有限公司);小牛血清白蛋白、十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳液、裂解液RIPA (上海碧云天生物技術有限公司);聚偏氟乙烯(PVDF)膜(美國Millipore公司);四甲基乙二胺(上海生工生物工程有限公司);Foxp3抗兔抗體一抗(武漢博士德生物工程有限公司);辣根過氧化物酶標記山羊抗兔IgG二抗(北京中杉金橋生物技術有限公司);增強化學發光(ECL)試劑盒(上海研卉生物科技有限公司);迷你濕式轉漬槽半干轉膜器(美國Bio-Rad公司);凝膠電泳裝置(北京醫療設備廠);二喹啉甲酸蛋白定量試劑盒(沈陽萬類生物科技有限公司)。
將RF/6A細胞接種于Dulbecco改良Eagle培養基(DMEM)/25 mmol/L D-葡萄糖完全培養液中,放于37℃、5%CO2恒溫培養箱中傳代至細胞穩定生長。取第3~5代處于對數生長期的RF/6A細胞,利用復合培養體系(Transwell培養板)將hUCMSC加入Transwell系統上層小室,下室中加入DMEM/25 mmol/L D-葡萄糖完全培養液及RF/6A細胞,將hUCMSC按照1 :1的比例與RF/6A細胞共培養。上下層小室間的半透隔膜孔徑為0.4 μm,保證上下層小室的大分子蛋白和細胞因子之間可以相互交流而細胞間不相互接觸。將復合培養體系置于恒溫培養箱中繼續培養。每隔2~3天更換一次新鮮DMEM/25 mmol/L D-葡萄糖完全培養液。
實驗分為對照組、高糖組及hUCMSC與高糖共培養組(hUCMSC組)進行,3組RF/6A細胞分別采用DMEM/F12完全培養液、DMEM/25 mmol/L D-葡萄糖完全培養液、hUCMSC與25 mmol/L D-葡萄糖完全培養液進行培養。
1.2 MTT比色法、蛋白免疫印跡法(Western blot)及酶聯免疫吸附法(ELISA)檢測
培養后第1、3、7天,采用MTT比色法檢測共培養后RF/6A細胞的增生活力。根據MTT細胞增生檢測試劑盒說明書進行操作,結晶物充分溶解后在酶聯免疫檢測儀上測定各孔570 nm波長處吸光度[A,舊稱光密度(OD)]值,以空白孔調零。計算不同作用條件下RF/6A細胞存活率,重復計算5次,取均值記錄。RF/6A細胞存活率=實驗孔A值/空白孔A值×100%。
培養后第7天,采用Western blot檢測RF/6A細胞中Foxp3蛋白的相對表達量。從RF/6A細胞中提取總蛋白,SDS-PAGE分離蛋白樣本,電泳將蛋白轉移到PVDF膜上,將膜上未反應位點經蛋白封閉后與一抗雜交,再與辣根過氧化物酶標記山羊抗兔IgG二抗反應。ECL曝光顯影,對Foxp3蛋白進行定量分析。蛋白條帶的灰度比值=目的蛋白Foxp3條帶灰度值/同標本磷酸甘油醛脫氫酶(GAPDH)條帶灰度值。
培養后第7天,采用ELISA檢測RF/6A細胞培養上清液中IL-17的濃度。嚴格按照ELISA試劑生產商提供的操作說明進行,所有操作均在室溫條件下完成。收集培養上清液后,以離心半徑9.6 cm、1000 r/min離心20 min,按照比例稀釋原倍標準品。在每個聚乙烯板反應孔中加0.1 ml稀釋的標準品,4℃過夜。次日,棄去孔內上清液,加一定稀釋的待測樣品0.1 ml于反應孔中,置37℃孵育1.0 h后洗滌。同時做陰性對照孔和空白孔。于各反應孔中,加入新鮮稀釋的酶標抗體0.1 ml,37°C放置0.5~1.0 h后洗滌。在反應孔中加入顯色劑0.1 ml,輕微震蕩搖勻,37℃放置10~30 min。加入終止液0.05 ml終止反應,于20 min內測定實驗結果,當最高濃度的標準品出現藍黑色時終止顏色反應。在ELISA檢測儀上,于波長450 nm處,以空白孔調零后測各孔A值。重復測量3次。
1.3 統計學方法
采用SPSS18.0統計學軟件進行統計分析,計量資料以均數±標準差(x±s)表示。組間比較采用單因素方差分析,多重比較采用最小顯著差法t檢驗。P < 0.05為差異有統計學意義。
2 結果
培養后第1天,對照組、高糖組及hUCMSC組RF/6A細胞存活率比較,差異無統計學意義(F=0.030,P > 0.05);培養后第3、7天,高糖組RF/6A細胞存活率較對照組明顯降低,差異有統計學意義(t=36.072、27.890,P < 0.05);hUCMSC組RF/6A細胞存活率較高糖組明顯提高,差異有統計學意義(t=13.280、19.650,P < 0.05)(表 1)。
Western blot檢測結果顯示,RF/6A細胞中Foxp3蛋白條帶在相對分子質量48×103處顯影(圖 1)。培養后第7天,高糖組RF/6A細胞中Foxp3蛋白相對表達量較對照組明顯下降,差異有統計學意義(t=7.826,P < 0.05);hUCMSC組RF/6A細胞中Foxp3蛋白相對表達量較高糖組明顯提高,差異有統計學意義(t=19.936,P < 0.05)(圖 2)。
 圖1
3組RF/6A細胞中Foxp3蛋白表達Western blot像
圖1
3組RF/6A細胞中Foxp3蛋白表達Western blot像
 圖2
3組RF/6A細胞中Foxp3蛋白相對表達量比較??圖 3??3組細胞培養上清液中IL-17濃度比較
圖2
3組RF/6A細胞中Foxp3蛋白相對表達量比較??圖 3??3組細胞培養上清液中IL-17濃度比較
ELISA檢測結果顯示,培養后第7天,高糖組、hUCMSC組細胞培養上清液中IL-17濃度較對照組明顯升高,差異有統計學意義(F=1267.503,P < 0.05)。hUCMSC組細胞培養上清液中IL-17濃度較高糖組明顯下降,差異有統計學意義(t=17.386,P < 0.05)(圖 3)。
3 討論
hUCMSC能夠在體外分化為成熟的胰島樣細胞簇。糖尿病模型鼠移植hUCMSC后血內胰島素水平顯著提高,血糖水平明顯下降[13]。有研究者將誘導后的hUCMSC移植入缺氧動物模型,發現hUCMSC可以整合入血管壁,使缺氧動物移植區域血管密度升高;并由此推斷hUCMSC可能通過分化為視網膜血管樣細胞并對視網膜血管進行修復,從而改善視網膜的缺血、缺氧狀況[14]。本研究應用hUCMSC干預高糖環境培養的RF/6A細胞,采用MTT比色法檢測共培養后RF/6A細胞的增生活力。結果顯示,培養后第3、7天高糖組RF/6A細胞存活率明顯較hUCMSC組低。說明高糖可以降低RF/6A細胞活力,抑制細胞增生,而hUMSC可以明顯提高高糖環境中RF/6A細胞活力。
Treg是一種特殊的免疫調節細胞,具有很強的免疫抑制和維持免疫耐受能力。Foxp3是Treg的特異性標志,被認為是表達Treg的關鍵轉錄因子和調節Treg發育和發揮功能的重要開關[6, 7]。Th17可以通過分泌炎性介質IL-17誘導嚴重的自身免疫反應,而IL-17能夠誘導多種細胞產生炎性和趨化因子,從而誘導血管生成,并且能啟動和維持炎性反應過程[15-18]。Treg與Th17失衡在自身免疫性疾病和組織炎癥等疾病的發生發展中起重要作用,兩者功能上的差異往往是由其分泌的特定細胞轉錄因子Foxp3、IL-17決定的[6-8]。我們采用Western blot檢測各組RF/6A細胞中Foxp3的蛋白相對表達量。結果顯示,培養后第7天高糖組RF/6A細胞中Foxp3蛋白相對表達量較對照組明顯下降,而hUCMSC組RF/6A細胞中Foxp3蛋白相對表達量較高糖組明顯升高。經ELISA檢測發現,高糖組、hUCMSC組細胞培養上清液中IL-17濃度較對照組明顯升高。說明Th17誘導自身免疫反應,而Treg抑制自身免疫。提示調節Treg與Th17免疫平衡對DR的防治至關重要。
本研究通過探索hUCMSC對RF/6A細胞的免疫調節作用及相關免疫因素,發現早期介入并應用hUCMSC干預以保持Treg與Th17之間的平衡,可能是將來治療DR的一種新途徑。但本研究只進行了體外實驗并未進行相關體內實驗,且未針對RF/6A細胞中Foxp3 mRNA、細胞培養上清液中IL-17 mRNA表達進行檢測,有關Treg與Th17細胞分化所涉及的其他信號通路以及能否作為疾病治療及發展藥物作用的靶點等問題尚有待于進一步的探討和研究。